-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Standardní diagnostický a terapeutický postup u genetické (hereditární) hemochromatózy
Doporučený postup České hepatologické společnosti České lékařské společnosti J. E. Purkyně
Autoři: J. Horák
Působiště autorů: I. interní klinika 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Jiří Horák, CSc.
Vyšlo v časopise: Vnitř Lék 2006; 52(2): 173-175
Kategorie: Doporučené postupy
Datum vydání doporučení: prosince 2005
1. Obecné poznámky
Genetická či hereditární hemochromatóza (GH) je autozomálně recesivní onemocnění, jehož podstatou je zvýšené a fyziologické regulaci se vymykající vstřebávání železa v tenkém střevě, které vede k ukládání přebytečného železa v orgánech a tkáních s jejich následným poškozením. U 80-85 % nemocných s klinicky diagnostikovanou GH lze nalézt mutaci 845G>A v tzv. HFE genu vedoucí k záměně cysteinu za tyrozin v 282. aminokyselině HFE proteinu (mutace Cys282Tyr). Tuto mutaci v heterozygotní podobě má 8-10 % obyvatel západní, severní a střední Evropy a v podobě homozygotní činí její prevalence asi 1 : 300-400, takže se jedná o jednu z nejčastějších geneticky přenášených chorob vůbec. Kromě této majoritní mutace byly popsány i mutace další, jejichž význam pro vznik GH však není zcela jasný. Z nich je nejčastější mutace 187C>G vedoucí ke genotypu His63Asp (H63D), který je nacházen asi u 40 % nemocných s GH, kteří nemají mutaci Cys282Tyr (C282Y). Ještě méně častá je mutace 193A>T, která má za následek genotyp S65C. Ten se nachází asi v 8 % případů GH bez jiné prokazatelné mutace; onemocnění zde mívá mírnou podobu. 5-7 % nemocných s fenotypem GH jsou heterozygoti Cys282Tyr. Zajímavou skupinu představují složení heterozygoti pro mutaci Cys282Tyr a His63Asp, kteří tvoří asi 1 % populace. Z nich má 22 % normální koncentraci ferritinu, u 40 % lze prokázat nadbytek železa bez klinických příznaků a 30 % splňuje klinická kritéria pro GH.
Naopak asi 5 % nemocných s fenotypem GH nemá žádnou známou genetickou poruchu. Penetrace genu není vysoká, téměř u 50 % homozygotů C282Y nedochází k progresivní akumulaci železa a nesplňují tedy klinická kritéria hemochromatózy, přestože u nich lze prokázat zvýšenou saturaci transferrinu.
Organizmus dospělého člověka obsahuje za fyziologických okolností 3-4 g železa. Průměrné denní ztráty, které jsou přesně vyrovnávány regulovaným vstřebáváním železa z gastrointestinálního traktu, činí 1-1,5 mg. U GH je regulace vstřebávání železa podle stavu jeho zásob narušena a železo se bez ohledu na zvýšení jeho obsahu v organizmu trvale nadměrně vstřebává. Železo se zprvu ukládá v buňkách parenchymatózních orgánů, později také v retikuloendotelu. Akumulace železa v játrech vyvolává poruchu lyzozomů, zvýšenou peroxidaci lipidů a aktivaci hvězdicovitých buněk s následnou tvorbou vaziva. Kupfferovy buňky zvýšeně produkují kyslíkové radikály a přispívají tak k nekróze hepatocytů.
Železo se hromadí také v srdci, pankreatu, endokrinních žlázách a synovii. V kůži se zvýšeně ukládá melanin. Stupeň akumulace železa se u jednotlivých nemocných se stejným genotypem výrazně liší a celotělové zásoby železa u GH nevykazují definovatelnou závislost na věku. Prevalence cirhózy, diabetu, kardiopatie, kožních změn a únavy stoupá s rostoucí koncentrací železa v játrech.
15-20 % nemocných s klinicky jasnou hemochromatózou nemá homozygotní mutaci C282Y. V těchto případech se může jednat o heterozygoty či složené heterozygoty, o jinou genetickou odchylku s podobným fenotypem či o dosud nerozpoznané sekundární nahromadění železa (hemosiderózu). Její příčinou může být abúzus alkoholu, nadměrný přívod železa a vitaminu C, hemolýza nebo opakované transfuze. U části nemocných s chronickou hepatitidou C dochází rovněž k akumulaci železa v játrech. Podobně dochází k akumulaci železa u nemocných s pozdní kožní porfyrií, přičemž pouze u části z nich lze prokázat GH. Také u nebiliární cirhózy je akumulace železa v játrech častá, aniž by to znamenalo GH.
V prevalenci GH existují významné geografické rozdíly. V Evropě a oblastech kolonizovaných Evropany převládá tzv. kavkazský typ s již uvedenou prevalencí okolo 0,005, který je geneticky přenášen HFE genem.
2. Klinický obraz a laboratorní nález
V klinickém obraze hemochromatózy dominuje slabost a únava, jaterní léze, diabetes mellitus, pigmentace kůže, kardiomyopatie, artropatie a hypogonadizmus (uvedeno sestupně podle četnosti příznaků). Časté jsou i bolesti břicha a úbytek hmotnosti. Intenzita potíží roste s věkem a zásobami železa; onemocnění se jen zřídka manifestuje před 40. rokem věku. Fyzikální nález může být u mladších nemocných zcela normální. Později se objevují různě vyjádřené známky jako hepatomegalie, kožní pigmentace, pavoučkovité névy, splenomegalie, artropatie, ascites, arytmie, kardiální insuficience, hypotrichóza, atrofie varlat, gynekomastie a ikterus. Typický laboratorní nález zahrnuje vysokou saturaci transferrinu (více než 60 % u mužů a 50 % u žen), vysokou koncentraci sérového ferritinu a zvýšený obsah železa v jaterní sušině (norma činí méně než 35 µmol/g suché hmotnosti). Z posledně jmenované hodnoty lze vypočítat tzv. index jaterního železa (obsah železa v jaterní sušině dělený věkem), který je úměrný celkovému obsahu železa v organizmu. Pro GH jsou typické hodnoty vyšší než 1,9. Z objemu odebrané krve nutného k normalizaci celotělových zásob železa lze vypočítat množství tzv. mobilizovatelného železa, které u GH činí obvykle několik gramů.
Mezi muži a ženami s GH existují dosti značné rozdíly v laboratorních nálezech i klinickém obraze. Ženy jsou do jisté míry chráněny před vysokou akumulací železa menstruací a těhotenstvím.
GH či alespoň akumulace železa se typicky sdružuje s některými dalšími chorobami: diabetes mellitus, pozdní kožní porfyrie, chronická hepatitida C, alkoholická jaterní léze, nonalkoholická steatohepatitida (NASH) a hepatocelulární karcinom, jehož incidence je zde asi 200krát vyšší než u kontrol.
Obr. 1. Schéma diagnostiky a léčby genetické hemochromatózy. 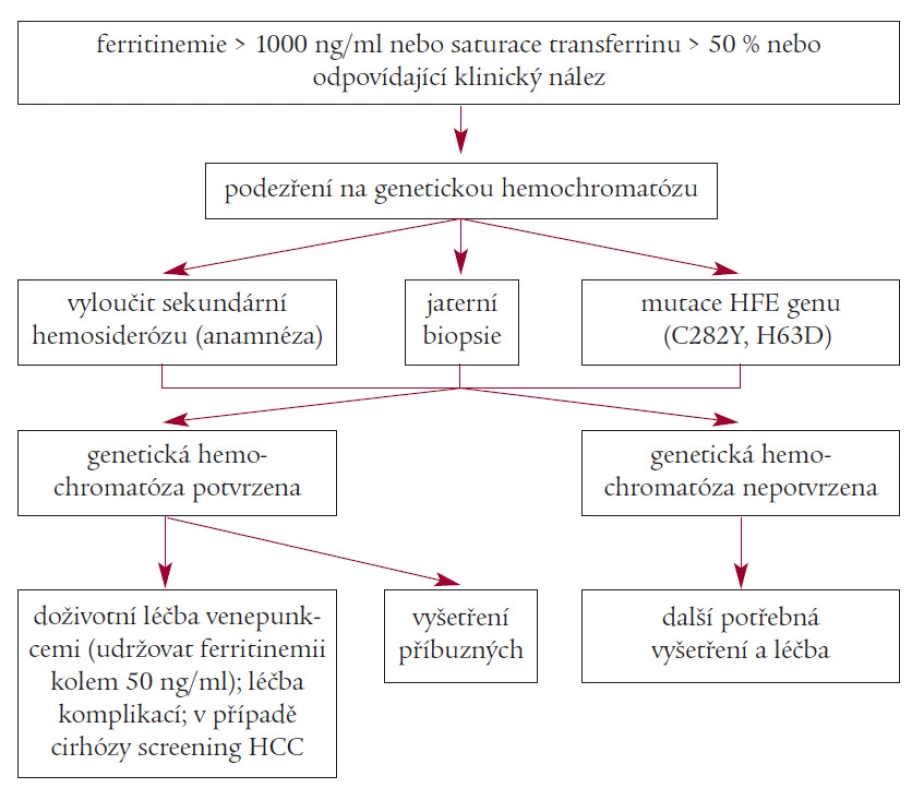
3. Diagnóza
Diagnózu GH lze u plně rozvinuté choroby stanovit s vysokou pravděpodobností již z klinického nálezu. V presymptomatickém období jsme odkázáni na laboratorní vyšetření. Nejvhodnější screeningovou metodou je vyšetření saturace transferrinu. Podobný význam má stanovení volné vazebné kapacity séra pro železo (UIBC); hodnoty nižší než 28 μmol/l svědčí pro přetížení železem. Sérová koncentrace ferritinu je u pokročilých případů obvykle vyšší než 1000 ng/ml, někdy je však jen mírně zvýšena. Zatímco normální koncentrace ferritinu u jedince nad 40 let věku silně mluví proti diagnóze GH, obrácený vztah neplatí: ferritin jako protein akutní fáze může být nespecificky zvýšen u těžkých zánětů a malignit. Za velmi spolehlivé vyšetření se považuje stanovení koncentrace železa v jaterní sušině, zejména pak vyjádřené jako tzv. index jaterního železa. Vyšetření se však neprovádí u jaterní cirhózy jakékoliv etiologie, kde je často přítomna akumulace železa, aniž by se jednalo o GH. Množství mobilizovatelného železa obvykle přesahuje 5 gramů. GH má charakteristický histologický nález s akumulací železa v zóně 1 (periportálně) i v hepatocytech.
Dnes by měla být u každého nemocného s podezřením na GH stanovena přítomnost mutací C282Y a H63D genu HFE.
Jaterní biopsie je potřebná zejména u homozygotů se známkami jaterního poškození nebo s velmi vysokým ferritinem (nad 1000 ng/ml), u nemocných starších 40 let a v přítomnosti dalších rizikových faktorů pro jaterní onemocnění. Řezy z jaterní biopsie je nutno obarvit pruskou modří na průkaz železa, ale přímé biochemické stanovení koncentrace železa ve vzorku je přesnější a mělo by se u podezření na GH provádět standardně.
4. Diferenciální diagnóza
Je nutno odlišit stavy spojené se zvýšenou koncentrací ferritinu, jako jsou záněty, tumory, poškození jater alkoholem a četné příčiny sekundární hemosiderózy.
5. Léčba
Základní léčbu GH představují krevní odběry. Léčbu je nutno zahájit co nejdříve, neboť jen tak lze předejít orgánovému poškození, příp. existující poškození zlepšit. Zpočátku se odebírá 500 ml krve 1-2krát týdně. S 500 ml krve se z organizmu odstraní asi 250 mg železa. Úvodní intenzivní léčba se ukončuje po dosažení deplece železa, což odpovídá sérové koncentraci ferritinu pod 50 ng/ml. Udržovací léčba se provádí v závislosti na koncentraci ferritinu; obvykle je dostatečná jedna flebotomie každé tři měsíce. Léčba desferrioxaminem se provádí jen zcela výjimečně tam, kde nemocný netoleruje krevní odběry (hemolytické anémie, dyserytropoetické syndromy), neboť lék je málo účinný a velmi nákladný. Podobně výjimečnou by měla být léčba pomocí erytrocytaferézy, která má opodstatnění pouze u nemocných neschopných dostatečné syntézy plazmatických bílkovin odebíraných při flebotomii.
Dárcovství krve odebrané nemocným s GH je většinou odmítáno.
6. Prognóza
U neléčené GH jsou hlavní příčinou smrti dekompenzace jaterní cirhózy, hepatocelulární karcinom, diabetes mellitus a kardiomyopatie. Nemocné s rozvinutou jaterní cirhózou je nutné pravidelně vyšetřovat se zaměřením na vznik hepatocelulárního karcinomu (jaterní sonografie a stanovení α-fetoproteinu po 6 měsících). Při včasném zahájení léčby je prognóza nemocných výborná.
7. Screening GH
Nejlepší screeningovou metodou je stanovení saturace transferrinu, jeho nákladová efektivita ale není vysoká. U zjištěných homozygotů je kromě přímých pokrevních příbuzných vhodné vyšetřit také manžela(ku); tak lze dosáhnout snížení nákladů, neboť v případě, že partner není ani heterozygotním nosičem genové mutace, odpadá nutnost vyšetřování dětí. Vyšetření potomků stačí provést kolem 20. roku věku, klinicky významná akumulace železa dříve prakticky nehrozí. Populační genetický screening se zatím v žádné zemi neprosadil. Jeho zavedení dosud brání nejen problémy ekonomické představované poměrně vysokými náklady na provedení DNA analýzy, ale také problémy etické. Existují obavy z možné pracovní a jiné diskriminace identifikovaných jedinců a jistý problém představuje i zmíněná diskrepance mezi genotypem a jeho fenotypovou manifestací.
prof. MUDr. Jiří Horák, CSc.
www.fnkv.cz
e-mail: horak@fnkv.cz
Doručeno do redakce: 10. 1. 2006
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Katetrizační ablace - metoda 1. volby v léčbě flutteru síní - editorial
- Význam transesofageálnej echokardiografie v detekcii kardiogénnej a aortálnej embolizácie při ložiskovej ischémii mozgu a tranzitórnych ischemických atakách - editorial
- Klinické příznaky, diagnostika a terapie ortostatické intolerance - editorial
- Komplikace v průběhu léčby mnohočetného myelomu - editorial
- Mutační analýza LQT genů u jedinců s polékovým prodloužením QT intervalu
- Význam kombinace změn fibrinogenu, mikro/makroalbuminurie a ateromatózy v karotickém řečišti pro posouzení rizika abnormálního nálezu zátěžového SPECT myokardu u asymptomatických diabetiků 2. typu
- Idiopatická komorová extrasystolie - katetrová ablace jako léčebná alternativa
- Je možné vyléčit typický flutter síní radiofrekvenční ablací do jedné hodiny?
- Autoimunitné tyreopatie u diabetikov
- Význam transezofageálnej echokardiografie v detekcii kardiogénnej a aortálnej embolizácie pri ložiskovej ischémii mozgu a tranzitórnych ischemických atakoch
- Význam virové kinetiky v počátcích léčby chronické hepatitidy C pegylovaným interferonem α a ribavirinem
- Přístroj Task Force Monitor v diagnostice synkopy pomocí testu na nakloněné rovině
- Role proteinů rodiny STAT v regulaci odpovědi na léčbu chronické hepatitidy C interferonem α
-
Standardní diagnostický a terapeutický postup u genetické (hereditární) hemochromatózy
Doporučený postup České hepatologické společnosti České lékařské společnosti J. E. Purkyně - Osteonekróza čelisti v průběhu léčby mnohočetného myelomu
- Tachykardií navozená kardiomyopatie: méně obvyklé příčiny, méně obvyklá řešení: 3 kazuistiky
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Prim. MUDr. Jaroslav Přehnal, CSc., zemřel
- Malina L. Antihistaminika a antimalarika v dermatologii. Praha: Maxdorf 2005. 82 stran. ISBN 80-7345-065-8
- Malina L. Fotodermatózy. 2. rozšířené vydání. Praha: Maxdorf 2005. 206 stran. ISBN 80-7345-039-9.
- Balíková M. Forenzní a klinická toxikologie. Laboratorní toxikologická vyšetření. Praha: Galén 2004. 140 stran. ISBN 80-7262-284-6.
- Marek J (editor). Endokrinní hypertenze. Praha: Galén 2004. 208 stran, ISBN 80-7262-270-6.
- Šlampa P, Soumarová R, Kocáková I et al. Konkomitantní chemoradioterapie solidních nádorů. Praha: Galén 2005. 167 stran. ISBN 80-7262-276-5.
- Prokeš J et al. Základy toxikologie. Obecná toxikologie a ekotoxikologie. Praha: Galén a Karolinum 2005. 248 stran. ISBN 80-7262-301-X (Galén), 80-246-1086-X (Karolinum).
- Boehmeke T, Doliva R. Pocket Atlas of Echokardiography. Stuttgart: Thieme Stuttgart 2006. 225 stran. ISBN 3-13-14241-0.
- Svačina Š (ed) et al. Trendy soudobé diabetologie. Praha: Galén 2005. Vol. 10. 225 stran. ISBN 80-7262-359-1.
- Tošenovský P, Edmonds ME et al. Moderní léčba syndromu diabetické nohy. Praha: Galén 2004. 207 stran. ISBN 80-7262-261-7.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Idiopatická komorová extrasystolie - katetrová ablace jako léčebná alternativa
- Klinické příznaky, diagnostika a terapie ortostatické intolerance - editorial
- Význam transezofageálnej echokardiografie v detekcii kardiogénnej a aortálnej embolizácie pri ložiskovej ischémii mozgu a tranzitórnych ischemických atakoch
- Je možné vyléčit typický flutter síní radiofrekvenční ablací do jedné hodiny?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



