-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Autoimunitní tyreoiditida: vybrané etiopatogenetické mechanizmy
Autoimmune thyroiditis - selected etiopathogenic mechanisms
Autoimmune thyroiditis occurs as organ specific autoimmune disease not only as an isolated impairment of thyroid gland, but also linked to many autoimmune endocrinopathies. Genetic predisposition in the area of HLA antigens was followed up for patients with autoimmune thyroiditis diagnosed in this way and it appeared that genetic predisposition in isolated autoimmune thyroiditis is different when compared to the occurrence linked to endocrine polyglandular disease. In selected groups of patients with autoimmune disease also the influence of extraneous factors on the development of the autoimmune process was followed up, namely the influence of heavy metals and the influence of infectious agent - Helicobacter pylori. Also these factors have a different character of activation of autoimmune thyroiditis, depending on the character of its manifestation as isolated disorder or in link to autoimmune polyglandular syndrome type II, or in link to the group of polyglandular activation of autoimmunity. To conclude, this study leads to the assumption, that autoimmune thyroiditis is a set of clinical syndromes that depends on the activation of the autoimmune process, rather than a strictly genetically and epigenetically characterized nosological unit.
Keywords:
autoimmune thyroiditis - autoimmune polyglandular syndrome - polyglandular activation of autoimmunity - HLA antigens - Helicobacter pylori - heavy metals
Autoři: I. Šterzl 1,2; P. Hrdá 1,2; P. Matucha 1; B. Potužníková 2; J. Procházková 3
Působiště autorů: Endokrinologický ústav, Praha, ředitel doc. MUDr. Vojtěch Hainer, CSc. 1; Ústav imunologie a mikrobiologie 1. lékařské fakulty UK a VFN, Praha, přednosta doc. MUDr. Ivan Šterzl, CSc. 2; Stomatologický ústav 1. lékařské fakulty UK a VFN, Praha, přednosta prof. MUDr. J. Dušková, DrSc., MBA 3
Vyšlo v časopise: Vnitř Lék 2006; 52(10): 891-899
Kategorie: Původní práce
Souhrn
Autoimunitní tyreoiditida se jako orgánově specifické autoimunitní onemocnění vyskytuje nejen v podobě samostatného poškození štítné žlázy, ale i ve vazbě na řadu autoimunitních endokrinopatií. Byla sledována genetická predispozice v oblasti HLA antigenů u takto diagnostikované autoimunitní tyreoiditidy a ukázalo se, že genetická predispozice u samostatné autoimunitní tyreoiditidy je odlišná ve srovnání s výskytem vázající se na endokrinní polyglandularitu. U vybraných skupin autoimunitní tyreoditidy byl sledován i vliv vnějších faktorů na rozvoj autoimunitního procesu, a to jak vliv těžkých kovů, tak vliv infekčního agens - Helicobacter pylori. I tyto vlivy měly odlišný charakter aktivace autoimunitní tyreoiditidy v závislosti na samostatném projevu či ve vazbě na autoimunitní polyglandulární syndrom II. typu, či na skupinu polyglandulární aktivace autoimunity. Závěrem této studie vzniká předpoklad, že autoimunitní tyreoiditida je souborem klinických syndromů v závislosti na aktivaci autoimunitního procesu a nejedná se o striktně geneticky a epigeneticky charakterizovanou nozologickou jednotku.
Klíčová slova:
autoimunitní tyreoiditida - autoimunitní polyglandulární syndrom - polyglandulární aktivace autoimunity - HLA antigeny - Helicobacter pylori - těžké kovyÚvod
Autoimunitní endokrinopatie jsou řazeny mezi orgánově specifická autoimunitní onemocnění. Nejčastějšími autoimunitními endokrinopatiemi, se kterými se setkáváme jak v imunologické tak endokrinologické ambulanci, jsou autoimunitní tyreopatie - především autoimunitní tyreoiditidy (AT). AT mohou být charakterizovány několika způsoby. Například dle výskytu, se AT vyskytuje buď jen samostatně nebo také ve vazbě na známé autoimunitní polyglandulární syndromy (APS) typ I-III [1]. V posledních letech jsme s profesorem Zamrazilem sledovali pacienty s AT, u kterých docházelo k vzájemné asociaci dalších subklinických autoimunitních endokrinopatií, u kterých ještě nedošlo k rozvoji plného klinického obrazu, a tuto skupinu jsme nazvali „polyglandulární aktivace autoimunity“ (PAA) [2,3]. AT se dále mohou dělit dle klinické charakteristiky [4] na Hashimotovu tyreoiditidu, silentní tyreoiditidu, juvenilní tyreoiditidu, poporodní tyreoiditidu, atrofickou tyreoiditidu a chronickou fibrózní tyreoiditidu. V naší ambulantní praxi, jejíž dlouholetým vůdčím představitelem je profesor Zamrazil, se nejčastěji setkáváme s Hashimotovou tyreoiditidou, jejímž podkladem je lymfocytární infiltrace štítné žlázy.
K tomu, aby mohlo dojít k rozvoji autoimunitní tyreoiditidy, je nezbytná genetická predispozice, která je vázána především na antigeny HLA systému. Tato genetická predispozice je nezbytná, ale pro rozvoj autoimunity ne zcela dostačující a při rozvoji autoimunitního onemocnění se uplatňuje řada dalších mechanizmů. Jako většina autoimunitních chorob mají autoimunitní tyreopatie polygenní základ. Nejdůležitějším genetickým faktorem se zdá být polymorfizmus hlavního histokompatibilitního komplexu, MHC (HLA u člověka). HLA antigeny se uplatňují ve všech funkčních souvislostech především jako HLA restrikce, selekce jednotlivých peptidů a prezentace antigenních štěpů. Je prokázáno, že u autoimunit hraje primární úlohu vazba HLA alel s peptidy virového a bakteriálního původu podobných peptidům vlastních tkání, a důsledkem je klonální expanze autoreaktivních T lymfocytů. HLA haplotypy samy zřejmě nejsou izolovaně etiopatogenetickým faktorem. Dokladem je to, že tytéž kritické haplotypy, které jsou přítomny u nemocných, jsou i u zdravých jedinců [5]. Pro riziko výskytu autoimunitní tyreopatie svědčí výskyt HLA-B8, B15 a B5 a DR3 a DR 4 [6]. U APS II. typu, jehož součástí může autoimunitní tyreoiditda být, byla posána vazba na HLA-DR3/DR4, HLA-DQ2/DQ8, HLA-DRB1*0404, HLA-DQA1*0301 [7,8]. Kromě genů HLA systému se mohou dále uplatnit defekty apoptotických genů (Fas/FasL, Bcl 2), polymorfizmus mikrosatelitních genů - SSPL (např. poruchy CTLA4 u GB tyreotoxikózy) a genové mutace vedoucí k imunodeficitním stavům (např. lymfoproliferační defekt - gen Fas) [9,10].
Ze zevních příčin jsou nejvýznamnější virové, bakteriální a parazitární infekce. Infekčním agens je přisuzován největší podíl na indukci autoimunity, i když zatím žádné infekční agens není přímo asociováno s konkrétní autoimunitní chorobou. Nejčastějším infekčním agens jsou viry (např. EBV), které se mohou uplatnit řadou různých mechanizmů, a to pozměněním autoantigenů (neoantigen), permanentní expresí virového proteinu na povrchu epiteliální buňky a indukcí HLA antigenů na těchto buňkách [11,12]. Z bakteriálních infekcí se již dlouhou dobu poukazuje na vztah mezi gastrointestinálními patogeny a autoimunitní tyreoiditidou. Mezi nejčastěji studované patogeny patří Yersinia enterocolitica, především u Gravesovy-Basedowovy tyreotoxikózy, a v současnosti stále více diskutovaný Helicobacter pylori [13,14]. Helicobacter pylori je G-bakterie kolonizující gastrointestinální trakt člověka a je hlavní příčinou peptické vředové choroby a je to hlavní rizikový faktor pro vznik karcinomu žaludku. Byla popsána i jeho role jako možného patogenetického činitele u řady extradikestivních onemocnění [15]. V současné době přibývá důkazů o jeho výrazné roli v etiopatogenezi autoimunitních tyreopatií. U pacientů s různými formami autoimunitních tyreopatií byla popsána zvýšená prevalence infekce Helicobacter pylori, což bylo prokázáno nálezem zvýšených hladin protilátek IgG proti Helicobacter pylori a výsledky dechových testů [14]. Bertalot popsal pokles titru antityreoidálních autoprotilátek po eradikaci infekce Helicobacter pylori a zdůrazňuje nutnost vyšetření pacientů s autoimunitní tyreoiditidou na přítomnost infekce Helicobacter pylori s očekáváním efektu klinického zlepšení přinášejícího eradikace [16]. Larizza et al prokázali signifikantní interakci mezi HLA-DRB1*0301 a infekcí Helicobacter pylori u dětí s autoimunitní tyreoiditiou, a též doporučují eradikaci Helicobacter pylori u dětí s autoimunitní tyreoiditidou a/nebo s vazbou na genetickou predizpozici [17]. Jsou však také někteří autoři, především gastroenterologové, kteří zpochybňují vztah mezi Helicobacter pylori a autoimunitními tyreopatiemi [18].
Mezi další významné zevní faktory hrající vliv v etiopatogenezi autoimunitních tyreopatií patří těžké kovy. V literatuře byla v souvislosti s působením některých těžkých kovů (rtuť, paladium, nikl, chrom, kobalt, zlato) popsána mimo autoimunitních endokrinopatií řada nejrůznějších chorob: kontaktní alergie, kožní příznaky, mírná ledvinná dysfunkce, pneumokonióza, kontaktní stomatitida či parodontitida, ústní lichen planus, vznik rezistence na antibiotika, dokonce i neplodnost u mužů [19-24]. Lidský organizmus je v neustálé interakci s kovy a jejich sloučeninami. Některé jsou ve stopovém množství pro normální funkci organizmu nezbytné, jiné naopak působí na organizmus toxicky. Rozhodující je i množství kovu a délka expozice, neboť i kov neškodný a prospěšný pro organizmus se ve větším množství a při opakované a dlouhé expozici může stát alergenem či toxickou látkou [25]. Hypersenzitivita na kovy a jejich sloučeniny je reakcí alergenu s efektorovým lymfocytem T, který je senzibilizován na specifický alergen předchozí expozicí. Efektorový T lymfocyt je při setkání s alergenem aktivován a vytváří cytokiny. Výsledkem je infiltrace mononukleárními buňkami nahromaděná v průběhu několika dnů. Výsledný zánět může probíhat na kůži anebo kdekoliv v organizmu, kde jsou deponovány ionty kovů [26]. Například dentální amalgam je v lidském těle hlavním zdrojem anorganické rtuti [27] a považuje se za důležitý rizikový faktor pro pacienty s autoimunitními tyreoiditidami [28].
V naší práci jsme se zaměřili na sledování genetické predispozice v oblasti HLA systému u pacientů s izolovanou AT a autoimunitní tyreoiditidou, která se vyskytuje u pacientů s PAA a APS II. typu a cílem bylo zjistit, zda genetické vazba AT, vyskytující se v těchto 3 odlišných projevech, je stejná nebo odlišná. Dalším cílem bylo též potvrdit odlišnost vlivu vybraných vnějších faktorů (těžké kovy, infekce Helicobacter pylori) na rozvoj autoimunitní tyreoiditidy ve vazbě na odlišné projevy (izolovaná AT, součást PAA a APS II. typu).
Materiál a metodika
1. HLA typizace
Soubor
Probandi byli vybráni z pacientů Endokrinologického ústavu v Praze a 3. interní kliniky 1. LF UK a VFN v Praze.
Na základě detekce orgánově specifických autoprotilátek a klinického stavu jsme vybrali 3 skupiny:
- A. skupina 30 pacientů s autoimunitní tyreoiditidou
- B. skupina 20 pacientů s PAA
- C. skupina 10 pacientů s APS II (Addisonova choroba s autoimunitní tyreoiditidou a/nebo diabetes mellitus - DM 1. typu).
Jako kontrolní data sloužila data alelické frekvence HLA od zdravých dárců krve kavkazského původu.
Průměrný věk pacientů ve skupině A byl 45,6 let, ve skupině B 43,9 let, ve skupině C 42,4 let. Skupinu A tvořilo 27 žen a 3 muži, ve skupině B bylo 19 žen a 1 muž, ve skupině C bylo 8 žen a 2 muži.
Diagnóza autoimunitní tyreoditidy byla stanovena na základě sonografického nálezu a pozitivity protilátek proti tyreoidální peroxidáze (TPO) a/nebo tyreoglobulinu (Tgl). Pacienti byli sledováni v Endokrinologickém ústavu více než 10 let.
Do skupiny PAA byli zařazeni probandi s autoimunitní tyreoiditidou a laboratorním nálezem pozitivity další orgánově specifické autoprotilátky.
Pacienti s APS II. typu byli vybráni na základě anamnestických dat o adrenokortikální nedostatečnosti, pozitivity autoprotilátek proti 21-hydroxyláze (21-OH), TPO a/nebo Tgl a/nebo pozitivity protilátek proti dekarboxyláze kyseliny glutamové (GAD). V době studie všichni pacienti užívali substituční terapii kortikosteroidy.
Metodika
Z periferní krve byla modifikovanou metodou podle Millera izolována genomická DNA. HLA typizace v lokusech HLA-A, HLA-B a HLA-DR byla provedena metodou alelově specifické PCR a frekvence ve skupinách byla porovnána mezi sebou a s kontrolami - zdraví dárci krve kavkazského původu.
Statistické zhodnocení
Dvoustranným Fisherovým exaktním testem byla porovnána alelická frekvence mezi skupinami a zdravými kontrolami.
2. Stanovení protilátek proti Helicobacter pylori v séru
Soubor
Probandi byli vybráni z pacientů Endokrinologického ústavu v Praze a 3. interní kliniky 1. LF UK a VFN v Praze.
Na základě detekce orgánově specifických autoprotilátek a klinického stavu jsme vybrali 4 skupiny:
- A. skupina 23 pacientů s autoimunitní tyreoiditidou
- B. skupina 30 pacientů s PAA
- C. skupina 7 pacientů s APS II (Addisonova choroba s autoimunitní tyreoiditidou a/nebo DM 1. typu)
- D. skupina 30 zdravých kontrol bez autoimunitní endokrinopatie.
Průměrný věk pacientů ve skupině A byl 49,2 let; ve skupině B 46,9 let; ve skupině C 45,9 let a ve skupině D 33,9 let. Skupinu A tvořilo 21 žen a 2 muži, ve skupině B bylo 29 žen a 1 muž, ve skupině C bylo 5 žen a 2 muži a skupinu D tvořilo 16 žen a 14 mužů.
Metody
Kvantitativní stanovení protilátek proti Helicobacter pylori v sérech vyšetřovaných osob bylo prováděno ve třídách IgG, IgA a IgM komerčními testy (EIA - H. pylori, Test-Line, ČR), vyjádřeno indexem pozitivity IP (IP = poměr průměrných absorbancí testovaného séra a cut-off ) a hodnoceno jako pozitivní pro IP > 1,2 a jako hraniční IP 0,8-1,2.
V sérech všech sledovaných skupin byly současně stanoveny pomocí komerčního kitu (BLOT Helicobacter pylori IgG a IgA, Test-Line, ČR) protilátky ve třídách IgG a IgA proti separovaným antigenům Helicobacter pylori: 120 kDa (CagA), 87 kDa (VacA), 33 kDa, 30 kDa, 29 kDa, 26 kDa, 19 kDa, 17 kDa. Jako pozitivní byla hodnocena séra reagující s jedním z antigenů: 120 kDa (CagA), 87 kDa (VacA), 33 kDa, nebo minimálně se dvěma antigeny: 30 kDa, 29 kDa, 26 kDa, 19 kDa, 17 kDa.
Statistické zhodnocení
Statistické hodnocení dat bylo provedeno pomocí dvoustranného Fisherova exaktního testu pomocí statistického balíku R [29].
3. Stanovení intolerance na kovy
Soubor
Probandi byli vybráni z pacientů Endokrinologického ústavu v Praze. Na základě detekce orgánově specifických autoprotilátek a klinického stavu jsme vybrali 3 skupiny:
- A. skupina 12 pacientů s autoimunitní tyreoiditidou, věkový průměr 49,3 let
- B. skupina 10 pacientů PAA, věkový průměr 50,2 let
- C. kontrolní skupina 13 probandů bez autoimunitní endokrinopatie, populační vzorek věkový průměr 41,7 let.
Metody
Stanovení intolerance na kovy bylo provedeno testem MelisaTM (modifikace testu blastické transformace). Tato metoda je patentována prof. V. Stejskalem ve Švédsku [28].
Statistické zhodnocení
Statistické hodnocení dat bylo provedeno pomocí dvoustranného Fisherova exaktního testu.
Výsledky
1. HLA typizace
Porovnáni skupiny A se skupinami B a C a s kontrolní skupinou
Ve skupině A jsme nalezli statisticky významně vyšší výskyt HLA-A24 (21,7 %) v porovnání se skupinou B (5,0 %; p = 0,024) a s kontrolami (8,5 %; p = 0,007). Dále jsme nalezli statisticky významně vyšší výskyt HLA-B27 (15 %) a HLA-DR11 (20 %) v porovnání s kontrolami (4,2 %; p = 0,01) (8,5 %; p = 0,013).
Porovnáni skupiny B se skupinami A a C a s kontrolní skupinou
Ve skupině B jsme nalezli statisticky významně vyšší výskyt HLA-A3 (25 %) v porovnání se skupinou A (10 %; p = 0,043) a s kontrolami (11,8 %; p = 0,047). Dále jsme ve skupině B nalezli statisticky významně vyšší výskyt HLA-B8 (22,5 %) v porovnání se skupinou A (8,3 %; p = 0,045) a s kontrolami (8,6 %; p = 0,012).
Porovnáni skupiny C se skupinami A a B a s kontrolní skupinou
Ve skupině C jsme nalezli statisticky významně vyšší výskyt HLA-DR3 (30 %) v porovnání se skupinou A (10 %; p = 0,040) a s kontrolami (9,8 %; p = 0,047). Dále jsme nalezli statisticky významně vyšší výskyt HLA-B8 (30 %) v porovnání se skupinou A (8,3 %; p = 0,024) a s kontrolami (8,6 %; p = 0,007).
V grafech 1-3 je znázorněna alelická frekvence HLA-A (graf 1), HLA-B (graf 2) a HLA-DR (graf 3) v jednotlivých skupinách.
Graf 1. Alelická frekvence HLA-A ve skupinách A (autoimunitní tyreoiditida), B (polyglandulární aktivace autoimunity), C (autoimunitní polyglandulární syndrom II. typu) a ve skupině kontrol. 
* označuje statisticky významný rozdíl (p < 0,05) v porovnání s kontrolami Graf 2. Alelická frekvence HLA-B ve skupinách A (autoimunitní tyreoiditida), B (polyglandulární aktivace autoimunity), C (autoimunitní polyglandulární syndrom II. typu) a ve skupině kontrol. 
* označuje statisticky významný rozdíl (p < 0,05) v porovnání s kontrolami Graf 3. Alelická frekvence HLA-DR ve skupinách A (autoimunitní tyreoiditida), B (polyglandulární aktivace autoimunity), C (autoimunitní polyglandulární syndrom II. typu) a ve skupině kontrol. 
* označuje statisticky významný rozdíl (p < 0,05) v porovnání s kontrolami 2. Stanovení protilátek proti Helicobacter pylori v séru
Tab. 1. sumarizuje výsledky získané metodou ELISA v jednotlivých skupinách.
Tab. 1. Základní statistika pro stanovení protilátek proti Helicobacter pylori ve třídách IgG, IgA, IgM a CagA IgG metodou ELISA, vyjádřené pomocí indexů pozitivity, provedené v sérech pacientů jednotlivých skupin (skupina A – pacienti s izolovanou autoimunitní tyroiditidou, skupina B – pacienti s polyglandulární aktivací autoimunity, skupina C – pacienti s autoimunitním polyglandulárním syndromem II. typu, skupina D – zdravé kontroly). 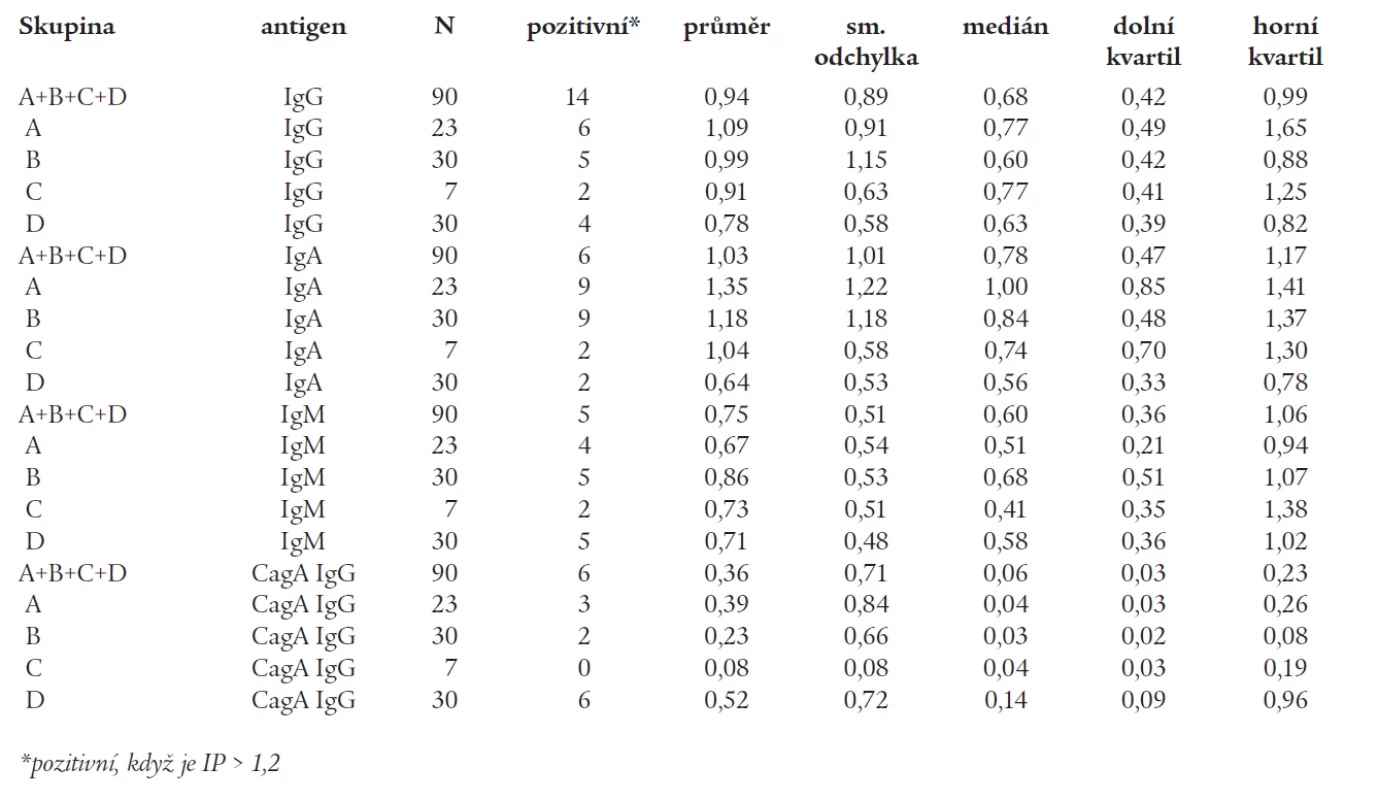
ELISA metoda
Protilátky proti Helicobacter pylori IgG jsme nalezli u 26 % ve skupině A, u 17 % ve skupině B, u 29 % ve skupině C a u 13 % ve skupině D.
Protilátky proti Helicobacter pylori IgA jsme nalezli u 39 % ve skupině A, u 30 % ve skupině B, u 29 % ve skupině C a u 7 % ve skupině D.
Protilátky proti Helicobacter pylori IgM jsme nalezli u 17 % ve skupině A, u 17 % ve skupině B, u 29 % ve skupině C a u 17 % ve skupině D.
Ve skupinách A, B, C jsme nalezli vyšší výskyt protilátek IgA a IgG proti Helicobacter pylori v porovnání se skupinou D, avšak statisticky významně vyšší výskyt byl pouze ve třídě IgA u skupiny A a B (p < 0,05). Výsledky jsou znázorněny ve grafu 4.
Graf 4. Výskyt tříd IgG, IgA a IgM protilátek proti Helicobacter pylori detekovaných metodou ELISA ve skupinách A (autoimunitní tyreoiditida), B (polyglandulární aktivace autoimunity), C (autoimunitní polyglandulární syndrom II. typu) a ve skupině kontrol. 
* označuje statisticky významný rozdíl (p < 0,05) v porovnání s kontrolami Protilátky proti Cag antigenu jsme nalezli u 13 % ve skupině A, u 7 % ve skupině B, u 0 % ve skupině C a u 20 % ve skupině D. Vzhledem k malému počtu probandů ve skupinách, zejména ve skupině C, nebyly tyto výsledky statisticky významné.
Kvalitativní detekce protilátek pomocí imunoblotu
U všech probandů byly detekovány protilátky proti separovaným antigenům Helicobacter pylori 120 kDa (CagA), 87 kDa (VacA), 33 kDa, 30 kDa, 29 kDa, 26 kDa, 19 kDa, 17 kDa ve třídách IgG a IgA.
Imunoblot IgG: U skupiny A jsme nalezli statisticky významně vyšší výskyt protilátek proti VacA (p = 0,01), proti 30 kDa antigenu (p = 0,001), proti 17 kDa antigenu (p = 0,008) v porovnání se skupinou D. U skupiny C v porovnání se skupinou D protilátek jsme nalezli statisticky významně vyšší výskyt protilátek proti 30 kDa antigenu (p = 0,037).
Imunoblot IgA: U skupiny A jsme nalezli statisticky významně vyšší výskyt protilátek proti 17 kDa antigenu (p = 0,0015) v porovnání se skupinou D.
Výsledky imunoblotu ve třídě IgG zobrazuje graf 5, imunoblotu ve třídě IgA graf 6.
Graf 5. Výskyt protilátek třídy IgG proti jednotlivým antigenům Helicobacter pylori detekovaných pomocí imunoblotu ve skupinách A (autoimunitní tyreoiditida), B (polyglandulární aktivace autoimunity), C (autoimunitní polyglandulární syndrom II. typu) a ve skupině kontrol. 
* označuje statisticky významný rozdíl (p < 0,05) v porovnání s kontrolami Graf 6. Výskyt protilátek třídy IgG proti jednotlivým antigenům Helicobacter pylori detekovaných pomocí imunoblotu ve skupinách A (autoimunitní tyreoiditida), B (polyglandulární aktivace autoimunity), C (autoimunitní polyglandulární syndrom II. typu) a ve skupině kontrol. 
* označuje statisticky významný rozdíl (p < 0,05) v porovnání s kontrolami 3. Intolerance na kovy
U skupiny A jsme nalezli vazbu k přecitlivělosti na stříbro, anorganickou a organickou rtuť, nikl a cín (p < 0,05).
U skupiny B jsme nalezli vazbu k přecitlivělosti na zlato, anorganickou a organickou rtuť, nikl a platinu (p < 0.05)
Výsledky jsou znázorněny v grafu 7.
Graf 7. Výskyt přecitlivělosti na kovy detekované metodou MELISA ve skupinách A (autoimunitní tyreoiditida), B (polyglandulární aktivace autoimunity) a ve skupině kontrol. 
* označuje statisticky významný rozdíl (p < 0,05) v porovnání s kontrolami Diskuse
V naší práci jsme si položili několik cílů. Prvním cílem bylo zjistit, zda genetické vazba AT, vyskytující se v 3 odlišných projevech (izolovaná AT, PAA, APS II), je stejná nebo odlišná. Jako marker genetické predispozice jsme si zvolili expresi antigenů HLA systému. Z literatury je známo, že u APS II. typu je vazba na HLA-DR3/DR4, HLA-DQ2/DQ8, HLA-DRB1*0404, HLA-DQA1*0301 [7,8]. Výsledky naší práce ukazují na rozdíly v HLA systému mezi izolovanou autoimunitní tyreoiditidou a oběma skupinami s „polyglandulárními projevy“, a to jak pacienty s PAA, tak pacienty s APS II. typu. Mezi PAA a APS II. typu jsme nenalezli statisticky významný rozdíl v alelické frekvenci HLA-B8 a HLA-DR3. Ty jsou považovány za důležité rizikové alely pro rozvoj polyglandularity.
Dalším cílem bylo potvrdit odlišnost vlivu vybraných vnějších faktorů (těžké kovy, infekce Helicobacter pylori) na rozvoj autoimunitní tyreoiditidy ve vazbě na odlišné projevy (izolovaná AT, součást PAA a APS II. typu).
Vztah infekce Helicobacter pylori k autoimunitní tyreoditidě byl cílem zájmu řady prací [14,16,30,31]. Možným mechanizmem, kterým infekce Helicobacter pylori může patogeneticky působit na organizmus, je indukce autoimunitní reakce pomocí mechanizmu molekulárních mimiker [32,33]. Eradikace infekce Helicobacter pylori vede též k redukci symptomů autoimunitního procesu, jako je pokles tyroidálních autoprotilátek [16]. Ve shodě s jinými autory [14,30,31] jsme prokázali vazbu infekce Helicobacter pylori k autoimunitní tyreoiditidě (klinickými a laboratorními přístupy) u všech 3 skupin pacientů (AT, PAA, APS II). Výskyt protilátek proti Helicobacter pylori byl statisticky významně vyšší ve třídě IgA u skupiny A (pacienti s izolovanou autoimunitní tyreoiditidou) a ve skupině B (pacienti s PAA).
Důležitým nálezem byla rozdílná exprese antigenů v jednotlivých skupinách. Kvalitativním stanovením protilátek proti Helicobacter pylori ve třídě IgG jsme nalezli vyšší expresi antigenů VacA a 30 kDa antigenu ve skupině A (izolovaná autoimunitní tyreoiditida) a 30 kDa antigenu ve skupině C (APS type II). Ve třídě IgA jsme prokázali statisticky významně vyšší expresi 17 kDa antigenu pouze u skupiny A.
V rámci sledování přecitlivělosti na kovy jsme u skupin PAA a AT prokázali přecitlivělost na odlišné kovy. Poukázali jsme na odlišnosti v přecitlivělosti na jednotlivé skupiny těžkých kovů u různých autoimunitních endokrinopatií. Domníváme se, že odlišné kovy mohou vést u rozdílně geneticky determinovaných jedinců k různým klinickým projevům. Ukázalo se také, že přecitlivělost k těžkým kovům se může vyvinout statisticky významněji u pacientů nesoucích antigeny HLA DR4 [34].
Naše výsledky exprese HLA antigenů ukazují na genetickou rozdílnost mezi izolovanou autoimunitní tyreoiditidou a oběma skupinami s „polyglandulárními projevy“ (PAA a APS II). Tyto dvě skupiny s „polyglandulárními projevy“ mají velmi malou genetickou odlišnost, rozdílný klinický vývoj záleží pravděpodobně na epigenetických faktorech. Rozdílné nálezy v séropozitivitě Helicobacter pylori ve všech 3 skupinách nás vedou k závěru, že epigenetický vliv infekce Helicobacter pylori a distribuce individuálních antigenů jsou odlišné u všech 3 skupin s přítomností autoimunitní tyreoiditidy. Určitý rozdíl jsme zjistili i v přecitlivělosti na kovy odlišné kovy, což hraje též roli epigenetického faktoru u autoimunitních tyreoiditid.
Tyto výsledky nás vedou k závěru, že autoimunitní tyreoiditida nemusí reprezentovat samostatnou nozologickou jednotku, ale je spíše projevem různých klinických syndromů s rozdílnými genetickými a epigenetickými faktory a domníváme se, že autoimunitní tyreoiditida při PAA je odlišnou nozologickou jednotkou (na rozdíl od izolované autoimunitní tyreoiditidy).
Poděkování
Práce vznikla za podpory grantu IGA MZ ČR 8115-3.
doc. MUDr. Ivan Šterzl, CSc
www.endo.cz
e-mail: isterzl@endo.cz
Doručeno do redakce: 26. 6. 2006
Zdroje
1. Muir A, Schatz DA, Maclaren NK. Polyglandular failure syndromes. 3013-3022. In: DeGroot LJ, Besser M, Burger HG. Endocrinology. Philadelphia: WB Saunders 1995 : 3013-3022.
2. Šterzl I, Fučíková T, Hrdá P et al. Únavový syndrom u autoimunitní tyreoiditidy s polyglandulární aktivací autoimunity. Vnitř Lék 1998; 44 : 456-460.
3. Šterzl I, Vavrejnová V, Matucha P et al. Extrathyroid autoantibodies in autoimmune thyroiditis. Polyendocrine autoantibodies. The Thyroid Gland 1999; 2 : 37-43.
4. Volpé R. The immunology of human autoimmune thyroid disease. 217-245. In: Volpé R. Autoimmune endocrinopathies. New Jersey 1999. 217-245.
5. Wucherpfennig KW, Strominger JL. Selective binding of self peptides to disease-associated major histocompatibility complex (MHC) molecules: a mechanism for MHC-linked susceptibility to human autoimmune diseases. J Exp Med 1995; 181 : 1597-1601.
6. Zamrazil V, Němec J, Šterzl I. Autoimunitní tyreopatie. Klinická biochemie a metabolismus 1995; 3 : 71-73.
7. Robles DT, Fain PR, Gottlieb PA et al. The genetics of autoimmune polyendocrine syndrome type II. Endocrinol Metab Clin North Am 2002; 31 : 353-368.
8. Wallaschofski H, Meyer A, Tuschy U et al. HLA-DQA1*0301-associated susceptibility for autoimmune polyglandular syndrome type II and III. Horm Metab Res 2003; 35 : 120-124.
9. De Maria R, Testi R. Fas-FasL interactions: a common pathogenetic mechanism in organ-specific autoimmunity. Immunol Today 1998; 19 : 121-125.
10. Ban Y, Tomer Y. Genetic susceptibility in thyroid autoimmunity. Pediatr Endocrinol Rev 2005; 3 : 20-32.
11. Gianani R, Sarvetnick N. Viruses, cytokines, antigens, and autoimmunity. Proc Natl Acad Sci USA 1996; 93 : 2257-2259.
12. Tomer Y, Davies TF. Infection, thyroid disease, and autoimmunity. Endocr Rev 1993; 14 : 107-120.
13. Bech K, Clemmensen O, Larsen JH et al. Thyroid disease and Yersinia. Lancet 1977; 8020 : 1060-1061.
14. de Luis DA, Varela C, de La Calle H et al. Helicobacter pylori infection is markedly increased in patients with autoimmune atrophic thyroiditis. J Clin Gastroenterol 1998; 26 : 259-263.
15. De Koster E, De Bruyne I, Langlet P et al. Evidence based medicine and extradigestive manifestations of Helicobacter pylori. Acta Gastroenterol Belg 2000; 63 : 388-392.
16. Bertalot G, Montresor G, Tampieri M et al. Decrease in thyroid autoantibodies after eradication of Helicobacter pylori infection. Clin Endocrinol (Oxf) 2004; 61 : 650-652.
17. Larizza D, Calcaterra V, Martinetti M et al. Helicobacter pylori infection and autoimmune thyroid disease in young patients: the disadvantage of carrying the human leukocyte antigen-DRB1*0301 allele. J Clin Endocrinol Metab 2006; 91 : 176-179.
18. Tomasi PA, Dore MP, Fanciulli G et al. Is there anything to the reported association between Helicobacter pylori infection and autoimmune thyroiditis? Dig Dis Sci 2005; 50 : 385-388.
19. Bruce GJ, Hall WB. Nickel hypersensitivity-related periodontitis. Compend Contin Educ Dent 1995; 178(16): 180-174.
20. Eti S, Weisman R, Hoffman R et al. Slight renal effect of mercury from amalgam fillings. Pharmacol Toxicol 1995; 76 : 47-49.
21. Hanf V, Forstmann A, Costea JE et al. Mercury in urine and ejaculate in husbands of barren couples. Toxicol Lett 1996; 88 : 227-231.
22. Hensten-Pettersen A. Casting alloys: side-effects. Adv Dent Res 1992; 6 : 38-43.
23. Larsson A, Warfvinge G. The histopathology of oral mucosal lesions associated with amalgam or porcelain-fused-to-metal restorations. Oral Dis 1995; 1 : 152-158.
24. Selden AI, Persson B, Bornberger-Dankvardt SI et al. Exposure to cobalt chromium dust and lung disorders in dental technicians. Thorax 1995; 50 : 769-772.
25. Shitova O, Guseva L, Denisova A et al. Immunosupression caused by industrial chemicals in workers of a pharmaceutical factory. In: Abstracts of the 8th International Congress of Immunology. Budapest (Hungary), Aug 1992. Budapest (Hungary): Springer Hungarica 1992 : 597.
26. Ionescu G. Allergotoxische Einflüsse von Umweltschadstoffen bei Allergiekranken. Forsch Komplementärmed 1995; 2 : 2-8.
27. Skare I, Bergstrom T, Engqvist A et al. Mercury exposure of different origins among dentists and dental nurses. Scand J Work Environ Health 1990; 16 : 340-347.
28. Sterzl I, Prochazkova J, Hrda P et al. Mercury and nickel allergy: risk factors in fatigue and autoimmunity. Neuroendocrinol Lett 1999; 20 : 221-228.
29. R Development. Core Team. R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing; 2005.
30. Figura N, Di Cairano G, Lore F et al. The infection by Helicobacter pylori strains expressing CagA is highly prevalent in women with autoimmune thyroid disorders. J Physiol Pharmacol 1999; 50 : 817-826.
31. Raymond J, Sauvestre C, Kalach N et al. Immunoblotting and serology for diagnosis of Helicobacter pylori infection in children. Pediatr Infect Dis J 2000; 19 : 118-121.
32. Moran AP, Prendergast MM, Appelmelk BJ. Molecular mimicry of host structures by bacterial lipopolysaccharides and its contribution to disease. FEMS Immunol Med Microbiol 1996; 16 : 105-115.
33. Negrini R, Savio A, Poiesi C et al. Antigenic mimicry between Helicobacter pylori and gastric mucosa in the pathogenesis of body atrophic gastritis. Gastroenterology 1996; 111 : 655-665.
34. Roos A, Schilder-Tol EJ, Chand MA et al. HgCl2 and IL4 differentially modify expression of major histocompatibility complex class II molecules RT1.B and RT1.D in B lymphocytes from brown Norway and Lewis rats. Transplant Proc 1997; 29 : 1675-1676.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2006 Číslo 10- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Profesor MUDr. Václav Zamrazil, DrSc. sedmdesátníkem
- Václav Zamrazil - pokračovatel v Šilinkově jodové profylaxi strumy
-
Změny v zásobení jodem české dospělé populace po eradikaci jodového deficitu a jejich příčiny
Randomizovaná studie dospělé populace dvou regionů České republiky s odstupem 5 let - Tyreoidální autoimunita u dospělých diabetiků 1. typu. Vlastní zkušenosti z 11letého sledování
- Jod a tyreoidální hormony
- Autoimunitní tyreoiditida: vybrané etiopatogenetické mechanizmy
- Testosteron v léčbě svalové slabosti
- Nádory štítné žlázy a Hirschsprungova choroba: desetileté zkušenosti s molekulárně genetickou diagnostikou RET proto-onkogenu
- Mechanizmus vnútrobunkového pôsobenia hormónov štítnej žľazy
- Hormonální poruchy po úrazu mozku
- Hashimotova encefalopatie
- Kongenitální adrenální hyperplazie na podkladě deficitu 3-β-hydroxysteroidní dehydrogenázy
- Subklinické tyreopatie
- Radionuklidové zobrazovací metody používané v endokrinologii
- Přirozené antiglukokortikoidy
- Příspěvek k diskusi o vzájemném vztahu mezi onemocněním mléčné a štítné žlázy
- Doporučený postup laboratorního vyšetřování funkce štítné žlázy - ano či ne?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hashimotova encefalopatie
- Radionuklidové zobrazovací metody používané v endokrinologii
- Kongenitální adrenální hyperplazie na podkladě deficitu 3-β-hydroxysteroidní dehydrogenázy
- Autoimunitní tyreoiditida: vybrané etiopatogenetické mechanizmy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



