-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Multikomponentní automatizované odběry – nový trend v dárcovství krve
Multi-component automated collection – novel tendency in blood donating
Multi-component blood collection represents a new tendency in transfusiology. Modern blood separators allows concomitant collection of erythrocytes, thrombocytes or plasma in various combinations from one blood donor in one session, with a result of high quality standardised transfusion preparations in the final form. The method represents the alternative to full blood donating, brings advantages for patients and transfusion sites. An application of more transfusion preparations from one donor decreases risks of haemotherapy in poly-transfusion patients, the method brings flexibility and rational utilisation of donor base for transfusion sites. Currently the method represents a matter of interest of leading world-known transfusion professionals, questions regarding inclusion criteria for blood donors, the influence of this type of blood collection on blood donors and the quality of products obtained are intensively studied. The author gives review of current state of the topic.
Key words:
multi-component blood collection – apheresis – inclusion criteria for blood donor – transfusion – quality of transfusion preparations – effectivity of the method
Autoři: R. Procházková
Působiště autorů: Transfuzní oddělení, Krajská nemocnice Liberec, přednosta prim. MUDr. Renata Procházková
Vyšlo v časopise: Vnitř Lék 2005; 51(3): 320-326
Kategorie: Přehledné referáty
Souhrn
Multikomponentní odběry krve představují nový trend v transfuziologii. Moderní krevní separátory umožňují současný odběr erytrocytů, trombocytů nebo plazmy v různých kombinacích od jednoho dárce krve při jednom sezení, výsledkem jsou standardizované transfuzní přípravky vysoké jakosti ve finálním formě. Metoda představuje alternativu k dárcovství plné krve, přináší výhody pro pacienty i transfuzní pracoviště. Aplikace více transfuzních přípravků od jednoho dárce snižuje rizika hemoterapie u polytransfundovaných pacientů, pro transfuzní pracoviště metoda přináší flexibilitu a racionální využití dárcovské základny. V současné době je předmětem zájmu předních světových transfuzních pracovníků, intenzivně jsou studovány otázky týkající se výběrových kritérií pro dárce krve, vliv tohoto typu odběrů na dárce krve, jakost získaných produktů. Autorka podává přehled současného stavu problematiky.
Klíčová slova:
multikomponentní odběr krve – aferéza – výběrová kritéria dárce – transfuze – jakost transfuzních přípravků – efektivita metodyÚvod
Transfuzní přípravky pro zajištění hemoterapie je možné získávat klasickými odběry plné krve a jejím následným zpracováním anebo aferetickými technikami. Nový trend představují multikomponentní odběry krve (MKO), které přinesl vývoj moderních krevních separátorů [3,27]. Umožňují odběr více transfuzních jednotek (TU) krevních složek od jednoho dárce při jednom odběru v různých kombinacích. Metoda byla poprvé představena na kongresu ESFH v roce 1993 v Aberdeenu, americkou FDA byl nejprve povolen odběr 1 TU erytrocytů a 2 TU plazmy (1995), poté odběr 2 TU autologních erytrocytů v roce 1996 a roku 1997 odběr 2 TU alogenních erytrocytů [26]. Vývoj tohoto typu odběrů probíhal současně se zvyšujícími se požadavky na množství a jakost transfuzních přípravků, které přinesly nové léčebné postupy, zejména v hematoonkologii [1,5]. Metoda umožňuje přípravu standardizovaných transfuzních přípravků vysoké jakosti [26,28], přináší výhody pro pacienty i transfuzní pracoviště, představuje v současné době moderní alternativu k dárcovství plné krve [4].
Aplikace většího spektra transfuzních přípravků od jednoho dárce snižuje počet dárců, jimž je pacient exponován, a tím snižuje riziko přenosu infekce [26], snižuje možnost imunizace hemoterapií zejména u polytransfundovaných pacientů [23,39], umožňuje bezpečnější pokračování v léčbě již imunizovaných nemocných výběrem fenotypově shodných dárců krve [38]. Aplikace přípravků s nízkým obsahem leukocytů a jimi uvolňovaných cytokinů snižuje výskyt nehemolytických febrilních potransfuzních reakcí [45,36,37]. Aplikace erytrocytů standardní jakosti zvýší terapeutickou dávku hemoglobinu, redukuje čas mezi následnými transfuzemi u polytransfundovaných pacientů [16,25]. Výhodná může být i při autotransfuzích [14].
Pro transfuzní pracoviště je přínosem možnost přípravy 2 transfuzních jednotek trombocytů, resp. přípravu erytrocytů vzácných krevních skupin [38], zejména při chronickém nedostatku dárců a stoupajících nárocích na jejich výběr [12]. Usnadňuje vyhledávání například CMV - negativních dárců v indikovaných případech [23]. Metoda přináší ekonomizaci provozu aferetické jednotky, umožňuje organizaci odběrů podle momentálních požadavků a pružné využití dárcovské základny [26]. Výsledkem MKO je transfuzní přípravek ve finální formě, není již potřeba další nákladná technika a pracovní síla na následné zpracování, jako tomu je u plné krve [8].
Charakteristika metody
Metoda představuje několik desítek minut (35–110 min) trvající odběr na krevním separátoru [23], kterým projde asi 1/2 celkového krevního objemu dárce. Tento objem je mimo tělo dárce odváděn speciálním setem intermitentně v cyklech po asi 250 ml krve (obr. 1), anebo průběžně kontinuální aferézou. Během tohoto procesu je krev dárce vystavena kontaktu s odběrovým materiálem a centrifugaci asi 3 000–7 000 otáček [38]. Do krevního oběhu dárce se vracejí složky krve, které nejsou předmětem sběru.
Obr. 1. Set pro odběr trombocytů a plazmy – separátor Haemonetics MCS+ 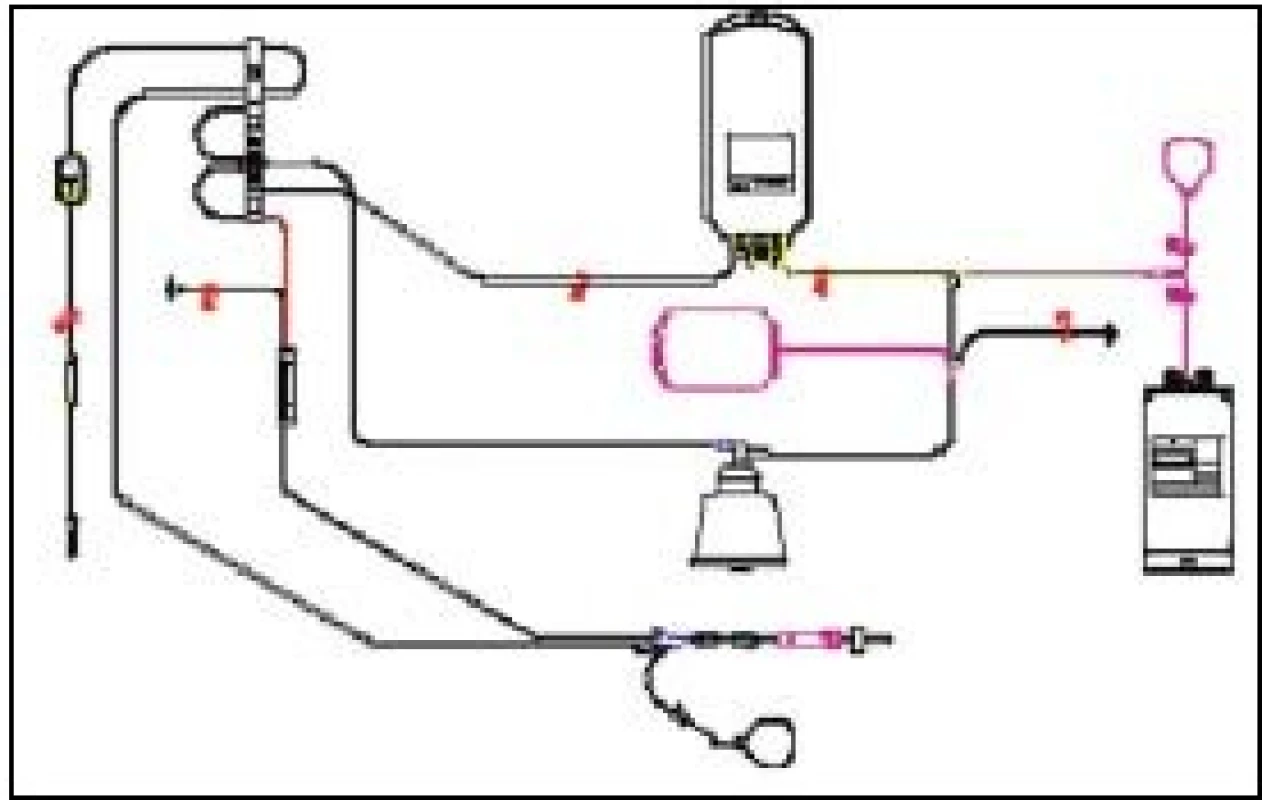
1 – Lathamův centrifugační zvon, 2 – sběrný vak pro plazmu, 3 – sběrný vak pro trombocyty, 4 – vzorkovací váček produktu, 5 – jednorázová jehla s krytkou, 6 – vzorkovací váček pro krev dárce, 7 – hrot pro připojení antikoagulačního roztoku Autoři se nejvíce soustředí na současný odběr krevních buněk – 2 TU erytrocytů nebo 2 TU trombocytů, resp. kombinaci erytrocytů a trombocytů [5,26], ojediněle práce popisují odběr až 600 ml erytrocytů [44] s cílem získat co nejvyšší terapeutickou dávku od jednoho dárce. Možné kombinace odběrů uvádí tab. 1. Současný odběr plazmy není prioritou, obvykle je získávána pro svou kvalitu a ekonomizaci procedury [49]. V současné době lze MKO provádět na několika typech krevních separátorů (tab. 2). Přednostně jsou získávány deleukotizované přípravky: dle typu přístroje lze připravit trombocyty deleukotizované přímo procedurou (leukoredukční Cobe TRIMA – obr. 2, Amicus Baxter), nebo následně filtrované (Haemonetics MCS+), erytrocyty jsou následně deleukotizovány filtrací u všech typů separátorů. Důležité je věnovat pozornost dávce odebíraných komponent v TU odebíraných produktů, se kterou autor pracuje: řada autorů uvádí TU o počtu trombocytů > 3,5 mld [5], jiní pracují s velikostí 1 TU > 2,0 mld. Dle EU Guide [27]. Z uvedeného je patrný podstatný rozdíl ve velikosti 2 TU PLT: 4,0 až 7,0 mld trombocytů. Plazma je obvykle odebírána v množství 230 ml na 1 TU, 460 ml při odběru 2 TU, množství erytrocytů kolísá mezi 180–230 ml v 1 TU.
Tab. 1. Možné kombinace odběrů (v TU). 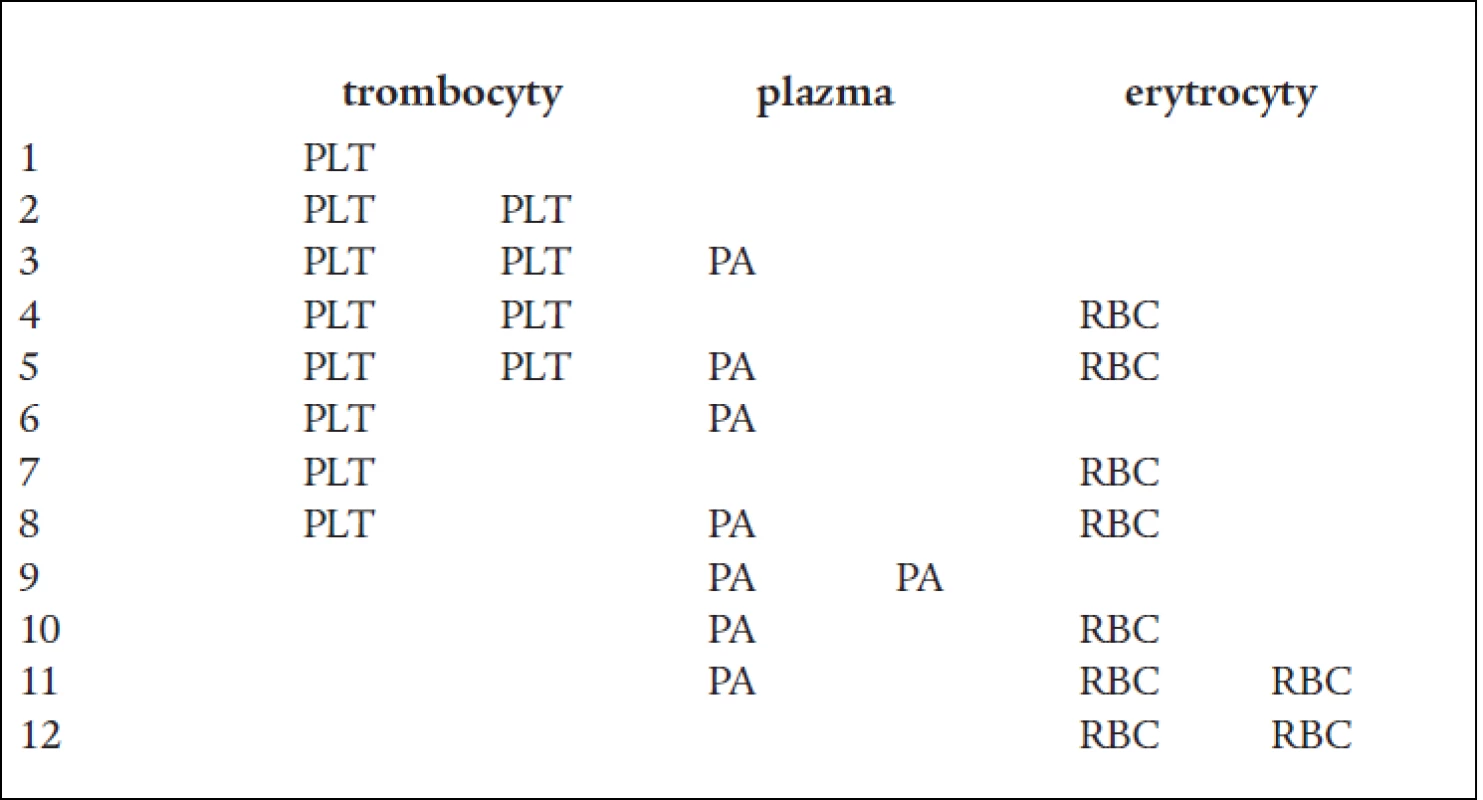
PLT – trombocyty, PA – plazma, RBC – erytrocyty, TU – transfuzní jednotka Upraveno dle: Matthes, GA. Options and cost effectiveness of multicomponent blood collection. Transf Apher Sci 2002; 27: 115, a Blanco L. Tailored collection of multicomponent by apheresis. Transf Apher Sci 2002; 27: 123–127. Tab. 2. Přístroje pro multikomponentní odběry. 
RBC – erytrocyty, PLT – trombocyty, FFP – plazma Upraveno dle: Matthes, GA. Options and cost effectiveness of multicomponent blood collection. Transf Apher Sci 2002; 27: 115–121. Výběr dárců
Výběr dárců probíhá dle různých kritérií, někteří autoři postupují dle Doporučení Rady Evropy [13], jiní dle kriterií FDA, která jsou volnější [2,15], nebo dle jejich kombinací s národními kritérii pro aferézy [5,44]. Doporučení Rady Evropy doporučují mimo standardní požadavky pro dárce aferézy (anamnéza bez krvácivých epizod a retence tekutin, bez nežádoucích účinků předchozích odběrů, předodběrový počet trombocytů, doporučení vyšetření bílkovinného spektra, stanovení celkového množství plazmy odebraného za 1 rok atd): pro 1 TU erytrocytů samostatně nebo se současným odběrem trombocytů a/nebo plazmy vyšetření Hb nebo Ht dárce před odběrem, pro odběr 2 TU erytrocytů stanoví podrobnější doporučení: váha dárce > 70 kg, celkový objem krve (TBV) > 5 000 ml, Hb > 140 g/l, Ht > 0,42, Hb po odběru by neměl klesnout pod hodnotu 110 g/l. Mezi dvojitou erytrocytaferézou je doporučen 6měsíční interval, odběr trombocytů, resp. plazmy může následovat po odběru 1 nebo 2 TU erytrocytů za 30 dnů, po odběru trombocytů, resp. plazmy za 14 dnů. Odběr 1, resp. 2 TU erytrocytů pro odběry plazmy či trombocytů je možný již za 2 dny. Výběrová kritéria FDA pro dárce 2 TU erytrocytů jsou: Hb > 133 g/l, nebo Ht > 0,40, u žen váha > 68 kg, výška > 168 cm, u mužů váha > 59 kg a výška > 155 cm. Mezi odběry je doporučen na 16týdenní interval [33]. Někteří němečtí autoři vybírají pro všechny MKO dárce s TBV > 4 350 ml, maximální extrakorporální objem může činit maximálně 15 % TBV, dvojitou erytrocytaferézou nesmí být odebráno více než 22,5 % celkové erytrocytární masy. Jsou vypracována dárcovská kritéria pro různé odběrové protokoly (tab. 3) [26]. Zde si nelze nevšimnout vysoké frekvence odběrů TU erytrocytů za rok, minimální interval mezi odběry 1 TU RBC je 63 dnů. Poněkud odlišně jsou pojata dárcovská vstupní kritéria v Centro De Transfusion v Madridu. Pro odběry 2 TU RBC jsou respektována Doporučení rady Evropy, pro ostatní MKO je dárce vybírán dle vztahu TBV a počtu trombocytů dárce (tab. 4). Pro odběry trombocytů a plazmy jsou preferováni dárci krevních skupin B a AB, pro odběry erytrocytů dárci krevních skupin 0 a A [5].
Tab. 3. Výběrová kritéria dárců krve (SRN). 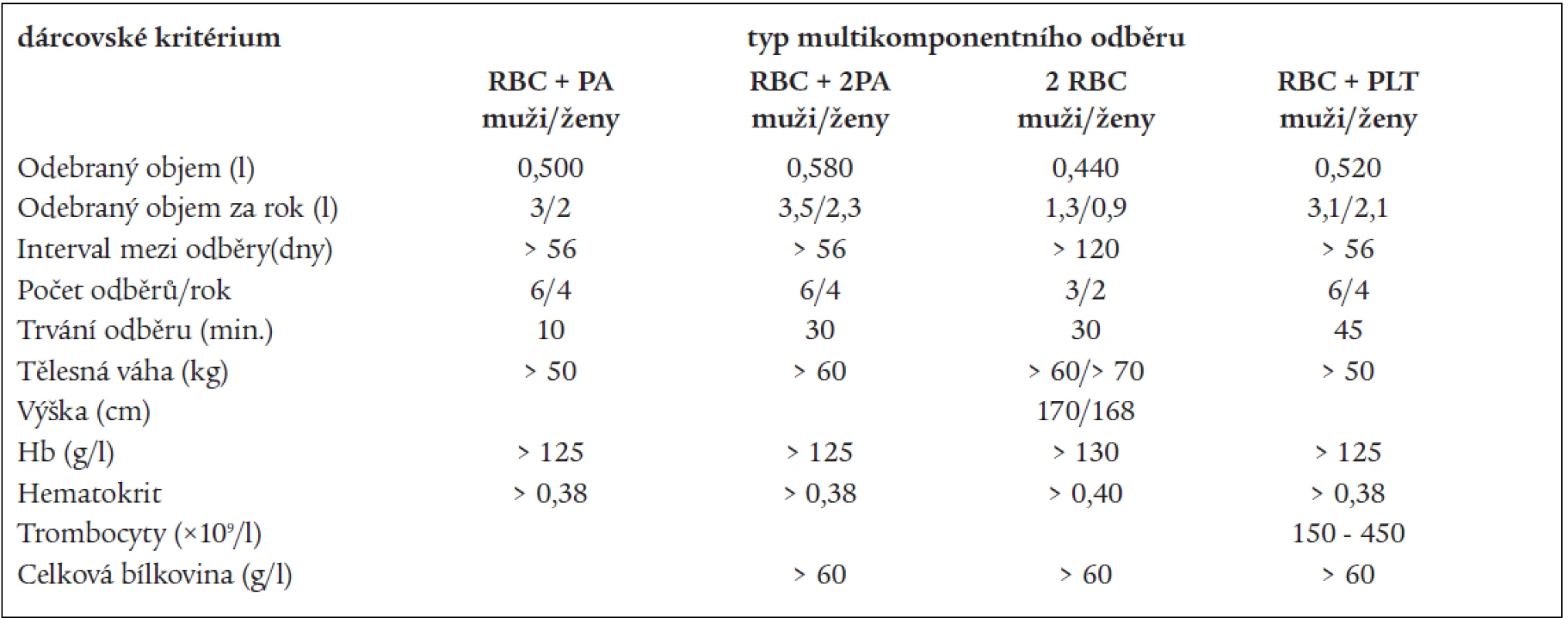
PLT – trombocyty, PA – plazma, RBC – erytrocyty , TU – transfuzní jednotka Upraveno dle: Matthes, GA. Options and cost effectiveness of multicomponent blood collection. Transf Apher Sci 2002; 27: 115–121. Tab. 4. Výběrová kritéria pro dárcovství trombocytů (Centro De Transfusion, Madrid). 
Legenda v textu Lze tedy konstatovat, že jednotná vstupní kritéria pro dárce krve pro MKO zatím nejsou stanovena. Jako klíčový parametr se ukazuje TBV, nicméně je nutné hodnotit více vstupních ukazatelů zdravotního stavu dárce krve, např. feritin u dvojitých erytrocytaferéz [23,27], předodběrový počet trombocytů dárce ve vztahu k TBV [5], celkovou bílkovinu [5,26]. Limitujícím faktorem se ukazuje být délka procedury, zejména u dobrovolných bezplatných dárců krve, jak vyplývá i z našich zkušeností.
Vliv aferéz na zdravotní stav dárce krve
Dle současných znalostí a zkušeností je metoda považována pro dárce krve za bezpečnou [8,26], jsou aplikovány poznatky z klasických aferéz a zkušenosti získané s novou metodou [28,48]. Nový způsob odběru je dárci kladně přijímán [32]. Nicméně je nutno očekávat vedlejší efekty procedury, a to krátkodobě i dlouhodobě.
Jsou známy krátkodobé efekty aferéz na dárce, například bolest při vpichu, nauzea, hematomy, oběhové reakce, vliv citrátového antikoagulans a další [4]. U MKO je spektrum jejich výskytu podobné [2], výskyt oběhových reakcí bývá i nižší než u dárců plné krve, protože při aferéze nedochází k náhlé ztrátě objemu [10]. Dvojitá erytrocytaferéza je dobře snášena, vzhledem k odběru cca 350–400 ml erytrocytů je incidence přímých vedlejších účinků erytrocytaferézy podobná jako u odběrů plné krve [16,28]. Vedlejší efekt citrátového antikoagulans může způsobit jeho zvýšená plazmatická hladina, způsobená zvýšeným poměrem antikoagulans ke krvi a také nedosažením jeho standardního plateau v plazmě. Zvýšená koncentrace citrátu s sebou následně přináší významné snížení hladiny ionizovaného kalcia a magnézia, v rozmezí 33–39 % pod fyziologické hodnoty. Hladina parathormonu se zvyšuje po 30 minutách trvání aferézy. Současně je zvýšena exkrece citrátu, kalcia, magnézia, koncentrace sodíku a draslíku v moči během celé aferézy [6]. Příčinou citrátové reakce může být i vysoká návratová rychlost plazmy s obsahem citrátu dárci [25]. Prevencí je v běžné praxi podávání kalcia, avšak možnost reakcí zcela eliminována není [9]. Vzhledem k délce odběru a množství použitého antikoagulans u některých typů MKO by bylo možno předpokládat vyšší výskyt vedlejších reakcí, avšak literatura je zatím neuvádí.
Z dlouhodobých účinků MKO byla sledována zejména „hematologická recovery“ a zásoby železa u dvojitých erytrocytaferéz: hodnoty hemoglobinu, retikulocytů, trombocytů, plazmatické hladiny železa, transferinu, feritinu, saturace transferinem a hladina endogenního erytropoetinu. Snížení hodnoty Hb bylo nejvýznamnější 7 dnů po odběru, přetrvávalo ještě 30. den po odběru. Vrchol vzestupu retikulocytů a erytropoetinu se projevil 1. až 7. den po odběru, stejně jako snížení plazmatické hladiny železa na minimum. K plné hematologické recovery dochází do 70 dnů, k regeneraci zásob železa nikoli [15], snížení hladiny feritinu na 12 ng/ml bylo zaznamenáno ještě za 16 týdnů po dvojité erytrocytaferéze [38]. Vyšetření hladiny feritinu je proto doporučeno jako marker výběru a sledování dárce [15], avšak doporučená plazmatická hladina zatím stanovena nebyla. Podrobnější studium parametrů metabolizmu železa, například cirkulujícího transferinového receptoru v séru, který je citlivým parametrem latentního nedostatku železa [6,17], publikováno nebylo.
Dvojitá erytrocytaferéza je považována řadou autorů za bezpečnou při suplementaci preparáty železa jako prevence možné sideropenie [9,38]. Pokles feritinu u erytrocytaferéz je srovnatelný s běžným dárcovstvím plné krve, u nějž je běžně doporučována preventivní suplementace Fe. Je třeba zdůraznit nutnost pečlivého hodnocení zdravotního stavu dárců MKO, zejména deficitu železa, aby nebyla přehlédnuta závažná choroba [26,41,42]. Komplexní dlouhodobé sledování zdravotního stavu dárců MKO není publikováno.
U odběrů plné krve upozorňuje Gemmell na možnou prokoagulační aktivaci stykem krve s odběrovým materiálem – byla nalezena zvýšená hladina annexinu V a P-selektinu [11]. Při aferetických odběrech dochází k dlouhotrvajícímu kontaktu s odběrovým materiálem, analogicky tedy lze podobnou aktivaci buněk předpokládat. U běžné trombocytaferézy byly sledovány vlastnosti neutrofilů navracených dárci a hladina aktivovaného komplementu C3a a C5a, která změněna nebyla. Lehké zvýšení hodnot CD 11 bylo zaznamenáno u 3 typů separátorů, stejně jako tendence ke zvýšení fagocytární aktivity [47]. U multikomponentních odběrů tento možný vliv na dárce sledován nebyl, stejně jako nebyl studován možný vliv dlouhodobého kontaktu krve s odběrovým materiálem při aferéze na krevní buňky a aktivita buněk navracených dárci krve.
Kvalita transfuzních přípravků
U multikomponentních odběrů byla provedena řada studií hodnotících jakost získaných přípravků. Řadou autorů byly hodnoceny základní parametry jakosti TP jako obsah účinné látky a buněčná kontaminace dle Doporučení Rady Evropy [20], dále markery vitality buněk (u erytrocytů: pH, K+, Na+, glukóza, laktát, elastáza, volný hemoglobin, ATP a 2,3 DPG v supernatantu, u trombocytů: pH, pO2, pCO2, glukóza, laktát, LDH). Annexin V jako marker apoptózy [30,31,37] byl hodnocen zejména u trombocytů [20], při současném stanovení K+ a volného hemoglobinu je vhodným markerem buněčného poškození i u erytrocytů [35]. Z markerů aktivace buněk byl nejvíce sledován solubilní P-selektin CD 62-P u trombocytů [18,23,24]. Cytokiny (IL-1-β, IL-6, IL-8, RANTES a další), které lze při stanovení v optimální kombinaci považovat za optimální indikátor čistoty transfuzního přípravku, zvláště v souvislosti s následnými nehemolytickými febrilními potransfuzními reakcemi [36], byly stanovovány u trombocytů.
Uvedené, ale i další parametry jakosti TP získaných technikou MKO v různých kombinacích byly sledovány na začátku, v průběhu skladování, resp. na konci exspirace produktu a byly srovnatelné s TP z plné krve [28,48], dle některých autorů i vyšší jakosti [26].
Pro erytrocytaferézu je charakteristická vysoce standardizovaná transfuzní jednotka [26] s nízkou variabilitou ve srovnání s erytrocyty z plné krve. Objem TU erytrocytů chudých na leukocyty, resuspendovaných v roztoku SAGM, resp. AS-3, kolísal v rozmezí 10 ml oproti asi 60 ml u erytrocytů z plné krve [8,16], obsah Hb v TU se pohyboval v rozmezí asi 5 g oproti 69 g u erytrocytů z plné krve [27]. Buněčná kontaminace přípravků splňovala doporučení Rady Evropy [28]. Stupeň hemolýzy erytrocytů na konci skladování byl u RBC z MKO srovnatelný nebo nižší než u RBC z plné krve: u separátoru Haemonetics MCS+ 0,61 % [27], 0,3 % [26], 0,1% ± 0,03 [23], u přístroje TRIMA 0,5 ± 0,2 % [8], u separátoru Amicus byl stupeň hemolýzy menší než 0,8 % [28]. S obsahem volného hemoglobinu korespondující hladina kalia byla u obou typů erytrocytů srovnatelná do 28. dne skladování, ale u přípravků z aferézy od 28. dne stoupala pomaleji a na konci exspirace byla nižší [23]. Předpokládá se, že postupné a kontrolované přidávání antikoagulans snižuje poškození membrány erytrocytu [23] a má pozitivní vliv na kvalitu produktu [26]. Obsah 2,3 DPG a pH byly vyšší [16], konsumpce ATP a glukózy a akumulace laktátu byla stejná jako v erytrocytech z PK v den skladování 0 i 42 [26]. Annexin V u erytrocytů z aferézy studován nebyl. Při porovnávání přežívání in vivo RBC z MKO a plné krve nebyl prokázán signifikantní rozdíl [34].
Trombocyty získané metodou MKO splňovaly dle uvedených prací stanovená kritéria výtěžnosti. Porovnání tzv. „destičkových lézí“ popisuje rozdíly nejen mezi aferetickými přípravky a přípravky z plné krve, ale i mezi produkty z různých typů separátorů a trombocyty z plné krve navzájem. Plazmatické hladiny annexinu V a solubilního P-selektinu v den odběru byly stejné u deleukotizovaných trombocytů z 3 typů separátorů i u trombocytů získaných z buffy coatu, následně deleukotizovaných. 5. den skladování byly hodnoty solubilního P-selektinu progresivně zvýšeny u trombocytů z buffy coatu, u trombocytů z aferézy bylo zvýšení nejvyšší u separátoru Amicus, následně Cobe Spectra a nejméně u přístroje Haemonetics MCS+ [21]. Trombocyty z MKO vykazovaly na začátku skladování nižší expresi solubilního P-selektinu a tedy nižší stupeň aktivace než trombocyty z jednoduché aferézy. V průběhu skladování se však hodnoty P-selektinu obrátily a u trombocytů z MKO byly vyšší, což může být v souvislosti s delší centrifugací a jejím vlivem na trombocyty u MKO [23]. Různé hladiny solubilního P-selektinu u různých odběrových separátorových souprav a protokolů souvisí s vlivem technologie na stav buněk při aferéze [23,40], podobný je vliv použitého typu deleukotizačního filtru u trombocytů z plné krve [19] nejen na aktivaci buněk, ale i na obsah cytokinů v TP. Při porovnání hladin cytokinů u TP ze separátorů Cobe Spectra LRS a Haemonetics MCS+ byla počáteční hladina IL-6 u MCS+ nižší než u přístroje Spectra, v průběhu skladování se však zvyšovala, zatímco u přístroje Spectra LRS byla standardní, hladina IL-8 byla u MCS+ nižší v průběhu celého skladování. Hladiny tzv. „platelet derived“ cytokinů (RANTES, PF-4, β-TG a TGF-β) stoupaly během skladování u obou typů produktů [46]. Na obsah cytokinů v přípravcích má vliv nejen technologie zpracování, jak již bylo uvedeno, ale i způsob samotného odběru krve, stupeň leukocytární kontaminace přípravku a dodatečné procesy, jako filtrace produktu, které mohou mít vliv na aktivaci trombocytů a způsobit generaci cytokinů z trombocytů [37]. Z uvedeného vyplývá složitost a náročnost vzájemného posouzení parametrů aktivace jednotlivých typů produktů, v řadě prací je také naznačena nutnost dalších studií.
Pro širší uplatnění metody v běžné praxi je velmi důležitá její ekonomická náročnost, která závisí na použitém protokolu, typu přístroje a množství vyráběných přípravků. V budoucnu lze předpokládat její větší implementaci v praxi vzhledem k pravděpodobnému poklesu cen spotřebního materiálu a zvýšení ceny lidské práce, její širší uplatnění na konkrétním pracovišti může být zvažováno i při plánované modernizaci techniky na zpracování plné krve [26].
Závěr
V současné době je metoda multikomponentních odběrů moderní a relativně bezpečnou alternativou odběrů dárců krve, která si již našla své místo na transfuzních pracovištích i v povědomí transfuzní veřejnosti. Jsou stanoveny základní mantinely pro její provozování, výběrová kritéria pro dárce krve však dosud nejsou sjednocena. Je publikována řada literárních prací, zaměřených na sledování jakosti produktů, zejména výtěžnosti ve vztahu k vstupním parametrům dárce krve. Neúplné jsou informace o poškození, resp. aktivaci buněk tímto typem odběrů jak v produktech, tak u buněk navracených dárci krve a procesech, které k němu vedou. Sledování zdravotního stavu dárce je publikováno ojediněle, převažuje zaměření prací na „hematologickou recovery“ při dvojitých odběrech erytrocytů, dlouhodobé sledování zdravotního stavu dárce chybí. Metoda je však intenzivně studována a v budoucnu lze očekávat upřesnění výběrových kriterií pro dárce jednotlivých typů MKO, stejně jako podrobnější zhodnocení jakosti přípravků.
Práce vznikla za podpory grantu IGA MZČR č. NR/8015-3.
MUDr. Renata Procházková
www.nemlib.cz
e-mail: renata.prochazkova@nemlib.cz
Doručeno do redakce: 26. 3. 2004
Přijato po recenzi: 6. 5. 2004
Zdroje
1. Adam Z, Vorlíček J, Koptíková J. Obecná onkologie a podpůrná léčba. Praha: Grada 2003.
2. Bandarenko N. The selection and care of multiple component apheresis donors: a medical perspective. Annual meeting AABB Symposium: Orlando, USA 2002.
3. Bláha M, Turek P, Gašová Z et al. Hemaferéza v České republice. Vnitř Lék 2003; 49(2): 153–154.
4. Bláha M et al. Rizika hemaferéz. Hematologie a transfuziologie 1992; 4 : 33–42.
5. Blanco L. Tailored collection of multicomponent by apheresis. Transfus Apher Sci 2002; 27(2): 123–127.
6. Bolan CD, Greer SE, Cecco SA et al. Comprehensive analysis of citrat effects during platepheresis in normal donors. Transfusion 2001; 41(9): 1165–1171.
7. Čermák J, Brabec V. Klinický význam vyšetření hladiny cirkulujících transferinových receptorů v séru. Vnitř Lék 1999; 8 : 468–472.
8. Elfath MD, Whitley P, Jacobson MS et al. Evaluation of an automated systém for the collection of packed RBCs, platelets, and plazma. Transfusion 2000; 40(10): 1214–1222.
9. Furuta M, Shimizu T, Mizuno S et al. Clinical evaluation of repeat apheresis donors in Japan. Vox Sanq 1999; 77(1): 17–23.
10. Gable RG, Edwards RL. The use of platelet concentrates versus platepheresis – the donor perspective. Transfusion 2001; 41 : 727–729.
11. Gemmell C. Activation of platelets by in vitro whole blood contact with materials: Increases in microparticle, procoagulant activity and soluble P-selectin blood levels. J Biomater Sci Polym Ed 2001; 12(8): 933–943.
12. Goodnough LT, Shander A, Brecher ME. Transfusion medicine: looking to the future. Lancet 2003; 361(9352): 161–188.
13. Guide to the preparation, use and quality assurance of blood components.9th ed. Strasburg: Council of Europe Publishing 2003.
14. Hocker P. Red cell apheresis in autologous preoperative blood donation. Transf Apher Sci 2001; 24(1): 75–78.
15. Hogler W, Mayer W, Messmer C et al. Prolonged iron depletion after allogenetic 2-unit apheresis. Transfusion 2001; 41(5): 602–605.
16. Holme S, Elfath MD, Whitley P. Evaluation of in vivo and in vitro quality of apheresis collected RBC stored for 42 days. Vox Sanq 1998; 75(3): 212–217.
17. Chrobák L. Mikrocytární a hypochromní anémie. Vnitř Lék 2001; 47(3): 166–174.
18. Koubek K. CD nomenklatura leukocytárních antigenů. Vnitř Lék 2003; 49(1): 66–72.
19. Krailadsiri P, Seghatchian J, Williamson LM. Platelet storage lession of WBC-reduced, pooled buffy coat-derived platelet concentrates prepared in three in-process filter/storage bag combinations. Transfusion 2001; 41(2): 243–250.
20. Krailadsiri P, Seghatchian J. Effect of processing and storage on platelet activation, cellular injury and microvesiculation. Transf Apher Sci 2001; 24(3): 237–238.
21. Krailadsiri, P., Seghatchian, J.: Are all leucodepleted platelet concentrates equivalent? Comparison of Cobe LRS Turbo, Haemonetics MCS+ LD, and filtered pooled buffy-coat-derived platelets. Vox Sanq 2000; 78(3): 171–175.
22. Kubešová H, Krahulcová E, Kiss I et al. Substituce krevními deriváty v období dřeňové aplázie u nemocných po agresivní chemoterapii zhoubných hematologických onemocnění. Vnitř Lék 1993; 39(5): 430–436.
23. Leitner GC, Stohlawetz PJ, Stiegler PJ et al. Quality of packed red blood cells and platelet concentrates by multicomponent collection using the MCS Plus device. J Clin Apheresis 2003; 18(1): 21–25.
24. Loudová M, Krejsek J, Kopecký O et al. Cytoimunofluorometrie a její využití v detekci aktivované destičky. Vnitř Lék 2001; 47(3): 175–180.
25. Makar YF, Butler MO, Cockersole GM et al. National audit of citrate toxicity in plateletpheresis donors. Transfus Med 2002; 12(3): 187–191.
26. Matthes GA. Options and cost effectiveness of multicomponent blood collection. Transf Apher Sci 2002; 27(2): 115–121.
27. Moog R, Bartsch R, Muller N. Concurent collection of in–line filtered platelets and red cells by apheresis. Ann Hematol 2002; 81(6): 322–325.
28. Moog R, Franck V, Pierce JA et al. Evaluation of a concurrent multicomponent collection system for the collection and storage of WBC – reduced RBC apheresis concentrates. Transfusion 2001; 41(9): 1159–1164.
29. Moore SB, Winters JL. Multiple blood donations and iron deficiency in patients with Restless legs syndrome. Mayo Clin Proc 2003; 78(5): 654–656.
30. Novosad J, Kodydková K, Krejsek J. Apoptóza, její mechanizmy a medicínský význam. I. Definice apoptózy a její průběh na buněčné úrovni. Vnitř Lék 2001; 47(6): 381–386.
31. Novosad J, Kodydková K, Krejsek J. Apoptóza, její mechanizmy a medicínský význam. II. Poruchy regulace apoptózy a jejich souvislost s rozvojem onemocnění. Vnitř Lék 2001; 47(6): 387–390.
32. Quendro I, Moog R, Muller N. A questionainre: will plateletpheresis donors accept multicomponent donation? Transfus Apher Sci 2002; 27(2): 95–99.
33. Recommendations for collecting red blood cells by automated apheresis methods. FDA Draft Guidance for Industry (Docket Number 98D–0545). Rockville, MD: FDA July 1998.
34. Regan F, Teesdale P, Garner S et al. Comparsion of in vivo red cell survival of donations collected by Haemonetics MCS versus conventional collection. Transfus Med 1997; 7(1): 25–28.
35. Seghatchian J, Krailadsiri P. Red cell storage lesion assesed by the levels of potassium, hemoglobin and annexin V in supernatantant. Transfus Apher Sci 2002; 26(2): 121–127.
36. Seghatchian J, Krailadsiri P, Dilger P et al. Cytokines as quality indicators of leucoreduced red cell concentrates. Transfus Apher Sci 2002; 26(1): 43–46.
37. Seghatchian MJ, Wadhwa M, Thorpe R. Cytokines in Platelet Concentrates: A Comparsion of Apheresis Platelet (Haemonetics) and Filtered and Unfiltered Pooled Buffy – Coat Derived Platelet Concentrates. Transfus Sci 1997; 18(1): 103–107.
38. Shi PA, Ness PM. Two–unit red cell apheresis and int potential advatages over traditional whole–blood donation. Transfusion 1999; 39(2): 218–225.
39. Silberman S. Platelets: preparations, transfusion modifications and substitutes. Arch Pathol Lab Med 1999; 123(10): 889–894.
40. Stohlawetz PO, Hergovich N, Stiegler G et al. Differential induction of P selectin on platelets by two cell separators during platepheresis and the effect on the release of soluble P–selectin. Transfusion 1998; 38(3): 24–30.
41. Straub J, Kolešková E, Haber J. Sideropenická anémie jako projev selektivní malabsopce železa. Vnitř Lék 2001; 47(7): 493–495.
42. Ščudla V, Adam Z, Ščudlová M. Současné možnosti diagnostiky a léčby anémie chronických chorob. Vnitř Lék 2001; 47(6): 400–406.
43. Tzima E, Walker JH. Platelet annexin V: the ins and outs. Platelets 2000; 11 : 245–251
44. Valbonesi M, Bruni R, Bo A et al. Double platepheresis (DPA) and tailored RBC collection with the Excel-Pro: preliminary results. Transf Apher Sci 2001; 24(1): 71–73.
45. Vášová I, Mayer J. Biologické účinky alogenních leukocytů a deleukotizace buněčných krevních derivátů. Vnitř Lék 1995; 41(10): 713–718.
46. Wadhwa M, Seghatchian MJ, Dilger P et al. Cytokines in WBC–reduced apheresis PCs during storage: a comparsion of two WBC-reduction methods. Transfusion 2000; 40(9): 1118–1126.
47. Western KH, Videm V. Donor neutrophil function after plateletpheresis. Transfusion 2000; 40(11): 1414–1418.
48. Zeiler TA, Kretschmer V. Automated blood component collection with the MCS 3p cell separator: evaluation of three protocols for buffy coat-poor and white cellreduced packed red cells and plazma. Transfusion 1997; 37(8): 791–797.
49. Zingsem J, Weisbach V, Zimmermann R et al. Preparation of FFP as byproduct of plateletpheresis. Transfusion 2001; 42(1): 81–86.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2005 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Předpokládané náklady na terapii diabetes mellitus a jeho pozdních komplikací v ČR
- Diabetické srdce či srdce diabetika?
- Multikomponentní automatizované odběry – nový trend v dárcovství krve
- Od odběrů plné krve k multikomponentnímu dárcovství
- Problematika hyperfosfatemie a jejích důsledků pro pacienty léčené dialýzou pro chronické selhání ledvin
- Železo v organizmu – nutný pomocník a skrytý nepřítel. Jaký význam mají nové poznatky o metabolizmu železa pro klinika
- Současná infekce viry hepatitidy B a C – terapeutický problém nejen u starších pacientů
- Kuřácké návyky lékařů a lékařek v porovnání s kouřením v populaci ČR. Porovnání se stavem v roce 1991
- Chronická kritická končetinová ischemie: distální revaskularizace vs distální revaskularizace s volným svalovým přenosem
- Příčiny akutních intoxikací v průběhu jednoho roku na jednotce intenzivní metabolické péče
- Předpokládané náklady na terapii diabetes mellitus a jeho pozdních komplikací v ČR – předbě
- Diabetická kardiomyopatia
- Multikomponentní automatizované odběry – nový trend v dárcovství krve
- Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin: I. Etiopatogeneze, důsledky a diagnostika
- Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin: II. Léčba
- Nové poznatky o metabolizmu železa
- Léčba starších pacientů s koinfekcí virů hepatitidy B a C
- Úvaha o studiu na lékařské fakultě
- Rostoucí nároky na výuku sociálního lékařství a výuka některých navazujících oborů
- Prof. MUDr. Jiří Widimský, DrSc., FESC, FAHA, člen České lékařské akademie, se dožívá 80 let
- Teplan V, Horáčková M, Bébrová E, Janda J et al. Infekce ledvin a močových cest v dospělém a dětském věku. Praha: Grada 2004. 252 stran. ISBN 80−247−0566−4.
- Hendl J. Přehled statistických metod zpracování dat. Praha: Portál 2004. 584 stran. ISBN 80−7178−820−1.
- Kaňovský P, Bareš M, Dufek J et al. Spasticita, mechanismy, diagnostika, léčba. Praha: Maxdorf 2004. 423 stran. ISBN 80−7345−042−0.
- Rychlíková E. Manuální medicína. 3. ed. Praha: Maxdorf 2004. 530 stran. ISBN 80−7345−010−0.
- Erban J. Dlouhodobá domácí oxygenoterapie. Praha: Maxdorf 2004. 109 stran. ISBN 80−7345−024−0.
- Višňa P, Hoch J et al. Traumatologie dospělých. Příprava ke zkouškám z chirurgických oborů. Praha: Maxdorf 2004. 157 stran. ISBN 80−7345−034−8.
- Mašata J, Jedličková A et al. Infekce v gynekologii a porodnictví. Praha: Maxdorf 2004. 371 stran. ISBN 80−7345−038−0.
- Hronek M. Výživa ženy v období těhotenství a kojení. Praha: Maxdorf 2004. 309 stran. ISBN 80−7345−013−5.
- Oznámení
- Oznámení
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin: I. Etiopatogeneze, důsledky a diagnostika
- Hyperfosfatemie jako závažná komplikace chronické renální insuficience a chronického selhání ledvin: II. Léčba
- Nové poznatky o metabolizmu železa
- Předpokládané náklady na terapii diabetes mellitus a jeho pozdních komplikací v ČR – předbě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




