-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVon Willebrandova choroba – porovnanie dvoch metód analýzy multimérov von Willebrandovho faktora
Von Willebrand disease – comparison of two methods of vWF multimer analysis
Von Willebrand factor (vWF) is a multimeric protein that plays a principal role in two key functions in hemostasis. It participates in the interaction between the platelets and the subendothelium at the site of the vascular damage and if is also important in the interaction between the platelets. vWF is complexed with factor VIII (1 : 1) to protect it from proteolysis by activated Protein C. vWF is a protein that is assembled from identical subunits into linear strings of varying size referred to as multimers. These multimers can be > 20 million daltons in mass and > 2 micrometers in length. Clinically significant and most effective in interacting with collagen and thrombocyte receptors are high molecular weight multimers. In our article we present comparing of two available methods of von Willebrand factor multimer analysis – the classical manual method and the new semi-automatic method of the Hydrasys instrument. The new method uses a prepared 2% agarose gel, the results are available within 6 h, the method is standardized and reproducible. However, abnormalities of multimers must be further investigated in more detail using the classical-manual method with different concentrations of agarose gels.
Keywords:
von Willebrand factor – von Willebrand factor multimers – von Willebrand disease – electorforesis – ADAMTS13
Autoři: I. Škorňová; J. Staško; P. Hollý; M. Dobrotová; T. Šimurda; J. Sokol; J. Žolková; I. Plameňová; P. Kubisz
Působiště autorů: Jesseniova lekárska fakulta v Martine a Univerzitná nemocnica v Martine, Slovenská republika ; Národné centrum hemostázy a trombózy, Klinika hematológie a transfúziológie, Univerzita Komenského v Bratislave
Vyšlo v časopise: Transfuze Hematol. dnes,27, 2021, No. 1, p. 42-50.
Kategorie: Původní práce
doi: https://doi.org/10.48095/cctahd202142Souhrn
Von Willebrandov faktor (vWF) je multimerický proteín, ktorý plní dve kľúčové funkcie v hemostáze. Podieľa sa na interakcii medzi doštičkami a subendotelom v mieste cievneho poškodenia a interakcii medzi doštičkami navzájom. vWF tvorí komplex s faktorom VIII v pomere (1 : 1), čím ho chráni pred proteolýzou aktivovaným proteínom C. vWF je proteín, ktorý je zostavený z identických podjednotiek do lineárnych reťazcov rôznej veľkosti označovaných ako multiméry. Tieto multiméry môžu mať hmotnosť > 20 miliónov daltonov a dĺžku > 2 mikrometre. Klinicky významné a najúčinnejšie pri interakcii s kolagénom a trombocytovými receptormi sú multiméry s vysokou molekulovou hmotnosťou (HMW). V článku uvádzame porovnanie dvoch dostupných metód analýzy multimérov von Willebrandovho faktora – klasickú manuálnu metódu a novú semiautomatickú metódu prístroja Hydrasys. Nová metóda využíva vopred pripravený 2% agarózový gél, výsledky sú dostupné do 6 h, metóda je štandardizovaná a reprodukovateľná. Avšak abnormality multimérov sa musia ďalej podrobnejšie skúmať pomocou klasickej – manuálnej metódy s rôznymi koncentráciami agarózových gélov.
Klíčová slova:
von Willebrandov faktor – multiméry von Willebrandovho faktora – von Willebrandova choroba – elektroforéza –ADAMTS13
ÚVOD
Von Willebrandova choroba (vWCH) je najčastejšie vrodené krvácavé ochorenie, charakterizované kvantitatívnym alebo kvalitatívnym deficitom von Willebrandovho faktora (vWF) [1,2]. vWF je produktom génu pre vWF a jeho transkripcia a translácia sa uskutočňuje v megakaryocytoch a v endotelových bunkách. Osobitou potranslačnou úpravou a glykozyláciou sa tvoria diméry a následne multiméry vWF.
Prítomnosť vWF bola potvrdená v plazme, v endoteli (Weibelove-Paladeho telieska) i v trombocytoch (a granulá). Z endotelových buniek je uvoľňovaný kontinuálne aj indukovane, po stimulácii alebo poškodení endotelu. Na rozdiel od toho z trombocytov je vWF uvoľňovaný len indukovane po ich aktivácii. Po sekrécii do cievneho riečiska podlieha vWF proteolýze metaloproteázou ADAMTS13 [3]. Adhezívna aktivita vWF na poškodený subendotel a následná agregácia krvných doštičiek sprostredkovaná vWF závisí od veľkosti jeho multimérov. Najúčinnejšie pri interakcii s kolagénom a trombocytárnymi receptormi sú multiméry s vysokou molekulovou hmotnosťou (HMW), 5 000–10 000 kDa. Z tohto dôvodu sú tieto HMW multiméry vWF obzvlášť klinicky významné.
Multiméry vWF môžeme v súčasnosti detekovať elektroforetickou separáciou a vizualizáciou priamou imunofixáciou alebo pomocou western blot.
V našom laboratóriu používame na detekciu multimérov vWF manuálnu metódu podľa Enayata et al. a Rugerihho et al. [4,5]. Uvedená metóda trvá 4–5 dní. V súčasnosti je dostupná na trhu aj nová metóda semiautomatizovaným prístrojom Hydrasys. Táto metóda je časovo menej náročnejšia – 6 h a vďaka denzitometrickému vyhodnoteniu s kvantifikáciou píkov je ľahšie interpretovateľná, čo nás viedlo k jej aplikácii do praxe.
Klasifikácia vWCH je podmienená analýzou multimérov vWF.
Klasifikácia vWCH [2]
- typ 1 – parciálny kvantitatívny deficit vWF bez signifikantného zníženia HMW multimérov, dedičnosť autozomálne dominantná
- typ 2 – kvalitatívny deficit vWF, dedičnosť autozomálne dominantná / autozomálne recesívna
- 2A – znížená adhézia trombocytov závislá na vWF spojená s chýbaním HMW, event. aj multimérov so strednou molekulovou hmotnosťou (IMW)
- 2B – zvýšená afinita vWF k doštičkovému glykoproteínu Ib (GPIb)
- 2M – znížená adhézia trombocytov závislá na vWF, nespôsobená selektívnym chýbaním HMW multimérov
- 2N – znížená afinita vWF k faktoru VIII (FVIII)
- typ 3 – kvantitatívny deficit vWF (takmer) úplné chýbanie vWF, dedičnosť autozomálne recesívna
Získaný von Willebrandov syndróm
Pri získanej forme vWCH dochádza sekundárne k deficitu vWF z rôznych príčin [6]:
- protilátky proti vWF (pri lymfoproliferatívnych ochoreniach a monoklonových gamapatiách) [7];
- imunoadsorpcia komplexu FVIII/vWF na malígne bunky, alebo trombocyty (pri myeloproliferatívnych ochoreniach) [6];
- zvýšená proteolýza komplexu FVIII/vWF (pri akútnej leukémii, pri paraproteinémii IgMλ);
- znížená produkcia vWF pri hypotyreóze;
- zvýšená spotreba vWF v cirkulácii. Pri vysokých šmykových rýchlostiach v aterosklerotických arteriolách dochádza k ireverzibilnej interakcii medzi HMW multimérmi vWF a trombocytmi a k odstráneniu komplexu vWF/trombocyty z cirkulácie a tiež strate HMW multimérov vWF.
Doštičkový typ von Willebrandovej choroby
Ide o trombocytopatiu, ktorá môže imitovať vWCH typ 2B. Je spôsobená defektom doštičkového receptora GPIb, ktorý má zvýšenú afinitu pre vWF. V dôsledku toho chýbajú HMW multiméry vWF v plazme. Dochádza tak ku agregácii trombocytov po pridaní koncentrátu vWF k plazme pacienta bohatej na trombocyty bez pridania ristocetínu, zatiaľ čo u typu 2B bez ristocetínu k agregácii nedôjde [8].
Klinický obraz
vWCH sa môže klinicky prejaviť slizničným krvácaním (epistaxy, u žien menoragie, krvácanie do tráviaceho traktu). Ďalším príznakom môže byť krvácanie pri poranení a perioperačne, u ťažkých foriem ide aj o krvácanie do kĺbov a svalov.
Laboratórna diagnostika
V laboratórnej diagnostike vWCH sa používa množstvo rôznych testov [9–11]. Prakticky všetky laboratória vykonávajú najprv skríningové testy ako je aktivovaný parciálny tromboplastínový čas (APTT), krvný obraz a čas krvácania podľa Duka, príp. podľa Ivyho. V súčasnosti sa používa aj rýchly skríningový test pomocou analyzátora funkcie doštičiek – Platelet Function Assay (PFA). Cieľom skríningových testov je určiť pacientov s vysokou pravdepodobnosťou vWCH.
Pomocou špecifických testov stanovujeme funkčnú aktivitu vWF, plazmatickú koncentráciu vWF: Ag, plazmatickú aktivitu faktora VIII, aktivitu väzby vWF na kolagén. Výhodou testu aktivity väzby vWF na kolagén je spoľahlivejšia pre diagnostiku kvalitatívneho defektu vWCH, hlavne typu 2A a 2B vWCH. Pomer vWF: CBA / vWF: Ag je pri type 2 vWCH < 0,5–0,7 u ostatných typov vWCH a aj v normálnej plazme je jeho hodnota okolo 1,0 (obr. 1) [12,13]. Rozsah referenčných hodnôt antigénu a funkčnej aktivity si musí určiť každé laboratórium. Koncentrácia vWF je v plazme u ľudí s krvnou skupinou 0 priemerne o 25 % nižšia v porovnaní so skupinami non-0. Koncentrácia vWF sa zvyšuje s vekom, po fyzickej záťaži, traume, v tehotenstve, pri infekciách, nádoroch, ateroskleróze. Koncentráciu vWF zvyšuje aj hormonálna antikoncepcia.
Obr. 1. Schéma zjednodušeného diagnostického algoritmu von Willebrandovej choroby, upravené podľa [12,13]. ![Schéma zjednodušeného diagnostického algoritmu von Willebrandovej
choroby, upravené podľa [12,13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/5086955f3707e81dfec4641a5ec75913.png)
V ďalšom kroku laboratórnej diagnostiky pristupujeme k diskriminačným testom, ktoré slúžia na určenie jednotlivých typov. Patrí tu test ristocetínom indukovanej agregácie trombocytov (RIPA), ktorý má význam pri diagnostike typu 2B vWCH, kde je zvýšená agregabilita doštičiek už pri koncentrácii ristocetínu 0,3–0,5 mg/ml. Metóda stanovenia väzbovej kapacity vWF ku FVIII je nevyhnutná pre stanovenie 2N vWCH. K diskriminačným testom patrí aj analýza multimérov vWF (obr. 1).
Meranie propeptidu von Willebrandovho faktora je dôležitým nástrojom na určenie typu deficitu vWF, najmä pri diferenciálnej diagnostike kvantitatívnych deficitov vWF ťažšieho stupňa (odlíšenie ťažkej formy vWCH typ 1 od vWCH typ 3). Molekulárno-genetické vyšetrenie má význam v prenatálnej diagnostike a u typov 2 a 3 vWCH.
Analýza multimérov vWF
Parciálny kvantitatívny defekt vWF, úplný deficit vWF, alebo kvalitatívny defekt môžeme stanoviť pomocou elektroforetického stanovenia multimérov vWF na SDS-agarózovom géle. Analýzu multimérov vWF je možné vykonávať:
manuálne s vlastnou prípravou agarózového gélu. Po elektroforetickej separácii (obr. 2) a inkubácii v primárnej protilátke a následne v sekundárnej protilátke môžeme vizualizovať multiméry vWF pomocou napr. alkalickej fosfatázy (AP), peroxidázy, biotínu [14,15];
Obr. 2. Elektroforetická zostava pre manuálnu metódu (vlastné údaje). 
pomocou poloautomatického prístroja „Hydrasys“ (obr. 3) s použitím „Hydragel 5 von Willebrand Factor Multimer“ testu. Denzitometrické grafy je možné získať skenovaním gélov pomocou Hydrasys 2 Scan, tento systém zabezpečuje meranie optickej hustoty s vysokým rozlíšením a presnou kvantifikáciou frakcií. Intenzita píkov priamo koreluje s koncentráciou multiméru [16].
Obr. 3. Poloautomatický prístroj „Hydrasys“ (vlastné údaje). 
CIEĽ PRÁCE
Naším cieľom bolo porovnať dve dostupné metódy analýzy multimérov von Willebrandovho faktora.
1. Manuálnu metódu
2. Metódu poloautomatickým prístrojom „Hydrasys“ s použitím „Hydragel 5 von Willebrand Factor Multimer“ testu.
METODIKA PRÁCE
V našom sledovanom súbore sme mali 12 pacientov (3 mužov a 9 žien), vo veku 1 roka – 70 rokov, ktorí boli vyšetrení v ambulancii Národného centra trombózy a hemostázy v Martine. Na základe klinických prejavov, prípadne rodinnej anamnézy na vWCH im bola vykonaná laboratórna diagnostika pre vWCH.
Odber venóznej krvi bol do 3,2 % (0,109 M) citrónanu sodného. Centrifugáciou pri 1 500–2 000 g 20 min sme separovanú plazmu priamo analyzovali, respektíve uskladnili pri –80 °C. Plazmu zdravého darcu sme použili ako kontrolnú vzorku.
Pacientom a aj kontrolnej skupine bola odobraná krv na základe ich podpísaného informovaného súhlasu.
V našej štúdii sme každú vzorku porovnali s kontrolou (plazmou s normálnou distribúciou multimérov). Kontrolnú vzorku sme aplikovali do každého gélu pri manuálnej i semiautomatizovanej metóde.
Pri in vitro analýze pomocou gélovej imunoelektroforézy je možné vizualizovať zo vzorky plazmy jednotlivé multiméry vo forme jasne oddelených prúžkov.
V závislosti od použitej metodiky a vzorky je možné vizualizovať 1 020 multimérov.
1. Pri manuálnej analýze multimérov vWF sme použili práce Enayata et al. a Ruggeriho et al. [4,5]. Vzorky pacientov sme riedili vzorkovým roztokom v pomere 1 : 2, 1 : 10 (až 1 : 100) v závislosti od ich koncentrácie vWF. Roztok na riedenie vzoriek sme pripravili zo základného roztoku s pH = 8 (TRIS, Chelatón a SDS), pridaním urey a bromfenolu. Nariedené vzorky sme inkubovali pri 60 °C/30 min. Takto pripravenú plazmu v objeme 20 µl sme dávkovali do vyrezaných jamiek gélu.
Separáciu multimérov sme uskutočnili na štartovacom géli s koncentráciou agarózy 0,8 % a separačnom géli s koncentráciou agarózy 1,5 % [17]. Samotná elektroforetická zostava pozostávala z niekoľkých častí: Multiphor II Electrophoresis System, EPS 3501XL Power Supply, Multitemp III-Termostatic Circulator, Švédsko (obr. 2). Na elektroforézu sme použili elektroforetický pufer (TRIS, Glycín a SDS) s pH = 8,35. Zapli sme elektroforézu na 30 mA (230 V) v trvaní cca 30–60 min. Po vycestovaní vzorky z jamky sme zaliali jamky gélom a zredukovali prúd na 5 mA. Po ukončení elektroforézy cca po 20–24 h sme gél niekoľkokrát premyli destilovanou vodou a nechali cez noc v primárnej protilátke (rabbit anti-human vWF; DAKO). Po premývaní s roztokom TBS + 0,05% Tween v priebehu 6–8 h sme gél vložili na noc do sekundárnej protilátky značenej enzýmom (swine anti-rabbit/AP; DAKO) (obr. 4). Po premývaní s roztokom TBS + 0,05 % Tween sme gél vložili približne do 20 ml roztoku z kitu „25× Alkaline Phosphatase colour“ (Alkaline phosphatase conjugate kit Biorad), ktorý sme pripravili pridaním 800 µl 25× AP roztoku do 20 ml destilovanej vody a do tohto roztoku sme postupne pridali 200 µl roztoku A a 200 µl roztoku B (roztok A a B, boli súčasťou kitu). Gél s pripraveným roztokom sme jemne miešali do vytvorenia relevantného zobrazenia multimérov. Reakciu sme ukončili vložením gélu do vody [17].
Obr. 4. Princíp stanovenia multimérov vWF manuálnou (IgG-alkaline phosphatase) a poloautomatickou metódou (IgG-peroxidase). 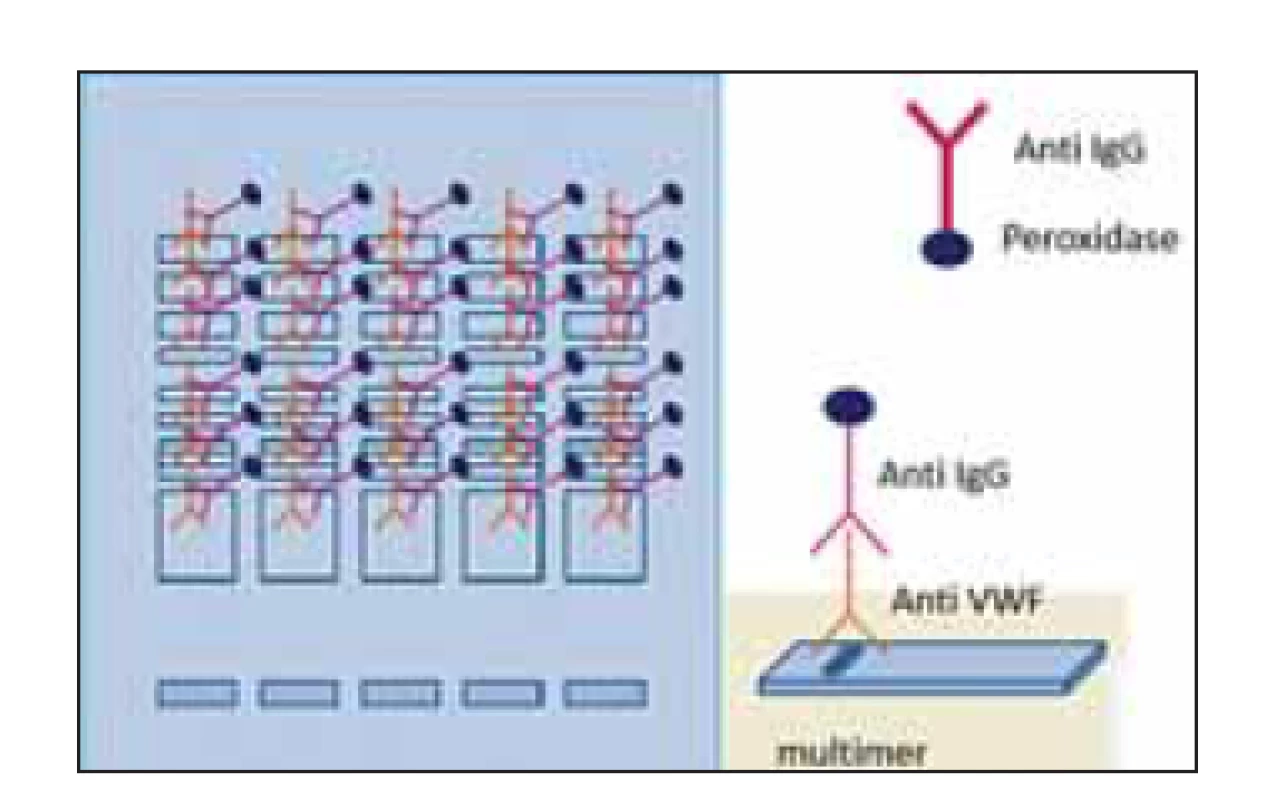
Prítomnosť multimérov pri manuálnej metóde sme identifikovali vizuálne, arbitrárnym spôsobom, najčastejšie používanou klasifikáciou, prvých 5 najrýchlejšie migrujúcich multimérov na anódovom konci gélu sme zhodnotili ako multiméry s nízkou molekulovou hmotnosťou, ďalších 5 za multiméry so strednou molekulovou hmotnosťou a všetky ostatné za multiméry s vysokou molekulovou hmotnosťou.
2. Metóda poloautomatickým prístrojom „Hydrasys“ – výrobca Sebia (obr. 3) spočíva v separácii proteínov prostredníctvom inovatívnych elektroforéznych systémov. Testovacia súprava Hydragel 5 von Willebrand multimers (výrobca Sebia), ktorú sme použili, je určená na analýzu distribúcie multimérov vWF v ľudskej plazme pomocou elektroforézy s použitím vopred vytvorených 2% agarózových gélov, priamej imunofixácie, vizualizácie s protilátkou značenou peroxidázou a denzitometrie. Vzorku sme riedili riediacim roztokom v pomere, ktorý závisí od koncentrácie vWF (< 20 % vWF: riedenie 1/4; 20–150 % vWF: riedenie 1/6; 150–300 % vWF: riedenie 1/10; > 300 % vWF: riedenie 1/20). Nariedenú vzorku a kontrolnú plazmu sme aplikovali do jamiek v géli a zapli sme elektroforézu. Plazmatické proteíny boli oddelené podľa molekulovej hmotnosti v neutrálnom tlmivom roztoku obsahujúcom aniónový detergent a imunoprecipitované špecifickým antisérom anti-von Willebrandovým faktorom. Multiméry vWF sa potom vizualizovali v géli s peroxidázou značenou protilátkou a špecifickým substrátom (anti-IgG – PER) (obr. 4). Gély s analyzovanou vzorkou sme skenovali na Hydrasys 2 Scan a denzitometricky vyhodnotili a kvantifikovali vzhľadom ku kontrole. Denzitometrické zobrazenie píkov sme hodnotili podľa odporúčania výrobcu v smere zľava doprava, pričom píky 1–3 sú LMW, píky 4–7 sú IMW a všetky ostatné píky tvoria HMW (obr. 5–7) [18,19]. Na kvantifikáciu multimérov LMW, IMW a HMW sme použili softvér Phoresis (Sebia) [20].
VÝSLEDKY
Každý gél získaný klasickou manuálnou metódou sme samostatne vizuálne kvalitatívne vyhodnotili porovnaním s kontrolou.
Farebné gély s multimérmi z poloautomatického prístroja sme vizuálne skontrolovali a naskenovali pomocou softvéru Phoresis. Denzitometrický graf každej vzorky sme kvalitatívne a aj kvantitatívne vyhodnotili v porovnaní s kontrolnou vzorkou získanou na rovnakom géli.
Manuálna metóda
obrázok č. 5:
Obr. 5. Analýza multimérov vWF vzoriek č. 1–4 a kontroly. (A) Klasická – manuálna metóda; (B) poloautomatickým prístrojom Hydrasys; (C) denzitometrické vyhodnotenie. 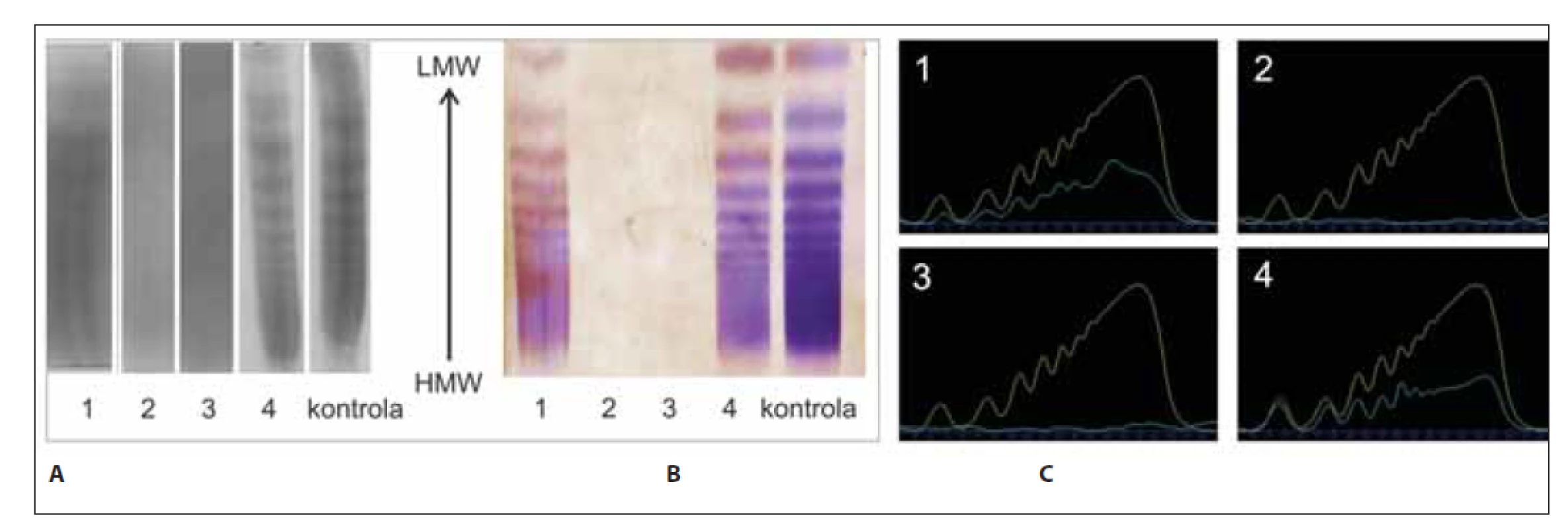
- vzorka č. 1 mala v porovnaní s kontrolou detekovaných prvých 5 multimérov LMW, ďalších 5 multimérov IMW a všetky ostatné viditeľné boli HMW. Multiméry boli v porovnaní s kontrolou slabšie zafarbené;
- vzorky č. 2 a č. 3 v porovnaní s kontrolou nemajú detekovateľné žiadne multiméry;
- vzorka č. 4 v porovnaní s kontrolou nemá jasne zobrazenú multimérnu štruktúru, vhodné opakovať analýzu s vyššou koncentráciou agarózy na potvrdenie možného typu 2M.
obrázok č. 6:
Obr. 6. Analýza multimérov vWF vzoriek č. 5–6 a kontroly. (A) klasická – manuálna metóda, (B) poloautomatickým prístrojom Hydrasys, (C) denzitometrické vyhodnotenie. 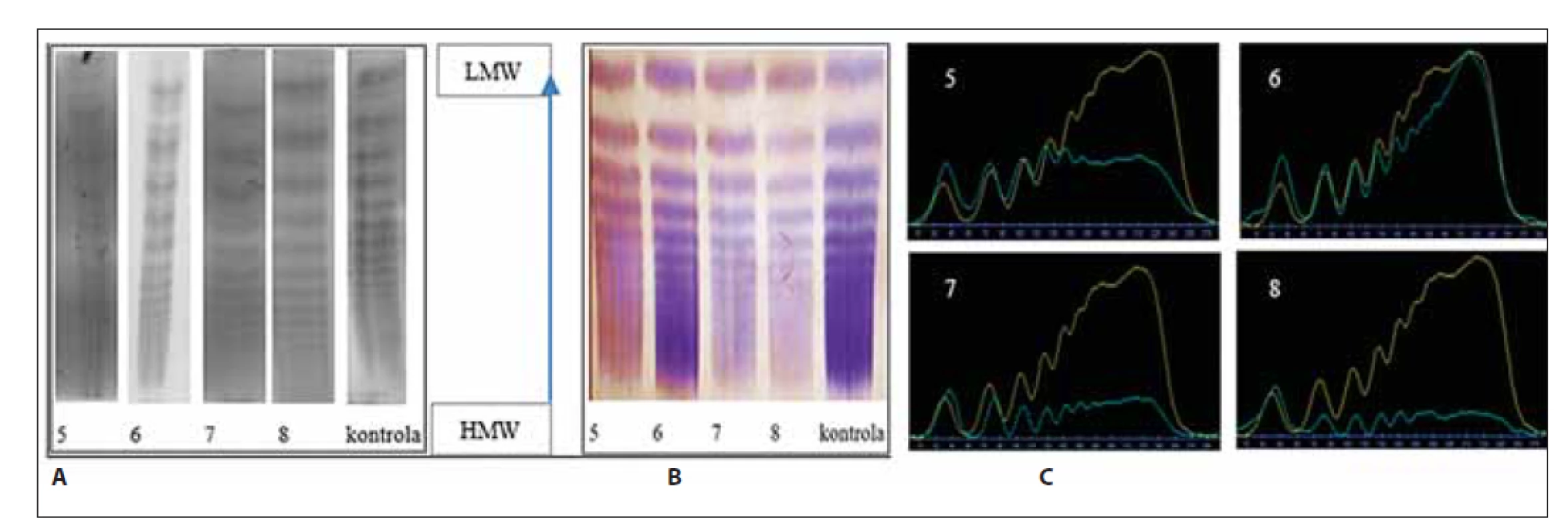
- vo vzorkách č. 5 a č. 6 v porovnaní s kontrolou je zobrazených zhora prvých 5 LMW multimérov, ďalších 5 IMW multimérov a ostatných HMW;
- vo vzorkách č. 7 a č. 8 chýbajú HMW multiméry.
- obrázok č. 7:
- u vzoriek č. 9 a č. 10 v porovnaní s kontrolou nie sú detekovateľné multiméry IMW a HMW;
- vo vzorke č. 11 je normálna distribúcia multimérov;
- vo vzorke č. 12 je distribúcia všetkých multimérov mierne znížená oproti kontrole.
Poloautomatická metóda
Normálne hodnoty pre kontrolnú vzorku boli prevzaté podľa odporúčania výrobcu: LMW 12–15 %, IMW 22–35 %, HMW 47–70 %.
obrázok č. 5:
- vo vzorke č. 1 boli detekované multiméry: LMW 10 %, IMW 15 %, HMW 24 %, vzorka vykazovala parciálny deficit multimérov;
- vzorky č. 2 (LMW 4 %, IMW 2 %, HMW 0 %) a č. 3 (LMW 3,3 %, IMW 1 %, HMW 3 %) vykazovali absenciu multimérov;
- vo vzorke č. 4 boli detekované multiméry: LMW 17,4 %, IMW 17,5 %, HMW 27 %, opakovať analýzu manuálnou metódou s vyššou koncentráciou agarózy na potvrdenie možného typu 2M.
obrázok č. 6:
- vo vzorke č. 5 boli detekované multiméry: LMW 28 %, IMW 25 %, HMW 26 %, vzorka vykazovala parciálny deficit HMW multimérov;
- vo vzorke č. 6 boli detekované multiméry: LMW 20 %, IMW 25 %, HMW 45 %, nutné dodiagnostikovať vWF: FVIII pre potvrdenie, príp. vylúčenie vWCH typ 2N;
- vo vzorke č. 7 boli detekované multiméry: LMW 13 %, IMW 10 %, IMW 14 %, vzorka vykazovala deficit IMW a HMW multimérov;
- vo vzorke č. 8 boli detekované multiméry: LMW 12 %, IMW 7 %, HMW 8 %, vzorka vykazovala deficit IMW a HMW multimérov.
obrázok č. 7:
Obr. 7. Analýza multimérov vWF vzoriek č. 9–12 a kontroly. (A) klasická – manuálna metóda, (B) poloautomatickým prístrojom Hydrasys, (C) denzitometrické vyhodnotenie. 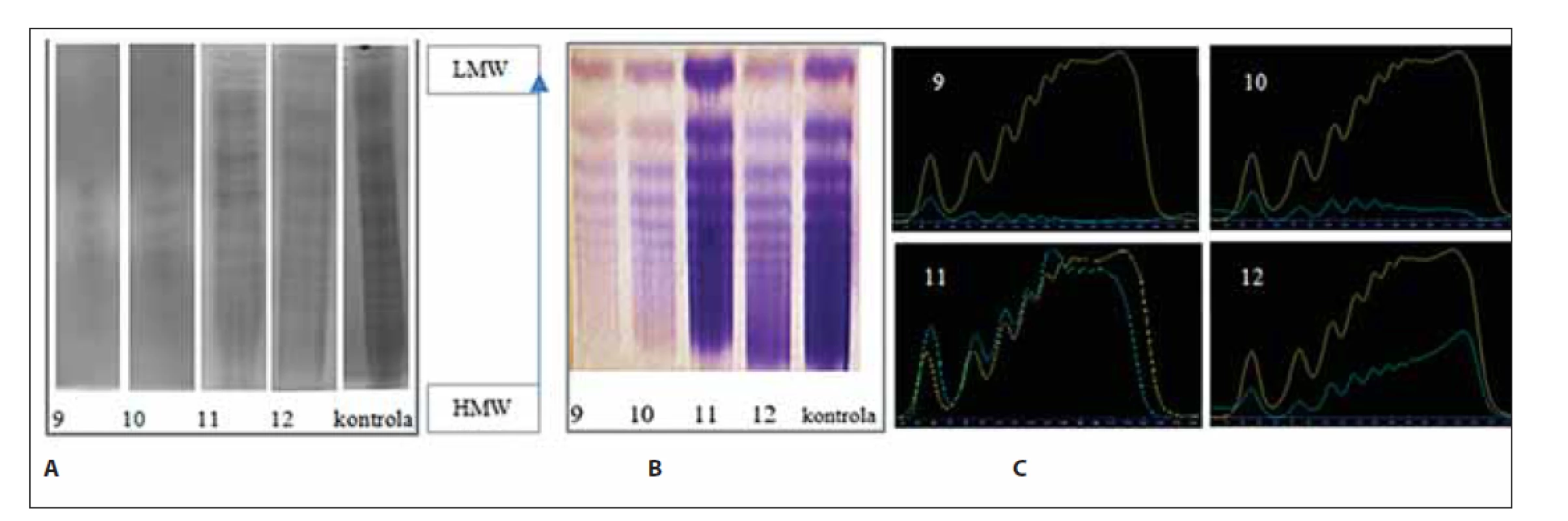
- vo vzorke č. 9 boli detekované multiméry: LMW 7 %, IMW 4 %, HMW 5 %;
- vo vzorke č. 10 boli detekované multiméry: LMW 6 %, IMW 6,8 %, HMW 6 %;
- Vo vzorkách č. 9 a č. 10 v porovnaní s kontrolou absentujú LMW, IMW a HMW multiméry.
- vo vzorke č.11 boli detekované multiméry: LMW 34 %, IMW 32 %, HMW 31 %;
- vo vzorke č.12 boli detekované multiméry: LMW 10 %, IMW 17 %, HMW 29 %, vzorka vykazovala parciálny deficit IMW a HMW multimérov.
Vizuálnym porovnaním gélov oboch metód, môžeme konštatovať, že multimérne štruktúry nie sú vo všetkých vzorkách manuálnej analýzy dostatočne zreteľne zobrazené.
Každá vzorka bola hodnotená komplexne vrátane výsledkov vWF: Ac, vWF: Ag, FVIII, RIPA (pokiaľ bola dostupná), počtu trombocytov, času krvácania pomocou PFA, prípadne Duka, CBA a krvnej skupiny (KS, plazmatická koncentrácia vWF je u KS 0 nižšia ako u ostatných krvných skupín), ako aj so zohľadnením klinického nálezu (tab. 1–3).
Tab. 1. Tabuľka výsledkov testov vzoriek č. 1–4. 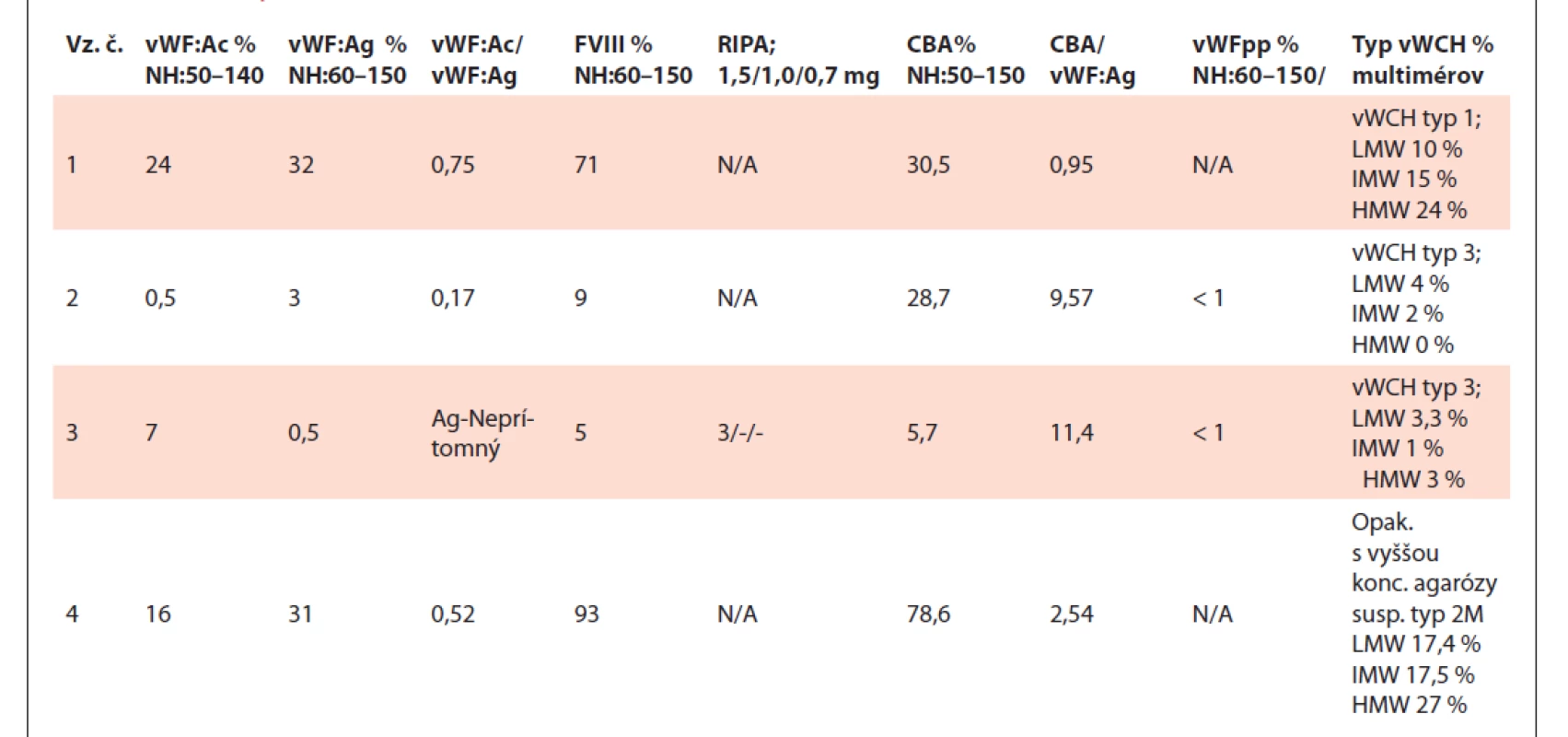
vWF – von Willebrandov faktor, vWF:Ac – funkčná aktivita vWF, vWF:Ag – antigén vWF, FVIII – aktivita koagulačného faktora VIII, RIPA – ristocetínom indukovaná agregácia, CBA (collagen binding assay) – aktivita väzby vWF na kolagén, vWFpp – propeptid vWF, N/A – nedostupné (not available), NH – normálne hodnoty, vz.č. – vzorka číslo. Tab. 2. Tabuľka výsledkov testov vzoriek č. 5–8. 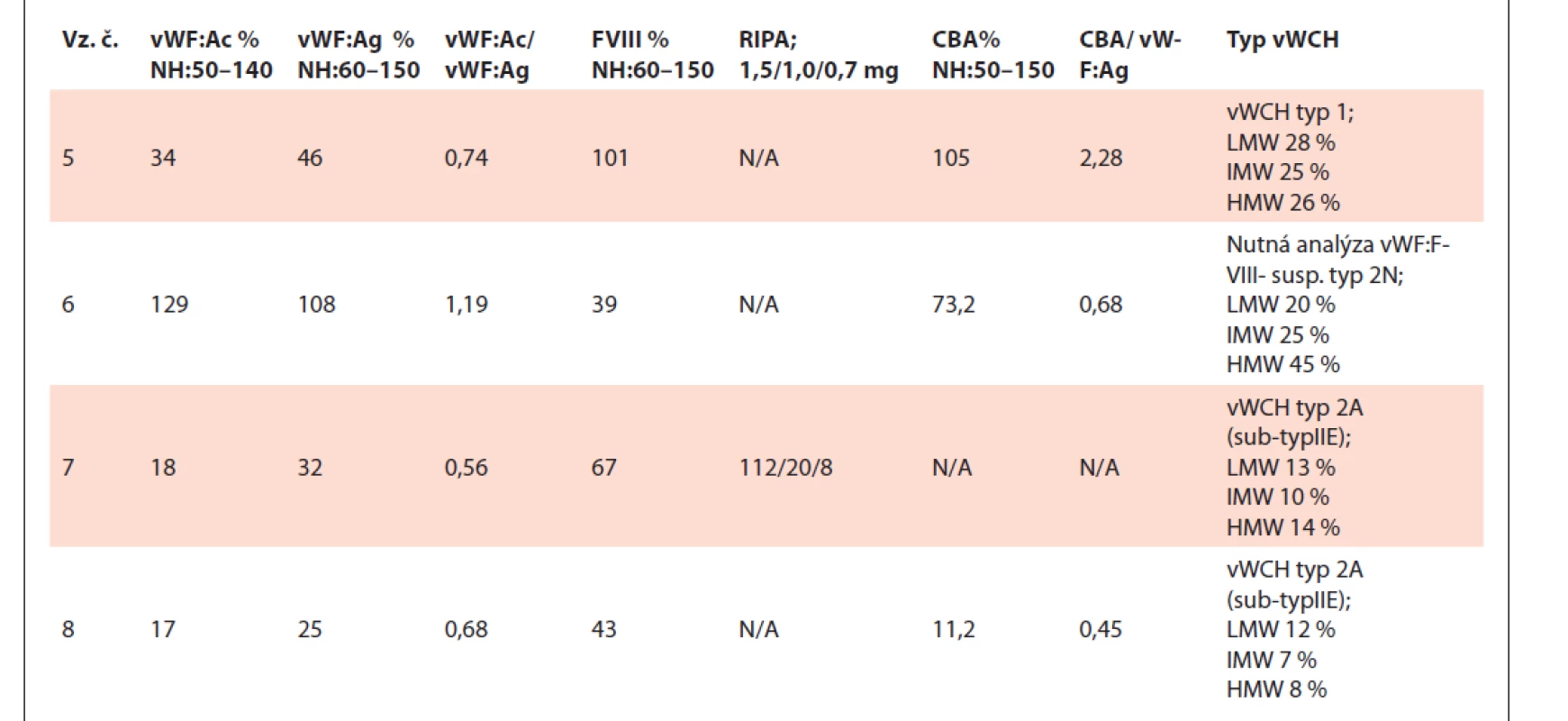
vWF – von Willebrandov faktor, vWF:Ac – funkčná aktivita vWF, vWF:Ag – antigén vWF, FVIII – aktivita koagulačného faktora VIII,
RIPA – ristocetínom indukovaná agregácia, CBA (collagen binding assay) – aktivita väzby vWF na kolagén, vWFpp – propeptid vWF,
N/A – nedostupné (not available), NH – normálne hodnoty, vz.č. – vzorka číslo.Tab. 3. Tabuľka výsledkov testov vzoriek č. 9–12. 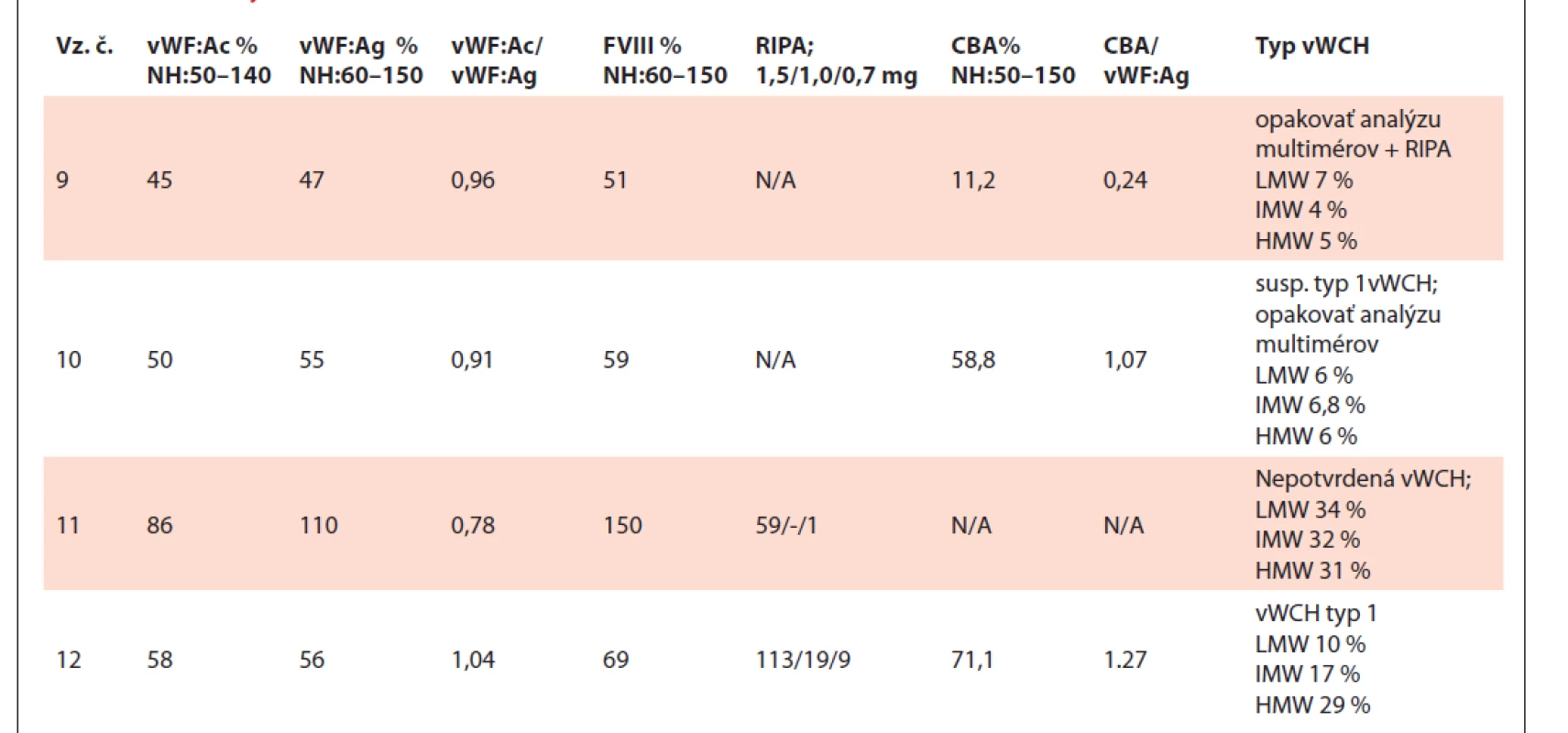
vWF – von Willebrandov faktor, vWF:Ac – funkčná aktivita vWF, vWF:Ag – antigén vWF, FVIII – aktivita koagulačného faktora VIII,
RIPA – ristocetínom indukovaná agregácia, CBA (collagen binding assay) – aktivita väzby vWF na kolagén, vWFpp – propeptid vWF,
N/A – nedostupné (not available), NH – normálne hodnoty, vz.č. – vzorka číslo.Vzorky č. 1, č. 5 a č. 12 porovnaním multimérov s kontrolou boli u oboch metód kvalitatívnym hodnotením prítomné s nižšou intenzitou a kvantitatívne denzitometrické hodnotenie potvrdilo ich nižšiu koncentráciu. Na základe výsledkov testov a multimérnej analýzy ich vyhodnocujeme ako suspektná vWCH typ 1.
Vzorky č. 2 a č. 3 u oboch typov analýz rovnako na oboch géloch nie je kvalitatívne zobrazená a ani kvantifikovateľná multimérna štruktúra, boli vykonané testy vWF: pp a genetická analýza, ide o suspektnú vWCH typ 3.
Vzorka č. 4 je porovnateľne zobrazená na oboch géloch, avšak z dôvodu lepšieho zobrazenia tripletnej štruktúry multimérov je potrebné opakovať odber a manuálnou metódou s vyššou koncentráciou agarózového gélu urobiť analýzu pre potvrdenie príp. vylúčenie vWCH typu 2M. Na prístroji Hydrasys to nie je možné nakoľko sú komerčne dodávané len 2% agarózové gély.
Vzorka č. 6 mala kvantitatívnou analýzou multimérov potvrdené prítomné všetky multiméry, manuálnou metódou boli tiež viditeľne prítomné všetky multiméry, avšak v zníženej intenzite v porovnaní s kontrolou. Vzhľadom k výsledku FVIII je potrebné dodiagnostikovať vzorku testom vWF: FVIII na potvrdenie príp. vylúčenie vWCH typ 2N.
Vzorky č. 7 a č. 8 vykazovali u oboch metód deficit IMW a HMW multimérov, vyhodnocujeme ako suspektná vWCH typ 2A.
Vo vzorkách č. 9 a č. 10 v oboch metódach nie sú detekovateľné multiméry LMW, IMW a HMW, vzhľadom na hodnoty vWF: Ac, vWF: Ag a FVIII je vhodné opakovať analýzu multimérov a doplniť RIPA analýzu s koncentráciou 0,3–0,5 mg/ml. Pravdepodobne došlo k deštrukcii multimérov v dôsledku skladovania vzoriek.
Vzorka č. 11 má multiméry v norme u oboch metód navzájom porovnateľné z hľadiska optickej denzity multimérnej štruktúry. Nebola potvrdená vWCH.
DISKUSIA
Na základe našich doterajších skúseností s aplikáciou súpravy „Hydragel 5 von Willebrand Factor Multimer“ stanovenia analýzy multimérov vWF na semiautomatizovanom prístroji Hydrasys môžeme povedať, že táto metóda má svoje výhody i úskalia. Predovšetkým výhodou je, že ide o metódu s pripravenými gélmi a roztokmi, metóda je štandardizovaná a reprodukovateľná, výsledky sú dostupné v deň analýzy a sú ľahko interpretovateľné.
Nevýhodou tejto metódy je, že neposkytuje zobrazenie tripletnej štruktúry, čo je dôležité pri určení 2M typu vWCH, ale je podstatná i pre klasifikáciu vWCH typ 2A (subtypy IIA, IID, IIE,IIC) [21–23].
Doteraz používaná manuálna metóda analýzy multimérov vWF má možnosť zobrazenia tripletnej analýzy multimérov, avšak metóda je neštandardizovaná s nižšou reprodukovateľnosťou, gély a roztoky sa pripravujú pri každom teste, metóda je aj časovo a technicky veľmi náročná.
Obe metódy si vyžadujú špecializované pracoviská s odbornou znalosťou a prístrojovým vybavením.
Vizuálne hodnotenie môže byť ovplyvnené subjektívnym postojom, denzitometricky a percentuálne vyhodnotené analýzy multimérov vWF jednoznačne poskytovali informáciu o prítomnosti multimérov (ich normálnej distribúcii, príp. so zníženou optickou denzitou), alebo informáciu o chýbajúcich multiméroch. Denzitometria zlepšila interpretáciu multimérov s malými štrukturálnymi zmenami, ktoré neboli hodnotiteľné vizuálnou kontrolou pri manuálnej metóde.
ZÁVER
Analýza multimérov vWF sa môže uplatniť u pacientov na určenie typu vWCH, určenie patomechanizmu, resp. zmeny niektorého procesu v metabolizme vWF, zhodnotenie prítomnosti multimérov vWF s HMW v koncentrátoch koagulačného faktora VIII s vWF a v koncentráte vWF, a tiež pri monitorovaní liečebnej odpovede. Naším cieľom je využitie analýzy multimérov vWF najmä za účelom upresnenia podtypov vWCH typu 2, čo umožní skvalitniť liečebný manažment týchto pacientov.
Prínosom a hlavnými výhodami analýzy poloautomatickým analyzátorom Hydrasys v porovnaní s manuálnou analýzou je hlavne to, že výsledky sú interpretovateľné už v deň analýzy a môžu byť poskytnuté a nápomocné pre klinika pre ďalší manažment liečby pacienta. Obmedzením metódy analyzátorom Hydrasys je nemožnosť laboratórneho rozlíšenia subtypov vWCH typ 2A (IIA, IIE, IIC, IID) na úrovni tripletnej štruktúry jednotlivých multimérov.
Zavedenie novej metódy analýzy multimérov vWF do praxe je užitočný k diagnostike vWCH a prínosom nielen pre klinikov, pacientov ale i laboratórnych diagnostikov. Abnormality multimérov sa však potom musia ďalej podrobnejšie skúmať pomocou klasických-manuálnych metód.
ZOZNAM SKRATIEK
ADAMTS13 – metaloproteáza štiepiaca von Willebrandov faktor (a disintegrin and metalloprotease with thrombospondin type-1 motifs)
AP – alkalická fosfatáza
APTT – aktivovaný parciálny tromboplastínový čas
ELFO – elektroforéza
FVIII: C – aktivita koagulačného faktora VIII
HMW – multiméry s vysokou molekulovou hmotnosťou
IMW – multiméry so strednou molekulovou hmotnosťou
LMW – multiméry s nízkou molekulovou hmotnosťou
PFA – Platelet Function Assay (analyzátor funkcie doštičiek)
RIPA – ristocetínom indukovaná agregácia trombocytov
vWF: Ac – funkčná aktivita vWF
vWF: Ag – von Willebrandov faktor antigén
vWF: CBA – aktivita väzby vWF na kolagén (collagen binding assay)
vWF: FVIII – väzbová kapacita vWF ku FVIII
vWF – von Willebrandov faktor
vWCH – von Willebrandova choroba
vWFpp – propeptid vWF
vWF: RCo – ristocetín kofaktorová aktivita vWF
PODIEL AUTOROV NA PRÍPRAVE RUKOPISU
ŠI – laboratórna diagnostika, napísanie rukopisu
HP, DM, ŠT, SJ, PI, KP – diagnostika, liečba a klinické sledovanie pacientov
ŽJ – laboratórna diagnostika
SJ – hodnotenie výsledkov, revidovanie a korigovanie rukopisu
Všetci spoluautori potvrdili finálnu verziu rukopisu.
PREHLÁSENIE O KONFLIKTE ZÁUJMOV
Autorka práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nie je v strete záujmov, a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou spoločnosťou. Toto prehlásenie sa týka aj všetkých spoluautorov.
POĎAKOVANIE
Táto práca bola podporená projektami APVV – 16-0020, Vega 1/0168/16, Vega 1/0187/17 a Centra excelentnosti pre perinatologický výskum (CEPV II, ITMS 26220120036) a Centra excelentnosti pre výskum v personalizovanej terapii (CEVYPET).
Doručeno do redakce dne 26. 8. 2019.
Přijato po recenzi dne 7. 9. 2020.
Ing. Ingrid Škorňová, PhD.
Národné centrum hemostázy a trombózy,
Klinika hematológie a transfúziológie JLF UK a UNM
Kollárova 2
03601 Martin, Slovenská republika
e–mail: ingrid.skornova@uniba.sk
Zdroje
1. Nichols WL Jr, Hultin MB, James AH, et al. The diagnosis, evaluation, and management of vWD, the National heart, lung, and blood institute (NHLBI), NIH Publication No. 08-5832, 2007; 1–126.
2. Sadler JE, Budde U, Eikenboom JC, et al. Working party on von Willebrand disease classification. Update on the pathophysiology and classification of von Willebrand disease: a report of the Subcommittee on von Willebrand factor. J Thromb Haemost. 2006; 4 : 2103–2114.
3. Montgomery RR, Haberichter SL. von Willebrand factor structure and function. In: Federici AB et al. von Willebrand disease. 1st Ed. Wiley-Blackwell, Oxford, UK 2011; 30–48.
4. Enayat MS, Hill FG. Analysis of the complexity of the multimeric structure of FVIII related antigen/von Willebrand protein using a modified electrophoretic technique. J Clin Pathol. 1983; 36 : 915–919.
5. Ruggeri ZM, Zimmerman TS. Classification of variant vWD subtypes by analysis of functional characteristics and multimeric composition of FVIII/von Willebrand factor. Ann NY Acad Sci. 1981; 370 : 205–209.
6. Veyradier A, Jenkins ChSP, Fressinaud E, et al. Acquired von Willebrand syndrome: from pathophysiology to management. Thromb Haemost. 2000; 84 : 175–182.
7. Eikenboom JC, Van der Meer FJM, Briet E. Acquired von Willebrands disease due to excessive fibrinolysis. Br J Haematol. 1992; 81 : 618–620.
8. Curnow J, Pasalic L, Favaloro EJ. Treatment of von Willebrand disease. Semin Thromb Hemost. 2016; 42 : 133–146.
9. Favaloro EJ. Von Willebrand disease: local diagnosis and management of a globally distributed bleeding disorder. Semin Thromb Hemost. 2011; 37 : 440–455.
10. Flood VH. Perils, problems, and progress in laboratory diagnosis of von Willebrand disease. Semin Thromb Hemost. 2014; 40 : 41–48.
11. Favaloro EJ. Rethinking the diagnosis of von Willebrand disease. Thromb Res. 2011; 127 (2): 17–21.
12. Federici AB, Castaman G, Mannucci PM, et al. Guidelines for the diagnosis and management of von Willebrand disease in Italy. Haemophilia. 2002; 8 : 607–621.
13. Federici AB, Mannucci PM. Diagnosis and management of von Willebrand disease. Haemophilia. 1999; 5 (2): 28–37.
14. Škorňová I, Staško J, Hollý P, et al. Analýza multimérov von Willebrandovho faktora pri von Willebrandovej chorobe. Vask Med. 2014; 6 (1): 32–34.
15. Oliver S, Vanniasinkam T, Mohammed S, et al. Semi-automated von Willebrand factor multimer assay for von Willebrand disease: Further validation, benefits and limitations. Int J Lab Hematol. 2019; 41 (6): 762–771.
16. Crist RA, Heikal NM, Rodgers GM et al. Evaluation of a new commercial method for von Willebrand factor multimeric analysis. Int J Lab Hem. 2018; 40 : 586–591.
17. Bowyer AE, Goodfellow KJ, Seidel H, et al. Evaluation of a semi-automated von Willebrand factor multimer assay, the Hydragel 5 von Willebrand multimer, by two European centers. Res Pract Thromb Haemost. 2018; 2 (4): 790–799.
18. Seidel H, Westhofen P, Bautista H, et al. Clinical evaluation of the sebia hydragel von Willebrand factor assay in comparison to electrophoresis and blotting based multimer analysis, Res Pract Thromb Haemost 2017; 1 : 717–718.
19. Bowyer AE, Goodfellow KJ, Nouadje G, et al. Performances of the Hydragel 5 von Willebrand multimers – a new within-day von Willebrand factor (VWF) multimer screening method evaluation of a new commercial method for von Willebrand factor multimeric analysis. Res Pract Thromb Haemost. 2017; 1 : 494.
20. Vasse M, Francois D, Ligneel T, et al. Interest of the new rapid test “Hydragel 5 von Willebrand multimers” for the analysis of von Willebrand multimers. Int J Lab Hem. 2016; 38 : 113.
21. Vasse M, Francois D, Bironien R, et al. Clinical interest of same-day resluts assay,,Hydragel 5 von Willebrand multimers“ for therapeutic decision. Clin Chem Lab Med. 2017; 55 : 721.
22. Lemaitre A, Nouadje G, Beaulieu Bautista H, et al. Clinical evaluation of the Hydragel 5 von Willebrand multimers of Sebia. Clin Chem Lab Med. 2017; 55 : 706.
23. Goodfellow KJ, Bowyer AE, Nouadje G, et al. Sebia Hydragel 5 von Willebrand multimers – a new and rapid von Willebrand factor (VWF) multimer screening method to aid subtyping of type 2 von Willebrand disease (VWD). Clin Chem Lab Med. 2017; 55 : 721.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2021 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- ZMĚNY V IMUNITNÍM SYSTÉMU U NELÉČENÝCH NEMOCNÝCH S CHRONICKOU LYMFOCYTÁRNÍ LEUKEMIÍ – ČÁST 2: NESPECIFICKÁ IMUNITA.
-
Doc. MUDr. Miroslav Tomíška, CSc.,
slaví sedmdesáté životní jubileum - Zemřel profesor Jan Evangelista Dyr
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
- Jaké dávky inhibitorů tyrozinkináz jsou v léčbě pacientů s chronickou myeloidní leukemií optimální?
- EDITORIAL
- Von Willebrandova choroba – porovnanie dvoch metód analýzy multimérov von Willebrandovho faktora
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Bolesti svalů jako vzácný autoimunitní projev při monoklonální IgM gamapatii – popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů
- Inhibítory faktora VIII – Výsledky imunotolerančnej indukcie v Národnom hemofi lickom centre a nové možnosti a prvé skúsenosti s liečbou bišpecifi ckou protilátkou (emicizumab) u pacientov s inhibítormi na Slovensku
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 3., rok 2021
- Heparinem indukovaná trombocytopenie
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Heparinem indukovaná trombocytopenie
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



