-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Inhibítory faktora VIII – Výsledky imunotolerančnej indukcie v Národnom hemofi lickom centre a nové možnosti a prvé skúsenosti s liečbou bišpecifi ckou protilátkou (emicizumab) u pacientov s inhibítormi na Slovensku
Factor VIII inhibitors – Results of immunotolerance induction at the National Haemophilia Centre; new options and fi rst experience with treatment using a bispecifi c antibody (emicizumab) in patients with inhibitors in Slovakia
Factor VIII (FVIII) inhibitors are the most challenging complication of haemophilia treatment. The priority is to eradicate the inhibitors and induce immune tolerance (ITI) to allow resumption of therapy with FVIII. The success rate of ITI is 60–85%, which means that some patients with inhibitors remain dependent on less effective treatment with bypassing agents. New, non-factor drugs are currently under development for effective prophylaxis in inhibitor patients. The first non-factor agent already in use is emicizumab, a bispecific antibody against factors IXa and X, which has been authorized for prophylaxis not only in patients with inhibitors but also in those without inhibitors. The availability of non-factor treatment can fundamentally change the current paradigm of haemophilia treatment, including access to early prophylaxis and ITI management. We discuss here the importance of ITI and we present the results of ITI in our centre and our first experience with non-factor treatment using emicizumab in three patients aged 3.5–7 years. Emicizumab was indicated in two patients with ITI failure and in one patient after successful ITI because of objective obstacles to pharmacokinetic guided prophylaxis with FVIII. In the absence of bleeding for 7–13 months, we evaluate bispecific antibody prophylaxis as being highly effective
Keywords:
haemophilia A – FVIII inhibitors – immunotolerance induction – emicizumab
Autoři: A. Bátorová; T. Prigancová; D. Jankovičová; A. Kyselová
Působiště autorů: Univerzitná nemocnica Bratislava, Slovensko ; Klinika hematológie a transfuziológie LF UK, SZU, Národné hemofi lické centrum – Európske hemofi lické centrum komplexnej starostlivosti
Vyšlo v časopise: Transfuze Hematol. dnes,27, 2021, No. 1, p. 63-71.
Kategorie: Kazuistika
doi: https://doi.org/10.48095/cctahd202163Souhrn
Inhibítory faktora VIII (FVIII) predstavujú závažnú komplikáciu liečby hemofílie. Prioritou liečby pacientov s inhibítormi je eradikácia inhibítorov a indukcia imunitnej tolerancie (ITI), ktorá umožní opätovnú liečbu faktorom VIII. Úspešnosť ITI je 60–85 % čo znamená, že časť pacientov s inhibítormi je stále odkázaná na menej účinnú liečbu prípravkami s „bypassing“ aktivitou. V súčasnosti sú vo vývoji nefaktorové lieky, ktoré umožnia prevenciu krvácaní aj u pacientov s inhibítormi. Prvým liekom uvedeným do praxe je bišpecifická protilátka proti faktorom IXa a X – emicizumab, ktorý bol registrovaný pre profylaxiu nielen u pacientov s inhibítormi, ale aj bez inhibítorov. Dostupnosť nefaktorovej liečby môže zásadne zmeniť doterajšiu paradigmu liečby hemofílie, vrátane prístupu k včasnej profylaxii a manažmentu ITI. V práci diskutujeme význam ITI, prezentujeme výsledky ITI v našom centre a prvé skúsenosti s nefaktorovou liečbou emicizumabom u troch pacientov vo veku 3,5–7 rokov. U dvoch pacientov sme emicizumab indikovali po zlyhaní ITI a u jedného pacienta po úspešnej ITI pre objektívne prekážky farmakokineticky riadenej profylaxie s FVIII. Pri absencii krvácania počas 7–13 mesiacov hodnotíme profylaxiu bišpecifickou protilátkou ako vysoko efektívnu.
Klíčová slova:
hemofília A – inhibítory FVIII – imunotolerančná indukcia – emicizumab
ÚVOD
Najzávažnejší problém liečby hemofílie v súčasnosti predstavuje tvorba neutralizujúcich aloprotilátok proti FVIII (inhibítory), ktoré postihujú 25–40 % pacientov s ťažkým stupňom hemofílie [1,2] a spôsobujú neúčinnosť liečby. Títo pacienti nemôžu profitovať zo súčasných pokrokov liečby hemofílie, ako sú personalizovaná, farmakokineticky riadená profylaxia [3] a nové koncentráty FVIII s predĺženým biologickým polčasom, ktoré redukciou počtu intravenóznych injekcií prispeli k zlepšeniu kvality života pacientov. U pacientov s inhibítormi sa pri epizodickej liečbe krvácaní používajú prípravky s „bypassing“ aktivitou (bypassing agents – BPA), t.j. rekombinantný faktor VIIa (rFVIIa) alebo aktivovaný koncentrát protrombínového komplexu (aPCC). Ich účinnosť je nižšia v porovnaní so špecifickou substitúciou FVIII, preto sú možnosti profylaxie veľmi limitované. Títo pacienti majú oproti pacientom bez inhibítorov signifikantne vyššiu morbiditu a mortalitu [4]. Z uvedených dôvodov ostáva hlavným cieľom liečby eradikácia inhibítora, pričom dodnes je jediným účinným spôsobom na dosiahnutie tohto cieľa indukcia imunologickej tolerancie pomocou opakovanej aplikácie FVIII. Táto liečba je veľmi náročná, keďže sa FVIII podáva v 12–48 h intervaloch a u najmenších detí, u ktorých sú inhibítory najčastejšie prítomné, si vyžaduje aj zavedenie centrálneho venózneho katétra (CVK). V úvode ITI pri vysokom titri inhibítora faktor VIII nechráni pacientov pred krvácaním, ktorého liečba aj naďalej vyžaduje aplikáciu BPA. Úspech ITI závisí na viacerých faktoroch ako sú titer inhibítora (historický, pred a počas ITI), vek pacienta, interval ITI od diagnózy inhibítora [5], prípadne typ génovej mutácie [6]. Vplyv dávky a typu FVIII nie je jednoznačný, ale u pacientov s nepriaznivými prognostickými faktormi sa zdajú byť efektívnejšími vysoko dávkované režimy [7–9]. V prospektívnej medzinárodnej ITI štúdii mal u pacientov s dobrou prognózou signifikantný negatívny vplyv na rýchlosť dosiahnutia eradikácie inhibítora aj výskyt krvácania počas ITI [5], čo odôvodňuje potrebu efektívnej profylaxie u pacientov podrobujúcich sa ITI. Efektivita ITI dosahuje 60–85 % [5,8,10] a pacienti so zlyhaním liečby ostávajú odkázaní na liečbu s BPA so suboptimálnou účinnosťou a veľmi limitovanými možnosťami profylaxie.
Snaha o umožnenie účinnej profylaxie u pacientov s inhibítormi bola stimulom pre vývin nových, tzv. nefaktorových liekov, ktoré modulujú hemostatickú rovnováhu imitáciou funkcie FVIII alebo interferenciou s regulačnými proteínmi koagulácie [11,12]. Prvým z týchto liekov uvedeným do praxe je emicizumab, bišpecifická protilátka namierená proti faktoru IXa (FIXa) a faktoru X (FX), ktorá imituje úlohu FVIII ako kofaktora zrážania [11]. Klinické skúšky potvrdili vysokú účinnosť lieku. V štúdii HAVEN 1 [13] činila redukcia krvácaní u dospelých pacientov a adolescentov s inhibítoromi 87 % v porovnaní s predchádzajúcou epizodickou liečbou BPA a 79 % v porovnaní s predošlou profylaxiou s BPA. Ešte výraznejší efekt sa pozoroval u detí v štúdii HAVEN 2, u ktorých profylaxia emicizumabom viedla k redukcii až 99% liečených krvácaní oproti profylaxii s BPA [14]. Ďalšie štúdie HAVEN 3 [15] a HAVEN 4 [16] potvrdili vysokú efektivitu bišpecifickej protilátky v prevencii krvácaní aj u pacientov bez inhibítorov. Emicizumab udržiava kontinuálnu hemostatickú ochranu na úrovni ľahkého stupňa hemofílie [10] a dnes je registrovaný pre profylaxiu u pacientov s hemofíliou A s, aj bez inhibítorov, čo spolu s jeho pohodlnou podkožnou aplikáciou v intervaloch dlhších ako pri podávaní koagulačných faktorov môže viesť k zásadnej zmene prístupu k liečbe hemofílie i k spôsobu a manažmentu ITI u pacientov s inhibítormi.
V práci uvádzame výsledky ITI v Národnom hemofilickom centre (NHC), ktoré vzhľadom na celoslovenské pôsobenie manažuje viac ako 85 % pacientov s inhibítormi na Slovensku. Na prípadoch 3 pacientov demonštrujeme úskalia imunotolerančnej liečby u detí a prezentujeme prvé skúsenosti s nefaktorovou liečbou emicizumabom na Slovensku.
MATERIÁL A METÓDY
Indukcia imunotolerancie u pacientov s hemofíliou A komplikovanou inhibítormi
Skúsenosti s ITI u pacientov s inhibítoromi a priebežné výsledky liečby v Národnom hemofilickom centre sme prezentovali v predchádzajúcich publikáciách [10,17]. V predloženej práci sme aktualizovali výsledky primárnej ITI aplikovanej v období rokov 1999–2019 u 22 pacientov s inhibítormi s vekovým mediánom v čase začatia ITI 3,5 rokov (rozptyl 0,5–57 rokov). U všetkých, s výnimkou jedného, sme použili plazmatický FVIII s obsahom von Willebrandovho faktora (pdFVIII /vWF), v 14 kúrach vysoko dávkovaný Bonnský protokol (HD ITI 100 IU/kg 2× denne) a v 8 prípadoch intermediárny režim (ID ITI 50–100 IU kg denne). Primárnu ITI ukončilo 21 pacientov, z nich podľa štandardných kritérií [5,7–9] dosiahlo kompletnú remisiu 17 (81 %) pacientov s časovým mediánom 14 mesiacov (rozptyl 4–36 mesiacov). Parciálnu remisiu s možnosťou profylaxie faktorom VIII dosiahli 2 pacienti (9,5 %) a u 2 ITI zlyhala (9,5 %). U 1 detského pacienta nastal relaps inhibítora po 5 rokoch s následnou úspešnou HD ITI, 57 ročný pacient, u ktorého vznikol inhibítor v dospelom veku mal 3 relapsy v 2–3ročných intervaloch, všetky boli úspešne zvládnuté následnými kúrami LD ITI v kombinácii s rituximabom.
Profylaxia bišpecifickou monoklonálnou protilátkou anti-FIXa a anti-FX u pacientov s inhibítormi po absolvovaní ITI
Liečbu emicizumabom sme indikovali u troch detí vo veku 3,5–7 rokov, z nich u 2 pacientov s perzistujúcim inhibítorom po zlyhaní ITI a 1 pacienta po úspešnej ITI s vážnymi prekážkami farmakokineticky riadenej profylaxie faktorom VIII s predĺženým biologickým polčasom. Charakteristiky a priebeh ITI u týchto troch pacientov demonštruje tab. 1. Pred začatím liečby emicizumabom sme rodičov poučili o spôsobe liečby, dokumentácii a nutnosti konzultácie centra v prípade krvácania alebo úrazu. Pacient liečený s aPCC vrátil rezervu lieku do centra a dvaja pacienti s aktuálne prítomným inhibítorom dostali do rezervy 3 dávky rFVIIa. Liečba emicizumabom sa riadi štandardným protokolom [13,14], nasycujúca liečba 3,0 mg/kg s.c. týždenne 4 týždne, následne udržiavacia liečba 1,5 mg/kg s.c. raz za týždeň.
Tab. 1. Charakteristiky a výsledok imuno-tolerančnej indukcie (ITI) 3 pacientov v súčasnosti liečených emicizumabom. 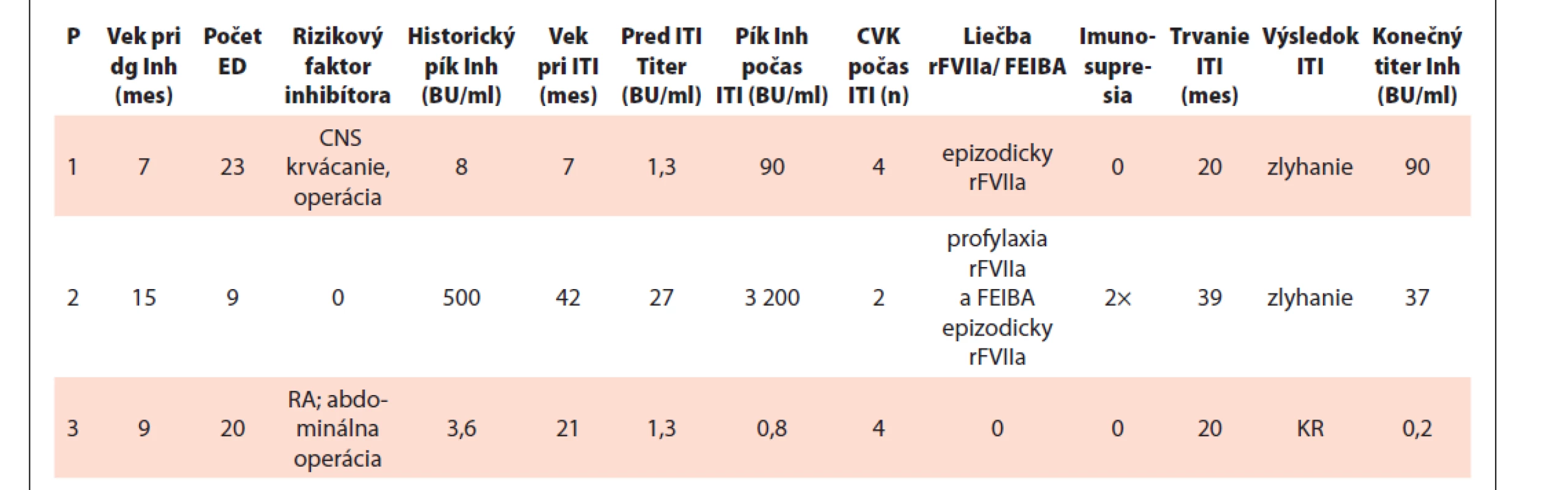
P – pacient, dg – diagnóza, Inh – inhibítor, mes – mesiace, ED – expozičný deň, CVK – centrálny venózny katéter (Broviac), rFVIIa – rekombinantný FVIIa, FEIBA– factor eight inhibitor bypassing activity, Imunosupresia – rituximab, IvIgG, dexametazón a mykofenolát mofetil, RA – rodinná anamnéza inhibítora, KR – kompletná remisia Laboratórne vyšetrenia: pred liečbou sme vyšetrili aPTT, FVIII a inhibítor Bethesda a modifikovanou Nijmegen metódou s použitím Dade Actin FSL aPTT reagentu (Siemens) a FVIII defektnej plazmy (Siemens). Počas liečby kontrolujeme aPTT, na overenie vplyvu emicizumabu sme faktory vnútorného systému (FVIII, FIX, FXI a FXII) vyšetrili jednostupňovou metódou s defektnými plazmami (Siemens). V priebehu liečby štandardne vyšetrujeme FVIII a inhibítor FVIII chromogénnou metódou s bovinnými reagenciami (bovinný FIX a FX; Siemens) [18,19], túto metódu sme použili aj na overenie aktivity FIX. Faktory XI a XII chromogénnou metódou nevyšetrujeme.
Štúdie u pacientov s inhibítormi v Národnom hemofilickom centre, vrátane zavádzania a hodnotenia nových postupov liečby, boli vopred schválené etickou komisiou Univerzitnej nemocnice Bratislava.
Opis prípadov liečených emicizumabom
Pacient 1
U 3,5ročného pacienta s negatívnou rodinnou anamnézou bolo prvým prejavom hemofílie A (FVIII < 1 %) podmienenej inverziou intrónu 22 masívne krvácanie do CNS v 6. mesiaci života s nutnosťou urgentnej operácie s rozsiahlou trepanáciou lebky. Diagnóza hemofílie A však bola stanovená až po reoperácii pre recidívu krvácania, ktorá nastala za 12 hodín po prvej operácii. Po 23 expozičných dňoch (ED) intenzívnej liečby faktorom VIII vznikol inhibítor s maximálnym titrom 8,0 BU/ml. Vzhľadom na perspektívu ďalšej operácie (reimplantácia kostnej časti kalvy) sme ihneď po zavedení CVK Broviac pod clonou rFVIIa začali HD ITI. Už v 2. mesiaci liečby sme zaznamenali negativitu inhibítora ale v ďalších mesiacoch titer kolísal medzi 1,1–2,8 Nijmegen BU/ml. Od 14. mesiaca nastal progresívny vzostup titra inhibítora až na 90 BU/ml, preto bola ITI v 20. mesiaci ukončená. K zlyhaniu mohli prispieť komplikácie priebehu ITI, pacient absolvoval 12 invazívnych výkonov (ventrikulo-peritoneálny VP skrat [shunt] pre intrakraniálnu hypertenziu, revízia VP skratu, reimplantáciu kostného krytu, 4 implantácie a výmeny CVK) pri negativite alebo nízkom titri inhibítora sa výkony robili pod clonou FVIII, ale posledná výmena CVK Broviac a jeho odstránenie už pod clonou rFVIIa (graf 1).
Graf 1. Pacient 1 – Priebeh a dávkovanie ITI, invazívne výkony pod clonou FVIII a rFVIIa a dynamika inhibítora počas ITI. Zlyhanie ITI v 20. týždni ITI.
ITI – indukcia imunotolerancie, FVIII – faktor VIII, rFVIIa – rekombinantný FVIIa
Po ukončení ITI sme vo veku 2,5 roka začali profylaxiu emicizumabom. V klinickom obraze dominovala ľavostranná hemiparéza s výrazným motorickým zaostávaním, pacient dokázal sedieť a plaziť sa, ale nechodil. Profylaxia emicizumabom umožnila intenzívnu rehabilitáciu, už po 2 mesiacoch sa začal stavať na kolená, od 6. mesiaca profylaxie stojí a chodí s oporou. V priebehu 13 mesiacov nemal žiadne spontánne krvácanie, drobné úrazy a očkovanie prebehli bez krvácania. Výsledky laboratórneho vyšetrenia aPTT a FVIII jednostupňovou a chromogénnou metódou s použitím bovinných reagencií demonštruje tab. 2. Zlepšuje sa aj psychický vývoj t. č. 3,5 ročného pacienta, trvá neurologický deficit so zlepšovaním pohybovej aktivity dieťaťa bez krvácavých epizód. Perspektívne sa u pacienta plánuje ďalšia operácia – implantácia keramického lebečného štepu.
Tab. 2. Laboratórne parametre počas profylaxie emicizumabom. 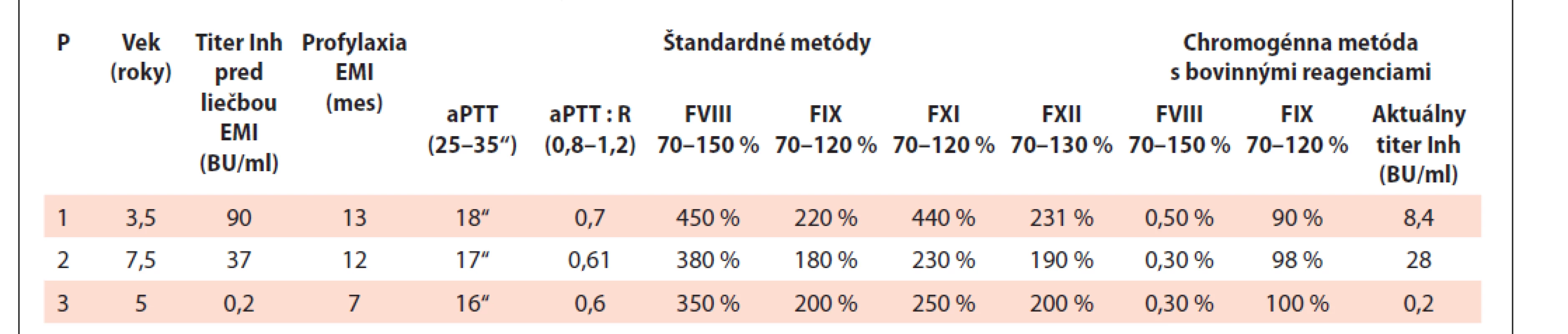
P – pacient, EMI – emicizumab, mes – mesiace, Štandardné metódy – vyšetrenie aktivity faktorov vnútorného systému jednostupňovou metódou na princípe aPTT, aPTT – aktivovaný parciálny tromboplastínový čas, aPTT : R – aPTT pacienta/aPTT normy, Inh – inhibítor Pacient 2
Dnes 7,5ročný pacient s aktivitou FVIII < 1 % s mutáciou c.1311delG; p.Ile438Leufs*44 pochádza z hemofilickej rodiny s negatívnou anamnézou inhibítora. U dieťaťa vznikol inhibítor bez akéhokoľvek rizikového momentu po 9. ED profylaxie začatej v 15. mesiaci života rekombinantným FVIII (rFVIII) a dosiahol titer 500 BU/ml. Keďže ani po 2 rokoch titer neklesol pod 10 BU/ml, vo veku 3,5 roka sme po zavedení CVK pod clonou rFVIIa začali ITI pri titri 27 BU/ml podľa Bonnského protokolu. Pre vývin cieľového kĺbu bol celý priebeh ITI clonený profylaxiou BPA, najskôr s rFVIIa 200 μg/kg denne, neskôr aPCC 2× 50 IU/kg denne. Anamnestický titer inhibítora bol 3 200 BU/ml, kvalitatívna analýza inhibítora ukázala zmiešanú špecificitu IgG4 protilátky proti ľahkému reťazcu a proti doméne A2-a2 ťažkého reťazca molekuly FVIII. Ani 39 mesiacov trvajúca ITI s dvomi vsuvkami imunomodulačnej liečby [20] v 19. a 32. mesiaci liečby a v závere ITI 4 mesačná aplikácia FVIII s predĺženým účinkom (rFVIIIFc) neviedli k eradikácii inhibítora (graf 2). Napriek profylaxii s aPCC mal pacient ročne 10 krvácaní, z nich 8 do cieľového lakťového kĺbu. Pri titri inhibítora 32 BU/ml sme ITI ukončili a po odstránení CVK pod clonou rFVIIa sme začali profylaxiu emicizumabom podľa štandardného protokolu. Počas 12 mesiacov nemal pacient žiadne spontánne, poúrazové alebo kĺbové krvácanie a nevynechal ani jeden deň školskej dochádzky z dôvodu hemofílie. Zaznamenali sme zlepšenie stavu cieľového kĺbu. Laboratórne parametre v priebehu profylaxie emicizumabom demonštruje tab. 1.
Graf 2. Pacient 2 – Priebeh ITI a PROFY prípravkami s bypasujúcou aktivitou. ITI ukončená pre zlyhanie v 39. týždni. ITI – indukcia imunotolerancie, PROFY – profylaxia, rFVIIa – rekombinantný FVIIa, FEIBA – factor eight inhibitor bypassing activity, pdFVIII/vWF – plazmatický FVIII/von Willebrandov faktor, rFVIIIFc – rekombinantný FVIII konjugovaný s Fc fragmentom, Ritux – rituximab, IvIG – intravenózny imunoglobulín, Dexa – dexametazón, MMF – mykofenolát mofetil 
Pacient 3
Päťročný pacient s ťažkou hemofíliou a mutáciou c.1311delG; p.Ile438Leufs*44 je mladším bratrancom pacienta 2. V čase diagnózy bola teda jeho rodinná anamnéza inhibítora pozitívna, preto sme už od 6. mesiaca plánovali začať profylaxiu s pdFVIII/vWF. Žiaľ, v 3. týždni života sa pacient podrobil akútnej brušnej operácii pre atréziu jejuna, pre ktorú dostal 10 ED pdFVIII/vWF. Profylaxia sa začala v 7. mesiaci života, ale už po 2 mesiacoch pri celkovom počte 20 ED bol potvrdený inhibítor v titri 1,0–1,5 BU/ml. Pri pokračujúcej profylaxii sa inhibítor nemenil, ale po 39. ED vo veku 15 mesiacov titer stúpol na 3,6 BU/ml (4,8 Nijmegen BU/ml), preto bola liečba s FVIII prerušená. Vo veku 21 mesiacov sa pri titri inhibítora 1,3 NBU/ml, po implantácii CVK Broviac pod clonou FVIII začala HD ITI. Pri absencii anamnestickej odpovede bol inhibítor negatívny už po mesiaci liečby, ale všetky kritériá kompletnej remisie (inhibítor 0,4 Nijmegen BU/ml, recovery FVIII nad 80 % a biologický polčas – T ½ 6,9 h) sme potvrdili až v 20. mesiaci ITI (graf 3). V priebehu ITI sme vymenili až 4 katétre Broviac a po ukončení ITI pokračovalo profylaktické podávanie FVIII do periférnej žily spočiatku obdeň, neskôr každé 3–4 dni. Pre veľmi zlý venózny prístup sme ordinovali farmakokineticky riadenú profylaxiu s FVIII s predĺženým polčasom (rFVIIIFc). Hodnotenie farmakokinetiky rFVIIIFc v programe WAPPS [21] však napriek negativite inhibítora (0,2 NBU/ml) ukázalo T ½ len 6,6 h, s odporučením režimu profylaxie dávkou 76 IU/kg obdeň s ročnou spotrebou FVIII 12 500 IU/kg. Matka však nekceptovala interval kratší ako 4 dni, pacient dostával dávku 120 IU/kg s vysokým píkom FVIII nad 170 %, ale takmer polovicu času 4 dňového intervalu bola hladina FVIII < 1 %. Z uvedených dôvodov a s ohľadom na stúpajúce riziko krvácaní pri zvyšujúcej sa fyzickej aktivite 5 ročného pacienta sme indikovali profylaxiu emicizumabom v štandardnom režime. Po 7 mesiacoch hodnotíme efekt liečby ako veľmi dobrý, pacient je bez akýchkoľvek prejavov krvácania.
Graf 3. Pacient 3 – Úspešná ITI, kompletná remisia v 20. týždni s prechodom na profylaxiu faktorom VIII. T. č. profylaxia emicizumabom.
ITI – indukcia imunotolerancie, pdFVIII/vWF – plazmatický FVIII/von Willebrandov faktor, rFVIIIFc – rekombinantný FVIII konjugovaný s Fc fragmentom, T1/2 – biologický polčas FVIII
DISKUSIA
Emicizumab je po viac ako 25 rokoch prvým novým liekom pre pacientov s inhibítormi FVIII, ktorý obchádza nevýhody doterajšej liečby: nie je neutralizovaný protilátkou proti FVIII a jeho dobrá biologická dostupnosť pri podkožnej aplikácii a dlhý biologický polčas umožňujú liečbu bez potreby venózneho prístupu v intervale podstatne dlhšom ako sú intervaly pri podávaní koagulačných faktorov. Emicizumab udržiava kontinuálnu hemostatickú ochranu na úrovni ľahkého stupňa hemofílie. V experimentálnych modeloch sa potvrdila hemostatická ekvivalencia FVIII medzi 10–20 % [12]. Z týchto dôvodov je liečba atraktívna aj pre pacientov s ťažkou hemofíliou bez inhibítorov. Súčasná registrácia lieku pre profylaxiu u pacientov s inhibítormi, ale aj bez inhibítorov, môže viesť k zásadnej zmene doterajšej paradigmy liečby hemofílie.
U pacientov s inhibítormi sa dnes intenzívne diskutuje otázka, či je v ére emicizumabu vôbec potrebné, aby podstupovali náročnú ITI [2,12,22,23]. Relevantné argumenty, ktoré aj naďalej podporujú snahu o eradikáciu inhibítorov pomocou ITI sú:
1) vysoká mortalita pacientov s inhibítormi z dôvodu krvácania;
2) emicizumab je účinný v prevencii, ale neposkytuje maximálnu hemostatickú ochranu pri traume a operáciách;
3) pri veľkom krvácaní a operácii sa musia používať „bypassing“ aktivity, ktoré pri súčasnej liečbe emicizumabom môžu niesť riziko trombotických komplikácií;
4) prítomnosť inhibítora vylučuje možnosť génovej terapie;
5) dlhodobá prognóza pacientov odkázaných na život v prítomnosti inhibítora je nejasná a stále neistá [2,12,23–25].
Skúsenosti nášho pracoviska s vysokým percentom úspešnosti (kompletná remisia po primárnej ITI 81 % a parciálna remisia 9,5 %) s následnou možnosťou účinnej profylaxie a epizodickej liečby faktorom VIII jednoznačne podporujú význam indukcie imunologickej tolerancie u pacientov s inhibítoromi [10].
Na druhej strane možno predpokladať, že dostupnosť emicizumabu by mohla priaznivo ovplyvniť náročnosť ITI. Redukcia krvácaní počas ITI teoreticky umožní použiť menej intenzívne režimy ITI s nižšími dávkami FVIII v dlhších intervaloch, čo významne zníži enormné zaťaženie pacienta a jeho rodiny [2,25]. Navyše eliminácia krvácania, ako známeho nepriaznivého prognostického faktora by mohla zlepšiť prognózu ITI [5]. Štúdie HAVEN 1 a HAVEN 2 potvrdili, že u pacientov na profylaxii emicizumabom je podanie FVIII bezpečné. Nedávno boli publikované prvé priaznivé výsledky tzv. Atlanta protokolu s podávaním emicizumabu v priebehu primárnej ITI u detí [26] a v súčasnosti už bežia štúdie záchrannej ITI nízkymi dávkami faktora FVIII v kombinácii s emicizumabom. Otvorenou ostáva otázka, či po dosiahnutí efektu ITI má pacient ostať na profylaxii emicizumabom alebo je nevyhnutná kontinuálna expozícia faktoru VIII, prípadne aké dávky a intervaly podávania FVIII by boli potrebné na udržanie dosiahnutej imunotolerancie [24].
V našej práci prezentujeme 3 prípady pacientov úspešne liečených emicizumabom. U pacienta 1 prispeli k vzniku inhibítora viaceré rizikové faktory. Zlyhanie včasne začatej a spočiatku úspešnej ITI mohol spôsobiť komplikovaný klinický priebeh s nutnosťou početných operácií. Našťastie, po zlyhaní ITI mohla byť hneď začatá profylaxia emicizumabom, jej dobrý efekt po 13 mesiacoch liečby potvrdzuje absencia krvácaní a možnosť intenzívnej rehabilitácie so zlepšením neurologického stavu pacienta. Aj v prípade pacienta 2 sa po neúspechu 39 mesiacov trvajúcej ITI s dvomi cyklami imunomodulačnej liečby, pri nedostatočnej účinnosti profylaxie s BPA javí liečba emicizumabom ako jediné východisko. Správnosť voľby potvrdzuje absencia akýchkoľvek krvácaní počas 12 mesačnej liečby. U pacienta 3 po úspešnej ITI s nedetegovateľným inhibítorom bol prekážkou účinnej farmakokineticky riadenej profylaxie predovšetkým zlý venózny prístup a krátky biologický polčas rFVIIIFc len 6,6 h, determinujúci krátky interval podávania FVIII. Aj v tomto prípade predstavuje emicizumab efektívne východisko.
Liečba bišpecifickou protilátkou však so sebou prináša aj viacero otázok. Jednou z nich je laboratórne monitorovanie v priebehu liečby. Emicizumab ako mimetická molekula FVIII interferuje s väčšinou testov vnútorného systému. aPTT sa normalizuje už pri veľmi nízkej koncentrácii emicizumabu 5µg/ml, pričom účinná koncentrácia emicizumabu je 45 µg/ml, preto test nie je vhodný na monitorovanie účinnosti liečby [11,18]. U pacientov liečených emicizumabom sme podľa očakávania potvrdili normalizovaný aPTT. Rýchla väzba na FIXa spôsobuje pri vyšetrení jednostupňovou metódou aj supranormálnu aktivitu FVIII a falošne vysoké aktivity ostatných faktorov vnútorného systému. Vyšetrenie FVIII, FIX a inhibítora FVIII chromogénnou metódu s bovinnými reagenciami ukázalo reálne výsledky týchto parametrov (tab. 1). Hodnota INR nebola liečbou emicizumabom ovplyvnená.
Kontrola aPTT v priebehu liečby slúži aj ako skríning pre odhalenie protilátok proti emicizumabu (anti-drug-antibiodies – ADA). Incidencia ADA je relatívne nízka (3,5 %) a výskyt neutralizujúcich protilátok je < 1 % [27]. V súčasnosti nie je dostupný komerčný test na ich detekciu a rutinné monitorovanie ADA nie je potrebné. Na prítomnosť neutralizujúcich protilátok upozorní opätovné predĺženie aPTT, ktoré signalizuje pokles koncentrácie emicizumabu < 5 µg/ml a stratu účinnosti liečby [18].
Ďalšou dôležitou otázkou pri liečbe emicizumabom je manažment krvácania a operácií. U našich troch pacientov sa v priebehu liečby emicizumabom zatiaľ nevyskytli žiadne krvácania ani situácie, ktoré by vyžadovali hemostatickú liečbu. Hrozbu posttraumatického krvácania alebo urgentnej operácie však nemožno vylúčiť a preto centrum, ktoré lieči pacientov emicizumabom musí byť na tieto situácie pripravené. U pacientov bez inhibítorov užívajúcich emicizumab možno pri krvácaní a operácii bezpečne použiť koncentrát FVIII [28,29]. U pacientov s inhibítormi sú však pri súčasnej liečbe s BPA obavy z trombotických komplikácií, ktoré vyvolali pozorovania 2 trombotických príhod a 3 prípadov trombotickej mikroangiopatie v štúdii HAVEN 1 u dospelých pacientov liečených pre krvácanie s aPCC v dávkach presahujúcich 100 IU/kg za 24 h [13]. Podľa dostupných odporučení sa podávaniu aPCC treba vyhýbať a tento liek použiť len v prípade neúčinnosti inej liečby [30,31]. Za postačujúcu sa považuje dávka aPCC 20–25 IU/kg a denná dávka nemá presiahnuť 100 IU/kg [32]. Pri liečbe s rFVIIa sa trombotické komplikácie nepozorovali a preto je rFVIIa liekom prvej voľby pri krvácaní a operácii, pričom sa odporúčajú nižšie dávky 45–90 µg/kg v 2–4 hodinových intervaloch [29,30]. Informácie o manažmente operácií u pacientov liečených emicizumabom boli donedávna veľmi limitované a nedovoľovali jednoznačné odporučenia. Pred plánovanou operáciou sa dokonca odporúčalo emicizumab vysadiť. My sme u nášho pacienta 2 zaistili operačné odstránenie CVK ešte pred začatím liečby emicizumabom, aby sme sa vyhli súčasnej aplikácii BPA. Čoskoro bude aktuálna operácia u pacienta 1 už viac ako rok liečeného emicizumabom, ktorý vyžaduje implantáciu keramického lebečného štepu. Vzhľadom na dlhý biologický polčas emicizumabu však nepovažujeme za vhodné prerušiť profylaxiu na tak dlhý čas. Názory na manažment operácií pri liečbe emicizumabom sa významne zmenil v poslednom roku na základe správ, že súčasné použitie rFVIIa je bezpečné a pri malých chirurgických výkonoch liečba emicizumabom podstatne znižuje spotrebu rFVIIa. McCary et al. u 5 pacientov s inhibítormi liečených emicizumabom odstránili Port-A-Cath pod clonou 1–2 dávok rFVIIa [33] a Badle et al. u 9 detí dokonca bez liečby BPA, len pod clonou kyseliny tranexámovej (15mg/kg 3× denne počas 10 dní) [34]. Santagostino et al. prezentovali doteraz najväčší súbor operácií u pacientov liečených emicizumabom v štúdiách HAVEN 1–4 [28]. Až 141 z 215 malých operácií sa vykonalo bez hemostatickej prípravy, z nich 91 % prebehlo bez liečených krvácavých komplikácií. Bez substitúcie prebehlo aj 25 implantácií CVK, s výskytom krvácania len v 2 prípadoch. Z 9 implantácií CVK clonených 1–2 dávkami rFVIIa boli dve komplikované krvácaním s potrebou 1–6 dávok rFVIIa. Väčšina veľkých operácií však bola clonená hemostatickou liečbou s 20% výskytom krvácavých komplikácií [28].
Na základe hromadiacich sa skúseností s manažmentom operácií u pacientov s inhibítoromi liečených emicizumabom dnes prevláda názor, že pri výkonoch s malým rizikom krvácania nie je vždy potrebná súčasná liečba BPA, ale musí sa prísne sledovať výskyt abnormálneho krvácania [35]. Pri veľkých chirurgických výkonoch sa odporúča predoperačná a pooperačná hemostatická liečba. Liekom prvej voľby je rFVIIa. V druhej línii, pri neúčinnosti rFVIIa sa pri nízkom titri inhibítora < 5 BU/ml použije koncentrát FVIII v adekvátnom dávkovaní a pri vysokom titri inhibítora aPCC v redukovaných dávkach 20–25 IU/kg [32,35]. Preto je dôležité aktuálne overenie titra inhibítora pred každou plánovanou operáciou.
ZÁVER
Indukcia imunotolerancie má v manažmente pacientov s inhibítormi kľúčový význam aj v ére nefaktorovej liečby, ktorá však môže zmeniť prístup k ITI, jej náročnosť a elimináciou krvácaní počas ITI aj prognózu ITI. Profylaxia emicizumabom je jednoznačne indikovaná u pacientov s perzistujúcim inhibítorom ako aj u pacientov, u ktorých je štandardná profylaxia s FVIII neúčinná alebo pre ňu existujú objektívne prekážky. Najbližší čas ukáže reálne možnosti širšieho použitia nefaktorovej liečby aj u pacientov bez inhibítorov, prípadne možnosti ovplyvnenia alebo oddialenia vzniku inhibítorov u detí liečených iniciálne emicizumabom. Pacienti liečení emicizumabom majú byť sledovaní v hemofilických centrách komplexnej starostlivosti. Pri rozhodovaní o manažmente krvácania a chirurgického výkonu sa možno opierať o výsledky publikovaných štúdií, každý pacient však vyžaduje prísne individualizovaný prístup a pri liečbe PBA aj monitorovanie markerov aktivácie hemostázy.
PODIEL AUTOROV NA PRÁCI
A.B. aktualizovala výsledky imunotolerančnej indukcie u pacientov s inhibítormi, vyhodnotila liečbu emicizumabom a napísala rukopis. A.B.,T.P., D.J. a A.K. sa podieľali na diagnostike a liečbe pacientov s inhibítormi, manažmente a monitorovaní imunotolerančnej liečby a liečby emicizumabom. Všetci spoluautori revidovali manuskript a potvrdili finálnu verziu rukopisu.
PREHLÁSENIE AUTOROV
Autorka práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nie je v strete záujmov, a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou spoločnosťou. Toto prehlásenie sa týka aj všetkých spoluautorov.
Do redakce doručeno dne 9. 7. 2020.
Přijato po recenzi dne 11. 9. 2020.
prof. MUDr. Angelika Bátorová, PhD.
Klinika hematológie a transfúziológie LF UK, SZU
Národné hemofilické centrum – EHCCC
Univerzitná nemocnica Bratislava
Antolská 11, 85107 Bratislava
Slovenská republika
e-mail: batorova@hotmail.sk
Zdroje
1. Rota M, Cortesi PA, Steinitz‐Trost KN, et al. Meta‐analysis on incidence of inhibitors in patients with haemophilia A treated with recombinant factor VIII products. Blood Coagul Fibrinolysis. 2017; 28 : 627–637.
2. Carcao M, Escuriola-Ettingshausen C, Santagostino E, et al. The changing face of immune tolerance induction in haemophilia A with the advent of emicizumab. Haemophilia. 2019; 25 (4): 676–684.
3. Máchal J. Farmakokintika v léčbě hemofilie. Transfuze Hematol Dnes. 2019; 25 (3): 230–240.
4. Walsh CE, Soucie JM, Miller CH; United States Hemophilia Treatment Center Network. Impact of inhibitors on hemophilia A mortality in the United States. Am J Hematol. 2015; 90 (5): 400–405.
5. Hay CR & DiMichele DM; International Immune Tolerance Study. The principal results of the International Immune Tolerance Study: a randomized dose comparison. Blood. 2012; 119 (6): 1335–1344.
6. Coppola A, Margaglione M, Santagostino E, et al. Factor VIII gene (F8) mutations as predictors of outcome in immune tolerance induction of hemophilia A patients with high-responding inhibitors. J Thromb Haemost. 2009; 7 (11): 1809–1815.
7. Collins PW, Chalmers E, Hart DP, et al. Diagnosis and treatment of factor VIII and IX inhibitors in congenital haemophilia: UK Haemophilia Centre Doctors Organization. Br J Haematol. 2013; 160 : 153–170.
8. Kreuz W, Escuriola Ettingshausen C, Vdovin V, et al. First prospective report on immune tolerance in poor risk haemophilia A inhibitor patients with a single factor VIII/von Willebrand factor concentrate in an observational immune tolerance induction study. Haemophilia. 2016; 22 : 87–95.
9. Ljung R, Auerswald G, Benson G, et al. Inhibitors in haemophilia A and B: Management of bleeds, inhibitor eradication and strategies for difficult-to-treat patients. Eur J Haematol. 2019; 102 (2): 111–122.
10. Batorova A, Jankovicova D, Morongova A, et al. Inhibitors in severe hemophilia A: 25-year experience in Slovakia. Semin Thromb Hemost. 2016; 42 (5): 550–562.
11. Kitazawa T, Igawa T, Sampei Z, et al. A bispecific antibody to factors IXa and X restores factor VIII hemostatic activity in a hemophilia A model. Nat Med. 2012; 18 : 1570–1574.
12. Hart DP, Kessler CM, Aledort L. Re-personalization and stratification of hemophilia care in an evolving treatment landscape, Hematology. 2019; 24 (1): 737–741.
13. Oldenburg J, Mahlangu JN, Kim B, et al. Emicizumab prophylaxis in hemophilia A with inhibitors. N Engl J Med. 2017; 377 : 809–818.
14. Young G, Liesner R, Chang T, et al. A multicenter, open-label phase 3 study of emicizumab prophylaxis in children with hemophilia A with inhibitors. Blood. 2019; 134 (24): 2127–2138.
15. Mahlangu J, Oldenburg J, Paz-Priel I, et al. Emicizumab prophylaxis in patients who have hemophilia A without inhibitors. N Engl J Med. 2018; 379 : 811–822.
16. Pipe SW, Shima M, Lehle M, et al. Efficacy, safety, and pharmacokinetics of emicizumab prophylaxis given every 4 weeks in people with haemophilia A (HAVEN 4): a multicentre, open-label, non-randomised phase 3 study. Lancet Haematol. 2019; 6 (6): e295–e305.
17. Prigancová T, Jankovičová D, Kyselová A, et al. Mutácie génu F8 u pacientov s ťažkým stupňom hemofílie A a výskyt inhibítorov FVIII. Transfuze Hematol Dnes. 2018; 24 (3): 94–206.
18. Tripodi A, Santoro RC, Testa S, et al. Position paper on laboratory testing for patients with haemophilia. A consensus document from SISET, AICE, SIBioC and SIPMeL. Blood Transfus. 2019; 17 : 229–236.
19. Adamkewicz JI, Chen DC, Paz-Priel I. Effects and interferences of emicizumab, a humanised bispecific antibody mimicking activated factor VIII cofactor function, on coagulation assays. Thromb Haemost. 2019; 119 (07): 1084–1093.
20. Beutel K, Hauch H, Rischewski J, et al. ITI with high-dose FIX and combined immunosuppressive therapy in a patient with severe haemophilia B and inhibitor. Haemostaseologie. 2009; 29 (2): 155–157.
21. Iorio A, Blanchette V, Blatny J, et al. Estimating and interpreting the pharmacokinetic profiles of individual patients with hemophilia A or B using a population pharmacokinetic approach: communication from the SSC of the ISTH. J Thromb Haemost. 2017; 15 (12): 2461–2465.
22. Santagostino E, Young G, Escuriola Ettingshausen C. Inhibitors: a need for eradication? Acta Haematol. 2019; 141 : 151–155.
23. Nakar C, Shapiro A. Hemophilia A with inhibitor: Immune tolerance induction (ITI) in the mirror of time. Transfus Apher Sci. 2019; 58 (5): 578–589.
24. Young G. Implementing emicizumab in hemophilia inhibitor management: emicizumab should be prescribed after tolerance. Blood Adv. 2018; 2 (20): 2780–2782.
25. Oldenburg J, Young G, Santagostino E, Escuriola Ettingshausen C. The importance of inhibitor eradication in clinically complicated hemophilia A patients. Expert Review Hematol. 2018; 11 (11): 857–862. |
26. Batsuli G, Zimowski KL, Tickle K, et al. Immune tolerance induction in paediatric patients with haemophilia A and inhibitors receiving emicizumab prophylaxis. Haemophilia. 2019; 25 (5): 789–796.
27. Paz-Priel I, Chang T, Asikanius E, et al. Immunogenicity of emicizumab in people with hemophilia A (PwHA): results from the HAVEN 1–4 studies. Blood. 2018; 132 (Suppl 1): 633.
28. Santagostino E, Oldenburg J, Chang T, et al. Surgical experience from four phase III studies (HAVEN 1-4) of emicizumab in persons with haemophilia A (PwHA) with or without FVIII inhibitors [abstract OC 60.1]. Res Pract Thromb Haemost. 2019; 4 (Suppl 1): 115.
29. Linari S, Castaman G. Concomitant use of rFVIIa and emicizumab in people with hemophilia A with inhibitors: current perspectives and emerging clinical evidence. Ther Clin Risk Manag. 2020; 16 : 461–469.
30. Collins PW, Liesner R, Makris M, et al. Treatment of bleeding episodes in haemophilia A complicated by a factor VIII inhibitor in patients receiving emicizumab. Interim guidance from UKHCDO Inhibitor Working Party and Executive Committee Guidelines. Haemophilia. 2018; 24 : 344–347.
31. Castaman G, Santoro C, Coppola A, et al. Emergency management in patients with haemophilia A and inhibitors on prophylaxis with emicizumab: AICE practical guidance in collaboration with SIBioC, SIMEU, SIMEUP, SIPMeL and SISET. Blood Transfus. 2020; 18 (2): 143–151.
32. Susen S, Gruel Y, Godier A, et al. Management of bleeding and invasive procedures in haemophilia A patients with inhibitor treated with emicizumab (Hemlibra®): Proposals from the French network on inherited bleeding disorders (MHEMO), the French Reference Centre on Haemophilia, in collaboration with the French Working Group on Perioperative Haemostasis (GIHP). Haemophilia. 2019; 25 (5): 731–737.
33. McCary I, Guelcher C, Kuhn J, et al. Real-world use of emicizumab in patients with haemophilia A: Bleeding outcomes and surgical procedures. Haemophilia. 2020; 26 (4): 631–636.
34. Badle S, Gosrani D, Taylor A, et al. Surgical experience with emicizumab: a single centre experience with central venous access device removal [abstract PB1154]. Res Pract Thromb Haemost. 2020; 4 (Suppl 1): 584-585.
35. Holstein K, Albisetti M, Bidlingmaier C, et al. Practical guidance of the GTH Haemophilia Board on the use of emicizumab in patients with haemophilia A. Haemostaseologie. 2020; Publikováno elektronicky 25. června 2020. doi: 10.1055/a-1127-6476.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2021 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- ZMĚNY V IMUNITNÍM SYSTÉMU U NELÉČENÝCH NEMOCNÝCH S CHRONICKOU LYMFOCYTÁRNÍ LEUKEMIÍ – ČÁST 2: NESPECIFICKÁ IMUNITA.
-
Doc. MUDr. Miroslav Tomíška, CSc.,
slaví sedmdesáté životní jubileum - Zemřel profesor Jan Evangelista Dyr
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
- Jaké dávky inhibitorů tyrozinkináz jsou v léčbě pacientů s chronickou myeloidní leukemií optimální?
- EDITORIAL
- Von Willebrandova choroba – porovnanie dvoch metód analýzy multimérov von Willebrandovho faktora
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Bolesti svalů jako vzácný autoimunitní projev při monoklonální IgM gamapatii – popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů
- Inhibítory faktora VIII – Výsledky imunotolerančnej indukcie v Národnom hemofi lickom centre a nové možnosti a prvé skúsenosti s liečbou bišpecifi ckou protilátkou (emicizumab) u pacientov s inhibítormi na Slovensku
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 3., rok 2021
- Heparinem indukovaná trombocytopenie
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Heparinem indukovaná trombocytopenie
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



