-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
DIAGNOSTIKA A LÉČBA WALDENSTRÖMOVY MAKROGLOBULINEMIE
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. Supplementum 1, p. 7-33.
Kategorie: Doporučení
A. DOPORUČENÍ PRO DIAGNOSTIKU WALDENSTRÖMOVY MAKROGLOBULINEMIE (WM)
- Monitorování koncentrace monoklonálního imunoglobulinu (MIg) IgM by mělo být prováděno v jedné laboratoři a za použití vždy stejné metodologie.
- Vyšetření chladových aglutininů a kryoglobulinu je doporučené v době diagnózy a u pacientů s klinickými projevy poruch prokrvení a/nebo vaskulitidy či laboratorními projevy hemolýzy.
- Vyšetření kostní dřeně, nejlépe trepanobiopsie s adekvátní analýzou metodou průtokové cytometrie, je nezbytné pro stanovení diagnózy WM.
- Biopsie tkáně je doporučována u všech pacientů se suspektní histologickou transformací (u části nemocných s WM může dojít k transformaci do difuzního velkobuněčného B-lymfomu (DLBCL)).
- Testování bodové mutace L265P v genu MYD88 je doporučeno u všech pacientů se zvažovanou diagnózou WM.
- U pacientů se symptomatickou periferní neuropatií je doporučováno vyšetření specifických protilátek proti glykoproteinu myelinu (MAG) nebo proti gangliosidu M1, tedy vyšetření anti-MAG a anti-GM-1 protilátek.
- Neurofyziologické testování pomocí elektromyografie (EMG) a neurografie (kondukční studie) je doporučeno při podezření na neuropatii a slouží k určení typu nervového poškození a usměrňuje další diagnostiku.
- K potvrzení diagnózy Bingova-Neelova syndromu je potřebná:
- a) histologicky potvrzená infiltrace struktur centrálního nervového systému (CNS) buňkami lymfoplasmocytárního lymfomu (LPL), například pomocí stereotaktické biopsie, nebo
- b) cytologický průkaz buněk LPL v likvoru bez klinických známek transformace v agresivnější lymfom a průkaz monoklonální B populace v likvoru pomocí metod průtokové cytometrie nebo molekulárně-genetický průkaz klonality pomocí přestavby genu pro imunoglobulin nebo průkaz mutace L265P v genu MYD88.
- Provedení vyšetření výpočetní tomografií (CT) nebo nukleární magnetickou rezonancí (MR) (hrudníku, břicha, pánve) nebo celotělovou pozitronovou emisní tomografií v kombinaci s CT (PET/CT) je doporučováno u všech symptomatických pacientů před zahájením léčby.
- Kontrastní vyšetření centrální nervové soustavy MR s gadoliniem je doporučené provádět před samotným vyšetřením mozkomíšního moku, z důvodu možného falešného zobrazení sycení leptomening. Rozsah MR vyšetření má být předem zkonzultován s radiologem pro výběr vhodných sekvencí a anatomických oblastí.
- Pro hodnocení rizika u symptomatických pacientů slouží mezinárodní prognostický skórovací systém pro nemocné s Waldenströmovou makroglobulinemií – IPSSWM.
B. DOPORUČENÍ PRO LÉČBU WALDENSTRÖMOVY MAKROGLOBULINEMIE
- Pacienty s asymptomatickou formou WM je vhodné pouze sledovat. Je doporučeno aktivní pravidelné celoživotní sledování. Sledování probíhá v tříměsíčních intervalech první 3 roky, poté v půlročních intervalech následující 2 roky a poté jednou ročně při stabilním stavu (úroveň důkazu III, stupeň doporučení B).
- Koncentrace IgM samotná není indikací k zahájení léčby (úroveň důkazu IIb, stupeň doporučení B).
- U pacientů s hyperviskozitou je indikovaná výměnná plazmaferéza před samotným zahájením systémové léčby (úroveň důkazu III, stupeň doporučení B).
- Pacienti se symptomatickou WM by měli být léčeni režimem obsahujícím rituximab (úroveň důkazu Ib, stupeň doporučení A).
- Monoterapie rituximabem je kontraindikována u pacientů s hyperviskozitou před provedením výměnné plazmaferézy. V případě vysoké koncentrace IgM (> 40 g/l) není monoterapie rituximabem vhodná (úroveň důkazu IV, stupeň doporučení C).
- Režim BR (bendamustin, rituximab) je preferovaným režimem pro nově léčené pacienty s velkou nádorovou masou, hyperviskozitou a potřebou rychlého nástupu léčebné odpovědi (úroveň důkazu IV, stupeň doporučení C).
- Režim DRC (dexamethason, rituximab, cyklofosfamid) je alternativou režimu BR pro nově léčené pacienty s malou nádorovou masou, bez hyperviskozity a nevyžadující rychlý nástup léčebné odpovědi, nebo v případě, že je režim BR rizikový (úroveň důkazu IV, stupeň doporučení C).
- Monoterapie ibrutinibem je alternativou pro pacienty nevhodné k imunochemoterapii (úroveň důkazu IIa, stupeň doporučení B).
- Pacienty v remisi po léčbě je vhodné pravidelně sledovat do symptomatické progrese (úroveň důkazu IV, stupeň doporučení C).
- Udržovací léčba rituximabem je doporučená u všech pacientů v remisi s dobrou tolerancí rituximabu (úroveň důkazu IIb, stupeň doporučení B).
- Léčbu purinovými analogy provází infekční a myelosupresivní komplikace a významně vyšší výskyt sekundárních malignit, a proto není vhodná pro pacienty s nově léčenou WM (úroveň důkazu IIa, stupeň doporučení B).
Léčba druhé a další linie
- Pacienti bez adekvátní odpovědi na režim imunochemoterapie v první linii s přetrvávajícími symptomy nebo pacienti s primárně refrakterní WM mají být léčeni ibrutinibem (úroveň důkazu IIa, stupeň doporučení B).
- Opakování režimu imunochemoterapie první linie je možné u pacientů s pozdním relapsem s dlouhým trváním remise (obvykle čas do zahájení další léčby ≥ 3 roky) a dobrou tolerancí předchozího režimu (úroveň důkazu IIa, stupeň doporučení B).
- Pacienti se symptomatickým pozdním relapsem by měli znovu dostat režim obsahující rituximab (úroveň důkazu IIa, stupeň doporučení B).
- Režim obsahující bortezomib je potenciální alternativou léčby symptomatického relapsu WM, preferovány jsou režimy s týdenním podáváním bortezomibu v podkožní formě s cílem předejít neurologické toxicitě, doporučována je profylaxe proti reaktivaci viru pásového oparu (herpes zoster virus – HZV) (úroveň důkazu IIa, stupeň doporučení B).
- V léčbě relapsu jsou používány režimy obdobné jako v léčbě první linie, ale také režimy obsahující bortezomib (bortezomib rituximab ± dexamethason). Režimy obsahující purinová analoga (například fludarabin nebo cladribin spolu s rituximabem, případně i cyklofosfamidem; FR, FCR, CladR) je optimální používat pro léčbu opakovaného relapsu (více než 3. linie léčby) z důvodu vysoké pravděpodobnosti vzniku sekundárního nádoru. Volba režimu vyžaduje komplexní zhodnocení klinického stavu u konkrétního pacienta a také zvážení potenciální možnosti provedení transplantace krvetvorných buněk (SCT) (úroveň důkazu IIa, stupeň doporučení B).
- Léčba ibrutinibem je vhodná pro léčbu relapsu pacientů s WM, zejména s přítomností mutace MYD88 (úroveň důkazu Ib, stupeň doporučení A).
- Pacienty s klinicky asymtomatickým relapsem projevujícím se pouze postupným vzestupem MIg je vhodné pouze sledovat a léčbu zahájit až v případě klinicky významné progrese WM (úroveň důkazu IV, stupeň doporučení C).
- Mladší pacienti s chemosenzitivním relapsem WM jsou kandidáty pro provedení SCT a měli by být diskutováni s transplantačním centrem (úroveň důkazu III, stupeň doporučení B).
V ČR v roce 2019 je použití rituximabu, bortezomibu, bendamustinu a ibrutinibu při léčbě WM možné pouze po schválení revizním lékařem příslušné zdravotní pojišťovny. Standardně jsou v ČR pro léčbu Waldenströmovy makroglobulinemie hrazena zatím pouze klasická cytostatika, kortikoidy a fludarabin.
1 METODICKÉ POSTUPY TVORBY DOPORUČENÍ
Předložené doporučení bylo vypracováno na základě medicíny založené na důkazech s cílem popsat všechny důležité oblasti diagnostiky a léčby Waldenströmovy makroglobulinemie. Úrovně důkazů a stupně doporučení standardně používané v doporučeních jsou uvedeny v tabulce 1.
Tab. 1. Úrovně důkazu a stupně doporučení používané ve směrnicích (guidelines) a principech medicíny založené na důkazech (evidence based medicine) 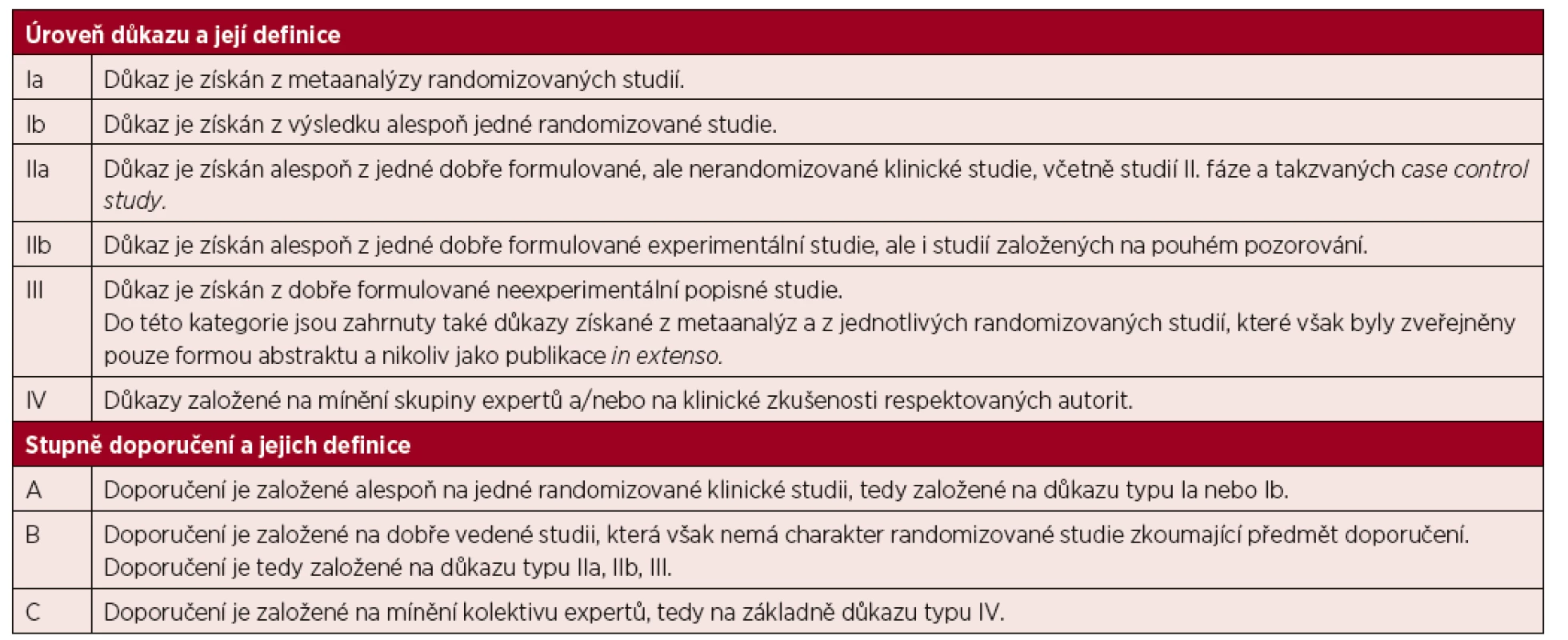
2 EPIDEMIOLOGIE
Waldenströmova makroglobulinemie (WM) je vzácně se vyskytující B-lymfoproliferativní onemocnění s incidencí 3–3,8 /1 milion obyvatel [Wang, 2012; Vos, 2013]. Medián věku v době diagnózy je 63–75 let [Treon, 2009; Teras, 2016; Kastritis, 2015].
3 DIAGNÓZA
Diagnóza WM vyžaduje jak průkaz lymfoplazmocytárních buněk/lymfoplazmocytárního lymfomu (LPL) v kostní dřeni, tak průkaz monoklonálního imunoglobulinu (MIg) typu IgM v séru [Owen, 2003; WHO, 2017]. WM vždy postihuje kostní dřeň, méně často současně i lymfatické uzliny a slezinu. Vyšetření kostní dřeně pomocí trepanobiopsie a/nebo aspirace je proto nevyhnutelné pro stanovení diagnózy. Při imunofenotypizačním vyšetření B-lymfocytů je pak pro WM typická přítomnost následujících znaků: CD19, CD20, CD22lo, CD25, CD27 a IgM, zatímco znaky CD5, CD10, CD11c, CD23 a CD103 ve většině případů exprimovány nejsou [Paiva, 2014; Owen, 2014; Jelinek, 2017]. Podpůrným vyšetřením je stanovení přítomnosti mutace L265P v genu MYD88, která bývá detekována přibližně v 90 % případů WM. Samotná mutace MYD88L265P však není specifická pro toto onemocnění [Treon, 2012; Treon, 2015]. Diagnostická kritéria shrnují tabulky 2 a 3.
Tab. 2. Diagnostická kritéria WM [Owen, 2003] ![Diagnostická kritéria WM [Owen, 2003]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/0c491d4e5b769c70c8a6681f0d84e18b.png)
Tab. 3. Diagnostická kritéria pro monoklonální gamapatii nejasného významu (MGUS) s IgM, symptomatickou a asymptomatickou Waldenströmovu makroglobulinemii (WM) [Owen, 2003] ![Diagnostická kritéria pro monoklonální gamapatii nejasného
významu (MGUS) s IgM, symptomatickou a asymptomatickou Waldenströmovu
makroglobulinemii (WM) [Owen, 2003]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/1df49e9b32e345ad95c322cdbaca0279.png)
3.1 Příznaky nemoci
Klinické příznaky u pacientů s WM mohou být velice různorodé. Jsou způsobeny infiltrací kostní dřeně s potlačením fyziologické krvetvorby (anemie, trombocytopenie, neutropenie), dále extramedulární proliferací (lymfadenopatie, organomegalie včetně splenomegalie), dále monoklonálním imunoglobulinem (periferní neuropatie, hyperviskozita, kryoglobulinemie, nemoc chladových aglutininů, sekundární amyloidóza) a paraneoplasticky (B-symptomy, kožní a krvácivé projevy) [Treon, 2015]. Příznaky WM přehledně shrnuje tabulka 4.
Tab. 4. Příznaky Waldenströmovy makroglobulinemie (převzato a upraveno podle [Adam, 2007]) ![Příznaky Waldenströmovy makroglobulinemie (převzato a upraveno podle [Adam, 2007])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/aafebba05d077eec3bcef1ee14d3af12.png)
3.2 Doporučená vyšetření
Pokud je stanovena diagnóza WM, pak je doporučeno provést komplexní vyšetření, jehož cílem je zhodnotit rozsah nemoci a detekovat včas případné komplikace. Rozsah těchto vyšetření je uveden v tabulce 5.
Tab. 5. Vyšetření prováděná u Waldenströmovy makroglobulinemie 
3.2.1 Elektroforéza séra a moče s imunofixací, kvantitativní stanovení imunoglobulinů
Základním vyšetřením u WM je průkaz zvýšené koncentrace monoklonálního, ale i celkového imunoglobulinu typu IgM. Stanovení monoklonálního imunoglobulinu (MIg) slouží pro sledování léčebné odpovědi a progrese a nepřímo pro monitorování míry infiltrace kostní dřeně lymfoplazmocytárním lymfomem (LPL). Korelace mezi hladinou MIg a mírou infiltrace kostní dřeně ale není vždy lineární [Treon, 2015]. Ve dvou třetinách případů jsou snížené koncentrace imunoglobulinů tříd IgG a IgA [Hunter, 2010]. Monitorování koncentrace MIg IgM by mělo být prováděno vždy ve stejné laboratoři a za použití stejné metodologie (densitometrie či nefelometrie) [Owen, 2013]. První vyšetření má proběhnout s odběrem vzorků do teplé lázně s vyšetřením na přítomnost kryoglobulinů. Aktivita kryoglobulinů může vést k měření falešně nižších hodnot MIg [Stone, 2009].
Elektroforéza bílkovin séra by měla být vždy doplněná imunofixací, jelikož samostatné kvantitativní měření může přehlédnout nízké koncentrace paraproteinu. Vyšetřování sérových volných lehkých řetězců není rutinně doporučováno. Výjimkou jsou specifické situace, jako je například podezření na amyloidózu z lehkých řetězců [Leleu, 2011]. Elektroforéza a imunofixace 24hodinového sběru moči může odhalit Bence Jonesovu proteinurii, odlitkovou nefropatii (agregáty volných lehkých řetězců; free light chain FLC a Tammův-Horsfallův protein) či významnou selektivní nebo neselektivní proteinurii v rámci postižení ledvin [Gnemmi, 2012; Vos, 2015].
3.2.2 Cytogenetické vyšetření
Cytogenetické vyšetření není běžně vyžadováno, jelikož u WM nebyly popsány charakteristické cytogenetické aberace, které by potvrdily přítomnost onemocnění, resp. které by měly prognostický význam. Přesto jsou u WM některé cytogenetické změny obvyklé, např. delece chromozomu 6q a trizomie chromozomu 4 [Schop & Fonseca, 2003; Ocio, 2007; Braggio & Fonseca, 2013; Nguyen-Khac, 2013]. Cytogenetické vyšetření může posloužit i v diferenciální diagnostice k odlišení od jiných lymfoproliferací.
3.2.3 Molekulárně genetic ké vyšetření
Molekulárně genetické vyšetření mutací v genech MYD88 a CXCR4 významně zpřesňují diagnostiku WM. Bodová mutace L265P genu MYD88 je přítomna u 90–95 % případů WM a může být přítomna i u monoklonální gamapatie nejasného významu (MGUS) s IgM cca v 50 % případů [Treon, 2012; Jimenéz, 2013; Poulain, 2013]. Méně často (kolem 10 % případů) se vyskytuje u jiných lymfoproliferací, jako je lymfom marginální zóny či chronická lymfocytární leukemie, a nebyla popsána u mnohočetného myelomu [Chapman, 2011; Puente, 2011; Wang, 2011; Troen, 2013]. V 5–10 % případů není tato mutace přítomna (jde o tzv. wild-type MYD88), přičemž její absence je obvykle spojena s horší léčebnou odezvou (rezistence na ibrutinib) a nepříznivou prognózou [Treon, 2015]. Vzácně byly popsány i alternativní mutace genu MYD88, které se běžně nevyšetřují [Treon, 2015].
Somatické mutace v genu pro chemokinový receptor CXCR4 provázejí 30–40 % případů WM, vždy v asociaci s mutací genu MYD88 [Treon, 2014]. Byly již popsány desítky různých mutací tohoto genu. Ve studiích pacientů léčených ibrutinibem představovala přítomnost mutace CXCR4 faktor relativní rezistence [Treon, 2014; Treon, 2015]. Vysoká míra shody s kostní dření (≥ 90 %) umožňuje testovat uvedené mutace MYD88 a CXCR4 i z periferní krve [Growková, 2017].
3.2.4 Zobrazovací vyšetření
Infiltrace kostní dřeně u WM je typicky difuzní. Osteolýza obdobná jako u myelomu se vyskytuje raritně. Bývá ale přítomno extramedulární postižení v podobě doprovodné lymfadenopatie, hepatosplenomegalie a výpotků. Mimokostní postižení bývá zjištěno u přibližně 15 % případů v době diagnózy a až v 60 % případů v období relapsu [Treon, 2009]. U pacientů je k dokumentaci extramedulárního postižení doporučeným vyšetřením kontrastní CT krku, hrudníku, břicha a pánve. V případě nejednoznačných nálezů může PET/CT přispět k diferenciální diagnostice, posouzení rozsahu choroby anebo při podezření na lymfomovou transformaci [Banwait, 2011; Castilo, 2016].
3.3 Speciální vyšetření
Unikátní biochemické a imunologické vlastnosti molekuly monoklonálního imunoglobulinu IgM a biologické chování WM mohou vést k neobvyklým projevům a komplikacím. V následující části upozorňujeme na specifické situace a indikovaná speciální vyšetření ve snaze o jejich časnou detekci a pro výběr správné léčby.
3.3.1 Vyšetření při anemii
Cytopenie a speciálně anemie jsou častým projevem a důvodem k zahájení léčby u pacientů s WM [Adam, 2007]. Příčina anemie u WM je multifaktoriální a mimo přímou infiltraci kostní dřeně buňkami LPL, může být způsobena dilucí v rámci hyperviskozity, hemolýzou nebo sideropenií. Pacienti s WM a anemií s velmi nízkou saturací transferinu (< 10 %) a nereagující na orální léčbu železem mohou profitovat z parenterální suplementace železa [Treon, 2013]. Mezi méně časté příčiny anemie patří autoimunitní hemolýza. I když je výsledek přímého antiglobulinového testu pozitivní až u 10 % pacientů s WM, klinicky významná hemolýza se rozvíjí v méně než 5 % [Poulain, 2006]. Mimo standardní vyšetření přímým a nepřímým antiglobulinovým testem je důležité doplnit i vyšetření chladových aglutininů. Nemoc chladových aglutininů (CAD) vede k mírné chronické hemolýze exacerbované chladem, nicméně vzácně může způsobit i těžkou anemii s hladinou hemoglobinu < 70 g/l. CAD se vyskytuje u < 10 % pacientů s WM a bývá asociována s vysokými titry protilátek (obvykle > 1 : 1000), typicky u izotypu IgM kappa reagujícím s antigenem I/i [Ghobrial, 2012].
3.3.2 Vyšetření při hyperviskózním syndromu a kryoglobulinemii
Biochemické vlastnosti molekuly IgM a vysoké koncentrace MIg typické pro WM významně zvyšují viskozitu séra a vedou k reologickým poruchám v podobě symptomatické hyperviskozity (HVS) u < 15 % pacientů v době diagnózy [Gustine, 2017]. Současně přítomná aktivita kryoglobulinu může ještě více zhoršit projevy HVS. Proto by měla být přítomnost kryoglobulinu vyšetřena vždy v případě HVS. Snaha o korekci anemie podáním transfuzních přípravků může obdobně vést ke zhoršení viskozity. Ke klinickým projevům HVS patří spontánní epistaxe, nové nebo zhoršené bolesti hlavy, rozmazané vidění nelepšící se korekční pomůckou, zhoršení sluchu, tinitus a vertigo [Stone, 2012]. HVS se prakticky nevyskytuje při hodnotách celkového IgM pod 30 g/l [Gustine, 2017; Ghobrial, 2012]. Medián času do rozvoje symptomatického HVS se zkracuje s narůstajícími hodnotami celkového IgM. Při hodnotách v rozmezích 30–40 g/l, 40–50 g/l a 50–60 g/l byl pozorován medián 156, 36 a 32 měsíců do rozvoje symptomatického HVS. Při extrémně vysokých hodnotách celkového IgM přes 60 g/l dochází k rozvoji velice časně (medián 3 měsíce) [Gustine, 2017]. Viskozita séra nemusí vždy korelovat s klinickými projevy [Castilo, 2016]. Proto je doporučeno vyšetření očního pozadí, které může napomoci k odhalení i časných a bezpříznakových fází hyperviskozity. První změny lze pozorovat v periferních okrajích sítnice v podobě mikrokrvácení a změn vinutí retinálních cév [Menke, 2006]. Změny na sítnici z důvodu HVS jsou indikací k plazmaferéze a časnému zahájení systémové léčby [Castilo, 2016]. Pravidelné vyšetření očního pozadí v intervalu 12 měsíců je doporučeno u pacientů s hodnotami celkového sérového IgM > 30 g/l.
Kryoglobulinemie I. typu je způsobena MIg typu IgM, který v chladu gelifikuje a tak způsobuje poruchu prokrvení malých cév. Porucha prokrvení vede k projevům podobným Raynaudovu fenoménu. Laboratorně jsou kryoglobuliny (typu I) detekovány až u 20 % pacientů s WM, symptomy se objeví u méně než 5 % [Ghobrial, 2012].
3.3.3 Vyšetření při periferních a centrálních neurologických projevech
Periferní neuropatie (PNP) je u pacientů s WM velice častá. Již v době diagnózy má 20 % pacientů určité projevy PNP a téměř polovinu postihne v průběhu nemoci [Levine, 2006]. Etiologie PNP může být velice různorodá od autoimunitního poškozování, depozice imunoglobulinu, amyloidózy a kryoglobulinemie způsobené MIg po přímou lymfoplasmocytární infiltraci nervů. Jelikož se PNP vyskytuje u 2–8 % běžné populace, je vždy nutné zvážit i nenádorovou etiologii, jako jsou diabetes mellitus, alkohol, deficit kobalaminu a thia-minu, infekce, radikulopatie, vaskulitidy a chronická demyelinizační polyneuropatie [Martyn and Huges, 1997]. Úzká spolupráce se specialistou neurologem je velice důležitá. Nejtypičtější forma PNP asociované s WM je chronická, měsíce až léta pomalu progredující, symetrická, distální a převážně senzorická nebolestivá demyelinizační PNP s dominujícími projevy v podobě nestability, nerovnováhy, zhoršené citlivosti, třesem a slabostí dolních končetin [Baehring, 2008].
V případě klinického obrazu PNP je vhodné doplnit elektromyografii (EMG) a neurografii (kondukční studie – vyšetření vodivosti nervů). Obvyklý je obraz demyelinizace. Rychle progredující neuropatie s EMG známkami axonálního poškození u pacienta s WM je podezřelá ze sekundární amyloidózy [D’Sa, 2017]. Dalším diagnostickým krokem je odběr protilátek proti nervovým strukturám, tzv. anti-MAG protilátek. Anti-MAG protilátky v séru bývají pozitivní až v 50 % případů [Baldini, 1994]. Klinicky významné jsou vysoké titry protilátek nebo silně pozitivní výsledky [Nobile-Orazio, 1989]. Protilátky proti gangliosidům anti-GM-1 jsou asociovány s motorickou neuropatií [Vlam, 2015]. Diagnostika PNP u pacientů s WM je velice komplexní, a proto odkazujeme na podrobné mezinárodní konsenzuální doporučení pracovní skupiny IWWM-8 [D’Sa, 2017].
Infiltrace centrálního nervového systému buňkami LPL je velice vzácným projevem WM. Odhadovaný výskyt podle retrospektivních analýz je kolem 1 % pacientů s WM [Simon, 2015; Castillo, 2016]. Na Bing-Neelův syndrom (BNS) je nutné myslet vždy v případě vzniku centrálních neurologických deficitů, bolestí hlavy, při záchvatech, kvantitativních, kvalitativních poruchách vědomí a kognitivních a psychiatrických změnách. BNS může ale probíhat i pod obrazem atypické neuropatie s dominujícím senzorickým deficitem [Simon, 2015]. Je nutné upozornit, že klinický průběh může být velice variabilní a až u pětiny pacientů trvá více než rok od prvních neurologických projevů ke stanovení diagnózy [Simon, 2015]. V rámci BNS může být přítomná jak leptomeningeální, tak intraparenchymatózní infiltrace CNS, nebo jejich kombinace. Pro ustanovení diagnózy BNS je doporučena bioptická verifikace CNS kompartmentu vždy, když je to možné. V případě rizikové lokalizace léze nebo při nebioptovatelném postižení je alternativou lumbální punkce. Pro potvrzení diagnózy lumbální punkcí je nutný cytologický průkaz LPL v kombinaci s adekvátní analýzou pomocí průtokové cytometrie s nálezem monoklonálních B-lymfocytů nebo molekulárně-genetický průkaz klonality pomocí přestavby genu pro imunoglobulin nebo průkaz mutace L265P v genu MYD88 v likvoru [Minnema, 2017]. Kontrastní magnetická rezonance (MR) mozku a míchy je zásadní pro lokalizaci postižení, které je přítomné ve většině případů BNS, a k odlišení od jiných procesů [Simon, 2015; Castillo, 2016]. Obvyklým obrazem je difuzní infiltrace leptomeningeálních a perivaskulárních prostor nebo izolovaný, eventuálně multifokální, intraparenchymatózní tumor [Kim, 2009; Drappatz, 2008]. Negativní nález na MR ale diagnózu BNS nevylučuje [Minnema, 2017]. Kontrastní vyšetření centrální nervové soustavy MR s gadoliniem je doporučené provádět před samotným vyšetřením mozkomíšního moku, z důvodu možného falešného zobrazení sycení leptomening. Rozsah MR vyšetření má být předem zkonzultován s radiologem pro výběr vhodných sekvencí a anatomických oblastí [Minnema, 2017].
3.3.4 Vyšetření při sekundární amyloidóze
Amyloidóza je vzácnou komplikací WM, ale s potencionálně závažnými důsledky. Časná a přesná diagnóza je nevyhnutelná pro zlepšení prognózy pacientů. Dominantně převažující formou u WM je amyloidóza z depozice lehkých řetězců (AL amyloidóza). V méně než 5 % případů může jít o formu AA amyloidózy z depozice cirkulujícího sérového amyoidu s odlišnou formou léčby [Terrier, 2008].
V případě systémové formy AL amyloidózy dochází k ukládání amyloidogenních řetězců a tvorbě nerozpustných fibril amyloidu v tkáních a orgánech. Typickými cílovými orgány jsou ledviny, srdce, játra a periferní nervy.
Zásadní je odhalení amyloidózy před rozvojem nezvratného orgánového poškození. Citlivými ukazateli orgánového poškození jsou natriuretický peptid B (BNP) nebo N-terminální fragment BPN (NT-proBNP) a troponin I pro srdce, albuminurie pro ledviny, zvýšení alkalické fosfatázy (ALP) a glutamyltranferázy (GMT) pro játra [Merlini, 2013]. Monitorování těchto ukazatelů lze využít v rámci pravidelného screeningu. Rychle se zhoršující bolestivá polyneuropatie tenkých vláken dolních končetin provázená vegetativní neuropatií nebo EMG známky axonálního poškození jsou podezřelé z přítomnosti amyloidózy [Rajkumar, 1998].
3.3.5 Vyšetření při krvácivých projevech
V případě spontánního krvácení nebo při časném krvácení po operaci nebo úrazu u pacienta s WM je nutné mimo trombocytopenie a hyperviskozity pomýšlet i na diagnózu získané von Willebrandovy choroby (vWCH). U pacientů s WM s vysokými hodnotami IgM, hyperviskozitou a kryoglobulinemií je riziko vWCH vyšší [Hivert, 2012]. V případě klinického podezření na získanou vWCH se vyšetřují plazmatické hladiny von Willebrandova faktoru (vWf), fVIII a funkční aktivita ristocetin kofaktoru (vWf:RCo).
4 PROGNÓZA
Waldenströmova makroglobulinemie je nemoc s poměrně příznivou prognózou. Podle dat Evropského registru v letech 2000–2014 bylo 10leté celkové přežití 69 % [Buske, 2018].
Osud nemocných je však velmi různorodý a více informací o prognóze u konkrétního pacienta nám mohou poskytnout prognostické indexy. Nejvýznamnějším z nich je Mezinárodní prognostický skórovací systém pro WM (IPSSWM), který je založen na hodnocení pěti klíčových parametrů, kterými jsou: věk, hodnota hemoglobinu, počet trombocytů, sérové koncentrace beta2-mikroglobulinu a MIg [Morel, 2009], podrobnosti jsou uvedeny v tabulce 6. Skórovací systém IPSSWM je určený pro symptomatickou formu WM. Kombinace vysokého rizika podle IPSSWM a zvýšené laktát dehydrogenázy může pomoci identifikovat podskupinu vysoce rizikových pacientů s celkovým přežitím < 3 roky [Kastritis, 2009].
Tab. 6. Mezinárodní prognostický skórovací systém pro nemocné s Waldenströmovou makroglobulinemií – IPSSWM [Morel, 2009] ![Mezinárodní prognostický skórovací systém pro nemocné
s Waldenströmovou makroglobulinemií – IPSSWM [Morel, 2009]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ec44058fb6007cc7798386591a7b235d.png)
5 VZOROVÝ ZÁPIS DIAGNÓZY WM
Doporučený zápis diagnózy WM by měl být v následujícím formátu: C88.0 Morbus Waldenström/Waldenströmova makroglobulinemie; datum diagnózy, riziko dle IPSSWM nízké/intermediární/vysoké (v případě symptomatické nemoci); rozsah postižení (CT, MR nebo PET/CT trupu v případě symptomatické nemoci); indikace k léčbě (hyperviskozita, nemoc chladových aglutininů, symptomatická kryoglobulinemie, IgM mediovaná neuropatie, lymfadenopatie, organomegalie, anemie s hemoglobinem < 100 g/l, trombocytopenie < 100 × 109/l).
6 DOPORUČENÍ PRO DIAGNOSTIKU WM
- Monitorování koncentrace MIg IgM by mělo být prováděno v jedné laboratoři a za použití vždy stejné metodologie.
- Vyšetření chladových aglutininů a kryoglobulinu je doporučené v době diagnózy a u pacientů s klinickými projevy poruch prokrvení a/nebo vaskulitidy či laboratorními projevy hemolýzy.
- Vyšetření kostní dřeně, nejlépe trepanobiopsie s adekvátní analýzou metodou průtokové cytometrie, je nezbytné pro stanovení diagnózy WM.
- Biopsie tkáně je doporučována u všech pacientů se suspektní histologickou transformací (u části nemocných s WM může dojít k transformaci do DLBCL).
- Testování bodové mutace L265P v genu MYD88 je doporučeno u všech pacientů se zvažovanou diagnózou WM.
- U pacientů se symptomatickou periferní neuropatií je doporučováno vyšetření specific-kých protilátek proti glykoproteinu myelinu nebo proti gangliosidu M1(anti-MAG a anti-GM-1 protilátek).
- Neurofyziologické testování pomocí EMG a neurografie (kondukční studie) je doporučeno při podezření na neuropatii a slouží k určení typu nervového poškození a usměrňuje další diagnostiku.
- K potvrzení diagnózy Bingova-Neelova syndromu je potřebná:
- a) histologicky potvrzená infiltrace struktur CNS buňkami LPL, například pomocí stereotaktické biopsie nebo
- b) Cytologický průkaz buněk LPL v likvoru bez klinických známek transformace v agresivnější lymfom a průkaz monoklonální B populace v likvoru pomocí metod průtokové cytometrie nebo molekulárně-genetický průkaz klonality pomocí přestavby genu pro imunoglobulin nebo průkaz mutace L265P v genu MYD88.
- Provedení CT nebo MR vyšetření (hrudníku, břicha, pánve) nebo celotělového PET/CT je doporučováno u všech symptomatických pacientů před zahájením léčby.
- Kontrastní vyšetření centrální nervové soustavy MR s gadoliniem je doporučené provádět před samotným vyšetřením mozkomíšního moku, z důvodu možného falešného zobrazení sycení leptomening. Rozsah MR vyšetření má být předem zkonzultován s radiologem pro výběr vhodných sekvencí a anatomických oblastí
- Pro hodnocení rizika u symptomatických pacientů slouží mezinárodní prognostický skórovací systém pro nemocné s Waldenströmovou makroglobulinemií – IPSSWM.
7 INDIKACE K LÉČBĚ
Současné léčebné možnosti mají potenciál dosáhnout dlouhotrvající léčebné odpovědi (remise nemoci) u velkého počtu pacientů. U většiny pacientů však není možná úplná eliminace maligního klonu. Nemoc obvykle po dosažení remise, trvající řádově měsíce či roky, opět recidivuje a vyžaduje další léčbu. Proto se u Waldenströmovy makroglobulinemie v současné době doporučuje asymptomatické nemocné pouze sledovat a se zahájením léčby vyčkat až do naplnění konsen-zuálních kritérií uvedených níže [Leblond, 2016; D’Sa, 2017; Minnema, 2017].
Kritéria pro zahájení léčby
- Klinické indikace pro zahájení léčby:
- opakované teploty, noční poty a necílený úbytek hmotnosti > 10 % během 6 měsíců a patologická únava
- hyperviskozita (včetně asymptomatických změn na očním pozadí)
- symptomatická či bulky (≥ 5 cm v největším průměru) lymfadenopatie
- symptomatická hepato/splenomegalie
- symptomatická organomegalie či infiltrace tkání/orgánů (včetně symptomatické formy Bing-Neelova syndromu)
- periferní neuropatie způsobená WM (symptomatická a progredující)
- symptomatická kryoglobulinemie
- Laboratorní indikace pro zahájení léčby:
- nemoc chladových aglutininů (chladová hemolytická anemie)
- autoimunitní hemolytická anemie či trombocytopenie
- nefropatie způsobená WM
- amyloidóza způsobená WM
- koncentrace hemoglobinu pod 100 g/l nebo počet trombocytů pod 100 × 109/1
Koncentrace monoklonálního imunoglobulinu IgM není sama o sobě indikací k zahájení léčby, nicméně pokud by koncentrace dosáhla 50 g/l, doporučuje se pátrat po možných projevech hyperviskozity (krvácení z nosu a z dásní, zhoršení vizu, bolesti hlavy, závratě, ataxie a změny psychiky). Vždy je nutné provést vyšetření očního pozadí. Pokud jsou přítomné klinické příznaky hyperviskozity, je akutně indikována plazmaferéza.
8 STRATEGIE LÉČBY
Skutečnost, že Waldenströmova makroglobulinemie je velmi vzácným onemocněním s relativně dlouhým přežitím nemocných, limituje organizování velkých klinických studií. Proto informace o účinnosti léčby máme z menších studií, které obvykle hodnotí pouze počet léčebných odpovědí a délku remise, zatímco studie fáze III, které by srovnávaly vliv léčebných postupů na délku celkového přežití, jsou ojedinělé. Přehled vybraných publikovaných studií je uveden v tabulce 7.
Tab. 7. Přehled režimů u nově léčené a relabované/refrakterní Waldenströmovy makroglobulinemie 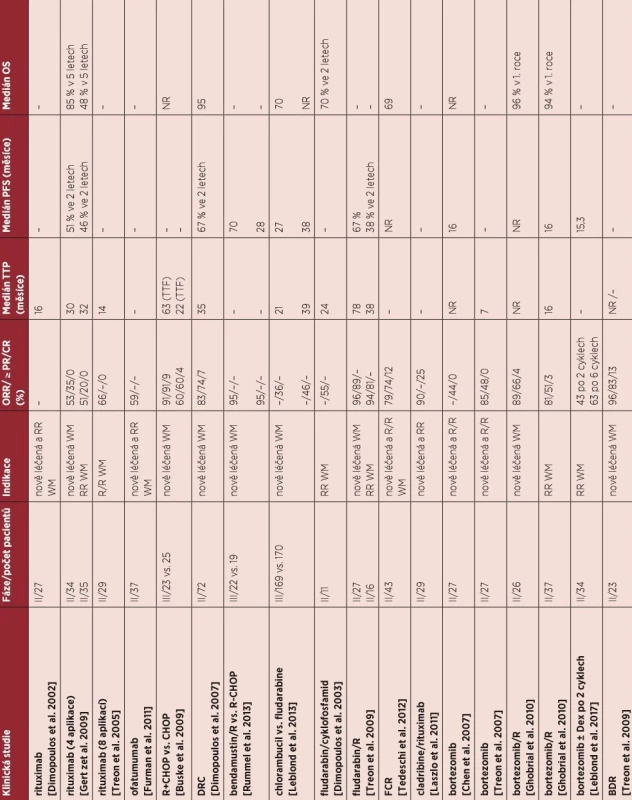

BDR (bortezomib, dexamethason, rituximab), CaRD (carfilzomib, dexamethason, rituximab), CR (kompletní remise), DRC (dexamethason, rituximab, cyklofosfamid), FCR (fludarabin, cyklofosfamid, rituximab), ORR (celkové léčebné odpovědi), CHOP (cyklofosfamid, doxorubicin, vinkristin, prednison), NR (nedosaženo), PFS (bezpříznakové přežití), TTP (čas do progrese), PFS (bezpříznakové přežití), R (rituximab), R/R (relaps, refrakterní nemoc), OS (celkové přežití) R (rituximab) Dimopoulos MA, Zervas C, Zomas A, et al. Treatment of Waldenstrom‘smacroglobulinemia with rituximab. J Clin Oncol. 2002; 20(9): 2327–2333. Gertz MA, Abonour R, Heffner LT, Greipp PR, Uno H, Rajkumar SV. Clinical value ofminor responses after 4 doses of rituximab in Waldenstrom macroglobulinemia: afollow-up of the Eastern Cooperative Oncology Group E3A98 trial. Br J Haematol.2009;147(5):677-680.
Treon SP, Emmanouilides C, Kimby E, et al. Extended rituximab therapy inWaldenstrom‘s macroglobulinemia. Annals of Oncology. 2005;16(1):132-138 Furman RR, Eradat H, DiRienzo CG, et al. A Phase II Trial of Ofatumumab in Subjectswith Waldenstrom‘s Macroglobulinemia. Blood. 2011;118(21):1581-1581. Buske C, Hoster E, Dreyling M, et al. The addition of rituximab to front-line therapy withCHOP (R-CHOP) results in a higher response rate and longer time to treatment failure inpatients with lymphoplasmacytic lymphoma: results of a randomized trial of the GermanLow-Grade Lymphoma Study Group (GLSG). Leukemia : official journal of theLeukemia Society of America, Leukemia Research Fund, UK. 2009;23(1):153-161. Dimopoulos MA, Anagnostopoulos A, Kyrtsonis MC, et al. Primary treatment ofWaldenstrom macroglobulinemia with dexamethasone, rituximab, andcyclophosphamide. J Clin Oncol. 2007;25(22):3344-3349. Rummel MJ, Niederle N, Maschmeyer G, et al. Bendamustine plus rituximab versusCHOP plus rituximab as first-line treatment for patients with indolent and mantle-celllymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet. 2013;381(9873):1203-1210.
Leblond V, Johnson S, Chevret S, et al. Results of a randomized trial of chlorambucilversus fludarabine for patients with untreated Waldenstrom macroglobulinemia, marginalzone lymphoma, or lymphoplasmacytic lymphoma. J Clin Oncol. 2013;31(3):301-307.
Dimopoulos MA, Hamilos G, Efstathiou E, et al. Treatment of Waldenstrom‘smacroglobulinemia with the combination of fludarabine and cyclophosphamide. LeukLymphoma. 2003;44(6):993-996. Treon, Steven P. et al „Long-term outcomes to fludarabine and rituximab in Waldenström macroglobulinemia.“ Blood. 2009;113(46):3673-3678. Tedeschi A, Benevolo G, Varettoni M, et al. Fludarabine plus cyclophosphamide andrituximab in Waldenstrom macroglobulinemia: an effective but myelosuppressiveregimen to be offered to patients with advanced disease. Cancer. 2012;118(2):434-443. Laszlo D, Andreola G, Rigacci L, et al. Rituximab and Subcutaneous 2-Chloro-2 ‚-Deoxyadenosine as Therapy in Untreated and Relapsed Waldenstrom‘sMacroglobulinemia. Clinical Lymphoma Myeloma & Leukemia. 2011;11(1):130-132. Chen CI, Kouroukis CT, White D, et al. Bortezomib is active in patients with untreated orrelapsed Waldenstrom‘s macroglobulinemia: A phase II study of the National CancerInstitute of Canada Clinical Trials Group. Journal of Clinical Oncology. 2007;25(12):1570-1575.
Treon SP, Hunter ZR, Matous J, et al. Multicenter clinical trial of bortezomib inrelapsed/refractory Waldenstrom‘s macroglobulinemia: Results of WMCTG trial 03-248. Clinical Cancer Research. 2007;13(11):3320-3325. Ghobrial IM, Xie WL, Padmanabhan S, et al. Phase II trial of weekly bortezomib incombination with rituximab in untreated patients with Waldenstrom Macroglobulinemia. Am J Hematol. 2010;85(9):670-674. Ghobrial IM, Hong F, Padmanabhan S, et al. Phase II trial of weekly bortezomib incombination with rituximab in relapsed or relapsed and refractory Waldenstrommacroglobulinemia. J Clin Oncol. 2010;28(8):1422-1428. Treon SP, Ioakimidis L, Soumerai JD, et al. Primary therapy of Waldenstrommacroglobulinemia with bortezomib, dexamethasone, and rituximab: WMCTG clinicaltrial 05-180. J Clin Oncol. 2009;27(23):3830-3835. Dimopoulos MA, Garcia-Sanz R, Gavriatopoulou M, et al. Primary therapy ofWaldenstrom macroglobulinemia (WM) with weekly bortezomib, low-dosedexamethasone, and rituximab (BDR): long-term results of a phase 2 study of theEuropean Myeloma Network (EMN). Blood. 2013;122(19):3276-3282.
Ghobrial IM, Redd R, Armand P, et al. Phase I/II trial of everolimus in combination with bortezomib and rituximab (RVR) in relapsed/refractory Waldenstrom macroglobulinemia. Leukemia 2015;29(12):2338–46. Treon SP, Tripsas CK, Meid K, et al. Carfilzomib, rituximab, and dexamethasone (CaRD) treatment offers a neuropathy-sparing approach for treating Waldenstrom’s macroglobulinemia. Blood 2014;124(4):503–10. Ghobrial IM, Savona MR, Vij R, et al. Final results from a multicenter, open-label, dose-escalation phase 1b/2 study of single-agent oprozomib in patients with hematologic malignancies. Blood 2016;128(22):2110. Castillo JJ, Meid K, Gustine J, et al. Prospective clinical trial of ixazomib, dexamethasone and rituximab as primary therapy in Waldenstro¨m macroglobulinemia. Clin Cancer Res 2018. Epub ahead of print. Treon SP, Soumerai JD, Branagan AR, et al. Thalidomide and rituximab in Waldenstrommacroglobulinemia. Blood. 2008;112(12):4452-4457. Lenalidomide and Rituximab in Waldenstrom‘s Macroglobulinemia Steven P. Treon, Jacob D. Soumerai, Andrew R. Branagan, Zachary R. Hunter, Christopher J. Patterson, Leukothea Ioakimidis, Luis Chu, Paul Musto, Ari D. Baron, Johannes C. Nunnink, Joseph J. Kash, Terenig O. Terjanian, Paul M. Hyman, Elena L. Nawfel, David J. Sharon, Nikhil C. Munshi and Kenneth C. Anderson Clin Cancer Res January 1 2009 (15) (1) 355-360; DOI: 10.1158/1078-0432.CCR-08-0862 Ghobrial IM, Gertz M, Laplant B, et al. Phase II trial of the oral mammalian target ofrapamycin inhibitor everolimus in relapsed or refractory Waldenstrommacroglobulinemia. J Clin Oncol. 2010;28(8):1408-1414. Treon SP, Tripsas CK, Meid K, et al. Ibrutinib in previously treated Waldenstrom‘smacroglobulinemia. N Engl J Med. 2015;372(15):1430-1440. Treon, Steven P et al „Long-Term Follow-up of Previously Treated Patients Who Received Ibrutinib for Symptomatic Waldenstrom‘s Macroglobulinemia: Update of Pivotal Clinical Trial.“ Blood 2017;130(suppl 1): 2766. Dimopoulos MA, Trotman J, Tedeschi A, et al. Ibrutinib Therapy in Rituximab-Refractory Patients with Waldenström‘s Macroglobulinemia: Initial Results from anInternational, Multicenter, Open-Label Phase 3 Substudy (iNNOVATE). Blood. 2015;126(23):2745-2745.
CR – kompletní remise, NR – nedosažen, ORR – celkový podíl odpovědí, OS – celkové přežití, PFS – přežití bez progrese, PR – parciální remise, RR, R/R – refrakterní nebo relabující, TTF – čas do selhání léčby, TTP – čas do progrese,
WM – Waldenströmova makroglobulinemieStrategie léčby v moderní hematologii respektuje, že Waldenströmova makroglobulinemie je zpravidla neagresivní pozvolné onemocnění s dlouhodobým přežitím (10leté celkové přežití 69%) při použití dostupné léčby [Buske, 2018]. Lze tedy pozorovat trend ke zvýšení bezpečnosti režimů modulací intenzity léčby s ohledem na celkový stav nemocného. Ibrutinib je například lékem, který má velmi akceptovatelný toxický profil, jde o monoterapii s perorální cestou aplikace. Onemocnění dlouhodobě stabilizuje, přestože počet kompletních remisí je limitovaný. Rovněž postupně dochází k vyloučení léků, které způsobují závažné nežádoucí účinky nebo způsobují vyšší četnost sekundárních nádorů, což je například případ fludarabinu.
8.1 Nově léčená waldenströmova makroglobulinemie
Hlavním cílem léčby je dlouhodobá kontrola symptomů nemoci při zachování kvality života. Anti-CD20 protilátka rituximab a její kombinace tvoří nadále základní pilíř léčby pacientů s WM [Buske, 2013; Leblond, 2016; Kapoor, 2017; Kastritis, 2018]. Přidání rituximabu k chemoterapii významně zvyšuje procento léčebných odpovědí a jejich trvání [Buske, 2009]. Několik retrospektivních analýz potvrdilo pozitivní vliv rituximabu na délku bezpříznakového období a celkové přežití [Buske, 2018; Olszewski, 2017; Castillo, 2017]. Monoterapie alkylačními cytostatiky a purinovými analogy je málo účinná a s ohledem na dostupnost nových účinných a bezpečnějších léků se od ní ustupuje.
Určující pro výběr vhodné léčby je rozsah a charakter nádorového postižení, požadovaná rychlost dosažení léčebné odpovědi, věk pacienta. Léčebný algoritmus pro nově léčenou symptomatickou WM je uveden v algoritmu 1.
Algoritmus 1 Nově léčená Waldenströmova makroglobulinemie 
8.1.1 Monoterapie rituximabem
Monoterapií rituximabem je dosahováno do 40 % celkových léčebných odpovědí po čtyřech aplikacích a 65 % po osmi aplikacích s trváním odpovědí od 8 do 29 měsíců [Gertz, 2004; Treon, 2005; Dimopoulos, 2002]. Nástup léčebné odpovědi je velice pozvolný (medián 7 měsíců) [Treon, 2005]. Monoterapie rituximabem tedy není vhodná pro pacienty vyžadující urychlenou kontrolu nemoci. Až u poloviny pacientů dochází v prvních měsících léčby k přechodnému nárůstu IgM, takzvanému vzplanutí „IgM flare“ [Treon, 2005]. Toto může vést vzácně až k projevům hyperviskozity [Treon, 2004]. Proto se u pacientů s vysokými koncentracemi IgM > 40 g/l doporučuje provést plazmaferézu před prvním podáním rituximabu. Monoterapii rituximabem lze zvážit pro specifické případy léčby imunologických komplikací IgM, jako je symptomatická kryoglobulinemie, na kortikoidy rezistentní významná hemolytická anemie, IgM asociovaná progredující neuropatie [Kastritis, 2018; Leblond, 2016; Kapoor, 2017].
8.1.2 Kombinované režimy imunochemoterapie
Nebyl doposud stanoven jednotný optimální režim léčby a při jejím výběru jsou důležité rozdíly v profilu nežádoucích účinků. Predispozice k neuropatickým komplikacím u pacientů s WM brání léčbě thalidomidem, vinca-alkaloidy a za méně vhodné lze považovat i intenzifikované podání bortezomibu. Léčba antracyklinovými režimy je zatížená vyšším výskytem infekčních komplikací a má kardiotoxické účinky. Bez rizik není ani léčba purinovými analogy, kterou provází infekční, myelosupresivní komplikace a vyšší výskyt sekundárních malignit. U nově léčených pacientů jsou doporučovány režimy s akceptovatelným poměrem účinnosti a profilem nežádoucích účinků režim rituximab, cyklofosfamid, dexamethason (DRC) a kombinace bendamustin, rituximab (BR) [Kaščák, 2016].
Pomocí režimu dexamethason, rituximab a cyklofosfamid u pacientů s nově léčenou WM bylo dosaženo 83 % léčebných odpovědí, z toho 7 % kompletních remisí. Medián do nástupu léčebné odpovědi byl 4 měsíce. Tolerance režimu byla velmi dobrá [Dimopoulos, 2007]. Medián do zahájení další léčby byl až 51 měsíců. Medián celkového přežití 95 měsíců [Kastritis, 2015]. Pravděpodobnost celkového přežití v 8 letech pro skupinu nízkého, středního a vysokého rizika podle IPSSWM byla 100%, 55% a 27% (p = 0,005) [Dimopoulos, 2007; Kastritis, 2015].
Režim bendamustin (90 mg/m2), rituximab byl srovnán s režimem R-CHOP ve studii fáze III. V obou ramenech bylo dosaženo shodně 95 % léčebných odpovědí. Medián přežití bez progrese v trvání téměř 70 měsíců vyšel ve prospěch režimu BR [Rummel, 2013]. Snížení počtu cyklů ze šesti na čtyři s redukcí dávky bendamustinu na 70 mg/m2/den nemělo negativní vliv na procento a hloubku léčebných odpovědí v jedné retrospektivní analýze [Castillo, 2016].
Při výběru vhodného režimu je doporučené řídit se klinickými projevy, rozsahem nádorového postižení a požadavkem na rychlost dosažení léčebné odpovědi. Velkou nádorovou masu lze předpokládat u pacientů s těžkými cytopeniemi, s masivní organomegalií, lymfadenopatií anebo hyperviskozitou. Režim DRC je vhodný pro symptomatické pacienty s menším nádorovým postižením nevyžadující urychlený nástup léčebné odpovědi. Pro pacienty s větší nádorovou zátěží v podobě výraznější anemie, trombocytopenie, vysokým IgM a zvýšeným B2M, vyjádřeno vysokým rizikem podle IPSSWM se jeví režim DRC jako méně vhodný. Režim BR je vhodnou volbou pro pacienty s větším nádorovým postižením a potřebou rychlého nástupu léčebné odpovědi [Leblond, 2016; Kapoor, 2017; Kastritis, 2018]. Dávku bendamustinu a/nebo počet cyklů BR je vhodné přizpůsobit podle individuálních charakteristik pa-cienta a tolerance léčby [Castillo, 2016; Kastritis, 2018].
8.1.3 Inhibitory Brutonovy tyrosinkinázy
Monoterapie inhibitorem Brutonovy tyrosinkinázy ibrutinibem je indikována k léčbě pacientů s WM, kteří již podstoupili alespoň jednu předchozí terapii, nebo i v první linii u pacientů, u nichž není vhodná immunochemoterapie. Registrace ibrutinibu u WM proběhla na základě výsledků studie fáze II u dříve léčených pacientů [Treon, 2015]. Recentně byly publikovány předběžné výsledky navazující studie s ibrutinibem u nově léčené WM [Treon, 2017]. Léčebná odpověď byla dosažená u 96,7 % léčených, z toho bylo 80 % odpovědí lepších než parciální remise a 17 % velmi dobrých parciálních remisí. Tolerance léčby byla dobrá.
V případě nemutované varianty genu MYD88 (wild-type MYD88) je u pacientů s WM léčených ibrutinibem dosaženo podstatně méně léčebných odpovědí s nižším zastoupením hlubokých léčebných odpovědí a jejich krátkým trváním [Treon, 2015; Dimopoulos, 2017]. V pokročilých fázích klinického testování je druhá generace inhibitorů Brutonovy tyrosinkinázy (acalabrutinib, zanubrutinib).
8.1.4 Kandidát autologní transplantace
Autologní transplantace (ASCT) představuje důležitou léčebnou alternativu v léčbě relapsu mladších pacientů s WM [Kaščák, 2016]. Včasný sběr v době nejmenšího nádorového postižení může snížit počet mobilizačních pokusů [Gertz, 2012].
U všech pacientů vhodných k transplantaci krvetvorných buněk proto doporučujeme zvážit mobilizaci a separaci periferních kmenových buněk po první dosažené léčebné odpovědi.
8.1.5 Udržovací rituximab
Pozitivní výsledky udržovací léčby rituximabem u pacientů s indolentními B-lymfomy vedly extrapolací k jeho rutinnímu použití u pacientů s WM v Bing Center for WM [Treon, 2011]. Velká retrospektivní analýza publikovaná tímto centrem ukázala významně delší přežití bez progrese (56,3 vs. 28,6 měsíců, p = 0,0001), celkové přežití (nedosaženo vs. 116 měsíců, p = 0,00095) a zlepšení kategorických odpovědí u téměř 42 % pacientů (p < 0,0001) léčených udržovacím rituximabem ve srovnání s observací. Udržovací léčba byla provázena zvýšeným výskytem nezávažných respiračních infekcí. Celková tolerance byla dobrá a jen u necelých 5 % bylo nutné léčbu rituximabem předčasně ukončit [Treon, 2011]. Další velká retrospektivní analýza nově léčené WM poukázala na snížené riziko progrese (HR 0,11; 95% CI 0,06–0,21; p < 0,001) a delší přežití bez progrese (6,8 roku vs. 2,8 roku) u pacientů léčených udržovacím rituximabem [Castillo, 2017]. V několika prospektivních studiích zkoumajících roli udržovacího rituximabu u indolentních B-lymfoproliferací byli léčeni i pacienti s WM. Tyto studie zaznamenaly delší trvání přežití bez progrese [Hochster, 2009; Salles, 2011; Barta, 2016].
Expertní doporučení stran udržovací léčby rituximabem u pacientů s WM nejsou jednotná [Leblond, 2016; Kapoor, 2017; Castillo, 2017; NCCN, 2018; Kastritis, 2018]. Koncem roku 2018 byl ukončen nábor prospektivní randomizované studie fáze III – MabCute (NCT01461928) hodnotící léčbu udržovacím subkutánním rituximabem po dobu 2 let u pacientů s dříve léčenými indolentními non-hodgkinskými lymfomy včetně WM. V roce 2022 je očekáváno ukončení prospektivní randomizované studie fáze III – MAINTAIN (NCT00877214) hodnotící udržovací léčbu subkutánním rituximabem po dobu 2 let proti sledování u pacientů s nově léčenou WM.
Výsledky z dostupných klinických studií ukazují na významný klinický benefit udržovací léčby rituximabem u pacientů s WM, a to v podobě zlepšení léčebných odpovědí a prodloužení období bez progrese. Udržovací léčba je doporučená u všech pacientů v remisi po předchozí léčbě režimem s rituximabem. Výjimkou jsou pacienti nereagující na léčbu imunochemoterapií, pacienti s těžkou sekundární hypogamaglobulinemií nebo netolerující rituximab [Kanan, 2014; Castillo, 2016; Castillo, 2017].
8.2 Léčba relapsu a refrakterní Waldenströmovy makroglobulinemie
Léčbu není obvykle nutné zahájit bezprostředně po zjištění laboratorní progrese. Symptomatickou progresi splňující indikace k zahájení léčby obvykle předchází o desítky měsíců progrese laboratorní [Kastritis, 2015].
8.2.1 Výběr vhodné léčby
Určujícími faktory při výběru vhodné léčby jsou typ předchozího použitého režimu, dosažená léčebná odpověď a délka jejího trvání, tolerance předchozí léčby, limitující komorbidity, mutační status genu MYD88 a schopnost podstoupit vysokodávkovanou chemoterapii s autologní transplantací krvetvorby. Léčebný algoritmus pro léčbu relapsu či refrakterní WM je uveden v algoritmu 2.
Algoritmus 2 Léčba relapsu/refrakterní Waldemströmovy makroglobulinemie 
8.2.2 Opakování režimu první linie
Zopakování režimu první linie lze zvážit u pacientů s dlouhým trváním léčebné odpovědi vyžadujících další léčbu po více než 3 letech od zahájení léčby předchozí. Podmínkou je ale dobrá tolerance poslední léčby [Kastritis, 2015]. S ohledem na efektivitu nových léků zaváděných do léčby relapsu WM se tento názor neustále vyvíjí.
8.2.3 Alternativní kombinované režimy
V případě intervalu kratšího než 3 roky do zahájení další léčby je nutné zvolit alternativní režim, než byl režim původní. V případě rituximab refrakterních pacientů je vhodná léčba ibrutinibem. Všeobecně akceptovanou definicí refrakterity je nedostatečná léčebná odpověď nebo progrese do 6 měsíců po ukončení léčby režimem obsahujícím rituximab [Rezvani, 2011]. Před použitím režimu s kombinací rituximabu je vhodné ověřit CD20 pozitivitu imunofenotypizačním vyšetřením kostní dřeně. Za preferované režimy považujeme režim bendamustin, rituximab, režim DRC, režim bortezomib, rituximab bez (VR) nebo s přidáním dexamethasonu (BDR) [Treon, 2011; Tedeschi, 2015; Paludo, 2016; Paludo, 2017; Treon, 2007; Chen, 2007; Dimopoulos, 2005; Ghobrial, 2010]. S cílem snížení výskytu neuropatických komplikací bortezomibu doporučujeme jeho podkožní podání, preferenčně v týdenních intervalech [Kastritis, 2018]. Další generace proteasomových inhibitorů, jako je carfilzomib a oprozomib, prokázaly smysluplnou léčebnou aktivitu u RRWM [Treon, 2014; Vesole, 2018; Ghobrial, 2016]. Léčbu kombinací rituximabu s purinovými analogy (fludarabin, cladribine) je nutné indikovat s opatrností. Důvodem jsou obavy spojené se zvýšeným výskytem sekundárních malignit včetně transformací v agresivnější lymfom (4,7–8 %), sekundární myelodysplastický syndrom a akutní myeloidní leukemie [Tedeschi, 2012; Tam, 2006; Souchet-Compain, 2013; Souchet-Compain, 2016; Leleu, 2009;]. V případě použití FCR v léčbě relapsu WM byl výskyt sekundárních malignit včet-ně myelodysplastického syndromu a akutní myeloidní leukemie až 32% ve srovnání s 8% ve sku-pině léčených režimem BR (p = 0,004) [Tedeschi, 2015]. K dalším léčebným možnostem léčby opakovaně relabované, refrakterní WM patří mTOR inhibitor everolimus v monoterapii či v kombinaci s rituximabem a bortezomibem [Ghobrial, 2014; Ghobrial, 2015].
8.2.4 Ibrutinib
Ibrutinib v monoterapii je schválený od roku 2015 pro léčbu Waldenströmovy makroglobulinemie po minimálně jedné předchozí linii léčby. Indikační kritéria umožňují jeho použití i u nově léčených pacientů neschopných podstoupit chemoterapii. Léčebné odpovědi nejsou negativně ovlivněny počtem předchozích linií léčby či refrakteritou k poslední léčbě včetně rituximabu [Treon, 2015; Dimopoulos, 2017]. Při monoterapii ibrutinibem nelze u většiny léčených pacientů očekávat navození hlubších léčebných odpovědí (≥ velmi dobrá parciální remise), nicméně zpravidla dojde k dlouhodobé, léta trvající stabilizaci onemocnění [Treon, 2015; Treon, 2017; Dimopoulos, 2017]. Ibrutinib je vhodný k léčbě časného relapsu WM s trváním léčebné odpovědi < 1 rok a k léčbě rituximab refrakterních pacientů. Mutační stav genu MYD88 a genu CXCR4 má zásadní vliv na procento léčebných odpovědí a jejich trvání [Treon, 2015]. Skupina s nemutovanou variantou MYD88 má významně kratší trvání léčebných odpovědí [Treon, 2017]. Monoterapie ibrutinibem probíhá nepřetržitě do selhání nebo nezvladatelné toxicity. Její přerušování je vhodné minimalizovat na co nejkratší dobu pro rizika rebound fenoménu a selhání léčby [Gustine, 2017].
8.2.5 Autologní transplantace kostní dřeně
Indikace a správné načasování myeloablativní vysokodávkované chemoterapie s autologní transplantací krvetvorby (ASCT) u pacientů s relabovanou WM nebyly zkoumány v prospektivních studiích. Údaje o její efektivitě a bezpečnosti jsou čerpány z kooperativních a nadnárodních transplantačních registrů [Munshi, 2003; Kyriakou, 2010; Kyriakou, 2007; Tournilhac, 2003; Anagnostopoulos, 2006; Gilleece, 2008; Anagnostopoulos, 2002; Dhedin, 2007]. Většina pacientů podstoupila transplantaci v chemosenzitivní fázi nemoci. Podle konsenzuálních expertních doporučení je ASCT vhodná v léčbě chemosenzitivní WM s agresivním klinickým průběhem a preferenčně po selhání léčby ibrutinibem [Kyriakou, 2017].
8.2.6 Alogenní transplantace kostní dřeně
Vysoká peritransplantační mortalita alogenní SCT významně limituje její širší uplatnění v léčbě WM. Její použití lze zvažovat jenom u vybraných mladých pacientů s agresivní nemocí a vyčerpanými možnostmi jiné léčby [Kyriakou, 2010; Bachanova, 2012; Kyriakou, 2017].
9 HODNOCENÍ LÉČEBNÝCH ODPOVĚDÍ
Hodnocení účinku léčby u WM vychází z posuzování vývoje koncentrace MIg a celkové koncentrace IgM, klinických parametrů, měřitelného extramedulárního postižení a morfologického hodnocení kostní dřeně. Hodnocení kategorických odpovědí může probíhat jak pomocí kvantifikace MIg denzitometrií, tak prostřednictvím měření celkové koncentrace sérového IgM pomocí nefelometrie. Obě metody sérologického hodnocení vykazují podobnou míru korelace s odpovědí pozorovanou v kostní dřeni [Tripsas, 2012]. Při hodnocení je nutné upozornit na očekávanou biologickou variabilitu měření pomocí nefelometrie (13 %) a densitometrie (8 %) [Katzmann, 2011]. Dynamika nástupu léčebných odpovědí se může významně lišit v závislosti na použitém režimu. Proto se doporučuje vyšetření pravidelně opakovat po ukončení léčby. Kompletní remisi je nutné potvrdit druhou imunofixací. Obdobně se vyžaduje opakovat vyšetření pro potvrzení progrese. V případě, že by byl nárůst koncentrace IgM jediným kritériem pro potvrzení progrese, musí být o nejméně 5 g/l. Může docházet k významným diskrepancím mezi poklesem IgM a mírou infiltrace kostní dřeně. To je patrné zejména při monoterapii anti-CD20 protilátkou s cílenou CD20 B-buněčnou deplecí nebo monoterapií proteazomovým inhibitorem s výraznějším efektem na plazmocelulární komponentu WM. Vyšetření kostní dřeně je doporučeno provádět 4–6 týdnů po ukončené léčbě. Ke splnění podmínek definice kompletní remise postačuje morfologické vymizení infiltrace, hodnocené cytologií aspirátu a histologickým vyšetřením biopsie kostní dřeně. Nicméně se doporučuje při vyšetřování kostní dřeně současně provádět i imunofenotypizační a imunohistochemické vyšetření k posouzení zbytkové klonální populace [Owen, 2013]. Do budoucna lze očekávat vyšetřování minimální reziduální nemoci inkorporací průtokové cytometrie a testování MYD88 pomocí PCR [Treon, 2013]. V případě vstupního extramedulárního postižení je nutné zopakovat po dokončení léčby zobrazovací vyšetření (CT nebo MR nebo PET/CT).
Kritéria pro hodnocení léčebných odpovědí byla naposledy revidována v roce 2013 v rámci 6. mezinárodního workshopu (tab. 8).
Tab. 8. Definice léčebných odpovědí u Waldenströmovy makroglobulinemie [Owen, 2013] ![Definice léčebných odpovědí u Waldenströmovy makroglobulinemie [Owen, 2013]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a38d5ad702d5770190a604440e36a9c5.png)
a Je nutné potvrdit druhou imunofixací.
b Vyšetření kostní dřeně je doporučeno provádět 4–6 týdnů po ukončené léčbě (pozn.: Ke splnění podmínek definice kompletní remise postačuje morfologické vymizení infiltrace, hodnoceno cytologií aspirátu a histologií trepanobiopsie kostní dřeně. Nicméně se doporučuje současně provádět i imunofenotypizační a imunohistochemické vyšetření.)
c Hodnocení kategorických odpovědí může probíhat jak pomocí kvantifikace MIg denzitometrií, tak prostřednictvím měření celkové koncentrace sérového IgM pomocí nefelometrie.10 LÉČBA BING-NEELOVA SYNDROMU
Bing-Neelův syndrom (BNS) je extrémně vzácnou manifestací WM, typicky se vyskytující v období relapsu [Malkani, 2010]. BNS je způsoben nádorovou infiltrací centrálního nebo periferního nervového systému buňkami LPL. V roce 2017 byla publikována první mezinárodní doporučení o diagnostice, léčbě a hodnocení léčebných odpovědí Bingova-Neelova syndromu [Minnema, 2017]. Doporučení byla vypracována na základě retrospektivních analýz malých souborů a kazuistických sdělení. Pacienti s BNS byli efektivně léčeni vysokými dávkami cytostatik s dobrým průnikem přes hematoencefalickou bariéru, jako je methotrexát a cytosinarabinosid [Hoang-Xuan, 2015]. Intenzivní indukční režimy byly u některých pacientů zakončeny vysokodávkovanou chemoterapií s autologní transplantací krvetvorby [Simon, 2015; Castillo, 2016; Abdallah, 2013]. S efektem byla použita i nukleosidová analoga fludarabin, cladribin a bendamustin ve standardních dávkách [Simon, 2015; Castillo, 2016; Varretoni, 2015]. Standardní dávky ibrutinibu, 480 mg/den, pronikají hematoencefalickou bariérou a vedly u několika pacientů k parciálním i kompletním remisím [Castillo, 2016; Cabannes-Hamy, 2016; Mason, 2017]. Role rituximabu v léčbě BNS není jasná, otázkou je její dostatečný průnik hematoencefalickou bariérou [Minnema, 2017]. Intrathekální chemoterapie samotná nevede k dlouhodobým remisím a je vhodné ji kombinovat se systémovou léčbou zejména u leptomeningeální formy BNS [Van Cauwenberge, 2015; Minnema, 2017]. V léčbě BNS lze použít i radioterapii [Abbi, 2013; Shimizu, 1993; Imai, 1995]. Stereotaktická radioterapie v dávkách 30–40 Gy je preferovanou formou léčby zejména lokalizovaného intraparenchymatózního postižení [Minnema, 2017]. Nicméně i u cílené radioterapie CNS je velmi častá oddálená neurotoxicita v podobě neurokognitivních deficitů [Saad, 2015].
Výběr vhodné léčby a její intenzita se řídí klinickým stavem pacienta, lokalizací a formou postižení, dříve použitou chemoterapií a schopností podstoupit autologní transplantaci. Asymptomatického pacienta s BNS je možné jenom pečlivě sledovat [Minnema, 2017]. U čistě leptomeningeálního postižení lze individuálně zvážit intrathekální chemoterapii. Lepší kontroly nemoci lze dosáhnout systémovou léčbou. Pro riziko transformace a negativní vliv na separaci kmenových buněk se obecně nedoporučuje opakovat léčbu nukleosidovými analogy. Intenzivní chemoterapie s konsolidací autologní transplantací by měla být vždy zvažována u mladších pacientů. Evropská neuro-onkologická asociace preferuje v léčbě primárních CNS lymfomů režim BCNU/thiotepa [Hoang-Xuan, 2015]. Optimální předtransplantační režim u BNS ale není známý.
Konsenzuální doporučení léčby BNS je uvedeno v algoritmu 3.
Algoritmus 3 Konsenzuální doporučení léčby Bing-Neelova syndromu (upraveno podle [Minnema, 2017]) ![Algoritmus 3 Konsenzuální doporučení léčby Bing-Neelova syndromu (upraveno podle [Minnema, 2017])](https://pl-master.mdcdn.cz/media/image_pdf/4586fd98b738c0bf1e619a90022ffed6.png?version=1562008878)
10.1 Hodnocení léčby
Hodnocení efektu léčby u BNS sestává z kombinace klinického hodnocení, vyšetření magnetickou rezonancí, a v případě leptomeningeální formy postižení, vyšetření mozkomíšního moku. Jednotlivá vyšetření je nutné pravidelně opakovat nejméně jednou v průběhu léčby a po ukončení léčby. Efekt kontinuální léčby se doporučuje monitorovat pravidelně v 3–4měsíčních intervalech a později co 12 měsíců. Hodnocení efektu léčby BNS má probíhat nezávisle na hodnocení WM [Minnema, 2017]. Konsenzuální kritéria hodnocení efektu léčby jsou uvedená v tabulce 9.
Tab. 9. Hodnocení léčebných odpovědí u BNS [Minnema, 2017] ![Hodnocení léčebných odpovědí u BNS [Minnema, 2017]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/633209fe3e1309d1a4db0c884c38a651.png)
11 PODPŮRNÁ TERAPIE A LÉČBA KOMPLIKACÍ
11.1 Léčba hyperviskozity a další indikace plazmaferézy
Plazmaferéza je indikovaná u pacientů s klinicky závažnými příznaky hyperviskozity, samotná fyzikální hodnota naměřené viskozity přitom není indikací pro plazmaferézu.
Výměna 1 až 1,5 plazmatického objemu sníží viskozitu asi o 60–75 %. U pacientů s klinicky závažnými projevy hyperviskozity se proto doporučuje provést 1 až 2 plazmaferézy [Mahmood, 2006; Clark, 1999; Stone, 2012].
Opakované plazmaferézy s cílem udržení viskozity v přijatelných mezích jsou doporučovány jednak pro nemocné, jejichž nemoc je rezistentní na medikamentózní léčbu, a také pro nemocné, kteří nejsou schopni podstoupit účinnou medikamentózní léčbu. Efekt plazmaferézy nastupuje rychle a trvá 4–6 týdnů [Ansell, 2010; Menke, 2009; Drew, 2002].
Dle omezených zkušeností je plazmaferéza léčebnou alternativou u nemocí způsobených monoklonálním imunoglobulinem (IgM related disorders), jako jsou závažná neuropatie nebo symptomatická kryoglobulinemie. Může být využita i jako iniciální krok před podáním cytoredukční léčby, která utlumí aktivitu nemoci.
Při plánování léčby si lékař musí být vědom možnosti dočasného zvýšení koncentrace monoklonálního IgM vlivem rituximabu a jeho podání naplánovat tak, aby nedošlo k tomuto jevu (flare efekt).
11.2 Léčba periferní neuropatie způsobené monoklonálním imunoglobulinem IgM
Při pomalu progredující neuropatii není léčba vždy nevyhnutelná. U pacientů s progredující neuropatií je doporučena léčba. Při agresivním průběhu se středně těžkou a těžkou neuropatií je vhodná vstupně léčebná plazmaferéza (obvykle týdenní plazmaferézy po dobu 2–3 měsíců) následovaná konsolidací imunochemoterapií nebo ibrutinibem. Při pomalejším průběhu a mírné neuropatii lze zvážit monoterapii rituximabem.
Při výrazných projevech senzorické neuropatie je v průběhu chemoterapie doporučená i symptomatická léčba s použitím gabapentinu, pregabalinu a duloxetinu, tyto léky indikuje a předepisuje neurolog.
Tab. 10. Přehled doporučených léčebných režimů u WM (obsahuje jen vybrané režimy) 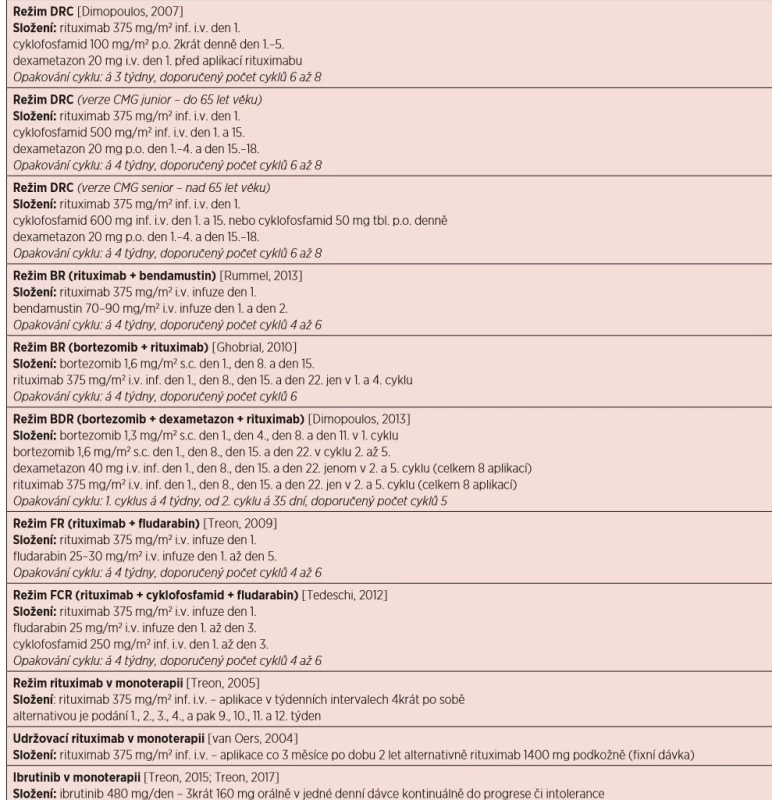
12 SLEDOVÁNÍ PO LÉČBĚ
Součástí pravidelných kontrol sledování nemocného je anamnéza, fyzikální vyšetření, kontrolní panel odběrů včetně kvantifikace IgM každé 3 měsíce po dobu 2 let, každých 4–6 měsíců po dobu dalších 3 let, a následně v ročních intervalech se speciálním zaměřením na transformaci nemoci, sekundární malignity. Zobrazovací vyšetření (CT nebo PET/CT) je vhodné zopakovat po dokončení léčby v případě vstupního extramedulárního postižení a eventuálně i v jejím v průběhu při podezření na nereagující či progredující onemocnění [Castillo, 2016]. U části pacientů s WM může dojít k transformaci do lymfomu vyššího stupně malignity, typicky do difuzního velkobuněčného B-lymfomu (DLBCL), v těchto případech je doporučována biopsie tkáně (nejčastěji lymfatické uzliny) a histologická verifikace.
13 DOPORUČENÍ PRO LÉČBU WM
- Pacienty s asymptomatickou formou WM je vhodné pouze sledovat. Je doporučeno aktivní pravidelné celoživotní sledování. Sledování probíhá v tříměsíčních intervalech první 3 roky, poté v půlročních intervalech následující 2 roky a poté jednou ročně při stabilním stavu (úroveň důkazu IIa, stupeň doporučení B).
- Koncentrace IgM samotná, není indikací k zahájení léčby (úroveň důkazu IIb, stupeň doporučení B).
- U pacientů s hyperviskozitou je indikovaná výměnná plazmaferéza před samotným zahájením systémové léčby (úroveň důkazu III, stupeň doporučení B).
- Pacienti se symptomatickou WM by měli být léčeni režimem obsahujícím rituximab (úroveň důkazu Ib, stupeň doporučení A).
- Monoterapie rituximabem je kontraindikována u pacientů s hyperviskozitou před provedením výměnné plazmaferézy. V případě vysoké koncentrace IgM (> 40 g/l) není monoterapie rituximabem vhodná (úroveň důkazu IV, stupeň doporučení C).
- Režim BR (bendamustin, rituximab) je preferovaným režimem pro nově léčené pacienty s velkou nádorovou masou, hyperviskozitou a potřebou rychlého nástupu léčebné odpovědi (úroveň důkazu IV, stupeň doporučení C).
- Režim DRC (dexamethason, rituximab, cyklofosfamid) je alternativou režimu BR pro nově léčené pacienty s malou nádorovou masou, bez hyperviskozity a nevyžadující rychlý nástup léčebné odpovědi, nebo v případě, že je režim BR rizikový (úroveň důkazu IV, stupeň doporučení C).
- Monoterapie ibrutinibem je alternativou pro pacienty nevhodné k imunochemoterapii (úroveň důkazu IIa, stupeň doporučení B).
- Pacienty v remisi po léčbě je vhodné pravidelně sledovat do symptomatické progrese (úroveň důkazu IV, stupeň doporučení C).
- Udržovací léčba rituximabem je doporučená u všech pacientů v remisi s dobrou tolerancí rituximabu (úroveň důkazu IIb, stupeň doporučení B).
- Léčbu purinovými analogy provází infekční a myelosupresivní komplikace a významně vyšší výskyt sekundárních malignit, a proto není vhodná pro pacienty s nově léčenou WM (úroveň důkazu IIa, stupeň doporučení B).
Léčba druhé a další linie
- Pacienti bez adekvátní odpovědi na režim imunochemoterapie v první linii s přetrvávajícími symptomy nebo pacienti s primárně refrakterní WM mají být léčeni ibrutinibem (úroveň důkazu IIa, stupeň doporučení B).
- Opakování režimu imunochemoterapie první linie je možné u pacientů s pozdním relapsem s dlouhým trváním remise (obvykle čas do zahájení další léčby ≥ 3 roky) a dobrou tolerancí předchozího režimu (úroveň důkazu IIa, stupeň doporučení B).
- Pacienti se symptomatickým pozdním relapsem by měli znovu dostat režim obsahující rituximab (úroveň důkazu IIa, stupeň doporučení B).
- Režim obsahující bortezomib je potenciální alternativou léčby symptomatického relapsu WM, preferovány jsou režimy s týdenním podáváním bortezomibu v podkožní formě s cílem předejít neurologické toxicitě, doporučována je profylaxe proti reaktivaci HZV (úroveň důkazu IIa, stupeň doporučení B).
- V léčbě relapsu jsou používány režimy obdobné jako v léčbě první linie, ale také režimy obsahující bortezomib (bortezomib rituximab ± dexamethason). Režimy obsahující purinová analoga (např. FR, FCR, CladR) je optimální používat pro léčbu opakovaného relapsu (> 3. linie léčby). Volba režimu vyžaduje komplexní zhodnocení klinického stavu u konkrétního pacienta a také zvážení potenciální možnosti provedení SCT (úroveň důkazu IIa, stupeň doporučení B).
- Léčba ibrutinibem je vhodná pro léčbu relapsu pacientů s WM, zejména s přítomností mutace MYD88 (úroveň důkazu Ib, stupeň doporučení A).
- Pacienty s klinicky asymptomatickým relapsem projevujícím se pouze postupným vzestupem MIg je vhodné pouze sledovat a léčbu zahájit až v případě klinicky významné progrese WM (úroveň důkazu IV, stupeň doporučení C).
- Mladší pacienti s chemosenzitivním relapsem WM jsou kandidáty pro provedení transplantace (SCT) a měli by být diskutováni s transplantačním centrem (úroveň důkazu III, stupeň doporučení B).
V ČR v roce 2018 je použití rituximabu, bortezomibu, bendamustinu a ibrutinibu při léčbě WM možné pouze po schválení revizním lékařem příslušné zdravotní pojišťovny. Standardně jsou v ČR pro léčbu Waldenströmovy makroglobulinemie hrazena zatím pouze klasická cytostatika, kortikoidy a fludarabin.
Seznam použitých zkratek
AIHA – autoimunitní hemolytická anemie
anti GM-1 – protilátky proti gangliosidům
anti-MAG – protilátky proti glykoproteinům asociovaným s myelinem
ASCT – autologní transplantace krvetvorných buněk
B2M – beta2-mikroglobulin
BCNU – carmustin
BNP – mozkový natriumuretický peptid, brain natriuretic peptide
BNS – Bing-Neelův syndrom
BR – bendamustin, rituximab
CAD – nemoc chladových aglutininů
CD – antigenní znak, cluster of differentiation
CladR – cladribin, rituximab
CNS – centrální nervový systém
CR – kompletní remise
CT – počítačová tomografie
DLBCL – difuzní velkobuněčný B-lymfom
DRC – dexamethason, rituximab, cyklofosfamid
EMG – elektromyografie
FCR – fludarabin, cyklofosfamid, rituximab
FISH – flourescenční in situ hybridizace
FLC – volné lehké řetězce
FR – fludarabin, rituximab
fVIII – koagulační faktor VIII
GMT – gamma-glutamyltransferáza
Gy – gray
HD-AraC – vysokodávkovaný cytosinarabinosid
HD-MTX – vysokodávkovaný methotrexát
Hg – hemoglobin
HIV – lidský virus získané imunodeficience
HR – poměr rizika, hazard ratio
HVS – hyperviskózní syndrom
HZV – virus herpes zoster
i.v. – nitrožilně
IgA – imunoglobulin třídy A
IgG – imunoglobulin třídy G
IgM – imunoglobulin třídy M
Inf. – infuze
IPSSWM – Mezinárodní prognostický skórovací systém pro nemocné s Waldenströmovou makroglobulinemií
ITP – imunitní trombocytopenie
LDH – laktát dehydrogenáza
LPL – lymfoplazmocytární lymfom
MGUS – monoklonální gamapatie nejasného významu
MIg – monoklonální imunoglobulin
MR – magnetická rezonance
MO – minimální léčebná odpověď
MUT – mutovaný
NCS – elektrofyziologické vyšetření vodivosti nervů, nerve conduction studies
p.o. – per os
PAT – přímý antiglobulinový test
PCR – polymerázová řetězová reakce
PD – progrese nemoci
PET – pozitronová emisní tomografie
PNP – periferní polyneuropatie
PR – parciální remise
RR WM – relabovaná refrakterní Waldenströmova makroglobulinemie
SCT – transplantace kostní dřeně
SD – stabilní nemoc
TnI – troponin I
TnT – troponin T
USG – ultrasonografie
VGPR – velmi dobrá parciální remise
VR – bortezomib, dexamethason
vWf:RCo – funkční aktivita ristocetin kofaktoru
vWCH – vonWillebrandova choroba
WHIM – syndrom vrozeného imunodeficitu Warts, Hypogammaglobulinemia, Infections and Myelokathexis
WM – Waldenströmova makrogobulinemie
Podíl autorů na rukopisu
M.K. (napsání rukopisu, revize rukopisu); R. H. (napsání dílčí části rukopisu, revize rukopisu); J. M. (napsání dílčí části rukopisu, revize rukopisu); T. J. (napsání dílčí části rukopisu, revize rukopisu); Z. A. (připomínky, revize rukopisu); D. B. (připomínky, revize rukopisu); A. J. (připomínky, revize rukopisu); V. M. (připomínky, revize rukopisu); M. T. (připomínky, revize rukopisu).
Doručeno do redakce: 10. 1. 2019.
Přijato po recenzi: 21. 1. 2019.
Prohlášení o konfliktu zájmů
R. H. (honoráře, přednášky, konzultace a nefinanční podpora od firmy Janssen); M. K.; J. M.; T. J.; Z. A.; D. B. (Jansssen Cilag – přednášky, advisory board); A. J.; V. M.; M. T. (nemají v souvislosti se vznikem a přípravou rukopisu žádný konflikt zájmů)
KORESPONDENČNÍ ADRESA:
prof. MUDr. Roman Hájek, CSc.
Klinika hematoonkologie, Fakultní nemocnice Ostrava
17. listopadu 1790, 708 52 Ostrava-Poruba
e-mail: roman.hajek@fno.cz
Zdroje
Literatura pro diagnostickou část
1. Adam Z, Šmardová J, Ščudla V. Waldenströmova makroglobulinemie – klinické projevy, diferenciální diagnostika a prognóza nemoci. Vnitř. Lék. 2007; 53 : 1325–1337.
2. Baehring JM, Hochberg EP, Raje N, et al. Neurological manifestations of Waldenström macroglobulinemia. Nat Clin Pract Neurol 2008; 4(10): 547–556.
3. Baldini L, Nobile-Orazio E, Guffanti A, et al. Peripheral neuropathy in IgM monoclonal gammopathy and Waldenström’s macroglobulinemia: a frequent complication in elderly males with low MAG-reactive serum monoclonal component. Am J Hematol 1994; 45 : 25–31.
4. Banwait R, O’Regan K, Campigotto F, et al. The role of 18F-FDG PET/CT imaging in Waldenström macroglobulinemia. Am J Hematol 2011; 86(7): 567–572.
5. Braggio E, Fonseca R. Genomic abnormalities of Waldenström macroglobulinemia and related low-grade B-cell lymphomas. Clin Lymphoma Myeloma Leuk 2013; 13(2): 198–201.
6. Buske C, Sadullah S, Kastritis E, et al. Treatment and outcome patterns in European patients with Waldenström’s macroglobulinaemia: a large, observational, retrospective chart review. Lancet Haematol 2018; 5(7): e299–e309.
7. Castillo JJ, D’Sa S, Lunn MP, et al. Central nervous system involvement by Waldenström macroglobulinaemia (Bing-Neel syndrome): a multi-institutional retrospective study. Br J Haematol 2016; 172(5): 709–715.
8. Castillo JJ, Garcia-Sanz R, Hatjiharissi E, et al. Recommendations for the diagnosis and initial evaluation of patients with Waldenström macroglobulinaemia: a task force from the 8th International Workshop on Waldenström macroglobulinaemia. Br J Haematol 2016; 175(1): 77–86.
9. Coucke L, Marcelis L, Deeren D, et al. Lymphoplasmacytic lymphoma exposed by haemoptysis and acquired von Willebrand syndrome. Blood Coagul Fibrinolysis 2014; 25(4): 395–397.
10. Chapman MA, Lawrence MS, Keats JJ, et al. Initial genome sequencing and analysis of multiple myeloma. Nature 2011; 471(7339): 467–472.
11. D’Sa S, Kersten MJ, Castillo JJ, et al. Investigation and management of IgM and Waldenström-associated peripheral neuropathies: recommendations from the IWWM-8 consensus panel. Br J Haematol 2017; 176(5): 728–742.
12. Drappatz J, Akar S, Fisher DC, et al. Imaging of Bing-Neel syndrome. Neurology 2008; 70(16): 1364.
13. Ghobrial IM. Are you sure this is Waldenström macroglobulinemia? Hematology Am Soc Hematol Educ Program 2012; 2012 : 586–594.
14. Gnemmi V, Leleu X, Provot F, et al. Cast nephropathy and light-chain deposition disease in Waldenström macroglobulinemia. Am J Kidney Dis 2012; 60(3): 487–491.
15. Growkova K, Kufová Z, Sevcikova T, et al. Diagnostic tools of Waldenströms macroglobulinemia – best possibilities for non-invasive and long-term disease monitoring. Klin Onkol 2017; 30(Suppl 2): 81–91.
16. Gustine JN, Meid K, Dubeau T, et al. Serum IgM level as predictor of symptomatic hyperviscosity in patients with Waldenström macroglobulinaemia. Br J Haematol 2017; 177(5): 717–725.
17. Hivert B, Caron C, Petit S, et al. Clinical and prognostic implications of low or high level of von Willebrand factor in patients with Waldenström macroglobulinemia. Blood 2012; 120(16): 3214–3221.
18. Hunter ZR, Manning RJ, Hanzis Ch, et al. IgA and IgG hypogammaglobulinemia in Waldenström’s macroglobulinemia. Haematologica 2010; 95(3): 470–475.
19. Jelinek T, Bezdekova R, Zatopkova M, et al. Current applications of multiparameter flow cytometry in plasma cell disorders. Blood Cancer J 2017; 7(10): e617.
20. Jiménez C, Sebastián E, Chillón MC, et al. MYD88 L265P is a marker highly characteristic of, but not restricted to, Waldenström’s macroglobulinemia. Leukemia 2013; 27(8): 1722–1728.
21. Kastritis E, Zervas K, Repoussis P, et al. Prognostication in young and old patients with Waldenström’s macroglobulinemia: importance of the International Prognostic Scoring System and of serum lactate dehydrogenase. Clin Lymphoma Myeloma 2009; 9(1): 50–52.
22. Kastritis E, Kyrtsonis MCH, Morel P, et al. Competing risk survival analysis in patients with symptomatic Waldenström macroglobulinemia: the impact of disease unrelated mortality and of rituximab-based primary therapy. Haematologica 2015; 100(11): e446–e449.
23. Kim HJ, Suh S, Kim JH, et al. Brain magnetic resolution imaging to diagnose Bing-Neel syndrome. J Korean Neurosurg Soc 2009; 46 : 588–591.
24. Leleu X, Roccaro AM, Moreau AS, et al. Waldenström macroglobulinemia. Cancer Lett 2008; 270(1): 95–107.
25. Leleu X, Xie W, Bagshaw M, et al. The role of serum immunoglobulin free light chain in response and progression in Waldenström macroglobulinemia. Clin Cancer Res 2011; 17(9): 3013–3018.
26. Levine T, Pestronk A, Florence J, et al. Peripheral neuropathies in Waldenström’s macroglobulinaemia. J Neurol Neurosurg Psychiatry 2006; 77(2): 224–228.
27. Martyn CN, Hughes RA. Epidemiology of peripheral neuropathy. J Neurol Neurosurg Psychiatry 1997; 62(4): 310–318.
28. Menke MN, Feke GT, McMeel JW, et al. Hyperviscosity-related retinopathy in Waldenström macroglobulinemia. Arch Ophthalmol 2006; 124(11): 1601–1606.
29. Merlini G, Wechalekar AD, Palladini G. Systemic light chain amyloidosis: an update for treating physicians. Blood 2013; 121 : 5124–5130.
30. Minnema MC, Kimby E, D’Sa S, et al. Guideline for the diagnosis, treatment and response criteria for Bing-Neel syndrome. Haematologica 2017; 102(1): 43–51.
31. Morel P, Duhamel A, Gobbi P, et al. International prognostic scoring system for Waldenström macroglobulinemia. Blood 2009; 113(18): 4163–4170.
32. Nguyen-Khac F, Lambert J, Chapiro E, et al. Chromosomal aberrations and their prognostic value in a series of 174 untreated patients with Waldenström’s macroglobulinemia. Haematologica 2013; 98(4): 649–654.
33. Nobile-Orazio E, Francomano E, Daverio R, et al. Anti-myelin-associated glycoprotein IgM antibody titers in neuropathy associated with macroglobulinemia. Ann Neurol 1989; 26(4): 543–550.
34. Owen RG, Kyle RA, Stone MJ, et al. Response assessment in Waldenström macroglobulinaemia: update from the VIth International Workshop. Br J Haematol 2013; 160(2): 171–176.
35. Ocio EM, Schop RFJ, Gonzalez B, et al. 6q deletion in Waldenström macroglobulinemia is associated with features of adverse prognosis. Br J Haematol 2007; 136 : 80–86.
36. Owen RG. Developing diagnostic criteria in Waldentröm’s macroglobulinemia. Semin Oncol 2003; 30 : 196–200.
37. Owen RG, Pratt G, Auer RL, et al. Guidelines on the diagnosis and management of Waldenström macroglobulinaemia. Br J Haematol 2014; 165(3): 316–333.
38. Paiva B, Montes MC, García-Sanz R, et al. Multiparameter flow cytometry for the identification of the Waldenström’s clone in IgM-MGUS and Waldenström’s macroglobulinemia: new criteria for differential diagnosis and risk stratification. Leukemia 2014; 28(1): 166–173.
39. Poulain S, Dervite I, Leleu X, et al. Autoimmune hemolytic anemias and IgG antierythrocyte autoantibodies in Waldenström’s macroglobulinemia: association with FcgammaRIIa polymorphism. Leukemia 2006; 20 : 1179–1181.
40. Poulain S, Roumier C, Decambron A, et al. MYD88 L265P mutation in Waldenström macroglobulinemia. Blood 2013; 121(22): 4504–4511.
41. Puente XS, Pinyol M, Quesada V, et al. Whole-genome sequencing identifies recurrent mutations in chronic lymphocytic leukaemia. Nature 2011; 475(7354): 101–105.
42. Rajkumar SV, Gertz MA, Kyle RA. Prognosis of patients with primary systemic amyloidosis who present with dominant neuropathy. Am J Med 1998; 104 : 232–237.
43. Schop RFJ, Fonseca R. Genetics and cytogenetics of Waldenström’s macroglobulinemia. Semin Oncol 2003; 30 : 142–145.
44. Simon L, Fitsiori A, Lemal R, et al. Bing-Neel syndrome, a rare complication of Waldenström macroglobulinemia: analysis of 44 cases and review of the literature. A study on behalf of the French Innovative Leukemia Organization (FILO). Haematologica 2015; 100(12): 1587–1594.
45. Stone MJ. Waldenström’s macroglobulinemia: hyperviscosity syndrome and cryoglobulinemia. Clin Lymphoma Myeloma 2009; 9(1): 97–99.
46. Stone MJ, Bogen SA. Evidence-based focused review of management of hyperviscosity syndrome. Blood 2012; 119 : 2205–2208.
47. Teras LR, DeSantis CE, Cerhan JR, et al. US lymphoid malignancy statistics by World Health Organization subtypes. CA Cancer J Clin 2016; 66(6): 443–459.
48. Terrier B, Jaccard A, Harousseau JL, et al. The clinical spectrum of IgM-related amyloidosis: a French nationwide retrospective study of 72 patients. Medicine (Baltimore) 2008; 87(2): 99–109.
49. Treon SP. How I treat Waldenström macroglobulinemia. Blood 2009; 114(12): 2375–2385.
50. Treon SP, Xu L, Yang G, et al. MYD88 L265P somatic mutation in Waldenström’s macroglobulinemia. N Engl J Med 2012; 367 : 826–833.
51. Treon SP, Tripsas CK, Ciccarelli BT, et al. Patients with Waldenström macroglobulinemia commonly present with iron deficiency and those with severely depressed transferrin saturation levels show response to parenteral iron administration. Clin Lymphoma Myeloma Leuk 2013; 13(2): 241–243.
52. Treon, SP, Cao Y, Xu L, et al. Somatic mutations in MYD88 and CXCR4 are determinants of clinical presentation and overall survival in Waldenström macroglobulinemia. Blood 2014; 123 : 2791–2796.
53. Treon SP, Xu L, Hunter Z. MYD88 Mutations and Response to Ibrutinib in Waldenström’s Macroglobulinemia. N Engl J Med 2015; 373(6): 584–586.
54. Treon SP. How I treat Waldenström macroglobulinemia. Blood 2015; 126(6): 721–732.
55. Trøen G, Warsame A, Delabie J. CD79B and MYD88 mutations in splenic marginal zone lymphoma. ISRN Oncol 2013; 252318.
56. Vlam L, Piepers S, Sutedja NA, et al. Association of IgM monoclonal gammopathy with progressive muscular atrophy and multifocal motor neuropathy: a case-control study. J Neurol 2015; 262(3): 666–673.
57. Vos JMI, Minnema MC, Wijermans PW, et al. Guideline for diagnosis and treatment of Waldenström’s macroglobulinaemia. Neth J Med 2013; 71 : 54–62.
58. Vos JM, Manning RR, Meid K, et al. Defining the incidence, pathology and clinical outcomes of kidney disease related to Waldenström’s macroglobulinemia and IgM MGUS. Blood 2015; 126 : 3926.
59. Wang, L, Lawrence MS, Wan Y, et al. SF3B1 and other novel cancer genes in chronic lymphocytic leukemia. N Engl J Med 2011; 365 : 2497–2506.
60. Wang H, Chen Y, Li F, Delasalle K, et al. Temporal and geographic variations of Waldenström macroglobulinemia incidence: a large population-based study. Cancer 2012; 118(15): 3793–3800.
61. WHO classification of tumours of haematopoietic and lymphoid tissues. Vol. 2 (Ed Revised 4th Edition). Geneva: WHO Press 2017.
Literatura pro léčebnou část
1. Abbi KKS, Muzaffar M, Gaudin D, et al. Primary CNS lymphoplasmacytic lymphoma: a case report and review of literature. Hematol Oncol Stem Cell Ther 2013; 6(2): 76–78.
2. Abdallah AO, Atrash S, Muzaffar J, et al. Successful treatment of Bing-Neel syndrome using intrathecal chemotherapy and systemic combination chemotherapy followed by BEAM auto-transplant: a case report and review of literature. Clin Lymphoma Myeloma Leuk 2013; 13(4): 502–506.
3. Anagnostopoulos A, Giralt S. Stem cell transplantation (SCT) for Waldenström’s macroglobulinemia (WM). Bone Marrow Transplant 2002; 29 : 943–947.
4. Anagnostopoulos A, Hari PN, Pérez WS, et al. Autologous or allogeneic stem cell transplantation in patients with Waldenström’s macroglobulinemia. Biol Blood Marrow Transplant 2006; 12(8): 845–854.
5. Ansell SM, Kyle RA, Reeder CB, et al. Diagnosis and management of Waldenström macroglobulinemia: Mayo stratification of macroglobulinemia and risk-adapted therapy (mSMART) guidelines. Mayo Clin Proc 2010; 85 : 824–833.
6. Bachanova V, Burns LJ. Hematopoietic cell transplantation for Waldenström macroglobulinemia. Bone Marrow Transplant 2012; 47(3): 330–336.
7. Barta SK, Li H, Hochster HS, et al. Randomized phase 3 study in low-grade lymphoma comparing maintenance anti-CD20 antibody with observation after induction therapy: A trial of the ECOG-ACRIN Cancer Research Group (E1496). Cancer 2016; 122(19): 2996–3004.
8. Buske C, Hoster E, Dreyling M, et al. The addition of rituximab to front-line therapy with CHOP (R-CHOP) results in a higher response rate and longer time to treatment failure in patients with lymphoplasmacytic lymphoma: results of a randomized trial of the German Low-Grade Lymphoma Study Group (GLSG). Leukemia 2009; 23(1): 153–161.
9. Buske C, Leblond V. How to manage Waldenström’s macroglobulinemia. Leukemia 2013; 27 : 762–772.
10. Buske C, Sadullah S, Kastritis E, et al. Treatment and outcome patterns in European patients with Waldenström’s macroglobulinaemia: a large, observational, retrospective chart review. Lancet Haematol 2018; 5(7): e299–e309.
11. Cabannes-Hamy A, Lemal R, Goldwirt L, et al. Efficacy of ibrutinib in the treatment of Bing-Neel syndrome. Am J Hematol 2016; 91(3): e17–e19.
12. Castillo JJ, Kanan S, Meid K, et al. Rituximab intolerance in patients with Waldenström macroglobulinaemia. Br J Haematol 2016; 174(4): 645–648.
13. Castillo JJ, D’Sa S, Lunn MP, et al. Central nervous system involvement by Waldenström macroglobulinaemia (Bing-Neel syndrome): a multi-institutional retrospective study. Br J Haematol 2016; 172(5): 709–715.
14. Castillo JJ, Gustine J, Meid K, et al. Bendamustine and bortezomib-containing regimens produce higher response rates and more durable responses versus cyclophosphamide-based therapy in frontline Waldenström macroglobulinemia. Blood 2017; 130 : 1488.
15. Castillo JJ, SP. Toward personalized treatment in Waldenström macroglobulinemia. Hematology Am Soc Hematol Educ Program 2017; 365–370.
16. Chen CI, Kouroukis CT, White D, et al. Bortezomib is active in patients with untreated or relapsed Waldenström’s macroglobulinemia: a phase II study of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007; 25(12): 1570–1575.
17. Clark WF, Rock GA, Buskard N, et al. Therapeutic plasma exchange: an update from the Canadian Apheresis Group. Ann Intern Med 1999; 131 : 453–462.
18. D’Sa S, Kersten M J, Castillo JJ, et al. Investigation and management of IgM and Waldenström associated peripheral neuropathies: recommendations from the IWWM8 consensus panel. Br J Haematol 2017 : 176 : 728–742.
19. Dhedin N, Tabrizi R, Bulabois PE, et al. Hematopoietic stem cell transplantation (HSCT) in Waldenström macroglobulinemia (WM): update of the French experience in 54 cases. Haematologica 2007; 92(S): 228.
20. Dimopoulos MA, Anagnostopoulos A, Kyrtsonis MC, et al. Treatment of relapsed or refractory Waldenström’s macroglobulinemia with bortezomib. Haematologica 2005; 90(12): 1655–1658.
21. Dimopoulos MA, Zervas C, Zomas A, et al. Treatment of Waldenström’s macroglobulinemia with rituximab. J Clin Oncol 2002; 20(9): 2327–2333.
22. Dimopoulos MA, Anagnostopoulos A, Kyrtsonis MC, et al. Primary treatment of Waldenström macroglobulinemia with dexamethasone, rituximab, and cyclophosphamide. J Clin Oncol 2007; 25(22): 3344–3349.
23. Dimopoulos MA, et al. Primary therapy of Waldenström macroglobulinemia (WM) with weekly bortezomib, low-dose dexamethasone, and rituximab (BDR): long-term results of a phase 2 study of the European Myeloma Network (EMN). Blood 2013; 122(19): 3276–3282.
24. Dimopoulos MA, Trotman J, Tedeschi A, et al. Ibrutinib for patients with rituximab-refractory Waldenström’s macroglobulinaemia (iNNOVATE): an open-label substudy of an international, multicentre, phase 3 trial. Lancet Oncol 2017; 18(2): 241–250.
25. Drew MJ. Plasmapheresis in the dysproteinemias. Ther Apher 2002; 6 : 45–52.
26. Gertz MA, Rue M, Blood E, et al. Multicenter phase 2 trial of rituximab for Waldenström macroglobulinemia (WM): an Eastern Cooperative Oncology Group Study (E3A98). Leuk Lymphoma 2004; 45(10): 2047–2055.
27. Gertz MA, Reeder CB, Kyle RA, et al. Stem cell transplant for Waldenström macroglobulinemia: an underutilized technique. Bone Marrow Transplant 2012; 47 : 1147–1153.
28. Ghobrial IM, Hong F, Padmanabhan S, et al. Phase II trial of weekly bortezomib in combination with rituximab in relapsed or relapsed and refractory Waldenström macroglobulinemia. J Clin Oncol 2010; 28(8): 1422–1428.
29. Ghobrial IM, Witzig TE, Gertz M, et al. Long-term results of the phase II trial of the oral mTOR inhibitor everolimus (RAD001) in relapsed or refractory Waldenström macroglobulinemia. Am J Hematol 2014; 89(3): 237–242.
30. Ghobrial IM, Redd R, Armand P, et al. Phase I/II trial of everolimus in combination with bortezomib and rituximab (RVR) in relapsed/refractory Waldenström macroglobulinemia. Leukemia 2015; 29(12): 2338–2346.
31. Ghobrial IM, Savona MR, Vij R, et al. Final results from a multicenter, open-label, dose-escalation phase 1b/2 study of single-agent oprozomib in patients with hematologic malignancies. Blood 2016 128 : 2110.
32. Gilleece MH, Pearce R, Linch DC, et al. The outcome of haemopoietic stem cell transplantation in the treatment of lymphoplasmacytic lymphoma in the UK: a British Society Bone Marrow Transplantation study. Hematology 2008; 13 : 119–127.
33. Gustine JN, Meid K, Dubeau T, et al. Ibrutinib discontinuation in Waldenström macroglobulinemia: Etiologies, outcomes, and IgM rebound. Am J Hematol 2018; 93(4): 511–517.
34. Gustine J, et al. Impact of ibrutinib dose intensity on patient outcomes in previously treated Waldenström macroglobulinemia. Blood 2017; 130(Suppl 1): 4051.
35. Hoang-Xuan K, Bessell E, Bromberg J, et al. Diagnosis and treatment of primary CNS lymphoma in immunocompetent patients: guidelines from the European Association for Neuro-Oncology. Lancet Oncol 2015; 16(7): e322–e332.
36. Hochster H, Weller E, Gascoyne RD, et al. Maintenance rituximab after cyclophosphamide, vincristine, and prednisone prolongs progression-free survival in advanced indolent lymphoma: results of the randomized phase III ECOG1496 Study. J Clin Oncol 2009; 27(10): 1607–1614.
37. Imai F, Fujisawa K, Kiya N, et al. Intracerebral infiltration by monoclonal plasmacytoid cells in Waldenström’s macroglobulinemia – case report. Neurol Med Chir (Tokyo) 1995; 35(8): 575–579.
38. Kanan S, Meid K, Treon SP, et al. Clinical characteristics of rituximab intolerance in patients with Waldenström’s macroglobulinemia. Blood 2014; 124 : 2610.
39. Kapoor P, Ansell SM, Fonseca R, et al. Diagnosis and management of Waldenström macroglobulinemia: Mayo stratification of macroglobulinemia and risk-adapted therapy (mSMART) Guidelines 2016. JAMA Oncol 2017; 3(9): 1257–1265.
40. Kastritis E, Gavriatopoulou M, Kyrtsonis MCh, et al. Dexamethasone, rituximab, and cyclophosphamide as primary treatment of Waldenström macroglobulinemia: final analysis of a phase 2 study. Blood 2015; 126 : 1392–1394.
41. Kastritis E, Leblond V, Dimopoulos MA, et al. Waldenström’s macroglobulinaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29(Suppl 4): iv41–iv50.
42. Kastritis E, Dimopoulos MA. Proteasome inhibitors in Waldenström macroglobulinemia. Hematol Oncol Clin North Am 2018; 32 : 829–840.
43. Kaščák M, Kufová Z, Growková K, et al. Waldenströmova makroglobulinémie v roce 2016: optimalizace imunochemoterapie s cílem minimalizace nežádoucích účinků. Onkológia pre Prax 2016; 5 : 291–295.
44. Kaščák M, Ďuraš J, Navrátil M, et al. Autologní transplantace kmenových buněk u Waldenströmovy makroglobulinémie. Transfuze Hematol dnes 2016; 1 : 28–38.
45. Katzmann JA, Snyder MR, Rajkumar SV, et al. Long-term biological variation of serum protein electrophoresis M-spike, urine M-spike, and monoclonal serum free light chain quantification: implications for monitoring monoclonal gammopathies. Clin Chem 2011; 57(12): 1687–1692.
46. Kyriakou C, Canals C, Taghipour G, et al. Autologous stem cell transplantation (ASCT) for patients with Waldenström’s macroglobulinaemia: an analysis of 201 cases from the European Bone Marrow Transplant Registry (EBMT). Haematologica 2007; 92(S2): 228.
47. Kyriakou C, Advani RH, Ansell SM, et al. Indications for hematopoietic stem cell transplantation in patients with Waldenstrom’s macroglobulinemia: a consensus project of the EBMT Lymphoma Working Party (LWP)/ European Consortium for Waldenström’s macroglobulinemia (ECWM)/International Waldenström’s Macroglobulinemia Foundation (IWMF). Blood 2017; 130 : 2026.
48. Kyriakou C, Canals C, Sibon D, et al. High-dose therapy and autologous stem-cell transplantation in Waldenström macroglobulinemia: the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2010; 28(13): 2227–2232.
49. Leblond V, Kastritis E, Advani R, et al. Treatment recommendations from the Eighth International Workshop on Waldenström’s Macroglobulinemia. Blood 2016; 128(10): 1321–1328.
50. Leleu X, Soumerai J, Roccaro A, et al. Increased incidence of transformation and myelodysplasia/acute leukemia in patients with Waldenström macroglobulinemia treated with nucleoside analogs. J Clin Oncol 2009; 27(2): 250-255.
51. NCCN Guidelines Version 1.2018 Waldenström’s Macroglobulinemia/Lymphoplasmacytic lymphoma. Dostupné z: https://www.nccn.org/professionals/physician_gls/default.aspx#site
52. Mahmood A, Sodano D, Dash A, et al. Therapeutic plasma exchange performed in tandem with hemodialysis for patients with M-protein disorders. J Clin Apher 2006; 21(2): 100–104.
53. Malkani RG, Tallman M, Gottardi-Littell N, et al. Bing-Neel syndrome: an illustrative case and a comprehensive review of the published literature. J Neurooncol 2010; 96(3): 301–312.
54. Mason C, Savona S, Rini JN, et al. Ibrutinib penetrates the blood brain barrier and shows efficacy in the therapy of Bing Neel syndrome. Br J Haematol 2017; 179(2): 339–341.
55. Menke MN, Feke GT, McMeel JW, et al. Ophthalmologic techniques to assess the severity of hyperviscosity syndrome and the effect of plasmapheresis in patients with Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma 2009; 9 : 100–103.
56. Minnema MC, Kimby E, D’Sa S, et al. Guideline for the diagnosis, treatment and response criteria for Bing-Neel syndrome. Haematologica 2017; 102(1):43–51.
57. Munshi NC, Barlogie B. Role for high-dose therapy with autologous hematopoietic stem cell support in Waldenström’s macroglobulinemia. Semin Oncol 2003; 30 : 282–285.
58. Olszewski AJ, Treon SP, Castillo JJ. Comparative effectiveness of rituximab-based immunochemotherapy in Waldenström’s macroglobulinemia (WM). Blood 2016; 128 : 2986.
59. Olszewski AJ, Chen C, Gutman R, et al. Comparative outcomes of immunochemotherapy regimens in Waldenström macroglobulinaemia. Br J Haematol 2017; 179 : 106–115.
60. Owen RG, Kyle RA, Stone MJ, et al. Response assessment in Waldenström macroglobulinaemia: update from the VIth International Workshop. Br J Haematol 2013; 160(2): 171–176.
61. Paludo J, Abeykoon JP, Hesse AB, et al. Bendamustine and rituximab versus dexamethasone, rituximab and cyclophosphamide in patients with Waldenström macroglobulinemia (WM). Blood 2016; 128 : 2968.
62. Paludo J, Abeykoon JP, Kumar S, et al. Dexamethasone, rituximab and cyclophosphamide for relapsed and/or refractory and treatment-naïve patients with Waldenström macroglobulinemia. Br J Haematol 2017; 179(1): 98–105.
63. Rezvani AR, Maloney DG. Rituximab resistance. Best Pract Res Clin Haematol 2011; 24 : 203–216.
64. Rummel MJ, Niederle N, Maschmeyer G, et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 2013; 381(9873): 1203–1210.
65. Saad S, Wang TJC. Neurocognitive deficits after radiation therapy for brain malignancies. Am J Clin Oncol 2015; 38 : 634–640.
66. Salles G, Seymour JF, Offner F, et al. Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): a phase 3, randomised controlled trial. Lancet 2011; 377(9759): 42–51.
67. Shimizu K, Fujisawa K, Yamamoto H, et al. Importance of central nervous system involvement by neoplastic cells in a patient with Waldenström’s macroglobulinemia developing neurologic abnormalities. Acta Haematologica 1993; 90 : 206–208.
68. Simon, L, Fitsiori A, Lemal R, et al. Bing-Neel syndrome, a rare complication of Waldenström macroglobulinemia: analysis of 44 cases and review of the literature. A study on behalf of the French Innovative Leukemia Organization (FILO). Haematologica 2015; 100(12): 1587–1594.
69. Souchet-Compain L, Nguyen S, Choquet S, et al. Primary therapy of Waldenström macroglobulinemia with nucleoside analogue-based therapy. Clin Lymphoma Myeloma Leuk 2013; 13 : 227–230.
70. Souchet L, Levy V, Ouzegdouh M, et al. Efficacy and long-term toxicity of the rituximab-fludarabine-cyclophosphamide combination therapy in Waldenström’s macroglobulinemia. Am J Hematol 2016; 91(8): 782–786.
71. Stone MJ, Bogen SA. Evidence-based focused review of management of hyperviscosity syndrome. Blood 2012; 119 : 2205–2208.
72. Tam CS, Wolf M, Prince HM, et al. Fludarabine, cyclophosphamide, and rituximab for the treatment of patients with chronic lymphocytic leukemia or indolent non-Hodgkin lymphoma. Cancer 2006; 106(11): 2412–2420.
73. Tedeschi A, Benevolo G, Varettoni M, et al. Fludarabine plus cyclophosphamide and rituximab in Waldenström macroglobulinemia: an effective but myelosuppressive regimen to be offered to patients with advanced disease. Cancer 2012; 118(2): 434–443.
74. Tedeschi A, Picardi P, Ferrero S, et al. Bendamustine and rituximab combination is safe and effective as salvage regimen in Waldenström macroglobulinemia. Leuk Lymphoma 2015; 56(9): 2637–2642.
75. Tedeschi A, Picardi P, Goldaniga MC, et al. Long term toxicity and follow-up of Waldenström’s macroglobulinemia patients after salvage treatment with fludarabine cyclophosphamide rituximab or bendamustine and rituximab. Blood 2015; 126 : 3958.
76. Treon SP, Emmanouilides C, Kimby E, et al. Extended rituximab therapy in Waldenström’s macroglobulinemia. Ann Oncol 2005; 16(1): 132–138.
77. Treon SP, Branagan AR, Hunter Z, et al. Paradoxical increases in serum IgM and viscosity levels following rituximab in Waldenström’s macroglobulinemia. Ann Oncol 2004; 15(10): 1481–1483.
78. Treon SP, Hunter ZR, Matous J, et al. Multicenter clinical trial of bortezomib in relapsed/refractory Waldenström’s macroglobulinemia: results of WMCTG Trial 03-248. Clin Cancer Res 2007; 13(11): 3320–3325.
79. Treon SP, Branagan AR, Ioakimidis L, et al. Long-term outcomes to fludarabine and rituximab in Waldenström macroglobulinemia. Blood 2009; 113 : 3673–3678.
80. Treon SP, Hanzis C, Manning RJ, et al. Maintenance rituximab is associated with improved clinical outcome in rituximab naïve patients with Waldenström macroglobulinaemia who respond to a rituximab-containing regimen. Br J Haematol 2011; 154(3): 357–362.
81. Treon SP, Hanzis C, Tripsas C, et al. Bendamustine therapy in patients with relapsed or refractory Waldenström’s macroglobulinemia. Clin Lymphoma Myeloma Leuk 2011; 11(1): 133–135.
82. Treon SP, Hunter ZR. A new era for Waldenstrom macroglobulinemia: MYD88 L265P. Blood 2013; 121(22): 4434–4436.
83. Treon SP, Tripsas CK, Meid K, et al. Carfilzomib, rituximab, and dexamethasone (CaRD) treatment offers a neuropathy-sparing approach for treating Waldenström’s macroglobulinemia. Blood 2014; 124(4): 503–510.
84. Treon SP, Tripsas ChK, Meid K, et al. Ibrutinib in previously treated Waldenström’s macroglobulinemia. N Engl J Med 2015; 372 : 1430–1440.
85. Treon SP, Gustine J, Meid K, et al. Ibrutinib is highly active as first line therapy in symptomatic Waldenström’s macroglobulinemia. Blood 2017; 130 : 2767.
86. Treon SP, Meid K, Gustine J, et al. Long-term follow-up of previously treated patients who received ibrutinib for symptomatic Waldenström’s macroglobulinemia: update of pivotal clinical trial. Blood 2017; 130 : 2766.
87. Tournilhac O, Leblond V, Tabrizi R, et al. Transplantation in Waldenström’s macroglobulinemia – the French experience. Semin Oncol 2003; 30 : 291–296.
88. Tripsas C, Ioakimidis LI, Hunter ZR, et al. Comparative response assessment by total serum IgM and IgM M-component in Waldenström’s macroglobulinemia. Journal of Clinical Oncology 2012; 30: e18575.
89. van Cauwenberge MG, Depreter B, Dumoulin EN, et al. Bing-Neel syndrome: Two unexpected cases and a review of the literature. Neurol Sci 2015; 356(1–2): 19–26.
90. van Oers MHJ, Van Glabbeke M, Teodorovic I, et al. Chimeric antiCD20 monoclonal antibody (rituximab; Mabthera®) in remission induction and maintenance treatment of relapsed/resistant follicular non-Hodgkin’s lymphoma: a phase III randomized intergroup clinical trial. Blood 2004; 104 : 41A.
91. Varettoni M, Marchioni E, Bonfichi M, et al. Successful treatment with rituximab and bendamustine in a patient with newly diagnosed Waldenström’s macroglobulinemia complicated by Bing-Neel syndrome. Am J Hematol 2015; 90(8): e152–e153.
92. Vesole DH, Richter J, Biran N, et al. Carfilzomib as salvage therapy in Waldenström macroglobulinemia: a case series. Leuk Lymphoma 2018; 59(1): 259–261.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo Supplementum 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
Nejčtenější v tomto čísle- DIAGNOSTIKA A LÉČBA SYSTÉMOVÉ AL AMYLOIDÓZY
- DIAGNOSTIKA A LÉČBA WALDENSTRÖMOVY MAKROGLOBULINEMIE
- ÚVODNÍ SLOVO
- ÚVODNÍ SLOVO
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



