-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
Chronic recurrent urticaria, joint and bone pain, fever of unknown origin and monoclonal IgM = Schnitzler’s syndrome
Schnitzler’s syndrome is an acquired auto-inflammatory disease of as yet unclear origin. The Strasbourg criteria (non-infectious fever, chronic urticaria, changes in bone structure, leucocytosis, elevated inflammatory markers – CRP and the presence of monoclonal immunoglobulin mostly IgM, very rarely of IgG) were adopted to establish this diagnosis. First-line therapy for this disease involves blocking interleukin-1 effects. In practice, the interleukin-1 receptor antagonist, anakinra, is most commonly used. Currently, there have also been reports regarding the use of other interleukin-1 blockers, namely canakinumab and rilonacept. We are currently treating 5 men, median age at diagnosis 53 (42–60) years, with anakinra. Median duration of treatment is 56 (19–122) months. In all the patients, we began administration of anakinra at a dose of 100 mg once a day. Administration of 100 mg once a day, led to the complete resolution of symptoms in 4 patients, and a reduction by about 75 % in 1 patient. This patient required an increased dose of 2 ampoules per day when his symptoms intensified. After one year of treatment, one of the four patients whose symptoms had completely disappeared using the 100 mg daily dose required this same dose at an interval 48-hour hours. However, this patient does not tolerate further extension of the intervals between doses. We have not recorded any adverse effects of anakinra in the course of the treatment and no decline in the efficiency of anakinra has been observed: it acts as effectively now as it did at the beginning of treatment. The text discusses the differential diagnosis of Schnitzler syndrome.>
Key words:
Schnitzler’s syndrome – Adult Still’s disease – auto-inflammatory diseases – monoclonal gammopathy – interleukin 1 – anakinra – fever of unknown origin – FUO
Autoři: Z. Adam 1; R. Koukalová 2; M. Krejčí 1; Z. Čermáková 3; E. Vetešníková 1; L. Pour 1; V. Sandecká 1; M. Štork 1; Z. Řehák 2; E. Pourová 4; A. Čermák 5; Z. Král 1; J. Mayer 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Oddělení nukleární medicíny, centrum PET, RECAMO. Masarykův onkologický ústav v Brně 2; Oddělení klinické biochemie FN Brno a Katedra laboratorních metod LF MU Brno 3; Ambulance praktického lékaře pro dospělé, Pustiměř u Vyškova 4; Urologická klinika LF MU a FN Brno 5
Vyšlo v časopise: Transfuze Hematol. dnes,24, 2018, No. 2, p. 88-103.
Kategorie: Souhrnné a edukační práce
Souhrn
stanovením této diagnózy byla přijata Štrasburská kritéria (neinfekční horečka, chronická kopřivka, změny kostní struktury, leukocytóza a zvýšené hodnoty zánětlivých markerů (CRP) a přítomnost monoklonálního imunoglobulinu většinou typu IgM, zcela výjimečně IgG. Léčbou volby pro tuto nemoc je blokáda účinků interleukinu-1. V praxi je nejčastěji využíván antagonista receptoru pro interleukin-1, anakinra. V současnosti se objevují zprávy i o použití dalších léků blokujících účinek interleukinu-1, canakinumabu a rilonaceptu. Diagnóza syndromu Schnitzlerové byla stanovena u 5 mužů, medián věku byl 53 (42–60) let. Všichni jsou léčeni preparátem anakinra, první z nich již více než 10 let. Medián sledování na léčbě anakinrou je 56 (19–122) měsíců. U všech nemocných jsme začali s aplikací anakinry v dávce 100 mg 1x denně. Při dávkování 100 mg 1x denně vymizely kompletně všechny příznaky u 4 nemocných, pouze u jednoho nemocného došlo k ústupu příznaků asi o 75 %, nikoliv však k úplnému vymizení. U jednoho ze 4 pacientů, u nichž příznaky při dávkování 1x denně zcela vymizely, se po roce léčby ukázalo dostačující podávat anakinru v 48hodinových intervalech. Delší prodloužení intervalu mezi aplikacemi však netoleruje. V průběhu léčby jsme nezaznamenali žádné nežádoucí účinky anakinry a nedochází k poklesu účinnosti léčby. V textu je dále rozvedena diferenciální diagnostika syndromu Schnitzlerové.
Klíčová slova:
syndrom Schnitzlerové – Stillova choroba dospělých – autoinflamatorní choroby – monoklonální gamapatie – interleukin-1 – anakinra – horečka nejasné etiologi
ÚVOD
V roce 1972 a 1974 poprvé popsala francouzská kožní lékařka Liliane Schnitzler pět pacientů s chronickými neinfekčními horečkami, chronickou kopřivkou (urtikariální vaskulitidou), spojenou s bolestí kostí, svalů, kloubů. Následující vyšetření těchto pacientů odhalilo kostní změny (hyperostózu), lymfadenopatii a přítomnost monoklonálního imunoglobulinu třídy IgM [1–3]. V té době se jednalo o novou klinickou jednotku neznámé etiologie, a ta byla pojmenována po autorce prvního popisu v anglické literatuře jako „Schnitzler’s syndrome“. Protože se jednalo o francouzskou lékařku, tak budeme používat názvu syndrom Schnitzlerové, i když dnešní mladé ženy vdané za cizince si příponu -ová nedávají, takže by bylo asi přijatelné používat i termínu Schnitzler syndrom. Diskusi o překladu necháme jazykovědcům a v dalším textu budeme používat termínu syndrom Schnitzlerové. Zásadním laboratorním znakem této nemoci je přítomnost monoklonálního imunoglobulinu typu IgM, výjimečně ale také typu IgG a zcela výjimečně i IgA. Dominantní úlohu v rozvoji základních zánětlivých rysů této nemoci má však interleukin-1. Zatím zůstává záhadou, jaký je vztah zvýšené koncentrace interleukinu-1 a monoklonálního imunoglobulinu [4–6]. Pro nemocné s touto chorobou nebyl dlouho dostupný žádný účinný lék, a tak velmi trpěli. Antihistaminika a imunosupresivní léky nebyly u těchto pacientů účinné, protizánětlivé léky jen tlumily bolest a přechodně snižovaly horečku. Pouze vysoké dávky glukokortikoidů mírnily příznaky nemoci, ale na druhé straně vyvolávaly známé nepříjemné projevy dlouhodobého podávání vysokých dávek glukokortikoidů. Teprve až se v roce 2005 do klinické praxe dostaly léky blokující cíleně účinek interleukinu-1 (anakinra), bylo možné ve většině případů zcela odstranit příznaky této nemoci, či příznaky alespoň zmírnit [5, 6]. Monoklonální gamapatie typu IgM, provázející syndrom Schnitzlerové, se asi u 15–20 % pacientů při dlouhodobém sledování transformuje v maligní lymfoproliferativní onemocnění [7]. Pak by měli být tito nemocní léčeni postupy běžnými pro uvedené lymfoproliferativní onemocnění. Pacienti se syndromem Schnitzlerové jsou proto většinou léčeni a sledováni hematoonkology. Dříve při nedostupnosti účinné léčby byli tito pacienti při dlouhodobém průběhu nemoci poškozováni depozity AA-amyloidu, protože chronický zánětlivý proces vedl k dlouhodobě zvýšené koncentraci amylopeptidu-A, který se ukládal ve formě AA-amyloidu [8, 9]. A někdy se nemoc projevila také lymfadenopatií [10]. V roce 2008 jsme popsali první případ v České republice, který byl úspěšně léčen preparátem anakinra [11]. Postupně jsme tuto nemoc diagnostikovali a začali léčit u dalších čtyř nemocných [12]. V době, kdy jsme tuto léčbu zahajovali, jsme si kladli otázku, jak dlouho tato léčba bude úspěšná a zda se v jejím průběhu neobjeví neočekávané nežádoucí účinky. V následujícím textu referujeme o dlouholeté léčbě celkem 5 pacientů. Prvnímu pacientovi je anakinra aplikována již více než 10 let. Léčba v průběhu let nic neztratila na své účinnosti. V diskusi přinášíme informace o diferenciální diagnostice této jednotky, která se řadí nejen do kategorie monoklonálních gamapatií, ale také do kategorie získaných autoinflamatorních chorob manifestujících se v dospělosti, a proto také ve velmi stručné podobně informujeme o této kategorii nemocí.
POPIS SOUBORU PACIENTŮ
Náš soubor 5 pacientů se skládá pouze z mužů, medián věku stanovení diagnózy byl 53 let (42–60). Medián sledování na léčbě je 56 měsíců (19–122). Všech 5 pacientů mělo monoklonální gamapatii typu IgM a u všech je v průběhu času vidět nárůst koncentrace celkového i monoklonálního imunoglobulinu typu IgM.
První pacient
Muž, narozený 1944, je na našem pracovišti sledován od roku 2002, od svých 58 let s monoklonální gamapatií typu IgM. První histologie kostní dřeně neprokázala maligní lymfoproliferaci. Trepanobiopsie byla obtížnější, kost kladla podstatně větší odpor bioptické jehle, než jsme zvyklí u pacientů s mnohočetným myelomem.
Pacient míval již před rokem 2002 ataky výsevů kopřivkových pupenů na velkých plochách. Kožní urtika byla v péči kožních specialistů a byl dlouho a marně hledán vyvolávající podnět. Žádná lokální léčba a perorálně podávaná antihistaminika nepomáhala. Urtika v tomto případně byla spojena s velmi silným svěděním, zatímco další čtyři pacienti svědění neudávali (obr. 1 a 2). Dalšími problémy byly bolesti v kostech dolních končetin a bolesti v oblasti pánve a kyčelních kloubů. Bolesti postihovaly dominantně ty části skeletu, v nichž byly zřetelné sklerotické (hyperostotické) změny při vyšetření počítačovou tomografii (CT) a zvýšená aktivita na scintigrafii skeletu. Ze všech léčebných alternativ, které jsme testovali od roku 2002 až do roku 2007, měl efekt pouze prednison, ale až v poměrně vysokých dávkách, 20–40 mg denně. Tyto dávky prednisonu indukovaly steroidní diabetes mellitus, kterým pacient trpí dodnes. Bolesti v kostech v místech osteosklerotických změn se zmenšovaly po aplikaci bisfosfonátů.
Obr. 1. Snímek prvního pacienta s velkými kopřivkovými morfami před léčbou anakinrou 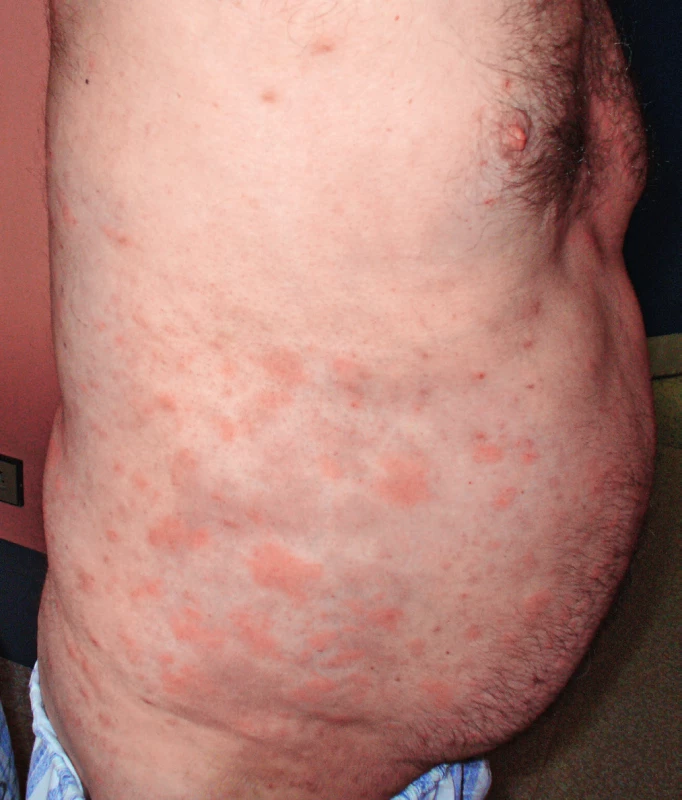
Obr. 2. Snímek prvního pacienta s velkými kopřivkovými morfami před léčbou anakinrou 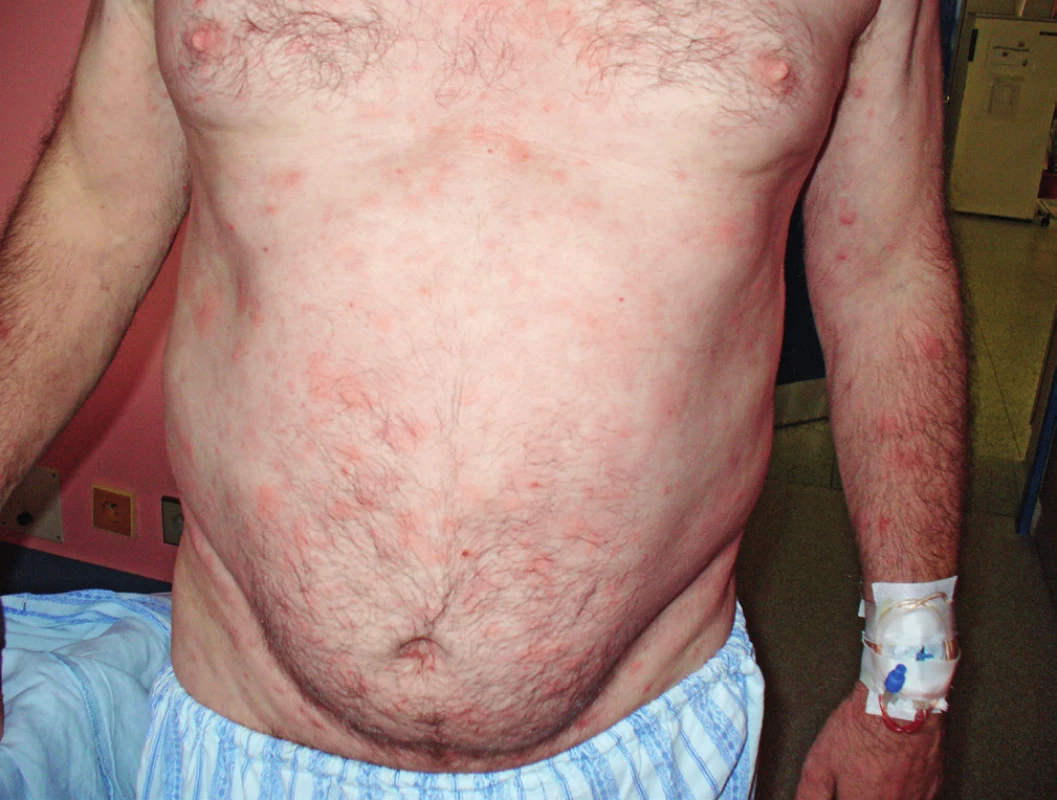
Podrobný popis celého případu až do roku 2007 jsme již publikovali [11]. Od října roku 2007 byla zahájena léčba preparátem anakinra v dávce 1 ampulka (100 mg) podkožně (s. c.) denně. Byl to první pacient s touto chorobou v ČR, u něhož byla zahájena léčba anakinrou po schválení ředitelem Všeobecné zdravotní pojišťovny. Již po první aplikaci došlo k vymizení kopřivkového exantému. Svědící kopřivkový exantém se objevil pouze ve dnech, když si pacient zapomněl aplikovat injekci anakinry. Zároveň s kožními změnami vymizely všechny ostatní příznaky – teploty, bolesti v oblasti skeletu a celková únava. Pacientův stav se natolik zlepšil, že je schopen v létě na kole zvládat trasy do 50 km. Vývoj laboratorních parametrů ukazuje tabulka 1. Je vidět, že v průběhu sledování se postupně zvyšuje koncentrace celkového i monoklonálního IgM. V lednu 2006 patolog popsal 10–15 % monoklonálních (kappa) zralých plazmatických buněk v počtu 10–15 %, CD56 negativních. V září 2017 popsal patolog v histologickém hodnocení kostní dřeně infiltraci indolentní zralou neoplazií typu lymfoplazmocytárního lymfomu a míru infiltrace vyjádřil 5–30 % patologických buněk. Infiltráty jsou tvořeny malými kulatými lymfocyty zčásti s plazmocytární diferenciací (kappa+, IgM+, CD20+, CD3-). Takže nejen v biochemickém vyšetření je vidět nárůst koncentrace celkového IgM a monoklonálního IgM, ale i v histologickém vyšetření kostní dřeně je zřetelný nárůst patologické populace odpovídající nyní jasněji než při původním hodnocení lymfoplazmocytárnímu lymfomu. Zatím se však tento vývoj neprojevuje cytopenií, ani hyperviskozitou, nicméně při hodnotách koncentrace celkového IgM lze již očekávat známky hyperviskozity na očním pozadí a to bude jasnou indikací k léčbě Waldenströmovy makroglobulinemie. Před zahájením léčby byla vysoká hodnota C-reaktivního proteinu (CRP) provázená nižším hemoglobinem i albuminem jako důsledek chronického zánětu (anémie chronických chorob), jak ilustruje tabulka 1.
Tab. 1. Vývoj laboratorních parametrů prvního pacienta 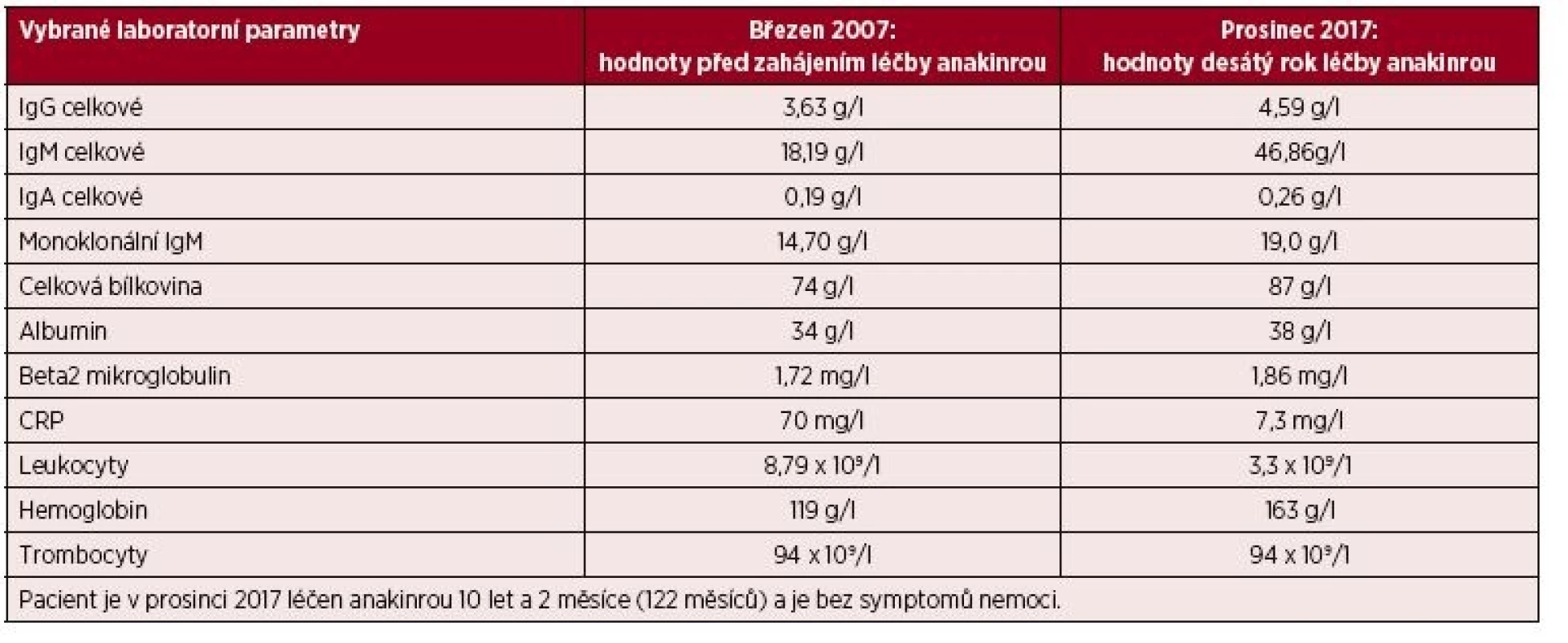
Druhý pacient
Muž, narozený 1963, byl poprvé na našem pracovišti vyšetřen v roce 2005 ve svých 42 letech. Přišel k diferenciální diagnostice v té době asymptomatické krční lymfadenopatie. Histologické vyšetření uzliny neprokázalo žádnou malignitu, pouze nespecifické zánětlivé změny. V roce 2006 si poprvé všiml kopřivkové vyrážky na celém těle. Kožní projevy nesvědily, nebolely. Na kůži byl zřetelný rudý drobný raš, difuzně postihující celé tělo a později se sléval do větších morf, které byly přítomné jak na trupu, tak i na končetinách. Tyto změny ilustrují obrázky 3 a 4. Při prvním vyšetření dostal lokálně kortikoidy a nemoc byla nazvána ošetřujícím kožním lékařem jako „Pityriasis Gilbert“. Léčba lokálně aplikovanými kortikoidy neměla léčebný efekt. Po necelém roce od první erupce kopřivkového raše se objevily bolesti v kostech bérce. Intenzita bolestí v průběhu času sílila. A postupně se přidávaly i febrilie. Byla hledána příčina horeček. V rámci hledání ložiska infekce přišel pacient o mnoho zubů zcela zbytečně, protože jejich odstranění nic neovlivnilo. Občas se předpokládá, že odstranění domnělé fokální infekce v dentální oblasti vyřeší problém. Ve své lékařské praxi jsem neviděl případ, kdy by odstranění zcela asymptomatických zubů se suspektním projasněním na rentgenu čelisti něco vyřešilo. V roce 2008 již bolesti nepostihovaly pouze dolní končetiny, ale také končetiny horní, klouby i kosti. Potíže někdy kulminovaly v záchvatech, kdy se zvýšila teplota, zvýšila intenzita bolestí a objevil se další výsev kopřivky a současně i s pocitem zimnice. Po těchto atakách se horšily i otoky kloubů. Kožní lékaři, kteří o nemocného do roku 2009 pečovali, zjistili, že lokální kortikoidy a antihistaminika nemají vůbec žádný efekt. Potíže mírnily pouze tablety prednisonu a později metylprednisolonu. V době, kdy byl odeslán na naše pracoviště, tak užíval 54 mg metylprednisolonu (Medrolu) denně, což způsobilo Cushingův syndrom a funkční útlum nadledvinek. V roce 2009 se dostavil na naši „ambulanci pro monoklonální gamapatie“, protože měl prokázaný monoklonální imunoglobulin IgM (MIG-IgM) v séru. V té době pacienta pořád trápila urtika, bolesti kloubů ale i kostí všech končetin, otoky kloubů a kolísavé febrilie. Vzestup teploty vždy signalizoval další výsev kopřivky a zhoršení bolestí. Laboratorní vyšetření prokázalo MIG typu IgM a zvýšené hodnoty CRP. Krevní obraz byl v mezích fyziologických hodnot. Klasické snímky kostí neprokázaly nic patologického, zatímco magnetická rezonance (MR) skeletu prokázala abnormální strukturu skeletu ve smyslu osteosklerotických změn. Vyšetření pozitronovou emisní tomografii v kombinaci s počítačovou tomografii (PET/CT) prokázalo sklerotizaci obou klíčních kostí, a zesílení kortikalis v některých částech skeletu. Klasická scintigrafie skeletu prokázala, abnormálně vyšší aktivitu v oblasti sterna, v obou humerech, v distální části levého femuru, v proximální polovině obou tibií a taktéž vysokou aktivitu v oblasti sakra. Tyto změny odpovídaly syndromu Schnitzlerové. Léčba preparátem anakinra byla zahájena v únoru roku 2010. Již za 6 hodin po první aplikaci vybledla vyrážka, do 24 hodin zcela vymizela a v již se v průběhu léčby anakinrou neobjevila. Po zahájení léčby vymizely zcela febrilie. Bolesti kloubů a otoky kloubů se zmenšily asi o 75 %, ale zcela při léčbě nevymizely. Od února roku 2010 pokračuje léčba anakinrou. V prosinci 2017 mu do 8 let léčby zbývají 2 měsíce, takže je léčen 94 měsíců anakinrou. V průběhu léčby bylo vyzkoušeno přidání kolchicinu v dávce 0,5 až 1,0 mg denně s cílem dosáhnout úplného vymizení příznaků nemoci. Přidání kolchicinu v období od února 2014 do prosince 2014 do chronické medikace nepřineslo dalšího zlepšení, navíc bylo ke konci podávání doprovázeno poklesem počtu krevních destiček na 50 x 109/l v terénu subklinické formy idiopatické trombocytopenické purpury s běžnými hodnotami trombocytů kolem 100 x 109/l. V průběhu léčby ale nebyly zjištěny žádné nežádoucí účinky anakinry. Kontrolní PET/CT v roce 2015 neprokázalo žádný patologický nález mimo změny skeletu, které stále přetrvávají, protože aktivita nemoci u tohoto pacienta nevymizela zcela (obr. 5). Změny ve vybraných laboratorních parametrech ukazuje tabulka 2. Z tabulky je zřetelné, že před léčbou byla vyšší hodnota CRP, nižší koncentrace hemoglobinu, což se při zahájení léčby upravilo a nyní jsou normální hodnoty CRP i hemoglobinu, ale je vidět pomalé zvyšování koncentrace celkového i M-IgM, zatímco navyšování monoklonálního IgM není tak markantní.
Obr. 3. Snímek druhého pacienta s kopřivkovými morfami před léčbou anakinrou 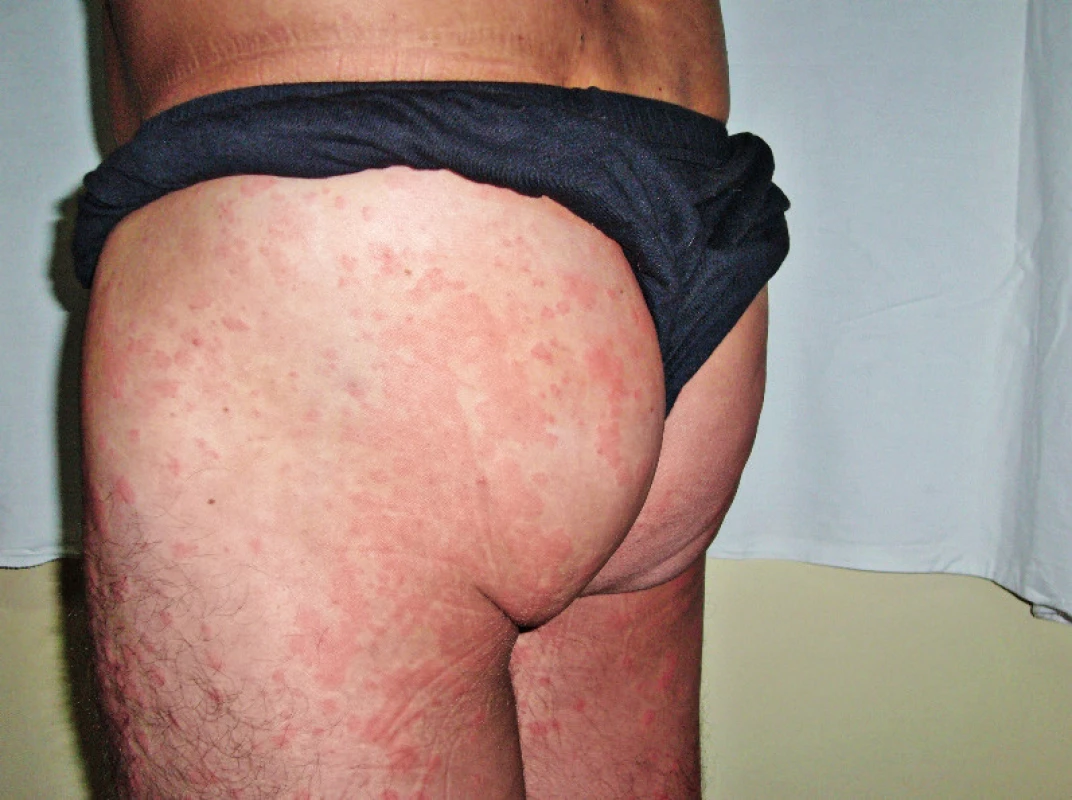
Obr. 4. Snímek druhého pacienta s kopřivkovými morfami před léčbou anakinrou 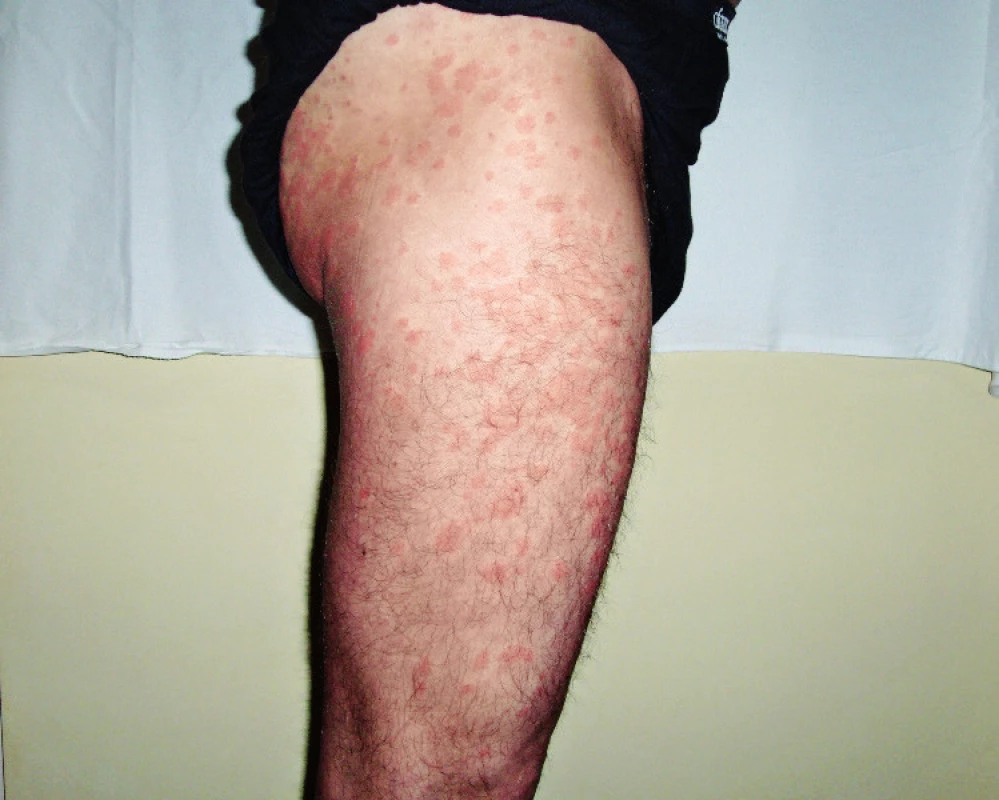
Obr. 5. Snímek druhého pacienta
18F-NaF-PET/CT obraz dolních končetin, koronární řezy: v distální části levého femuru (diafýza, epifýza) jsou patrné nevýrazné, nehomogenní okrsky sklerotizace, jen některé vykazují zvýšenou akumulaci 18F-NaF v PET/CT obraze. Maximum změn je v periférii kosti. Obdobný, více denzní nález je v CT obrazu také ve ventrálním okraji proximálního okraje levé tibie. V obdobné lokalizaci jsou diskrétní změny kostní struktury také v pravém femuru a pravé tibii.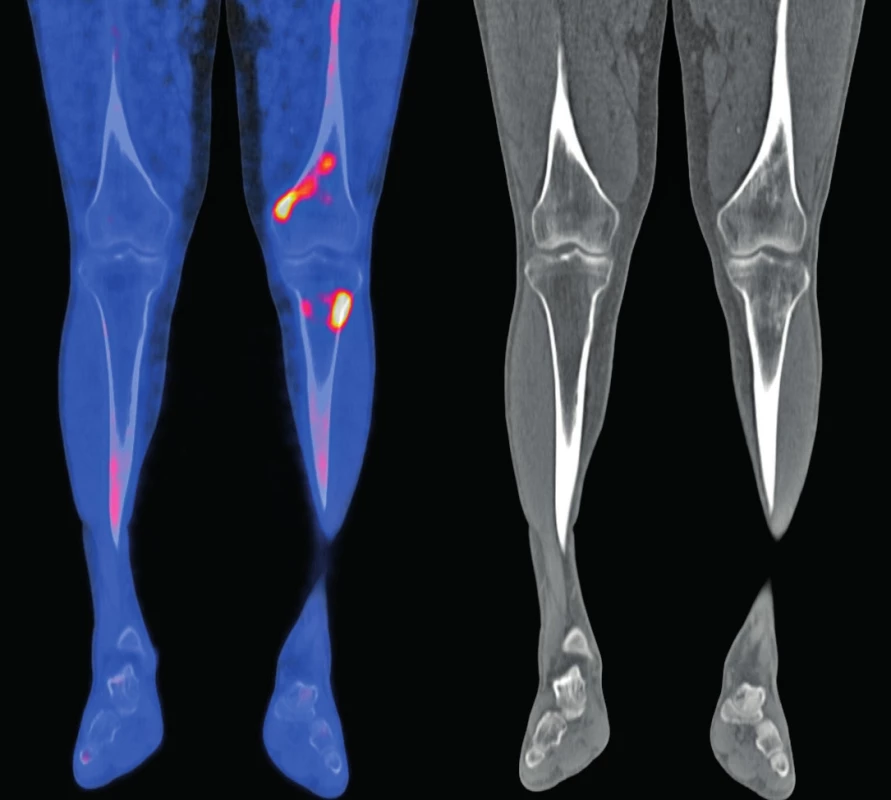
Tab. 2. Laboratorní parametry před zahájením léčby anakinrou a v současnosti u druhého pacienta 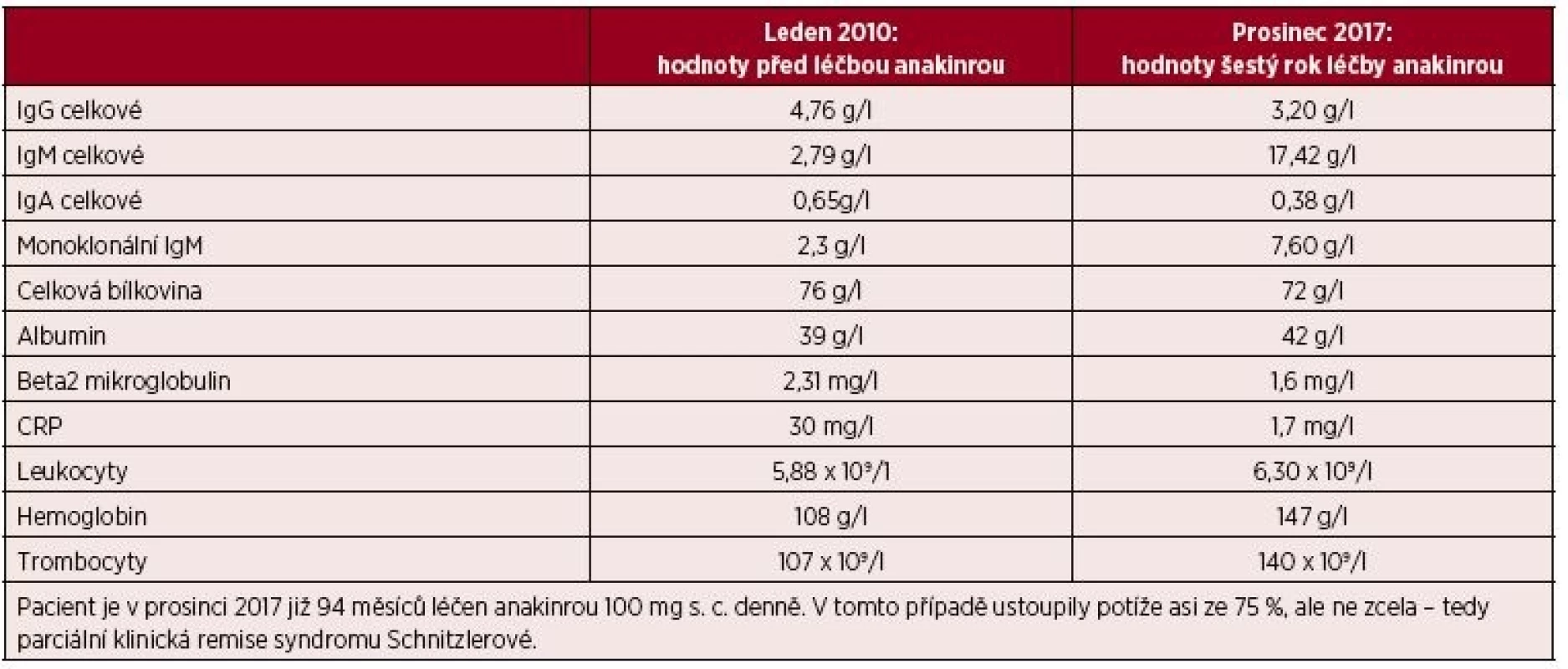
Třetí pacient
Muž, narozený 1949, zpozoroval první příznaky nemoci, patologickou únavu poprvé v červnu 2009 ve svých 60 letech. Začátkem listopadu 2009 zjistil, že mívá večer vždy zvýšené teploty, kolem 37,5 °C, ne však vyšší než 38 °C. Počátkem prosince 2009 se objevily bolesti bércových kostí, nejintenzivněji je vnímal večer. Kosti byly bolestivé i na dotek. V prosinci 2009 se také postřehl první výsevy kopřivkových pupenů. Kopřivkové morfy ale nikdy nesvědily. Kožní změny před anakindře a po ní jsou na obr. 6. Bolesti v dlouhých kostech a horečky jej nakonec v květnu 2010 přivedly interní oddělení regionální nemocnice. Hmotnost pacienta se snížila z 86 kg na 77 kg. Až při dalších vyšetřeních byl zjištěn M-IgM a tento nález vedl k odeslání nemocného na naše pracoviště. První vyšetření na naší klinice proběhlo v lednu roku 2013. Potvrdili jsme klasické příznaky syndromu Schnitzlerové: kopřivkový exantém, subfebrilie, bolesti kostí, patologický nález na scintigrafii skeletu a vypsali žádost revizním lékařům o schválení úhrady léčby anakinrou. Léčbu jsme zahájili v dubnu 2013. Od té doby si jej pacient aplikoval v prvním roce 1krát denně. Veškeré příznaky nemoci při této léčbě vymizely. Po roce jsme otestovali prodloužení intervalů mezi aplikacemi anakinry a zjistili jsme, že symptomy nemoci se nevrací, pokud se anakinra aplikuje v intervalu 48 hodin, ne však v intervalech delších. Od té doby si jej sám aplikuje ob den. I při tomto dávkování se již nikdy nevrátily bolesti kostí a neinfekční teploty a upravil se celkový stav natolik, že zvládá všechny aktivity podobně jako jeho vrstevníci. Jeho hmotnost se vrátila na hodnotu před začátkem nemoci. Laboratorní parametry před léčbou anakinrou a při léčbě anakinrou uvádí tabulka 3. U tohoto pacienta se výjimečně koncentrace monoklonálního a polyklonálního IgM nezvyšuje.
Obr. 6. Snímek třetího pacienta s kopřivkovými morfami a jejich vymizení po první aplikaci anakinry 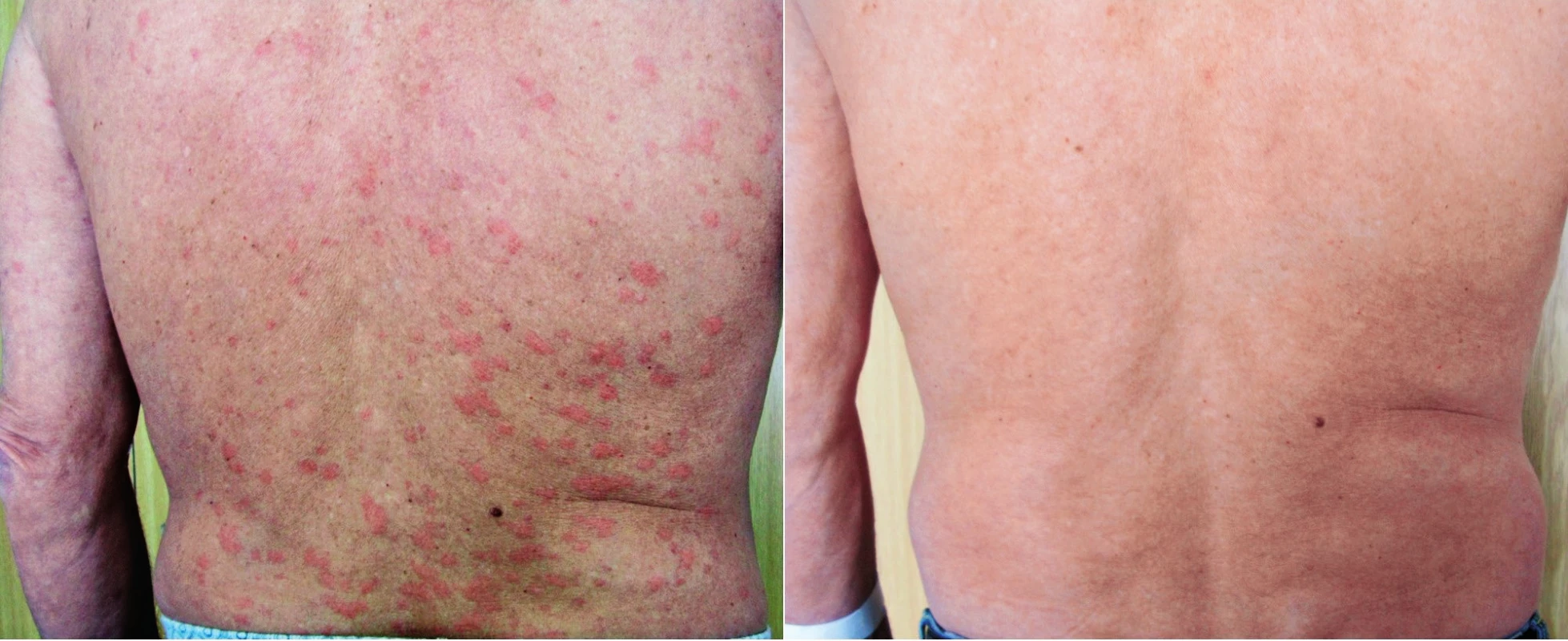
Tab. 3. Laboratorní parametry před zahájením léčby anakinrou a v současnosti u třetího pacienta 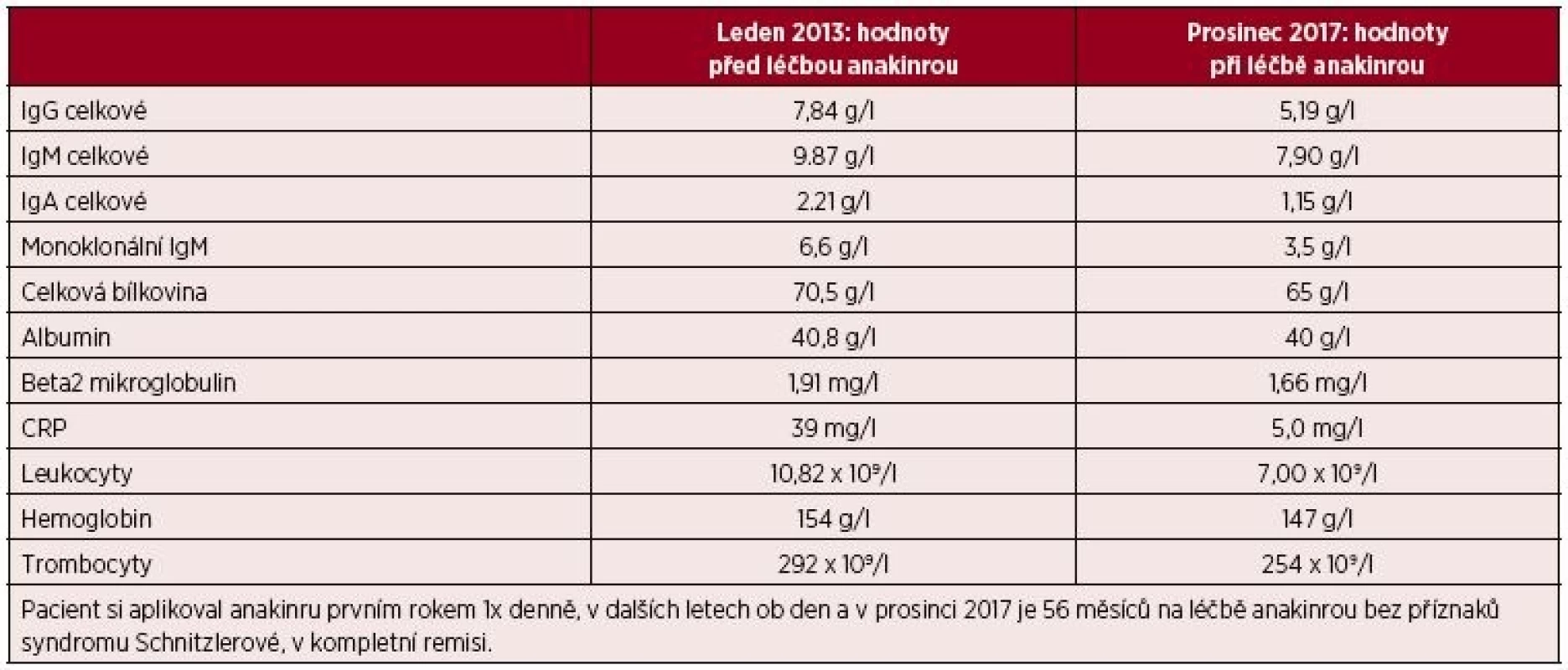
Čtvrtý pacient
Muž, narozený 1955, si v roce 2008 ve svých 53 letech poprvé všimnul nesvědících kopřivkových morf. Od té doby začal navštěvovat kožní lékaře. Erupce kopřivky byly spojené s difuzními bolestmi kostí, hlavně v oblasti dolních končetin. Po třech letech ošetřování kožními lékaři byla odhalena přítomnost M-IgM, a proto byl v roce 2011 odeslán na odborné hematologické pracoviště v Praze s podezřením na syndrom Schnitzlerové. Klasická scintigrafie skeletu zobrazila ložiska zvýšeného vychytávání technecia v dlouhých kostech horních i dolních končetin. Vzhledem k tomu, že se jednalo o IgM monoklonální gamapatii, byl v roce 2011 testován účinek chlorambucilu (Leukeran). Tato léčba probíhala dlouhodobě, ale s minimálním či žádným efektem. V lednu roku 2012 byl k chlorambucilu přidán prednison. Prednison se v této indikaci ukázal účinnějším než chlorambucil a poněkud více tlumil potíže. Ale k žádné zásadní změně nedošlo. A tak byl pacient po dvou letech sledování předán k další léčbě na naše pracoviště. Po ověření diagnózy syndromu Schnitzlerové jsme vypsali žádost revizním lékařům o schválení úhrady léčby preparátem anakinra a léčba anakinrou byla zahájena v červnu roku 2013 a od té doby kontinuálně pokračuje. Při poslední kontrole na našem pracovišti, v prosinci 2017 pacient udává, že nemá žádné teploty, žádné bolesti kostí, žádnou kopřivku, prostě vůbec žádné symptomy nemoci při aplikaci anakinry 1krát denně. Jediný zdravotní problém, je patologická únava. Ráno se probudí, aplikuje si anakinru a pak ještě setrvá asi další 3 hodiny v posteli, než v sobě najde tolik energie, aby vstal a byl schopen úkonů běžného života. Po obědě je únava menší a je schopen i věnovat se svému koníčku – rybaření. Únava souvisí s kalendářním obdobím, v zimě je výraznější než v letních měsících. Přetrvávající únavu jsme u tohoto pacienta zpočátku také hodnotili jako možný příznak nemoci a doplnili léčbu přechodně od července 2014 do července 2015 o kolchicin v dávce 0,5 mg s postupným zvyšováním dávky až na 1,5 mg. Přidání kolchicinu a ani jeho opětovné vysazení však nijak neovlivnilo intenzitu patologické únavy. Odborné psychiatrické vyšetření tento příznak nyní uzavřelo jako chronická depresivní porucha navazující na vznik nemoci. Ale ani antidepresiva, která mu psychiatři předepisují, tuto patologickou únavu zásadně nepotlačila. U tohoto pacienta lze léčbu trvající více než dva roky zhodnotit jako dosažení kompletní klinické remise, ale stav komplikuje chronická depresivní porucha. Laboratorní parametry před zahájením léčby anakinrou a při poslední kontrole ukazuje tabulka 4. Opět je zřetelný pokles CRP, vzestup koncentrace hemoglobinu a koncentrace M-IgM se v průběhu sledování jen nepatrně navýšila.
Tab. 4. Laboratorní parametry před zahájením léčby anakinrou a v současnosti u čtvrtého pacienta 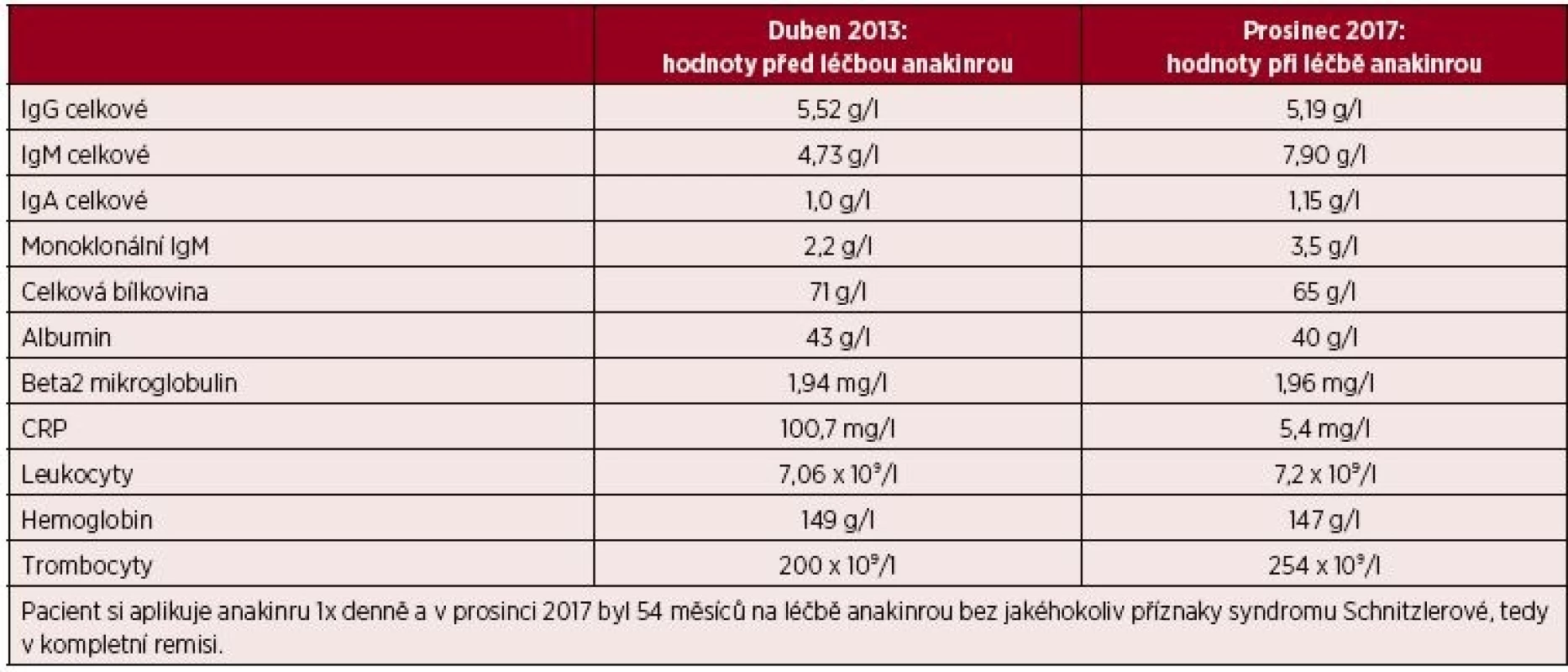
Pátý pacient
Pátý pacient je opět muž, narozený 1971. První kopřivkové potíže se u něj objevily v roce 2013, ve 42 letech. Opět následovalo intenzivní testování a hledání možných alergenů, proti nimž by bylo možno vznést obvinění, že jsou příčinou všech těchto problémů. Nebyl však nalezen vyvolávající alergen, ani se nepodařilo najít antihistaminikum, které by tlumilo potíže. Kopřivkový exantém pokrývá s různou intenzitou celé tělo vyjma hlavy. Pacient svými laboratorními parametry, opakovaně prokázanou leukocytózou se zvýšením počtu neutrofilních segmentů, opakovaně prokázanou zvýšenou hodnotou CRP, přítomným M-IgM a histologickým vyšetřením kůže splnil Štrasburská kritéria syndromu Schnitzlerové. Bolesti kostí pacient sice neudával, ale popisuje bolesti velkých kloubů a bederní páteře. Teploty neměl, hmotnost stejná. V posledních letech však narůstající nevýkonnost a patologická únava. Všechny tyto symptomy v posledních třech letech se postupně zintenzivňovaly a zvyšovala se leukocytóza a hodnota CRP. Oproti předchozím pacientům však jde o relativně časně stanovenou diagnózu. Vstupní laboratorní hodnoty ukazuje tabulka 5. Pacient po schválení léčby revizním lékařem začal v květnu 2016 s aplikací anakinry a při její aplikaci je schopen normálního pracovního nasazení.
Tab. 5. Laboratorní parametry před zahájením léčby anakinrou a v jejím průběhu u pátého pacienta 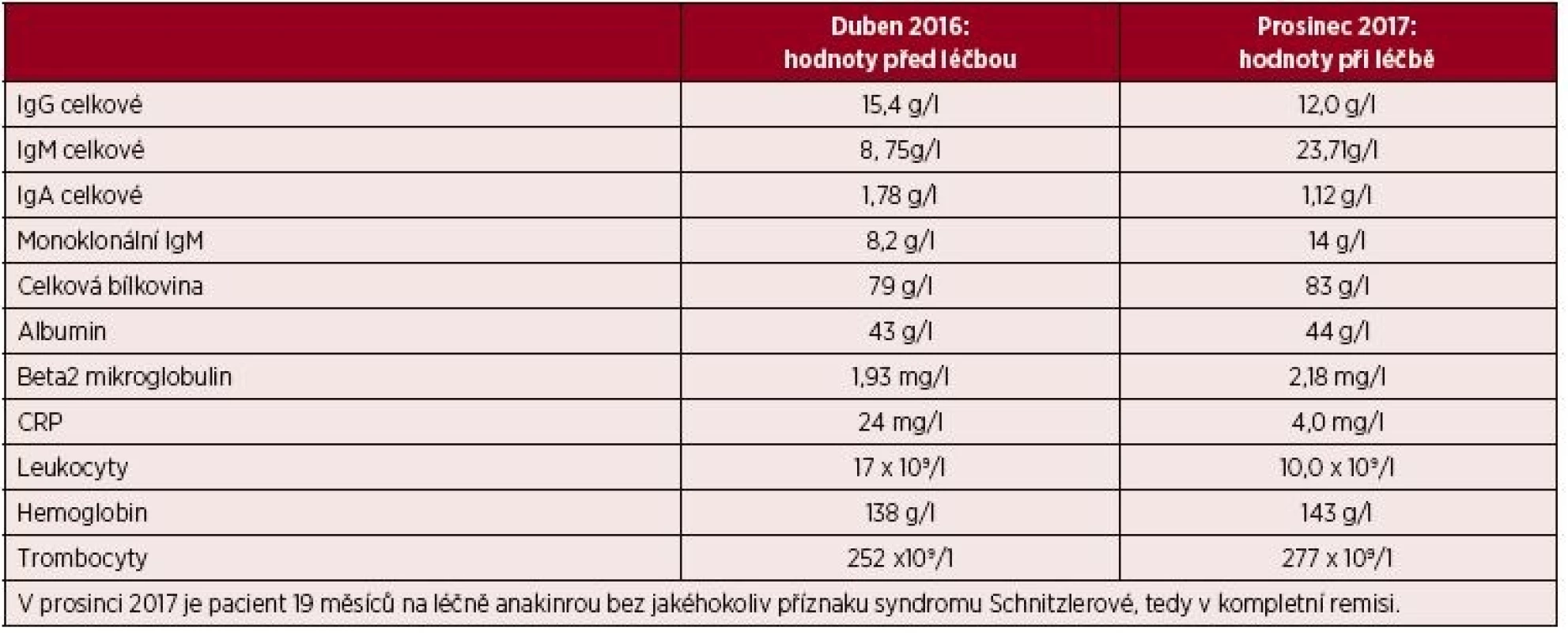
DISKUSE
Kam zařadit syndrom Schnitzlerové? Na hematoonkologická pracoviště tyto pacienty přivádí přítomnost monoklonálního imunoglobulinu (M-Ig) a případně průkaz amyloidu. Přítomnost M-Ig je důvodem, proč je syndrom Schnitzlerové řazen do velké skupiny nemocí, nazvané „monoklonální gamapatie“ a někteří hematologové je řadí do skupiny monoklonálních gamapatií s kožními projevy (Monoclonal gammopathy of cutaneous signifikance). Zásadní role interleukinu-1 v etiopatogenezi příznaků této nemoci zase vede k řazení této choroby do skupiny „autoinflamatorních chorob“. Tato skupina chorob představuje nejmladší skupinu nemocí, a proto v diskusi připomeneme velmi stručně a orientačně i základní choroby z této skupiny. Cílem tohoto stručného připomenutí autoinflamatorních chorob je dosáhnout lepšího pochopení variability klinických projevů syndromu Schnitzlerové i variabilitu léčebných odpovědí a pomoci při diferenciální diagnóze, protože některé ze zmíněných autoinflamatorních chorob je nutno mít na mysli při diferenciální diagnostice tohoto syndromu. Potvrzení diagnózy níže uvedených autoinflamatorních chorob je v ČR možné v Ústavu imunologie, eventuálně na revmatologii Fakultní nemocnice Motol a také ve Všeobecné fakultní nemocnici v Praze na revmatologické ambulanci Kliniky dětského a dorostového lékařství.
Obecná charakteristika autoinflamatorních chorob
Je tomu již desetiletí, co byly definovány autoimunitní choroby, neboli choroby způsobené tvorbou autoprotilátek poškozujících organismus. Tyto autoprotilátky pak slouží jako základ diagnostiky autoimunitních chorob. Ale teprve relativně nedávno, koncem devadesátých let minulého stolení, byla definována nová kategorie patologických stavů, autoinflamatorní choroby. Jsou způsobené změnami vrozených imunitních reakcí. Zatímco autoimunitní nemoci jsou způsobené poruchou tolerance a zprostředkovány protilátkami, eventuálně buněčnými reakcemi, namířenými proti vlastním tkáním, u autoinflamatorních chorob jsou základním mechanismem opakovaná vzplanutí zánětu. Tento zánět není spouštěn infekcí, ale vychází z porušených mechanismů regulace zánětlivé reakce, většinou spočívá v poruchách reakcí vrozené imunity. Jedna skupina autoinflamatorních chorob je již molekulárně definována. Jednotky, které jsou řazeny do této skupiny, jsou důsledkem mutace jednoho genu. Druhá skupina autoinflamatorních chorob zatím jednotně definované molekulárně-biologické znaky nemá, ale podle všech ostatních znaků do kategorie autoinflamatorních chorob jednoznačně patří. Vrozené monogenní autoinflamatorní choroby se začínají projevovat v dětství, mnohdy časně po porodu. Stejné či podobné mutace mohou vzniknout „de novo“ v průběhu embryonálního života. Autoinflamatorní choroby mohou mít podle své povahy a dalších doplňujících vlivů časnou postnatální manifestaci, ale i opožděné klinické projevy objevující se až v dospělosti. Porucha mechanismů vrozené imunity, většinou doprovázená zvýšenou produkcí a špatnou regulací prozánětlivých cytokinů, způsobuje podobné klinické příznaky: ataky horeček, často periodických, bolesti kloubů, strukturální změny kostí (hyperostózy, osteosklerotická ložiska) spojené s bolestmi kostí, a změny na kůži. Autoinflamatorní choroby jsou provázeny zvýšenými humorálními (biochemickými i hematologickými) známkami zánětu [13–24]. Při přehlédnutí charakteristiky těchto nemocí je zřetelné, že příznaky se mnohdy prolínají, opakují a je pravděpodobné, že poznání této kategorie nemocí se bude postupně rozvíjet a budou přibývat molekulárně definované nemoci podobně, jako je tomu v případě myeloproliferativních nemocí. Syndrom Schnitzlerové je řazen zatím do skupiny získaných autoinflamatorních chorob, zatím bez jasně definované molekulární podstaty této nemoci, a proto pro stanovení diagnózy používáme Štrasburská kritéria. Popis těchto autoinflamatorních chorob jsme uvedli v časopise Vnitřní lékařství [12]. Většina z nich se manifestuje v dětském věku. Ve věku dospělém se ze skupiny autoinflamatorních chorob manifestují dvě, a to Stillova nemoc dospělých a syndrom Schnitzlerové. Přehledem nejznámějších hereditárních a dvou získaných autoinflamatorních chorob včetně možností jejich terapie se podrobně zabývá například Lachmanová et al. [26].
Stillova nemoc dospělých
Z autoinflamatorních chorob, které se manifestují až v dospělém věku a které je třeba brát v úvahu při diferenciální diagnostice syndromu Schnitzlerové, je důležité připomenout Stillovu chorobu dospělých. V dětství se tato nemoc manifestuje jako idiopatická artritida, také zvaná SOJIA (systemic onset juvenile idiopatic arthritis). Dnes je řazena mezi multigenní autoinflamatorní choroby [27–29]. Je to opět onemocnění nejasné etiologie, bez jakýchkoliv pro tuto nemoc typických autoprotilátek, které se diagnostikuje pouze a jen na základě klinických příznaků, podobně jako syndrom Schnitzlerové. Pro tuto nemoc je typická vysoká horečka, artralgie či artritida, nesvědící makulární a makulopapulární kožní exantém lososovité barvy, neutrofilní leukocytóza. Dále bývá bolest v hrdle, lymfadenopatie, hepatosplenomegalie, abnormální hodnoty jaterních testů, negativní výsledky vyšetření antinukleárních protilátek a revmatoidního faktoru. U 30–40 % pacientů jsou přítomny serositidy. Z laboratorních parametrů je vyjma leukocytózy přítomna zvýšená hladina ferritinu, až 5krát nad normu a zvýšené aktivity jaterních enzymů. Pro Stillovu chorobu bylo publikováno hodně kritérií, jejich přehled uvádí Malegová et al. [29]. Snad největší akceptovanost mají stále původní „Yamaguchi kritéria“, která uvádíme v tabulce 6, abychom demonstrovali odlišnosti od syndromu Schnitzlerové. Všechna kritéria Stillovy horečky dospělých se shodují ve velkém kritériu – febrilie nad 39 °C. U Stillovy nemoci dospělých je popisována extrémně zvýšená koncentrace ferritinu jen u 10–20 % nemocných, takže extrémně vysoký ferritin není podmínkou stanovení diagnózy Stillovy nemoci dospělých [26–32]. Léčbou prvé volby zde bývají kortikoidy v dávce 1 mg/kg s postupným snižováním. Dávky kortikoidů může snížit použití perorálního metotrexátu. Léčba anakinrou je novou léčebnou možností pro tyto nemocné v případě neúčinnosti kortikoidů.
Tab. 6. Dvě nejčastěji používaná diagnostická kritéria Stillovy nemoci 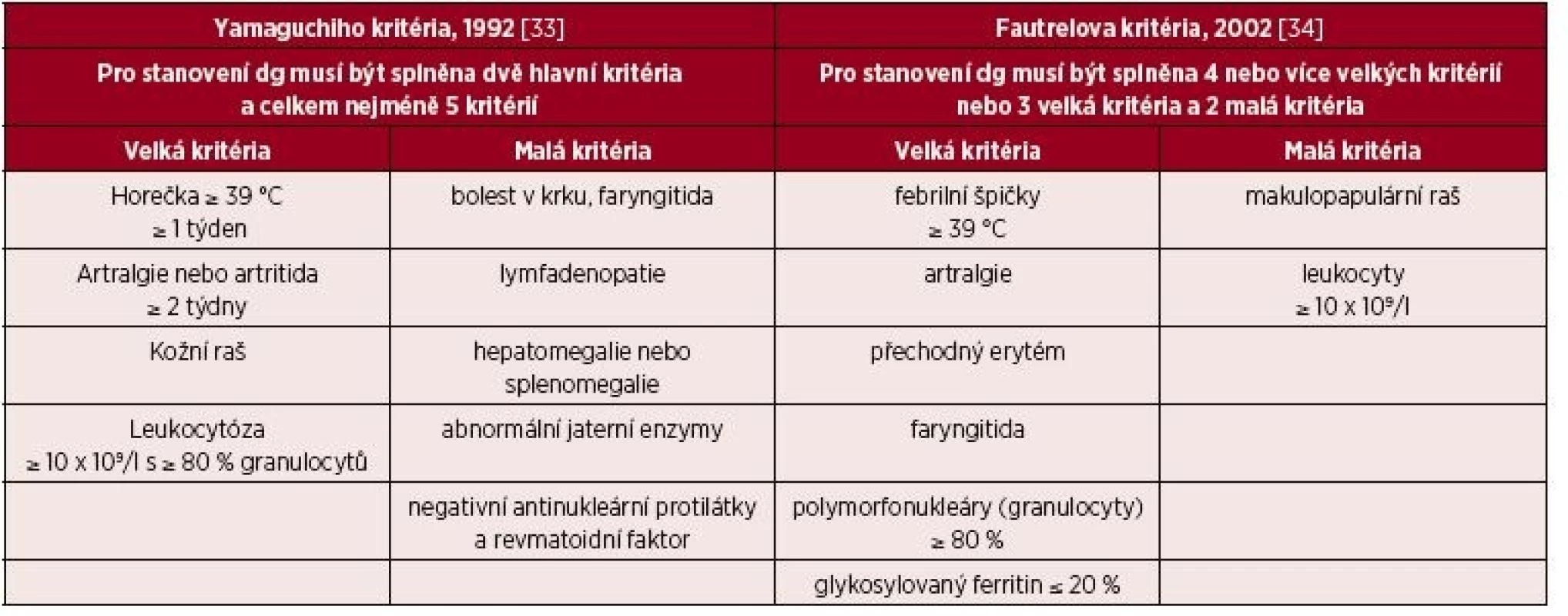
Syndrom Schnitzlerové
Syndrom Schnitzlerové je choroba, která v mnohém připomíná geneticky definované autoinflamatorní nemoci, ale manifestuje se až ve věku dospělém. Má hodně podobných příznaků se skupinou nemocí zvanou „Cryopyrin Associated Periodic Syndrome“ (CAPS). Kostní změny u syndromu Schnitzlerové se podobají kostním změnám popisovaným u dětí při „Deficiency Interleukin-1 Antagonist (DIRA)“. U některých případů syndromu Schnitzlerové byla analyzována mutace genu NLRP3 a byl prokázán somatický mosaicismus genu NLRP3 v linii myeloidních buněk [35–37]. Také u jednoho z našich pacientů byl prokázán polymorfismus v genu NLRP3. Tyto první výsledky signalizují, že syndrom Schnitzlerove bude v průběhu let molekulárně-biologicky definován. Je zřejmé, že podobnou variabilitu závažnosti průběhu, jakou vidíme u CAPS syndromu v dětství, můžeme vidět i u syndromu Schnitzlerové v dospělosti. Vysvětlujeme si tím rozdílnou intenzitu léčebné odpovědi na anakinru u našich pacientů [38–40]. U čtyř z pěti demonstrovaných pacientů anakinra úplně odstranila příznaky nemoci, zatímco u jednoho pacienta s polymorfismem v genu NLRP3 došlo jen k výraznému ústupu potíží, ale ne k jejich úplnému vymizení. Na patofyziologii se podílí zvýšené sekrece interleukinu-1 and interleukinu-6 mononukleárními buňkami z periferní krve [10]. Role monoklonálního imunoglobulinu typu IgM je nejasná, v jednom případě byl popsán opožděný nástup měřitelné koncentrace monoklonálního imunoglobulinu [39].
Klinické příznaky syndromu Schnitzlerové
Kopřivka
Na první pohled nejzřetelnějším znakem je kopřivkový raš, který obvykle nesvědí. Kopřivka postihuje většinou trup a končetiny a po erupci trvá asi do 24 hodin, a intervaly mezi erupcemi jsou různé dlouhé. Morfy mají podobu rudých makulí, někdy mírně vyvýšené papuly nebo plaky. Někdy může mít kopřivka podobu velkých kopřivkových makul, jindy jde o difuzní krupičkový kožní raš. Erupci může vyvolat stres či fyzická zátěž. Někdy může být kolem kopřivkové erupce vazokonstrikce nebo dermografismus [10]. Pro stanovení diagnózy je vhodné provést biopsii nově vzniklé morfy. V histologickém preparátu by měla být prokazatelná infiltrace neutrofily neboli neutrofilní kožní infiltrát, ale bez projevů vaskulitidy. Je vhodné připomenout, že podobný raš se objevuje u lupus erythematodes či u Stillovy nemoci dospělých [40–42]. V našem souboru pacientů měli 4 nemocní nesvědící kopřivku a jeden měl kopřivku provázenou značným svěděním. Kopřivka je tedy zásadním znakem syndromu Schnitzlerové, podobně jako přítomnost M-Ig. Pokud by pacient měl přítomny všechny ostatní příznaky a neměl kopřivkový raš, doporučuje se tento stav nazývat „Schnitzler-like syndrome“ [10]. Pokud je přítomna kopřivka a jeden z dalších typických příznaků, uvedených v tabulce 7, doporučuje se vždy zapátrat po ostatních možných příznacích, a pak prozkoumat, zda pacient nesplňuje Štrasburská kritéria syndromu Schnitzlerové [10] uvedená v tabulce 8.
Tab. 7. Klinické a laboratorní nálezy u 196 pacientů se syndromem Schnitzlerové 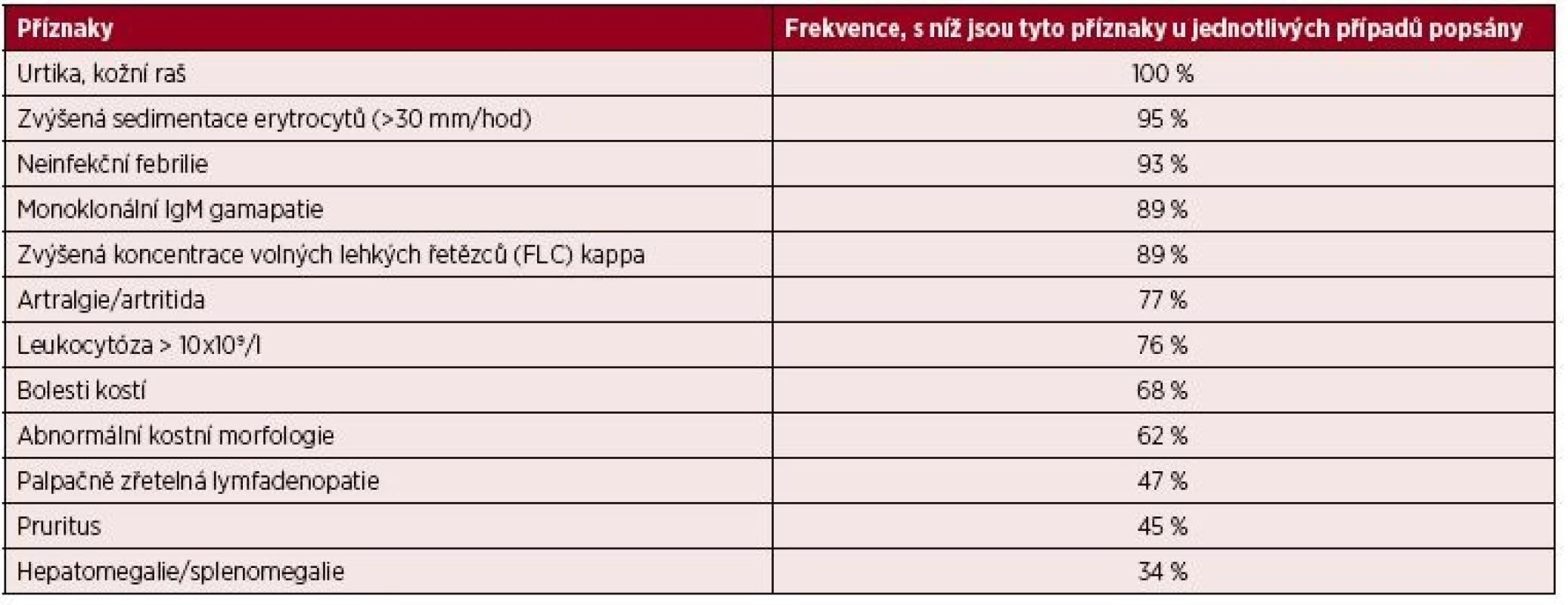
(Simon, 2013 [9]) Tab. 8. Diagnostická kritéria syndromu Schnitzlerové 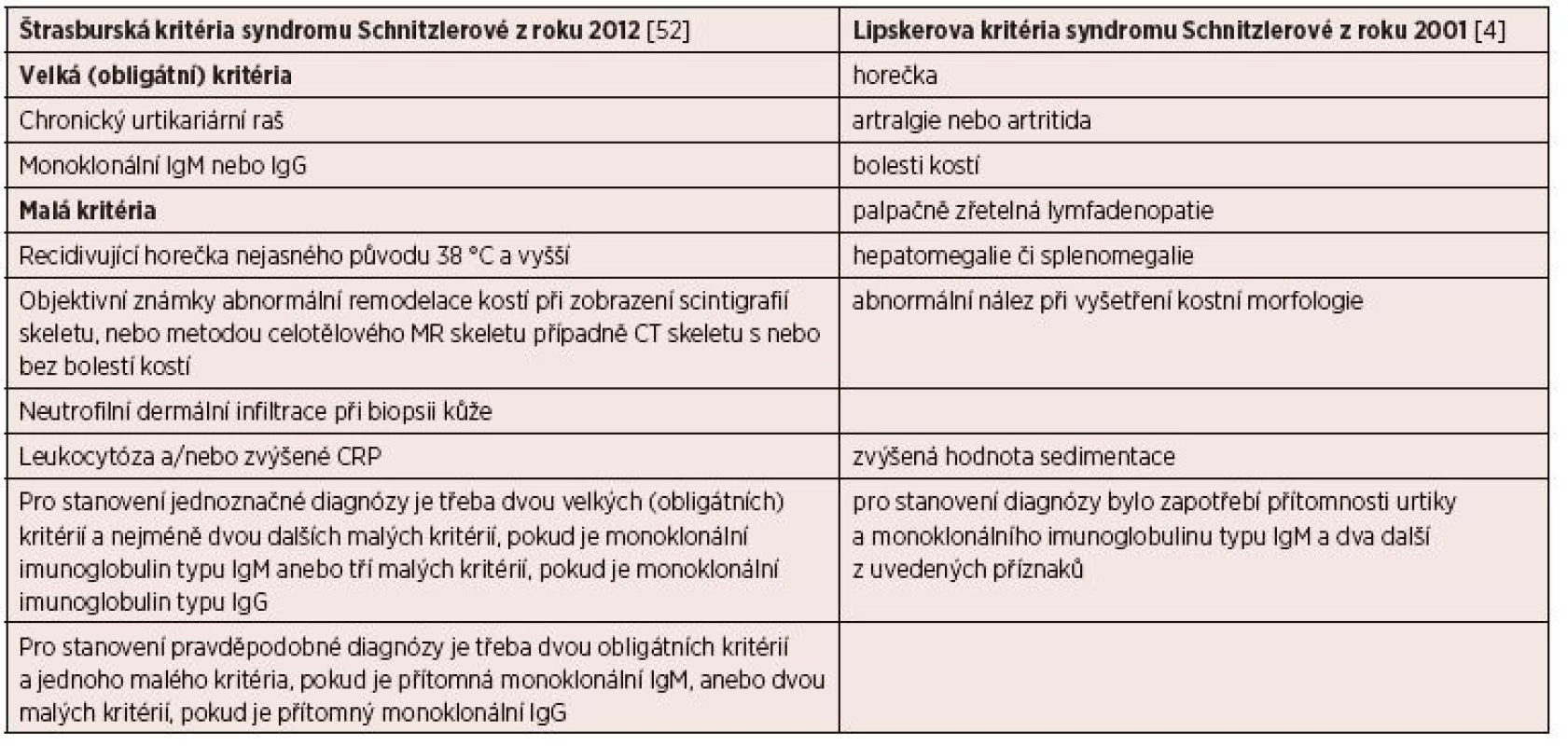
Rekurentní teploty
Opakovaně se objevující teploty jsou dalším znakem této nemoci, obvykle se objevují společně s výsevem kopřivky ale také společně s bolestmi kostí či kloubů, obvykle nejsou tak vysoké jako u Stillovy nemoci dospělých [43].
Bolesti kloubů a kostí
Bolesti kosti a kloubů se objevují u 40-80 % nemocných a obvykle postihují dolní končetiny. Muskulo-skeletární postižení je důležitým znakem této nemoci. Syndrom Schnitzlerové způsobuje totiž i změny kostního metabolismu. Zvýšení kostní denzity je nejčastějším radiologickým nálezem. V oblastech zvýšené kostní denzity jsou často pociťovány bolesti. Kostní bolesti jsou nejčastěji popisovány v oblasti pánve a v kosti holenní. Stehenní kosti, paže, předloktí a klíční kosti jsou postihovány méně často. Bolesti kloubů bývají v kyčli, koleni, zápěstí či lokti, méně často v ostatních kloubech těla. V některých případech byly uvedeny i myalgie [43].
Monoklonální imunoglobulin
Ve většině případů je přítomen monoklonální imunoglobulin typu IgM, jen výjimečně byly popsány případy provázené MIG typu IgG a velmi výjimečně i typ IgA [10, 44, 45].
Skeletální změny při zobrazení skeletu
Změny na kostech charakteru osteosklerózy lze detekovat pomocí klasických kostních CT skenů, ale jsou viditelné i při MR zobrazení skeletu. Klasické rentgenové zobrazení či CT zobrazení může prokázat ložiska sklerotického charakteru, či naopak ložiska osteolytického charakteru či obě dvě formy alterace kostí. Tato alterace skeletu se znázorní jako ložiska zvýšeného vychytávání radiofarmaka. Lze použít jak klasickou scintigrafii kostí radioaktivním techneciem nebo metodou PET/CT s použitím radioaktivního natriumfluoridu [46-51].
Epidemiologie
Lipsker ve svém přehledu z roku 2017 uvádí, že zatím bylo popsáno asi 300 případů [10] v odborné literatuře celého medicínského světa, tedy včetně Japonska a Austrálie. Jde tedy o velmi vzácnou nemoc jejíž incidence a prevalence nebyla zatím přesně zmapována.
Diagnostická kritéria syndromu Schnitzlerové
V případech, kdy neexistuje specifický znak choroby, tak se jednotka definuje vždy pomocí kritérií, která pak v průběhu času doznávají změn odpovídajících vývoji poznání a názorů. V květnu roku 2012 se konala ve Štrasburku (ve Francii) konference expertů, jejímž cílem bylo definovat kritéria této nemoci, její optimální léčbu a sledování pacientů. Závěrem této konference byla dohodnuta nová definice (kritéria) této nemoci, která uvádí tabulka 8. Dále bylo vytvořeno doporučení pro diagnostiku, léčbu a sledování pacientů s touto nemocí [4,10,52, 53].
Diferenciální diagnóza syndromu Schnitzlerové
Na diagnózu syndromu Schnitzlerové se obvykle dochází v rámci diferenciální diagnostiky chronické urtiky kožními specialisty či alergology. Anebo také internisty v rámci širší diagnostiky horečky nejasného původu – (Fever of unknown origin = FUO). V rámci diferenciální diagnostiky febrilního stavu je vždy třeba také vyloučit infekční, nádorová a autoimunitní – protilátkami zprostředkovaná onemocnění. Z infekčních nemocí připadá v úvahu jako příčina více než 3 týdny probíhajících horeček infekce HIV, infekční endokarditida, borrelióza, yersinióza, mykoplazmová infekce, syfilis, tuberkulóza, oseteomyelitida, případně jiné skryté dlouhodobě probíhající infekce. Musí se provést odpovídající sérologická a kultivační vyšetření. Je třeba vyloučit neoplazie, které mohou způsobovat horečku, tedy světlobuněčný Grawitzův karcinom ledviny, lymfomy, leukemie, ale také uzlinová onemocnění nejasné etiologie, jako je Castlemanova choroba či Rosai-Dorfmanova choroba. Tyto choroby lze odhalit s pomocí PET/CT vyšetření a odběrem histologie v případě nálezu patologického ložiska. Dále je třeba vyloučit autoimunitní onemocnění, polymyalgia revmatica, obrovskobuněčnou arteritidu a další systémové nekrotizující vaskulitidy. To je možné pomocí sérologií a opět zde pomůže PET/CT vyšetření [51, 54, 55], které prokáže i přítomnost vaskulitidy. Je třeba provést sérologická vyšetření k vyloučení lupusu, revmatoidní atritidy (antinukleární protilátky, revmatoidní faktor, anti-citrulin-peptidy, ANCA protilátky) a také vyloučit Bechtěrevovu chorobu. Také nutno vyloučit střevní specifické záněty, pokud by byly odpovídající příznaky. Pokud se nic z uvedeného neprokáže, je možné vznést podezření na autoinflamatorní chorobu [26].
A v diferenciální diagnostice autoinflamatorních chorob dospělých musíme myslet na syndrom Schnitzlerové a Stillovu nemoc dospělých. Podobné kožní projevy může mít ale také urtikariální vaskulitida a kryoglobulinemická vaskulitida, systémový lupus erythematodes a chronická idiopatická kopřivka. Stillova choroba dospělých může v mnohém napodobovat syndrom Schnitzlerové, protože i pro Stillovu chorobu jsou typické kožní projevy, febrilie, bolesti kostí a kloubů, leukocytóza a nepřítomnost specifických diagnostických markerů. U Stillovy nemoci se často popisuje počáteční faryngitida, zatímco pro syndrom Schnitzlerové není typická. U syndromu Schnitzlerové nebývá také zvýšení transamináz, to je častěji pozorované u Stillovy nemoci. Také velmi vysoké hodnoty ferritinu jsou typické pro Stillovu chorobu ale ne pro syndrom Schnitzlerové. Urtikariální vaskulitida, zvláště její varianta se sníženou hladinou komplementu, může také svými příznaky (raš, teploty, kloubní bolesti) připomínat syndrom Schnitzlerové. V těchto případech pomůže ke stanovení diagnózy kožní biopsie, která v případě urtikariální vaskulitidy prokáže opravdovou vaskulitidu s fibrinoidní nekrózou malých cév, což nebývá u syndromu Schnitzlerové. V případě urtikariální vaskulitidy je přítomná konzumpce komplementu a jsou přítomny anti-C1q protilátky, které nebývají přítomny u syndromu Schnitzlerové. A také je třeba si uvědomit, že může jít o současnou manifestaci dvou nezávislých odchylek, monoklonální gamapatie a idiopatické kopřivky, protože incidence obou těchto odchylek narůstá po padesátém roku života.
Léčba syndromu Schnitzlerové
Před zavedením léčby blokující účinek interleukinu-1 v roce 2005 byly popsány různé léčebné postupy, které však neměly žádné větší přínos. Byl zkoušen kolchicin, pefloxacin, interferon alfa a glukokortikosteroidy [10].
Anakinra
Lékem volby je od roku 2005 stále anakinra, což je antagonista receptoru pro interleukin-1. Biologický poločas anakinry je ale jen 4–6 hodin. Standardní doporučená dávka je 100 mg denně. Z nežádoucích účinků se zmiňuje o něco vyšší frekvence závažných infekcí ve srovnání s placebem a občas možný pokles absolutního počtu neutrofilů. U pacientů s renální insuficiencí není předepsána žádná redukce, pouze v dokumentaci léku se vybízí ke zvýšené opatrnosti. U syndromu Schnitzlerové se anakinra podává zpočátku v dávce 100 mg denně. V případě nedostatečného účinku anakinry se doporučuje navýšit denní dávku anakinry až na 3krát 100 mg denně. Efekt anakinry nastupuje za několik hodin po aplikaci. Účinnost léčby anakinrou potvrzují dnes již několik desítek publikací, citujeme jen 5 z nich [56–59]. Podle publikovaných i našich zkušeností léčebný účinek anakinry nemizí ani při dlouhodobé léčbě. Autoři multicentrické studie s mediánem sledování 36 měsíců (2–79) uvádějí, že v 83 % případů bylo dosaženo kompletní remise a jen u 17 % parciální remise [60].
V případně úplného vymizení příznaků je možné zkoušet najít nejnižší ještě účinnou dávku, tedy podávat tento lék s nižší frekvencí než 1krát denně. V případech, když se léčbou navodí kompletní remise, je možné po dvou letech otestovat přerušení léčby, s tím, že v případě recidivy nemoci se ihned obnoví přerušená léčba. Efekt preparátu anakinra je potvrzen velkým počtem publikací, takže anakinra představuje pro tuto nemoc standardní lék první volby.
Canakinumab
V roce 2018 se v zahraničí dostávají do klinické praxe dlouhodobě účinné inhibitory interleukinu-1, které není nutné podávat denně a které pro tyto nemocné představují výhodnou alternativu. Jedná se o canakinumab a rilonacept. Canakinumab je humánní monoklonální protilátka proti lidskému interleukinu-1. Jeho přínos pro nemocné, trpící syndromem Schnitzlerové, uvádí již více autorů [61–64]. Dokonce byl již použit i v jedné randomizované studii. Výhodou canakinumabu je delší účinek [65]. Zatím jsme jej u našich pacientů neměli možnost vyzkoušet.
Rilonacept
Rilonacept je další lék s podstatně delším účinkem, než má anakinra. Rilonacept je dimerický fuzní protein, skládající se z extracelulární částí receptoru pro interleukin-1 (IL-1) a z jeho akcesorního proteinu, které jsou oba navázány na Fc fragment protilátky typu IgG. Tato látka je obecně charakterizována jako IL-1 trap čili past na IL-1. Zatím je pouze jedna zpráva o léčbě syndromu Schnitzlerové syndromu lékem zvaným „rilonacept“, který jiným mechanismem inhibuje aktivitu interleukinu-1, a to na podstatně delší dobu než 1 aplikace anakinry [66]. Rilonacept je v USA registrován agenturou FDA (Food and Drug Administration) pro léčbu nemocí ze skupiny CAPS.
Protilátky proti interleukinu-6
Léčba pomocí protilátky proti interleukinu-6 zvaná tocilizumab byla popsána taktéž jako účinná u syndromu Schnitzlerové [67, 68].
Rituximab s chemoterapií
Zatím jen jedna práce popisuje použití chemoterapie obsahující antiCD20 protilátku rituximab u pacienta se syndromem Schnitzlerové, jehož IgM gamapatie již měla charakter Waldenströmovy makroglobulinemie. Léčba, která dosáhla kompletní hematologické remise, vedla i k remisi syndromu Schnitzlerové [69]. Nicméně ne ve všech případech vedl rituximab k léčebnému efektu. Pokud již charakter nemoci splňuje kritéria symptomatické Waldenströmovy makroglobulinemie, tak je jistě vhodné použít léčbu této nemoci obsahující rituximab s nadějí, že při dosažení kompletní remisi Waldenströmovy makroglobulinemie se uklidní i příznaky syndromu Schnitzlerové [70–73].
Sledování při léčbě
V průběhu léčby se doporučuje sledovat klasické parametry zánětu, počet leukocytů a hodnotu CRP. Někteří autoři zvažují i monitorování sérového amylopeptidu A, protože při jeho vysoké koncentraci hrozí rozvoj AA-amyloidózy. Dále je třeba sledovat koncentraci M-Ig a při výrazném vzestupu provést přešetření, zda již nedošlo k transformaci v maligní lymfoproliferaci, což je výjimečně také možné.
ZÁVĚR PRO PRAXI
- Akutní výsev kopřivky není výjimečný, ale chronická kopřivka bez jasné příčiny je vzácná. Pokud se s ní setkáte, je vhodné doplnit vyšetření monoklonálního imunoglobulinu a při jeho prokázání srovnat nálezy u nemocného s kritérii syndromu Schnitzlerové.
- Horečka nejasného původu může mít i u dospělých vysvětlení v autoinflamatorní nemoci typu syndromu Schnitzlerové či Stillovy nemoci, a proto je vhodné vždy srovnat nálezy pacienta s uvedenými kritérii nemocí.
- Pro pacienty se syndromem Schnitzlerové je anakinra lék první volby. Léčebný efekt má ale i u Stillovy nemoci.
- Léčba pomocí preparátu anakinra ani po mnohaleté aplikaci neztrácí nic ze své účinnosti.
Podíl autorů na přípravě rukopisu
ZA – návrh a příprava první verze rukopisu
RK, MK, ZČ, EV, LP, VS, MŠ, ZŘ, EP, AČ, ZA, JM – kritická revize rukopisu a schválení konečné verze.
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací toho článku nejsou ve střed zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 2. 1. 2018.
Přijato po recenzi dne 30. 1. 2018.
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika
Jihlavská 20
625 00 Brno
e-mail: adam.zdenek@fnbrno.cz
Zdroje
1. Schnitzler L. Lésions urticariennes chroniques permanentes (érythème pétaloïde?) Cas cliniques, n° 46 B. Journée Dermatologique d’Angers, 28 octobre 1972.
2. Schnitzler L, Schubert B, Boasson M, et al. Urticaire chronique, lésions osseuses, macroglobulinémie IgM: maladie de Waldenström? Bull Soc Fr Dermatol Syphil 1974;81 : 363–366.
3. Schnitzler L, Hurez D, Verret JL. Urticaire chronique, ostéocondensation, macroglobulinémie. Cas princeps. Etude sur 20 ans. Ann Dermatol Venereol 1989;116 : 547–550.
4. Lipsker D, Veran Y, Grunenberger F, et al. The Schnitzler syndrome. Four new cases and review of the literature. Medicine (Baltimore) 2001;80 : 37–44.
5. de Koning HD, Bodar EJ, van der Meer JW. Schnitzler Syndrome Study Group. Schnitzler syndrome: beyond the case reports: review and follow-up of 94 patients with an emphasis on prognosis and treatment. Semin Arthritis Rheum 2007;37 : 137–148.
6. Lipsker D. The Schnitzler syndrome. Orphanet J Rare Dis 2010;8 : 38–40.
7. Kyle RA, Therneau TM, Rajkumar SV, et al. Long-term follow-up of IgM monoclonal gammopathy of undetermined significance. Blood 2003;102 : 3759–3764.
8. Claes K, Bammens B, Delforge M, et al. Another devastating complication of the Schnitzler syndrome: AA amyloidosis. Br J Dermatol 2008;158 : 182–184.
9. Simon A, Asli B, Braun-Falco M, et al. Schnitzler syndrome: diagnosis, treatment and follow up. Alergy 2013;68 : 562–568.
10. Gusdorf, L Lipsker D. Schnitzler syndrome. Curr Rheumatol Rep 2017;19 : 46–50.
11. Adam Z. Krejčí M, Pour L, et al. Schnitzlerův syndrom – popis čtrnáctiletého průběhu nemoci a přehled informací o této nemoci. Vnitř Lék 2008;54 : 1140–1153.
12. Adam Z, Šedivá A, Koukalová R, et al. Schnitzlers syndrome, diferenciální diagnóza, přehled léčebných možností a popis 5 případů léčených anakinrou. Vnitř Lék 2016;62 : 713–727.
13. Cetkovská P, Benáková N. Autoinflamatorní syndromy s kožními projevy. Čes-slov Derm 2015;90 : 144–155.
14. Tichá M. Terapie autoinflamatorních onemocnění a periodických horeček. Alergie 2015;17 : 128–135.
15. Šedivá A. Nové poznatky a pokroky v oblasti primárních imunodeficiencí. Postgrad Med 2015;17 : 294–303.
16. Blažová K, Horáčková M, Horváth R. Kardiorenální syndrom při AA amyloidóze v důsledku kombinace dvou mutací genů pro periodické horečky. Aktuality v nefrologii 2013;19 : 127–130.
17. Doležalová P. Syndrom CINCA – nejzávažnější onemocnění ze skupiny kryopyrinopatií. Farmakoterapie 2012;8(Suppl. 1):8–9.
18. Šedivá A. Autoinflamatorní onemocnění v dermatologii. Čes-slov Derm 2012;2 : 239–243.
19. Šedivá A. Autoinflamatorní onemocnění a familiární středozemní horečka. Alergie 2012;14(Suppl. 2):26–30.
20. Šedivá A. Periodické horečky a autoinflamatorní onemocnění – klinický přístup. Postgrad Med 2012;14 : 174–179.
21. Šedivá A. Periodické horečky AU. Alergie 2009;11:P1–P16.
22. Šedivá A. Periodické horečky a další syndromy s poruchou regulace zánětlivé odpovědi. Čes-slov Pediat 2011;66 : 187–191.
23. Němcová D, Doležalová D, Brejchová I. Autoinflamatorní onemocnění kostí. Čes Revmatol 2010;18 : 10–15.
24. Doležalová P, Król P, Němcová D. Autoinflamatorní onemocnění – přehled. Čes Revmatol 2010;18 : 144–145.
25. Cush JJ. Autoinflamatory syndromes. Dermatol Clin 2013;31 : 471–480.
26. Lachmann HJ. Autoinflammatory syndromes as causes of fever of unknown origin. Clin Med (Lond) 2015;15 : 295–298.
27. Beer HD, Contassot E, Frech LE. The inflammasome in autoinflamatory disease with skin involvement. J Invest Dermatol 2014;134 : 1805–1810.
28. Valentin MG, Jamilloux Y, Iwaz Y, et al. Adult onset Sill´s disease. Autoimmunity reviews 2014;13 : 708–722.
29. Malegová J, Koen L, Horák P. Stillova nemoc dospělých, obtížná cesta k diagnóze přes horečku a výpotky nejasné etiologie. Vnitř Lék 2014; 60 : 520–526.
30. Skácelová M, Horák P. Stillova nemoc dospělých – kazuistika. Čes Revmatol 2012;20 : 198–202.
31. Skácelová M, Horák P. Stillova choroba dospělých. Postgrad Med 2015;17 : 391–394.
32. Houzarová A. Stillova nemoc. Referátový Výběr z Revmatologie 2007;47 : 1214–1216.
33. Yamaguchi M, Ohta A, Tsunematsu T, et al. Preliminary criteria for classification of adult Still’s disease. J Rheumatol 1992;19 : 424–430.
34. Fautrel B, Zing E, Golmard JL, et al. Proposal for a new set of classification criteria for adult-onset still disease. Medicine 2002;81(3):194–200.
35. Ryan JG, de Koning HD, Beck LA, et al. IL-1 blockade in Schnitzler syndrome: ex vivo findings correlate with clinical remission. J Allergy Clin Immunol 2008;121 : 260–262.
36. De Koning HD, Schalkwijk J, Stoffels M, et al. The role of interleukin-1 beta in the pathophysiology of Schnitzler’s syndrome. Arthritis Res Ther 2015;7 : 187–188.
37. De Koning HD, van Vlijmen-Willems IMJJ, Rodijk-Olthuis D, et al. Mast-cell interleukin-1beta, neutrophil interleukin-17 and epidermal antimicrobial proteins in the neutrophilic urticarial dermatosis in Schnitzler’s syndrome. Br J Dermatol 2015;173 : 448–456.
38. Noster R, de Koning HD, Maier E, et al. Dysregulation of proinflammatory versus anti-inflammatory human TH17 cell functionalities in the autoinflammatory Schnitzler syndrome. J Allergy Clin Immunol 2016;138 : 1161–1169.
39. Mulla E, Neame R. Delayed development of the IgM paraprotein in Schnitzler’s syndrome. Scand J Rheumatol 2015; 44 : 521–522.
40. De Koning HD. Schnitzler’s syndrome: lessons from 281 cases. Clin Transl Allergy 2014;4 : 41–43.
41. Kieffer C, Cribier B, Lipsker D. Neutrophilic urticarial dermatosis: a variant of neutrophilic urticaria strongly associated with systemic disease. Report of 9 new cases and review of the literature. Medicine (Baltimore) 2009;88 : 23–31.
42. Broekaert SMC, Boer-Auer A, Kerl K, Herrgott I, et al. Neutrophilic epitheliotropism is a histopathological clue to neutrophilic urticarial dermatosis. Am J Dermatopathol 2016;38 : 39–49.
43. Lamprecht P. Adult-onset Still’s disease, Schnitzler syndrome, and autoinflammatory syndromes in adulthood. Z Rheumatol 2009;68 : 740–746.
44. Patel S, Sindher S, Jariwala S, et al. Chronic urticaria with monoclonal IgG gammopathy: a clinical variant of Schnitzler syndrome? Ann Allergy Asthma Immunol 2012;109 : 147–148.
45. Sokumbi O, Drage LA, Peters MS. Clinical and histopathologic review of Schnitzler syndrome: the Mayo Clinic experience (1972–2011). J Am Acad Dermatol 2012;67 : 1289–1295.
46. Flórez AF, Gallardo Agromayor E, García-Barredo R, at al. Radiological aid to clinical diagnosis of Schnitzler’s syndrome: multimodality imaging approach. Clin Rheumatol 2008;27 : 107–110.
47. Lee KY, Grattan CE. Intracostal neuralgia as a previously undescribed symptom of Schnitzler’s syndrome. Br J Dermatol 2012;167 : 1392–1393.
48. Terpos E, Asli B, Chistoulas D, et al. Increased angiogenesis and enhanced bone formation in patients with IgM Monoclonal gammopathy and urticarial skin rash: New insight into the biology of the Schnitzler syndrome. Haematologica 2012;97 : 1699–1703.
49. Niederhauser BD, Dingli D, Kyle RA. Imaging findings in 22 cases of Schnitzler syndrome: charakteristic paraartikular osteosklerosis and the hot knees sign differential diagnosis. Skeletal Radiol 2014;43 : 905–915.
50. Willekens I, Walgraeve N, Goethals L, et al. Correlative bone imaging in a case of Schnitzler´s syndrome a briew review of the literatura. Hell J Nucl Med 2015;18 : 71–73.
51. Jarůšková M, Bělohlávek O. Role of FDG-PET and PET/CT in the diagnosis of prolonged febrile states. Eur J Nucl Med Mol Imaging 2006;33 : 913–918.
52. Simon A, Asli B, Braun-Falco M, et al. Schnitzler’s syndrome: diagnosis, treatment, and follow-up. Allergy 2013;68 : 562–568.
53. Gusdorf L, Asli B, Barbarot S, et al. Schnitzler syndrome: validation and applicability of diagnostic criteria in real-life patients. Allergy 2017;72 : 177–182.
54. Kotík L. Teploty nejasného původu Interní Med pro Praxi 2006;8 : 493–495.
55. Ferdová E, Záhlava J, Ferda J. Horečky nejasného původu, význam hybridního zobrazení 18F-FDG-PET/CT. Čes Radiol 2008;62 : 23–33.
56. Ahn MJ, Yu JE, Jeong J, et al. A case of Schnitzler’s syndrome without monoclonal gammopathy-associated chronic urticaria treated with anakinra. Yonsei Med J 2018;59 : 154–157.
57. Gouveia AI, Micaelo M, Pierdomenico F, et al. Schnitzler Syndrome: A dramatic response to anakinra. Dermatol Ther (Heidelb) 2016;6 : 299–302.
58. Sönnichsen A, Saulite I, Mangana J, et al. Interleukin-1 receptor antagonist (anakinra) for Schnitzler syndrome. J Dermatolog Treat 2016;27 : 436–438.
59. Koch A, Tchernev G, Chokoeva AA, et al. Schnitzler syndrome responding to interleukin-1 antagonist anakinra. J Biol Regul Homeost Agents 2015;29(1 Suppl):19–21.
60. Néel A, Henry B, Barbarot S, et al. Long-term effectiveness and safety of interleukin-1 receptor antagonist (anakinra) in Schnitzler’s syndrome: a French multicenter study. Autoimmun Rev 2014;13 : 1035–1041.
61. Pesek R, Fox R. Successful treatment of Schnitzler syndrome with canakinumab. Cutis 2014;94:E11–E12.
62. de Koning HD, Schalkwijk J, van der Ven-Jongekrijg J, et al. Sustained efficacy of the monoclonal anti-interleukin-1 beta antibody canakinumab in a 9-month trial in Schnitzler’s syndrome. Ann Rheum Dis 2013;72 : 1634–1638.
63. Vanderschueren S, Knockaert D. Canakinumab in Schnitzler syndrome. Semin Arthritis Rheum 2013;42 : 413–416.
64. de Koning HD, Schalkwijk J, van der Meer JW, et al. Successful canakinumab treatment identifies IL-1β as a pivotal mediator in Schnitzler syndrome. J Allergy Clin Immunol 2011;128 : 1352–1354.
65. Krause K, Tsianakas A, Wagner N, et al. Efficacy and safety of canakinumab in Schnitzler syndrome: A multicenter randomized placebo-controlled study. J Allergy Clin Immunol 2017;139 : 1311–1320.
66. Krause K, Weller K, Stefaniak R, et al. Efficacy and safety of the interleukin-1 antagonist rilonacept in Schnitzler syndrome: an open-label study. Allergy 2012;67 : 943–950.
67. Kluger N, Bessis D, Guillot B. Tocilizumab as a potential treatment in Schnitzler syndrome. Med Hypotheses 2009;72 : 479–480.
68. Krause K, Feist E, Fiene M, et al. Complete remission in 3 of 3 anti-IL-6-treated patients with Schnitzler syndrome. J Allergy Clin Immunol 2012;129 : 848–850.
69. Aouba A, Pressiat C, Pricopi M, et al. Complete remission of Schnitzler syndrome and Waldenström macroglobulinemia under rituximab-cyclophosphamide-dexamethasone. Dermatol 2015;230 : 18–22.
70. Cascavilla N, Bisceglia M, D’Arena G. Successful treatment of Schnitzler’s syndrome with anakinra after failure of rituximab trial. Int J Immunopathol Pharmacol 2010;23 : 633–636.
71. Murota H, Shoda Y, Ishibashi T, et al. Improvement of recurrent urticaria in a patient with Schnitzler syndrome associated with B-cell lymphoma with combination rituximab and radiotherapy. J Am Acad Dermatol 2009;61 : 1070–1075.
72. Eiling E, Möller M, Kreiselmaier I, et al. Schnitzler syndrome: treatment failure to rituximab but response to anakinra. J Am Acad Dermatol 2007;57 : 361–364.
73. Ramadan KM, Eswedi HA, El-Agnaf MR. Schnitzler syndrome: a case report of successful treatment using the anti-CD20 monoclonal antibody rituximab. Br J Dermatol 2007;156 : 1072–1074.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2018 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Predikce vzniku inhibitoru faktoru VIII v kohortě SIPPET pomocí analýzy mutací a měření antigenu faktoru VIII
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Automatizované promývání transplantátů krvetvorných buněk pro autologní použití
- Život ohrožující orgánové infiltrace u akutní myeloidní leukemie – kazuistiky
- Léčba vitaminem C obnovuje nedostatek enzymové aktivity TET2 a přispívá k senzitivitě buněk vůči inhibitorům PARP
- Obinutuzumab dosáhl v kombinaci s chlorambucilem ve srovnání s rituximabem zlepšení celkového přežití komorbidních pacientů s chronickou lymfocytární leukemií: finální analýza přežití ve studii CLL11
- 100. výročí založení Československé republiky – vzpomínky hematologa
- Prof. MUDr. Milan Bláha, CSc., osmdesátníkem
- Doc. MUDr. Adela Bártová, CSc. (1927–2018)
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
- Srovnatelná účinnost přímých antikoagulancií a warfarinu u pacientů s rakovinou a fibrilací předsíní
- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



