-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam fyzické aktivity u pacientů s hematoonkologickými malignitami
The role of physical activity in patients suffering from haematological malignancies
Patients with haematological malignancies often receive very aggressive treatment, which in many cases leads to complete remission and a rising proportion of completely cured patients. Despite this, many patients often complain of fatigue, weakness, exhaustion following minimal activity, shortness of breath on exertion as well as other symptoms associated with the deconditionimg syndrome. These symptoms are perceived very negatively by patients, as they induce a continued feeling of ill health. The deconditioning syndrome is partially caused by the treatment itself together with the aimless physical activity that develops during therapy and continues once this is terminated. The disease itself and repeated courses of treatment induce a catabolic effect. Physical inactivity moreover leads to loss of cardiopulmonary fitness as well as to loss of active muscle tissue. Physical training (exercise) is capable of minimising inactivity-related symptoms. Incorporation of these processes into standard care for patients with haematological malignancies is not a routine approach. In literature, eighteen studies dealing with physical activity in haemato-oncological patients have been reported to date. Eleven of these studies analyzed a mixed sample of haematological diagnoses and about half of the studies focused on physical exercise exclusively after end of treatment. The only large randomized study involving lymphoma patients produced valid and convincing data supporting the importance of supervised physical activity during chemotherapy. Positive and measurable changes in mental and physical functions were observed (aerobic capacity, muscle strength and quality of life). Based on these results, it could be concluded that physical exercise in patients with various haematological malignancies regardless of disease phase and type of treatment is safe, feasible and can induce positive objective as well as subjective measurable effects. Physical exercise should be recommended as a part of supportive care in haematological cancer patients.
Key words:
physical exertion, leukaemia, lymphoma, haematological malignancy, survival
Autoři: A. Janíková 1; J. Radvanský 2; R. Vysoký 3,4; L. Baťalík 3; J. Šupitová 1; D. Žáčková 1; Z. Ráčil 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika Fakultní nemocnice Brno a Lékařské fakulty MU Brno, 2Klinika rehabilitace a tělovýchovného lékařství 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole, Praha, 3Rehabilitační oddělení Fakultní nemocnice 1
Vyšlo v časopise: Transfuze Hematol. dnes,18, 2012, No. 1, p. 31-38.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Pacienti s hematoonkologickými malignitami podstupují značně agresivní léčbu, která vede ve většině případů k navození dlouhodobé remise se stále větším podílem zcela vyléčených případů. Mezi časté a chronické stesky řady nemocných po úspěšně ukončené léčbě však patří únava, nevýkonnost, slabost, námahová dušnost a další příznaky, které odpovídají syndromu dekondice. Tyto projevy jsou vnímány pacienty velmi negativně, neboť vyvolávají stálý pocit nemoci. Dekondice je částečně způsobena účinkem vlastní léčby, k němuž mohutně přispívá často bezúčelná fyzická inaktivita, která se rozvíjí během léčby a pokračuje po ní. Výsledkem je ztráta kardiopulmonální výkonnosti a aktivní svalové tkáně. Fyzické cvičení je metoda, která je schopna tyto příznaky minimalizovat. Aplikace fyzického tréninku v léčbě pacientů s hematologickými malignitami je však využívána sporadicky. Dosud bylo publikováno jen asi osmnáct studií zabývající se účinky pohybové aktivity u hematoonkologických pacientů, přičemž 11 z nich popisovalo smíšené sestavy pacientů s různými diagnózami. Asi polovina studií se zaměřovala na pohybovou intervenci výhradně po ukončení léčby. Existuje jediná velká randomizovaná studie s aplikací fyzického tréninku v průběhu léčby u nemocných s lymfomy, která poskytuje validní výsledky s měřitelnými změnami psychických a fyzických funkcí (aerobní kapacity, svalové síly a kvality života). Na základě výsledků uvedených studií lze konstatovat, že tréninková intervence je u pacientů s hematoonkologickými chorobami nejen proveditelná a bezpečná, ale dokáže navodit pozitivní objektivně i subjektivně měřitelné změny. Fyzický trénink by měl být doporučen a aplikován jako součást podpůrné léčby u pacientů s hematologickými malignitami.
Klíčová slova:
fyzická zátěž, leukemie, lymfom, hematoonkologické malignity, přežitíÚvod
Pohybová aktivita má z obecného pohledu na celkovou populaci všech věkových skupin mnohokrát prokázaný blahodárný vliv. Sedavý způsob života byl identifikován jako jeden z nejsilnějších rizikových faktorů pro vznik ischemické choroby srdeční, který má přinejmenším srovnatelný vliv s kouřením, obezitou, vysokým krevní tlakem nebo cukrovkou (1).
Fyzická aktivita (FA) je v současné době pokládána také za faktor snižující riziko vzniku mnoha nádorů (tlustého střeva, prsu, endometria, prostaty, plic a ovaria). Dle některých pozorování je dostatek FA sdružen překvapivě s nižším rizikem akutních leukemií dospělých (2, 3, 4). I přes tato zjištění je stále větší část „vyspělé“ populace hlavně Evropy a Spojených Států ohrožena kritickým nedostatkem pohybu v důsledku sedavého způsobu života.
Pacienti s onkologickým respektive hematoonkologickým onemocněním pocházejí z dnešní „sedavé“ populace, po stanovení diagnózy se tento neblahý trend vlivem mnoha okolností spíše prohlubuje. V rámci hematoonkologie kolísá nyní 5leté přežití u dospělých pacientů od velmi špatného (10–20 % u akutních leukemií) po velmi dobré (více než 90 % u Hodgkinova lymfomu). U většiny pacientů se i po úspěšně překonané léčbě setkáváme v různé míře s potížemi pramenícími ze snížené celkové tělesné zdatnosti (= dekondice). Kupříkladu asi 60 % „nemocných“ má ještě 3 roky po autologní transplantaci kostní dřeně výrazně limitovanou schopnost zvládat vcelku běžné denní aktivity jako nést těžší břemena nebo ujít delší procházku (5). K projevům dekondice patří dušnost při malé zátěži, rychlá únavnost, zvýšená nervozita, poruchy spánku, pocity pracovní neschopnosti, bolesti hlavy a zad, pocity studených končetin, bušení srdce a podobně.
Celkové snížení fyzické kondice má u onkologických pacientů jistě komplexní povahu, které bývá alespoň zčásti dáno existencí nádoru samotného nebo jeho sekundárními projevy (anémie). V průběhu úspěšné léčby (zejména chemoterapie, kortikoidy) je vliv nádoru zpravidla eliminován, avšak současně dochází ke změnám tělesného složení především ve smyslu úbytku aktivní svalové tkáně a také k výraznému snížení kardiorespirační výkonnosti. Významnou roli zde pravděpodobně sehrává tělesná inaktivita během léčby a případně po ní (6, 7).
Zdá se, že k tomuto nepříznivému trendu vede několik příčin: 1) pacienti po stanovení diagnózy nádoru jsou obvykle ubezpečováni zejména svým nejbližším okolím, že je třeba šetřit se a odpočívat, což vede nutně k bezdůvodnému snížení nebo i téměř úplnému eliminování i dosud běžné fyzické aktivity; 2) protinádorová léčba svými vedlejšími účinky na metabolismus a orgány jako jsou kosterní svaly, srdce a plíce působí toxicky, pacient se cítí unavený a na tuto únavu reaguje zpravidla další pasivitou; 3) lékaři – a to jak onkologové, tak praktici jsou často nejistí v této oblasti, pacientům „pro jistotu“ cvičení také nedoporučí, nezřídka rovnou aktivně zakážou.
Výsledky studií s hematoonkologickými pacienty ukazují, že vhodná pohybová aktivita může být provozována bezpečně i během náročné protinádorové léčby a může také příznaky plynoucí z dekondice výrazně snížit až zcela eliminovat (8, 9). Kromě snížení únavy („fatigue“), objektivně měřitelného zlepšení celkové výkonnosti a svalové síly, má také obrovský pozitivní vliv na psychiku nemocných a jejich kvalitu života. Je současně perfektním naplněním přirozené potřeby nemocného aktivně se podílet na svém uzdravení. Nadto se zdá, že alespoň u některých nádorů (rakovina prsu, gastrointestinální nádory) intenzivní FA dokonce snižuje riziko návratu choroby a prodlužuje přežití (2, 10).
V současné době převažuje i mezi odbornou veřejností mlhavý hyperprotektivní názor, který vede většinou k iracionálnímu zákazu jakékoli tělesné zátěže. Cílem našeho sdělení je poněkud změnit pohled na fyzickou aktivitu u pacientů s hematoonkologickými malignitami. Doufáme, že prezentované informace budou impulzem ke změně tohoto postoje, ke stanovení doporučení a také inspirací pro další výzkum v této oblasti.
Fyzická aktivita, cvičení a tělesná kondice
Na tomto místě bychom si dovolili zrekapitulovat několik základních pojmů souvisejících s FA, která je definována jako tělesný pohyb prováděný kosterním svalstvem za zvýšeného výdeje energie. Volnočasová tělesná aktivita, o kterou nám půjde především, je potom individuálně zvolená činnost periodicky opakujícího se charakteru, která je výrazně odlišná od pracovních aktivit či domácích prací. Mluvíme-li o tělesné kondici spojené se zdravím („health-related fitness“), pak máme na mysli tři oblasti:
- kardiorespirační (oběhově-dechová) kondice je schopnost provádět dynamické cvičení se zapojením velkých svalových skupin střední a vysoké zátěže po delší dobu (zjednodušeně řečeno vytrvalostní/aerobní zátěž),
- muskuloskeletální (svalově kosterní) kondice je schopnost svalů vyvinout sílu a napětí a udržet je po určitou dobu a současně také schopnost kloubního aparátu pohybovat se v celém rozsahu pohybu (zjednodušeně svalová síla),
- tělesné složení zpravidla definuje poměr tukové a netukové tkáně v těle.
Pro běžné denní aktivity je třeba jak jisté úrovně kardiorespirační kondice, tak i určité svalové síly, která je dána objemem aktivní svalové hmoty. Tréninková intervence by proto měla zahrnovat jak aerobní zátěž (jízda na ergometru, běh…), tak prvky silového tréninku (11).
Pohybová aktivita se často také dělí na dynamickou a statickou (izometrickou).
- Dynamická zátěž je určena jako pravidelné střídání kontrakce a relaxace, dynamickou zátěž v čisté podobě představuje chůze nebo běh.
- Statická zátěž je definována izometrickým stahem, v běžném životě se uplatňuje při zvedání či nošení břemen. Silový trénink znamená obvykle posilování svalstva končetin zátěží na posilovacích trenažérech. Za silový trénink lze však také považovat jízdu na ergometru nebo veslování proti většímu odporu. V obecné rovině platí, že posilování proti velkému odporu vede zejména ke zvýšení síly, střední zátěž představuje rovnováhu mezi silou a vytrvalostí, cvičení proti nízkému odporu charakterizuje vytrvalostní trénink (12).
Pokud má pohybová aktivita vést k adaptačním změnám organismu, tzn. zlepšení tělesné zdatnosti, musí dosahovat určitou minimální (prahovou) intenzitu. Ta spolu s hodnotou maximální intenzity určuje hranice tzv. aerobního (tréninkového) pásma, které je u každého individuální. Všeobecně platí, že čím je jednotlivec zdatnější, tím může dosahovat vyšší intenzity cvičení. Intenzita určuje délku cvičení, množství spotřebovaného kyslíku a energii potřebnou na cvičení. Intenzitu FA lze definovat jako procento maximální spotřeby kyslíku (obvykle se pohybuje mezi 40 % – 85 % VO2 max), kterou je však nutno změřit při zátěžové ergometrii nebo spiroergometrii. Jako vnějšího indikátoru lze využít tepovou frekvenci, intenzita by se měla pohybovat na úrovni 40–90 % maximální tepové frekvence TFmax (tedy mezi cca 90–150/min). Platí však vždy pouze pro stejný typ zátěže u stejného pacienta, jinak je použití tepové frekvence jako ukazatele zátěže velmi orientační (11)!
Pro praktické vyjádření stupně intenzity se používá srovnání násobků spotřeby kyslíku přijímaných v klidovém stavu. Energetický výdej vsedě v klidu je označován jako MET (= metabolický energetický ekvivalent), což odpovídá 3,5 ml/min/kg neboli spotřebě asi 250 ml/min kyslíku pro muže nebo asi 200 ml/min pro ženu. Zátěž považujeme za lehkou, jestliže odpovídá méně než 3 MET, střední 3–4,5 MET, těžká 4,6 až 7,0 MET a velmi těžká nad 7,1 MET. Jde opět jen o orientační rozdělení, které platí zhruba u průměrně zdatného jedince (11).
Vzhledem k limitaci univerzálního využití tepové frekvence bylo do praxe zavedeno subjektivní hodnocení pomocí číselné stupnice, kterou zavedl G. Borg. Tzv. Borgova škála je určitou integrací svalové činnosti, změn kardiovaskulárního systému, bolesti, psychického stresu, tělesné teploty i podmínek, ve kterých se cvičí (13). Škála sestává z 15 slovně definovaných stupňů od 6 do 20. Autor zvolil jako nenižší hodnotu 6 pro nelineární počátek vztahu mezi pocity a lehkou zátěží (viz tabulka č. 1). Navzdory subjektivnímu vyjádření vykazuje Borgova škála překvapivě dobrou korelaci s objektivně měřenými veličinami (spotřeba kyslíku, tepová frekvence).
Tab. 1. Stupnice dle Borga na odhadování intenzity zátěže založené na subjektivním vnímání (podle 13). 
Svalová síla se dá rovněž měřit. Její velikost je dána maximální svalovou kontrakcí (MSK) a zjišťuje se například tzv. hand-grip testem pomocí balónkového dynamometru. Zátěž při silovém cvičení se určuje na základě množství síly, které lze aplikovat jen jednou tzv. 1RM (one repetition maximum). Pro libovolný cvik je to ta nejvyšší hmotnost závaží, se kterou je jedinec schopen cvik vykonat v plném rozsahu pohybu a správným pohybovým stereotypem (14).
Inaktivita a efekt protinádorové terapie na tělesnou kondici
U velké většiny nemocných s hematoonkologickým onemocněním dochází vlivem příčin uvedených výše ke značnému poklesu fyzické aktivity, jejíž důsledky mohou spíše zhoršovat léčebné výsledky a tím i prognózu nemocného. Podívejme se podrobněji na tělesné změny, kterou sebou inaktivita přináší. Tělesná inaktivita znamená snížení schopnosti maximálního příjmu kyslíku, vede k poruše regulace na úrovni vegetativního nervstva a k tzv. ortostatické labilitě. Inaktivita je provázena snížením objemu krve v oběhu, počtu červených krvinek a klesá taktéž fibrinolytická aktivita séra se zvýšenou náchylností ke vzniku krevních sraženin. Snižuje se množství aktivní svalové hmoty, jejímž výsledkem jsou ztráty dusíku a vyplavování vápníku zejména z kostí osového skeletu (páteř, pánevní kosti apod.). Nedostatečnou stimulací dlouhých kostí chůzí se také málo stimulují kostní buňky produkující bílkovinnou kostní matrix, do které se ukládají minerály. Klesá kostní hustota a zvyšuje se tak riziko osteoporózy, které je již zvýšené tam, kde bylo k léčbě nutno použít kortikoidů. Inaktivita vyvolává změny v metabolismu především cukrů s nežádoucí sníženou citlivostí na inzulin (11).
Uvedené změny jsou navíc mohutně podporovány mnohými léky, které však musejí být součástí léčebných protokolů. Kortikoidy (dexametazon, prednizon, metylprednizolon) ve vysokých dávkách jsou součástí mnoha léčebných protokolů především lymfoidních malignit. Kortikoidy umocňují atrofii svalů zvýšenou degradací svalových bílkovin, zástavou jejich novotvorby a snížením schopnosti jejich fosforylace. Kortikoidy také mění metabolismus cukrů, zhoršují nebo mohou vyvolat cukrovku. Mnoho cytostatik je navíc přímo toxických pro některé orgány jako srdeční sval (antracykliny), plicní tkáň (bleomycin), nervy (vinka-alkaloidy) s trvalými důsledky na jejich funkci. Rovněž ozáření především oblasti hrudníku vede často k poškození srdce a plic s následným poklesem kardiorespirační výkonnosti (7).
Specifické aspekty pohybové aktivity u hematoonkologických pacientů
Je třeba říci, že ve srovnání s nejčastějšími nádory jako je rakovina prsu, střeva či prostaty, kde jsou k dispozici zkušenosti z desítek až stovek velmi dobře organizovaných studií zabývající se pohybovou aktivitou, je obdobných studií u pacientů s maligními onemocněními krve (lymfomy, leukemie nebo myelomy) podstatně méně. Jedním z důvodů je patrně celkově nižší četnost těchto maligních onemocnění (cca 10 % všech nádorů) a jejich poněkud odlišná biologická charakteristika s výrazným postižením produkce krevních elementů, které vede k anémii, poruchám krevního srážení a také snížením výkonnosti imunitního systému s častými infekčními komplikacemi. Studie jsou publikovány zejména z oblasti dětské hematoonkologie, studií podobného typu u dospělých pacientů bylo od roku 1986 publikováno asi jen 18. Celková kvalita studií pohybové aktivity v hematoonkologii trpí především nedostatkem randomizovaných studií (publikovány jsou dosud pouze 4), nízkými počty pacientů (největší ojedinělý soubor čítá 200 nemocných), designem, délkou sledování a volbou výstupů (2). Navzdory těmto výhradám, výsledky studií však v zásadě potvrzují závěry obdobných analýz u jiných nádorů a dokládají, že pohybová aktivita pacientům s krevními nádory neublíží, ani pokud jsou léčeni velmi intenzivně (včetně transplantace kostní dřeně). Tolerance programů od střední až po vysokou intenzitu zátěže byla výborná. Pacienti, kteří absolvovali programy s kombinovanou zátěží (vytrvalostní i silový trénink doplněný strečinkem), dosáhli zlepšení aerobní kapacity (měřeno maximální spotřebou kyslíku) a svalové síly dokonce nad úroveň před zahájením léčby! Zajímavou zkušeností je, že i když pohybová intervence ve studii trvala poměrně krátce, asi jen 12 týdnů, efekt tohoto tréninku přetrvával ještě 12 měsíců po jeho ukončení! (15)
Fyzický trénink a pokles krvinek (cytopenie)
U pacientů po chemoterapii dochází pravidelně k více či méně intenzivnímu přechodnému poklesu počtů krevních elementů (cytopenii). Za kritické hodnoty se obvykle považují hodnoty neutrofilních leukocytů pod 1,0x x109/l, hemoglobinu pod 80 g/l a krevních destiček pod 50x109/l, při nichž lékaři zpravidla z obavy před možnými komplikacemi nedoporučují provozovat jakékoli cvičení a zdůvodňují to vysokým rizikem krvácení, infekce, zranění apod. Protože však u hematoonkologických pacientů je cytopenie častý ne-li každodenní problém, byla by aplikace jakékoli pohybové aktivity prakticky nemožná. Jsou však tato aktuální doporučení vhodná a restrikce cvičení nutná?
Trombocytopenie
Na základě jedné studie se zdá, že i pacienti s velmi těžkou trombocytopenií pod 10x109/l(!) jsou schopni bezpečně absolvovat vhodné cvičení bez nebezpečí krvácení. Tréninková intervence zahrnovala šlapání na ergometru submaximální intenzity (180 – počet let věku) po dobu 12 týdnů s frekvencí 3x týdně. Kromě poměrně významné ochoty pacientů cvičit, 8/12 tj. cca 70 % bylo ochotno se cvičení podrobit, bylo objektivně zjištěno zlepšení aerobní kapacity bez výskytu krvácení či jiných komplikací (16).
I když jde o výsledky pouze jediné studie s malým počtem pacientů, zdá se, že trombocytopenie sama o sobě pravděpodobně nepředstavuje absolutní kontraindikaci cvičení. Pokud jsou ovšem přítomny zjevné známky krvácení, pak je vhodné snížit intenzitu či cvičení dočasně vynechat. Jistě bychom také u pacientů zejména s trombocytopenií pod 50x109/l nedoporučili dopadové a úpolové aktivity s rizikem pádu nebo nárazu (karate, judo, fotbal……). Nicméně aktivity typu šlapání na ergometru či na kole, svižné chůze, cvičení na stepperu nebo kondiční posilování lze v zásadě doporučit, optimálně za vzájemné spolupráce fyzioterapeuta a hematoonkologa. Zátěž, zejména posilování, stimuluje tvorbu steroidních hormonů, které zvyšují produkci krevních destiček megakaryocyty.
Neutropenie
Sama o sobě nepředstavuje překážku v provozování fyzického tréninku. Protože je v této fázi zvýšené riziko infekce, není vhodné cvičit tam, kde je mnoho lidí a kde je vlhko s možností růstu plísní (čili hromadná cvičení v přecpaných sálech – aerobik, zumba, plavecké bazény apod.). Cvičit lze však jistě individuálně doma, rovněž tak i v tělocvičně nebo posilovně v době minimálního provozu.
Anémie
Naprostá většina nemocných s hematologickými malignitami je více či méně anemická. Obecně vzato vnímání anémie (= anemický syndrom) nemusí vůbec odpovídat absolutní hodnotě hemoglobinu. U většiny pacientů jsou hladiny nad 100 g/l tolerovány bez problémů a zde asi není nutná restrikce fyzické aktivity, při hladinách mezi 80–100 g/l závisí na adaptaci konkrétního nemocného, u hladin nižších bychom doporučili před fyzickou zátěží transfuzi ke korekci anémie.
Cvičení a intenzivní léčba
Intenzivní léčba má řadu nežádoucích účinků akutní i dlouhodobé povahy a je často spojena s hospitalizací a změnou obvyklého denního režimu. Za nejintenzivnější léčbu se považují přípravné režimy před alogenní transplantací kostní dřeně sledované dlouhými pobyty na izolačních jednotkách a často komplikovaným průběhem. Zdálo by se tedy, že během takovéto léčby je nemožné provozovat jakékoli pravidelné tělesné cvičení. Studie s pacienty v programu alogenní transplantace kostní dřeně (n = 64) však ukázala, že intenzivní trénink (experimentální skupina) oproti běžné rehabilitační péči (téměř žádná zátěž) přináší pacientům nejen zlepšení aerobní kapacity, svalové síly, únavy a emočního stavu, ale také byla prokázána dobrá proveditelnost a hlavně bezpečnost bez nežádoucích účinků (17). Intezivní trénink v délce 4 týdnů zahrnoval aerobní zátěž na ergometru 3x týdně (submaximální intenzita snížená o 20 %) po dobu 10–20 minut doplněný denní aktivitou typu chůze, šlapání na stepperu v trvání dalších 20 minut. Kontrolní skupina procvičovala pouze gymnastiku na lůžku a absolvovala masáže.
Tréninková intervence a motivace pacientů s hematoonkologickými malignitami
V rozvaze pohybové intervence u pacientů nesmí chybět zkoumání motivace a adherence, které mají zásadní vliv na potenciální úspěšnost tělesného cvičení. Zajímavé pozorování u pacientů s lymfomy přinesla studie, která zkoumala ochotu pacientů cvičit. Po nabídce předem známého tréninkového plánu se 70–80 % pacientů uvolilo pravidelně a dle doporučení cvičit, přičemž významně horší ochotu vykazovali pacienti mladší 40 let, fyzicky nedostatečně aktivní před onemocněním, obézní či s nadváhou, kuřáci a pacienti po předchozí radioterapii (18).
Tréninkový režim dodržovalo až 100 % nemocných pokud bylo cvičení vedeno za hospitalizační péče, přičemž v domácím prostředí byla tato dlouhodobá ochota menší (asi 80 %), avšak stále vysoce převyšovala úroveň motivace u „zdravé populace“, která se pohybovala kolem 40–50 %!
Fyzická aktivita u pacientů s akutní leukemií
Pacienti s akutní leukemií jsou považováni za specifickou podskupinu nemocných i v rámci onkologie. Obvykle je jejich léčba ve srovnání s pacienty s tzv. solidními nádory intenzivnější, delší a toxičtější. Zpravidla je schéma léčby akutní leukemie zahájeno intenzivní chemoterapií – tzv. indukční, která se podává během 5–7 dní a je následována přibližně 3–4 týdenním útlumem krvetvorby. Pacienta je nutno po tuto dobu hospitalizovat a zabezpečit izolační režim tak, aby se minimalizovalo riziko infekce. Pacient se po té vrací obvykle opakovaně k podání udržovací (konsolidační) chemoterapie a nakonec je většinou směřován k některému typu transplantační léčby. Celá léčba akutní leukémie se vyznačuje častými a relativně dlouhými hospitalizacemi a četnými komplikacemi plynoucími z dlouhých dřeňových útlumů. To vše je provázeno výrazně sníženou tělesnou aktivitou, zhoršeným příjmem potravy, který je důsledkem nevolnosti, průjmů, zánětů dutiny ústní. Přitom celkový stav (performance status) je jednou z hlavních determinant úspěchu léčby.
První studie s pohybovou intervencí u pacientů léčených s akutní leukemií byla publikována až v roce 2008 (19). Studie prokázala v randomizovaném uspořádání, že i minimální pohybová intervence může mít měřitelný efekt. Zatímco kontrolní skupina 11 pacientů absolvovala běžný pohybový režim (tedy de facto žádný), experimentální skupina jiných 11 nemocných absolvovala 5 dní v týdnu 12minutovou chůzi po oddělení po dobu 3 týdnů. I tato zdánlivě velmi drobná tréninková intervence vedla u pacientů experimentální skupiny ke zlepšení tolerance zátěže a zmírnění únavy oproti kontrolní skupině. Z praktického hlediska je důležité zjištění, že snadno zvládnutelná, levná a v podmínkách nemocnice lehce aplikovatelná 12minutová chůze má měřitelný pozitivní vliv na pacienty aktuálně podstupující intenzivní léčbu akutní leukemie (19).
Proveditelnost, bezpečnost a pozitivní efekt na svalovou sílu a únavu včetně zlepšení aerobní výkonnosti potvrdila i další studie s velmi dobře strukturovanou kombinovanou zátěží. Deset pacientů s akutní leukemií absolvovalo čtyřtýdenní trénink během indukční léčby, cvičení probíhalo s frekvencí 4x týdně s 36hodinovým odpočinkem mezi cvičením. Po propuštění navazoval domácí program po dobu 2 týdnů. Cvičení po dobu hospitalizace bylo rozděleno do dvou bloků po 30 minutách (jeden ráno, druhý v pozdním odpoledni). První blok byl aerobní – šlapání na ergometru s mírnou až středně intenzivní zátěží (tepová frekvence mezi 40–50 % maximální frekvence), druhý trénink byl silový a zahrnoval cvičení s pružinami/gumami, závažím a míčem. Každý pokoj pacienta byl kompletně vybaven cvičebními pomůckami včetně ergometru a toto vybavení nikdy neopustilo místnost. Domácí program byl založen na svižné chůzi po dobu 10–30 minut o mírné intenzitě s frekvencí 3x týdně. I tato studie prokázala bezpečnost pohybové aktivity u pacientů s akutní leukemií na intenzivní léčbě (20).
Fyzická aktivita u pacientů s lymfomy
První studie s pohybovou aktivitou byla provedena v roce 2003 u pacientů s Hodgkinovou nemocí po ukončení léčby. Cílem studie bylo mimo jiné zjistit, zda u pacientů lze aplikovat 20týdenní domácí cvičební program střední intenzity (mezi 65–80 % maximální srdeční frekvence), přičemž pacienti si mohli sami zvolit typ zátěže (svižná chůze, běh, plavání…). Studie byla koncipována jako domácí nekontrolovaná (nesupervizovaná) FA. Navzdory ne zcela dostatečné objektivní kontrole naplnění plánované zátěže, bylo pozorováno významné zlepšení aerobní kapacity (měřeno spotřebou kyslíku VO2max) a únavy (měřeno pomocí dotazníku) až o 43 % oproti stavu před zahájením cvičení. Tato studie přinesla doklad o proveditelnosti a účinnosti domácích cvičebních programů u pacientů s lymfomy (21).
Velká randomizovaná studie s více než 120 nemocnými s lymfomem prokázala (60 pacientů experimentální a 62 nemocných kontrolní skupina), že aerobní trénink aplikovaný během chemoterapie má významný a pozitivní vliv na únavu, kvalitu života, tělesnou kondici a podíl svalové tkáně. Současně také bylo zjištěno, že neovlivňuje léčebný protokol a nemá negativní vliv na léčebnou odpověď. Tréninková intervence trvala 12 týdnů, během kterých pacienti 3x týdně cvičili na bicyklovém ergometru. Intenzita začínala na 60 % maximální spotřeby kyslíku VO2peak, trvání cvičební jednotky bylo zpočátku 15 až 20 minut s postupným zvyšováním zátěže až na 75 % VO2peak a délky jednotlivé lekce na 40–45 minut, 1x týdně byl zařazován intervalový trénink. Tato studie podobně jako mnoho dalších potvrdila, že tělesná aktivita je prosta jakýchkoli nežádoucích účinků (22).
Základní doporučení aplikace fyzické aktivity u pacientů s hematoonkologickými malignitami
Obecná doporučení
Stejně jako u sportovního tréninku jde u nemocných s nádorovým onemocněním krve o adaptaci na zátěž, neboli jde o zvýšení celkové aerobní kapacity (aerobní trénink) a svalové síly (silový/odporový trénink). K hlavním faktorům vyvolávajícím adaptaci patří délka cvičení, frekvence a intenzita. Fyzický trénink jako metoda podpůrné léčby u hematoonkologických pacientů je zatím oblast málo prozkoumaná a využívaná, žádná oficiální doporučení v podstatě neexistují. Pokud je zachována stejná intenzita, četnost i trvání zátěže, pak je vcelku jedno, o jakou pohybovou aktivitu jde. Aerobní trénink by měl obsahovat cyklickou zátěž velkých svalových skupin (jízda na kole, chůze, severská chůze, běh, veslování, in-line bruslení, běh na lyžích, plavání…). Zcela základní a obecná doporučení, která lze aplikovat na všechny nemocné bez ohledu na fázi léčby, věk a celkový stav byla publikována v rámci doporučení American Cancer Society (ACS) a jsou uvedena v tabulce 2 (23).
Tab. 2. Co lze každému pacientovi s lymfomem nebo leukemií doporučit během kterékoli fáze léčby i po ní? (upraveno dle 23). 
Dle publikovaných studií a jejich výsledků lze jistě s výhodou využít metody a zkušenosti uplatňované a používané v rehabilitačních programech u pacientů po infarktu myokardu.
Ačkoli všeobecně dosud panuje názor, že cvičení svalové síly má především estetický smysl, v současné době převažují důkazy zdůrazňující význam zachování svalové hmoty a síly. Hlavním přínosem zvýšení svalové síly prostřednictvím silového tréninku je především prevence úrazů, osteoporózy a úbytku aktivní svalové tkáně, což vede ke zvýšení kvality života. Pro pacienty s onkologickým onemocněním je udržení přiměřené svalové hmoty absolutně zásadní, proto by měl cvičební program pro tuto skupinu nemocných obsahovat vždy posilovací cviky.
Dle studií se rovněž zdá, že jak zátěž pod odborným vedením tak i individuálně provozovaná (nesupervizovaná) jsou rovnocenné a mohou přinášet stejné výsledky (24).
Individuální trénink (domácí, nesupervizovaný)
Pohybová aktivita by měla být provozována dlouhodobě, v ideálním případě celoživotně. Zejména v počátečních fázích je optimálním typem pohybu chůze, protože je nejjednodušší, nejdostupnější a současně nejméně riziková forma fyzického tréninku, která se dá navíc snadno skloubit s běžnými denními aktivitami. Nevyžaduje žádný předchozí zácvik, je snadno měřitelná (krokoměry) a lze snadno volit její intenzitu (rychlost, délka úseku). Obvyklá doporučení pro běžnou populaci jsou 10 000 kroků denně. Při frekvenci 5 dnů v týdnu je to asi 25 km pro ženu a 35 km pro vyššího muže týdně. Časově je to něco přes hodinu chůze denně (25). V realitě budou u hematoonkologického pacienta, u kterého předpokládáme jistý stupeň dekondice, tyto požadavky zpočátku neakceptovatelnou zátěží. Jako hrubé vodítko lze v takovém případě využít postupnou zátěž dle tabulky 3, která byla aplikována u nemocných po infarktu myokardu (26).
Tab. 3. Plán individuálního domácího tréninku (upraveno podle 26). 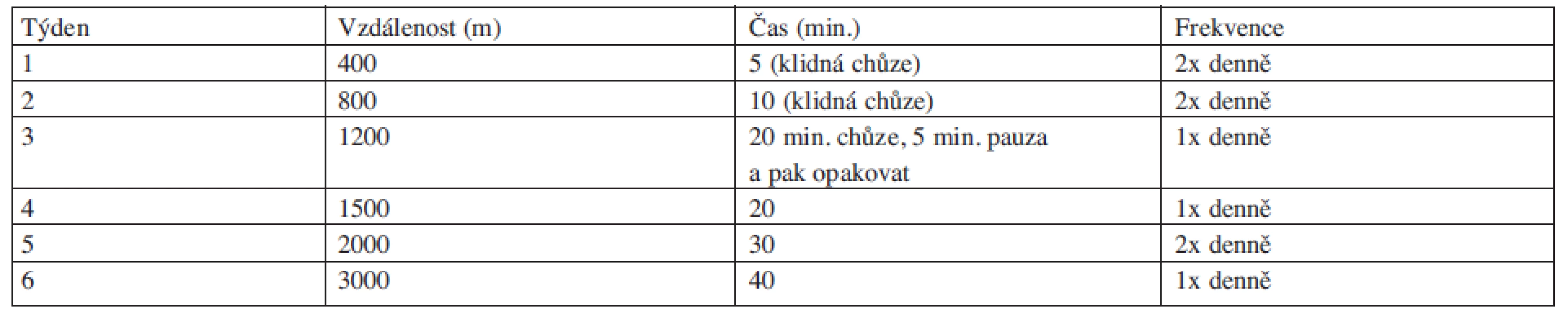
Modifikací dnes velmi módní a vcelku efektivní je tzv. severská chůze se speciálními holemi („Nordic walking“). Dobrou alternativou zejména pro pacienty s určitým omezením (nemoci kloubů, těžší obezita, poruchy rovnováhy…) je jízda na kole či domácím ergometru nebo plavání. V úvahu také přicházejí rovněž různá cvičení v odborně vedených fitcentrech, programy by však měly být vyvážené s prvky odporové (silové) i aerobní (vytrvalostní) zátěže. Pokud pacient před stanovením diagnózy provozoval pravidelně konkrétní sport, lze v této aktivitě v zásadě opatrně pokračovat. Určitou výjimku tvoří kolektivní sporty v době imunosuprese. Rovněž je možno připustit po ukončení léčby pokračování ve sportovních aktivitách i na úrovni vrcholového sportu. Je však vždy žádoucí konzultovat typ zvláště intenzivnějších či rizikovějších pohybových aktivit jak s onkologem, tak s tělovýchovným lékařem.
Supervizované tréninkové programy pro hematoonkologické pacienty
Před zahájením fyzického tréninku je optimální u nemocného zajistit zátěžové ergometrické popřípadě přesnější spiroergometrické vyšetření a ECHO srdce. Zátěžovým vyšetřením přesně zjistíme základní metabolické a oběhové parametry, které individuálně určí intenzitu tréninkové intervence. Před zahájením každé lekce je nutné vždy se pacienta dotázat na subjektivní potíže a zaznamenat hodnoty krevního tlaku a pulzu, které je třeba sledovat i během zátěže. Z hlediska optimální efektivity a bezpečnosti je vhodné zahájit tréninkový program jako řízený (supervizovaný).
Je nutno však zdůraznit, že pokud je autorům známo, v ČR žádné supervizované tréninkové programy pro hematonkologické ani onkologické pacienty v rámci běžné klinické péče neprobíhají. V rámci zejména pediatrických onkologických pracovišť byly takovéto programy dostupné dočasně v rámci grantových projektů. Bohužel do běžné klinické praxe se tyto programy nepodařilo přenést. Jedním z problémů je náročnost na složení tréninkového týmu (onkolog/hematoonkolog, tělovýchovný lékař a fyzioterapeut proškolený zejména v oblasti vytrvalostního a silového tréninku), dostupnost vhodných prostor a geografický faktor znevýhodňující pacienty z větší vzdálenosti, kteří by museli na trénink komplikovaně dojíždět. Uvedené parametry tréninkových programů jsou čerpány ze zahraniční literatury a převzaty z doporučení kardiologických studií.
Většina tréninkových programů je organizována zpravidla s frekvencí 3x týdně po dobu 2–3 měsíců. Pozorovatelné zlepšení aerobní kapacity lze pozorovat již po 4 týdnech, maximum lze však očekávat za 16 až 26 týdnů (alespoň takto je pozorováno u kardiologických pacientů). Jednotlivá cvičební jednotka obvykle trvá 60–90 minut a sestává ze zahřívací fáze (cca 10 minut), fáze vlastního tréninku a fáze relaxační (5–10 min). U pacientů s velmi nízkou tolerancí zátěže (méně než 3 MET; 25–40 W) se doporučuje krátké cvičení s nízkou intenzitou i třeba jen 5–10 minut 2x i vícekrát denně, u nemocných s tolerancí 3–5 MET (40–80 W) 1–2x denně 15 minut a nad 5 MET 3–5x týdně 30 minut. Obecně lze říci, že při zlepšování funkční kapacity zvyšujeme zátěž nejprve trváním, potom frekvencí a nakonec intenzitou.
Intenzita zátěže se nejčastěji stanovuje na základě vstupního zátěžového vyšetření a vyjadřuje se podílem z hodnoty vrcholové (maximální) spotřeby kyslíku (VO2 peak), užívané hodnoty se pohybují v širokém rozmezí 40–80 % VO2 peak. Hodnocení tepové frekvence je dobře využitelné pokud je tato hodnota změřena u konkrétního pacienta při konkrétní zátěži, jinak nutno tento parametr považovat za orientační a nedostatečně přesný. Přesto by každý pacient měl svoji tepovou frekvenci při dané zátěži a intenzitě znát a naučit se ji měřit.
Aerobní trénink je nejčastěji provozován na bicyklovém ergometru (rotopedu), který umožňuje přesně dávkovat a kontrolovat zátěž stejně jako oběhové a klinické ukazatele. Umožňuje také použít efektivního intervalového tréninku s cyklickou periodou vysoké zátěže střídaného úseky zotavení s minimální zátěží. Intervalový trénink se považuje za zvláště efektivní ve stimulaci srdce a svalů i v případě hematoonkologických pacientů (8). Vhodnou kombinací aerobního tréninku na ergometru je běhátko, pomocí kterého můžeme pacientovi také doporučit intenzitu tréninkové aktivity chůzí. Zařazení prvků silového tréninku 2x týdně je důležité v prevenci svalové atrofie a budování svalové hmoty (8, 14).
Kontraindikace fyzického tréninku
Vždy je třeba zvážit absolutní kontraindikace fyzického tréninku. Za absolutní kontraindikace se obecně považují: nestabilní angina pectoris, manifestní srdeční selhání, disekující aneurysma aorty, komorová tachykardie nebo jiné život ohrožující arytmie, klidová sinusová tachykardie nad 120/min, těžká aortální stenóza, akutní žilní trombóza, podezření na plicní embolii, systolický tlak nad 200 mmHg, diastolický tlak nad 115 mmHg, symptomatická hypotenze, kolapsové stavy, akutní infekce (14, 26). V případě hematologických pacientů by mezi kontraindikace patřily také: akutní krvácivé projevy a těžká koagulopatie (například u nemocných s akutní promyelocytární leukemií), kompresivní syndromy (syndromy horní a dolní duté žíly), čerstvé osteolytické léze především osového skeletu a podobně.
Závěr
Z uvedeného lze shrnout následující poznatky: 1) FA je pro pacienty s hematoonkologickými malignitami bezpečná (nemá tedy smysl ji zakazovat), zvláště u pacientů, kteří dosud pravidelně sportovali; 2) je-li provozována racionálně, lze FA provozovat bez negativního dopadu na léčebné výsledky i v průběhu terapie; 3) FA má měřitelné pozitivní účinky na fyzickou i psychickou kondici pacientů již po relativně krátké době 2–3 měsíců; 4) u pacientů hospitalizovaných s agresivním typem léčby a hlubokými cytopeniemi je optimální sestavit odborně vedený tréninkový program se vstupním zátěžovým vyšetřením; 5) oblast cílené rehabilitace a výzkumu fyzické aktivity u hematoonkologických nemocných je zatím na samém počátku, nicméně FA by se měla zřejmě stát jednou ze standardních metod podpůrné léčby.
Doc. MUDr. Andrea Janíková, Ph.D.
Interní hematoonkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
Doručeno do redakce: 26. 12. 2011
Přijato po recenzi: 9. 2. 2012
Zdroje
1. Wen XJ, Balluz LS. Physical activity level and ischemic heart disease prevalence among individuals aged 45 years and older with normal weight, BRFSS, 2007. J Phys Act Health 2011; 8(4): 475–80.
2. Courneya KS, Friedenreich CM. Physical activity and cancer: an introduction. In: Physical activity and Cancer. Springer Verlag Berlin Heidelberg 2011.
3. Kasim K, Johnson KC, Levallois P, et al. Recreational physical activity and the risk of adult leukemia in Canada. Cancer Causes Control 2009; 20(8): 1377–1386.
4. Wong O, Harris F, Yiying W, Hua F. A hospital-based case-control study of acute myeloid leukemia in Shangai: analysis of personal characteristics, life-style and environmental risk factors by subtypes of the WHO classification. Regul Toxicol Pharmacol 2009; 55(3): 340–352.
5. Gullbrandsen N, Hjermstad MJ, Wisloff F. Interpretation of quality of life scores in multiple myeloma by comparison with a reference population and assessment of the clinical importance of score differences. Eur J Haematol 2004; 72 : 172–180.
6. Elbl L, Vasova I, Tomaskova I, et al. Cardiopulmonary exercise testing in the evaluation of functional capacity after treatment of lymphomas in adults. Leukemia Lymphoma 2006; 47(5): 843–851.
7. Radvanský J, Radvanská J, Slabý K, et al. Pozdní následky Hodgkinovy choroby a její léčby u pacientů léčených v letech 1980-1999 na klinice dětské onkologie 2. LF FNM. Klinická onkologie 2004; 17 : 131–135.
8. Persoon S, Kersten MJ, ChinAPaw MJM, et al. Design of the EXercise Intervention after Stem cell Transplantation (EXIST) study: a randomized controlled trial to evaluate the effectiveness and cost-effectiveness of an individualized high intensity physical exercise program on fitness and fatigue in patients with multiple myeloma or (non-) Hodgkinęs lymphoma treated with high dose chemotherapy and autologous stem cell transplantation. BMC Cancer 2010; 10 : 671–680.
9. Speck R, Courneya KS, Masse LC, et al. An update of controlled physical activity trials in cancer survivors: a systematic review and meta-analysis. J Cancer Surviv 2010; 4 : 87–100.
10. Schmitz K. Physical activity and breast cancer survivorship. In: Courneya KS, Friedenreich CM (eds). Physical activity and cancer: Recent results in cancer research, vol 186. Springer, Berlin Heidelberg 2011.
11. Máček M, Radvanský J. Fyziologie a klinické aspekty pohybové aktivity. Praha, Galén 2011.
12. Chaloupka V, Elbl L. Rehabilitace po infarktu myokardu II. Kardiol Rev 2005; 7 (2): 73–76.
13. Borg G. Anstrengungsempfinden und körperliche Aktivität. Deutsches Ärzteblatt 2004; 101 : 1016–1021.
14. Williams MA, Haskell WL, Ades PA, et al. Resistance exercise in individuals with and without cardiovascular disease: 2007 update. Circulation 2007; 116 : 572-584.
15. Carlson LE, Smith D, Russell J, et al. Individualized exercise program for the treatment of severe fatigue in patients after allogeneic hematopoietic stem-cell transplant: A pilot study. Bone Marrow Transplant 2006; 37 (10): 945-954.
16. Elter T, Stipanov M, Heuser E, et al. Is physical exercise possible in patients with critical cytopenia undergoing intensive chemotherapy for acute leukaemia or aggressive lymphoma? Int J hematol 2009; 90(2): 199–204.
17. Baumann FT, Zopf EM, Nykamp E, et al. Physical activity for patients undergoing an allogeneic hematopoietic stem cell transplantation: benefits of a moderate exercise intervention. Eur J Haematol 2011; 87(2): 148–156.
18. Courneya KS, Stevinson C, McNeely ML, et al. Predictors of adherence to supervised exercise in lymphoma patients participating in a randomized controlled trial. Ann Behav med 2010; 40 : 30–39.
19. Chang PH, Lai YH, Shun SC, et al. Effects of a walking intervention on fatigue-related experiences of hospitalized acute myelogenous leukemia patients undergoing chemotherapy: a randomized controlled trial. J Pain Symptom Management 2008; 35(5): 524–534.
20. Battaglini CL, Hackney AC, Garcia R, et al. The effects of an exercise program in leukemia patients. Integr Cancer Ther 2009; 8(2): 130–138.
21. Oldervoll LM, Kaasa S, Knobel H, Loge JH. Exercise reduces fatigue in chronic fatigued Hodgkins disease survivors-results from a pilot study. Eur J Cancer 2003; 39(1): 57–63.
22. Courneya KS, Sellar CM, Stevinson C, et al. Randomized controlled trial of the effects of aerobic exercise on physical functioning and quality of life in lymphoma patients. J Clin Oncol 2009; 27 : 4605–4612.
23. Brown JK, Byers T, Doyle, et al. Nutrition and physical activity during and after cancer society guide for informed choices. CA Cancer J Clin 2003; 53 : 268–291.
24. Shelton ML, Lee JQ, Morfia GS, et al. A randomized control trial of a supervised versus a self-directed exercise program for allogeneic stem cell transplant patients. Psychooncology 2009; 18(4): 353–359.
25. Tudor-Locke C, Bassett DR. How many steps/day are enough. Sports Med 2004; 34 : 1–8.
26. Chaloupka V, Elbl L. Rehabilitace po infarktu myokardu III. Kardiol Rev 2005; 7 (4): 187–190.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2012 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Genetické polymorfismy destičkových receptorů u mladých pacientů s akutním infarktem myokardu (AIM) a rezistencí k protidestičkové léčbě
- Žilní trombózy u dětských pacientů s akutní lymfoblastickou leukemií
- Senzibilizace polytransfundovaných hematologických pacientů alogenními erytrocytovými a HLA antigeny
- Význam fyzické aktivity u pacientů s hematoonkologickými malignitami
- Asymptomatický makroadenom hypofýzy komprimující optické chiasma – „incidentalom“ – identifikovaný při diagnostickém stážování nemocného s primárně extranodálním difúzním B-velkobuněčným lymfomem očnice a paranasálních dutin – popis případu
- Vyhlášení ceny firmy Janssen
- Anti-Escherichia coli asparaginase antibody levels determine the activity of second-line treatment with pegylated E. coli asparaginase: a retrospective analysis within the ALL-BFM trials
- Warfarin and acetaminophen interaction: a summary of the evidence and biologic plausibility (Evidence-based focused review)
- Úvodní slova
- VKORC1 and CYP2C9 genotype and patient characteristics explain a large proportion of the variability in warfarin dose requirement among children
- XXVI. Olomoucké hematologické dny
- Pražské hematologické dny
- Mobilizace krvetvorných buněk pomocí plerixaforu - zkušenosti transplantačních center v České republice
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Asymptomatický makroadenom hypofýzy komprimující optické chiasma – „incidentalom“ – identifikovaný při diagnostickém stážování nemocného s primárně extranodálním difúzním B-velkobuněčným lymfomem očnice a paranasálních dutin – popis případu
- Význam fyzické aktivity u pacientů s hematoonkologickými malignitami
- Senzibilizace polytransfundovaných hematologických pacientů alogenními erytrocytovými a HLA antigeny
- Mobilizace krvetvorných buněk pomocí plerixaforu - zkušenosti transplantačních center v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



