-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Radioterapie u folikulárního lymfomu.
Stará historie v nové perspektivě?
Radiotherapy in follicular lymphoma. The old story in a new perspective?
Follicular lymphoma (FL) is the most common type of low grade malignant B-cell non-Hodgkin’s lymphoma. Despite of low proliferation, FL belongs to the extremely radiosensitive tumors. The high radiosensitivity is evident from rapid onset of efficacy early during first doses of irradiation and from good global results of low dose total body irradiation (1-2 Gy). Involved field radiotherapy (IF RT) is a standard therapeutic procedure especially in the localized stages of disease. In the case of extended FL, now, a therapy is based on combination of rituximab with chemotherapy, and radiotherapy is used as an auxiliary method in a small proportion of patients only. The doses between 25 and 40 Gy are usually used. Recently, there is increasing amount of evidence concerning very low radiation doses (2x2 Gy) in recurrent follicular lymphoma with significant efficacy. Low dose radiotherapy probably leads to the induction of apoptosis via p53 pathway. This hypothesis is in accordance with a theory of FL being a disease resistant to the apoptosis. IF radiotherapy 2x2 Gy offers an extremely attractive treatment possibility with minimal toxicity that is applicable also in heavily pretreated patients and that, moreover, could be administered with success repeatedly.
Key words:
follicular lymphoma, low dose radiotherapy, rituximab, microenvironment
Autoři: A. Janíková 1; J. Gombošová 2; I. Čoupková 2; J. Michalka 1; I. Vášová 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty Masarykovy Univerzity, Fakultní nemocnice Brno 1; Klinika radiační onkologie Lékařské fakulty Masarykovy univerzity, Masarykův onkologický ústav Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 4, p. 210-217.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Folikulární lymfom (FL) je nejčastěji se vyskytujícím typem nízce maligního B-buněčného nehodgkinského lymfomu. Přestože FL patří k nízce proliferujícím nádorům, je mimořádně radiosenzitivní. Klinicky je radiosenzitivita FL patrná z rychlého nástupu účinku již během prvních dávek záření a také z velmi dobrého systémového efektu nízkých dávek celotělového záření (1–2 Gy). Radioterapie jako standardní léčebný postup především u lokalizovaných forem onemocnění je aplikována metodou „involved field“ (IF RT). U pokročilého FL, kde je dnes léčba založená na kombinaci rituximabu a chemoterapie, má radioterapie využití pouze u malé části pacientů jako doplňková léčba. Dávky radioterapie se obvykle pohybují mezi 25–40 Gy IF RT. V poslední době přibývá důkazů o dobré účinnosti i velmi nízkých dávek záření (2x2 Gy) u relapsů folikulárního lymfomu. Mechanismem účinku nízkých dávek záření je patrně indukce apoptózy aktivací p53. Tato hypotéza je v souladu s představou FL jako choroby s rezistencí k apoptóze. IF radioterapie 2x2 Gy představuje mimořádně atraktivní alternativu s nepatrnou toxicitou, která je vhodná i pro velmi předléčené nemocné a kterou je možno s dobrým efektem podat i opakovaně.
Klíčová slova:
folikulární lymfom, low-dose radioterapie, rituximab, mikroprostředíÚvod
Folikulární lymfom (FL) je nejčastěji se vyskytujícím typem nízce maligního B-nehodgkinského lymfomu (NHL). Na celkovém množství NHL v západní Evropě a USA se podílí přibližně 20 %, což odpovídá zhruba jednomu procentu všech nádorových chorob (1). Situace v ČR je obdobná s podílem FL 17 % na celkovém počtu NHL a cca 0,3% na objemu všech hlášených zhoubných novotvarů (2).
FL se klinicky obvykle projevuje jako nebolestivé zvětšení uzlin, které jen zvolna narůstá a dlouho nečiní svému nositeli žádných potíží. Onemocnění, které se nejčastěji objevuje kolem 60. roku věku, je typické pomalým průběhem a opakovanými relapsy, výjimkou však nejsou ani spontánní regrese. Zcela zásadním je rozlišení časných (stadium I a II) a pokročilých (stadium III a IV) stadií. Stadia I a II lze i zcela vyléčit pouhou radioterapií, zatímco u pokročilého onemocnění je standardem systémová léčba založená na chemoterapii respektive dnes na kombinaci rituximabu a chemoterapie (imunochemoterapie).
Folikulární lymfom je maligní choroba, která je extrémně zajímavá z hlediska radioterapie. Historicky je radioterapie u folikulárního lymfomu využívána v různých podobách již řadu desetiletí. S nástupem nových cytostatik, později transplantační léčby a monoklonální protilátky anti-CD20 (rituximab), však došlo k výrazné redukci její aplikace především u pokročilých FL. Naprostá většina těchto pacientů je dnes léčena imunochemoterapií a radioterapie představuje pouze doplňkovou léčbu, což je částečně dáno systémovým charakterem onemocnění a léčbou spíše na hematologických pracovištích nežli na onkologických odděleních.
FL je považován za vůbec jeden z necitlivějších nádorů k ozáření. Klinicky je jeho radiosenzitivita patrná z rychlého nástupu účinku již během prvních dávek léčby a také velmi dobrým systémovým efektem nízkých dávek celotělového záření (3, 4, 5, 6, 7, 8, 9). Nově využívají vysoké radiosenzitivity FL sofistikované molekuly radioimunokonjugátů ( 90Y-ibritumomab tiuxetanu a 131I tositumomabu) (10, 11, 12, 13). Radioimunoterapie však představuje samostatnou problematiku, která přesahuje rámec tohoto přehledu a dále tedy nebude rozebírána.
Podstata radiosenzitivity folikulárního lymfomu je velmi zajímavá, neboť podstatou růstu FL je spíše kumulace buněk s defektem apoptózy v důsledku přestavby t(14;18) nežli vlastní proliferace (14). Předpokládaný mechanismus účinku radiace je tedy zásah do apoptotických procesů buňky.
Tato přehledná práce systematicky a strukturovaně pojednává postavení různých variant radioterapie v historii léčby folikulárního lymfomu. Hlavním motivem textu je však vyzvednout možnost aplikace atraktivní nízce dávkované a tudíž prakticky netoxické (,,low-dose“) radioterapie (2x2Gy) v kontrole lokálního rekurentního folikulárního lymfomu. Dle našeho názoru je tato možnost léčby uplatňována v českých zemích minimálně. Vzhledem k uvedeným dnes již však často nepoužívaným radiačním technikám byla práce doplněna o části věnované obecným principům a technický aspektům radioterapie lymfomů.
Obecné poznámky k radioterapii u lymfomů
Ozařovací objemy
Upraveno dle ICRU 50 (International Commission on Radiation Units and Measurements) (15).
Nádorový objem – Gross tumor volume (GTV) - anatomický rozsah nádoru určený zobrazovacími metodami anebo klinickým vyšetřením.
Klinický cílový objem - Clinical target volume (CTV) - klinicko-anatomický pojem vyjadřující GTV + bezpečnostní lem, který je nutný z důvodu rizika mikroskopického šíření nádorových buněk a který je závislý na biologické povaze nádoru.
Plánovací cílový objem - Planning Target Volume (PTV) - geometrický pojem obsahuje CTV + lem ke korekci nepřesnosti způsobené pohybem a změnou polohy orgánů (např. dýchací pohyby), a také nepřesnosti při nastavení pacienta do předem definované polohy při samotném ozáření. Celý PTV by měl být ozářen požadovanou dávkou.
Léčený objem - Treated volume (TV) - objem tkáně obklopený izodózou (většinou 95%) vhodnou k dosažení léčebného záměru.
Ozářený objem - Irradiated volume (IV) – objem tkáně, který je ozářen významnou dávkou vzhledem k toleranci zdravé tkáně. Vztah jednotlivých ozařovacích objemů je znázorněn na obrázku 1.
Obr. 1. Definice cílových objemů. 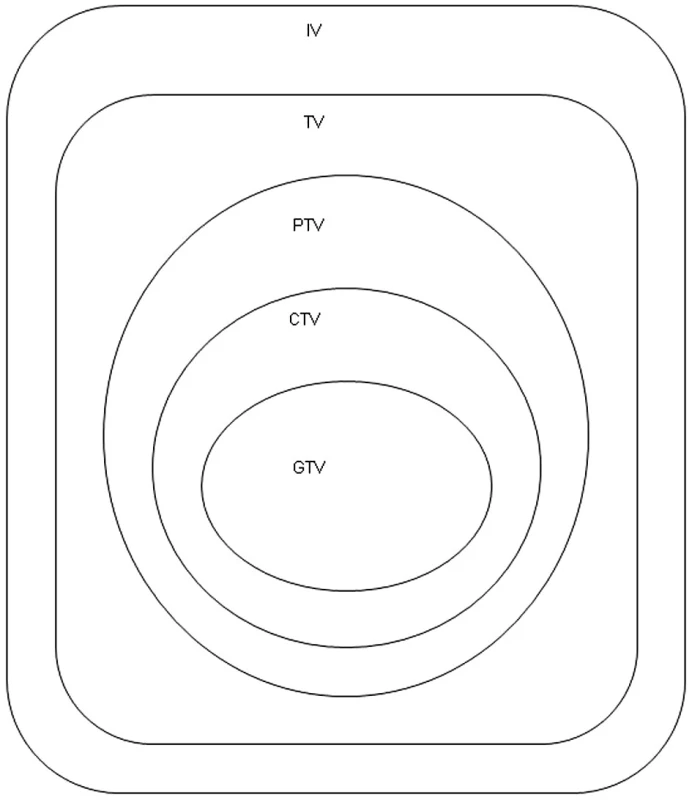
Dávky záření a toxicita
Terapeutické dávky záření se liší v závislosti na typu nádorového onemocnění, velikosti ozařovaného objemu a toleranci okolních zdravých struktur. Dávky aplikované u lymfomů, jakožto nádorů citlivých k ozáření, se pohybují obecně mezi 30–50 Gy a jsou aplikovány tzv. normofrakcionací (tj. aplikací záření 1x denně, 5 dní v týdnu s maximální dávkou 2 Gy na frakci) tedy 5x 1,8–2 Gy/týden. Pro srovnání dávky aplikované v kurativní léčbě karcinomů se pohybují kolem 70–80 Gy. Naproti tomu celotělově aplikovaná dávka 3–4 Gy je obecně udávána jako střední letální dávka. V současnosti se klade důraz na respektování tolerancí okolních zdravých struktur – tzv. kritických orgánů. Každý orgán má určitou kritickou dávku, která nesmí být překročena, aby zářením nedošlo k jeho závažnému poškození. Podrobněji je problematika rozvedena v učebnicích radiační onkologie Hynková 2009 a Šlampa 2008 (16, 17).
Samostatnou problematikou je opětovné ozáření („reiradiace“) při relapsu onemocnění. Pacienti iniciálně léčení samotnou radioterapií jsou při relapsu obvykle indikováni k chemoterapii respektive imnunochemoterapii jako k základní záchranné terapii. Přesto může být v některých případech indikováno opětovné ozáření jako samostatná léčebná metoda či v kombinaci s chemoterapií. Problémem reiradiace je tolerance okolních zdravých tkání a orgánů na záření. Rozlišují se tkáně, které nemají po radiačním poškození možnost regenerace (srdce, ledviny, močový měchýř) a tkáně, u kterých je schopnost regenerace zachována (kůže, sliznice, plíce, mícha). Při rozhodování o reiradiaci se bere v úvahu typ orgánu, který má být znovu ozářen, velikost ozařované oblasti, časový odstup od předcházející radioterapie a předchozí aplikovaná dávka. Přibližně lze říci, že u lymfomů lze ve druhé sérii radioterapie použít dávku 15–25 Gy na oblasti již dříve ozářené (16, 18).
Vybrané ozařovací techniky a objemy u lymfomů
V následujícím stručném přehledu uvádíme používané techniky u lymfomů. I když řada z nich představuje dnes již historii a v současné praxi se již nevyužívá, dovolili si autoři zařadit tuto část s ohledem na zmínění řady technik v dalším textu. Podrobněji je problematika rozvedena v příslušných učebnicích radiační onkologie (19).
IF radioterapie (Involved field irradiation = ozáření postižené lokality uzlin)
Ozáření celé lymfatické oblasti při postižení alespoň jedné skupiny uzlin v dané oblasti. V současnosti používaná metoda. Příklady IF-RT v různých lokalitách jsou na obrázcích 2–4.
Obr. 2. IF radioterapie na oblast krčních, nadklíčkových a podklíčkových uzlin oboustranně. Obrázek pochází z archivu Kliniky radiační onkologie Masarykova onkologického ústavu 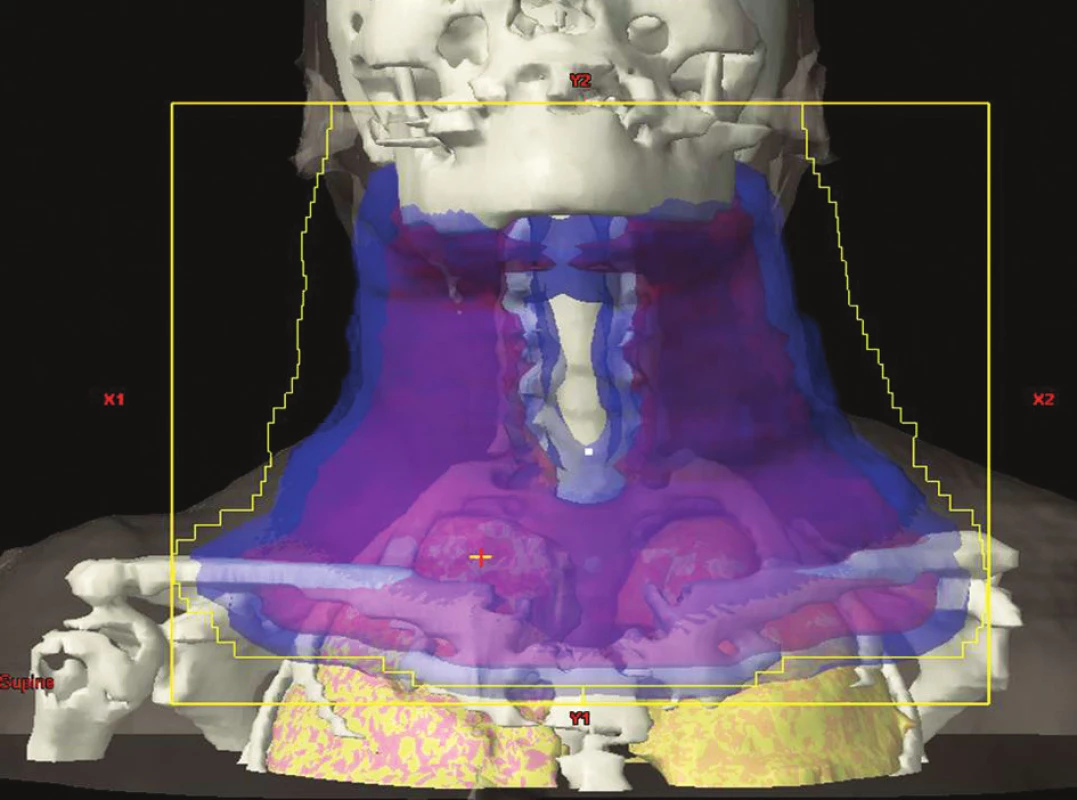
Obr. 3. IF radioterapie na oblast axilárních uzlin. Obrázek pochází z archivu Kliniky radiační onkologie Masarykova onkologického ústavu 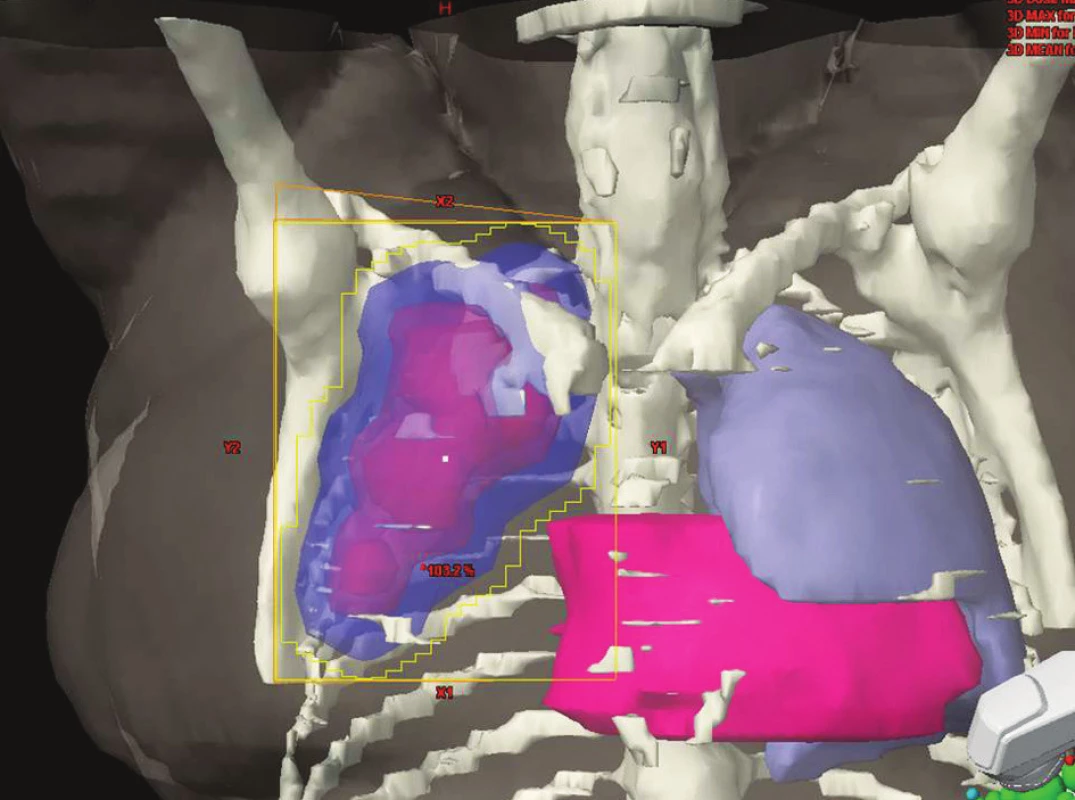
Obr. 4. IF radioterapie na oblast tříselných uzlin Obrázek pochází z archivu Kliniky radiační onkologie Masarykova onkologického ústavu 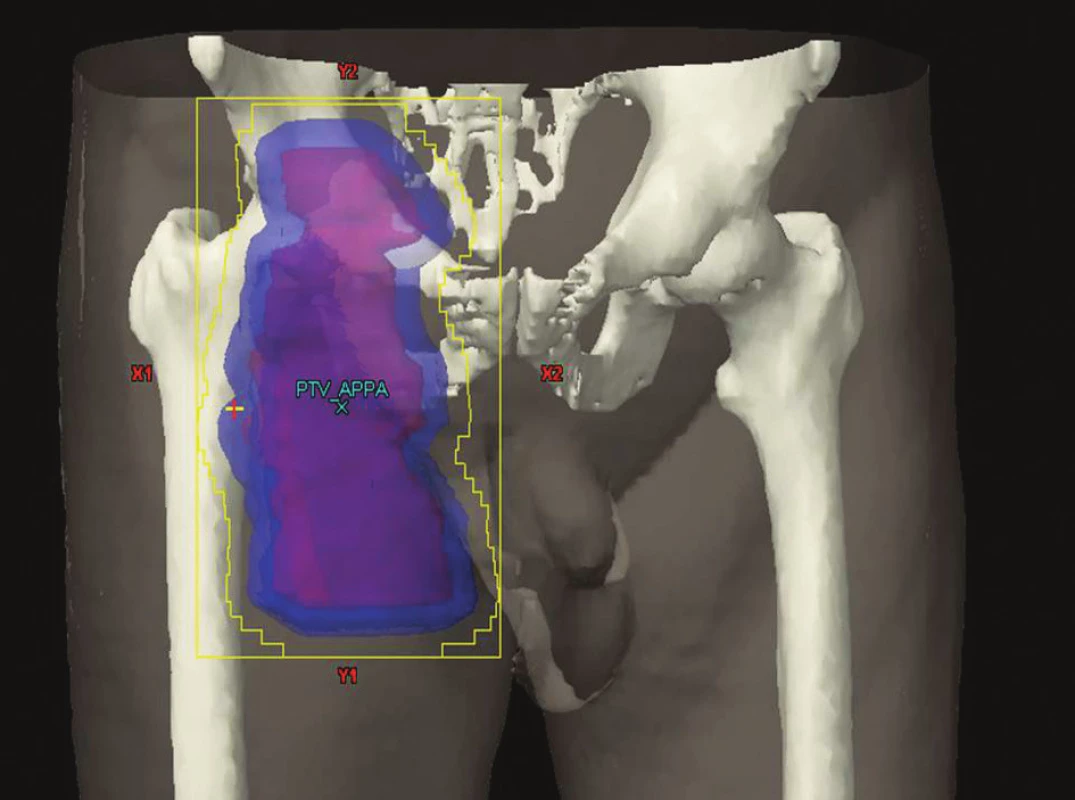
EF radioterapie (Extended field irradiation = ozáření rozšířeným polem)
Ozáření všech uzlinových skupin na jedné nebo po obou stranách bránice. EF radioterapie byla nejvíce používána do začátku devadesátých let. Do tohoto typu radioterapie patří následující techniky:
Mantle technika (= technika plášťového pole): ozáření všech uzlinových oblastí nad bránicí (uzliny mediastinální, hilové, podklíčkové, nadklíčkové, axilární, krční, subokcipitální).
Technika obráceného Y: ozáření všech uzlinových oblastí pod bránicí (uzliny paraaortální, pánevní, ingvinální, femorální a dle postižení i slezina či její hilus).
TNI (Total nodal irradiation = ozáření všech mízních uzlin): oblasti zahrnujíci techniku mantle a techniku obráceného Y.
STLI (Subtotal nodal irradiation = subtotální ozáření mízních uzlin): kombinace mantle techniky a ozáření paraaortálních uzlin se slezinou.
TLI (Total lymphoid irradiation = ozáření všech lymfatických orgánů): Zahrnuje techniku mantle, obráceného Y a ozáření sleziny. Dávky se dle literatury pohybují mezi 20 až 48 Gy (20, 21, 22).
TBI (Total body irradiation = celotělové ozáření)
Tato metoda představuje ozáření celého těla včetně kůže. Celotělovým ozářením se rozumí aplikace frakcí á 10–15 cGy 2–5x týdně až do celkové dávky 1,5 až 3,0 Gy. Uvedené dávky byly používány jako konveční léčba bez podpory kmenových buněk. Naopak obvyklá dávka podávaná v rámci myeloablativních režimů je 12 Gy aplikovaných v 6 frakcích (2x denně po dobu 3 dní), mohou však být používána i jiná frakcionační schémata včetně jednorázového ozáření dávkou 4 Gy (23, 24, 25, 26). Kritickým orgánem jsou plíce, kde je tolerována dávka 8–10 Gy.
Radioterapie folikulárního lymfomu
Následující text je zaměřen na tři různé možnosti využití radioterapie v léčbě folikulárního lymfomu:
- primární lokální kurativní radioterapie (IF-RT = involved field radiotherapy) pro pacienty časného stadia FL
- celotělová ,,low-dose“ (nízce dávkovaná) radioterapie v primární léčbě pokročilých stadií
- lokální „low-dose“ IF-RT (nízce dávkovaná IF RT) u relabujících pacientů
Primární lokální kurativní radioterapie (IF-RT = involved field radiotherapy) pro pacienty stadia I/II FL
Představu o účinnosti radioterapie u stadia I-II FL v primární léčbě si lze udělat z publikovaných studií za posledních asi 25 let, kde je celkem hodnoceno více než 1800 nemocných (tab. 1). Medián sledování v těchto studiích se pohybuje mezi 4,5 až 11 lety. Přežití pacientů bez progrese v 10 letech se pohybuje kolem 30–50 % (6, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37). Z těchto studií rovněž vyplývá, že počet pacientů relabujících po více než 10 letech je již nepatrný a je zde tendence k ,,plateau“ v křivkách doby do relapsu a celkového přežití (38, 39). Zkušenosti ukazují, že u pacientů léčených radioterapií je pravděpodobnost relapsu mezi 5–10 lety 19 %, mezi 10–15 lety 14 %, mezi 15 a 20 lety 7 % a po 20 letech už jen 4 % (40). Je tedy zřejmé, že část pacientů lze radioterapií opravdu vyléčit.
Tab. 1. Přehled nejvýznamnějších studií primární léčby radioterapií u stadií I a II folikulárního (indolentního, low-grade) lymfomu. 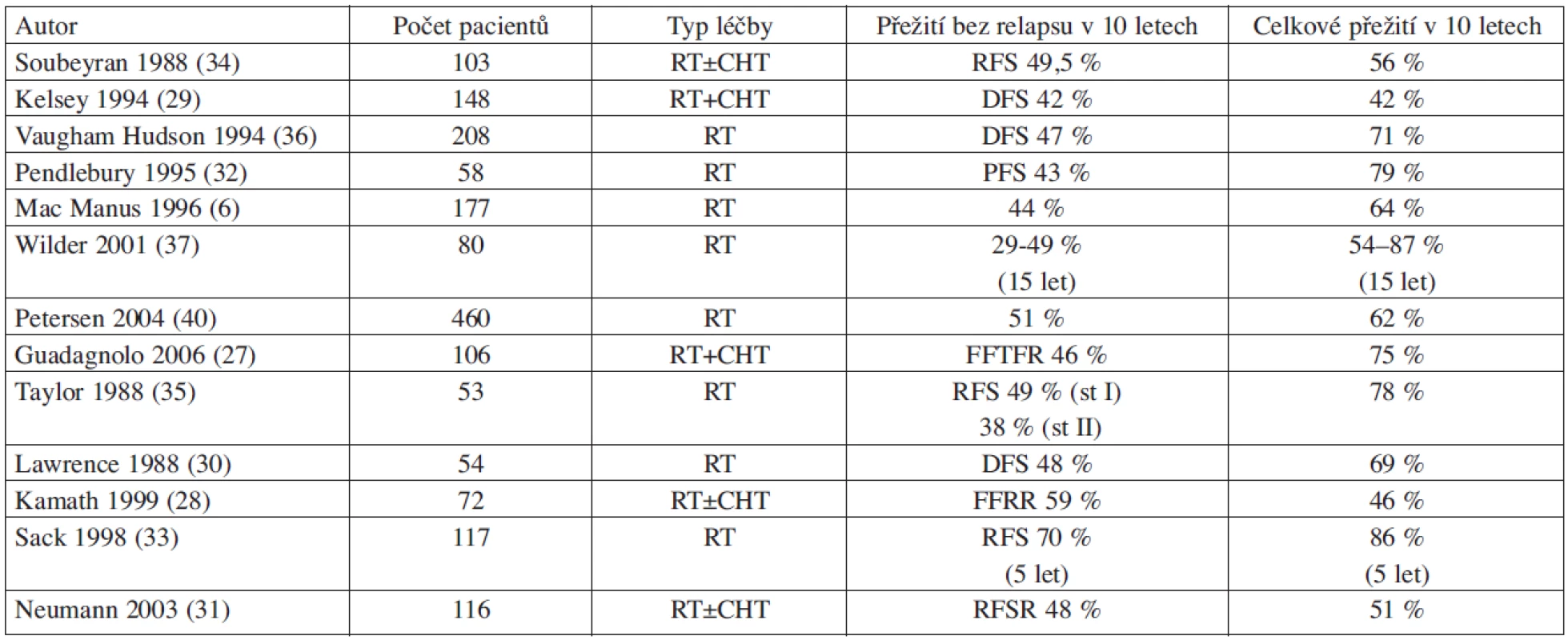
Zkratky a vysvětlivky: RT – radioterapie, CHT – chemoterapie, st – stage, RFSR – relapse free survival rate, RFS – relapse free survival, DFS – disease free survival, FFR – freedom from relapse rate, FFTFR –freedom from treatment failure rate. Pokud jde o rozsah ozařované oblasti, více extenzivní ozáření (EF = extended field) včetně ,,celolymfatického“ ozáření (TLI) prodlužuje sice do dobu do relapsu avšak bez efektu na prodloužení celkového přežití (6, 30, 41, 42). U extenzivního ozáření narůstá také značně toxicita, zejména jsou nebezpečné pozdní následky v podobě sekundárních myelodysplázií a leukemií (43, 44). Přidání chemoterapie k radioterapii obecně nevede k prodloužení celkového přežití (45, 46). Nicméně Seymour a kol. pozorovali u pacientů s velkou nádorovou masou (tumor ≥ 5 cm), vysokou proliferační aktivitou, rychlou progresí choroby anebo vysokou aktivitou LDH (laktát dehydrogenáza) lepší úroveň léčebné odpovědi a delší přežití po chemoterapii + IF-RT než po samotné IF-RT (47). Data pocházejí z doby před zavedením rituximabu do léčby FL.
Další otázkou je dávka aplikovaná na ozařovanou oblast. I když optimální dávka záření není přesně stanovena, je oprávněný předpoklad, že na dávce závislá účinnost nevzrůstá nad 30 Gy (28, 48). Jsou však i práce, které poukazují na prakticky shodnou lokální kontrolu u indolentních lymfomů již u dávek mezi 20 až 40 Gy (30, 49). Naprostá většina relapsů po radioterapii (přes 80 %) je identifikována mimo ozařované oblasti (45). Pro tuto skupinu pacientů doba do relapsu i celkové přežití nevykazuje ani po 10 letech ,,plateau“ fázi. Uvedené výsledky mohou být ovlivněny soudobými diagnostickými a stážovacími možnostmi, které pacienty s reálně pokročilým postižením nedokázaly rozeznat. Lze předpokládat, že při využití dnešních zobrazovacích metod, zejména využití PET či CT/PET v identifikaci pacientů s lokalizovaným postižením, by mohly být výsledky mnohem lepší (50).
Na základě publikovaných výsledků lze konstatovat, že stadia I/II folikulárního lymfomu bez rizikových faktorů (tzn. nízká proliferační aktivita, normální hodnoty LDH, nepřítomnost B-symptomů a nepřítomnost velké nádorové masy) lze úspěšně vyléčit IF (= involved field) radioterapií dávkou 30–40 Gy. Dávky nad 31 Gy však mohou být spojeny s významně vyšším výskytem sekundárních malignit (47). Předpokládá se, že účinná dávka u non-bulky tumoru (< 5 cm) by mohla být kolem již 20–25 Gy (28). Bohužel nejsou k dispozici žádná srovnávací data mezi uvedenými dávkami IF-RT. Rozhodnutí v závislosti na lokalitě, velikosti nádoru a stavu pacienta může být v uvedených rozmezích individuální.
Celotělové ,,low-dose“ (TBI) a celolymfatické ozáření v primární léčbě stadia III a IV
V 70. a 80. letech minulého století byla publikována řada studií s tímto typem primární léčby, zahrnujících celkem asi 600 nemocných s indolentními, převážně folikulárními (nebo ekvivalentními = centrocytickými, centroblasticko-centrocytickými) lymfomy. TBI (označováno jako „low-dose“, ve srovnání s dávkami používanými v rámci myeloablativních režimů) bylo aplikováno 2–5x týdně á 10–15 cGy/frakce až do celkové dávky 1,5 až 2,5 Gy. Úroveň celkové odpovědi (RR = response rate) se pohybovala mezi 73–100 % s dosažením kompletní remise (CR) mezi 24–96 %. Medián doby do relapsu kolísal od 1 roku do 4 let, celkové přežití bylo reportováno pouze v některých studiích a trvalo od 5 do 8 let (21, 38, 46, 51, 52). Výsledky ,,low-dose“ TBI v indikaci konvenční léčby se prakticky shodují s výsledky dosaženými po chemoterapii u pokročilých stadií folikulárního lymfomu v té době (43, 46).
Total nodal irradiation (TNI) nebo také total lymphoid irradiation (TLI) – jsou další způsoby aplikace extenzivní radioterapie. Ve studii publikované Murtha a kol. bylo takto primárně léčeno 66 pacientů s FL, podaná celková dávka se pohybovala kolem 40–48 Gy s frakcionací 2–2,2 Gy/den. Medián sledování byl 9,5 roku (0,5 až 24,3), medián celkového přežití byl 9.5 let a období bez relapsu bylo 7,1 let. Pro skupinu pacientů s limitovaným stadiem III FL (bez B-symptomů, <5 postižených lokalit, celková masa nádoru < 10cm) bylo ve 23,5 letech přežití bez relapsu (freedom from relapse) 88 % a specifické přežití dle příčiny (cause specific survival) 100 % (22). Podobné výsledky byly prezentovány i ve dvou dalších studiích s TLI (21, 53). Po TLI bylo také pozorováno dosažení molekulární remise (54). Po podání TLI/TNI byla nezávisle popsána incidence sekundárních malignit kolem 20 % s mediánem sledování 10 let (21, 22, 44).
Nízce dávkovaná („low dose“) IF-RT (Involved field-Radiotherapy) u rekurentního folikulárního lymfomu
Pozoruhodný účinek nízkých dávek záření pozorovaný ve studiích s TBI a také dlouhodobé remise u pacientů, kteří z různých důvodů nebyli s to absolvovat větší dávky záření než 5–7,5 Gy, vedlo k myšlence využít nízké dávky záření IF-RT u rekurentních především nízce maligních lymfomů. Jako první se o systematickou aplikaci „limited-field“ dávkou 2x2 Gy pokusil tým radioterapeutů z Institutu Gustav Roussy (55). Povzbudivé výsledky, kterých bylo dosaženo s tímto typem léčby, byly inspirací pro další pracoviště. Dosud bylo takto léčeno přes 200 nemocných v 5 nezávislých studiích. Celková odpověď (RR = response rate) se po aplikaci nízkých dávek záření pohybovala mezi 75 až 94 % s podílem 36–84 % kompletních odpovědí definovaných jako lokální kontrola nemoci. Medián trvání odpovědi byl v rozmezí 1,5 až 3,5 roku (55, 56, 57, 58, 59, 60; tab. 2). Ozáření IF 4 Gy je možné úspěšně aplikovat i opakovaně, přičemž pozorovaná léčebná odpověď byla srovnatelná nebo lepší nežli při prvním podání (59). Největší studie s IF-RT 2 x 2 Gy zahrnující výsledky od 109 nemocných, dokládá nejen vysokou účinnost a nepatrnou toxicitu, ale také pozoruhodně lepší efekt, než ten, který byl pozorován po podání poslední předcházející chemoterapie (57).
Tab. 2. Přehled studií s low-dose (2x2 Gy) involved field radioterapií (IF-RT) u rekurentních indolentních/folikulárních lymfomů. 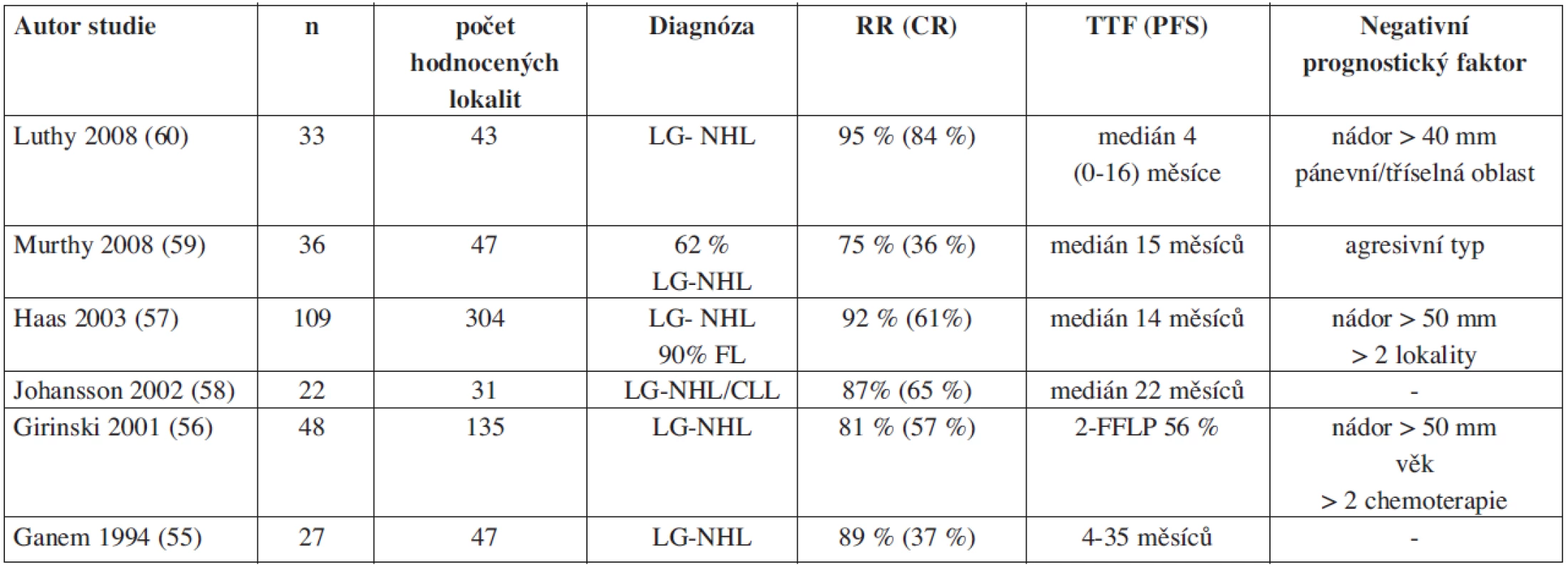
Zkratky a vysvětlivky: LG-NHL – low grade- NonHodgkin lymphoma, NHL - NonHodgkin lymphoma, CLL – chronic lymphoid leukaemia, FL – follicular lymphoma, RR – response rate (úroveň léčebné odpovědi), CR – complete remission (kompletní remise), TTF – time to failure (doba do selhání léčby), PFS – progression free survival (doba do progrese), FFLP – freedom from local progression. Biologický účinek if-rt 2 x 2 Gy u folikulárního lymfomu
Folikulární lymfom je charakteristický pomalým růstem, o němž se všeobecně předpokládá, že se děje kumulací buněk rezistentních k apoptóze. Této úvaze odpovídá i obecně nízká proliferační aktivita buněk FL a vysoký výskyt translokace t(14;18) s následnou zvýšenou expresí antiapoptotického proteinu bcl-2 (61, 62). Pokud hledáme vysvětlení pro rychlý účinek radioterapie u FL, který lze pozorovat jako ústup lymfadenopatie již v průběhu několika prvních dávek záření, musí efekt radiace souviset s indukcí apoptózy (3, 63). Tento předpoklad potvrdila studie, kde byla apoptóza buněk v postižených uzlinách měřena scintigraficky a cytologicky před a po ozáření 2 x 2 Gy IF-RT a kde míra apoptózy pozitivně korelovala s klinickou odpovědí (64).
Molekulární podstata efektu nízkých dávek radioterapie byla analyzována srovnáním profilů genové exprese biopsií uzlin před a po ozáření 2 x 2 Gy. Shodně a výrazně byla u všech párových ozářených vzorků zvýšena především exprese genů souvisejících s p53, přičemž byly aktivovány geny vnitřní i vnější cesty apoptózy. Dále byla přítomna zvýšená exprese genů spojených s aktivací makrofágů a Th1-zánětlivé odpovědi. Imunohistochemická analýza ozářených vzorků potvrdila specifickou aktivaci nebo diferenciaci makrofágů apoptotickými buňkami (65). Je zřejmé, že efekt radioterapie, alespoň v případě nízkých dávek, se děje nejen na úrovni vlastních nádorových buněk, ale také na buňkách mikroprostředí.
Rituximab a radioterapie
Rituximab (R) je první komerčně dostupnou monoklonální protilátkou určenou k léčbě lymfomů. Jedná se o chimérický anti-CD20 imunoglobulin (IgG1) s myší komponentou ve variabilní oblasti. Mechanismus účinku rituximabu je mnohovrstevný a není v některých detailech ještě zcela objasněn. V současné době se za hlavní nositele účinnosti rituximabu pokládají v zásadě tři mechanismy: 1. komplementem zprostředkovaná cytolýza, 2. na protilátkách závislá cytotoxicita a 3. indukce apoptózy (66, 67). Rituximab je účinný v monoterapii, kde navodí léčebnou odpověď u zhruba 45–60 % pacientů s indolentním NHL (68, 69). Jeho hlavní indikací je však dnes kombinace s chemoterapií (70, 71, 72), neboť s řadou cytostatických látek vykazuje synergismus (73).
Méně je však známo o možném spolupůsobení radioterapie a rituximabu. Dle výsledků ojedinělých prací in vitro na liniích t(14;18)-pozitivních buněk folikulárního lymfomu (RL, RAJI) vede aplikace rituximabu ke zvýšení radiosenzitivity buněčných linií a potenciaci apoptózy indukované radiací (74, 75). Klinická data o účincích současné aplikace radioterapie a rituximabu nejsou k dispozici, lze však předpokládat aditivní až synergistický účinek i v klinické praxi.
Nové perspektivy
Vzhledem k významnému efektu rituximabu zejména v kombinované systémové léčbě klinických stadií III a IV folikulárního lymfomu, bude jistě velmi zajímavé zjistit, jaký je efekt rituximabu respektive rituximabu s IF radioterapií u pacientů s lokalizovaným postižením v primární léčbě. Popsaná účinnost nízkých dávek záření (2x2 Gy) a synergismus radiace a rituximabu in vitro inspirují k podání této kombinace jak u relabujících nemocných, tak i u pacientů s lokalizovanou chorobou v první linii. Dosud se však žádnou studii s podobným designem nepodařilo autorům tohoto přehledu v literatuře najít. Zajímavá je také úvaha o stanovení optimální dávky tzv. low-dose radioterapie, neboť dávka 2x2 Gy byla stanovena víceméně empiricky a jak ukazují výše uvedené výsledky, účinek opakovaného podání 2 x 2 Gy se jeví ještě intenzivnější.
Přehled současných indikací radioterapie v léčbě folikulárního lymfomu
Radioterapie v primární léčbě
- IF-RT 25–35 Gy pro stadium I/II bez rizikových faktorů (standardní indikace)
- IF-RT 25–35 Gy + 4–6x RCHOP/RCOP pro stadium I/II s rizikovými faktory (bulky tumor, LDH > norma, B-symptomy, vysoká proliferační aktivita, eventuálně FLIPI ≥ 2)
- IF-RT 25–35 Gy jako terapie rezidua po systémové imunochemoterapii (indikace je individuální)
Radioterapie v léčbě relapsu
- IF-RT 25–35 Gy v léčbě lokalizovaného relapsu +/ - imunochemoterapii, dále jako doplňující léčba na bulky infiltráty u systémového relapsu (indikace je individuální).
- IF-RT 4 Gy (2x2) zejména u non-bulky pacientů s lokalizovaným relapsem, u značně předléčených nemocných nebo nemocných neschopných agresivnější terapie (indikace je individuální).
- TBI (různé dávky) v rámci přípravných myeloablativních režimů i režimů s redukovanou intenzitou (indikace je variabilní).
Doručeno do redakce: 8. 4. 2010
Přijato po recenzi: 6. 10. 2010
MUDr. Andrea Janíková, Ph.D.
Interní hematoonkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail: ajanikova@fnbrno.cz
Zdroje
1. Anderson JR, Armitage JO, Weisenburger DD. Epidemiology of the non-Hodgkinęs lymphomas: distributions of the major subtypes digger by geographic locations. Non-Hodgkinęs Lymphoma Classification Project. Ann Oncol 1998; 9 : 717-720.
2. ÚZIS ČR, NOR ČR 2009 http://www.linkos.cz/odbornici/onkologie/nor.php
3. Dubray B, Breton Ch, Delic J, et al. In vitro radiation apoptosis and early response to low-dose radiotherapy in non-Hodgkinęs lymphomas. Radiother Oncol 1998; 46 : 185-191.
4. Delic J, Magdelenat H, Barbaroux C, et al. In vivo induction of apoptosis in human lymphocytes by therapeutic fractionated total body irradiation. Br J Radiol 1995 : 68 : 997-1003
5. Joiner MC, Lambin P, Malaise EP, et al. Hypersensitivity to very-low single radiation doses. Mutat Res 1996; 358 : 171-183.
6. Macmanus MP, Hoppe RT. Is radiotherapy curative for stage I and II low-grade follicular lymphoma? Results of a long-term follow-up study of patients treated at Stanford University. J Clin Oncol 1996; 14 : 1282-90.
7. Meerwaldt JH, Carde P, Burgers JM, et al. Low-dose total body irradiation versus combination chemotherapy for lymphomas with follicular growth pattern. Int J Radit Oncol Biol Phys 1991; 21 : 1167-1172.
8. Lybeert ML, Meerwaldt JH, Deneve W. Long-term results of low dose body irradiation for advanced non-Hodgkin lymphoma. Int J Radiat Oncol Biol Phys 1987; 13 : 1167-1172.
9. Jacobs P, Kong HS. A randomized prospective comparison of chemotherapy to total body irradiation as initial treatment for the indolent lymphoproliferative diseases. Blood 1987; 69 : 1642-1646.
10. Emmanouilides CE, Witzig TE, Gordon LI, et al. Treatment with yttrium 90 ibritumomab tiuxetan at early relapse is safe and effective in patients with previously treated B-cell non-Hodgkinęs lymphoma. Leukemia Lymph 2006; 47 : 629-636.
11. Goff L, Summers K, Iqbal S, et al. Quantitative PCR analysis PCR analysis for Bcl-2/IgH in a phase III study of Ytrium Tiuxetan as consolidation of first remission in patiens with follicular lymphoma. J Clin Oncol 2009; 27 : 6094-6100.
12. Witzig TE, Gordon LI, Cabanillas F, et al. Randomized controlled trial of ytrium-90-labeled ibritumomab tiuxetan radioimmunotherapy versus rituximab immunotherapy for patients with relapsed or refractory low-grade, follicular, or transformed B-cell non-Hodgkinęs lymphoma. J Clin Oncol 2003; 20 : 2453-2463.
13. Witzig TE, Flinn IW, Gordon LI, et al. Treatment with ibritumomab tiuxetan radioimmunotherapy in patients with rituximab-refractory follicular non-Hodgkinęs lymphoma. J Clin Oncol 2002; 20 : 3262-3269.
14. Galteland E, Sivertsen EA, Svendsrud DH, et al. Translocation t(14;18) and gain of chromosome 18/Bcl2; effects on BCL-2 expression and apoptosis in B-cell non-Hodgkinęs lymphomas. Leukemia 2005; 19 : 2313-2323.
15. ICRU: Prescribing, recording, and reporting photon beam therapy. In ICRU report. Volume 50. Bethesda: International Commission on Radiation Units and Measurements; 1993.
16. Hynková L, Šlampa P, et al. Radiační onkologie – učební texty, MOÚ, Brno, 2009, 242 s.
17. Perez CA, Brady LW, et al. Principles and practice of radiation oncology. 5th ed. Philadelphia: Lippincot Wiliams and Wilkins, 2008, 2106 s.
18. Gosselin M, Podgorsak EB, Evans MD, et al. A technique using parallel-opposed high energy electron beams for reirradiation of tumors near the spinal cord. Int J Radiat Oncol Biol Phys 1993; 27 : 1207-1214.
19. Šlampa P, Petera J, et al. Radiační onkologie. Galén-Karolinum, Praha, 2007, 457 s.
20. Ha CS, Tucker SL, Blanco AI, et al. Hematologic recovery after central lymphatic irradiation for patiens with stage I-III follicular lymphoma. Cancer 2001; 92 : 1074-1079.
21. Jacobs JP, Murray KJ, Schultz CJ, et al. Central lymphatic irradiation for stage III nodular malignant lymphoma: Long-term results. J Clin Oncol 1993; 11 : 233-238.
22. Murtha AD, Knox SJ, Hoppe RT, et al. Long-term follow-up of patients with stage III follicular lymphoma treated with primary radiotherapy at Stanford University. Int J Rad Oncol Biol Phys 2001; 49 : 3-15.
23. Adkins DR, DiPersio F. Total body irradiation before an allogeneic stem cell transplantation: is there a magic dose? Curr Opin Hematol 2008; 15 : 555-560.
24. Bieri S, Held C, Chapuis B, et al. Total body irradiation before allogeneic bone marrow transplantation: is more dose better? Int J Radiat Oncol Biol Phys 2001; 49 : 1071-1077.
25. Demirer T, Buckner CD, Appelbaum Fr, et al. Busulfan, cyclophosphamide and fractioned total body irradiation for allogeneic marrow transplantation in advanced acute and chronic myelogenous leukemia: phase I dose escalation of busulfan based on targeted plasma levels. Bone Marrow Transplant 1996; 17 : 341-346.
26. Geller RB, Devine SM, OęToole K, et al. Allogeneic bone marrow transplantation with matched unrelated donors for patients with hematologic malignancies using a preparative regimen of high-dose cyclophosphamide ad fractionated total body irradiation. Bone Marrow Transplant 1997; 3 : 219-225.
27. Guadagnolo BA, Li S, Neuberg D, et al. Long-term outcome and mortality trends in early stage, grade 1-2 follicular lymphoma treated with radiation therapy. Int Radiat Oncol Biol Phys 2006; 64 : 928-934.
28. Kamath SS, Marcus RB, Lunch JW, et al. The impact of radiotherapy dose and other treatment-related and clinical factors on in-field control in stage I and II non-hodgkinęs lymphoma. Int J Rad Oncol Biol Phys 1999; 44 : 563-8.
29. Kelsey SM, Newland AC, Hudson GV, et al. A British National Lymphoma Investigation randomised trial of single agent chlorambucil plus radiotherapy versus radiotherapy alone in low grade, localised non-Hodgkinęs lymphoma. J Clin Oncol 1994; 11 : 19-25.
30. Lawrence TS, Urba WJ, Steinberg SM, et al. Retrospective analysis of stage I and II indolent lymphomas at the National Cancer Institute. Int J Rad Oncol Biol Phys 1988; 14 : 417-24
31. Neumann H, Blanck H, Koch R, et al. Follicle center lymphoma: treatment results for stage I and II. Strahlenther Onkol 2003; 179 : 840-846.
32. Pendlebury S, el Alwadi M, Ashley S, et al. Radiotherapy results in early stage low grade nodal non-Hodgkinęs lymphoma. Radiother Oncol 1995; 167-71.
33. Sack H, Hoederath A, Stuschke M, et al. Radiotherapy of follicle center lymphoma. Results of a German multicenter and prospective study. Members of the Study Group „NHL – early stages“. Strahlenther Onkol 1998; 174 : 178-185.
34. Soubeyran P, Eghbali H, Bonichon F, et al. Localized follicular lymphomas: prognosis and surfoval of stages I and II in a retrospective series of 103 patients. Radiother Oncol 1988; 13 : 91-8.
35. Taylor RE, Allan SG, McIntyre MA, et al. Low grade stage I and II non-Hodgkinęs lymphoma: results of treatment and relapse pattern following therapy. Clin Radiol 1988; 39 : 287-290.
36. Vaughan Hudson B, vaughan Hudson G, MacLennan KA, et al. Clinical stage1 non-Hodgkinęs lymphoma: long-term follow-up study of patiens treated at Stanford University. J Clin Oncol 1996; 14 : 1282-1290.
37. Wilder RB, Jones D, Tucker SL, et al. Long-term results with radiotherapy for Stage I-II follicular lymphomas. Int J Radiat Oncol Biol Phys 2001; 51 : 1219-1227.
38. Haas RLM. Low dose radiotherapy in indolent lymphomas, enough is enough. Hematol Oncol 2009; 27 : 71-81.
39. Tsang RW, Gospodarowicz MK. Low-grade Non-Hodgkinęs lymphomas. Semin Radiat Oncol 2007; 17 : 198-205.
40. Petersen PM, Gospodarowicz M, Tsang R, et al. Long-term outcome in stage I and II follicular lymphoma following treatment with involved field radiation therapy alone. J Clin Oncol 2004; 22 : 563.
41. Frank C, Zierhut D, Schultz-Ertner D, et al. Centroblastic-centrocytic non-Hodgkinęs lymphoma stage I-III: patterns of failure following radiotherapy. Strahlenther Onkol 2001; 177 : 597-603.
42. Paryani SB, Hoppe RT, Cox RS, et al. Analysis of non-Hodgkinęs lymphomas with nodular and favorable histology, stages I and II. Cancer 1983; 52 : 2300-2307.
43. Johnson RE, Canellos GP, Young RC, et al. Chemotherapy (cyclophosphamide, vincristine, and prednisone) versus radiotherapy (total body irradiation) for stage III-IV poorly differentiated lymphocytic lymphoma. Cancer Treat Rep 1978; 62 : 321-325.
44. Travis LB, Weeks J, Curtis RE et al. Leukemia following low-dose total body irradiation and chemotherapy for non-Hodgkinęs lymphoma. J Clin Oncol 1996; 14 : 565-571.
45. Gustavsson A, Osterman B, Cavallin-Stahl E. A systematic overview of radiation therapy effects in Non-Hodgkinęs lymphoma. Acta Oncol 2003; 42 : 605-19.
46. Hoppe RT, Kushlan P, Kaplan HS, et al. The treatment of advanced stage of favorable histology non-Hodgkinęs lymphoma: A preliminary report of a randomized trial comparing single agent chemotherapy, combination chemotherapy, and whole body irradiation. Blood 1981; 58 : 592-598.
47. Seymour JF, Pro B, Fuller LM, et al. Long-term follow-up of a prospective study of combined modality therapy for stage I-II indolent non-Hodgkinęs lymphoma. J Clin Oncol 2003; 21 : 2115-2122.
48. Spry NA, Lamb DS, Vaughan Hudson G, et al. Localized grade I non-Hodgkinęs lymphoma: results of treatment with radiotherapy alone in 88 patients. Clin Oncol 1989; 1 : 33-38.
49. Sutcliffe SB, Gospodarowicz MK, Bush RS, et al. Role of radiation therapy in localized non-Hodgkinęs lymphoma. Radiother Oncol 1985; 4 : 211-223.
50. Janíková A, Bolcak K, Pavlik T, Mayer J, Kral Z. Value of [18F] Flurodeoxyglucose positron emission tomography in the management of follicular lymphoma: The end of dilemma? Clin Lymph Myeloma 2008; 8 (5): 287-293.
51. Lybeert ML, Meerwaldt JH, Deneve W. Long-term results of low dose total body irradiation for advanced non-Hodgkinęs lymphoma. Int J Radiat Oncol Biol Phys 1987; 13 : 1167-1172.
52. Meerwaldt JH, Carde P, Burgers JM, et al. Low-dose total body irradiation versus combination chemotherapy for lymphomas with follicular growth pattern. Int J Radiat Oncol Biol Phys 1991; 21 : 1167-1172.
53. De Los Santos JF, Mendenhall NP, Lynch JWJ. Is comprehensive lymphatic irradiation for low-grade non-Hodgkinęs lymphoma curative therapy? Long-term experience at a single institution. Int J Radiat Oncol Biol Phys 1997; 38 : 3-8.
54. Ha CS, Cabanillas F, Lee MS, et al. Serial determination of the bcl-2 gene in the bone marrow and peripheral blood after central lymphatic irradiation for stages I-III follicular lymphoma: a preliminary report. Clin Cancer Res 1997; 3 : 215-219.
55. Ganem G, Lambin P, Socie G, et al. Potential role for low-dose limited-field radiation therapy (2 x 2 Grays) in advanced low-grade NonHodgkinęs lymphomas. Hematol Oncol 1994; 12 : 1-8.
56. Girinski T, Guillot-Vals D, Koscielny S, et al. A high and sustained response rate in refractory or relapsing low-grade lymphoma masses after low-dose radiation: analysis of predictive parameters of response to treatment. Int J Rad Oncol Biol Phys 2001; 51 : 148-155.
57. Haas RLM, Poortmans P, de Jong D, et al. High response rates and lasting remissions after low-dose involved field radiotherapy in indolent lymphomas. J Clin Oncol 2003; 21 : 2474-2480.
58. Johannsson J, Specht L, Mejer J, et al. Phase II study of palliative low-dose local radiotherapy in disseminated indolent non-Hodgkinęs lymphoma and chronic lymphocytic leukemia. Int J Rad Oncol Biol Phys 2002; 54 : 1466-1470
59. Murthy V, Thomas K, Foo K, et al. Efficacy of palliative low-dose involved field radiation therapy in advanced lymphoma: a phase II study. Clin Lymph Myeloma 2008; 8 : 241-245.
60. Luthy SK, Ng AK, Silver B, et al. Response to low-dose involved field radiotherpay in patients with non-Hodgkinęs lymphoma. Ann Oncol 2008; 19 : 2043-2047.
61. Cleary ML, Galili N, Sklar J. Detection of a second t(14;18) breakpoint cluster region in human follicular lymphomas. J Exp Med 1986; 164 : 315-320.
62. Tsujimoto Y, Croce CM. Analysis of the structure, transcripts, and protein products of bcl-2, the gene involved in human follicular lymphoma. Proc Natl Acad Sci USA 1986; 83 : 5214-5218.
63. Dubray B, Breton C, Delic J, et al. In vitro radiation-induced apoptosis and tumor response to radiotherapy: a prospective study in patiens with non-Hodgkin lymphomas treated by low-dose irradiation. Int J Radiat Biol 1997; 72 : 759-760.
64. Haas RLM, de Jong D, Valdes Olmos RA, et al. In vivo imaging of radiation-induced apoptosis in follicular lymphoma patiens. Int J Rad Oncol Biol Phys 2004; 59 : 782-787.
65. Knoops L, Haas R, de Kemp S et al. In vivo p53 response and immune reaction underlie higly effective low-dose radiotherapy in follicular lymphoma. Blood 2007; 110 : 1116-1122.
66. Kennedy AD, Solga MD, Schuman TA, et al. An anti-C3b(i) mAb enhances complement activation, C3b(i) deposition, and killing of CD20+ cells by rituximab. Blood 2003; 101 : 1071-1079.
67. Shan D, Ledbetter JA, Press OW. Apoptosis of malignant human B cells by ligation of CD20 with monoclonal antibodies. Blood 1988; 91 : 1644-1652.
68. McLaughlin P, Grillo-Lopez AJ, Link BK, et al. Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four-dose treatment program. J Clin Oncol 1998; 16 : 2825-2833.
69. Colombat P, Salles G, Brousse N, et al. Rituximab (anti-CD20 monoclonal antibody) as single first-line therapy for patients with follicular lymphoma with a low tumor burden: clinical and molecular evaluation. Blood 2001; 97 : 101-106.
70. Fortspointer R, Dreyling M, Repp R, et al. The addition of rituximab to a combination of fludarabine, cyclophosphamide, mitoxantrone (FCM) significantly increases the response rate and prolongs survival as compared with FCM alone in patients with relapsed and refractory follicular and mantle cell lymphomas: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 2004; 104 : 3064-3071.
71. Hiddemann W, Kneba M, Dreyling M, et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine and prednisone (CHOP) significantly improves the outcome of patients with advanced stage follicular lymphoma as compared to CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group (GLSG). Blood 2005; 106 : 3725-3732.
72. Marcus R, Imrie K, Belch A, et al. CVP chemotherapy plus rituximab compared with CVP as first-line treatment for advanced follicular lymphoma. Blood 2005; 105 : 1417-1423.
73. DiGaetano N, Xiao Y, Erba E, et al. Synergism between fludarabine and rituximab revealed in a follicular lymphoma cell line resistant to the cytotoxic activity of either drug alone. Br J Haematol 2001; 114 : 800-809.
74. Skvortsova I, Popper BA, Skvortsov S, et al. Pretreatment with rituximab enhances radiosensitivity of non-Hodgkinęs lymphoma cells. J Radiat Res 2005; 46 : 241-248.
75. Skvortsova I, Skvortsov S, Popper BA, et al. Rituximab enhances radiation-triggered apoptosis in non-Hodgkinęs lymphoma cells via caspase-dependent and independent mechanisms. J Radiat Res 2006; 47 : 183-196.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2010 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Súčasná klasifikácia, diagnostika a prognóza primárnych monoklonových gamapatií (paraproteinémií)
- Výsledky liečby pacientov v chronickej fáze chronickej myelocytovej leukémie na HOK v Olomouci v rokoch 2000-2009: prognostický význam Sokalovho indexu a ELN kritérií
-
Radioterapie u folikulárního lymfomu.
Stará historie v nové perspektivě? - Proteomická analýza solubilních proteinů důležitých u dětské leukemie
- Vliv dárcovství krve na zásoby železa u dárců: porovnání dvojité erytrocytaferézy a dárcovství plné krve
- Výběr z tisku a zpráv o knihách
- Česká asociace zdravotních laborantů - co je a proč vznikla
- Zpráva o XX. konferenci dětských hematologů a onkologů České a Slovenské republiky konané ve dnech 8.–10. října 2010 v Praze
-
Vybrané odborné akce v roce 2011
ČESKÁ REPUBLIKA - OBSAH ROČNÍKU 16/2010 Transfuze a hematologie dnes
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Súčasná klasifikácia, diagnostika a prognóza primárnych monoklonových gamapatií (paraproteinémií)
- Vliv dárcovství krve na zásoby železa u dárců: porovnání dvojité erytrocytaferézy a dárcovství plné krve
- Česká asociace zdravotních laborantů - co je a proč vznikla
-
Radioterapie u folikulárního lymfomu.
Stará historie v nové perspektivě?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



