-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVliv vysokodávkované chemoterapie s podporou autologní transplantace kmenových buněk na proliferační a apoptotické vlastnosti plazmatických buněk u mnohočetného myelomu
The effect of high-dosed chemotherapy with support of autologous stem cell transplantation on proliferative and apoptotic characteristics of plasma cells
In a cohort of 91 patients with multiple myeloma according to International Myeloma Working Group criteria, treated in 1996-2008 with high-dosed chemotherapy with support of autologous stem cell transplantation (HD-ASCT) and during progression/relapse also with novel biological drugs (thalidomide, bortezomib, lenalidomide), we compared the prognostic significance of the evaluation of kinetic properties of plasma cells. Both the parameters, i.e. proliferative and apoptotic index, were measured at the time of diagnosis and after the transplantation.Proliferative characteristics of myeloma plasmocytes were assessed with the use of propidium-iodide index (PC-PI), for the evaluation of apoptotic cells we used flow cytometry with the help of annexin-V FITC index (PC-AI). Myeloma plasmocytes were identified using the expression of CD138. We found that after HD-ASCT there was a statistically significant decrease in PC-PI with respect to initial measurements (average 2.5 vs 2.1, median (M) 2.4 vs. 2.1, p < 0.001) and an increase in PC-AI (average 5.4 vs 6.9, M – 4.8 vs. 5.6, p < 0,004) together with a decrease of summary index of proliferation and apoptosis (PC-PI/PC-AI) from the average value 0.69 and M 0.50 to 0.37 and 0.40 respectively, p < 0.001. It was revealed that the same results were within the assessment of PC-PI and summary PC-PI/PC-AI index in MM stages 1-3 according to Durie-Salmon (D-S) and International staging system (ISS). In the case of PC-AI there was a statistically significant increase in stage 3 patients and substage A according to D-S and stage 1 according to ISS. With the help of mathematical Kaplan-Meier model and log rank test we found that the median of overall survival (OS) from the time of diagnosis was in the whole cohort 85 months and from the date of HD-ASCT 74 months. Within the evaluation of all three indices (i.e. PC-PI, PC-AI and PC-PI/PC-AI) measured both at the time of diagnosis and after the HD-ASCT there was no relationship to OS. The presented analysis indicates that the use of HD-ASCT and novel biological agents lead to the loss of prognostic potential of both PC-PI and PC-AI indices, which was previously described in conventional therapy patients.
Key words:
multiple myeloma, propidium-iodide index, annexin-V index, proliferation, apoptosis, clinical stage, autologous stem cell transplantation, prognosis
Autoři: V. Ščudla 1; M. Ordeltová 2; E. Faber 3; J. Minařík 1; T. Pika 1; J. Bačovský 1; N. Rytiková 4; K. Indrák 3; L. Dušek 5
Působiště autorů: III. interní klinika Lékařské fakulty Univerzity Palackého a Fakultní nemocnice, Olomouc, 2Oddělení klinické imunologie Lékařské fakulty Univerzity Palackého a Fakultní nemocnice, Olomouc, 3Hematoonkologická klinika Lékařské fakulty Univerzity Palackého a 1
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 2, p. 92-100.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
V souboru 91 nemocných splňujících International myeloma working group kritéria mnohočetného myelomu léčeném v rozmezí 1996–2008 vysokodávkovanou chemoterapií s podporou autologní transplantace kmenových buněk (VDT/ATKB) a v případě relapsu či progrese nemoci i novými biologickými působky (thalidomid, bortezomib a lenalidomid) byl porovnán prognostický význam vyšetření kinetických vlastností plazmatických buněk vyšetřených v období diagnózy nemoci a po absolvování transplantační léčby. Proliferační vlastnosti plazmocytů byly hodnoceny s pomocí propidium-jodidového (PC-PI) indexu, k rozpoznání plazmocytů vstupujících do apoptózy byla použita průtokově cytometrická metoda s použitím annexin V FITC indexu (PC-AI) s identifikací plazmocytů s pomocí průkazu exprese CD138. Bylo zjištěno, že po VDT/ATKB dochází oproti stavu při diagnóze ke statisticky významnému poklesu PC-PI proliferačního indexu (geom. průměr 2,5, medián (M) 2,4 vs. 2,1 a 2,1, p < 0,001), k vzestupu PC-AI apoptotického indexu (geom. průměr 5,4, M-4,8 vs. 6,9 a 5,6, p < 0,004) a k poklesu sumárního poměrného indexu proliferace a apoptózy (PC-PI/AI) z hodnoty geom. průměru 0,69 a M-0,50 na 0,37 a 0,40, p < 0,001. Bylo zjištěno, že stejný závěr platil v případě hodnocení proliferačního PC-PI indexu i sumárního indexu PC-PI/AI pro stadia 1–3 MM vyhodnocené s pomocí stážovacího systému Durieho-Salmona (D-S) a dle International staging system (ISS). V případě apoptotického PC-AI indexu bylo zaznamenáno statisticky významné zvýšení u nemocných stadia 3 a podstadia A dle D-S a stadia 1 dle ISS. S pomocí matematického modelu dle Kaplan-Meiera a log rank testu bylo zjištěno, že medián celkového přežití (OS) od diagnózy byl v hodnoceném souboru 85 měsíců a od data VDT/ATKB 74 měsíců. V případě všech tří vyhodnocených indexů (PC-PI, PC-AI a PC-PI/AI), vyšetřených při diagnóze MM i po absolvování VDT/ATKB nebyl prokázán vztah k OS. Z analýzy vyplývá, že začlenění VDT/ATKB a nových biologických působků vedlo k vymizení prognostického potenciálu proliferačního (PC-PI) i apoptotického indexu (PC-AI), prokázaného v období konvenční chemoterapie.
Klíčová slova:
mnohočetný myelom, propidium-jodidový index, annexin V index, proliferace, apoptóza, klinické stadium, autologní transplantace kmenových buněk, prognóza.Úvod
Mnohočetný myelom (MM) je zhoubné klonální onemocnění krvetvorby, vyznačující se akumulací neoplasticky transformovaných plazmocytů v kostní dřeni (KD), nadaných různě intenzivní proliferační aktivitou a zvýšenou rezistencí k apoptóze (1). Porucha regulace kinetiky myelomových plazmocytů s omezenou pohotovostí k apoptóze je považována za jeden z klíčových mechanismů, uplatňujících se v procesu neoplastické transformace a nádorové expanze (2). Konečná masa nádorové tkáně, klinické projevy i prognóza MM jsou výsledkem poměru úrovně proliferace a apoptózy myelomových buněk (2, 3, 4, 5). Zatímco pro význam hodnocení proliferačních vlastností plazmocytů v klinické praxi bylo sneseno v období konvenční chemoterapie mnoho jednoznačně přijatých dokladů (2, 6, 7, 8, 9), v případě hodnocení významu stupně apoptózy plazmatických buněk z hlediska klinické praxe tomu tak doposud není, neboť většina prací, věnovaných této problematice vychází z poměrů in vitro nebo z experimentálních studií na zvířecích modelech (4, 10, 11). V našich předchozích publikacích, ale i v některých pracích světového písemnictví byl potvrzen přínos vyšetřování propidium-jodidového proliferačního indexu (PC-PI) a annexin V apoptotického indexu (PC-AI) vyšetřených s pomocí průtokové cytometrie pro odlišení MM od MGNV (monoklonální gamapatie nejistého významu), pro hodnocení stability, aktivity a stupně pokročilosti i prognózy MM v období konvenční chemoterapie (2, 4, 5, 8, 9, 10, 12, 13).
Náplní předloženého sdělení je zjištění, zdali v případě použití intenzivní vysokodávkované chemoterapie s podporou autologní transplantace kmenových buněk (VDT/ATKB) nedochází obdobně jako u mnoha klasických prognostických faktorů (PF) k oslabení, případně i k vymizení prognostického potenciálu stanovení PC-PI a PC-AI plazmocytů, případně jejich vzájemného poměru (PC-PI/PA index) a zjištění, zdali je prognosticky významnější vyšetření obou indexů při diagnóze před zahájením indukční léčby, nebo v 1–2měsíčním odstupu od VDT/ATKB, tj. v reziduální populaci plazmatických buněk. Součástí analýzy bylo i porovnání obou kinetických indexů plazmatických buněk při diagnóze MM a po VDT/ATKB v jednotlivých stadiích pokročilosti nemoci (stadium 1–3), vyhodnocených podle Durieho-Salmona (D-S) i podle International staging system (ISS) (14, 15, 16).
Soubor nemocných a použité metody
Analyzovanou sestavu 91 nemocných, vyšetřených v rozpětí 1997–2007 tvořili nemocní s MM splňující International myeloma working group (IMWG) a Southwest oncology group (SWOG) kritéria (16, 17), u nichž byly proliferační a apoptotické vlastnosti myelomových plazmocytů vyšetřeny jednak při diagnóze nemoci před zahájením indukční léčby, jednak v 6–8týdenním odstupu po provedené VDT/ATKB. Do studie byli zařazeni pouze nemocní, splňující kritéria VDT/ATKB a u nichž byla tato léčebná modalita použita (16). Věkový medián souboru byl 55 (36–64) let, poměr M/Ž byl 1,2, průměrná délka sledování byla 52 (12–111) měsíců. Imunochemický typ IgG byl zastoupen v 60 % (n =55), IgA ve 24 % (n = 22), Bence-Jonesův ve 12 % (n = 11), IgD ve 2 % (n = 2) a IgM v 1 % (n = 1), poměr byl κ/λ 1,9. Z hlediska hodnocení stupně pokročilosti nemoci bylo zastoupení jednotlivých stadií s použitím stratifikace dle D-S následující: 17 nemocných (19 %) stadium I, 36 (39 %) stadium II a 38 (42 %), stadium III, v podstadiu B bylo 12 (13 %) nemocných. Při použití ISS mělo 43 (47 %) stadium 1, 33 (36 %) stadium 2 a 15 nemocných (17 %) stadium 3.
Nemocní splňující indikační kritéria VDT/ATKB byli léčeni v intencích doporučení vypracovaných Českou myelomovou skupinou obvykle 4 cykly indukčního režimu VAD (vinkristin, doxorubicin a dexametazon), od roku 2007 indukčním režimem CTD (cyklofosfamid, thalidomid, dexametazon) „junior“ (16). Sběr autologních kmenových buněk byl prováděn po stimulaci vysokými dávkami cyklofosfamidu a G-CSF (granulocyte-colony stimulating factor), zatímco v rámci přípravného režimu byla používána standardně jednorázová vysoká dávka melfalanu (200 mg/m2) s následným převodem autologních kmenových buněk. Proliferační aktivita myelomových elementů (procentuální podíl plazmatických buněk v S-fázi buněčného cyklu) byla měřena prostřednictvím PC-PI s pomocí průtokové cytometrie (Coulter Epics XL Coulter Corporation), přičemž průměrný počet hodnocených buněk byl 2–4 x 109/l. Proliferační index plazmocytů (PC-PI) byl měřen s pomocí DNA/CD138 techniky dvojího značení. Plazmocyty, jež vstoupily do fáze apoptózy (5, 9, 18, 19) byly detekovány rovněž průtokově cytometrickou metodou s použitím annexinu V konjugovaného s fluorescein-isothiocyanátem (Annexin V FITC kit, Immunotech, Marseille) a s pomocí monoklonální protilátky anti-CD138 (PC-AI) (4). Použité techniky byly podrobně rozvedeny v předchozích sděleních (5, 9, 19). Při statistickém vyšetření byly použity párový i standardní t-test, univariantní proporcionální regresní model dle Coxe i standardní log rank test a matematický model dle Kaplan-Meiera na hranici významnosti p < 0,05.
Výsledky
V souboru 91 nemocných s MM, vyšetřených při diagnóze nemoci před zahájením indukční chemoterapie a zařazených do přípravy k VDT/ATKB bylo zjištěno, že průměrná hodnota proliferačního PC-PI byla 2,5 s mediánem 2,4 (rozmezí 1,3–3,5 při 5–95 percentilu), zatímco průměrná hodnota apoptotického (PC-AI) indexu byla 5,4 s mediánem 4,8 (rozmezí 1,6–10,5). V souboru vyšetřeném v odstupu 2–3 měsíců po absolvování VDT/AKTB byly pozorovány nižší hodnoty proliferačního PC-PI indexu s průměrnou hodnotou 2,1 a s mediánem 2,1 (rozmezí 1,3–2,6), zatímco hodnota apoptotického PC-AI indexu byla oproti stavu před indukční terapií vyšší s průměrnou hodnotou 6,9 a s mediánem 5,6 (3,0–13,7). Hodnota vypočteného poměru proliferačního a apoptotického indexu (PC-PI/AI) byla při diagnóze MM vyšší, tj. aritmetický průměr byl 0,69 a medián 0,50 (0,20–1,90), zatímco při vyšetření po VDT/ATKB došlo k poklesu aritmetického průměru na 0,37 a mediánu na 0,40 (0,10–0,60). Jak vyplývá z tabulky 1, využívající ke statistickému hodnocení geometrický průměr (95% konfidenční interval) a párový t-test vyplývá, že zjištěné rozdíly v hodnotách proliferačního (PC-PI), apoptotického (PC-AI) a poměrného indexu proliferace a apoptózy (PC-PI-AI) byly u nemocných vyšetřených při diagnóze MM ve srovnání se situací po prodělané VDT/ATKB statisticky vysoce významné. V souboru nemocných, po absolvování VDT/ATKB došlo oproti stavu při diagnóze MM ke statisticky významnému poklesu indexu proliferace (PC-PI) a poměrného indexu proliferace/apoptózy (PC-PI/AI), a naopak ke statisticky významnému vzestupu indexu apoptózy (PC-AI) (tab. 1). Podrobnější analýza ukázala, že zjištěné, statisticky významné rozdíly všech tří hodnocených ukazatelů (PC-PI, PC-AI a PC-PI/AI) mezi oběma hodnocenými soubory byly téměř vždy přítomny i při rozdělení do skupin podle stupně pokročilosti nemoci vyhodnocené dle D-S (stadium I+II vs. III a podstadium A vs B) i ISS (stadium 1 vs. 2+3). Uvedený závěr neplatil pouze pro hodnocení PC-AI ve st. III a v podstadiu B dle D-S a stadiu 2+3 dle ISS (tab. 1). Prakticky identické zjištění bylo zaznamenáno při vyhodnocení rozdílů vypočtených mezi všemi třemi hodnocenými indexy (při použití rozdílu geometrického průměru) při rozpoznání MM a po VDT/ATKB (tab. 2). Při hodnocení případného vztahu proliferačního (PC-PI), apoptotického (PC-AI) a sumárního kinetického indexu (PC-PI/AI) ke stupni pokročilosti nemoci (stážovací systém dle D-S a ISS) bylo zjištěno, že neexistuje vztah intenzity proliferace a stupně apoptózy plazmatických buněk k jednotlivým klinickým stadiím nemoci (tab. 3). Délka celkového přežití (OS - overall survival), vyhodnocená podle Kaplan-Meiera ukázala, že medián OS byl v souboru vyhodnoceném od rozpoznání MM 85 měsíců a v souboru hodnoceném od provedení VDT-ATKB 74 měsíců (obr. 1). Při rozboru vztahu proliferačních (PC-PI) a apoptotických (PC-AI) vlastností plazmocytů KD včetně jejich vzájemného poměru (PC-PI/AI) se ukázalo, že v obou analyzovaných souborech (soubor vyšetřený při diagnóze a po VDT/ATKB) nebyl zjištěn s pomocí Coxova regresního modelu, matematického modelu (křivek přežití dle Kaplan-Meiera i s pomocí log-rank testu) vztah k délce celkového přežití (tab. 4, obr. 2). Podrobnější analýza prokázala negativní prognostický vztah k celkové délce přežití (OS) stadia III. vs. stadia I+II dle DS (rel. riziko 1,89, medián OS 57 vs. 90 měsíců, p = 0,036), pacientů stadií 2+3 vs. stadia 1 dle ISS (rel. riziko 2,05, mediány OS 65 vs. 103 měsíců, p = 0,036) a příslušnost k B-J typu MM (rel. riziko 2,76, p = 0,019) v případě souboru vyšetřeném při diagnóze MM. V souboru vyšetřeném po VDT/ATKB přetrvával negativní prognostický význam jen v případě stadia 2+3 vs. 1 dle ISS (rel. riziko 1,96, mediány OS 53 vs. 93 měsíců, p = 0,044) a B-J typu MM (relativní riziko 2,57, p = 0,028). V obou analyzovaných souborech nebyl zaznamenán prognostický význam pohlaví, věku (< 50 vs. 50–64 let), podstadia B při diagnóze a IgG i IgA imunochemického typu MM.
Tab. 1. Srovnání proliferačního, propidium-jodidového (PC-PI) a apoptotického annexin-V indexu (PC-AI) včetně jejich poměru (PC-PI/AI) vyšetřených při diagnóze MM a po vysokodávkované chemoterapii s autologní transplantací kmenových buněk z pohledu vztahu ke klinickému stadiu nemoci. 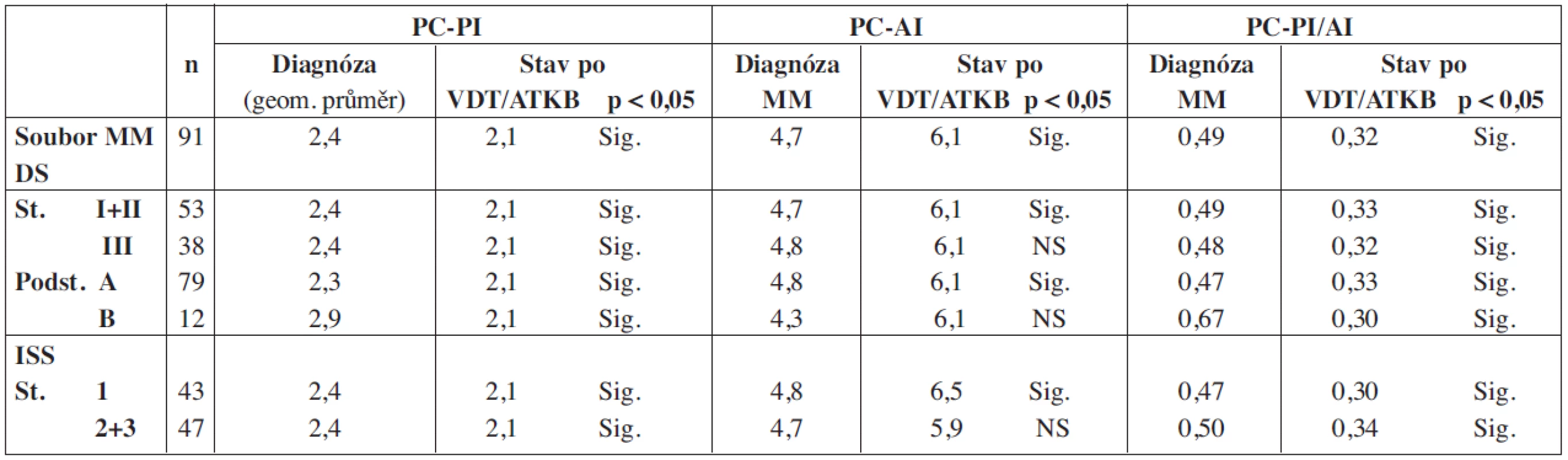
PC-PI – proliferační, propidium-jodidový index plazmocytů kostní dřeně, PC-AI – apoptotický, annexin V index plazmocytů kostní dřeně, PC-PI/AI – poměr proliferačního a apoptotického indexu plazmocytů, VDT-ATKB – vysokodávkovaná terapie s podporou autologní transplantace kmenových buněk, MM – mnohočetný myelom, D-S – stážovací systém dle Durieho-Salmona, ISS – International staging system, Sig. – statisticky vyjádřená významnost, NS – chybějící statisticky významný rozdíl Tab. 2. Vyhodnocení rozdílnosti hodnot PC-PI, PC-AI a PC-PI/AI v souborech nemocných vyšetřených při diagnóze MM a po VDT/ASCT. 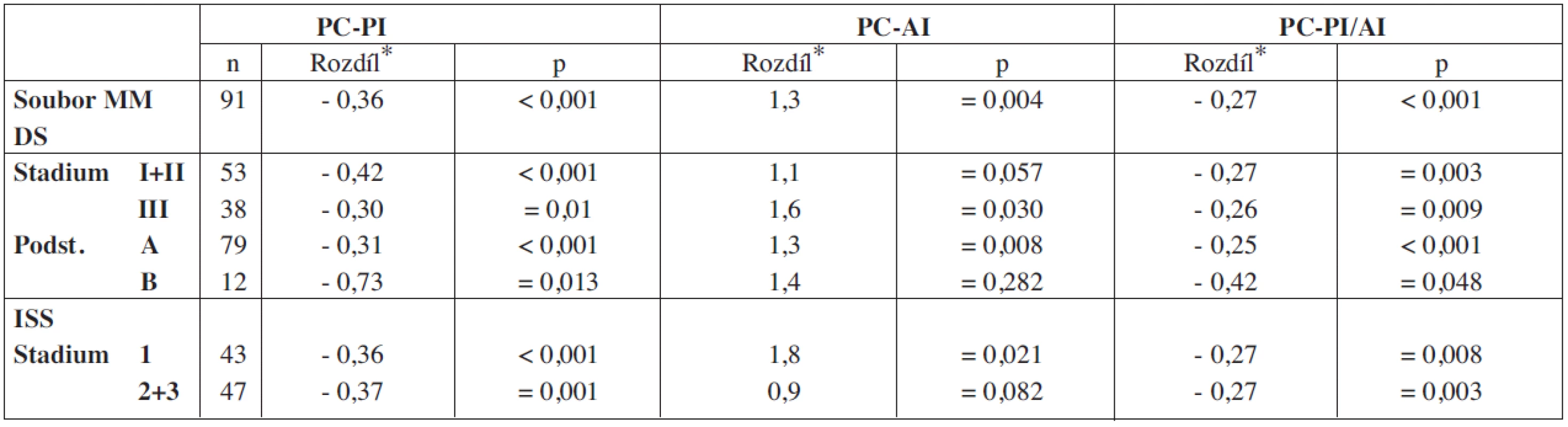
*– geometrický rozdíl, PC-PI – proliferační, propidium-jodidový index plazmocytů kostní dřeně, PC-AI – apoptotický, annexin-V index plazmocytů kostní dřeně, PC-PI/AI – poměr proliferačního a apoptotického indexu, VDT/ATKB – vysokodávkovaná chemoterapie s podporou autologní transplantace kmenových buněk, MM – mnohočetný myelom, D-S – stážovací systém dle Durieho-Salmona, ISS – International staging system, Sig. – statisticky vyjádřená významnost, NS – chybějící statisticky významný rozdíl Tab. 3. Vztah proliferačního-propidium jodidového a apoptotického – annexin V indexu plazmatických buněk vyšetřených při diagnóze mnohočetného myelomu ke klinickým stadiím mnohočetného myelomu. 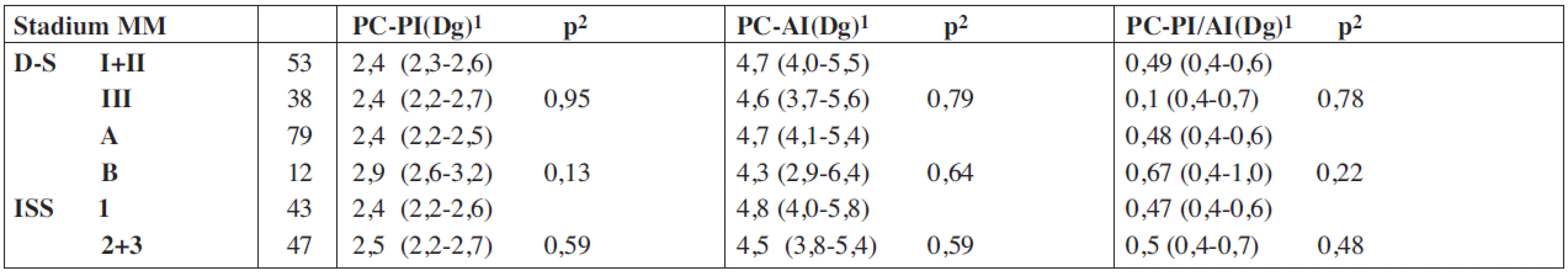
MM – mnohočetný myelom, PC-PI – proliferační/propidium-jodidový index plazmocytů, Dg – diagnóza nemoci, PC-AI - apoptotický/Annexin V index plazmocytů, 1 – geometrický průměr (95% konfidenční interval), 2 – standardní t-test, D-S stážovací systém dle Durieho-Salmona, ISS – International staging system Obr. 1. Křivky přežití dle Kaplan-Meiera v souboru 91 nemocných léčených vysokodávkovanou chemoterapií s podporou autologní transplantace krvetvorných buněk (VDT/ATKB) sestrojené jednak od data diagnózy mnohočetného myelomu (medián celkového přežití (OS) 85 měsíců), jednak od data VDT/ATKB (medián OS - 74 měsíců). 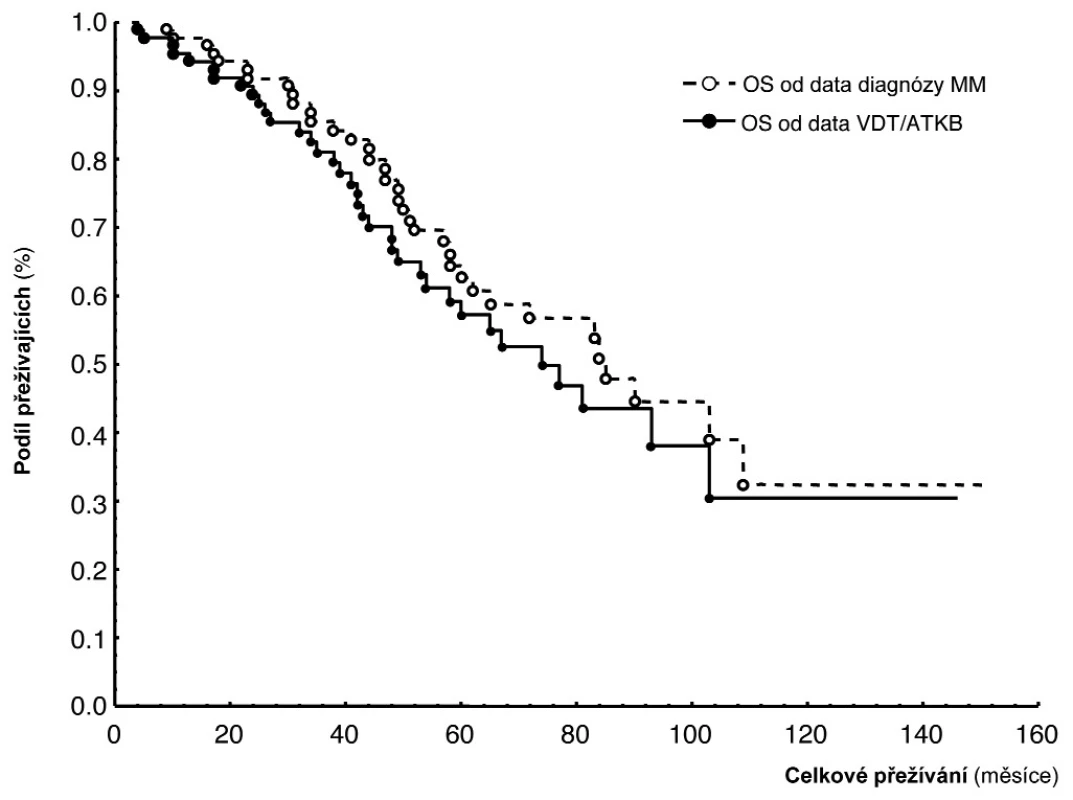
Tab. 4. Vztah proliferačních (PC-PI) a apoptotických (PI-AI) indexů plazmocytů k celkovému přežití vyšetřeného od diagnózy mnohočetného myelomu a od data vysokodávkované chemoterapie s autologní transplantací kmenových buněk. 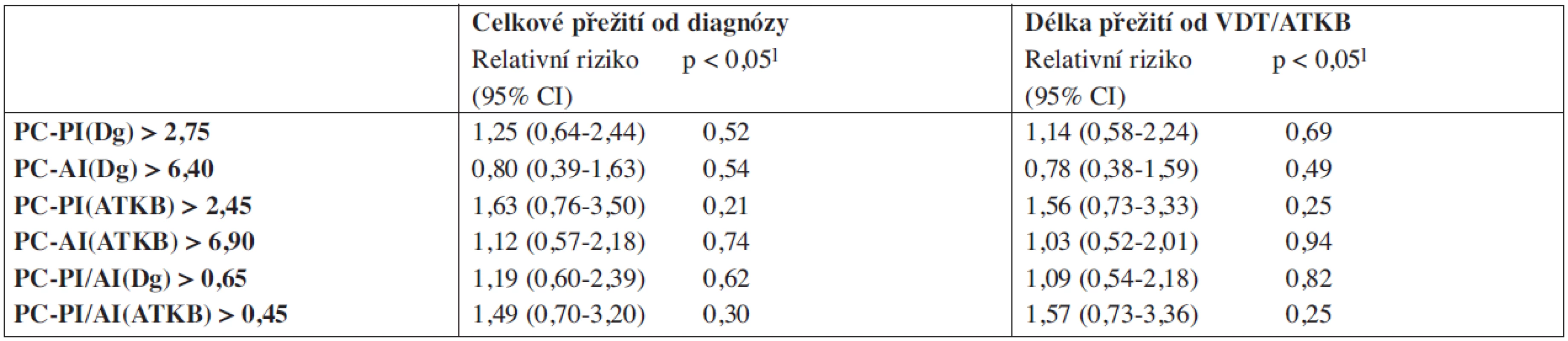
PC-PI – proliferační, propidium-jodidový index plazmatických buněk, PC-AI – apoptotický annexin-V index plazmatických buněk, CI – konfidenční interval, 1-Coxův proporcionální hazardní model, Dg – diagnóza myelomu, ATKB – autologní transplantace kmenových buněk, PC-PI/AI – poměr proliferačního a apoptotického indexu. Obr. 2. Křivky přežití dle Kaplan-Meiera v souboru 91 nemocných léčených vysokodávkovanou chemoterapií s podporou autologní transplantace kmenových buněk (VDT/ATKB) sestrojené jednak od data diagnózy (Dg.) mnohočetného myelomu (MM), jednak od data VDT/ATKB a to s ohledem na hodnoty proliferačního indexu plazmatických buněk (PC-PI, propidium-jodidový index) a na hodnoty apoptotického indexu (PC-AI, annexin V index). Statistické rozdíly byly hodnoceny s pomocí log-rank trestu (p<0,05). A Křivky přežití dle výše PC-PI (cut off 2,75) při diagnóze MM, mediány celkového přežití (OS) 90 vs 85 měsíců (p=0,514). B Křivky přežití dle výše PC-PI (cut off 2,75) po VDT/ATKB, mediány OS 77 vs. 74 měsíců (p=0,693). C Křivky přežití dle výše PC-AI (cut off 6,40) při diagnóze MM, mediány OS 85 vs. 72 měsíců (p=0,535). D Křivky přežití dle výše PC-AI (cut off 6,40) po VDT/ATKB, mediány OS 77 vs. 67 měsíců (p=0,490). E Křivky přežití dle výše sumárního/poměrného indexu proliferace a apoptózy, tj. PC-PI/AI (cut off 0,65) při diagnóze MM, mediány OS 85 vs. 72 měsíců (p=0,616). F Křivky přežití dle výše sumárního/poměrného indexu proliferace a apoptózy, tj. PC-PI/AI (cut off 0,65) po VDT/ATKB, mediány OS 77 vs. 67 měsíců (p=0,817). 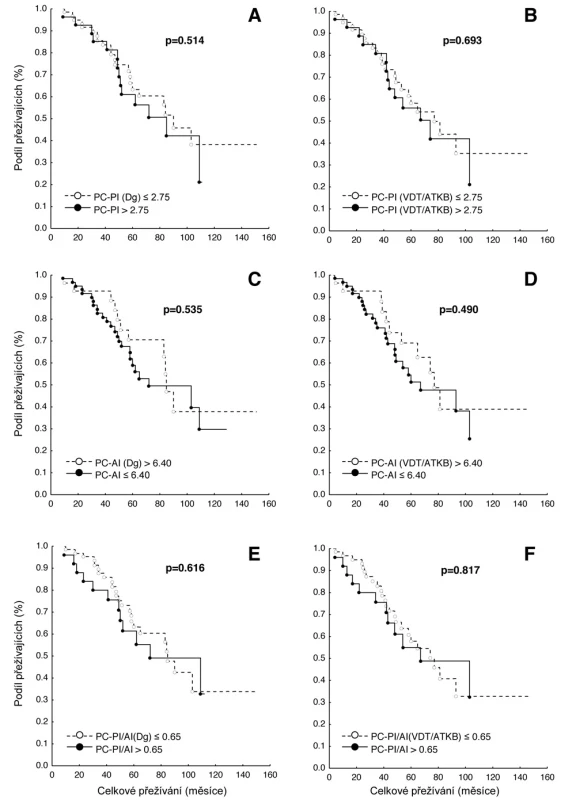
Diskuse
Z předchozích, dnes již klasických studií, založených na hodnocení nemocných léčených konvenční chemoterapií vyplynulo, že důležitou roli v rozvoji nemoci a v klinickém obraze MM hrají cytokinetické vlastnosti myelomových elementů, tj. zvýšená proliferace a snížená pohotovost k apoptóze (4). V úctyhodné řadě ověřovacích studií z období KT byl potvrzen vysoce významný na ostatních PF nezávislý prognosticky potenciál výše proliferačního indexu plazmocytů, determinujícího spolehlivě celkovou délku přežívání, a to jak s použitím „labelling indexu“ (PC-LI) zjištěného s pomocí mikroskopické imunofluorescenční metody (20), tak i s vyhodnocením podílu buněk v S-fázi buněčného cyklu s použitím průtokové cytometrie stanovením hodnoty propidium-jodidového indexu (7, 18). I nedávná studie, provedená u nemocných s MM v seniorském věku prokázala, že procentuální zastoupení plazmatických buněk v S-fázi buněčného cyklu je nejsilnějším prognostickým faktorem (PF) nemocných ve stadiu 3 vyhodnoceném dle ISS (18). Bylo zjištěno, že u nemocných s MM trvání léčebné odezvy a OS značně kolísá v závislosti na proliferačních vlastnostech myelomového klonu (5, 6, 7, 9, 21). Nemocní s vysokým podílem myelomových buněk v S-fázi buněčného cyklu, případně s vysokým PC-LI ve spojení s vysokou nádorovou masou měli velmi nepříznivou prognózu oproti nemocným s nízkým PC-LI. Hodnoty PC-LI plazmocytů a sérové hladiny β2-mikroglobulinu se staly dokonce východiskem prognostického stratifikačního systému rozdělujícího nemocné s konvenční chemoterapií na nemocné s nízkou, střední a vysokou mírou prognostického rizika s diametrálně odlišnou délkou OS (71, 40 a 17 měsíců) (3). PC-LI byl v období KT považován za nejvýznamnější a nezávislý PF a specifický ukazatel nádorové agresivity nemoci (6, 7, 21, 22, 23). Zjištění vysoké hodnoty PC-LI ve stabilní, plateau fázi MM bylo signálem časné progrese a fatálního vyústění nemoci (24). Na druhé straně jsou však známa i zjištění, která prokázala, že ~ 40 % nemocných i s nízkou hodnotou PC-LI se nacházelo v pokročilé, progresivní fázi s vysokou náloží nádorové masy (7, 25, 26). Hlubší analýza odhalila, že se stupněm aktivity nemoci nejlépe koreluje PC-LI vyšetřený v subpopulaci nezralých (CD38++, CD45-) plazmatických buněk (23). Je známo, že myelomová populace v KD sestává z nevelké kohorty rychle proliferujících buněk a většiny neproliferujících, diferencovanějších elementů vstupujících postupně do procesu apoptózy (27). Na rozvoji a manifestaci MM se proto vedle proliferačních vlastností myelomových plazmocytů významně uplatňuje i snížení apoptózy subklonu myelomových buněk, vedoucí k jejich „nesmrtelnosti“ (4, 28). Bylo zjištěno, že vysoký stupeň proliferace myelomových buněk se vyskytuje u nemocných s amplifikací chromozomu 1 (1q21) a se zvýšenou expresí genu CKS1B a to často de novo u nemocných se současnou t(4;14) nebo t(14;16) a lze je proto považovat za markery nepříznivé prognózy (29, 30, 31, 32, 33). Ukázalo se ale, že prognostický význam přítomnosti 1q21 se vytratil, byla-li použita multivariační analýza se zahrnutím PC-LI a t(4;14) a vztah nálezu 1q21 k prognóze je tedy vázán na současnou přítomnost vysokého proliferačního indexu a prognosticky nepříznivé genetické změny (32). Jak patrno z naší studie, ani pokus o použití sumárního indexu, sdružujícího hodnocení dvou protichůdných buněčných dějů, tj. proliferace a apoptózy (PC-PI/AI) nezvýšil citlivost hodnocení kinetických vlastností plazmatických buněk k prognóze nemoci, a to nejen v souboru léčeném VDT/ATKB, ale i předchozí studii s použitím KT (9). V recentním odborném písemnictví byl zaznamenán obdobně koncipovaný pokus o sdružené hodnocení proliferace a apoptózy stanovením indexu, založeném na součtu hodnoty PC-LI a log PCAP (procentuální výskyt plazmocytů v apoptóze s pomocí Annexinu V). Bylo zjištěno, že při hodnotě cut off 1,5 umožňuje tento index vyčlenění nemocných s nepříznivou prognózou (10). Stojí za pozornost, že potlačení prognostického významu PC-PI v důsledku začlenění nových imunomodulačních působků tj. thalidomidu a bortezomibu bylo zaznamenáno i v předchozí studii našeho pracoviště (36). Z výsledků získaných na pokusech in vitro i na zvířecích modelech vyplynulo, že u MM je pokles apoptózy základním mechanismem nádorové expanze (3). Nárůst neoplastického klonu vyplývá ze selhání přirozené ekvilibrace mezi stupněm proliferace a blokády apoptózy. Selhání apoptózy, vedoucí k prodloužení životnosti myelomových buněk je provázen nárůstem myelomové masy a v některých případech i bez zvýšeného stupně plazmocelulární proliferace (3, 27). Na rozvoji apoptózy se uplatňuje disrupce mitochondriálního transmembránového potenciálu, aktivace caspázy-3 a 8, zvýšení citlivosti k Fas-indukované apoptóze, expanze bcl-2 a dysregulace aktivity transkripčního nukleárního faktoru kappa-B (NF-kB) (34, 35).
Z předložené studie vyplývá, že iniciální hodnoty mediánů proliferačního (PC-PI) byly obdobné výši mediánů zjištěných v naší předchozí studii tj. 2,5 vs. 2,4 %, zatímco hodnota indexu apoptózy (PC-AI) byla v nynější studii poněkud nižší, tj. 4,8 % vs. 6,2 % (8, 9). Příčinou rozdílu může být skutečnost, že nynější analyzovaný soubor zahrnoval přednostně nemocné s aktivní, symptomatickou formou nemoci vyžadující VDT/ATKB s vyloučením nemocných s iniciální/asymptomatickou formou MM, vyznačující se přirozeně vyšším apoptotickým potenciálem (8, 9). Za zajímavé nutno považovat zjištění, že hodnoty proliferačního (PC-PI) i apoptotického indexu (PC-AI) včetně jejich poměru (PC-PI/AI) byly obdobné, bez statisticky významné rozdílnosti v jednotlivých stadiích MM vyhodnocených s pomocí tradičního stážovacího systému dle D-S i s použitím prognostického stratifikačního indexu ISS. Za důležité a z hlediska pochopení změn, ke kterým dochází po VDT/ATKB považujeme zjištění, že po prodělané VDT/ATKB dochází ke statisticky vysoce významnému poklesu proliferační aktivity (PC-PI) plazmatických buněk a to ve všech stadiích i podstadiích MM vyhodnocených dle D-S i s pomocí ISS. V případě hodnocení intenzity apoptotického procesu plazmatických buněk (PC-AI) byl zaznamenán statisticky významný vzestup stupně apoptózy pouze v celém souboru nemocných s MM a ve stadiu III i v podstadiu A dle D-S a ve stadiu 1 dle ISS. Statisticky významný pokles byl po prodělané VDT/ATKB, a to ve všech stadiích MM vyčleněných dle D-S i ISS zaznamenán v případě sumárního indexu PC-PI/AI. Velmi příznivá délka celkového přežití, dosahující 85 měsíců od diagnózy MM je zřejmě podmíněna nepochybným přínosem začlenění nových léčebných přípravků s imunomodulačním účinkem (thalidomid, bortezomib a lenalidomid) a moderní komplexní podpůrné léčby. Kratší délka OS, vypočtená od data VDT/ATKB je podmíněna jednak časovým posunem vyplněným indukční a stimulační léčbou i „čekacím“ obdobím do data vlastního provedení VDT/ATKB. Za významné považujeme taktéž zjištění, že intenzivní léčba nemocných s použitím VDT/ATKB a u části i moderními imunomodulačními působky včetně inhibitoru proteazomu vedla k úplnému potlačení prognostického významu proliferačního (PC-PI) i apoptotického (PC-AI) indexu a jejich vzájemného poměru (PC-PI/AI). Nutno uvést, že chybějící vztah k celkové délce přežití (OS) platil pro kinetické indexy vyšetřené jak při diagnóze, tak i po absolvování VDT/ATKB. Jde tedy o zásadně rozdílný nález proti výsledkům analýz prováděných v období KT (6, 23) a to včetně námi provedené prognostické analýzy v souboru léčeném pouze konvenční chemoterapií (9).
Nutno uvést, že uvedené zjištění zapadá do trendu, dobře patrného v posledním desetiletí, že s nástupem VDT/ATKB a zejména nových léků s biologickým účinkem dochází k výraznému oslabení, případně i úplnému potlačení významu mnoha PF, majících v období KT jednoznačný prognostický potenciál a na nichž byly založeny i předchozí stratifikační systémy (7, 14). Současná pozornost se proto obrací od klasických PF, jakými jsou β2-mikroglobulin, albumin, LDH, CRP, ale i proliferační vlastnosti plazmocytů včetně jejich plazmoblastické morfologie k novým ukazatelům vyjadřujících vnitřní, biologické vlastnosti myelomových buněk a poměry v mikroprostředí KD. Významného uplatnění dosáhly moderní, sofistikované zobrazovací metody (celotělová MRI a FDG/PET-CT) umožňující daleko citlivější odhalení a kvantifikaci ložiskových skeletálních, intramedulárních a extramedulárních lézí (37, 38, 39, 40). Na pořadu dne je ale především integrace cytogenetických nálezů a biologických PF vyplývajících z použití metod molekulární biologie, poskytující přímou a relevantní informaci o individuálních biologických vlastnostech nemoci. Se vzrůstající dostupností molekulárně-biologických metod, genomických a proteomických technik se objevují snahy o rozdělení MM do molekulárně-biologicky odlišných skupin s možností výběru individuálně uzpůsobené terčové léčby. Již v současnosti je zcela zřejmé, že spíše nežli klasické PF a dle závěrů předložené práce i proliferační a apoptotické vlastnosti plazmocytů má podstatně vyšší stratifikační a prognostický potenciál odhalení genetických odchylek (hypodiploidie, t(4;14),t(14;16), del 13 a delece 17p13 (p53 lokus) (13, 30, 41, 42, 43, 44,45, 46, 47) i zvýšená exprese CKS1B s amplifikací chromozomu 1q21 (33). Významným pokusem v klasifikaci MM na podkladě výsledků genové expresní analýzy je 8stupňová TC klasifikace, založená na kategorizaci nemocných podle expanze genů deregulujících translokaci těžkých řetězců imunoglobulinu a nadměrné exprese genů jednotlivých cyklinů (D1-D4). Výhodou této klasifikace je okolnost, že zahrnuje měření pouze několika ukazatelů a že většinu translokací lze odhalit metodou FISH (48). K rozpoznání „high risk“ pacientů s velmi nepříznivým prognostickým potenciálem při léčbě konvenční terapií i VDT/ATKB bez použití nových biologických působků je molekulárně-cytogenetické klasifikace mSMART, sestavená experty z Mayo kliniky a vyžadující přítomnost některého z následujících nálezů: t(4;14), t(14;16), t(14;20), del 17p13 (vše s pomocí FISH), konvenční cytogenetickou analýzou prokázanou deleci nebo monozomii chromozomu 13 nebo hypodiploidii (< 44) chromozomů a vysokou hodnotou PC-LI (> 3,0) (13, 49). Je tedy určitým překvapením, že klasifikace mSMART a to snad téměř jako jediná v současné odborné literatuře se přidržuje hodnocení proliferačního indexu plazmocytů, vyšetřeného ovšem s pomocí klasické sklíčkové mikroskopické imunofluorescence (13, 50).
Závěr
Z předloženého sdělení vyplývá, že proliferační a apoptotické vlastnosti plazmocytů se neliší z hlediska stupně pokročilosti, tj. klinického stadia MM (dle D-S i dle ISS) a že dochází po absolvování VDT/ATKB ke statisticky významnému poklesu obou parametrů, což zapadá do představy o chování reziduálního myelomového klonu po intenzivní cytoredukční léčbě. Za nejvýznamnější ale nutno považovat zjištění, že vyšetřování proliferačních a apoptotických vlastností plazmocytů s pomocí PC-PI a PC-AI ztratilo v současném období vysokodávkované chemoterapie s podporou autologní transplantace kmenových buněk a se začleněním nových biologických působků (thalidomidu, bortezomibu a lenalidomidu) na prognostickém významu a nemá spolehlivý předpovědní vztah k délce celkového přežití. V současné, doslova revoluční éře, kterou prodělává šíře poznatků o biologii a léčbě MM je nutné přenesení pozornosti k novým prognostickým ukazatelům, vycházejícím z moderních, vysoce sofistikovaných molekulárně-biologických technik.
S podporou grantů IGA MZ ČR NR 9500-3, VVVZ MSM 6198959205.
Prof. MUDr. Vlastimil Ščudla, CSc.
Na Střelnici 38
772 00 Olomouc
e-mail: vlastimil.scudla@fnol.cz
Doručeno do redakce: 13. 10. 2009
Přijato po recenzi: 23. 2. 2010
Zdroje
1. Landowski TH, Dalton WS. Molecular biology of plasma cell disorders. In: Mehta J, Singhal S. Myeloma. 1. edit. London, Martin Dunitz Ltd, 2002 : 25-37.
2. Greipp PR, Kyle RA. Clinical, morphological and cell kinetic differences among multiple myeloma, monoclonal gammopathy of undetermined significance and smoldering multiple myeloma. Blood 1983; 62 : 166-171.
3. Greipp PR, Lust JA, OęFallon WM, Katzmann JA, Witzig TE, Kyle RA, et al. Plasma cell labelling index and β2-microglobulin predict survival independent of thymidine kinase and C-reactive protein in multiple myeloma. Blood 1993; 81 : 3382-3387.
4. Witzig TE, Timm M, Larson D, Therneau T, Greipp PR. Measurement of apoptosis and proliferation of bone marrow plasma cells in patients with plasma cell proliferative disorders. Brit J Haematol 1999; 104 : 131-137.
5. Scudla V, Ordeltova M, Spidlova A, Bacovsky J, Kurasova J, Vranova V. Importance of examination of the propidium-iodide index of plasmocytes in multiple myeloma. I. Relationship to some laboratory findings of the disease. II. Relationship with extent and activity of the disease. Vnitr Lek 1999; 45 : 331-335, 336-341.
6. Boccadoro M, Marmont F, Tribalto M, Fossati G, Redoglina V, Bataglio S, et al. Early responder myeloma: kinetic studies identify a patient subgroup characterized by very poor prognosis. J Clin Oncol 1989; 7 : 119-125.
7. San Miguel JF, García-Sanz R, González M, Moro MJ, Hernández JM, Ortega F et al. A new staging system for multiple myeloma based on the number of S-phase plasma cells. Blood 1995; 85 : 448-455.
8. Scudla V, Bacovsky J, Vytrasova M, Zurek M, Ordeltova M. Contribution to examination of propidium-iodide and annexin-V indices of plasma cells in multiple myeloma. Int J Hematol 2002; 76 (suppl I): 24.
9. Scudla V, Ordeltova M, Bacovsky J, Vytrasova M, Sumna E, Martinek A, et al. A contribution to examination of propidium iodide and annexin V plasma cells indices in multiple myeloma. Neoplasma 2003; 50 : 363-371.
10. Kumar S, Timm M, Lacy MQ, Dispenzieri A, Hayman SR, Gertz MA, et al. Combining measurement of plasma cell apoptosis and proliferation in multiple myeloma identifies patients with poor survival. Blood 2005; 106: abstract No - 3410.
11. Xu JL, Lai R, Kinoshita T, Nakashima N, Nagasaka T. Proliferation, apoptosis and intratumoral vascularity in multiple myeloma: correlation with the clinical stage and cytological grade. J Clin Pathol 2002; 55 : 530-534.
12. Minarik J, Scudla V, Ordeltova M, Bacovsky J, Zemanova M. Evaluation of plasma cell propidium-iodide and annexin-V indices: their relation to prognosis in multiple myeloma. Biomed Pap 2005; 149 : 271-274.
13. Dispenzieri A, Rajkumar SV, Gertz MA, Fonseca R, Lacy MQ, Bergsagel PL, et al. Treatment of newly diagnosed multiple myeloma based on Mayo stratification of myeloma and Risk-adapted Therapy (mSMART): consensus statement. Mayo Clin Proc 2007; 82 : 323-341.
14. Durie BGM, Salmon SE. A clinical staging system for multiple myeloma. Cancer 1975; 36 : 842-854.
15. Greipp PR, San Miguel J, Durie BGM, Crowley JJ, Barlogie B, Blade J, et al. International staging system for multiple myeloma. J Clin Oncol 2005; 23 : 3412-3420.
16. Hájek R, Adam Z, Maisnar V, for Czech myeloma working group. Diagnosis and treatment of multiple myeloma (Summary of recommendations 2009). Transfuze Hematol dnes 2009; 15 (Suppl 2): 5-80.
17. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121 : 749-757.
18. Garcia-Sanz R, Gonzalez-Fraile MI, Mateo G, Hernandez JM, Lopez-Berges MO, De las Heras N, et al. Proliferative activity of plasma cells is the most relevant prognostic factor in elderly multiple myeloma patients. Int J Cancer 2004; 112 : 884-889.
19. Ordeltová M, Ščudla V, Špidlová A, Tomanová D, Bačovský J, Vytřasová M. Hodnocení apoptózy myelomových plazmocytů (annexin V/CD138 indexu) metodou průtokové cytometrie. Transfuze Hematol dnes 2002; 1-2 : 499-508.
20. Fonseca R, Conte G, Greipp PR. Laboratory correlates in multiple myeloma: How useful for prognosis? Blood Rev 2001; 15 : 97-102.
21. Trendle MC, Leong T, Kyle RA, Katzmann JA, Oken MM, Kay NE, et al. Prognostic significance of the S-phase fraction of light-chain-restricted cytoplasmic immunoglobulin (clg) positive plasma cells in patients with newly diagnosed multiple myeloma enrolled on Eastern cooperative oncology group treatment trial E9486. Am J Hematol 1999; 61 : 232-237.
22. Barlogie B, Tricot G, Anaissie E. Thalidomide in the management of multiple myeloma. Sem Oncol 2001; 28 : 577-582.
23. Joshua D, Petersen A, Brown R, Pope B, Snowdon L, Gibson J. The labelling index of primitive plasma cells determines the clinical behaviour of patients with myelomatosis. Brit J Haematol 1996; 64 : 76-81.
24. Steensma DP, Gertz MA, Greipp PR, Kyle RA, Lacy MQ, Lust JA, et al. A high bone marrow plasma cell labelling index in stable plateau-phase multiple myeloma is a marker for early disease progression and death. Blood 2001; 97 : 2522-2523.
25. Kyle RA. Multiple myeloma. Diagnostic challenges and standard therapy. Sem Hematol 2001; 38: Suppl 3 : 11-14.
26. Schambeck ChM, Bartl R, Höchtlen-Vollmar W, Wick M, Lamerz R, Fateh-Moghadam A. Characterization of myeloma cells by means of labelling index, bone marrow histology, and serum ß2-microglobulin. Hematopathology 1996; 106 : 64-68.
27. Vacca A, Ribatti D, Roncali L, Dammacco F. Angiogenesis in B cell lymphoproliferative diseases. Biological and clinical studies. Leuk Lymph 1995; 20 : 27-38.
28. Schneider V, van Lessen A, Huhn D, Serke S. Two subsets of peripheral blood plasma cells defined by differential expression of CD45 antigen. Brit J Haemat 1997; 97 : 56-64.
29. Shaughnessy J. Amplification and overexpression of CKS1B at chromosome band 1q21 is associated with reduced levels of p27Kip1 and an agressive clinical course in multiple myeloma. Hematology 2005; 10(Suppl 1): 117-126.
30. Shaughnessy JD Jr., Zhan F, Burington BE, Huang Y, Colla S, Hanamura I, et al. A validaded gene expression model of high-risk multiple myeloma is defined by deregulated expression of genes mapping to chromosome 1. Blood 2007; 109 : 2276-2284.
31. Chng WJ, Kuehl WM, Bergsagel PL, Fonseca R. Translocation t(4;14) retains prognostic significance even in the setting of high-risk molecular signature. Leukemia 2008; 22 : 459-461.
32. Fonseca R, Van Wier SA, Chng WJ, Ketterling R, Lacy MQ, Dispenzieri A, et al. Prognostic value of chromosome 1q21 gain by fluorescent in situ hybridization and increase CKS1B expression in myeloma. Leukemia 2006; 20 : 2034-2040.
33. Zhan F, Colla S, Wu X, Chen B, Stewart JP, Kuehl WM et al. CKS1B, over expressed in aggresive disease, regulates multiple myeloma growth and survival through SKP2 - and p27Kip1-dependent and independent mechanisms. Blood 2007; 109 : 4995-5001.
34. Drewinko B, Alexanian R, Boyer H, Barlogie B, Rubinow SI. The growth fraction of human myeloma cells. Blood 1981; 57 : 333-338.
35. Mitsiades N, Mitsiades CS, Poulaki V, Chauhan D, Richardson PG, Hideshima T, et al. Apoptotic signaling induced by immunomodulatory thalidomide analogs in human multiple myeloma cells: therapeutic implications. Blood 2002; 99 : 4525-4530.
36. Minarik J, Scudla V, Bacovsky J, Zemanova M, Pika T, Ordeltova M, et al. Thalidomide and bortezomib overcame the prognostic significance of proliferative index in multiple myeloma. Neoplasma 2010; 57 : 8-14. (in press).
37. Walker R, Barlogie B, Haessler J, Tricot G, Anaissie E, Shaughnessy JD Jr, et al. Magnetic resonance imaging in multiple myeloma: Diagnostic and clinical implications. J Clin Oncol 2007; 25 : 1121-1128.
38. Baur A, Stabler A, Nagel D, Lamerz R, Bartl R, Hiller E, et al. Magnetic resonance imaging as a supplement for the clinical staging system of Durie-Salmon? Cancer 2002; 95 : 1334-1345.
39. Greipp PR, Leong T, Bennett JM, Gaillard JP, Klein B, Steward JA, et al. Plasmablastic morphology – an independent prognostic factor with clinical and laboratory correlates. Eastern cooperative oncology group (OCOG) myeloma trial E9486 report by the ECOG Myeloma Laboratory Group. Blood 1998; 91 : 2501-2507.
40. Rajkumar SV, Fonseca R, Lacy MQ, Witzig TE, Therneau TM, Kyle RA, et al. Plasmablastic morphology is an independent predictor of poor survival after autologous stem-cell transplantation for multiple myeloma. J Clin Oncol 1999; 17 : 1551-1557.
41. Fassas AB, Spencer T, Sawyer J, Zangari M, Lee CK, Anaissie E, et al. Both hypodiploidy and deletion of chromosome 13 independently confer poor prognosis in multiple myeloma. Br J Haematol 2002; 118 : 1041-1047.
42. Shaughnessy J, Jacobson J, Sawyer J, McCoy J, Fassas A, Zhang F, et al. Continuous absence of metaphase-defined cytogenetic abnormalities, especially of chromosome 13 and hypodiploidy, ensures long-term survival in multiple myeloma treated with Total therapy I: Interpretation in the context of global gene expression. Blood 2003; 101 : 3849-3856.
43. Dewald G, Therneau T, Larson D, Lee YK, Fink S, Smoley S, et al. Relationship of patient survival and chromosome anomalies detected in metaphase and/or interphase cells at diagnosis of myeloma. Blood 2005; 106 : 3553-3558.
44. Chang H, Sloan S, Li D, Zhuang L, Yi Q, Chen CI, et al. The t(4;14) is associated with poor prognosis in myeloma patients undergoing autologous stem cell transplant. Br J Haematol 2004; 125 : 64-68.
45. Fonseca R, Blood E, Rue M, Harrington D, Oken MM, Kyle RA, et al. Clinical and biologic implications of recurrent genomic aberrations in myeloma. Blood 2003; 101 : 4569-4575.
46. Gertz MA, Lacy MQ, Dispenzieri A, Greipp PR, Litzow MR, Henderson KJ, et al. Clinical implications of t(11;14) (q13;q32), t(4;14)(p16.3;q32), ane -17p13 in myeloma patients treated with high-dose therapy. Blood 2005; 106 : 2837-2840.
47. Fonseca R, Barlogie B, Bataille R, Bastard C, Bergsagel PL, Chesi M, et al. Genetics and cytogenetics of multiple myeloma: A workshop report. Cancer Res 2004; 64 : 1546-1558.
48. Bergsagel PL, Kuehl WM, Zhan F, Sawyer J, Barlogie B, Shaughnessy J Jr. Cyclin D dysregulation: An early and unifying pathogenic event in multiple myeloma. Blood 2005; 106 : 296-303.
49. Stewart AK, Bergsagel PL, Greipp PR, Dispenzieri A, Gertz MA, Hayman SR, et al. A practical guide to defining high-risk myeloma for clinical trials, patient counseling and choice of therapy. Leukemia 2007; 21 : 529-534.
50. Stewart AK. Staging and risk-stratification of multiple myeloma. In: Rajkumar SV, Kyle RA. Treatment of multiple myeloma and related disorders. 1. edit. Cambridge, Cambridge University Press, 2009; 18-25.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek VZDĚLÁVACÍ AKCE IPVZČlánek VZDĚLÁVACÍ AKCE IPVZČlánek Zprávy odborných společnostíČlánek Zprávy odborných společnostíČlánek Zprávy odborných společnostíČlánek Zprávy odborných společnostíČlánek VZDĚLÁVACÍ AKCE IPVZ
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2010 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Výběr z tisku a zprávy o knihách
- Úspěšný odběr periferních krvetvorných buněk u pacientky s chronickou myeloidní leukemií léčenou nilotinibem. Kazuistika
- VZDĚLÁVACÍ AKCE IPVZ
- Recenze knihy „Diferenciální diagnostika plicních infiltrátů a pokroky v léčbě mykotických infekcí u imunokompromitovaných pacientů“ autorského kolektivu vedeného Petrem Cetkovským a Michalem Koubou
- Výběr z tisku a zprávy o knihách
- Výběr z tisku a zprávy o knihách
- Zprávy odborných společností
- Zprávy odborných společností
- Zprávy odborných společností
- Zprávy odborných společností
- In memoriam Za docentem MUDr. Zdeňkem Churým, CSc.
- Vzpomínka na přednostu MUDr. Vladimíra Chudomela, CSc.
- Konsenzuální návrh České lékařské společnosti J. E. Purkyně na novelizaci vyhlášky 185/2009 Sb., o specializačním vzdělávání lékařů
- Konsenzuální návrh České lékařské společnosti J. E. Purkyně
- Globální hodnocení funkce hemostázy – část I. Trombin generační test
- VZDĚLÁVACÍ AKCE IPVZ
- Detekce poškození genu TP53 u pacientů s chronickou lymfocytární leukemií
- Výběr z tisku a zprávy o knihách
- Použití chladicích gelových pouzder při zpracování kmenových buněk
- Léčba relabovaného a refrakterního Hodgkinova lymfomu
- Stručné morfometrické poznámky k heterogenitě lymfocytů periferní krve („minireview“ s vlastními výsledky)
- VZDĚLÁVACÍ AKCE IPVZ
- Vliv vysokodávkované chemoterapie s podporou autologní transplantace kmenových buněk na proliferační a apoptotické vlastnosti plazmatických buněk u mnohočetného myelomu
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba relabovaného a refrakterního Hodgkinova lymfomu
- Globální hodnocení funkce hemostázy – část I. Trombin generační test
- Detekce poškození genu TP53 u pacientů s chronickou lymfocytární leukemií
- Stručné morfometrické poznámky k heterogenitě lymfocytů periferní krve („minireview“ s vlastními výsledky)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



