-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Globální hodnocení funkce hemostázy – část I. Trombin generační test
Global assessment of haemostagic function - part I. Thrombin generation test
There are numerous assays available for evaluation of the hemostatic system in humans, including clotting times of different types, investigation of single components of clotting system such as factors, inhibitors, specific mutations, lupus anticoagulant, bleeding time and platelet aggregation. These tests do not cover complexity of clotting system. The central enzyme of the hemostatic system is thrombin. Estimation of an individualęs potential to generate thrombin may closely correlate with hyper - or hypo-coagulable state. Thrombin generation assays have been studied in various settings including acquired and congenital bleeding and thrombophilic states or in platelet disorders. Several variations of the assay do exist depending on the investigated defect. There are still considerable inter-laboratory variations which make the comparison between studies difficult.
Key words:
thrombin, thrombophilia, thrombin generation test
Autoři: A. Hluší; L. Slavík; J. Úlehlová; V. Krčová; K. Indrák
Působiště autorů: Hemato-onkologická klinika FN a LF UP Olomouc
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 2, p. 65-70.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Pro posouzení funkce lidského hemostatického systému je v současnosti k dispozici celá řada testů zahrnujících měření koagulačních časů, vyšetření jednotlivých komponent koagulačního procesu jako jsou hladiny konkrétních faktorů, inhibitorů, specifické mutace, lupus antikoagulans, doba krvácivosti, agregace trombocytů. Uvedené laboratorní testy ale nepostihují komplexitu hemostatického systému. Centrálním enzymem hemostatického systému je trombin. Zhodnocení individuálního potenciálu pro generaci trombinu pomocí trombin generačního testu (TGT) může těsně korelovat s hyper - nebo hypokoagulačním stavem. Generace trombinu byla studována u řady koagulačních poruch – získaných i vrozených krvácivých a hyperkoagulačních stavů či poruch destičkové funkce. V závislosti na vyšetřované problematice se používá několik variant testu. Pro velkou interlaboratorní variabilitu je dosud velmi obtížné srovnávání výsledků jednotlivých studií.
Klíčová slova:
trombin, trombofilie, trombin generační testÚvod
Funkce hemostatického systému
Hlavním úkolem hemostatického systému je zajištění integrity cévního řečiště a umožnění kontinuální cirkulace krve. Jde o systém komplexní, zahrnující inertní endotelovou cévní výstelku, cirkulující buněčné krevní složky – trombocyty, erytrocyty, leukocyty, z nich uvolňované buněčné mikropartikule, a dále složitý systém plazmatických koagulačních proteinů, který při své aktivaci cestou kaskádovitých enzymatických reakcí vede k tvorbě klíčového koagulačního enzymu trombinu štěpícího solubilní fibrinogen na fibrin, hlavní komponentu nerozpustné fibrinové matrix (1) (obr. 1).
Obr. 1. Koagulační kaskáda (zdroj http://kuwait-md.org). 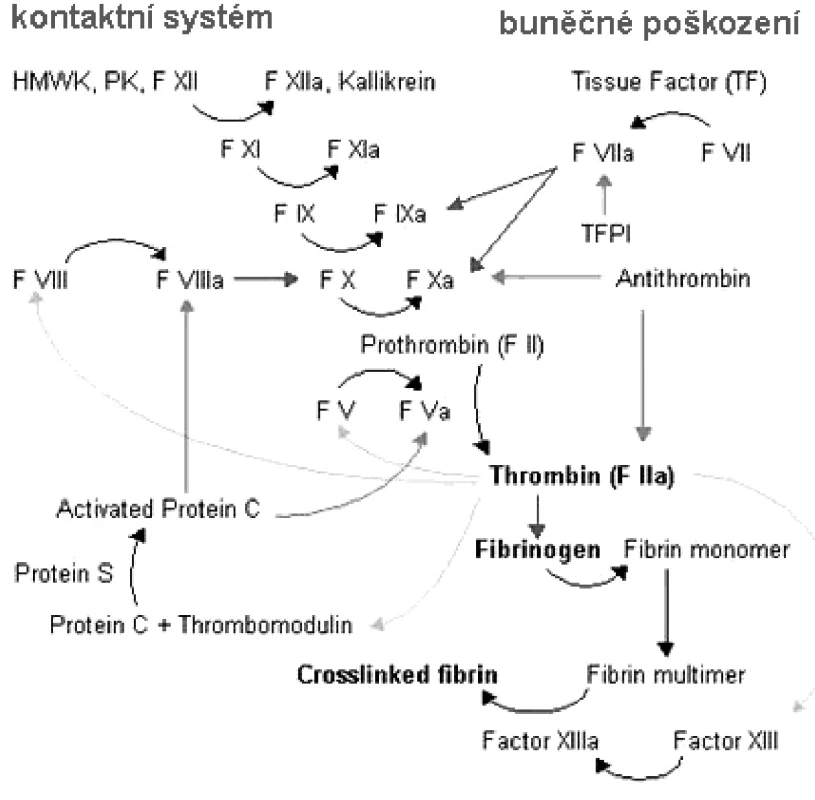
Při poškození cévní stěny se rozbíhá mnohaúrovňový proces: v endotelu dochází k syntéze a uvolňování působků ovlivňujících buněčné složky i plazmatický koagulační systém. Z buněčných elementů hrají dominantní úlohu trombocyty, procházející procesem adheze, aktivace, agregace k formaci primární trombotické zátky. Zároveň trombocyty poskytují esenciální povrch pro průběh plazmatických koagulačních reakcí. Sama koagulační kaskáda funguje vícestupňově.
Krátce po poškození cévy, obnažení subendoteliálních struktur a uvolnění tkáňového faktoru dojde velmi rychle k iniciaci koagulačního děje a vytvoření malého množství trombinu. Ten dále zpětnovazebně působí propagaci celého děje a stupňuje aktivitu prokoagulačního enzymatického komplexu, jehož výsledkem je syntéza velkého množství trombinu resp. dostatečného množství fibrinu, který formuje primární hemostatickou zátku v nerozpustnou sraženinu – trombus. Během této fáze již trombin zahajuje aktivaci fibrinolýzy a aktivuje též inhibitory krevního srážení.
Terminální fáze celého procesu je zajištěna inhibicí prokoagulačního enzymatického komplexu buď přímo antitrombinem, nebo inaktivací bílkovinných kofaktorů. Tímto je umožněna lokalizace hemostatického procesu pouze do místa cévního poškození. V poslední fázi dochází k aktivaci fibrinolytických dějů vedoucích k rozpuštění starého trombu a opravě a regeneraci poškozené tkáně.
Správná funkce hemostatického systému vyžaduje udržení rovnováhy mezi jeho prokoagulačními a antikoagulačními složkami. Jejich vychýlení jedním nebo druhým směrem vede k hypokoagulačnímu nebo naopak hyperkoagulačnímu stavu, který se klinicky projeví krvácením nebo naopak trombotickými komplikacemi.
Tradiční hodnocení funkce hemostázy
Dosud užívané hodnocení funkce koagulačního systému je založeno na měření tradičních koagulačních časů jako je aktivovaný tromboplastinový čas (aPTT), protrombinový čas (PT, Quickův), trombinový čas (TT) nebo jejich alternativy, které sledují v laboratorních podmínkách dobu od zahájení koagulační reakce do vytvoření fibrinové sraženiny. Tyto testy jsou vhodné k orientačnímu zhodnocení případného rizika krvácení nebo k monitorování příslušné antikoagulační terapie. K hodnocení trombotického stavu je užít nelze.
Další širokou skupinu laboratorních vyšetření představují testy sloužící ke kvantitativnímu, příp. kvalitativnímu stanovení jednotlivých koagulačních faktorů nebo inhibitorů, složek fibrinolytického systému a přítomnosti nespecifických (antifosfolipidové protilátky) nebo specifických inhibitorů krevního srážení. Moderní molekulárně genetické testy již rutinně umožňují vyšetření vrozených trombofilních dispozic jako jsou mutace faktoru V Leiden nebo protrombinová mutace (2–4). K vyšetření funkce krevních destiček je k dispozici několik možností. Mezi klinicky nejužívanější patří vyšetření agregace trombocytů nebo funkční test PFA-100; měření času krvácení (krvácivost) patří mezi testy hrubě orientační.
Zavedené laboratorní koagulační metody tedy vždy postihují pouze část hemostatického systému a vůbec neodrážejí vztah plazmatických a buněčných složek. Přes nesporné pokroky v laboratorní hemostazeologii ale stále zůstává část pacientů, u kterých závažný klinický průběh nekoreluje s výsledky dostupných vyšetření. Jde především o idiopatické či recidivující tromboembolické komplikace bez laboratorního průkazu trombofilního stavu. Obdobný problém představuje také laboratorní posouzení bypassové léčby u pacientů s inhibitorem koagulačního faktoru VIII/IX či specifické případy monitorování antikoagulační terapie (např. u antifosfolipidového syndromu). Snaha o zavedení vyšetření, které by uvedené nedostatky klasických testů postrádalo, je proto logická a žádoucí.
„Globální hemostatické testy“
Pro účely komplexního posouzení funkce hemostatického systému byla navržena řada testů, z nichž se mnohé v klinické praxi neprosadily. V současnosti se využívá několik metod, které jsou založeny na nepřímém nebo přímém sledování generace trombinu. Do první skupiny patří tromboelastografie (TEG), při které je analyzována plná krev (5). Tromboelastografický záznam je vhodný hlavně pro urgentní medicínu k základnímu posouzení aktuálního stavu hemostázy, k odlišení hypokoagulace, fibrinolýzy, vlivu trombocytopenie a případně ke sledování efektu substituční léčby.
Další možností je vyšetření celkového hemostatického potenciálu (overall hemostatic potential assay, OHP) testem založeným na monitorování formace fibrinu pomocí měření kapacity reakčního produktu (6).
Jako přesnější a klinicky lépe využitelný se jeví test založený na měření kinetiky vzniku trombinu, trombin generační test (TGT). Měření individuální kapacity pro generaci trombinu v plné krvi nebo v plazmě může být proto ve srovnání s konvenčními testy potenciálně užitečnější tím, že odráží hemoragický nebo trombotický klinický fenotyp (snížená nebo zvýšená generace trombinu).
Měření generace trombinu
Filozofie měření trombinové generace vychází z postavení trombinu v koagulačním procesu, kde představuje centrální enzym (obr. 2). Trombin zajišťuje aktivaci krevního srážení, zároveň ale v pokročilých fázích procesu zprostředkovává samotnou inhibici hemostatických pochodů, hraje významnou roli v mezibuněčné signalizaci, ovlivňuje fibrinolýzu a zánětlivé procesy. Uvedené funkce jsou realizovány skrze plejádu enzymatických reakcí, které vyžadují těsnou koordinaci. V řadě reakcí vystupuje trombin jako enzymatický substrát, jindy působí jako kofaktor. Jeho úloha v hemostáze je multifunkční, občas i bivalentní.
Obr. 2. Centrální role trombinu v hemostáze (převzato z J Thromb Haemost, Crawley J., The central role of thrombin in hemostasis (1)) Prokoagulační, antikoagulační, prozánětlivé, protizánětlivé a anti-fibrinolytické působení trombinu. (PAR – proteázou aktivovaný receptor, TM – trombomodulin, GAG - glykosaminoglykany, TAFI – trombinem aktivovatelný inhibitor fibrinolýzy, Gp – destičkový povrchový glykoproteinový receptor, HCII – heparin kofaktor II, C5a – složka komplementu) 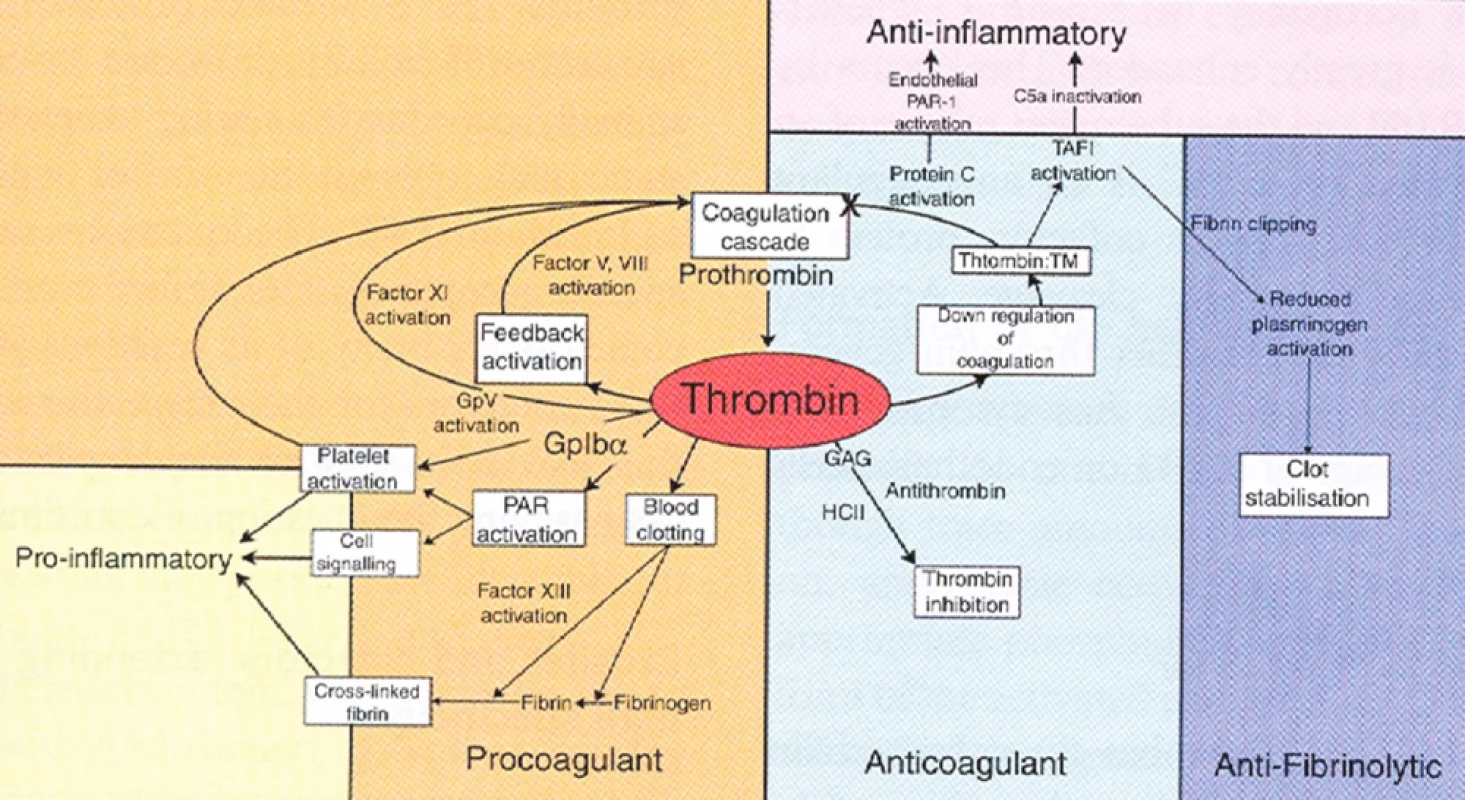
Monitorování tvorby trombinu se jeví jako vhodný postup pro globální vyšetření funkce hemostázy. K posouzení stavu in vivo se nabízí stanovení markerů generace trombinu jako protrombinové fragmenty (F1+2), fibrinopeptid A nebo trombin-antitrombinové komplexy (TAT). Pro praktické použití nejsou ale vhodné.
Laboratorní sledování generace trombinu jednoduchým testem bylo poprvé popsáno Macfarlanem a Pitneym již v roce 1953 (7, 8). Principem dnes používaných automatizovaných měření je in vitro monitorování vzniku trombinu v plazmě po aktivaci koagulační kaskády tkáňovým faktorem (TF). Reakce probíhá za účasti negativně nabitých fosfolipidů a Ca2+. TF a koncentrace fosfolipidů je používán v různých koncentracích v závislosti na typu používané plazmy a charakteru vyšetření (bypassová léčba u hemofiliků, trombofilní stav, antikoagulační léčba). Generovaný trombin štěpí chromogenní nebo fluorogenní substrát, který je odpovídající metodou detekován. Nevýhodou chromogenních substrátů je jejich pomalejší štěpení trombinem, nižší afinita k trombinu a potřeba blokace vzniku fibrinu ve vyšetřované plazmě. Použití fluorogenního substrátu je vhodnější navíc i proto, že generovaný fluorogenní signál není rušen vznikající sraženinou ani přítomností trombocytů.
Výsledkem měření je křivka odrážející aktuální kapacitu systému pro generaci trombinu (obr. 3), která je charakterizována třemi hlavními parametry: dobou do nástupu generace trombinu (lag fáze), maximální koncentrací trombinu (peak), a plochou pod křivkou odrážející celkové množství vzniklého trombinu (endogenní potenciál, ETP). K vyšetření lze použít plazmu chudou na destičky (PPP) nebo plazmu na destičky bohatou (PRP). Z technického hlediska během vývoje vznikla řada variant testu, používajících různé koncentrace tkáňového faktoru a fosfolipidů, přidání inhibitoru kontaktní fáze nebo trombomodulinu (9–14).
Obr. 3. Základní generační křivky trombinu (zdroj http://www.stago.fr) 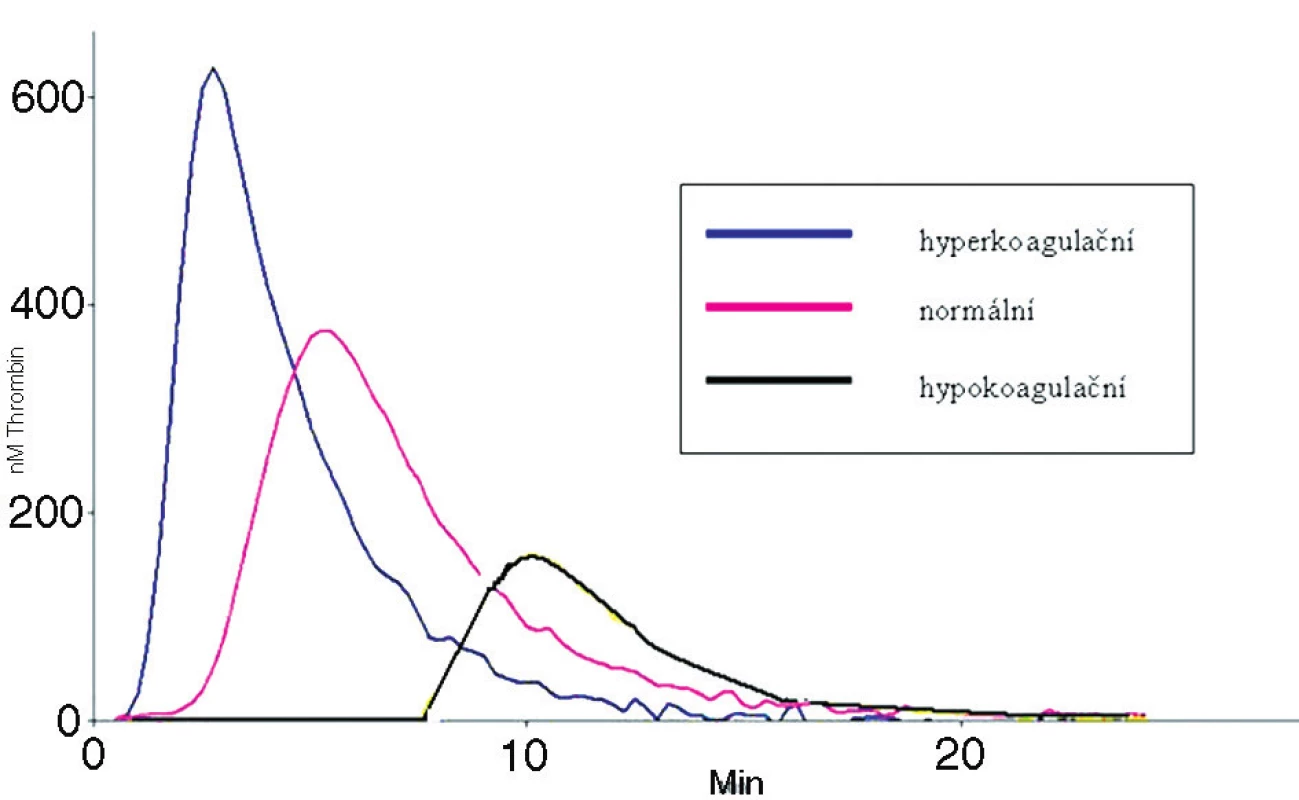
Technické možnosti
V současnosti jsou komerčně dostupné dva druhy TGT, které vykazují dostatečnou reprodukovatelnost a jejich provedení je relativně snadné. U obou je používán fluorogenní substrát. První metodou je kalibrovaný automatizovaný trombin generační test (CAT) (Thrombinoscope B.V., Maastricht, The Netherlands), vyvíjený v kolektivu prof. Hemkera od poloviny osmdesátých let (13–17). Druhou možností je Technothrombin® TGA assay (Technoclone, Vienna, Austria) (18, 19). Dosavadní zkušenosti prokázaly dostatečnou intralaboratorní reproducibilitu s intra - i inter-assay koeficientem variace pod 10 % v PPP i PRP (20, 21). Mezilaboratorní variabilita je ale mnohem výraznější, závisí na používaných reagenciích, metodice ale i na způsobu odběru, skladování a přípravě vzorku plazmy. Srovnávání výsledků mezi jednotlivými pracovišti je proto zatím problematické.
Z hlediska metodiky testu bylo popsáno několik jeho variant využívajících:
- rozdílné koncentrace TF jako koagulačního iniciátoru testu (10, 11),
- rozdílné koncentrace fosfolipidů (12, 14),
- přidání inhibitoru kontaktní fáze při měření u stavů s nízkou generací trombinu (hemofilie) (9, 11),
- přidání trombomodulinu nebo aktivovaného proteinu C, který zvyšuje senzitivitu testu při deficitu proteinů C, S nebo APC-rezistenci (22, 23).
Možnosti použití TGT v praxi
Hypokoagulační stavy
Hemofilie. U pacientů s hemofilií byla prokázána jednoznačná závislost koagulační aktivity FVIII (FIX) a peaku i ETP generace trombinu (12, 24). Uvedené parametry se zřetelně liší u zdravých lidí a u pacientů s různou tíží hemofilie. Byla také prokázána signifikantní variabilita v TGT u pacientů se stejnou aktivitou FVIII (FIX), což koresponduje s klinickým fenotypem onemocnění.
V generaci trombinu se logicky odráží i substituční léčba koagulačním faktorem. Zde byly rovněž zaznamenány rozdíly v parametrech TGT u pacientů se stejnou hladinou faktoru po substituci. Z dosavadních zkušeností do budoucna vyplývá možnost použití testu pro lepší monitorování substituční terapie, než jakou poskytuje měření aktivity koagulačního faktoru.
Hemofilie s přítomností specifického inhibitoru. U hemofilických pacientů s přítomností komplikujícího inhibitoru nelze k monitorování substituční bypassové terapie konvenční testy vůbec použít. Použití trombin generačního testu se proto potenciálně jeví jako velmi výhodné. Dostupná možnost monitorování by přinesla zřetelnou racionalizaci v léčbě s významným ekonomickým efektem.
Studie (25, 26) prokazují lineární závislost odpovědi na dávce FEIBA (Factor Eight Inhibitor Bypassing Activity) u peaku generace trombinu a jeho normalizaci po léčbě. Test je použitelný i k monitorování substituce u pacientů podstupujících chirurgické výkony (27). Možnostem využití TGT k monitorování bypassové léčby rekombinantním FVIIa se také věnuje několik autorů používajících různé technické modifikace testu (25, 27, 28). Výsledky jsou zde méně jednoznačné, všichni ale prokazují zkrácení lag fáze TGT.
Ostatní vrozené krvácivé stavy. U pacientů s von Willebrandovou chorobou, Bernard - Soulierovým syndromem nebo Glanzmannovou trombastenií jsou zkušenosti s TGT dle literárních údajů velmi limitované (29). Parametry TGT vykazují u pacientů se stejným defektem výrazné rozdíly, které přetrvávají po terapii.
Jiné koagulopatie. Generace trombinu byla studována i v jiných stavech provázených koagulopatií. Například u pacientů s jaterní cirhózou Tripodi prokázal větší vliv trombocytopenie na generaci trombinu, než jaký měla koncentrace koagulačních faktorů (30).
Trombotické stavy
Žilní tromboembolismus, trombofilní stavy. V několika studiích zabývajících se trombofilními stavy byla prokázána zvýšená generace trombinu. Jde o klasické trombofilie jako jsou mutace FV Leiden (R506Q), protrombinová mutace (G20210A) nebo vrozené deficity proteinu C, proteinu S, antitrombinu (31–34). Endogenní trombogenní potenciál je u těchto stavů zvýšený. Podobně jako u hemofilií existují významné rozdíly v ETP mezi pacienty se stejným defektem. Zvýšená generace trombinu byla prokázána i u zvýšení hladin FVIII, FIX, FXI u žen užívajících kombinovanou kontracepci, i u pacientů s přítomností lupus antikoagulans (35–37).
Z klinického hlediska by byla užitečná možnost predikce rekurence TEN příhod. V Hronově studii (19) byla zkoumána závislost rekurence HŽT a generace trombinu. U pacientů s peak trombinu < 400 nmol/l bylo riziko rekurence ve 4 letech 6,5 %, u pacientů s peakem > 400 nmol/l riziko činilo 20 %.
Arteriální tromboembolismus. V případě arteriálních trombotických komplikací jsou zkušenosti s TGT chudší. Zvýšené riziko ischemické mozkové příhody podle Fabera koreluje s hodnotou ETP (38). U kardiologických nemocných byla prokázána časnější, rychlejší a vyšší generace trombinu u pacientů, kteří prodělali akutní formu koronárního syndromu ve srovnání s pacienty se stabilizovanou chronickou ischemickou chorobou srdeční (39).
Monitorování antikoagulační a antiagregační terapie
Měření generace trombinu umožňuje i posuzování efektivity antikoagulační i antiagregační léčby. Je senzitivní jak k nejrozšířenějším antikoagulačním lékům warfarinu a heparinu, tak k novým přípravkům. Hodnota ETP v případě warfarinu negativně koreluje s mezinárodním normalizovaným poměrem (INR) (40). Citlivost vyšetření byla potvrzena i u nefrakcionovaného heparinu nízkomolekulárních heparinů (41, 42).
U zmíněných antikoagulačních léků byla zaznamenána signifikantní variabilita v generaci trombinu u pacientů se stejným INR resp. aPTT či anti-FXa. Nabízí se zde do budoucna využití monitorování generace trombinu u antikoagulovaných pacientů s krvácivými nebo trombotickými komplikacemi v případech, kdy jsou výsledky konvenčních testů v terapeutickém rozmezí.
Z nových antikoagulačních léků vykazuje generace trombinu citlivost k inhibitorům faktoru Xa (fondaparinux, rivaroxaban), kde byla pozorovaná závislost ve všech parametrech. Obdobné výsledky byly získány u přímých inhibitorů trombinu dabigatranu a argatrobanu. Měření generace trombinu v PRP bylo zkoumáno i u antiagregační léčby aspirinem, clopidogrelem, abciximabem (43). Při této léčbě dochází k prodloužení lag fáze; celková generace trombinu ale ovlivněna není.
Dosavadní zkušenosti z této oblasti poukazují na některé výhody měření trombinové generace oproti tradičním koagulačním testům a pro řadu nových léčebných modalit jsou zatím jedinou možností k laboratornímu posuzování jejich efektu.
Neutralizace antikoagulační terapie
Měření generace trombinu nabízí možnost lepšího posouzení neutralizace léčby warfarinem, nefrakcionovaným i frakcionovaným heparinem pomocí čerstvě zmražené plazmy, koncentrátu protrombinového komplexu, resp. protamin sulfátu či rFVIIa (44). Obdobně je test využitelný k posuzování neutralizace protidestičkové duální léčby pomocí rVIIa u kardiologických pacientů podstupujících implantace stentů či kardiochirurgický výkon (43).
Závěr
Stanovení generace trombinu se jeví jako metoda vhodná k posouzení globální funkce hemostatického systému. Fluorescenční měření generace trombinu je v současnosti již dostupná automatizovaná metoda s přijatelnou intralaboratorní variabilitou. Mezilaboratorní srovnávání zkušeností u hypokoagulačních i hyperkoagulačních stavů ale zatím vykazuje výrazné rozdíly. Vzhledem k chybějící standardizaci vyšetření, existenci řady metodických postupů, nevyhovující interlaboratorní korelaci jde ale stále o metodu experimentální. Zmiňované nevýhody zatím znemožňují realizaci větších multicentrických studií.
Přes uvedené nedostatky se vyšetření generace trombinu do budoucna jeví jako nadějná metoda pro přesnější diagnostiku i monitorování léčby jak hemoragických, tak trombotických komplikací. Možný přínos lze spatřovat v lepším odhadu rizika uvedených stavů a také v možnosti individualizace profylaktických i léčebných přístupů. Slibná je i pro možnost monitorování nových antikoagulačních i antiagregačních léčebných postupů, kde jsou tradiční metody nepoužitelné. Vyšetření generace trombinu by tak mohlo přispět k větší bezpečnosti a ekonomičnosti terapeutických postupů.
Práce byla podpořena granty NS 10319-3/2009 86-14 a NR 9282-3/2007 86-12.
MUDr. Antonín Hluší
751 05 Kokory 401
e-mail: hlusian@fnol.cz
Doručeno do redakce: 27. 10. 2009
Přijato po recenzi: 20. 1. 2010
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek VZDĚLÁVACÍ AKCE IPVZČlánek Zprávy odborných společnostíČlánek Zprávy odborných společnostíČlánek Zprávy odborných společnostíČlánek Zprávy odborných společnostíČlánek VZDĚLÁVACÍ AKCE IPVZČlánek VZDĚLÁVACÍ AKCE IPVZ
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2010 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Výběr z tisku a zprávy o knihách
- Úspěšný odběr periferních krvetvorných buněk u pacientky s chronickou myeloidní leukemií léčenou nilotinibem. Kazuistika
- VZDĚLÁVACÍ AKCE IPVZ
- Recenze knihy „Diferenciální diagnostika plicních infiltrátů a pokroky v léčbě mykotických infekcí u imunokompromitovaných pacientů“ autorského kolektivu vedeného Petrem Cetkovským a Michalem Koubou
- Výběr z tisku a zprávy o knihách
- Výběr z tisku a zprávy o knihách
- Zprávy odborných společností
- Zprávy odborných společností
- Zprávy odborných společností
- Zprávy odborných společností
- In memoriam Za docentem MUDr. Zdeňkem Churým, CSc.
- Vzpomínka na přednostu MUDr. Vladimíra Chudomela, CSc.
- Konsenzuální návrh České lékařské společnosti J. E. Purkyně na novelizaci vyhlášky 185/2009 Sb., o specializačním vzdělávání lékařů
- Konsenzuální návrh České lékařské společnosti J. E. Purkyně
- Globální hodnocení funkce hemostázy – část I. Trombin generační test
- VZDĚLÁVACÍ AKCE IPVZ
- Detekce poškození genu TP53 u pacientů s chronickou lymfocytární leukemií
- Výběr z tisku a zprávy o knihách
- Použití chladicích gelových pouzder při zpracování kmenových buněk
- Léčba relabovaného a refrakterního Hodgkinova lymfomu
- Stručné morfometrické poznámky k heterogenitě lymfocytů periferní krve („minireview“ s vlastními výsledky)
- VZDĚLÁVACÍ AKCE IPVZ
- Vliv vysokodávkované chemoterapie s podporou autologní transplantace kmenových buněk na proliferační a apoptotické vlastnosti plazmatických buněk u mnohočetného myelomu
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba relabovaného a refrakterního Hodgkinova lymfomu
- Globální hodnocení funkce hemostázy – část I. Trombin generační test
- Detekce poškození genu TP53 u pacientů s chronickou lymfocytární leukemií
- Stručné morfometrické poznámky k heterogenitě lymfocytů periferní krve („minireview“ s vlastními výsledky)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



