-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výroba transfuzních přípravků, kontrola jakosti
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 3 - Supplementum, p. 32-38.
045 Edukační přednáška
SPEKTRUM TRANSFUZNÍCH PŘÍPRAVKŮ A JEJICH JAKOST
Procházková Renata
Transfuzní oddělení, Krajská nemocnice Liberec, a.s.
Úvod: Požadavky na hemoterapii, resp. její jakost se historicky vyvíjely v souladu s vývojem medicínského poznání. První historicky doložený krevní převod provedl Robert Lower v Oxfordu, první převod lidské krve uskutečnil v roce 1816 J. Blundel. Až ve 20. století došlo k řadě objevů, které zásadním způsobem ovlivnily rozvoj transfuzního lékařství. Zásadní přelom znamenal objev krevních skupin (Karel Landsteiner 1901, Jan Janský 1907) a objev RhD antigenu v roce 1941. Nomenklatura krevních skupin A, B, AB, 0 je používána od roku 1921. Mezi další klíčové objevy patří použití citronanu sodného jako antikoagulační látky (1915) a objev roztoku ACD, který umožnil skladovat odebranou krev 21 dnů, vývoj plastických hmot pro výrobu krevních vaků a vývoj uzavřených souprav pro odběr a zpracování odebrané krve na jednotlivé krevní složky (1, 2). Druhá polovina 20. století přinesla vyšetření infekčních markerů, deleukotizaci, ozáření a promývání transfuzních přípravků (TP). Hemoterapie se tak vyvinula z původní aplikace plné krve k dnešní komponentové terapii, kterou hradíme deficit anebo poruchu funkce jednotlivých krevních složek. Základním předpokladem pro terapeutické použití krve a krevních složek je jejich zachování v nesrážlivém stavu, zachování funkce krevních buněk a plazmy a sterilita. Krev a její složky se odebírají do antikoagulačních roztoků, jejichž základním činidlem je citronan sodný. Pro zachování funkce krevních buněk se používají aditivní roztoky, které podporují zachování jejich látkové přeměny a umožňují relativně dlouhé skladování buněčných krevních složek. Tyto roztoky obsahují glukózu (substrát pro výživu erytrocytů), adenin (substrát pro tvorbu adenosintrifosfátu (ATP), manitol pro stabilizaci buněčné membrány, kyselinu citronovou a fosforečnan sodný pro zajištění optimální hodnoty pH (3).
Cílem hemoterapie je docílení optimálního terapeutického účinku, s minimalizací možných nežádoucích efektů aplikace TP. Předpokladem je proto TP se standardizovaným obsahem účinné látky, minimalizovanou buněčnou kontaminací a zachovanou funkcí. V praxi jsou sledovány parametry jakosti určené Vyhl. 143/2008 Sb. (4). Povinné parametry jakosti jsou vyšetřovány u všech odebraných jednotek – imunohematologické parametry a vyhledávací testy na krví přenosné infekční choroby (HBsAg, anti-HCV-Ab, HIV Ab/A a TPHA). Vývoj metod pro stanovení virových markerů přinesl výrazné zkrácení tzv. infekčního okna (období po nákaze, kdy známka infekce v krvi není přítomna) z několika týdnů na několik dnů. V posledních letech věda přinesla testy na bázi molekulární biologie (PCR metodiky), které detekují přímo virovou DNA či RNA. Ani negativní výsledky těchto testů nezaručují 100% bezpečnost TP. V České republice nejsou zatím povinné a rutinně se neprovádějí. Namátkové kontroly jakosti slouží pro kontrolu procesu výroby v ZTS. Hodnocen je obsah účinné látky: u RBC obsah hemoglobinu a hematokrit, u PLT jejich počet v transfuzní jednotce (TU), u plazmy obsah faktoru VIII a celkové bílkoviny. Dále se sleduje buněčná kontaminace přípravků a sterilita. Počet kontrol musí odpovídat kvantitě výroby na ZTS (5).
Pro účely validací nových procesů je doporučováno hodnocení markerů metabolického stavu krevních buněk. Struktura a funkce krevních buněk jsou ovlivněny řadou faktorů, počínaje technikou odběru, složením antikoagulačního roztoku, kontaktem s povrchem odběrového vaku či setu, metodou zpracování a obsahem leukocytů v produktu či způsobem leukodeplece (6, 7, 8, 9, 10). Metabolické a morfologické alterace u erytrocytů i trombocytů v koncentrátech limitují jejich skladovatelnost a mohou asociovat se snížením potransfuzní recovery in vivo (11, 12). Některé z těchto změn jsou reverzibilní a jiné ne (10). Morfologické změny se projevují u PLT změnou diskoidního tvaru ve sférický, pro RBC je typická změna diskoidního tvaru ve sférocyt či echinocyt. Metabolické alterace krevních buněk se odráží ve změnách pH, zvýšení LDH v supernatantu, v konsumpci glukózy a produkci laktátu. Dochází k externalizaci phosphatidylserinu na povrch buněčné membrány, u trombocytů navíc k expresi markerů aktivace. Za moderní marker jakosti TP je považován annexin V, globální marker apoptózy (13, 14, 15). Jde o intracelulární glykoprotein, který je v buňkách fyziologicky obsažen v cytosolu a organelách. Jeho zvýšená plazmatická hladina je v přímé relaci se stupněm buněčného poškození. Stav krevních buněk významně ovlivňuje obsah leukocytů v přípravku. Snížení obsahu leukocytů časnou leukodeplecí snižuje uvolnění většiny na leukocyty vázaných cytokinů (zvl. IL-1β, IL-6, IL-8, RANTES) a intracelulárních enzymů, které mohou indukovat poškození krevních buněk během skladování a být příčinou nehemolytických febrilních potransfuzních reakcí (16, 17). Změnou specifickou pro trombocyt je aktivace. K aktivaci destičky dochází také během procesu přípravy PLT koncentrátu a je spojena se snížením metabolické aktivity trombocytu během skladování. Aktivace trombocytu je spojena s morfologickým a funkčními změnami, zejména s degranulací vnitřních granulárních struktur trombocytu, které vedou k povrchové expresi makromolekul lokalizovaných původně intracelulárně v granulích destiček. Jednou z nich je P-selektin (CD62P), jehož povrchová detekce je průkazem degradace alfa-granulí (11). Zvýšení jeho exprese koreluje se vzestupem annexinu V a poklesem pH (při pH < 6,2 dochází k irreverzibilní expresi CD62P).
V běžné praxi se ke kontrole funkce TP používají jednoduché testy in vitro, jako je stanovení stupně hemolýzy u koncentrátů RBC, pH a „swirling“ fenomén u koncentrátů PLT (5, 18). Pro procesní validaci nových postupů je přínosné použití testů reflektujících změny v buněčné morfologii, biochemickém stavu buněk, kvantifikaci buněčných mikropartikulí, expresi markerů aktivace či externalizace phosphatidyserinu na buněčné membráně (10). Ne všechny mechanismy, které vedou k poškození krevních buněk, jsou plně objasněny a pochopeny. Jsou v současné době předmětem intenzivního studia.
S vývojem medicínského poznání se požadavky na jakost TP neustále zvyšují. Současnými trendy jsou např. opatření k prevenci TRALI, TA-GvHD, zavádění patogenní inaktivace PLT koncentrátů a plazmy, implementace PCR metodik do povinných vyšetření infekčních markerů apod. Ve dnech 24.–25. 4. 2009 na symposiu „Optimal Clinical Use of Blood Components“ ve Wildbad-Kreuth v SRN, kde byli i zástupci ČR, proběhlo poslední přehodnocení vývoje v této oblasti na evropské úrovni a byla zde formulována nová doporučení. Je však třeba konstatovat, že ne všechna doporučení jsou v České republice, kde dosud neproběhla reorganizace transfuzní služby, realizovatelná, ať již z organizačních či ekonomických důvodů.
Transfuzní přípravky, přehled a charakteristika
Transfuzní přípravky jsou získávány klasickými odběry plné krve a jejím následným zpracováním anebo aferetickými technikami. Vždy jsou minimálně buněčně kontaminované a nejsou protivirově ošetřené. Plná krev (PK) v současné době nemá racionální indikační oprávnění. Přípravek neobsahuje funkční leukocyty ani trombocyty, zůstává však jejich antigenicita a s ní související nežádoucí účinky. PK je proto nahrazována TP, které hradí určitou chybějící složku krve s co nejmenší příměsí složek ostatních (RBC a PLT koncentráty, čerstvě zmražená plazma).
I. Erytrocytární koncentráty
jsou TP získané z odběru plné krve, s následným odstraněním plazmy nebo aferetickým odběrem. Základní zpracování je rozšířeno o odstranění vrstvy buffy-coatu, o přidání resuspenzního roztoku, případně o deleukotizaci, promytí či ozáření RBC koncentrátu. Přehled v současnosti používaných RBC koncentrátů a jejich základní parametry jakosti uvádí tabulka 1.
Tab. 1. Erytrocytární koncentráty. 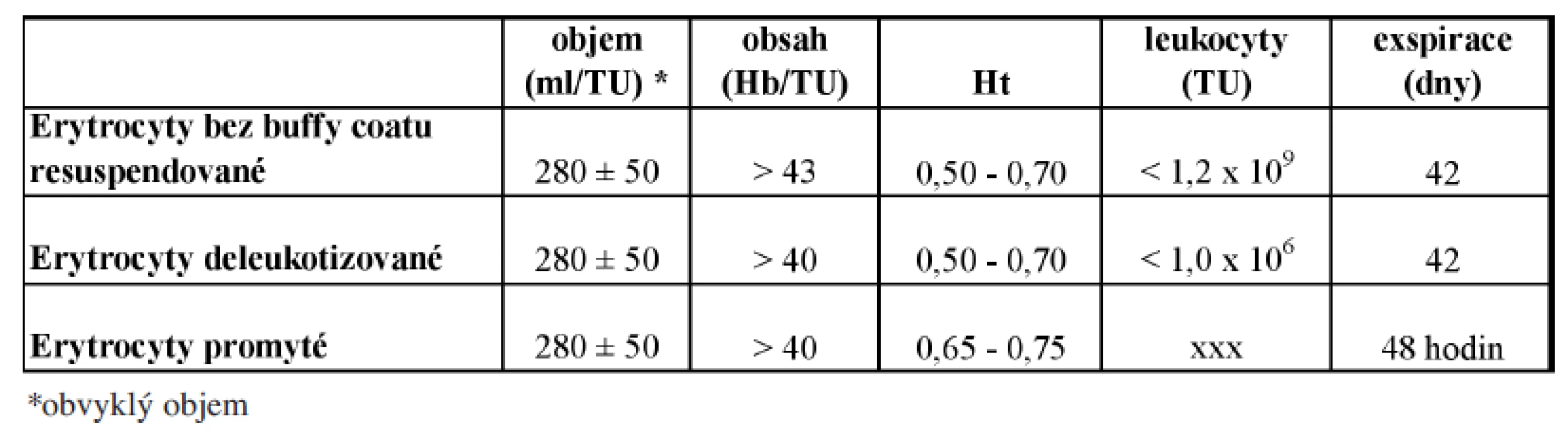
Erytrocyty bez buffy-coatu resuspendované: jde o nejčastěji používaný RBC koncentrát resuspendovaný do aditivního roztoku, s významně redukovaným imunosupresivním účinkem a sníženým rizikem senzibilizace leukocyty (docílenoodstraněním buffy-coatu).
Erytrocyty deleukotizované: odstranění většiny leukocytů z RBC či PK významně zvyšuje jakost TP, který nemá imunosupresivní účinky, nesenzibilizuje proti leukocytům, je minimalizováno až vyloučeno riziko přenosu cytomegaloviru a dalších nediagnostikovaných virů s možnou inkorporací v leukocytech.
Optimální je včasné odstranění leukocytů ihned po odběru (tzv. prestorage), které minimalizuje nežádoucí účinky, které mohou být způsobeny uvolněním substancí z rozpadajících se leukocytů. Ve většině států EU je možné používat pouze tento typ RBC koncentrátů. Univerzální prestorage leukodeplece RBC koncentrátů je jedním z doporučení z Wildbad-Kreuth.
Erytrocyty promyté se připravují následným promytím RBC koncentrátů fyziologickým roztokem uzavřeným systémem. Tímto postupem jsou z koncentrátu odstraněny bílkoviny plazmy, maximální množství bílkoviny je 0,5 g/TU. Indikovány jsou u pacientů po opakovaných těžkých alergických potransfuzních reakcích a u pacientů s protilátkami proti bílkovinám krevní plazmy (např. anti-IgA).
Kryokonzervované RBC jsou skladované při teplotě -80 °C. Po rozmrazení jsou proprané a resuspendované ve vhodném aditivním roztoku určeny k bezprostřednímu podání. Lze jimi zajistit dostupnost transfuzní léčby pro pacienty s vysokým rizikem tvorby antierytrocytárních protilátek, případně již s vytvořenými, jejichž specificita znemožňuje použití běžného TP.
Ozářené RBC koncentráty
Ozáření TP je prevencí GvHD, závažné komplikace způsobené transfuzí. Gama záření v dávce 25–30 Gy způsobí devitalizaci lymfocytů a tím zamezí proliferaci imunokompetentních lymfocytů přítomných v krevním produktu. RBC koncentráty musí být ozářeny do 2 týdnů ode dne odběru, po ozáření se exspirace zkracuje na 14 dnů. Indikace uvádí tabulka 3.
Tab. 2. Indikace ozářených erytrocytárních koncentrátů. 
Fyziologická funkce erytrocytů a vliv skladování
Funkcí erytrocytů je přenos hemoglobinu, složky odpovědné za transport respiračních plynů v plicích, krvi a tkáních. Za 2–24 hodin po transfuzi 1 TU RBC lze u pacienta očekávat zvýšení hladiny Hb o 10 g/l (Ht o 3–4 %). Erytrocyty přežívají v oběhu 110–120 dnů, protože RBC koncentrát obsahuje erytrocyty různého stáří, průměrné přežití transfundovaných erytrocytů je cca 58 dnů (19). Pro RBC v koncentrátu je specifická redukce obsahu 2,3-difosfoglycerátu (2,3-DPG) vedoucí ke snížení schopnosti uvolnit O2 do mikrocirkulace (10, 20). Obsah 2,3-DPG v erytrocytech se může po transfuzi obnovit (50–70 % za 1 den, plně za týden) (10). Nepřímý efekt zvýšení hladiny dalších mediátorů (např. intracelulární Ca2+) vede k buněčné dehydrataci, vzniku mikrovesikulací a ztrátě intracelulárního K+ (21). K normalizaci intracelulárního K+ dojde během několika hodin po transfuzi.
Skladování RBC koncentrátů je nutné při kontrolované skladovací teplotě v rozmezí 2–6 °C, po výdeji jsou přípravky určeny k okamžitému použití, mimo krevní banku nesmí být skladovány. Doba použitelnosti závisí na použitém antikoagulačním a additivním roztoku, je vždy schválena pro daný systém (obvykle 35–42 dnů). Údaj o době použitelnosti musí být vyznačen na štítku přípravku. Transport mimo krevní banku musí být zajištěn v izolačních termoboxech tak, aby byla zajištěna teplota 4 ± 2 °C.
RBC koncentráty jsou indikovány k léčbě anémie a akutních krevních ztrát, deleukotizované koncentráty viz tabulka 2.
Tab. 3. Indikace deleukotizovaných erytrocytárních koncentrátů 
Mezi možné nežádoucí účinky podání patří oběhové přetížení, hemolytické potransfuzní reakce, nehemolytické potransfuzní reakce, aloimunizace proti HLA a erytrocytovým antigenům, možný přenos syfilis, pokud byl tento přípravek uchováván při teplotě 4 °C méně než 96 hodin, přenos virů (hepatitidy, HIV apod.) je možný bez ohledu na pečlivý výběr dárců a screeningová vyšetření, vzácně přenos protozoí (např. malárie), sepse způsobená náhodnou bakteriální kontaminací, biochemické odchylky při masivní transfuzi (např. hyperkalemie), potransfuzní purpura, akutní poškození plic vyvolané transfuzí (TRALI), TA – GvHD, přenos infekcí, které nejsou testovány nebo známy.
II. Trombocytární koncentráty
jsou TP získané z plné krve anebo technikou aferézy, které obsahují stanovené množství trombocytů v terapeuticky účinné formě. V průběhu přípravy či následně mohou být ošetřeny deleukotizací, ozářením, méně často promytím.
Z jednoho odběru plné krve lze připravit v závislosti na metodě přípravy trombocyty z buffy-coatu či plné krve (TP obsahuje trombocyty v množství > 45 x 109/TU, průměrně 60–70 x 109/TU) a leukocyty < 0,05 x 109/TU. Trombocyty z buffy-coatu směsné deleukotizované jsou směsí několika TU (od 4–6 dárců) trombocytů z buffy-coatu s následnou deleukotizací. Přípravek obsahuje trombocyty v množství > 200 x 109, leukocyty < 1 x 106/TU.
Současným trendem je příprava poolovaných PLT koncentrátů v aditivních roztocích. Výhodou je mimo jiné odstranění zbytkové plazmy (prevence TRALI), deleukotizace prestorage a snížení možné bakteriální kontaminace přípravku.
Trombocyty z aferézy se získávají odběrem na krevním separátoru od jednoho dárce. Přípravek obsahuje trombocyty v terapeuticky účinné formě > 200 x 109/TU nebo 300 x 109/TU (množství vyznačeno na štítku přípravku). Trombocyty z aferézy deleukotizované: Trombocyty z aferézy jsou deleukotizovány dle typu přístroje buď průběžnou filtrací, nebo leukoredukčním systémem. Obsah leukocytů je < 1,0 x 106/TU. Současným trendem je univerzální deleukotizace PT koncentrátů prestorage.
V rámci prevence TRALI by měly být aferetické PLT koncentráty odebírány u dárců/dárkyň bez anamnézy transfuze a u dárkyň bez anamnézy gravidity, případně po vyšetření anti-HLA protilátek v uvedených případech (22).
Ozářené PLT koncentráty
Význam a indikace jsou stejné jako u RBC koncentrátů, doba skladování se ozářením nemění.
PLT koncentráty se skladují při teplotě 20–24 °C za stálého šetrného míchání ve validovaném zařízení. Po výdeji by měly být co nejdříve podány.
Doba použitelnosti je standardně 5 dnů. Prodloužení na 7 dnů je možné při negativním výsledku bakteriologického vyšetření nebo po ošetření patogenní inaktivací. V zemích Evropy, kde je patogenní inaktivace standardně prováděna (např. Norsko), nahrazuje současně i ozáření PLT koncentrátů.
PLT koncentráty jsou indikovány u trombocytopenií či trombocytopatií s klinicky významným krvácením nebo podezřením na něj, deleukotizované PLT koncentráty mají obdobnou indikaci jako deleukotizované RBC koncentráty.
RhD negativním ženám ve fertilním věku by v případě nutnosti aplikace trombocytů RhD pozitivních měl být podán specifický imunoglobulin anti-RhD v dávce 150–300 μg (obsah erytrocytů cca 3 x 109/TU nelze vyloučit) (19).
Možné nežádoucí účinky: jako u RBC, navíc refrakterita k léčbě PLT koncentráty (je definována jako opakované selhání očekávaného vzestupu trombocytů při opakované transfuzi AB0 – kompatibilních, max. tři dny starých koncentrátů. Nejčastější příčinou imunní refrakterity jsou protilátky proti HLA antigenům I. třídy, které v 15–30 % mohou být asociovány s výskytem HPA protilátek (19)).
III. Plazma pro klinické užití
a) Jedná se obvykle o TP z jednoho odběru plné krve (P) nebo z aferézy (PA), zamražený co nejdříve na takovou teplotu, aby byly zachovány labilní koagulační faktory ve funkčním stavu. Přípravek obsahuje plazmu s normální hladinou stabilních koagulačních faktorů, inhibitorů koagulace, albuminu a imunoglobulinů a minimálně 70 % množství F VIII a alespoň stejné množství ostatních labilních koagulačních faktorů. 1 TU má objem cca 260 ± 40 ml, obsahuje erytrocyty max. 6 x 109/l, leukocyty max. 0,1 x 109/l, trombocyty < 50 x 109/l a antikoagulační roztok. Ke klinickému použití je přípravek uvolněn po šestiměsíční karanténě (u dárce musí být provedeno opakované vyšetření infekčních markerů a výsledky musí být shledány negativní).
V rámci prevence TRALI by měla být klinická plazma vyráběna z odběrů od dárců/dárkyň bez anamnézy transfuze a od dárkyň bez anamnézy gravidity, případně po vyšetření anti-HLA protilátek s anamnézou v uvedených případech (22).
Leukodeplece plazmy není doporučována.
Plazma se skladuje při teplotě -25 °C a nižší (doba použitelnosti 36 měsíců), 3 měsíce při teplotě -18 až -25 °C.
Před použitím je přípravek třeba rozmrazit při kontrolované teplotě, ověřit neporušenost obalu, po rozmrazení by neměla být patrná přítomnost kryoproteinu. Rozmrazený přípravek je třeba aplikovat do cca 6 hodin (dle některých zdrojů i po delší době), nelze jej již znovu zamrazit.
Plazma je indikována u koagulačních poruch, kde dochází ke kombinovanému deficitu koagulačních faktorů, u trombotické trombocytopenické purpury, výjimečně při nedostupnosti koncentrátů koagulačních faktorů. Zmrazená lidská plazma není indikována k pouhé úpravě objemového deficitu a tam, kde je k dispozici alternativní výrobek, v němž byly inaktivovány viry, nevhodná je u pacientů s nesnášenlivostí proti plazmatickým bílkovinám.
Možné nežádoucí účinky: viz RBC koncentráty, navíc citronanová toxicita při rychlé transfuzi velkých objemů.
b) V řadě zemí EU se používá plazma ošetřená patogenní inaktivací, ať již v zařízeních transfuzní služby či komerčně (např. Solvent-detergent-treated plasma, Methyleneblue-photoinactivated plasma). Indikační kritéria jsou obdobná, skladovací podmínky odpovídají způsobu ošetření plazmy.
IV. Granulocytární koncentráty (GK)
GK jsou odebírány technikou aferézy od zdravých dárců po přípravě kortikoidy a/nebo granulocytárními růstovými faktory. K lepší separaci granulocytů od erytrocytů v průběhu aferézy se používá sedimentační činidlo, nejčastěji 6% hydroxyethylškrob.
GK musí obsahovat množství funkčních granulocytů, odpovídající váze nebo tělesnému povrchu příjemce. Vzhledem k autolytické tendenci granulocytů ex vivo je nutno GK aplikovat co nejdříve po přípravě, maximální doba skladování je 24 hodin při pokojové teplotě.
Pro vysokou příměs erytrocytů je nutno GK aplikovat AB0 a RhD kompatibilní. Je nutné provést předtransfuzní vyšetření a test leukocytární kompatibility. GK musí být před aplikací ozářeny dávkou 30 Gy v rámci prevence fatální GvHD. V případě nutnosti aplikace RhD pozitivních GK RhD negativním ženám by měl být profylakticky podán anti-D Ig (10 μg anti-D/mL erytrocytárního sedimentu). Aplikace GK je provázena refrakteritou ve 20–30 % v případě iatrogenní neutropenie, u pacientů s aplastickou anémií až v 80 %.
Mimo výše uvedené transfuzní přípravky se samozřejmě používají i další. Jedná se zejména o specifické TP připravované pro intrauterinní, výměnné či novorozenecké transfuze, dále krryoprotein, případně K plazmu a další.
Literatura
- Hrubiško M, Dobrý E. Základy hemoterapie. Osveta, 1974; 5 –16.
- Gašová Z. Od odběrů plné krve k multikomponentnímu dárcovství – editorial. Vnitř Lék 2005; 51 : 274 – 275.
- Sakalová A, Lipšic T. Hematológia a transfuziologia, Teória. Osveta, Martin, 1995.
- Vyhl. 143/2008 Sb. o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidské krve a jejích složek (vyhláška o lidské krvi).
- Guide to the preparation, use and quality assurance of blood components. 12th ed. Strasburg, Council of Europe Publishing, 2006.
- Gemmell Ch. Activation of platelets by in vitro whole blood contact with materials: increases in microparticle, procoagulant activity and soluble P – selectin blood levels. J. Biomater Sci Polym Ed 2001; 12 : 933–943.
- Gullikson H. Platelet storage media. Transfus Apher Sci 2001; 24 : 241–244.
- Runkel S, Bach J, Anders C, et al. The impact of two whole blood inline filters on markers of coagulation, complement and cell activation. Vox Sanq 2005; 88 : 17–21.
- Seghatchian J, Krailadsiri P. The platelet storage lesion. Transfus Med Rev 1997; 11 : 130–144.
- Solheim BG, Flesland O, Seghatchian J, et al. Clinical implications of red blood cell and platelet storage lesions: an overview. Transfus Apher Sci 2004; 31 : 185–189.
- Curvers J, van Pampus ECM, Feijge MAH, et al. Decreased responsiveness and development of activation markers of PLTs stored in plasma. Transfusion 2004; 44 : 49–58.
- Perrotta PL, Perrotta ChL, Snyder EL. Apoptotic activity in stored human platelets. Transfusion 2003; 43 : 526–535.
- Seghatchian J, Krailadsiri P. Red cell storage lesion assesed by the levels of potassium, hemoglobin and annexin V in supernatantant. Transfus Apher Sci 2002; 26 : 121–127.
- Tzima E, Walker JH. Platelet annexin V: the ins and outs. Platelets 2000; 11 : 245 – 251.
- Gutensohn K, Alisch A, Geidel K, et. al. Annexin V and platelet antigen expression is not altered during storage of platelet concentrates obtained with AMICUS cell separator. Transfus Sci 1999; 20 : 113–120.
- Lin SJ, Tzeng CH, Hao HY, et al. Cytokine release in febrile non-haemolytic red cell transfusion reactions. Vox Sanq 2002; 82 : 156–160.
- Seghatchian J, Krailadsiri P, Dilger P, et al. Cytokines as quality indicators of leucoreduced red cell concentrates. Transfus Apher Sci 2002; 26 : 43–46.
- Sowemimo-Coker S.O. Red blood cell hemolysis during processing. Transfus Med Rev 2002; 16 : 46–60.
- Cross-sectional guidelines for therapy with blood components and plasma derivates. German Medical Assotiation, 2009.
- Llohn A, Vetlesen A, Fagerhol MK, et al. The effect of pre-storage cooling on 2,3-DPG levels in red cells stored in SAG-M. Transfus Apher Sci 2005; 33 : 113–118.
- Bessos H, Seghatchian J. Red cell storage lesions: The potential impact of storage –induced CD47 decline on immunomodulation and the surfoval of leucofiltered red cells. Transf Apher Sci 2005; 32 : 227–232.
- Bierling P, Bux J, Curtis B, et al. Recommendations of the ISBT Working Party on Granulocyte Immunobiology for leukocyte antipody screening in the investigation and prevention of antibody – mediated transfusion – related acute lung Indry. Vox Sanq 2009; 96 : 266–299.
046
SROVNÁVACÍ UŽIVATELSKÁ STUDIE ODBĚROVÝCH SOUPRAV S IN-LINE DELEUKOTIZAČNÍM FILTREM ERYTROCYTŮ
Bohoněk M., Kostrouchová B., Staropražská V.
Oddělení hematologie, biochemie a krevní transfuze, Ústřední vojenská nemocnice Praha
Úvod: Vzhledem k zavádění paušální výroby deleukotizovaných erytrocytárních přípravků jsme provedli srovnávací studii vybraných kvalitativních parametrů a uživatelských parametrů některých odběrových souprav s in-line deleukotizací dostupných na českém trhu.
Materiál a metodika: Do studie byly zařazeny tyto soupravy s deleukotizačním filtrem zařazeným za vak s odseparovanými erytrocyty: Leukotrap RC T&B (Pall Medical, Ref.000071100), Leucoflex (Macopharma, Ref. 410708624), OptiPure RC (Baxter/Fenwal, Ref., 08D15L02) a jako srovnávací systém laboratorní filtr PALL BPF4 (PALL Medical, Ref.0850404).
Hodnoceny byly tyto parametry: ztráta hemoglobinu během filtrace (v g/TU a v %), reziduální leukocyty, stupeň hemolýzy v den filtrace (D0), na konci doby skladování (D42) a po době použitelnosti (D49), biochemická analýza (pH, LDH, K, P, Glu) prováděná v den filtrace (D0), dále 42. a 49. den (D42, D49). Hodnocení uživatelského komfortu bylo provedeno pouze u souprav s in-line filtrací. Pro účely studie bylo celkem odebráno 62 plných krví, ve všech parametrech bylo testováno 44 vyrobených TU ERD.
Výsledky: viz tabulka 1 – Kvalitativní parametry
Tabulka 1 - Kvalitativní parametry. 
Závěr: Všechny odběrové soupravy vyhověly předepsaným parametrům kvality a testované odběrové soupravy s in-line deleukotizací vykazovaly obdobné výsledky ve všech zkoušených ukazatelích. Studie nicméně prokázala vyšší účinnost laboratorních filtrů, v daném případě PALL BPF4ARBL, stejně jako menší ztrátu Hb v průběhu filtrace, ve srovnání s in-line filtrací v rámci odběrové soupravy. Co se týče uživatelských vlastností, byly nejlépe hodnoceny soupravy OptiPure RC Baxter/Fenwal.
047
TROMBOCYTY V NÁHRADNÍCH ROZTOCÍCH VE FN BRNO
Tesařová E., Pacasová R., Michlíčková S.
Transfuzní oddělení a krevní banka Fakultní nemocnice Brno
Úvod: Léčba trombocyty představuje ve Fakultní nemocnici Brno velmi významnou část hemoterapie zároveň s konstatováním, že v průběhu posledních let dochází k jejímu výraznému kvantitativnímu nárůstu, zejména s ohledem na dlouhodobou úspěšnost léčby pacientů s onkologickými diagnózami, lymfomy a leukemie, nevyjímaje. S ohledem na výše uvedené a s ohledem na ostatní faktory, jakými jsou limitovaný počet dárců krve v aferetickém registru FN Brno, limity pracovní doby pracovníků TO a KB FN Brno, limity stanoveného rozpočtu TO a KB FN Brno, požadavek na zvýšení produkce aferetické plazmy k frakcionaci a dostupná nabídka náhradních roztoků pro skladování trombocytů na českém trhu, výrobce v průběhu roku 2008 standardizoval produkci, zvýšil jakost transfuzních přípravků a zároveň snížil finanční náklady v řádu milionů korun.
Metodika: Standardizace produkce byla zajištěna cestou výroby dvou až tří terapeutických dávek trombocytů procesem jedné aferézy na separátorech TRIMA ACCEL, za současného zvýšení jakostních parametrů přípravků zvýšením obsahu účinné složky a snížením obsahu kontaminujících leukocytů, zároveň s omezením spektra vyráběných trombocytů pouze na jejich deleukotizovanou formu metodou prestorage deleukotizace, resp. elutriace. Snížení finančních nákladů bylo dosaženo nahrazením přibližně jedné třetiny trombocytů získaných aferézou, trombocyty směsnými, získaných z odběrů plné krve v náhradních roztocích (T-sol, resp. Composol).
Výsledky: V roce 2008 došlo k nárůstu výroby trombocytů ve FN Brno o 35 % ve srovnání s obdobím roku 2007. V roce 2007 bylo ve FN Brno vyrobeno 4874 terapeutických dávek trombocytů, v roce 2008 pak 6587 dávek. Přesto, že počet terapeutických dávek meziročně vzrostl o 35 %, přímé finanční náklady na výrobu trombocytů se podařilo snížit z 21,6 milionů Kč v roce 2007 na 19,4 miliony Kč v roce 2008, což představuje relativní úsporu nákladů v celkovém finančním objemu 9,8 milionů Kč, absolutní úsporu pak 2,2 miliony Kč. Zatímco produkce trombocytů roku 2007 byla deleukotizována post-storage ve 38 %, k výrobě bylo použito 4075 separačních setů a bylo odebráno 4075 dárců krve, produkce trombocytů v roce 2008 byla deleukotizována pre storage v 84 % za použití 3056 separačních setů u 3056 dárců krve. Počet trombocytů v jedné terapeutické dávce v roce 2007 činil v průměru 2,21 x 1011, v roce 2008 činil 2,46 x 1011. Za významný úspěch autoři považují skutečnost, že relativní četnost výskytu potransfuzních reakcí po trombocytech se podařilo snížit na polovinu, u trombocytů v náhradních roztocích na čtvrtinu.
Závěr: Díky výsledkům, kterých se podařilo v roce 2008 ve FN Brno dosáhnout, autoři plánují zahájení výroby trombocytů z aferézy v náhradních roztocích a režim úprav pro zvaní dárců k odběru plné krve tak, aby bylo možné maximum buffy-coatů z odběrů plné krve využít pro výrobu trombocytů.
048
NAŠE ZKUŠENOSTI S PŘÍPRAVOU TRANSFUZÍ URČENÝCH PRO PRENATÁLNÍ A NEONATÁLNÍ PODÁNÍ
Dušková D.1, Březinová H.1, Calda P.2
1FTO VFN v Praze, 2Gyn.-por. klinika VFN v Praze
Jeden z nejdůležitějších aspektů transfuzního lékařství je prevence, indikace a léčba hemolytického onemocnění plodu a novorozence (HON).
HON mohou způsobit pouze klinicky významné antierytrocytární protilátky, tedy takové, které jsou schopné destruovat erytrocyty plodu. Tyto protilátky jsou většinou imunoglobuliny typu G (IgG) reagující při 37 °C. Ženy tvoří tyto protilátky buď v důsledku předchozí transfuze, těhotenství, nebo obojího. Proto je hlavním důvodem prenatálního screeningu identifikace tohoto typu protilátek. Při správném screeningu můžeme včas odhalit počínající HON a díky tomu včas zahájit léčbu podáním intraumbilikální transfuze (IUT).
V našem příspěvku chceme prezentovat naše mnohaleté zkušenosti s výrobou intraumbilikálních a výměnných transfuzí a tím dokumentovat, že jejich příprava má dnes již své stabilní místo v rutinních procesech zařízení transfuzní služby.
049
STANOVENÍ POČTU TROMBOCYTŮ V TRANSFUZNÍCH PŘÍPRAVCÍCH RŮZNÝMI HEMATOLOGICKÝMI ANALYZÁTORY (MULTICENTRICKÁ STUDIE)
Kolomý V.1, Fátorová I.2, Hošková J.2, Pavlíková Z.2, Baťková Z.2, Řeháček V.3, Schlesinger P.4
1CaridianBCT, 2II interní klinika – Oddělení klinické hematologie, LF UK a FN Hradec Králové, 3Transfuzní oddělení, Fakultní nemocnice a Lékařská fakulta UK Hradec Králové, 4Ústav formální a aplikované lingvistiky, Matematicko-fyzikální fakulta UK Praha
Tato práce navazuje na předcházející studii provedenou ve FN Hradec Králové, ve které jsme sledovali, jak hematologický analyzátor ovlivňuje výslednou hodnotu počtu trombocytů v transfuzním přípravku. Tehdy bylo posuzováno 6 různých analyzátorů. Některé z nich i přes správnou kalibracipočet trombocytů trvale podhodnocovaly, jiné naopak trvale nadhodnocovaly. Nebylo však jasné, zda to je charakteristická vlastnost určitého typu hematologického analyzátoru.
Cíl práce: V této studii jsme chtěli zjistit, zda se takto chovají všechny analyzátory určitého typu, nebo pouze jednotlivé přístroje. Posuzovány byly následující analyzátory: Abbott Cell Dyne 3200 (3), Nihon KohdenCelltac Alfa (2), Nihon Kohden Celltac F (5), Beckman Coulter LH750 (4), Sysmex XE 2100 - impedančně (4) a Sysmex XE 2100 – opticky (3). Celkem tedy 21 přístrojů v 10 laboratořích.
Metoda: 20 různých vzorků trombocytů z aferézy (TA) a 4 vzorky plné krve (PK) byly odebrány do K3EDTA. Vzorky TA byly naředěny 5% albuminem v poměru 1 : 2. Potom byl každý vzorek rozplněn po 2 ml do 10 zkumavek a všechny vzorky byly večer rozvezeny do zúčastněných laboratoří. Druhý den ráno ve stejnou dobu byly všechny vzorky změřeny na všech přístrojích. Pro každý transfuzní přípravek a pro každý analyzátor byla vypočítána hodnota TN/K, kde
TAN hodnota počtu trombocytů (koncentrace) v N-tém transfuzním přípravku
TAN mean střední hodnota počtu trombocytů v TA z měření na všech 21 přístrojích
PKN hodnota počtu trombocytů v N-tém vzorku plné krve
PKN mean střední hodnota počtu trombocytů plné krve z měření na všech 21 přístrojích
Výsledky: V grafu jsou vyznačeny hodnoty TN/K (medián, mezikvartilové rozpětí, minimum, maximum a odlehlé hodnoty) pro každý analyzátor z 20 měření. Čím je hodnota vyšší než 1,0, tím více byl počet trombocytů nadhodnocován, a naopak.
Závěr: Z výsledků je patrné, že podhodnocování či nadhodnocování počtu trombocytů v transfuzních přípravcích je vlastnost určitého typu hematologického analyzátoru. Ale i mezi analyzátory stejného typu se našel přístroj, který se choval odlišně – viz CD 3200 a Celltac F. Nezáleží tedy pouze na typu, ale také na jednotlivém kusu a jeho technickém stavu. Předcházející studie zmíněná v úvodu totiž také ukázala, že technický stav přístroje uvedenou vlastnost může ovlivnit. Z uvedených výsledků ale nelze posoudit, který typ analyzátoru měří počet trombocytů v TA správně (a naopak), protože ve studii nebyla použita jiná (referenční) metoda. Uvedenou vlastnost nelze eliminovat jinak, než přizpůsobením výroby TA nastavením krevního separátoru. Při podhodnocování je nutné „vyrobit více“, při nadhodnocování naopak snížit koncentraci trombocytů, aby nebyl překročen limit 1,5 x 109/ml.
050
ZHODNOCENÍ VYBRANÝCH PARAMETRŮ JAKOSTI TRANSFUZNÍCH PŘÍPRAVKŮ – CELKOVÁ BÍLKOVINA A VOLNÝ HEMOGLOBIN U PROMYTÝCH ERYTROCYTŮ
Řehořová L.
Transfuzní oddělení, Krajská nemocnice Liberec, a.s.
Úvod: Promyté erytrocyty jsou indikovány pro pacienty s protilátkami proti bílkovinám plazmy, zejména s protilátkami anti-IgA a pro pacienty s těžkými alergickými reakcemi po transfuzích. Cílem naší práce bylo retrospektivně zhodnotit jakost promytých erytrocytů za rok 2008 doposud, s akcentem na určení kritických míst při stanovení volného hemoglobinu (Hb) a celkové bílkoviny (CB).
Metoda: Promyté erytrocyty jsou připravovány uzavřeným způsobem dodatečným promytím deleukotizovaných erytrocytárních přípravků fyziologickým roztokem a následným přidáním SAG-Manitolu. Kontrola jakosti byla provedena u všech vyrobených transfuzních přípravků (TP). Celková bílkovina a volný hemoglobin byl měřen na Oddělení klinické biochemie (OKB) naší nemocnice. Stanovení volného Hb bylo provedeno přímou spektrofotometrií na dvoupaprskovém spektrofotometru Shimadzu, stanovení CB na automatickém nefelometru BN ProSpec s kyselinou trichloroctovou, pro zpracování výsledků kontrol jakosti jsme zvolili program Excel ze souboru Microsoft Office a pro statistické hodnocení dat Pearsonův korelační koeficient.
Výsledky a diskuse: Za sledované období bylo zhodnoceno 66 promytých erytrocytů. Celková bílkovina splnila limit 0,5 g / TU u 65 přípravků (medián 0,2 g/TU), jedna jednotka promytých erytrocytů nebyla z důvodu nesplněného limitu (0,7 g/TU) aplikována, opakované promytí fyziologických roztokem se pro tyto ojedinělé případy ukazuje jako možné. V našem případě nebylo provedeno. Vliv promytí na hemolýzu erytrocytů nebyl prokázán, u všech TP bylo % hemolýzy nižší než 0,8 % erytrocytární masy (medián 0,1 %). Byla prokázána korelace mezi koncentrací volného hemoglobinu a koncentrací celkové bílkoviny (r = 0,96).
Závěr: Vyrobené promyté erytrocytární přípravky dosahovaly za sledované období vysokého standardu jakosti. V rámci jejich kontroly jakosti jsme se pokusili o definici kritických míst při laboratorní analýze volného Hb a CB, z našeho pohledu se tak jeví výběr speciální metody pro stanovení nízkých hodnot CB.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Dárcovské a léčebné aferézyČlánek Krví přenosné chorobyČlánek ImunohematologieČlánek Sekce v angličtiněČlánek Sekce nelékařských profesíČlánek Dárcovství, hemovigilanceČlánek HemoterapieČlánek Sekce v angličtiněČlánek PosteryČlánek Rejstřík autorů
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2009 Číslo 3 - Supplementum- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Transfuzní služba - historie a současnost
- Dárcovské a léčebné aferézy
- Krví přenosné choroby
- Slavnostní Janského přednáška
- Imunohematologie
- Sekce v angličtině
- Sekce nelékařských profesí
- Výroba transfuzních přípravků, kontrola jakosti
- Hemoterapie
- Sekce v angličtině
- Postery
- Rejstřík autorů
- Dárcovství, hemovigilance
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Krví přenosné choroby
- Hemoterapie
- Výroba transfuzních přípravků, kontrola jakosti
- Transfuzní služba - historie a současnost
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





