-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Plazmatické koncentrace solubilního endoglinu mají prognostický význam u nemocných s chronickou lymfocytární leukemií
Plasma levels of soluble endoglin have prognostic significance in patients with chronic lymphocytic leukemia
Angiogenesis has been recently extensively studied in a wide spectrum of hematological malignancies. Endoglin (CD105), member of transforming growth factor beta (TGF-beta) receptor family, modulates cellular responses to TGF-beta and is essential for angiogenic processes. Elevated circulating levels of soluble endoglin (sCD105) have been reported in patients with various solid tumors and several hematological malignancies. In the present study, we measured peripheral blood plasma concentrations of sCD105 using enzyme-linked immunosorbent assay in 79 patients with chronic lymphocytic leukemia and 69 healthy donors. We found a statistically significant increase in sCD105 concentrations in patients with CLL compared to controls (mean ± standard deviation: 6.8 ± 2.1 vs. 4.6 ± 1.5 ng/ml, 95% confidence interval of mean: 6.4-7.3 vs. 4.2-4.9 ng/ml, p<0.0001). Patients with progressive CLL had higher sCD105 than patients with indolent disease (p=0.0016). Soluble endoglin increased significantly with Rai stage (Rai 0 vs. I-II vs. III-IV, p=0.009 and p=0.04). Progression-free survival was significantly shorter in patients with sCD105 levels above mean (median 15 months vs. not reached, p=0.0045). In conclusion, our data suggest that endoglin may play a significant role in CLL biology and progression; its quantification could contribute to better understanding of angiogenic processes and refine prognostication of individual patients in this disease.
Key words:
endoglin, CD105, angiogenesis, CLL, prognosis
Autoři: L. Smolej 1; C. Andrýs 2
; D. Belada 1; M. Hrudková 1; J. Krejsek 2; J. Malý 1
Působiště autorů: II. interní klinika, oddělení klinické hematologie1 a Ústav klinické imunologie a alergologie2, Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy v Hradci Králové.
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 1, p. 24-27.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Angiogeneze je v posledních letech intenzivně studována u celého spektra hematologických malignit. Endoglin (CD105) je součástí komplexu receptorů pro transformující růstový faktor beta (TGF-beta) a je nepostradatelný pro novotvorbu cév. Cirkulující solubilní forma endoglinu (sCD105) byla zjištěna ve zvýšených koncentracích v krvi u nemocných se solidními nádory a některými hematologickými malignitami. V naší studii jsme měřili sCD105 ELISA metodou v plazmě periferní krve u 79 nemocných s chronickou lymfocytární leukemií (CLL) a 69 zdravých dobrovolníků. Zjistili jsme signifikantně zvýšené koncentrace sCD105 u nemocných s CLL v porovnání s kontrolní skupinou (průměr ± standardní odchylka: 6,8 ± 2,1 vs. 4,6 ± 1,5 ng/ml, 95% interval spolehlivosti průměru 6,4–7,3 vs. 4,2–4,9 ng/ml, p < 0,0001). Nemocní s progresivní chorobu měli významně vyšší koncentrace sCD105 v porovnání s pacienty s indolentním průběhem (p = 0,0016). Byly prokázány významné rozdíly v koncentracích sCD105 v souvislosti s klinickým stadiem dle Raie ve smyslu vzestupu endoglinu od časných přes intermediární k pokročilým stadiím (p = 0,009 a p = 0,04). Přežití do progrese bylo významně kratší u nemocných s CLL, kteří měli hodnotu sCD105 vyšší než průměr (medián 15 měs. vs. nedosažen, p = 0,0045). Naše výsledky naznačují, že endoglin by mohl hrát významnou roli v patogenezi a progresi CLL a jeho hodnocení by mohlo přispět ke zlepšení poznání angiogenních procesů u CLL a individuální prognostické stratifikaci.
Klíčová slova:
endoglin, CD105, angiogeneze, CLL, prognózaÚvod
Angiogeneze, tedy tvorba nových cév z již existující vaskulatury, je zcela nepostradatelným procesem při rozvoji zhoubných nádorů (1–3). Zvýšená neovaskularizace byla také v od poloviny 90. let 20. století zjištěna u řady hematologických malignit (2–7). Některé práce nalezly souvislost mezi zvýšenými ukazateli angiogeneze a nepříznivým klinickým průběhem (6–7). Chronická lymfocytární leukemie (CLL) je nejčastější leukemií dospělých v západním světě; typickým rysem je mimořádná různorodost prognózy s přežitím od několika měsíců po desítky let (8). Proto jsou v současné době hledány prognostické faktory, které by bylo možno použít ke zpřesnění individuální prognózy nemocných s CLL (8, 9). Také u tohoto onemocnění byly zjištěny zvýšené hladiny cirkulujících angiogenních cytokinů či neovaskularizace v kostní dřeni (5, 7, 10). Endoglin (CD105) je homodimerický transmembránový glykoprotein, tvořící součást receptorového komplexu pro transformující růstový faktor beta (TGF-beta) (11–12). CD105 ovlivňuje buněčné odpovědi na TGF-beta, čímž se účastní na vývoji a remodelaci cév, zejména jako induktor proliferace endotelií. Tím je dána jeho nepostradatelná role v angiogenních pochodech (12–15). Endoglin může být uvolněn v solubilní formě (sCD105) do krevního oběhu; zvýšené koncentrace byly zjištěny u nemocných se solidními tumory, u myeloidních malignit a akutní lymfoblastické leukemie (16–22). V naší pilotní studii jsme zjistili zvýšené koncentrace sCD105 u lymfoidních malignit (23). Cílem nynější práce bylo zjištění prognostického významu sCD105 u CLL.
Nemocní a metody
V naší práci jsme stanovili plazmatické koncentrace solubilního endoglinu u 79 nemocných s chronickou lymfocytární leukemií. V souboru bylo zastoupeno 29 žen a 50 mužů s průměrným věkem 63 let (rozmezí 31–88). Kontrolní skupinu tvořilo 69 zdravých dobrovolníků. Diagnóza CLL byla stanovena dle kritérií National Cancer Institute-Sponsored Working Group z roku 1996 (24). Kohorta nemocných s CLL byla dále rozdělena na podskupiny dle prognostických faktorů: pohlaví, klinický průběh (stabilní vs. progresivní), klinické stadium dle Raie (0 vs. I-II vs. III–IV). Data týkající se přežití bez progrese byla dostupná u 64 nemocných. Veškeré pacientské vzorky byly získány od neléčených nemocných. Ethylendiamintetraoctová kyselina (EDTA) byla použita jako antikoagulans. Všechny vzorky plazmy byly po centrifugaci zamraženy při teplotě -80 °C až do měření. Solubilní endoglin byl stanoven pomocí komerčně dostupného ELISA kitu (Human Endoglin Quantikine ELISA kit, R & D Systems, MN, USA). Měření bylo provedeno podle standardní metodiky doporučené výrobcem. Citlivost metody je 0,007 ng/ml. Studie byla provedena dle zásad Helsinské deklarace, schválena etickou komisí a nemocní podepsali informovaný souhlas. Statistická analýza byla provedena pomocí software Analyse-it (Analyse-it Software Ltd., Velká Británie) a MedCalc (Mariakerke, Belgie). Všechna data byla testována na normalitu Shapiro-Wilkovým testem. Pokud bylo rozdělení dat normální, byl k testování rozdílů koncentrací vůči kontrolní skupině užit parametrický t-test, jinak byl použit neparametrický Mann--Whitneyův U test. Křivky přežití bez progrese byly konstruovány dle Kaplan-Meierovy metody, ke stanovení rozdílu v přežití byl použit log-rank test. Období do progrese bylo definováno jako časový interval mezi datem odběru krve na hladinu sCD105 a progresí, a to vzhledem k tomu, že u některých nemocných byl vzorek krve získán po více než 6 měsících od diagnózy CLL. P-hodnoty nižší než 0,05 byly považovány za statisticky signifikantní.
Výsledky
Solubilní endoglin byl detekovatelný ve všech vzorcích. Koncentrace u nemocných s CLL byly signifikantně vyšší oproti kontrolní skupině (p < 0,0001, obr. 1a). Nemocní s progresivní chorobou měli vyšší koncentrace sCD105 v porovnání s pacienty bez progrese (p = 0,0016, obr. 1b). Dále byly zjištěny významné rozdíly v koncentracích sCD105 v souvislosti s klinickým stadiem dle Raie ve smyslu vzestupu endoglinu od časných přes intermediární k pokročilým stadiím (p = 0,009 a p = 0,02, obr. 1c). Nebyl významný rozdíl v koncentracích sCD105 mezi muži a ženami (p = 0,422). Přežití bez progrese bylo významně kratší u nemocných s CLL, kteří měli hodnotu sCD105 vyšší než aritmetický průměr (medián 15 měs. vs. nedosažen, p = 0,0045, obr. 2). Deskriptivní statistika i výsledky testování rozdílů v koncentracích sCD105 mezi jednotlivými podskupinami jsou uvedeny v tabulce 1.
Obr. 1. a-c. Krabičkové grafy koncentrací sCD105. a – CLL vs. kontroly; b – progresivní vs. stabilní choroba; c – klinické stadium Rai 0 vs. I-II vs. III-IV. Všechny hodnoty jsou v ng/ml. 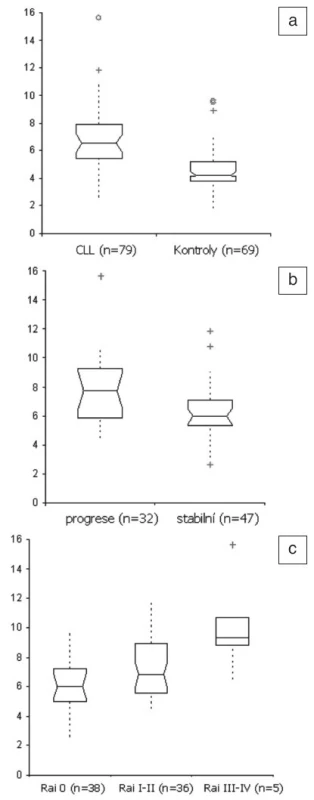
Obr. 2. Přežití bez progrese je významně kratší u nemocných s CLL a koncentracemi sCD105 vyššími než aritmetický průměr. 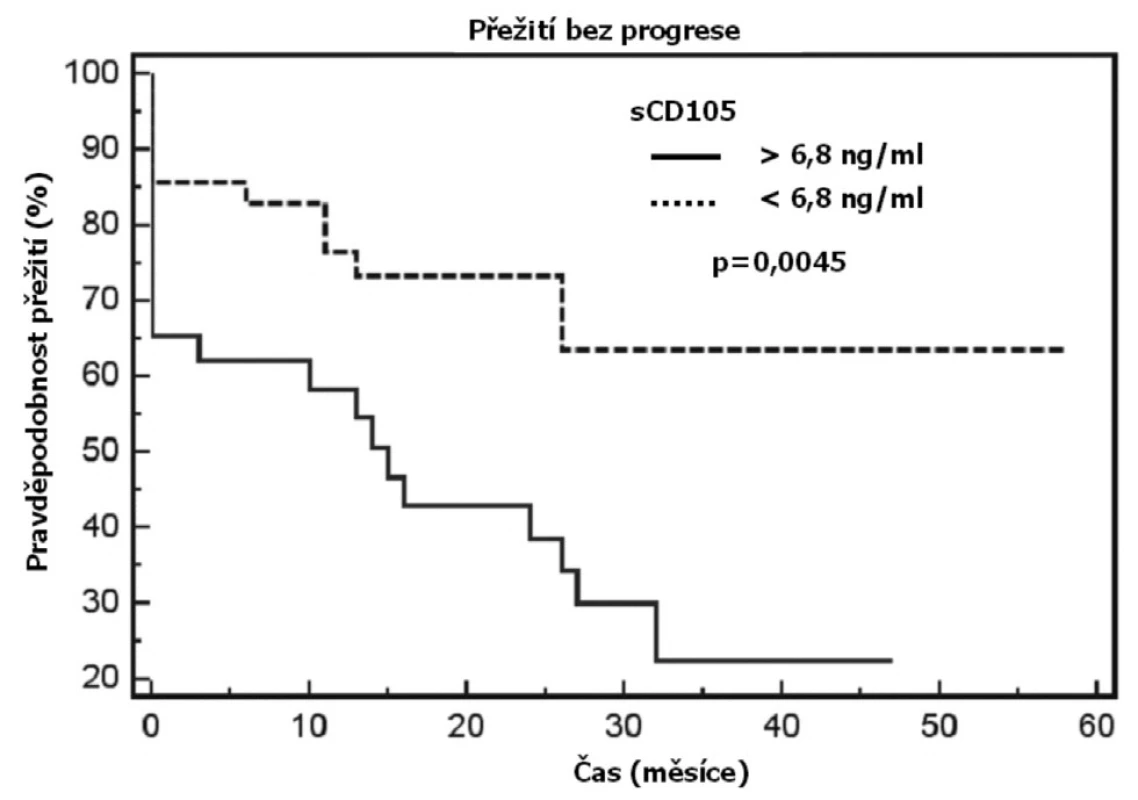
Tab. 1. sCD105 – deskriptivní statistika. 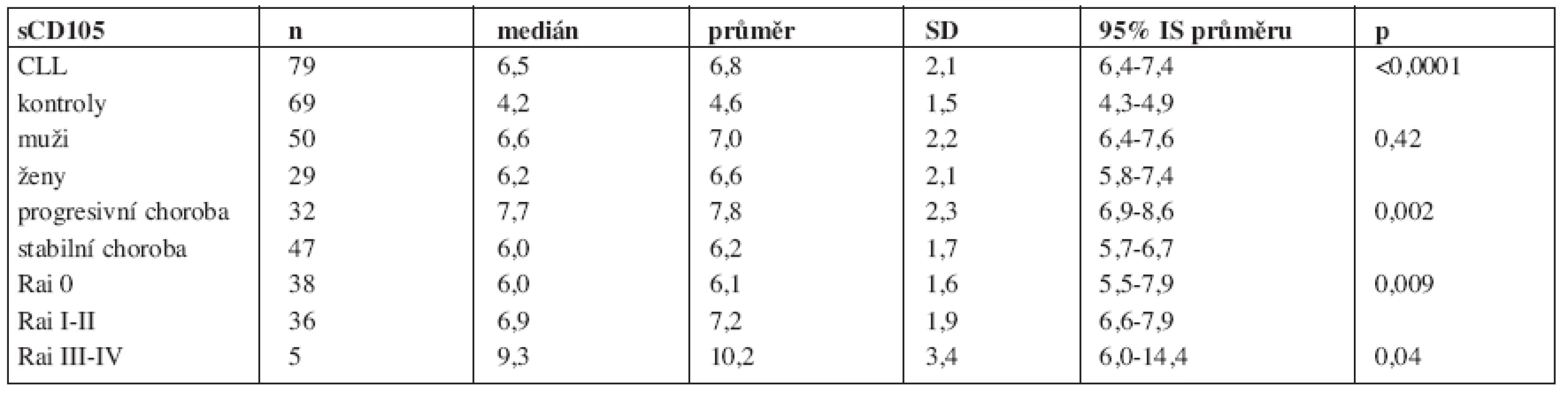
Zkratky: CLL - chronická lymfocytární leukemie; SD – standardní odchylka (standard deviation); IS, interval spolehlivosti. Všechny koncentrace jsou uvedeny v ng/ml. Diskuse
V posledních letech přibývá důkazů o významu angiogeneze u CLL. V naší práci jsme se zaměřili na solubilní endoglin, který se účastní angiogenních procesů prostřednictvím signální cesty TGF-beta, ovlivňováním buněčných odpovědí na tento cytokin. Existuje několik publikací vyzdvihující prognostický význam solubilního endoglinu u solidních nádorů (16–20), avšak pouze dvě práce z oblasti hematologických malignit (21–22). Jedinou předchozí prací na téma solubilního endoglinu u CLL je naše předchozí pilotní studie, kdy byly zjištěny zvýšené plazmatické koncentrace v porovnání s kontrolami (23). V této studii jsme pilotní data potvrdili, navíc jsme zjistili možný prognostický význam sCD105, a to nejen z hlediska souvislosti s klinickým stadiem (vzestup ve směru Rai 0 vs. I–II vs. III–IV), ale také klinickým průběhem (vyšší sCD105 u progresivního onemocnění, kratší období bez progrese u hodnot vyšších než průměr). Ke stanovení souvislosti sCD105 s moderními prognostickými ukazateli (mutační stav IgVH, genetické aberace, exprese ZAP-70) nebylo k dispozici dostatek dat. Zhodnocení případného prediktivního významu sCD105 pro celkové přežití nebylo možné v námi studovaném souboru provést vzhledem k malému počtu úmrtí. Bude též zapotřebí delšího sledování a zvýšení rozsahu vyšetřované skupiny CLL pacientů k potvrzení těchto dat. Naše práce nicméně ukazuje, že endoglin by mohl hrát významnu úlohu v patogenezi CLL a stanovení jeho solubilní formy v plazmě periferní krve by mohlo napomoci k dalšímu poznání komplexní problematiky angiogeneze u tohoto onemocnění a eventuálně i zpřesnění prognostické stratifikace u jednotlivého pacienta.
MUDr. Lukáš Smolej
Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy
v Hradci Králové
II. interní klinika, Oddělení klinické hematologie,
Sokolská 581
500 05 Hradec Králové
e-mail: smolej@seznam.cz
Poděkování
Tato práce byla podpořena grantem IGA NR/8373 – 3 a výzkumným záměrem MZO 00179906 Ministerstva zdravotnictví České republiky.
Došlo do redakce: 21. 11. 2007
Přijato: 15. 1. 2008
Zdroje
1. Folkman J. Angiogenesis in cancer, vascular, rheumatoid, and other disease. Nat Med 1995; 1 : 27–31.
2. Rajkumar SV, Mesa, RA, Tefferi, A. A review od angiogenesis and anti-angiogenic therapy in hematological malignancies. J Hematother Stem Cell Res 2001; 11 : 33–47.
3. Pour L, Hájek R, Büchler T, Maisnar V, Smolej L: Angiogeneze a antiangiogenní léčba u nádorů. Vnitř Lék 2004; 12 : 930–8.
4. Hussong JW, Rodgers GM, Shami PJ. Evidence of increased angiogenesis in patients with acute myeloid leukemia. Blood 2000; 95 : 309.
5. Aguayo A, Kantarjian H, Manshouri T, Gidel C, Estey E, Thomas D, Koller C, Estrov Z, O’Brien S, Keating M, Freireich E, Albitar M: Angiogenesis in acute and chronic leukemias and myelodysplastic syndromes. Blood 2000; 96 : 2240–5
6. Rajkumar SV, Leong T, Roche PC, Fonseca R, Dispenzieri A, Lacy MQ, Lust JA, Witzig TE, Kyle RA, Gertz MA, Greipp PR: Prognostic value of bone marrow angiogenesis in multiple myeloma. Clin Cancer Res 2000; 6 : 3111–3116
7. Molica S, Vacca A, Ribatti D, Cuneo A, Cavazzini F, Levato D, Vitelli G, Tucci L, Roccaro AM, Dammacco F: Prognostic value of enhanced bone marrow angiogenesis in early B-cell chronic lymphocytic leukemia. Blood 2002; 100 : 3344–51.
8. Smolej L, Žák P, Belada D, Malý J. Diagnostika a léčba chronické lymfocytární leukemie. Lék Zpr LF UK Hradec Králové 2007;52(1): 23–34.
9. Papajík T, Jarošová M, Pikalová Z, Indrák K. Chronická B-lymfocytární leukemie Část II: Diagnostická kritéria a význam stanovení individuální prognózy nemocného. Trans Hemat dnes 2006; 3 : 132–9.
10. Kašparová P, Smolej L. Angiogeneze v kostní dřeni u pacientů s chronickou lymfocytární leukemií. Čes-slov Patol 2007; 43(2): 50–58.
11. Cheifetz S, Bellon T, Cales C, Vera S, Bernabeu C, Massague J, Letarte M. Endoglin is a component of the transforming growth factor-beta receptor system in human endothelial cells. J Biol Chem. 1992; 267(27): 19027–30.
12. Duff SE, Li C, Garland JM, Kumar S: CD105 is important for angiogenesis: evidence and potential applications. FASEB J 2003; 17 : 984–92.
13. Fonsatti E, Altomonte M, Nicotra MR, Natali PG, Maio M. Endoglin (CD105): a powerful therapeutic target on tumor-associated angiogenetic blood vessels. Oncogene 2003; 22 : 6557–63.
14. Arthur HM, Ure J, Smith AJ, Renforth G, Wilson DI, Torsney E, Charlton R, Parums DV, Jowett T, Marchuk DA, Burn J, Diamond AG. Endoglin, an ancillary TGF-beta receptor, is required for extraembryonic angiogenesis and plays a key role in heart development. Dev Biol 2000; 217 : 42–53.
15. Lebrin F, Goumans MJ, Jonker L, Carvalho RL, Valdimarsdottir G, Thorikay M, Mummery C, Arthur HM, Dijke Pt P. Endoglin promotes endothelial cell proliferation and TGF-beta/ALK1 signal transduction. EMBO J 2004; 1–11.
16. Miller DW, Graulich W, Karges B, Stahl S, Ernst M, Ramaswamy A, Sedlacek HH, Muller R, Adamkiewicz J. Elevated expression of endoglin, a component of the TGF-beta-receptor complex, correlates with proliferation of tumor endothelial cells. Int J Cancer 1999; 81 : 568–72.
17. Li C, Guo B, Wilson PB, Stewart A, Byrne G, Bundred N, Kumar S. Plasma levels of soluble CD105 correlate with metastasis in patients with breast cancer. Int J Cancer 2000; 89 : 122–6.
18. Li C, Gardy R, Seon BK, Duff SE, Abdalla S, Renehan A, O’Dwyer ST, Haboubi N, Kumar S. Both high intratumoral microvessel density determined using CD105 antibody and elevated plasma levels of CD105 in colorectal cancer patients correlate with poor prognosis. Br J Cancer 2003; 88 : 1424–31.
19. Takahashi N, Kawanishi-Tabata R, Haba A, Tabata M, Haruta Y, Tsai H, Seon BK. Association of serum endoglin with metastasis in patients with colorectal, breast, and other solid tumors, and suppressive effect of chemotherapy on the serum endoglin. Clin Cancer Res 2001; 7 : 524–32.
20. Yagmur E, Rizk M, Stanzel S, Hellerbrand C, Lammert F, Trautwein C, Wasmuth HE, Gressner AM. Elevation of endoglin (CD105) concentrations in serum of patients with liver cirrhosis and carcinoma. Eur J Gastroenterol Hepatol. 2007; 19(9): 755–61.
21. Calabro L, Fonsatti E, Bellomo G, Alonci A, Colizzi F, Sigalotti L, Altomonte M, Musolino C, Maio M. Differential levels of soluble endoglin (CD105) in myeloid malignancies. J Cell Physiol 2003; 194 : 171–5.
22. Catchpoole D, Lail A, Guo D, Chen QR, Khan J. Gene expression profiles that segregate patients with childhood acute lymphoblastic leukaemia: An independent validation study identifies that endoglin associates with patient outcome. Leuk Res 2007; 31(12): 1741–7.
23. Smolej L., Andrýs C., Belada D., Maisnar V., Žák P., Široký O., Malý J. Plazmatické koncentrace solubilního endoglinu u nemocných s lymfoidními malignitami. Trans Hemat dnes 2006; 12(1): 37–39.
24. Cheson BD, Bennett JM, Grever M, Kay NE, Keating MJ, O’Brien S, Rai KR. National Cancer Institute-sponsored Working Group guidelines for chronic lymphocytic leukemia: Revised guidelines for diagnosis and treatment. Blood 1996; 87 : 4990–7.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2008 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Sekundární MDS/AML po autologní transplantaci pro lymfom s použitím BEAM jako přípravného režimu: zkušenosti jednoho pracoviště
- Plazmatické koncentrace solubilního endoglinu mají prognostický význam u nemocných s chronickou lymfocytární leukemií
- Klinické studie RNA vakcín
- Veno-okluzivní choroba jater (Sinusoidální obstrukční syndrom)
- OHD 2008
- Slovo úvodem
- Prenatální a postnatální imunohematologická vyšetření
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Veno-okluzivní choroba jater (Sinusoidální obstrukční syndrom)
- Prenatální a postnatální imunohematologická vyšetření
- Klinické studie RNA vakcín
- Sekundární MDS/AML po autologní transplantaci pro lymfom s použitím BEAM jako přípravného režimu: zkušenosti jednoho pracoviště
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



