-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Určení tělních tekutin založené na analýze nukleových kyselin
Determination of body fluid based on analysis of nucleic acids
Recent methodological approaches of molecular genetics allow isolation of nucleic acids (DNA and RNA) from negligible forensic samples. Analysis of these molecules may be used not only for individual identification based on DNA profiling but also for the detection of origin of the body fluid which (alone or in mixture with other body fluids) forms the examined biological trace. Such an examination can contribute to the evaluation of procedural, technical and tactical value of the trace. Molecular genetic approaches discussed in the review offer new possibilities in comparison with traditional spectrum of chemical, immunological and spectroscopic tests especially with regard to the interpretation of mixtures of biological fluids and to the confirmatory character of the tests. Approaches based on reverse transcription of tissue specific mRNA and their subsequent polymerase chain reaction (PCR) and fragmentation analysis are applicable on samples containing minimal amounts of biological material. Methods for body fluid discrimination based on examination of microRNA in samples provided so far confusing results therefore further development in this field is needed. The examination of tissue specific methylation of nucleotides in selected gene sequences seems to represent a promising enrichment of the methodological spectrum. The detection of DNA sequences of tissue related bacteria has been established and it provides satisfactory results mainly in combination with above mentioned methodological approaches.
Keywords:
body fluids – mRNA – microRNA – qPCR – promotermethylation – microbial DNA
Autoři: Marie Korabečná 1,2
Působiště autorů: Ústav biologie a lékařské genetiky 1. lékařské fakulty UK a Všeobecné fakultní nemocnice, Praha 1; Lékařská fakulta UK v Plzni, Plzeň 2
Vyšlo v časopise: Soud Lék., 60, 2015, No. 3, p. 33-36
Kategorie: Přehledový článek
Souhrn
Přístupy molekulární genetiky dovolují izolovat nukleové kyseliny ze vzorků (DNA i RNA současně) a analýzu těchto molekul využít nejen pro individuální identifikaci původců stop, ale také pro stanovení původu tělní tekutiny, která sama či ve směsi tvoří příslušnou biologickou stopu. Takto získané údaje mohou výrazně přispět ke zvýšení procesní hodnoty stopy. Molekulárně genetické metody zde diskutované nabízejí v porovnání s široce využívaným spektrem chemických a imunologických testů nové možnosti – je možné jimi analyzovat všechny typy biologických tekutin a jejich směsí, mají konfirmační charakter.
Klíčová slova:
tělní tekutiny – mRNA – mikroRNA – qPCR – metylace promotorů – mikrobiální DNA
Aplikace molekulárně genetických metod při vyšetřování trestných činů je dnes samozřejmostí, zejména co se týče individuální identifikace původců jednotlivých biologických stop. Nezanedbatelnou hodnotu pro proces vyšetřování má však i správné stanovení typu biologické tekutiny obsažené ve stopě. Nejčastěji se jedná o krev periferní či menstruační, sperma, sliny, vaginální sekret, moč a pot. Vývoj různorodých technik založených na testech chemických, imunologických či mikroskopických nebo na spektroskopických metodách trvá již více než jedno století. Celé obrovské spektrum známých testů (sahajících od využití alternativních světelných zdrojů, čistě chemických i enzymy katalyzovaných reakcí přes užití protilátek, spektroskopické detekce metabolitů pomocí nukleární metabolické resonance až k Ramanově spektroskopii) lze zhruba rozdělit na testy orientační a konfirmační. S výjimkou Ramanovy spektroskopie (1) a metod využívajícich nukleární magnetické resonance k detekci metabolitů (2) však testy nejsou univerzálně využitelné pro určení všech v úvahu připadajících tělních tekutin, detekce každé z tekutin vyžaduje vlastní metodické řešení. Ramanova spektroskopie (1) i metody založené na nukleární magnetické rezonanci (2) pracují při interpretaci spekter získaných ze vzorků tělních tekutin s vysoce specifickým matematickým aparátem vyžadujícím zkušeného analytika, zatím chybí studie dokumentující rozsáhlejší nasazení těchto metod v kriminalistické praxi. Metodiky založené na imunofluorescenčních biosenzorech - nanopartikulích konjugovaných s protilátkami (3,4) - stejně jako spektroskopické metody sice nepoškozují DNA obsaženou ve vzorku, ale zatím umožňují identifikovat jen jednu (3) nebo dvě (4) tělní tekutiny. Problematika různých metodických přístupů k určování tělních tekutin je souhrnně zpracována například v článcích Virklera a Ledneva (5) nebo An a spoluautorů (6). Nezanedbatelnou výhodu každého potencionálně využitelného testu pak představuje možnost jeho použití přímo v terénu při vyšetřování místa činu, přičemž je třeba pečlivě volit metodu tak, aby ve stopě vzhledem k typu použitých reagencií či světelného zdroje nedošlo k poškození DNA nutné pro individuální identifikaci (5). V poslední dekádě byly vyvinuty testy založené na analýze mRNA, mikroRNA, metylaci DNA a vyšetření přítomnosti DNA tkáňově specifických mikroorganismů, které představují významné obohacení možností forenzní práce. Vzhledem ke svému charakteru spadají tyto testy do kategorie testů konfirmačních, zatím nevhodných pro terénní využití. Jejich hlavní výhoda spočívá v obecné využitelnosti napříč spektrem tělních tekutin, v možnosti detekovat jejich směsi a ve využití stávajícího metodologického potenciálu forenzních molekulárně genetických laboratoří směrem ke konfirmaci dat získaných jinými technikami. Principy a aplikační možnosti těchto nově vyvíjených testů jsou diskutovány v následujícím textu.
PŘEHLED METOD A JEJICH MOŽNOSTÍ
Profilování mRNA
Hlavním problémem analytického využití RNA je její obecně známá nestabilita způsobená aktivitou všudypřítomných ribonukleáz. Průlom ve forenzním využívání tkáňově specifických transkriptů, jejichž translací vznikají proteiny typické pro danou tělní tekutinu či tkáň, byl umožněn prací Zubakova et al. (7). Tato skupina prokázala, že i v dlouhodobě skladovaných (180 dnů) vzorcích krve a slin je možné prokázat tkáňově specifické mRNA.Další studie (8) stejné skupiny ukázala, že specifické transkripty lze detekovat i v materiálu mnohem starším, například v 16 let staré krevní skvrně. Možnost úspěšně detekovat vybrané transkripty tzv. housekeeping genů (tj. genů provozních - potřebných pro fungování každé buňky organismu) a genů tkáňově specifických po delší době skladování za působení širokého spektra faktorů vnějšího prostředí byla studována Setzerem et al. (9) - RNA byly detekovatelné i po 547 dnů trvajícím uchovávání vzorků při pokojové teplotě, zvýšená teplota a vlhkost se ukázaly jako kruciální faktory negativně ovlivňující získání výsledků.
Hlavní výhodou identifikace tělní tekutiny pomocí mRNA profilování je možnost současné extrakce mRNA i DNA z téhož vzorku, což nabývá na významu u materiálu o limitovaném množství, kdy tento přístup vede zároveň k individuální identifikaci původce stopy. Příslušné izolační metody byly úspěšně etablovány a mezinárodně testovány (10,11,12,13).
Další výhodou mRNA profilování je možnost zaměřit se v jedné reakci RT PCR (Reverse Transcription Endpoint PolymeraseChain Reaction) nebo qRT-PCR (Quantitative Real-Time Reverse Transcription – PCR) na amplifikaci více tkáňově specifických transkriptů najednou – provádět tzv. multiplexování, které nejen šetří limitovaný výchozí materiál, ale může vést i k odhalení směsí tělních tekutin (14,15).
Pro determinaci jednotlivých tělních tekutin byly selektovány transkripty tkáňově vysoce specifických genů (15,16,17) uvedené v tabulce 1. Přesvědčivě byla prokázána možnost determinovat složení směsí biologických tekutin profilováním mRNA ve stopě obsažených (16). Tato problematika byla dále rozvíjena a v roce 2014 vyústila ve vývoj PCR multiplex eseje pro detekci 12 tkáňově specifických mRNA zahrnujícího transkripty genů pro hemoglobin beta (HBB) a glykoforin A (GLY) pro detekci periferní krve, transkripty genů pro protamin 2 (PRM2) a transglutaminázu 4 (TGM4) pro sperma, transkripty genů pro mucin 4 (MUC4) pro vaginální sekret, transkripty genů pro matrix metaloproteinázy 7 and 11 (MMP7 a MMP11) pro menstruační krev, keratinu 4 (KRT4) pro orální sliznici, histatinu 3 (HTN3) pro sliny, statherinu (STATH) pro nosní sekrety, dermcidinu (DCD) pro pot a uromodulinu (UMOD) pro moč (18).
Tab. 1. Využití vybraných tkáňově specifických charakteristik pro určení typu tělní tekutiny molekulárně genetickými metodami dle v textu citovaných literárních zdrojů. U mikroRNA různé výzkumné skupiny dosáhly různých vzájemně se nekonfirmujících výsledků. 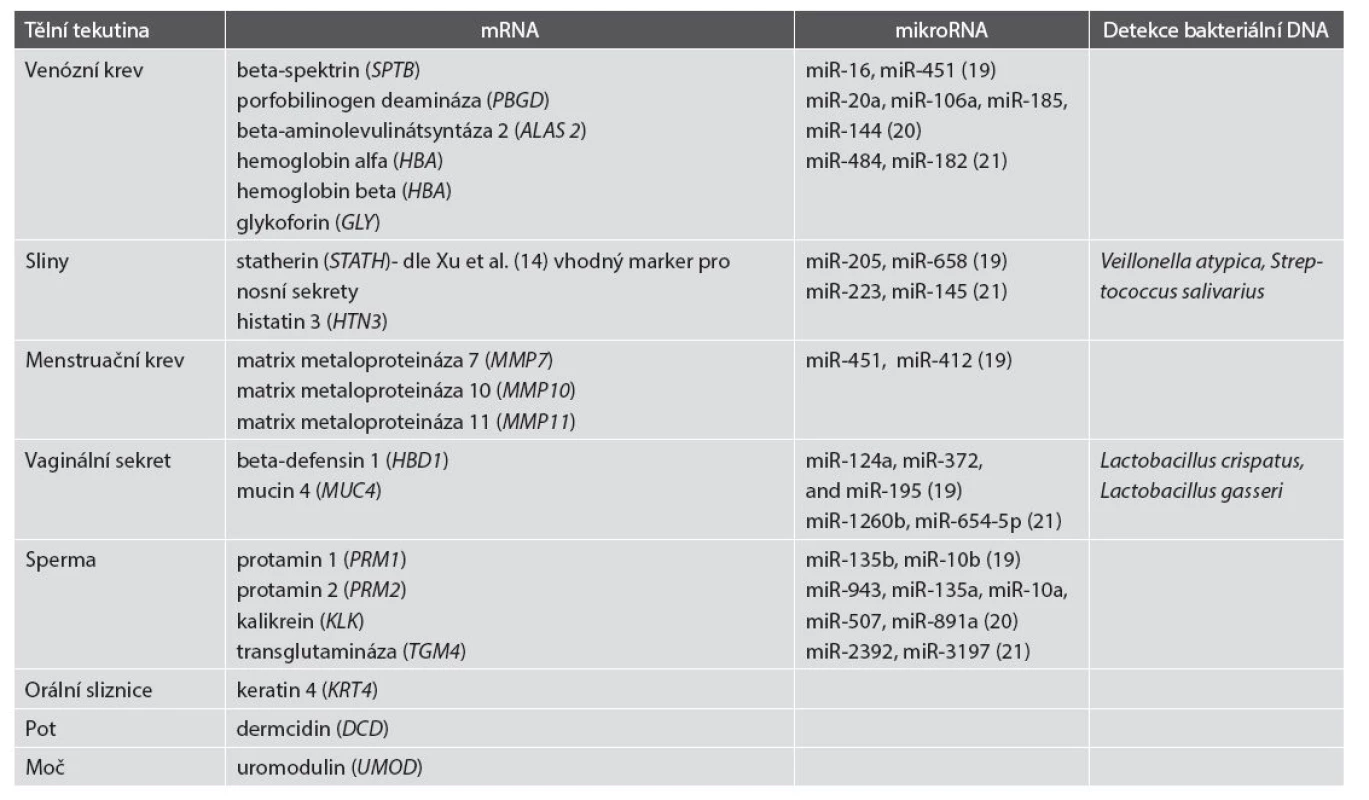
Profilování mikroRNA
MikroRNA (miRNA) jsou malé nekódující RNA molekuly o délce 18 až 22 nukleotidů, které regulují genovou expresi na post-transkripční úrovni. Byly provedeny studie směřující k nalezení miRNA s tkáňově specifickou expresí a tudíž vhodných pro forenzní aplikace. Dosavadní výsledky (19,20,21) jsou bohužel zatím nekonzistentní, jak vyplývá i z údajů v tabulce 1 demonstrujících zásadní odlišnost výsledků získaných jednotlivými výzkumnými skupinami. V kontrastu k profilování mRNA při studiu tkáňově specifických mikroRNA zatím nebylo dosaženo shody v otázce výběru nejvhodnějšího panelu markerů vykazujícího parametry srovnatelné s profilováním mRNA, jednotlivé studie (19,20,21) nedosahují průniku v selekci markerů tak, jak je tomu u mRNA profilování. Ukazuje se, že výsledky získané miRNA profilováním jsou závislé na použité metodě izolace, reverzní transkripce i detekční technologie (22). Pro praktické využití ve forenzní genetice je tedy nutná další optimalizace, standardizace a validace dosavadních přístupů.
Stanovení tkáňově specifických epigenetických změn
Diferenciace tkání je spojena s epigenetickým změnami, dlouhodobě je z tohoto hlediska studována zejména metylace DNA, která ovlivňuje aktivitu genových promotorů. Vyšší stupeň metylace může vést k transkripčnímu umlčení dotyčného genu. Různé buněčné typy a tkáně jsou charakterizovány specifickými metylačními vzory a chromosomálními segmenty známými jako tkáňově specifické diferenciálně metylované regiony (tissue-specific Differentially Methylated Regions (tDMRs) (23). Na tomto teoretickém základě byl vyvinut test umožňující spolehlivé a rychlé určení vzorků spermatu bez nutnosti mikroskopického vyšetření či aplikace biochemických testů. Test je založen na štěpení DNA metylačně senzitivním enzymem Hha1, následné amplifikaci zbylých, enzymem nerozštěpených sekvencí za pomoci fluorescenčně značených primerů a analýze takto získaných amplikonů pomocí kapilární elektroforézy (24). Řada dalších studií zaměřených na vytipování tDMR vhodných ke spolehlivému odlišení tělních tekutin využívá jako prvního kroku bisulfitové konverze, přičemž je nemetylovaný cytosin konvertován na uracil, jehož přítomnost vede k zařazení thyminu do sekvence DNA amplifikované z takovéhoto výchozího materiálu za pomoci PCR. Bisulfitová konverze však vede k částečné degradaci výchozího vzorku DNA, což je hlavní nevýhodou tohoto metodického přístupu. V genech DACT1 a USP49 byly nalezeny tDMR vhodné k odlišení vzorků spermatu, v nichž jsou jejich sekvence specificky hypometylovány, a gen PFN3 poskytl kandidátní tDMR pro determinaci vaginálního sekretu (25). Vyšetření tDMR v genech DACT1, USP49, PFN3 a PRMT2 po bisulfitové konverzi bylo navrženo k úspěšnému odlišení vzorků spermatu, menstruační krve a vaginálního sekretu od jiných tělních tekutin (23). Jiná studie (26) rovněž rozvíjející metodiku založenou na bisulfitové konverzi navrhuje využití tDMR v jiných genech - pro determinaci vzorků spermatu jsou zde navrženy geny ZC3H12D a FGF7, zatímco vyšetření C20orf117 a BCAS4 má sloužit k odlišení vzorků krve a slin od ostatních biologických tekutin.
Jak vyplývá z výše uvedeného, metody založené na vyšetřování tkáňově specifických diferenciálně metylovaných regionů (tDMR) představují nadějný analytický nástroj v oblasti molekulárně genetické determinace tělních tekutin také tím, že pracují s DNA izolovanou ze stopy, vyžadují však provedení dalších validačních studií zahrnujících širokou paletu markerů a relevantní množství biologických stop rozmanitého charakteru. Studie Parkera a spolupracovníků (27) je v tomto směru nejnovějším krokem - na pozadí celého lidského metylomu bylo vybráno 8 DNA metylačních markerů, které vykazují vysokou sensitivitu a specificitu pro determinaci stop krve, slin, spermatu a vaginálního sekretu.
Nalezení DNA sekvencí tkáňově specifických mikroorganismů
Metody identifikace tělních tekutin založené na amplifikaci DNA tkáňově specifických bakterií využívají nejčastěji k určení bakteriálních druhů amplifikace druhově specifické sekvence genu pro 16S rRNA nebo intragenové transkribované oblasti lokalizované mezi geny pro 16S a 23S rRNA (28,29). Pozornost byla zaměřena především na identifikaci slin a vaginálního sekretu. Detekci slin dovoluje zjištění přítomnosti DNA pocházející ze Streptococcus salivarius a Streptococcus mutans (28), k určení vaginálního sekretu slouží nejčastěji DNA z Lactobacillus crispatus a Lactobacillus gasseri (30, 31). Zjištění přítomnosti sekvencí z těchto dvou mikroorganismů dovoluje také odlišení menstruační krve (32). Detekce druhově specifických sekvencí z Gardnerella vaginalis a Atopobium vaginae, původců častých vaginálních zánětlivých onemocnění žen fertilního věku, je rovněž využívána pro identifikaci vaginálního sekretu (32). Jeden z recentních metodických přístupů (32) úspěšně využívá kombinace vyšetření tDMRs v genech USP49, DACT1, PFN3 a L81528 s detekcí DNA výše popsaných tkáňově specifických mikroorganismů, přičemž například pro spolehlivé určení vaginálního sekretu touto metodou postačuje celkové množství DNA izolované ze vzorku 250pg.
ZÁVĚR
V oblasti molekulárně genetické determinace tělních tekutin byla dosud provedena celá řada velmi zajímavých, výše zmiňovaných studií. Praktického využití zatím dosáhlo jen mRNA profilování v důsledku své vysoké tkáňové specifity a sensitivity dostačující pro práci se stopami spolu s detekcí DNA tkáňově specifických mikroorganismů. Přístupy založené na vyšetřování mikroRNA zatím nedosáhly potřebného konsensu v náhledu na spektrum mikroRNA dostačujících ke spolehlivé identifikaci jednotlivých typů forenzně zajímavých tkání. Vyšetřování tkáňově specifických diferenciálně metylovaných regionů (tDMR) DNA vedlo k úspěchu při jednoznačné determinaci vzorků krve, spermatu, slin a vaginálních sekretů (26,27). Velmi úspěšné jsou přístupy založené na kombinaci metodických možností - například na současné detekci tDMRnebo mRNAspolu s detekcí DNA tkáňově specifických mikroorganismů (32,23).
Vývoj spektra metod založených na analýze nukleových kyselin ve stopách tělních tekutin s cílem určit jejich biologickou podstatu představuje zcela určitě obohacení možností forenzní práce ve smyslu potenciální aplikace jedné univerzální konfirmační metody na stopy nejrůznějších tělních tekutin a jejich směsí za využití stávajícího vybavení a etablovaných metod laboratoří forenzní genetiky.
PODĚKOVÁNÍ
Práce byla podpořena projektem PRVOUK P25/LF1/2 Ministerstva školství, mládeže a tělovýchovy ČR, projektem RVO VFN 64165 Ministerstva zdravotnictví ČR a projektem TIP I/328 Ministerstva průmyslu a obchodu ČR.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doc. RNDr. Marie Korabečná, Ph.D.
Ústav biologie a lékařské genetiky 1. LF UK a VFN
Albertov 4, 128 00 Praha 2
e-mail: marie.korabecna@lf1.cuni.cz
Zdroje
1. Sikirzhytski V, Sikirzytskaya A, Lednev IK. Multidimensional Raman spectroscopic signatures as a tol for forensic identifiation of body fluids traces: a review. Appl Spectrosc 2011; 65 : 1223-1232.
2. Scano O, Locci E, Noto A et al. 1H NMR metabolite fingerprinting as a new tool for body fluid identification in forensic science. Magn Reson Chem 2013; 51 : 454-462.
3. Frascione N, Pinto V, Daniel B. Development of biosensor for human blood: new routes to body fluid identification. Anal Bioanal Chem 2012; 404 : 23-28.
4. Frascione N, Thorogate R, Daniel B, Jickells S. Detection and identification of body fluids stains using antibody-nanoparticle conjugates. Analyst 2012; 137 : 508-512.
5. Virkler K, Lednev IK. Analysis of body fluids for forensic purposes: from laboratory testing to non-destructive rapid confirmatory identification at a crime scene. Forensic Sci Int 2009; 188 : 1-17.
6. AnJH, ShinKJ, YangWI, LeeHY. Body fluid identification in forensics. BMB Rep 2012; 45 : 545-553.
7. Zubakov D, Hanekamp E, Kokshoorn M, van IJcken W, Kayser M. Stable RNA markers for identification of blood and saliva stains revealed from whole genome expression analysis of time-wise degraded samples. Int J Legal Med 2008; 122 : 135-142.
8. Zubakov D, Kokshoorn M, Kloosterman A, Kayser M. New markers for old stains: stable mRNA markers for blood and saliva identification from up to16-year-old stains. Int J Legal Med 2009; 123 : 71-74.
9. Setzer M, Juusola J, Ballantyne J. Recovery and stability of RNA in vaginal swabs and blood, semen, and saliva stains. J Forensic Sci 2008; 53 : 296-305.
10. Bauer M, Patzelt D. Simultaneous RNA and DNA isolation from blood and semen stains. Forensic Sci Int 2003; 136 : 76-78.
11. Alvarez M, Juusola J, Ballantyne J. An mRNA and DNA co-isolation method for forensic casework samples. Anal Biochem 2004; 335 : 289-298.
12. Haas C, Hanson E, Bär W, et al. mRNA profilig for the identification of blood-results of a collaborative EDNAP exercise. Forensic Sci Int Genet 2011; 5 : 21-26.
13. Haas C, Hanson E, Anjos MJ, et al. RNA/DNA co-analysis from blood stains—results of a second collaborative EDNAP exercise. Forensic Sci Int Genet 2012; 6 : 70-80.
14. Juusola J, Ballantyne J. Multiplex mRNA profilig for the identification of body fluids. Forensic Sci Int 2005; 152 : 1-12.
15. Juusola J, Ballantyne J. mRNA profilig for body fluid identification by multiplex quantitative RT-PCR. J Forensic Sci 2007; 52 : 1252-1262.
16. Haas C, Klesser B, Maake C, Bär W, Kratzer A. mRNA profilig for body fluid identification by reverse transcription end point PCR and realtime PCR. Forensic Sci Int Genet 2009; 3 : 80-88.
17. Nussbaumer C, Gharehbaghi-Schnell E, Korschineck I. Messenger RNA profiling: a novel method for body fluid identification by real-time PCR. Forensic Sci Int 2006; 157 : 181-186.
18. Xu Y, Xie J, Cao Y et al. Development of highly sensitive and specific mRNA multiplex system (XCYR1) for forensic human body fluids and tissues identification. PLoSOne 2014; 9(7): e100123.
19. Hanson EK, Lubenow H, Ballantyne J. Identification of forensically relevant body fluids using a panel of differentially expressed microRNAs. Anal Biochem 2009; 387 : 303-314.
20. Zubakov D, Boersma AW, Choi Y, van Kuijk PF, Wiemer EA, Kayser M. MicroRNA markers for forensic body fluid identification obtained from microarray screening and quantitative RT-PCR confirmation. Int J Legal Med 2010; 124 : 217-226.
21. Park JL, Park SM, Kwon OH, et al. Microarray screening and qRT-PCR evaluation of microRNA markers for forensic body fluid identification. Electrophoresis 2014; 35 : 21-22.
22. Wang Z, LuoHB, Pan XF, Liao M, Hou YP. A model for data analysis of microRNA expression in forensic body fluid identification. Forensic Sci Int Genet 2012; 6 : 419-423.
23. AnJH, Chi A, Shin KJ, Zang WI, Lee HY. DNA methylation-specific multiplex assays for body fluid identification. Int J Legal Med 2013; 127 : 35-43.
24. Wasserstrom A, Frumkin D, Davidson A, Shpitzen M, Herman Y, Gafny R. Demonstration of DSI-semen-A novel DNA methylation-based forensic semen identification assay. Forensic Sci Int Genet 2013; 7 : 136-142.
25. Lee HY, Park MJ, Choi A, An JH, Yang WI, Shin KJ. Potential forensic application of DNA methylation profiling to body fluid identification. Int J Legal Med 2012; 126 : 55-62.
26. Madi T, Balamurugan K, Bombardi R, Duncan G, McCord B. The determination of tissue-specific DNA methylation patterns in forensic biofluids using bisulfite modification and pyrosequencing. Electrophoresis 2012; 33 : 1736-1745.
27. Park JL, Kwon OH, Kim JH, et al. Identification of body fluid-specific DNA methylation markers for use in forensic science. Forensic Sci Int Genet 2014; 13C: 147-153.
28. Hsu L, Power D, Upritchard J, et al. Amplification of oral streptococcal DNA from human incisors and bite marks. Curr Microbiol 2012; 65 : 207–211.
29. Akutsu T, Motani H, Watanabe K, Iwase H, Sakurada K. Detection of bacterial 16S ribosomal RNA genes for forensic identification of vaginal fluid. Legal Med (Tokyo) 2012; 14 : 160–162.
30. Giampaoli S, Berti A, Valeriani F, et al. Molecular identification of vaginal fluid by microbial signature. Forensic Sci Int Genet 2012; 6 : 559–564.
31. Giampaoli S, Alessandrini F, Berti A, et al. Forensic interlaboratory evaluation of the ForFLUID kit for vaginal fluids identification. J Forensic Leg Med 2014; (21): 60-63.
32. Choi A, Shin KJ, Yang WI, Lee HY. Body fluid identification by integrated analysis of DNA methylation and body fluid-specific microbial DNA. Int J Legal Med 2014; 128 : 33-41.
33. Fleming RI, Harbison S. The use of bakteria for identification of vaginal secretions. Forensic Sci Int Genet 2010; 4 : 311-315.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseSoudní lékařství

2015 Číslo 3-
Všechny články tohoto čísla
- Náhlá smrt při anomálii věnčité tepny asociované s přítomností rete Chiari
- III. Kongres traumatologie a muskuloskeletální radiologie
- Určení tělních tekutin založené na analýze nukleových kyselin
- Nejvyšší ocenění ministra ŠMT ČR pro člena naší odborné společnosti
- Truncus arteriosus communis s prežívaním 46 rokov: kazuistika
- Test barvením pro snadnou identifikaci požitého povrchového aktivačního činidla
- XVIII. Rozmaričovy soudně lékařské dny
- Komentár ku článku “Konfrontácia poznatkov o koncentrácii alkoholu v krvi a vo vydychovanom vzduchu” autorov Bauer et al.
- III. národní kongres „Dopravní úrazy 2015“
- Soudní lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Náhlá smrt při anomálii věnčité tepny asociované s přítomností rete Chiari
- Truncus arteriosus communis s prežívaním 46 rokov: kazuistika
- Určení tělních tekutin založené na analýze nukleových kyselin
- XVIII. Rozmaričovy soudně lékařské dny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



