-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCirkulující nádorová DNA jako biomarker metastazujícího kolorektálního karcinomu − kazuistika
Circulating tumor DNA as a biomarker in metastatic colorectal carcinoma − case report
Introduction: Colorectal cancer (CRC) is the third most common malignant disease worldwide. The stage of the disease at the time of diagnosis and the capture of an early recurrence have a direct impact on long-term survival. Existing control screening methods often do not reflect real-time metastatic disease. In patients with detectable circulating tumor DNA (ctDNA), liquid biopsy can be an effective monitoring tool.
Case report: In 2012, we performed sigmoid resection in a 57 years old patient for advanced CRC. The follow-up assessments included: blood samples for CA 19-9 and CEA, endoscopy and imaging methods. We also sampled peripheral blood to determine the level of ctDNA. Its value corresponded to the development of the disease throughout the period. Twice it outperformed imaging methods. CEA showed some degree of unreliability, especially after prolonged illness. CA 19-9 was in the normal range at all times.
Conclusion: Circulating tumor DNA is an effective tool in the diagnosis of recurrent metastatic CRC. In patients with detectable ctDNA, its level correlates with the tumoral mass in real time. It has a predictive value in monitoring the treatment response. Its implementation in the follow-up of patients with CRC may have an impact on the choice of treatment strategy and consequently on patient survival.
Keywords:
colorectal cancer – metastases – biomarkers – Circulating tumor DNA – follow-up
Autoři: K. Menclová 1; J. Pudil 1; L. Benešová 2; T. Hálková 2; R. Ptáčková 2; A. Semyakina 2; M. Minárik 2,3; M. Levý 4; J. Šimša 4; F. Pazdírek 5; J. Hoch 5; M. Bláha 6; M. Ryska 1
Působiště autorů: Chirurgická klinika 2. lékařské fakulty Univerzity Karlovy a Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 1; Centrum aplikované genomiky solidních nádorů, Genomac výzkumný ústav, Praha 2; Elphogene, Praha 3; Chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Thomayerovy nemocnice, Praha 4; Chirurgická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol, Praha 5; Institut biostatistiky a analýz Masarykovy univerzity, Brno 6
Vyšlo v časopise: Rozhl. Chir., 2020, roč. 99, č. 4, s. 179-182.
Kategorie: Kazuistika
doi: https://doi.org/10.33699/PIS.2020.99.4.179–182Souhrn
Úvod: Kolorektální karcinom (KRK) je celosvětově třetím nejčastějším zhoubným onemocněním. Stadium onemocnění v době diagnózy a záchyt časné rekurence mají přímý vliv na přežívání pacientů. Stávající kontrolní vyšetřovací metody často neodrážejí průběh metastazujícího onemocnění v reálném čase. U pacientů s detekovatelnou cirkulující nádorovou DNA (ctDNA) může být tento marker účinným monitorujícím nástrojem.
Kazuistika: V roce 2012 jsme na našem pracovišti provedli resekci sigmatu u 57letého pacienta pro pokročilý karcinom. V rámci pravidelných dispenzárních kontrol pacient podstupoval zobrazovací vyšetření, odběry krve na CA 19-9 a CEA, endoskopii. Zároveň jsme odebírali vzorek periferní krve ke stanovení hladiny ctDNA. Její hodnota po celou dobu odpovídala vývoji nemoci. Dvakrát předstihla v diagnostice zobrazovací metody. CEA vykazoval určitou míru nespolehlivosti, zejména po delší době trvání nemoci. CA 19-9 byl po celou dobu v rozmezí normálních hodnot.
Závěr: ctDNA je účinným nástrojem v diagnostice rekurence metastazujícího KRK. U pacientů s detekovatelnou ctDNA její hladina koreluje s přítomností nádorové masy v reálném čase. Má prediktivní význam při sledování odpovědi na léčbu. Její implementace do sledování pacientů s KRK může mít vliv na volbu léčebné strategie a přežívání pacientů.
Klíčová slova:
cirkulující nádorová DNA – kolorektální karcinom – sledování – metastázy – biomarkery
Úvod
Kolorektální karcinom (KRK) je celosvětově třetím nejčastějším zhoubným nádorovým onemocněním [1−2]. Přes pokrok v diagnostice a léčbě se se svými 694 tisíci úmrtími ročně řadí na čtvrté místo mezi malignitami [3−4]. Stadium onemocnění v době diagnózy má jasný dopad na přežívání pacientů. Zatímco pro I. stadium je pětileté přežívání udáváno okolo 95 %, u stadia IV. klesá na pouhých 8 % [5]. V době diagnózy jsou zhruba dvě třetiny pacientů s potenciálně vyléčitelným onemocněním. V současnosti se na plánování léčby neodmyslitelně podílí mezioborový tým. Bohužel i přes multimodální léčbu a snahu o kurabilitu dochází ve 30–40 % k rekurenci nádorového onemocnění [6]. Časná detekce nádorové progrese a její léčba v průběhu dispenzarizace má zásadní vliv na přežívání pacientů. Stávající doporučení využívají ke sledování pacientů s KRK četné nástroje. Mezi základní se řadí klinický stav pacienta. Dále jsou to vyšetření na bázi zobrazovacích metod (ultrazvukové vyšetření, CT, magnetická rezonance, pozitronová emisní tomografie). Hodnocení vývoje nádorového onemocnění v průběhu léčby probíhá na základě RECIST kritérií (Response Evaluation Criteria in Solid Tumors) [7]. Mimo zobrazovací metody jsou to i vyšetření endoskopická a odběry sérových nádorových markerů, zejména karcinoembryonálního antigenu (CEA). Vyšetření se v prvních letech po iniciální, obvykle chirurgické léčbě provádí v pravidelných tříměsíčních intervalech. Senzitivita i specificita těchto vyšetření se pohybuje mezi 70–80 % [1,8]. Dochází tím ke zpoždění diagnostiky a zahájení léčby rekurentního onemocnění s dopadem na přežívání nemocných. Proto se hledají další nové nástroje umožňující zlepšení diagnostiky a monitoringu léčby. Právě takovýmto slibným prediktivním faktorem je stanovení cirkulující nádorové DNA (ctDNA). Metoda, někdy označovaná jako „liquid biopsy“, je založena na faktu, že solidní tumory (včetně KRK) uvolňují fragmenty DNA do periferní krve [9]. Její hladinu můžeme detekovat po odběru periferní krve v separované plazmě. Metodologie zpracování krve a analýzy hladiny ctDNA včetně výsledků multicentrické studie, na které jsme se podíleli, již byly publikovány [8]. Prezentujeme případ pacienta s rekurentním KRK, u kterého jsme pravidelně monitorovali hladinu ctDNA.
Kazuistika
V prosinci 2012 jsme na Chirurgické klinice 2. LF UK a ÚVN Praha operovali 57letého muže (BMI 24,1) pro stenozující adenokarcinom sigmatu. Pacient, dosud bez přidružených onemocnění s výjimkou arteriální hypertenze, byl vyšetřován pro krátkou anamnézu kolikovitých bolestí břicha. Koloskopicky byl zjištěn tumor ve 35 cm, neprostupný pro endoskop. Stagingová vyšetření odhalila synchronní jaterní metastázu v SVIII jater velikosti 15 mm. Pro vyjádřené symptomy poruchy pasáže byl pacient indikován k resekci primárního tumoru. Histologicky se jednalo o středně diferencovaný adenokarcinom pT3N1c (1/18). Fenotypové dovyšetření prokázalo somatické mutace v genu KRAS exonu 2 a genu PIK3CA exonu 20. Pooperační průběh byl nekomplikovaný. Pacient odmítl navrhovanou adjuvantní systémovou léčbu. V únoru 2013 jsme cestou multidisciplinárního týmu pacienta indikovali k CT navigované radiofrekvenční ablaci (RFA) solitárního ložiska jater. Před výkonem jsme u pacienta odebrali periferní krev ke stanovení sérových nádorových markerů a ctDNA. CA 19-9 byl v normálním rozmezí (norma 0−34 kU/l), CEA mírně zvýšený na 5,38 µg/l (norma 0−5 µg/l), ctDNA byla pozitivní (600 RFU – relative fluorescence unit). Po výkonu klesla hladina ctDNA na nulu. Kontrolní ultrazvukové (US) vyšetření po třech měsících nezachytilo nové jaterní ložisko. Po šesti měsících, tedy v září 2013, byla opět detekována ctDNA (100 RFU). CEA i CA 19-9 byly v normě (5,38 µg/l, resp. 8,7kU/l). CT vyšetření ukázalo nové jaterní ložisko v SIV jater velikosti 18 mm. Opět jsme provedli CT navigovanou RFA jaterní metastázy. K poklesu hladiny ctDNA nedošlo (122 RFU). Pacient absolvoval 4 cykly systémové léčby v režimu XELOX (capecitabine/oxaliplatina). Další pokračování odmítl. Tři měsíce po poslední RFA došlo k opětovnému nárůstu ctDNA (228 RFU), elevaci CEA na 9,29 µg/l. CA 19-9 zůstalo v normě. Radiologicky šlo o remisi. CT nález byl prostý generalizace základního onemocnění. Šest měsíců od poslední RFA strmě vzrostla hladina ctDNA (2068 RFU) i CEA (28,34 µg/l). Zřejmá byla i radiologická progrese. CT ukázalo progresi ložiska v SIV jater s přesahem do laterálního segmentu. Pacienta jsme operovali v dubnu 2014. Provedli jsme R0 levostrannou hemihepatektomii. Výkon byl komplikován biliárním leakem (Clavien-Dindo III). Bilom byl drénován pod CT kontrolou. Po domluvě pacient pokračoval v léčbě capecitabinem. Hladina ctDNA klesla na nulu. Zvýšila se hodnota sérového CEA (42,85 µg/l). 13 měsíců po operaci svědčila opakovaná CT vyšetření a nulové hladiny ctDNA pro remisi onemocnění. Hodnoty CEA zůstaly setrvale zvýšené okolo 12 µg/l. V červnu 2015 došlo opět ke skokové elevaci ctDNA (328 RFU). Pacient byl pozván na časnější kontrolu. CT zachytilo suspektní lymfadenopatii v oblasti ligamentum hepatoduodenale. CEA kleslo z 12 na 6,79 µg/l. V říjnu 2015 jsme provedli lymfadenektomii z retropankreatické oblasti a oblasti ligamentum hepatoduodenale. Histologicky se jednalo o rozsáhlá nekrotická ložiska adenokarcinomu v uzlinách. Molekulárně genetické vyšetření tkáně potvrdilo přítomnost obou dříve detekovaných mutací v genech KRAS a PIK3CA. Těsně před operací pacient podstoupil kontrolní koloskopii s endoskopickým snesením malignizovaného polypu rekta. S navrhovaným resekčním výkonem nesouhlasil. Upřednostnil časté endoskopické kontroly. Po operaci uzlinového postižení nebyla ctDNA detekovatelná, CEA zůstalo okolo 7 µg/l. Pacient toleroval 1 cyklus adjuvantní léčby v režimu FUFA (fluorouracil/leukovorin). S dalším pokračováním terapie nesouhlasil. Šest měsíců po operaci vzrostla ctDNA na 415 RFU, CEA bylo 11 µg/l a CT potvrdilo progresi metastatického procesu v játrech a v uzlinách retroperitonea. Systémovou léčbu pacient opět odmítl a léčil se alternativně. Při poslední kontrole v červnu 2016 dosáhla hodnota ctDNA 1054 RFU, CEA bylo 16 µg/l. Na CT byla zřejmá další početní i velikostní progrese choroby. Sérový CA 19-9 zůstal po celou dobu sledování pacienta v normálním laboratorním rozmezí. Hladiny sérových markerů a ctDNA v závislosti na čase a vývoji nádorového onemocnění znázorňuje Obr. 1.
Obr. 1. Změny hladiny ctDNA v průběhu onemocnění
Fig. 1: Changes in ctDNA levels during the disease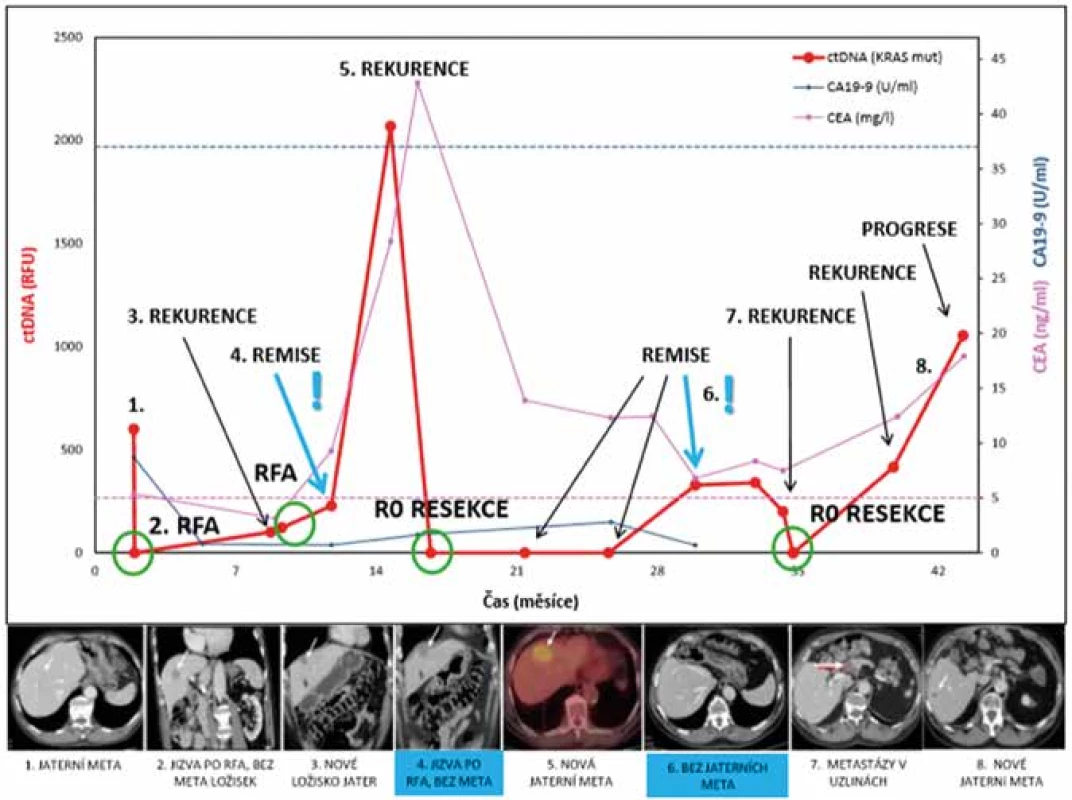
Diskuze
Pokrok v multimodální léčbě s sebou přináší změnu pohledu na KRK. V širším pojetí o něm můžeme mluvit jako o chronickém onemocnění. Hlavním předpokladem úspěšné terapie je jeho časná diagnostika, resp. časné rozpoznání jeho rekurence. Pilířem léčby je radikální chirurgické odstranění nádoru. Určení radikality operace spočívá v definitivním histologickém vyšetření. Laboratorním prognostickým markerem může být právě ctDNA. Hladina ctDNA , resp. její detekovatelnost se mezi různými jedinci liší. Je-li však před operací tumoru u pacienta zachytitelná, dá se očekávat, že se nadále bude chovat v korelaci s přítomnou nádorovou masou [10]. U R2 resekcí bude přítomnost ctDNA u dříve pozitivních pacientů 100 %. Po R1 resekci pak 57 %, zatímco u R0 pacientů v 93 % případů ctDNA nebude detekována. U R0 nebo R1 resekcí s pozitivní ctDNA po operaci bývá rekurence onemocnění časnější mezi 3–7 měsíci, oproti pacientům s nedetekovanou hladinou (7−22 měsíců) [1,8,10,11]. CEA vykazuje výrazně nižší senzitivitu (80 %) a specificitu (70 %) v určení přítomnosti reziduální choroby.
Ze studií vyplývá, že ctDNA je dobrým prediktorem systémové léčby metastazujícího KRK. Ze změny hladiny ctDNA po 1. cyklu aplikované chemoterapie dokážeme předpovědět léčebnou odpověď [12]. Na rozdíl od rutinního stanovení ctDNA je v současné době běžné profilovat somatické mutace KRK (MSI – microsatellite instability, KRAS, BRAF, TP53, APC, PIK3CA, CTNNB1) [8,13]. Jejich znalost má prognostický i prediktivní význam. Mutace KRAS je asociovaná s rezistencí k anti-EGFR léčbě (cetuximab, panitumumab) [3]. Častější výskyt je u lokalizace KRK v pravém kolon a u pacientů s nízkou MSI. Nemá ale jasnou prognostickou hodnotu [5]. Souvislost s odpovědí na anti-EGFR léčbu u KRAS wild type má i mutace BRAF. Prediktivní význam je malý [3]. BRAF disponuje silným prognostickým potenciálem. Přítomnost mutace BRAF obzvláště u tumorů pravého tračníku s nízkou MSI ukazuje na špatnou prognózu. Nádory jsou spojené s lymfatickou a perineurální invazí, často s mucinózní diferenciací. U MSI se i přes rezistenci k alkalyzujícím agens a cisplatině udává lepší prognóza. Pacienti přežívají déle. Prodlužuje se interval doby bez nádoru. V klinické praxi nemá rutinní vyšetřování MSI význam [5].
Existují práce zabývající se detekcí ctDNA u nemetastazujícího KRK, resp. jeho II. stadia. Prioritou je vytipování rizikových pacientů a indikace k adjuvantní systémové léčbě. Pacienti s pooperačně pozitivní hladinou ctDNA mají násobně vyšší riziko radiologické rekurence než pacienti rutinně léčení po operaci pro KRK III. stadia [14].
Mimo sledování léčebné odpovědi se detekce ctDNA uplatňuje v časném záchytu rekurence onemocnění. Jedná se o minimálně invazivní vyšetření s vysokou reprodukovatelností. Hladiny ctDNA mají přímou vazbu na přítomnost nádorové masy, tzv. tumor burden [15]. V diagnostice rekurentního onemocnění u pacientů s předoperační ctDNA pozitivitou se senzitivita i specificita vyšetření blíží 100 % [1,8]. Námi prezentované kazuistické sdělení je jednoznačnou ukázkou využití monitorace hladin ctDNA ke sledování pacienta s KRK v klinické praxi. Hladiny ctDNA po celou dobu přesně korelovaly s pooperačním průběhem onemocnění. Dvakrát dokonce předpověděly progresi nemoci a předešly radiologickému nálezu. Pacient byl na základě detekce ctDNA vyzván k časnější kontrole. CT odhalilo rekurenci metastazujícího procesu. Hladina CA 19-9 neměla žádnou výpovědní hodnotu o průběhu onemocnění, po celou dobu byla v rozmezí normálních hodnot. Hladina CEA zpočátku dobře korelovala s pooperačním průběhem. Jednou však byla falešně negativní. Od čtrnáctého měsíce sledování byla setrvale zvýšená a na rozdíl od ctDNA často falešně pozitivní.
Závěr
Kolorektální karcinom patří celosvětově k nejčastějším zhoubným onemocněním. Časná diagnostika a záchyt rekurence se zahájením léčby mají přímý vliv na přežívání pacientů. Současné nástroje používané ke sledování pacientů s metastazujícím KRK často neodpovídají aktuálnímu průběhu onemocnění. CtDNA se jeví jako slibný marker detekující metastazující KRK v reálném čase. Odběr pacienta nezatěžuje a je snadno reprodukovatelný. Využití má i jako prediktor odpovědi na systémovou léčbu. Může pomoci vytipovat rizikové pacienty ve II. stadiu KRK vhodné k adjuvantní léčbě. Implementace „liquid biopsy“ do klinické praxe může pozitivně ovlivnit péči o nemocné s KRK.
Podpořeno grantem MZ 15-27939A a MO1012.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů
MUDr. Kateřina Menclová
Chirurgická klinika 2. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: katerina.menclova@uvn.cz
Zdroje
- Reinert T, Schøler LV, Thomsen R, et al. Analysis of circulating tumor DNA to monitor disease burden following colorectal cancer surgery. Gut 2016;65 : 625–634. doi:10.1136/gutjnl-2014-308859.
- Labianca R, Nordlinger B, Beretta GD, et al. Early colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013;24(6)64−72. doi:10.1093/annonc/mdt354.
- Kin C, Kidess E, Poultsides GA, et al. Colorectal cancer diagnostics: biomarkers, cell-free DNA, circulating tumor cells and defining heterogeneous populations by single-cell analysis. Expert Review of Molecular Diagnostics 2013;13 : 6,581−599. doi:10.1586/14737159.2013.811896.
- Tie J, Kinde I, Wang Y, et al. Circulating tumor DNA as an early marker of therapeutic response in patients with metastatic colorectal cancer. Ann Oncol. 2015;26 : 1715−1722. doi:10.1093/annonc/mdv177.
- Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics. Cancer J Clin. 2005;55(2):74−108. doi:10.3322/canjclin.55.2.74.
- Bohm B, Schwenk W, Hucke HP, et al. Does methodic long-term follow-up affect survival after curative resection of colorectal carcinoma? Dis Colon Rectum 1993;36 : 280−6. doi:10.1007/bf02053511.
- Chao M, Gibbs P. Caution is required before recommending routine carcinoembryonic antigen and imaging follow-up for patients with early-stage colon cancer. J Clin Oncol. 2015;26,644−656. doi:10.1200/JCO.2009.25.6156.
- Benesova L, Halkova T, Ptackova R, et al. Significance of postoperative follow-up of patients with metastatic colorectal cancer using circulating tumor DNA. World J Gastroenterol. 2019;25(48):6939−6948. doi:10.3748/wjg.v25.i48.6939.
- Diehl F, Li M, Dressman D, et al. Detection and quantification of mutations in the plasma of patients with colorectal tumors. Proc Natl Acad Sci USA 2005;102(45):16368−16373. doi:10.1073/pnas.0507904102.
- Chaudhuri AA, Chabon JJ, Lovejoy AF, et al. Early Detection of molecular residual disease in localized lung cancer by circulating tumor DNA profiling. Cancer Discov. 2017;7(12):1394−1403. doi:10.1158/2159-8290.
- Benesova L, Belsanova B, Suchanek S, et al. Mutation-based detection and monitoring of cell-free tumor DNA in peripheral blood of cancer patients. Anal Biochem. 2013;433(2)227−234. doi:10.1016/j.ab.2012.06.018.
- Bettegowoda C, Sausen M, Leary RJ, et al. Detection of circulating tumor DNA in early - and late-stage human malignancies. Sci Transl Med. 2014;6(224):224ra24. doi:10.1126/scitranslmed.3007094.
- Minarikova P, Benesova L, Belsanova B, et al. Evaluation of circulating-tumor DNA (ctDNA) as a source material for molecular phenotyping of colorectal tumors. J Clin Oncol. 2015;33 : 642. doi:10.1200/jco.2015.33.3_suppl.642.
- Tie J, Wang Y, Tomasetti C, et al. Circulating tumor DNA analysis detects minimal residual disease and predicts recurrence in patients with stage II colon cancer. Sci Transl Med. 2016;8 : 346ra92. doi:10.1126/scitranslmed.aaf6219.
- Benesova L, Belsanova B, Halkova T, et al. The significance of postoperative follow-up of patients with advanced colorectal cancer using circulating tumor DNA: Selected case studies. Cancer Res. 2017;77(3) 524. doi:10.1158/1538-7445.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek HIPEC
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2020 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- HIPEC
- Aktuální možnosti minimálně invazivní terapie divertiklů jícnu
- Pseudomyxom peritonea (PMP) a jeho léčba − dvacetileté zkušenosti jednoho pracoviště
- Výsledky chirurgickej liečby nádorových trombov dolnej dutej žily pri karcinóme obličky
- Chirurgická léčba karcinomu prsu po neoadjuvantní terapii
- Cirkulující nádorová DNA jako biomarker metastazujícího kolorektálního karcinomu − kazuistika
- Podtlaková terapie − účinky a jejich využití, soubor kazuistik
- Komplikovaný priebeh u pacientky s cervikálnou krčnou fascitídou a descendentnou nekrotizujúcou mediastinitídou – kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pseudomyxom peritonea (PMP) a jeho léčba − dvacetileté zkušenosti jednoho pracoviště
- Podtlaková terapie − účinky a jejich využití, soubor kazuistik
- Aktuální možnosti minimálně invazivní terapie divertiklů jícnu
- Chirurgická léčba karcinomu prsu po neoadjuvantní terapii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



