-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci?
Positive sentinel node in breast cancer – when and why also opt for axillary dissection?
One of the central concerns of contemporary mammary surgery is to verify the actual need for axillary dissection (AD) in patients with early breast cancer and positive sentinel lymph node biopsy. Several studies have addressed this issue (ASOCOG Z0011, IBCSG 23-01, MIRROR, EORTC AMAROS). So far, the preliminary results of the ASOCOG Z0011 trial with a median follow-up of 6.3 years and the results of the IBCSG 23-01 trial with a median follow-up of 5 years have been published. The conclusions of both randomized studies have implied that under specific circumstances, there is no significant difference in the local or regional recurrence between patients who had undergone completion AD compared to the patients in whom AD had been omitted. This article summarizes the current knowledge regarding indications for AD in patients with positive sentinel nodes.
Key words:
breast cancer – sentinel lymph node biopsy – axillary lymph node dissection – ACOSOG Z0011 trial
Autoři: P. Krsička 1,2; O. Coufal 1,2
; O. Zapletal
Působiště autorů: Masarykův onkologický ústav, Brno ; Oddělení chirurgické onkologie, přednosta: Prim. MUDr. Z. Eber 1; Klinika komplexní onkologické péče, přednosta: Prof. MUDr. R. Vyzula, CSc. 2
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 12, s. 684-689.
Kategorie: Souhrnné sdělení
Práce je věnována prof. MUDr. Janu Wechslerovi u příležitosti jeho 75. narozenin
Souhrn
V popředí zájmu současné mamární chirurgie je ověřit skutečnou potřebu axilární disekce (AD) u pacientek s časným karcinomem prsu a pozitivní sentinelovou biopsií. Na tuto problematiku se zaměřilo několik studií (např. ASOCOG Z0011, IBCSG 23–01, MIRROR, EORTC AMAROS). Doposud byly zveřejněny výsledky studie ASOCOG Z0011 s mediánem doby sledování pacientek 6,3 roku a studie IBCSG 23-01 s mediánem sledování 5 let. Ze závěrů obou studií vyplývá, že za určitých okolností není významný rozdíl v četnosti lokálních ani regionálních recidiv mezi pacientkami, u nichž byla AD doplněna, oproti pacientkám, u nichž bylo od AD upuštěno. Naše práce přehledovou formou shrnuje současné poznatky v oblasti indikace AD u pacientek s nádorovým postižením sentinelové uzliny.
Klíčová slova:
karcinom prsu – biopsie sentinelové uzliny – disekce axily – ACOSOG Z0011Úvod
Podle tradičního konceptu chirurgické léčby karcinomu prsu představuje pozitivní sentinelová uzlina indikaci k doplnění axilární disekce. Uvažovaný přínos této radikální operace pro pacientku je dvojí: Odstraníme lymfatické uzliny (LU), které mohou být nádorově postiženy, čímž snížíme celkový nádorový objem, zlepšíme tzv. „lokální kontrolu“ onemocnění (local control) a s ní pravděpodobně i celkové přežití. Tento efekt operace lze označit za tzv. kurativní. Dále získáme podrobnější informaci o rozsahu nádorového postižení axily, který je u nemetastatického karcinomu prsu nejvýznamnějším prognostickým faktorem.
V posledních letech se množí přesvědčivé klinické informace, že axilární disekce nepřináší teoreticky zamýšlený prospěch zdaleka všem pacientkám s pozitivní sentinelovou uzlinou. Vezmeme-li v úvahu jednoznačné důkazy o častých a trvalých nežádoucích následcích této operace v čele s lymfedémem, je plně namístě průběžné přehodnocování její klinické role. Panuje všeobecná shoda, že disekce axily je na místě při evidentních klinicky detekovatelných axilárních metastázách, nebo v případě metastáz přetrvávajících i po neoadjuvantní chemoterapii. Rovněž není příliš zpochybňována její indikace u inflamatorního karcinomu. V ostatních situacích, při méně výrazném axilárním nádorovém postižení (low-volume axillary disease), je však vhodné podrobit možné přínosy a rizika axilární disekce kritické analýze.
Klasifikace postižení sentinelové uzliny:
Stav sentinelové uzliny (SN) na základě histopatologického vyšetření je rozdělován do následujících kategorií [1]:
- pN0 – sentinelová uzlina negativní. Do této kategorie patří i případný nález izolovaných nádorových buněk (Isolated tumor cells, ITC), které jsou zpravidla detekovány imunohistochemickými nebo molekulárními metodami,
- pN1(mi) – mikrometastázy o velikosti 0,2–2 mm v největším rozměru,
- pN1 – metastázy v 1–3 stejnostranných axilárních mízních uzlinách. Metastáza je větší než 2 mm v největším rozměru a bývá označována i jako tzv. makrometastáza.
Běžné vyšetření uzlin dříve představovalo mikroskopické prohlédnutí několika řezů uzlinou obarvených hematoxylinem a eozinem (H&E). Při sentinelové biopsii je však namísto někdejšího axilárního disekátu dodána k vyšetření pouhá jedna nebo několik málo lymfatických uzlin. Relativně malý objem vyšetřované tkáně tak umožňuje sériové prokrojení uzliny a aplikaci senzitivních imunohistochemických (IHC) či dokonce molekulárních metod. Podrobnější vyšetření s sebou ve zvýšené míře přináší záchyt dvou výše uvedených kategorií, tedy ITC a mikrometastáz [2]. Tyto jsou někdy označovány též jako minimální formy nádorového postižení, nebo – pokud jsou zjištěny výlučně doplňkovým vyšetřením – okultní (mikro)metastázy. Z výzkumného hlediska jsou podrobnější poznatky jistě žádoucí, problém však nastává při jejich interpretaci v klinické praxi. Významem minimálních forem uzlinového postižení se zabývalo několik studií.
Minimální postižení sentinelové uzliny – prognostický význam:
ITC zpravidla nevykazují známky metastatické aktivity a tyto případy by měly být i podle TNM klasifikace označovány jako pN0 [1]. Již od roku 2004 panuje konsenzus, že izolované nádorové buňky v sentinelové uzlině nemají jednoznačný klinický význam a nepředstavují indikaci k axilární disekci [3].
Retrospektivní studie MIRROR posuzovala vliv přítomnosti ITC a mikrometastázy v SN na pětileté přežití bez známek onemocnění (disease free survival, DFS). Vycházela z údajů od všech pacientek s karcinomem prsu, které prodělaly biopsii sentinelové uzliny v Holandsku do roku 2006. Byly vybrány ženy, u nichž byly v uzlinách zjištěny ITC nebo mikrometastázy, ovšem primární nádory vykazovaly poměrně příznivé prognostické parametry. Z analýzy vyplývá, že u pacientek s ITC nebo mikrometastázou, které neměly žádnou systémovou léčbu, bylo přežití bez známek onemocnění výrazně horší (cca o 10 %) než u pacientek s adjuvantní systémovou léčbou. Minimální postižení axilárních uzlin tedy může být spojeno s horší prognózou, nicméně systémová léčba je schopna tento negativní prognostický efekt minimalizovat. Vliv případné disekce axily nebylo možné v této studii posoudit [4].
Prognostický význam minimálních forem postižení sentinelové uzliny zjištěných pomocí IHC byl zdokumentován i ve dvou velkých prospektivních studiích ACOSOG Z0010 [5] a NSABP B-32 [6]. Pacientky byly léčeny jen na základě nálezů v sentinelových uzlinách zjištěných běžným vyšetřením při barvení hematoxylinem a eozinem (H&E). Uzliny byly až dodatečně vyšetřeny pomocí IHC tak, aby ani pacientka, ani ošetřující lékař neznali výsledek. V první jmenované studii byly zjištěny okultní metastázy v 10,5 % ze 3326 vzorků a jejich vliv na přežití se statisticky neprokázal. Ve studii B-32 byly okultní metastázy pomocí imunohistochemických metod nalezeny u 15,9 % z 3887 pacientek. Jejich výskyt byl spojen s horším přežitím bez známek onemocnění (DFS) i celkovým přežitím (overall survival, OS). Rozdíl v celkovém přežití však dosáhl jen pouhých 1,2 % (94,6 % versus 95,8 %). Na základě těchto výsledků většina současných doporučení uzavírá, že nálezy zjištěné jen imunohistochemicky při negativním základním vyšetření H&E nejsou natolik klinicky významné, aby opravňovaly užívání IHC v běžné klinické praxi [7].
Mikrometastázy v sentinelové uzlině a vynechání axilární disekce:
Z výše uvedeného lze vyvodit, že při zvažování axilární disekce bychom nemuseli přihlížet k nálezům v sentinelové uzlině, které byly zjištěny pouze imunohistochemicky. Faktem však je, že řada (ne-li většina) histopatologických pracovišť tyto metody při vyšetřování sentinelových uzlin používá a promítá je do svých závěrů. Při nálezu mikrometastázy jen pomocí IHC pak těžko můžeme argumentovat, že vlastně neměla být nalezena.
V letošním roce byly zveřejněny výsledky randomizované prospektivní studie IBCSG 23-01 [8]. Jejím cílem bylo zjistit, zda při nálezu mikrometastázy (nebo mikrometastáz) v sentinelové uzlině není vynechání axilární disekce spojeno s horším DFS, než pokud je disekce doplněna (non-inferiority study). Podmínkou k zařazení byly:
- palpačně fyziologické uzliny v axile (cN0),
- velikost primárního nádoru do 5 cm,
- absence extrakapsulárního šíření mikrometastázy.
Během let 2001–2010 bylo do ramene s axilární disekcí zařazeno 465 pacientek, do ramene bez disekce 469 pacientek. Sekundárními cíli studie bylo celkové přežití (OS), typ relapsu a četnost chirurgických komplikací. Po mediánu sledování 5 let nebylo zjištěno, že by vynechání axilární disekce vedlo k horšímu DFS či OS. V souladu s očekáváním se v rameni s axilární disekcí vyskytovalo více nežádoucích účinků chirurgické léčby (neuropatie, lymfedém). Blíže jsou výsledky studie IBCSG 23-01 shrnuty v tabulce (Tab. 1).
Tab. 1. Přehled výsledků studie IBCSG 23-01 Tab. 1: Overview of results of the IBCSG 23-01 trial 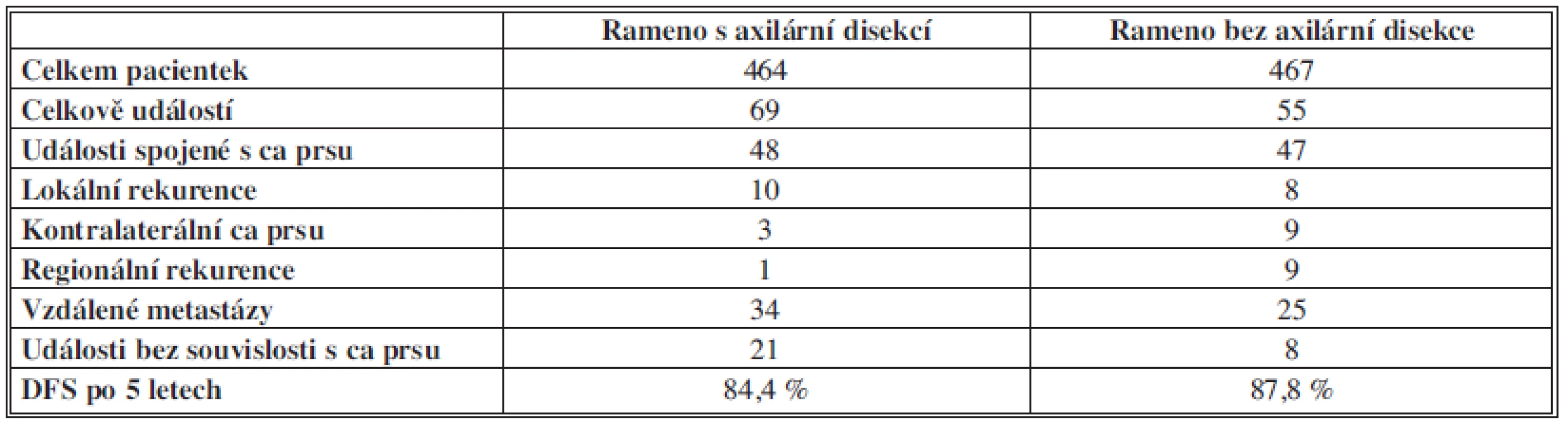
Makrometastázy a studie ACOSOG Z0011:
Ještě překvapivější klinická zjištění byla učiněna v situacích, kdy je sentinelová uzlina postižena makrometastázou. Z několika převážně retrospektivních studií vyplývá, že vynechávání axilární disekce u pacientek s jinak příznivějšími prognostickými parametry není spojeno s významným nárůstem regionálních recidiv. Četnost axilárních relapsů se pohybuje v oblasti několika málo procent [9], a bývá výrazně menší, než by odpovídalo pravděpodobnosti metastatického postižení nesentinelových uzlin podle některého z četných dosud zveřejněných prediktivních modelů [10,11]. Tato fakta podporují představu, že nádorové buňky uzlinových metastáz nevykazují přílišnou agresivitu ke svému hostiteli a většinou se klinicky neprojeví, ani pokud nejsou chirurgicky odstraněny.
Studie American College of Surgeos Oncology Group (ACOSOG) Z0011 [12–14] si dala za cíl ověřit, zda při nálezu metastázy v sentinelové uzlině není vynechání axilární disekce spojeno s horším celkovým přežitím, sekundárně také DFS, než pokud je disekce axily doplněna. Dalším dílčím cílem bylo také sledování nežádoucích účinků chirurgické léčby. Vstupními kritérii byly:
- primární nádor T1–T2,
- konzervativní resekční výkon na prsu (parciální mastektomie),
- klinická nepřítomnost patologických uzlin (cN0),
- maximálně dvě postižené sentinelové uzliny a absence extrakapsulárního šíření metastáz či uzlinových paketů,
- operační výkon byl vždy doplněn standardní radioterapií na oblast prsu a pacientky absolvovaly systémovou léčbu dle běžné klinické rozvahy.
Sentinelové uzliny byly vyšetřovány základním způsobem pomocí H&E. Při nálezu metastázy byly pacientky randomizovány, do ramene s axilární disekcí a do ramene bez disekce. Do studie bylo v letech 1999–2004 zařazeno 891 pacientek. Do ramene s axilární disekcí bylo randomizováno 445 pacientek a do ramene bez disekce 446 pacientek. Po mediánu sledování 6,3 roku, do 4/2010, nebylo zjištěno, že by vynechání axilární disekce vedlo k horšímu OS nebo DFS. Blíže jsou výsledky studie Z0011 shrnuty v tabulce (Tab. 2).
Tab. 2. Přehled výsledků studie ACOSOG Z0011 Tab. 2: Overview of the results of ACOSOG Z0011 trial 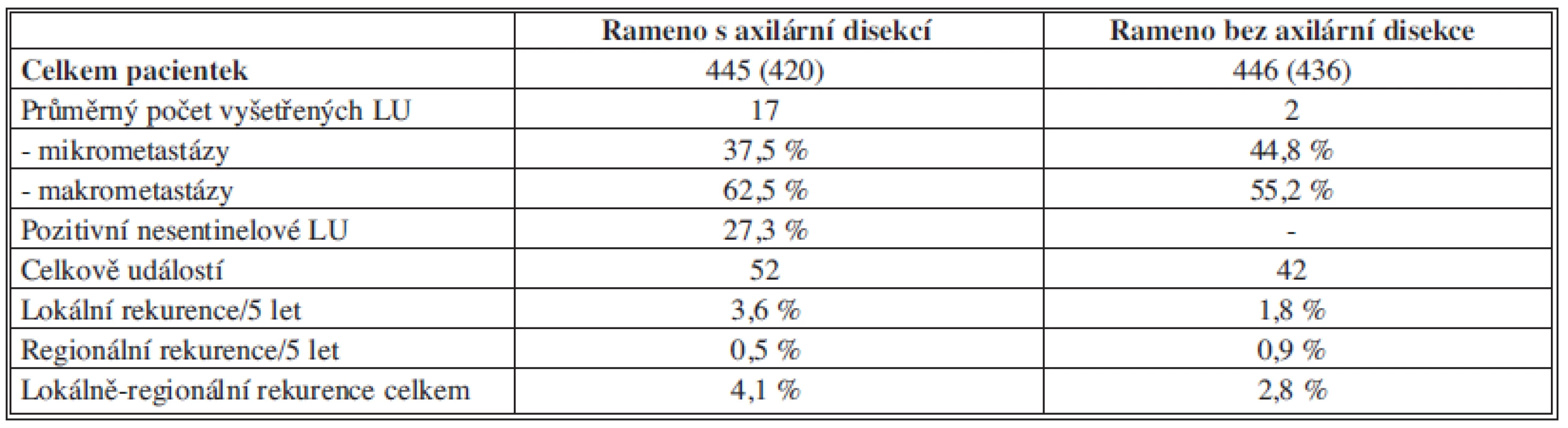
Závěry studie Z0011 však nebyly přijaty kladně celou odbornou veřejností. Někteří odborníci označili tuto studii za příliš provokativní a kontroverzní na to, aby zásadním způsobem měnila dlouhodobě zavedenou praxi. Objevilo se několik prací, které se snaží závěry Z0011 kriticky přehodnotit [15,16]. Výtky poukazují zejména na fakt, že nábor do studie byl pomalý a nepodařilo se zařadit plánovaný počet 1900 pacientek s definitivní analýzou po úmrtí 500 žen. Na pomalém náboru se podílela nízká četnost cílových událostí a zřejmě nepříliš velká ochota lékařů zařazovat své pacientky do studie. Bylo již zřejmé, že disekce axily pro ně nepřináší podstatnou výhodu, tedy je nechtěli případnou disekcí zbytečně poškozovat. Je velmi pravděpodobné, že zařazení většího počtu pacientek by dosažené výsledky studie nikterak nezměnilo.
Také bylo upozorněno, že do studie byly zařazovány především starší ženy se SR-pozitivními nádory (SR = steroidní receptory), jejichž prognóza je všeobecně považována za lepší. To však odráží běžnou klinickou praxi, kdy nejvyšší incidenci karcinomu prsu pozorujeme ve vyšších věkových skupinách a většina nádorů je SR-pozitivních. Navíc není prokázáno, že by u nádorů s negativními steroidními receptory byly častěji postiženy regionální uzliny nebo že by tyto nádory měly relativně vyšší podíl regionálních rekurencí.
Zazněla kritika i kvůli relativně krátké době sledování pacientek (follow-up) a absenci bližších informací o adjuvantní radioterapii. V některých případech nebyl detailně zaznamenán rozsah adjuvantní léčby a asi 10 % pacientek se nedostavilo na pravidelnou dispenzární kontrolu.
Při interpretaci studie Z0011 je důležité podtrhnout skutečnost, že její výsledky lze vztahovat pouze na pacientky, které splňují výše uvedená vstupní kritéria, tedy především:
- palpačně negativní uzliny před zahájením léčby (cN0),
- primární nádor do velikosti 5 cm,
- konzervativní resekční výkon doplněný standardní radioterapií na oblast prsu ze dvou tangenciálních polí,
- maximálně dvě pozitivní sentinelové uzliny s absencí extrakapsulárního šíření uzlinových metastáz [7,12,13].
Prognostický a prediktivní význam axilární disekce – vliv na ostatní léčebné modality:
Dvě výše zmíněné studie (IBCSG 23-01 a ACOSOG Z0011) posuzovaly význam axilární disekce z hlediska kurativního. Nelze však pominout její význam prognostický a prediktivní, slangově nazýván též „stagingový“. Stav axilárních uzlin je u karcinomu prsu nejsilnějším prognostickým faktorem. Samotný odhad prognózy onemocnění by však neospravedlňoval vysokou morbiditu, kterou jsou operované ženy zatíženy. Předpoklad horší prognózy ale může sloužit jako podklad k indikaci agresivnější adjuvantní léčby – chemoterapie a radioterapie. Můžeme tedy hovořit i o prediktivním významu axilární disekce, který spolurozhoduje o indikaci ostatních léčebných modalit.
Samotná sentinelová biopsie poskytne základní informaci – zda jsou regionální uzliny postiženy nebo nepostiženy. Doplněním axilární disekce získáme její zpřesnění, tj. kolik uzlin je postiženo. Dopad této informace na volbu systémové léčby však pozvolna ustupuje do pozadí. Hlavním faktorem rozhodujícím o podání systémové terapie je v současné době fenotyp nádoru [17]. Triple-negativní nádory jsou léčeny adjuvantní chemoterapií, HER2-pozitivní nádory chemoterapií v kombinaci s biologickou léčbou. U nádorů typu „luminal A“ s pozitivními steroidními receptory (SR) a poměrně příznivou prognózou je podávána pouze adjuvantní hormonální léčba. Nejednoznačná situace tak zpravidla vzniká jen u SR-pozitivních a HER2-negativních nádorů s grade G2 či G3, střední či vyšší proliferační aktivitou a případnou angioinvazí.
Vlivem axilární disekce, resp. jejího vynechání na indikaci systémové chemoterapie se zabývala práce italských autorů [18]. Retrospektivně identifikovali 321 žen s časným karcinomem prsu a jednou či dvěma postiženými sentinelovými uzlinami, tedy takových žen, u nichž by podle závěrů studie ACOSOG Z0011 mohla být disekce axily vynechána. Tyto ženy však ve skutečnosti disekci axily prodělaly. Případ každé ženy byl zaslepeně posouzen místním mamárním týmem, který měl rozhodnout o indikaci chemoterapie v kategoriích: 1) doporučit, 2) ke zvážení, 3) nedoporučit. V prvním kole posuzovatelé neznali informaci z doplněné axilární disekce, tedy jaký byl počet postižených nesentinelových uzlin (NSLN), tato informace jim byla dodána až pro druhé kolo posuzování. Dodatečná informace z axilární disekce vedla ke změně doporučení u 52 žen (16 %). Většina změn směřovala k podání chemoterapie a v naprosté většině případů se jednalo o nádory SR-pozitivní a HER2-negativní. Autoři práce uzavírají, že vynechání axilární disekce u pacientek s jednou či dvěma postiženými sentinelovými uzlinami může změnit indikaci adjuvantní chemoterapie u nezanedbatelného podílu pacientek se SR-pozitivními a HER2-negativními nádory a že bychom v rozvaze měli přihlížet i k tomuto faktu. Ve studiích IBCSG 23-01 a ACOSOG Z0011 však v konzervativním rameni (pouze SNB) informace z disekátu axily k dispozici nebyla a ženy byly adjuvantně léčeny jen na základě informace získané z primárního nádoru a sentinelových uzlin. Přesto jsou výsledky léčby v obou ramenech z dosavadního pohledu srovnatelné. Nyní navíc nalézají uplatnění při rozhodování o adjuvantní chemoterapii i genové analýzy (např. Oncotype DX, MammaPrint). Až čas tedy ukáže, do jaké míry bude stav nesentinelových uzlin důležitý pro indikační rozvahu v blízké budoucnosti.
Zaznamenáváme také trend posunu chemoterapie do neoadjuvantního podání, tedy před operaci, a to i u nádorů časných stadií. Tato praxe poněkud oživila diskuze o indikacích či kontraindikacích sentinelové biopsie a axilární disekce. Z dnešního pohledu se jeví jako nezbytné, aby i u pacientek po neoadjuvantní chemoterapii byl přijat koncept biopsie sentinelové uzliny namísto paušálních disekcí, nechceme-li vývoj směřující ke snižování morbidity chirurgické léčby obrátit opačným směrem. Využití potenciálu neoadjuvantní léčby i v chirurgických přístupech by mohlo naopak vést k selekci axilárních disekcí skutečně jen na ty pacientky, jejichž nádory prokážou určitou míru chemorezistence, kdy axilární metastázy přetrvají i po podání neoadjuvantní léčby.
Snad ještě podstatnější, či rozsáhleji diskutován, je vliv informace z doplněné axilární disekce na volbu adjuvantní radioterapie. Přítomnost 4 a více postižených uzlin v axilárním disekátu představuje široce přijímané indikační kritérium pro podání radioterapie na oblast axilárních uzlin a hrudní stěny po totální mastektomii. Při postižení 1–3 uzlin spolurozhoduje i přítomnost dalších rizikových faktorů vycházejících z vlastností nádoru a pacientky. Vynecháme-li axilární disekci, bude celkový počet postižených uzlin neznámý. Radiační onkolog může takovou situaci posuzovat jako neadekvátní zajištění chirurgického axilárního „stagingu“ a cíleně indikovat radioterapii na oblast regionálních uzlin jako alternativu k disekci. Účinek radioterapie v této indikaci však není dostatečně prověřen, věnuje se mu studie EORTC AMAROS. Ženy zařazené do této studie byly randomizovány do dvou ramen, do ramene s AD a do ramene bez AD – v této skupině je doplňována radioterapie (RT) na oblast axily. Východiskem studie AMAROS je předpoklad, že RT je méně invazivní a také zatížena méně výraznými dlouhodobými nežádoucími účinky, tedy je lépe tolerována než AD. Výsledky této studie zatím nebyly zveřejněny [19].
Druhá možnost přístupu radiačních onkologů odráží poznatky studií IBCSG 23-01 a ACOSOG Z0011, kdy pacientky randomizované do ramene bez disekce neabsolvovaly žádnou radioterapii „navíc“ oproti standardnímu přístupu. Tangenciální pole cílená na oblast prsu po parciální mastektomii zahrnují i kaudální část axily a předpokládá se, že mohou eliminovat i nádorový proces v uzlinách. Z toho důvodu není možné vztahovat výsledky studie ACOSOG Z0011 na pacientky po totální mastektomií, které běžně radioterapii neabsolvují, nemají-li výraznější uzlinové postižení či ostatní výše zmíněné rizikové faktory. Práce autorů z Memorial Sloan-Kettering Cancer Center zaměřená na téma ozařovacích polí při vynechání axilární disekce uzavírá, že tzv. regionální kontrola onemocnění u pacientek po parciální mastektomii s méně výrazným uzlinovým postižením a vynechanou disekcí axily je velmi dobrá (99 % po 4 letech) bez ohledu na to, zda axila byla nebo nebyla ozářena. Dostatečné se jeví standardní ozáření prsu [20]. Nutno však připustit, že názory na tuto problematiku nejsou jednoznačné a postupně se vyvíjejí.
Závěr
Studie ACOSOG Z0011 a nověji i IBCSG 23-01 přinášejí revoluci do našeho vnímání významu axilární disekce po pozitivní sentinelové biopsii. V posledních letech je poměrně široce akceptováno její vynechání při mikrometastázách [21,22]. Závěry konference v St. Gallen 2011 připouštějí nedoplňovat disekci ani v případě makrometastáz, pokud pacientka splňuje vstupní kritéria studie ACOSOG Z0011 [7,23]. Z řady publikací menšího rozsahu vyplývá, že vynechávání axilární disekce není v praxi na špičkových pracovištích zřídkavým jevem [24–30]. Je zřejmé, že četnost axilárních relapsů je velmi nízká, mnohem nižší, než odpovídá pravděpodobnosti metastáz v non-sentinelových uzlinách dle některého ze zveřejněných modelů, a že tedy kurativní význam disekce při uzlinovém postižení menšího rozsahu (low volume) je zanedbatelný, pokud vůbec nějaký. Indikace adjuvantní systémové léčby vychází převážně z nádorového fenotypu stanoveného histopatologickým vyšetřením primárního nádoru. Stav axilárních uzlin má v tomto ohledu až druhořadý význam a není zřejmé, zda informace z axilární disekce vyváží rizika svých dlouhodobých komplikací. Vzhledem k rychlosti vývoje poznatků a stratifikaci léčby nelze očekávat, že by byla otázka indikací axilární disekce po pozitivní sentinelové biopsii brzy definitivně uzavřena. Ačkoli se to může jevit jako klišé, více než kde jinde je zde třeba individualizovaný přístup, který zohlední možný kurativní význam operace, eventuální přínos pro volbu adjuvantní léčby a v neposlední řadě i názor informované pacientky. Není možné spoléhat se na jednoduché guidelines, protože takové nelze na základě současných poznatků zodpovědně vytvořit. V žádném případě nedoporučujeme běžné vynechávání axilární disekce těmi lékaři, kteří nejsou v problematice dostatečně orientováni.
Tyto skutečnosti akcentují význam teoretických znalostí mamárních chirurgů a kooperativní komunikaci s interními i radiačními onkology a patology. Je stále zřejmější, že chirurgická léčba karcinomu prsu vyžaduje značný stupeň koncentrace na specializovaná pracoviště.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101).
Práce byla financována z institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR Masarykovu onkologickému ústavu.
MUDr. Petr Krsička
Masarykův onkologický ústav
Oddělení chirurgické onkologie; Žlutý kopec 7
656 53 Brno
e-mail: petr.krsicka@gmail.com
Zdroje
1. Sobin LH, Gospodarowicz MK, Wittekind CH. TNM klasifikace zhoubných novotvarů. 7. Vydání 2009, Ústav zdravotnických informací a statistiky, česká verze 2011.
2. Moore KH, Thaler HT, Tan LK, Borgen PI, Cody HS. Immunohistochemically detected tumor cells in the sentinel lymph nodes of patients with breast carcinoma: biologic metastasis or procedural artefact? Cancer 2004;100 : 929–934.
3. ASCO Guideline Recommendations for Sentinel Lymph Node Biopsy in Early-Stage Breast Cancer: Guideline Summary. J Oncol Pract 2005;1 : 134–136.
4. de Boer M, van Deurzen CH, van Dijck JA, et al. Micrometastases or isolated tumor cells and the outcome of breast cancer. N Engl J Med 2009;361 : 653–63.
5. Giuliano AE, Hawes D, Ballman KV, Whitworth PW, Blumencranz PW, et al. Association of occult metastases in sentinel lymph nodes and bone marrow with survival among women with early-stage invasive breast cancer. JAMA 2011;306 : 385–93.
6. Weaver DL, Ashikaga T, Krag DN, Skelly JM, Anderson SJ, et al. Effect of occult metastases on survival in node-negative breast cancer. N Engl J Med 2011;364 : 412–21.
7. The American Society of Breast Surgeons. Position Statement on Management of the Axilla in Patients With Invasive Breast Cancer. Dostupný na https://www.breastsurgeons.org/statements/PDF_Statements/Axillary_Management.pdf>.
8. Galimberti V, Cole BF, Zurrida S, Viale G, Luini A, et al. Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial. Lancet Oncol 2013;14 : 297–305.
9. Yi M, Giordano SH, Meric-Bernstam F, Mittendorf EA, Kuerer HM, et al. Trends in and outcomes from sentinel lymf node biopsy (SLNB) alone vs. SLNB with axillary lymph node dissection for node-positive breast cancer patiens: experience from the SEER diabase. Ann Surg Oncol 2010;17 Suppl3 : 343–51.
10. Van Zee KJ, Manasseh DM, Bevilacqua JL, Boolbol SK, Fey JV, et al. A nomogram for predicting the likelihood of additional nodal metastases in breast cancer patients with a positive sentinel node biopsy. Ann Surg Oncol 2003;10 : 1140–51.
11. Coufal O, Pavlik T, Fabian P, Bori R, Boross G, et al. Predicting Non-Sentinel Lymph Node Status After Positive Sentinel Biopsy in Breast Cancer: What Model Performs the Best in a Czech Population? Pathology & Oncology Research 2009;15 : 733–40.
12. Giuliano AE, Hunt KK, Ballman KV, Beitsch PD, Whitworth PW, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial. JAMA 2011;305 : 569–75.
13. Giuliano AE, McCall L, Beitsch P, et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases: the American College of Surgeons Oncology Group Z0011 randomized trial. Ann Surg 2010;252 : 426–32.
14. Giuliano AE. ACOSOG Z0011: A randomized trial of axillary node dissection in women with clinical T1–2 N0M0 breast cancer who have a positive sentinel node. ASCO Annual Meeting 2010, CRA506.
15. Gatzemeier W, Bruce Mann G. Which sentinel lymph-node (SLN) positive breast cancer patient needs an axillary lymph-node dissection (ALND) – ACOSOG Z0011 results and beyond. Breast 2013:S0960-9776(13)00032–5.
16. Giuliano AE, Morrow M, Duggal S, Julian TB. Should ACOSOG Z0011 change practice with respect to axillary lymph node dissection for a positive sentinel lymph node biopsy in breast cancer? Clin Exp Metastasis 2012;29 : 687–92.
17. Grant M, Harbeck N, Thomssen Ch. St. Gallen 2011: Summary of the Consensus Discussion. Breast Care, Basel 2011; 6 : 136–141.
18. Montemurro F, Maggiorotto F, Valabrega G, Kubatzki F, Rossi V, et al. Omission of axillary dissection after a positive sentinel node dissection may influence adjuvant chemotherapy indications in operable breast cancer patients. Ann Surg Oncol 2012;19 : 3755–61.
19. Straver ME, Meijnen P, van Tienhoven G, et al. Role of axillary clearance after a tumor-positive sentinel node in the administration of adjuvant therapy in early breast cancer. J Clin Oncol 2010;28 : 731–7.
20. Setton J, et al: Radiation Field Design and Regional Control in Sentinel Lymph Node-Positive Breast Cancer Patients With Omission of Axillary Dissection. Cancer 2012;118 : 1994–2003.
21. Morrow M, Giuliano AE. To cut is to cure: can we really apply Z11 in practice? Ann Surg Oncol 2011;18 : 2413–5.
22. Galimberti V, Chifu C, Rodriguez Perez S, Veronesi P, Intra M,et al. Positive axillary sentinel lymph node: is axillary dissection always necessary? Breast 2011;20,Suppl3:S96–8.
23. Goldhirsch A, Wood WC, Coates AS, Gelber RD, Thürlimann B, et al. Panel members. Strategies for subtypes-dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011;22 : 1736–47.
24. Pazaiti A, Fentiman IS. Which patients need an axillary clearance after sentinel node biopsy? Int J Breast Cancer 2011 : 195892. doi: 10.4061/2011/195892. Epub 2011 Aug 24.
25. Kotoč J, Kotočová K, Gatěk J, Duben J, Vážan P, et al. Mikrometastáza v sentinelové uzlině – nutnost disekce axilárních uzlin? Prakt Lék 2009;89 : 587–590.
26. Coufal O, Fait V. Chirurgická léčba karcinomu prsu. Praha, Grada 2011 : 207–52.
27. Gatek J, Vrana D, Hnatek L, Bakala J, Dudesek B, et al. Sentinel node biopsy and neoadjuvant chemotherapy in the treatment of breast cancer. J BUON 2012;17 : 265–70.
28. Coufal O, Vrtelova P, Krsicka P. Operace mízních uzlin u karcinomů prsu – současný pohled. Postgraduální medicína 2012;14 : 376–383.
29. Zapletal O, Coufal O, Selingerová I, Krsička P, Vrtělová P. The number of removed axillary sentinel lymph nodes and its impact on the diagnostic accuracy of sentinel lymph node biopsy in breast cancer. Rozhl Chir 2013;92 : 21–6.
30. Fait V, Coufal O, Gatěk J. Chirurgie karcinomu prsu v České republice. Rozhl Chir 2010;89 : 229–230.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2013 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci?
- Je celkové přežití objektivním kritériem kvality chirurgické léčby kolorektálního karcinomu?
- K 80. narozeninám prim. MUDr. Vojtecha Blaška
- Opakované plicní resekce v chirurgii plicních metastáz
- Miniinvazivní videoasistovaná paratyreoidektomie (MIVAP) v terapii primární hyperparatyreózy (pHPT)
- Zvýšení kvality histopatologického hodnocení preparátů kolorektálního karcinomu prostřednictvím zavedení standardního protokolu
- Zemřel primář MUDr. Jiří Hamous
- Je přesná předoperační diagnostika cystických lézí pankreatu možná?
- K životnímu jubileu docenta Vladimíra Visokaie
- Retrospektívna analýza krátkodobých a strednodobých výsledkov perkutánnej endovaskulárnej liečby pacientov s aneuryzmou abdominálnej aorty
- Zdvojení žlučníku a duktus cystikus jako raritní nález při cholecystektomii – kazuistika
- Epiteliální cysta intrapankreaticky uložené akcesorní sleziny – kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci?
- Epiteliální cysta intrapankreaticky uložené akcesorní sleziny – kazuistika
- Miniinvazivní videoasistovaná paratyreoidektomie (MIVAP) v terapii primární hyperparatyreózy (pHPT)
- Zdvojení žlučníku a duktus cystikus jako raritní nález při cholecystektomii – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



