-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mikroprostředí spinocelulárního karcinomu hlavy a krku jako analogie hojící se rány
Microenvironment of squamous cell carcinoma of the head and neck as an analogy of a healing wound
Numerous interactions occur among fibroblasts, keratinocytes and immune cells during wound healing. The release of cytokines supports formation of granular tissue which then fills the wound. A chronic wound appears when this complex process is disrupted. We can see this problem in patients with diabetes. Granular tissue is very similar to the stroma of solid tumors. This work is focused on parallels between a healing wound and tumor. It aims to clearly describe the regulation of both processes. New knowledge in this field can contribute to revealing new therapeutic possibilities in chronic wounds and solid tumors.
Keywords:
squamous cell carcinoma – Head and neck tumors – healing – tumor microenvironment
Autoři: V. Bandúrová 1,2
; K. Smetana 2
; J. Plzák 1,2
; B. Dvořánková 2
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN v Motole, Praha 1; Anatomický ústav 1. LF UK, Praha 2
Vyšlo v časopise: Otorinolaryngol Foniatr, 71, 2022, No. 1, pp. 18-23.
Kategorie: Přehledový článek
doi: https://doi.org/10.48095/ccorl202218Souhrn
V průběhu hojení dochází k četným interakcím mezi fibroblasty, keratinocyty a buňkami imunitního systému. Uvolňování cytokinů podporuje tvorbu granulační tkáně, která vyplňuje poraněné místo. V případě narušení regulace tohoto komplexního děje dojde ke vzniku chronické rány. Tento problém často vídáme např. u diabetiků. Granulační tkáň je velmi podobná stromatu solidních nádorů. Tato práce se věnuje paralelám mezi hojící se ránou a nádorem. Klade si za cíl přehledně popsat regulaci obou procesů. Nové poznatky v této oblasti by mohly přispět k objevení nových terapeutických možností u chronických ran i solidních nádorů.
Klíčová slova:
dlaždicobuněčný karcinom – hojení – nádory hlavy a krku – nádorové mikroprostředí
Úvod
Hojení je proces, při kterém dochází k náhradě poškozené tkáně. Může probíhat dvěma způsoby. U menších poranění, kdy je organizmus schopen poškozenou tkáň nahradit funkčně rovnocennou tkání (restitutio ad integrum), mluvíme o regeneraci. V případě větších poranění mluvíme o reparaci, kdy v místě poranění vzniká jizva (sanatio per cicatricem) [1]. V obou případech hojení začíná po hemokoagulaci zánětlivou fází, po které následuje fáze proliferační a poté finální remodelační. Při selhání regulačních mechanizmů může zánětlivá fáze hojení přejít do chronického stavu. V průběhu těchto dějů se produkuje velké množství růstových faktorů a dochází k nadměrnému množení buněk. Z toho důvodu je chronický zánět jedním z hlavních rizikových faktorů vzniku nádoru [2]. Na hlavě a krku je infekční a zánětlivý původ nádoru potvrzen už u několika anatomických lokalit. V orofaryngu jsou to nádory způsobené papilomaviry, u karcinomu nosohltanu je původcem infekce virus Epsteina-Barrové. Ač konkrétní patologické dráhy mají jednotlivé viry odlišné, společným rysem je jisté oslabení imunity nemocných, které vede v propuknutí nádorové nemoci a posléze také znesnadňuje léčbu [3]. U HPV asociovaných nádorů je dokázaná přítomnost tzv. nádorově asociovaných makrofágů a lymfocytů, které vytvářejí nádoru imunoprivilegované prostředí, což představuje velkou terapeutickou výzvu pro klinické onkology [4].
Délka hojení závisí na věku a na celkovém zdravotním stavu pacienta, případně na přidružené infekci. Obzvláště po onkologických operacích na hlavě a krku jsou infekce a případné píštěle relativně časté, a tím způsobují opoždění následné adjuvantní léčby [5] a zhoršují prognózu pacienta. Pooperační (adjuvantní) radioterapie či chemoradioterapie má být podle platných aktuálních doporučení zahájena do 6 týdnů od chirurgického výkonu [6]. Velká část nemocných kvůli komplikovanému hojení a dalším faktorům zahajuje následnou onkologickou terapii později. Podle údajů z USA se jedná až o 55 % pacientů [7]. Z výše uvedených důvodů se neustále obnovují doporučení, jak pooperačním komplikacím předcházet. Nejvíce diskutovanými tématy jsou vhodná antibiotická profylaxe a rekonstrukční postupy po rozsáhlých operačních výkonech [8]. Předpokladem úspěšné aplikace nových postupů v léčbě je porozumění základním patofyziologickým dějům, které hojení regulují. Pochopení těchto mechanizmů by mohlo vést ke zkvalitnění a zrychlení léčebných postupů a bylo by přínosem nejen pro pacienty po rozsáhlých operacích hlavy a krku, ale i pro léčbu ran v ostatních oblastech medicíny.
Hojení
Hojení představuje kaskádu po sobě jdoucích a navzájem se překrývajících dějů. Průběh hojení je ovlivněn produkcí velkého množství růstových faktorů na straně jedné a mezibuněčnými interakcemi na straně druhé. Výsledkem tohoto komplexního procesu je obnovení integrity porušené tkáně pomocí jizvy [9]. Na průběhu hojení se podílejí buněčné populace rezidentní v poškozené tkáni i buňky, které do místa poranění aktivně migrují. Buněčné populace spolu mohou interagovat přímými fyzickými kontakty. Pro vznik prostředí, které usnadňuje hojení, je zásadní produkce velkého množství cytokinů, chemokinů i růstových faktorů, které umožňují buňkám interagovat na krátké vzdálenosti, tedy parakrinně. V úvahu je ale třeba brát i faktory působící na úrovni celého organizmu (endokrinně), tedy zejména hormony typické pro stresovou fázi. Svou roli v zadržení těchto malých molekul v místě hojení pak sehrává i extracelulární matrix, která může jednotlivé molekuly vázat i uvolňovat, a vytvářet tak jakousi depotní zásobu.
Hojení začíná hemostázou a vytvořením fibrinové zátky. Pokračuje tzv. sterilním zánětem, v jehož průběhu je produkováno velké množství cytokinů a chemokinů, které vedou k diferenciaci fibroblastů v myofibroblasty [10]. Za diferenciaci fibroblastů směrem k myofibroblastům je odpovědná zejména lokální produkce transformujícího růstového faktoru beta (transforming growth factor beta – TGFb). V in vitro experimentech bylo dokázáno, že přechod fibroblastů na myofibroblasty mohou stimulovat i další proteiny např. galektin-1 [11]. Myofibroblasty způsobují kontrakci rány a produkují velké množství extracelulární matrix [12]. Byl prokázán významný vliv komponent extracelulární matrix (extracellular matrix – ECM) na hojení tkáňového poškození [13]. Nejhojnějším proteinem ECM je fibronektin. Podrobnějším výzkumem tohoto glykoproteinu se zjistilo, že plní nejen mechanickou funkci, ale je také „rezervoárem“ růstových faktorů, které se na něj navazují. Tím přispívá k diferenciaci jak fibroblastů, tak keratinocytů a stává se vhodným cílem medikamentózní podpory hojení [14]. Své místo v ECM má i tenascin. Je asociován s efektivním hojením sliznic v orofaciální oblasti. Právě tenascin by mohl být jedním z faktorů, který přispívá k tomu, že sliznice se hojí bez vzniku jizvy [15]. Při porovnání sliznice hojící se rány dutiny ústní a sliznice fetů se zjistilo, že v obou případech je hojná přítomnost tenascinu [15]. Tenascin je nepostradatelný pro hojení v obecnějším smyslu. Jeho exprese je prokázaná i při hojení po rekonstrukcích zkřížených vazů [16] a transplantacích rohovky [17]. V ECM jsou dále hojně zastoupeny kolageny, elastin a z glykoproteinů vedle fibronektinu a tenascinu např. galektin-1 a galektin-3.
Po vytvoření dostatečného množství extracelulární matrix do ní vrůstají krevní cévy. Tento proces představuje kvalitativní změnu tkáně, kterou lze terminologicky vymezit pojmem granulační tkáň. Extracelulární matrix se transformuje, přičemž je do nově vznikající molekulární sítě hojně ukládán zejména kolagen-1 [18]. K reparaci poranění je potřeba migrace buněk, obzvláště keratinocytů, nacházejících se na okrajích rány. Aby se zvýšil migrační potenciál těchto buněk, musí u nich dojít k epitelo-mezsenchymovému přechodu (epithel-mesenchymal transition – EMT). Keratinocyty se postupně uvolňují ze spojení s bazální laminou rozrušováním hemidesmozomů, ruší se i vzájemné mezibuněčné spoje tvořené E-kadheriny [19]. Dochází k vzájemnému ovlivňování s myofibroblasty, které produkují fibroblastový růstový faktor, jenž podporuje i migraci keratinocytů [20]. Epitelo-mezenchymový přechod keratinocytů je reverzibilní děj a po uzavření defektu získávají buňky epiteloidní charakter a vytvářejí mezibuněčné spoje [21]. Po definitivním uzavření rány keratinocyty dochází k remodelaci extracelulární matrix. Kožní hojení, na rozdíl od hojení sliznice, je postnatálně vždy spojeno s tvorbou jizvy. Jedním z faktorů určujících vzhled jizvy je hladina proteinů z rodiny TGFb. Dalším je aktivita imunitního systému a role sterilního zánětu. V regulaci zánětu se uplatňují prozánětlivé cytokiny interleukin-6 a interleukin-8. Protichůdný účinek má interleukin-10, který je protizánětlivý. Blokáda interleukinu-10 na modelu fetálního hojení u myší vedla k tvorbě jizvy [22]. Interleukin-10 byl již aplikován na rány v klinické studii, a to u myší i u lidí. Potvrdil se velmi dobrý efekt na makroskopický vzhled rány spolu s menším zarudnutím [23]. Extrémním případem jizvení, který je pro pacienta velkou zdravotní i kosmetickou zátěží, jsou hypertrofické a keloidní jizvy. Hypertrofické jizvy a keloidy jsou dvě klinické jednotky, které se však v poslední době řadí do společné skupiny fibroproliferativních chorob. Rozdíly v normálním a patologickém jizvení jsou dány zejména přítomností chronického zánětu (narušení rovnováhy mezi pro - a protizánětlivými faktory), zvýšenou proliferací buněk a produkcí ECM a její následnou remodelací [13]. Hypertrofická jizva nepřesahuje okraj původní rány, ale je zvýšená nad okolní plochu. Tyto jizvy často způsobují kontraktury, zejména v ohybových místech. V průběhu času však může docházet k jejich spontánní regresi. Keloid je definován jako kožní fibroproliferativní nádor, který nikdy nemalignizuje. Na rozdíl od hypertrofické jizvy přesahuje hranice původního poranění či chirurgického řezu [24] a nikdy nedochází k jeho samovolné regresi [25]. V primární prevenci se doporučuje respektovat linie štěpitelnosti kůže, zamezit tahu v ráně, např. použitím tapingu či aplikací silikonového krytí [26]. V léčbě je zlatým standardem lokální aplikace kortikoidu triamcinolonu, a to opakovaně po 2–4 týdnech v dávce 10–20 mg. Dá se použít buď jako samostatná léčba, anebo v kombinaci s chirurgickým výkonem. Prostá excize vede k značné rekurenci vzhledem k tomu, že dochází k opětovnému poranění kůže a následnému problematickému hojení. V případě velmi závažných případů je možno použít i radioterapii případně lokální chemoterapii [27].
Hojení bez jizvy
U člověka je bezjizevnaté hojení spojeno pouze s prenatálním vývojem plodu. Klinická praxe však ukázala, že při operacích rozštěpů rtu a patra docházelo k výrazně rychlejšímu a téměř bezjizevnatému hojení, pokud byla operace provedena v prvních 10 dnech po narození. Z tohoto důvodu se cheiloplastiky při rozštěpu rtu indikují co nejdříve po narození [28]. V rámci studia rozdílů v hojení starších dětí a novorozenců byla zkoumána jak produkce a složení extracelulární matrix, tak studován fenotyp novorozeneckých a dětských fibroblastů a keratinocytů. Bylo zjištěno, že kultivované novorozenecké kožní keratinocyty obsahují populaci velice malých buněk (cca 4 μm), které nejsou navzájem v zápoji, více než 90 % těchto buněk exprimuje vimentin a mnohé i keratiny charakteristické pro velmi nízce diferencované keratinocyty. S rostoucím věkem dětských pacientů četnost těchto znaků ubývá [29]. V případě fibroblastů nebyly nalezeny významné rozdíly mezi buňkami různě starých dětí, a to jak na úrovni RNA, tak na úrovni proteinu. Fibroblasty starších dětí však produkovaly větší množství nefibrilární složky ECM, zejména fibronektinu a tenascinu než buňky novorozenecké [30]. V rámci in vitro pokusů však bylo dokázáno, že novorozenecké keratinocyty, které se významně podílejí na rychlém a bezjizevnatém hojení, potřebují k udržení svého nezralého fenotypu součinnost s novorozeneckými fibroblasty. Pokud jsou nahrazeny fibroblasty starších pacientů, novorozenecké keratinocyty svůj fenotyp rychle ztrácejí [31]. Lze tedy předpokládat, že výše uvedené skutečnosti společně s útlumem imunitní reakce u novorozenců by mohly být odpovědné za lepší kosmetický výsledek cheiloplastik, provedených krátce po narození, v porovnání s operacemi u starších dětí.
Podobnost nádorového mikroprostředí a hojící se rány
Již v roce 1986 byla postulována základní podobnost mezi tvorbou nádorového stromatu a hojením ranné plochy [32]. Harald Dvorak charakterizoval „nádory jako rány, které se nezhojí“ [32]. Od té doby je této problematice věnována velká pozornost [11, 33].
Při vývoji nádoru, stejně jako v průběhu hojení rány, dochází ke sledu dějů, které jsou obdobné. Jedná se o následující kroky: a) infiltrace leukocyty, b) nahromadění fibroblastů a jejich částečná přeměna na myofibroblasty, c) produkce extracelulární matrix a prorůstání kapilár do nově tvořené tkáně, d) sekrece proteáz fibroblasty a myofibroblasty, e) proliferace epitelových buněk a s tím související EMT. V případě ranné plochy jsou všechny tyto kroky časově omezené a vyústí ve zhojení rány a remodelaci jizvy, v případě nádoru se jedná o nikdy nekončící proces, který vede k tvorbě nádoru, jeho růstu a následné diseminaci (obr. 1) [34, 35]. V případě obou těchto procesů hraje zásadní roli vytvoření podpůrné tkáně – granulační v případě hojení a nádorového stromatu u tumoru. Nádorové mikroprostředí se skládá z buněčné části a ECM. Tvoří ho zaprvé buňky, které již v dané lokalitě jsou, zejména lokální fibroblasty či endotelové buňky. Fibroblasty se vlivem nádorových buněk aktivují, začnou vytvářet hladký svalový aktin (smooth muscle actin – SMA) a získávají sekreční fenotyp. Endotelové buňky jsou naopak spojeny s vaskularizací vytvářené tkáně. Angiogeneze je podporována růstovými faktory VEGF (vascular endotelial growth factor) a bFGF (basic fibroblast growth factor). Oba stimulují endoteliální buňky k produkci proteolytických enzymů, které odbourávají ECM, což umožňuje jejich migraci, proliferaci a následně i novotvorbu cév [36]. V nádorovém stromatu však proces degradace ECM umožňuje nejen angiogenezi, ale také rozsev tumoru.
Obr. 1. Schematické znázornění dějů, které probíhají v procesu hojení a při vývoji nádoru, a to jak na úrovni buněk, tak na úrovni cytokinů a růstových faktorů. Při hojení dochází v místě poranění ke kolonizaci imunitními buňkami, tvorbě kapilár a k aktivaci fibroblastů v myofibroblasty, které produkují hojné množství extracelulární matrix a cytokinů. Všechny tyto složky tvoří společně granulační tkáň. V mezidobí se množí keratinocyty z okraje rány, granulační tkáň se remodeluje a dochází k deaktivaci fibroblastů a ukončení hojení. Naproti tomu při vzniku nádoru, kde také dochází ke kolonizaci imunitními buňkami, tvorbě kapilár, aktivaci fibroblastů a tvorbě cytokinů, toto časové ohraničení chybí. Podpůrná tkáň, tvořená jak buňkami, tak extracelulární matrix (stroma), vytváří podmínky i pro uvolňování mezibuněčných spojení, a tím umožňuje metastazování.
Fig. 1. Schematic representation of the processes that take place in the healing process and in the development of the tumor, both at the level of cells and at the level of cytokines and growth factors. During healing, immune cells colonize, form capillaries, and activate fibroblasts into myofibroblasts at the site of injury, which produce abundant amounts of extracellular matrix and cytokines. All these components together form granulation tissue. In the meantime, keratinocytes multiply from the wound margin, the granulation tissue is remodeled, and fibroblasts are inactivated and healing ends. In contrast, in tumorigenesis, where colonization by immune cells, capillary formation, fi broblast activation, and cytokine formation also occurs, this time limit is absent. The supporting tissue, formed by both the cells and the extracellular matrix (stroma), also creates the conditions for the release of intercellular connections, thus enabling metastasis.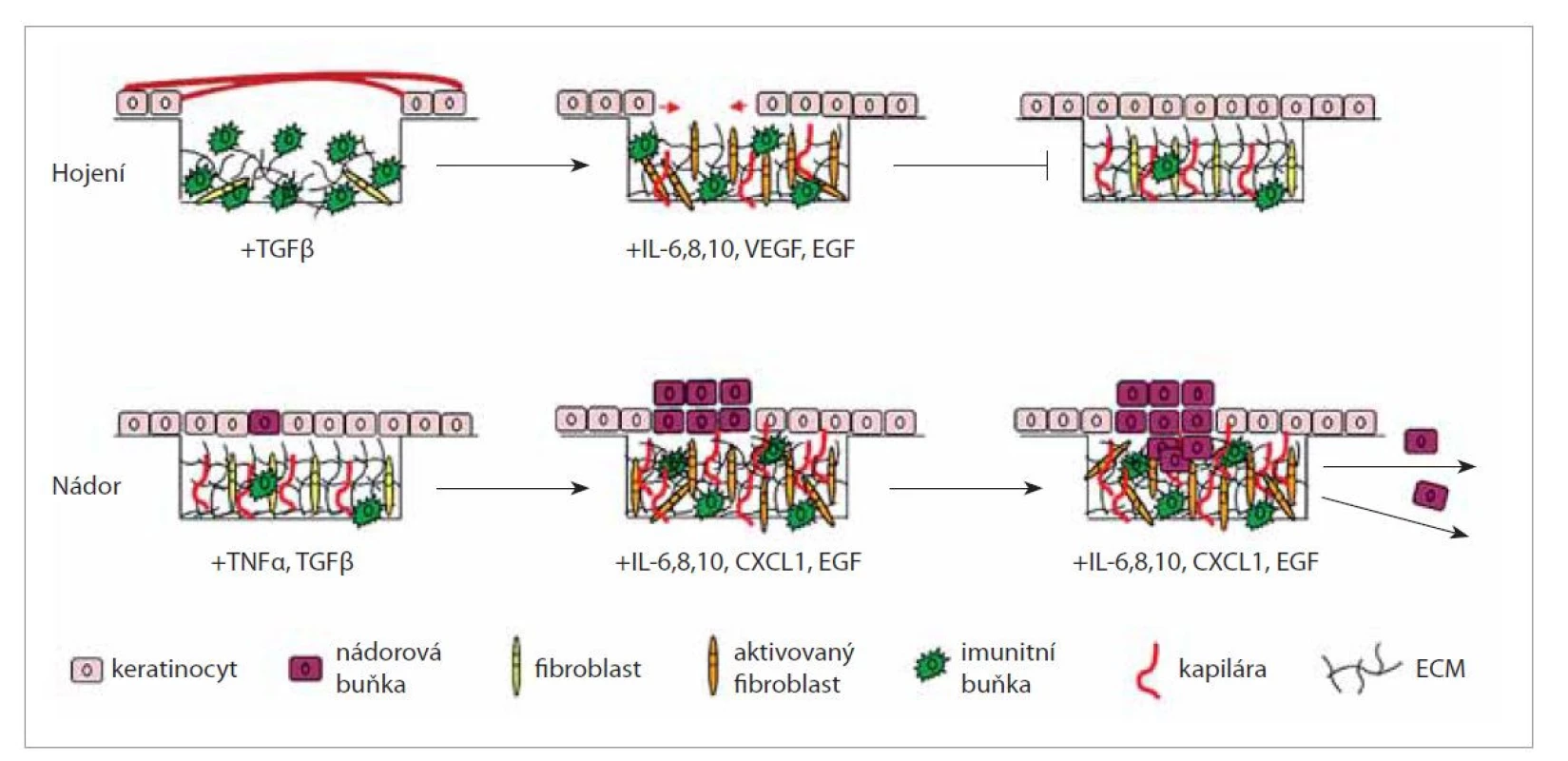
Za druhé jsou to buňky migrující ze vzdálených lokalit, mezi které počítáme buňky imunitního systému a cirkulující mezenchymové kmenové buňky. Populace imunitních buněk je heterogenní, obsahuje různé typy lymfocytů, ale i makrofágy, neutrofily a myeloidní supresorové buňky [37].
Takto vzniklé mikroprostředí aktivně komunikuje a spolupracuje s nádorovými buňkami na dalším rozvoji nádoru. Je schopné udržovat nízký diferenciační stav nádorových buněk a chránit je před účinky protinádorové terapie [38]. Nejvýraznější buněčnou populací nádorového stromatu jsou aktivované fibroblasty, které nazýváme nádorově asociované fibroblasty (cancer associated fibroblasts – CAFs). Jejich původ se odvozuje jak od lokálních fibroblastů, tak od migrujících mezenchymálních buněk. CAFs produkují velké množství růstových faktorů, cytokinů, chemokinů a imunomodulačních látek. Mezi nejdůležitější patří zejména IL-6, IL-8, CXCL1, TNFa, TGFb. Právě na pou - žití monoklonálních protilátek proti jednotlivým proteinům je založena biologická léčba. Podrobný přehled látek užívaných pro biologickou léčbu jsme zpracovali v článku „Nádorové mikroprostředí“ [39]. Klinická praxe však ukazuje, že blokace jednoho proteinu či receptoru není dostatečná, ale je potřeba více cílových molekul. Další významnou skupinou látek, které hrají významnou roli jak v hojení, tak nádorovém bujení, jsou galektiny (Gal). Galektiny, z rodiny endogenních lektinů, mají velmi široký biologický dopad; mezi nejvýznamnější patří Gal-1, Gal-3 a Gal-7 [40]. Gal-1 je spojován se všemi fázemi růstu a metastazace nádoru a hraje významnou roli jak v nádorových buňkách, tak i v buňkách mikroprostředí. Jeho funkce je velmi široká, podílí se na úniku nádoru z působení imunitního systému a podporuje růst, vaskularizaci a metastazování nádoru. Naproti tomu v průběhu hojení Gal-1 zrychluje kontrakci ranné plochy a pomáhá udržovat kmenový charakter migrujících keratinocytů v průběhu epitelizace. Podobné účinky má v případě nádoru i hojení Gal-3, který urychluje reepitelizaci rány [41].
Galektiny se vyskytují jak intracelulárně, tak i v mezibuněčném prostoru jako součást ECM. Vedle proteinů/glykoproteinů obsahuje ECM i glykosaminoglykany a proteoglykany. Glykosaminoglykany zajišťují hydrataci a také slouží k ukotvení růstových faktorů. Důležitým zástupcem je kyselina hyaluronová, která je produkována a akumulována v nádorovém stromatu. Vyskytuje se ve dvou různých formách – jako nízkomolekulární (low-molecular weight – LMW) a vysokomolekulární (high-molecular weight – HMW). I když se jedná o jednu látku, obě formy působí různě na vývoj nádoru. LMW zvyšuje proliferační a migrační kapacitu nádoru, zatímco vysokomolekulární forma omezuje růst nádoru, zánětlivou reakci i neoangiogenezi [42]. Kyselina hyaluronová podporuje proces hojení, a to jak fázi zánětlivou, tak i tvorbu granulační tkáně. Tím, že omezuje nadprodukci kolagenu v průběhu hojení, pozitivně ovlivňuje výsledný vzhled jizvy. Mezi významné proteiny obsažené ve stromatu patří zejména kolagen, fibronektin, tenascin, laminin. Zatím co většina výše jmenovaných proteinů se vyskytuje i ve zdravé tkáni, tenascin, jak již bylo uvedeno, se v tkáních dospělého člověka vyskytuje zřídka. Lze jej však nalézt v hojící se tkáni a za patologických stavů, jakými jsou chronický zánět či nádor [43]. Jeho exprese je aktivována pomocí osy Twist1–Prrx1, což je klíčový regulátor nádorově asociovaných fibroblastů, a tedy přímo CAFs indukují expresi tenascinu [44]. U nemalobuněčného karcinomu plic či kolorektálního karcinomu byl tenascin popsán jako negativní prognostický znak asociovaný se zvýšenou agresivitou nádorové nemoci [45]. Předpokládá se, že tenascin blokuje na fibronektinu vazebná místa pro proteoglykany, a tím inhibuje adhezi buněk. Výsledkem je zvýšení invazivity nádoru [46]. U karcinomů hlavy a krku tato asociace zatím potvrzena nebyla [47]. V neposlední řadě je nutno zmínit podobnost mezi hojením a nádorem a v regulaci apoptózy a senescence, tj. přechodu do stadia, kdy se buňka již nedělí, ale zároveň nepodléhá apoptóze. Nicméně, jedná se o tak rozsáhlá témata, že přesahují možnosti této práce a budou, doufejme, námětem pro další.
Závěr
I přes výše uvedené podobnosti jsou hojící se rána a nádor zcela opačné biologické jednotky a jejich léčba vyžaduje komplexní přístup, který změní celkové mikroprostředí v ráně i v tumoru. Právě v těchto postupech je ten zásadní rozdíl. U chronické rány je potřeba zajistit nejen dostatek kmenových buněk, ale i udržení jejich kmenovosti a s tím související dostatek růstových faktorů. Naproti tomu při léčbě nádoru je cílem zasáhnout a změnit jeho mikroprostředí (tvořené ECM a podpůrnými buňkami) tak, aby přestalo chránit a udržovat kmenovost nádorových buněk.
Lepší pochopení komunikace mezi nádorovými buňkami a stromatem karcinomu může přispět nejen k účinnější léčbě nádorů, ale zlepšit i proces hojení u rozsáhlých kožních ztrát a chronických ran. Laboratorní pokusy i klinické studie ukazují, že blokace jedné molekuly či jednoho receptoru v případě nádoru či přidání jediného růstového faktoru v případě hojící se rány není dostatečné. K dosažení větších úspěchů bude potřeba hledat komplexní přístupy, které by zasáhly různé signální molekuly v různých časových úsecích.
Prohlášení o střetu zájmů
Autorka práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Grantová podpora
Projekt „Centrum nádorové ekologie – výzkum nádorového mikroprostředí v organizmu podporujícího růst a šíření nádoru“ (reg. č. CZ.02. 1.01/0.0/0.0/16_019/0000785) je podpořen z Operačního programu Výzkum, vývoj a vzdělávání.
ORCID autorů
V. Bandúrová ORCID 0000-0002-1754-7737,
K. Smetana jr. ORCID 0000-0002-7878-8403,
J. Plzák ORCID 0000-0003-3710-4455,
B. Dvořánková ORCID 0000-0002-3914-9668.
Přijato k recenzi: 12. 2. 2021
Přijato k tisku: 12. 4. 2021
MUDr. Veronika Bandúrová
Klinika otorinolaryngologie a chirurgie hlavy a krku
1. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
Zdroje
1. Martin P. Wound healing--aiming for perfect skin regeneration. Science 1997; 276 (5309): 75–81. Doi: 10.1126/science.276.5309.75.
2. Shacter E, Weitzman SA. Chronic inflammation and cancer. Oncology (Williston Park) 2002; 16 (2): 217–226, 229; discussion 230–212.
3. Maxwell JH, Grandis JR, Ferris RL. HPV-associated head and neck cancer: Unique features of epidemiology and clinical management. Annu Rev Med 2016; 67 : 91–101. Doi: 10.1146/annurev-med-051914-021907.
4. Lyford-Pike S, Peng S, Young GD et al. Evidence for a role of the PD-1: PD-L1 pathway in immune resistance of HPV-associated head and neck squamous cell carcinoma. Cancer Res 2013; 73 (6): 1733–1741. Doi: 10.1158/0008-5472.CAN-12-2384.
5. Kim YH, Roh JL, Choi SH et al. Prediction of pharyngocutaneous fistula and survival after salvage laryngectomy for laryngohypopharyngeal carcinoma. Head Neck 2019; 41 (9): 3002 – –3008. Doi: 10.1002/hed.25786.
6. Marur S, Forastiere AA. Head and neck squamous cell carcinoma: Update on epidemiology, diagnosis, and treatment. Mayo Clin Proc 2016; 91 (3): 386–396. Doi: 10.1016/j.mayocp.2015.12.017.
7. Graboyes EM, Kompelli AR, Neskey DM et al. Association of treatment delays with survival for patients with head and neck cancer: A systematic review. JAMA Otolaryngol Head Neck Surg 2019; 145 (2): 166–177. Doi: 10.1001/ jamaoto.2018.2716.
8. Chiesa-Estomba CM, Calvo-Henriquez C, Siga Diom E et al. Head and neck surgical antibiotic prophylaxis in resource-constrained settings. Curr Opin Otolaryngol Head Neck Surg 2020; 28 (3): 188–193. Doi: 10.1097/MOO.0000 000000000626.
9. Clark JA, Leung KS, Cheng JC et al. The hypertrophic scar and microcirculation properties. Burns 1996; 22 (6): 447–450. Doi: 10.1016/0305-4179 (95) 00166-2.
10. Gabbiani G, Ryan GB, Majne G. Presence of modified fibroblasts in granulation tissue and their possible role in wound contraction. Experientia 1971; 27 (5): 549–550. Doi: 10.1007/BF02147594.
11. Dvorankova B, Szabo P, Lacina L et al. Human galectins induce conversion of dermal fibroblasts into myofibroblasts and production of extracellular matrix: potential application in tissue engineering and wound repair. Cells Tissues Organs 2011; 194 (6): 469–480. Doi: 10.1159/000324864.
12. Springer BA, Pantoliano MW, Barbera FA et al. Identification and concerted function of two receptor binding surfaces on basic fibroblast growth factor required for mitogenesis. J Biol Chem 1994; 269 (43): 26879–26884.
13. Strnadova K, Sandera V, Dvorankova B et al. Skin aging: the dermal perspective. Clin Dermatol 2019; 37 (4): 326–335. Doi: 10.1016/ j.clindermatol.2019.04.005.
14. Prasad A, Clark RA. Fibronectin interaction with growth factors in the context of general ways extracellular matrix molecules regulate growth factor signaling. G Ital Dermatol Venereol 2018; 153 (3): 3612374. Doi: 10.23736/S0392-0488.18.05952-7.
15. Glim JE, van Egmond M, Niessen FB et al. Detrimental dermal wound healing: what can we learn from the oral mucosa? Wound Repair Regen 2013; 21 (5): 648–660. Doi: 10.1111/wrr.12 072.
16. Schwarz S, Gogele C, Ondruschka B et al. Migrating myofibroblastic iliotibial band-derived fibroblasts represent a promising cell source for ligament reconstruction. Int J Mol Sci 2019; 20 (8). Doi: 10.3390/ijms20081972.
17. Molzer C, Shankar SP, Masalski V et al. TGF-beta1-activated type 2 dendritic cells promote wound healing and induce fibroblasts to express tenascin c following corneal full-thickness hydrogel transplantation. J Tissue Eng Regen Med 2019; 13 (9): 1507–1517. Doi: 10.1002/term.2853.
18. Olczyk P, Mencner L, Komosinska-Vassev K. The role of the extracellular matrix components in cutaneous wound healing. Biomed Res Int 2014; 2014 : 747584. Doi: 10.1155/2014/747584.
19. Schnapp LM, Hatch N, Ramos DM et al. The human integrin alpha 8 beta 1 functions as a receptor for tenascin, fibronectin, and vitronectin. J Biol Chem 1995; 270 (39): 23196-23202. Doi: 10.1074/jbc.270.39.23196.
20. Zivicova V, Lacina L, Mateu R et al. Analysis of dermal fibroblasts isolated from neonatal and child cleft lip and adult skin: Developmental implications on reconstructive surgery. Int J Mol Med 2017; 40 (5): 1323–1334. Doi: 10.3892/ijmm.2017.3128.
21. Romio L, Fry AM, Winyard PJ et al. OFD1 is a centrosomal/basal body protein expressed during mesenchymal-epithelial transition in human nephrogenesis. J Am Soc Nephrol 2004; 15 (10): 2556-2568. Doi: 10.1097/01.ASN.0000140220.46477.5C.
22. Liechty KW, Kim HB, Adzick NS et al. Fetal wound repair results in scar formation in interleukin-10-deficient mice in a syngeneic murine model of scarless fetal wound repair. J Pediatr Surg 2000; 35 (6): 866–872; discussion 872–863. Doi: 10.1053/jpsu.2000.6868.
23. Kieran I, Knock A, Bush J et al. Interleukin-10 reduces scar formation in both animal and human cutaneous wounds: results of two preclinical and phase II randomized control studies. Wound Repair Regen 2013; 21 (3): 4282436. Doi: 10.1111/wrr.12043.
24. De Felice B, Wilson RR, Nacca M et al. Molecular characterization and expression of p63 isoforms in human keloids. Mol Genet Genomics 2004; 272 (1): 28–34. Doi: 10.1007/s00438-004-1034-4.
25. Gauglitz GG, Jeschke MG. Combined gene and stem cell therapy for cutaneous wound healing. Mol Pharm 2011; 8 (5): 1471–1479. Doi: 10.1021/mp2001457.
26. Lee SY, Borovicka JH, Holbrook JS et al. A short educational intervention measurably benefits keloid-prone individuals‘ knowledge of prevention and treatment. J Drugs Dermatol 2013; 12 (4): 397–402.
27. Sidle DM, Kim H. Keloids: prevention and management. Facial Plast Surg Clin North Am 2011; 19 (3): 505–515. Doi: 10.1016/j.fsc.2011.06.005.
28. Borsky J, Tvrdek M, Kozak J et al. Our first experience with primary lip repair in newborns with cleft lip and palate. Acta Chir Plast 2007; 49 (4): 83–87.
29. Krejci E, Kodet O, Szabo P et al. In vitro differences of neonatal and later postnatal keratinocytes and dermal fibroblasts. Physiol Res 2015; 64 (4): 561–569. Doi: 10.33549/physiolres.932893.
30. Zheng Z, Kang HY, Lee S et al. Up-regulation of fibroblast growth factor (FGF) 9 expression and FGF-WNT/beta-catenin signaling in laser--induced wound healing. Wound Repair Regen 2014; 22 (5): 660–665. Doi: 10.1111/wrr.12212.
31. Mateu R, Zivicova V, Krejci ED et al. Functional differences between neonatal and adult fibroblasts and keratinocytes: Donor age affects epithelial-mesenchymal crosstalk in vitro. Int J Mol Med 2016; 38 (4): 1063–1074. Doi: 10.3892/ijmm.2016.2706.
32. Dvorak HF. Tumors: wounds that do not heal. Similarities between tumor stroma generation and wound healing. N Engl J Med 1986; 315 (26): 1650–1659. Doi: 10.1056/NEJM19861 2253152606.
33. Martin P, Nunan R. Cellular and molecular mechanisms of repair in acute and chronic wound healing. Br J Dermatol 2015; 173 (2): 370–378. Doi: 10.1111/bjd.13954.
34. Gal P, Varinska L, Faber L et al. How signaling molecules regulate tumor microenvironment: Parallels to wound repair. Molecules 2017; 22 (11). Doi: 10.3390/molecules22111818.
35. Kolar M, Szabo P, Dvorankova B et al. Upregulation of IL-6, IL-8 and CXCL-1 production in dermal fibroblasts by normal/malignant epithelial cells in vitro: Immunohistochemical and transcriptomic analyses. Biol Cell 2012; 104 (12): 738–751. Doi: 10.1111/boc.201200018.
36. Campbell NE, Kellenberger L, Greenaway J et al. Extracellular matrix proteins and tumor angiogenesis. J Oncol 2010; 2010 : 586905. Doi: 10.1155/2010/586905.
37. Lacina L, Plzak J, Kodet O et al. Cancer microenvironment: What can we learn from the stem cell niche. Int J Mol Sci 2015; 16 (10): 24094–24110. Doi: 10.3390/ijms161024094.
38. Kodet O, Dvorankova B, Bendlova B et al. Microenvironment-driven resistance to BRaf inhibition in a melanoma patient is accompanied by broad changes of gene methylation and expression in distal fibroblasts. Int J Mol Med 2018; 41 (5): 2687–2703. Doi: 10.3892/ijmm.2018.3448.
39. Novák Š, Bandúrová V, Mifková A et al. Nádorové mikroprostředí. Otorinolaryngol Foniatr 2019; 68 (1): 41–51.
40. Valach J, Fik Z, Strnad H et al. Smooth muscle actin-expressing stromal fibroblasts in head and neck squamous cell carcinoma: increased expression of galectin-1 and induction of poor prognosis factors. Int J Cancer 2012; 131 (11): 2499–2508. Doi: 10.1002/ijc.27550.
41. Gal P, Vasilenko T, Kostelnikova M et al. Open wound healing in vivo: Monitoring binding and presence of adhesion/growth-regulatory galectins in rat skin during the course of complete re-epithelialization. Acta Histochem Cytochem 2011; 44 (5): 191–199. Doi: 10.1267/ahc.11 014.
42. Liu M, Tolg C, Turley E. Dissecting the dual nature of hyaluronan in the tumor microenvironment. Front Immunol 2019; 10 : 947. Doi: 10.3389/fimmu.2019.00947.
43. Midwood KS, Chiquet M, Tucker RP et al. Tenascin-C at a glance. J Cell Sci 2016; 129 (23): 4321–4327. Doi: 10.1242/jcs.190546.
44. Yeo SY, Lee KW, Shin D et al. A positive feedback loop bi-stably activates fibroblasts. Nat Commun 2018; 9 (1): 3016. Doi: 10.1038/ s41467-018-05274-6.
45. Murakami T, Kikuchi H, Ishimatsu H et al. Tenascin C in colorectal cancer stroma is a predictive marker for liver metastasis and is a potent target of miR-198 as identified by microRNA analysis. Br J Cancer 2017; 117 (9): 1360–1370. Doi: 10.1038/bjc.2017.291.
46. Bass MD, Humphries MJ. Cytoplasmic interactions of syndecan-4 orchestrate adhesion receptor and growth factor receptor signalling. Biochem J 2002; 368 (Pt 1): 1–15. Doi: 10.1042/BJ20021228.
47. Zivicova V, Gal P, Mifkova A et al. Detection of distinct changes in gene-expression profiles in specimens of tumors and transition zones of tenascin-positive/-negative head and neck squamous cell carcinoma. Anticancer Res 2018; 38 (3): 1279–1290. Doi: 10.21873/anticanres.12 350.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek EditorialČlánek Historie ORL – 100 let
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2022 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosine nově bez indikačních a preskripčních omezení
- Lokální antiseptická terapie faryngitidy – účinnost oktenidinu a zachování integrity střevní mikrobioty
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
- Efekt chirurgické terapie syndromu obstrukční spánkové apnoe na výši tlaků na Positive Airway Pressure (PAP) – první výsledky
- Mikroprostředí spinocelulárního karcinomu hlavy a krku jako analogie hojící se rány
- Vrodená (nešpecifická) imunita stredného ucha a jej úloha pri stredoušnej otitíde
- Koincidence bilaterálního Warthinova tumoru příušních žláz a epitelio-myoepiteliálního karcinomu parafaryngu
- Inflamatorní myofibroblastický tumor v otorinolaryngologii
- Izolovaná lézia n. hypoglossus ako dôsledok aneuryzmy arteria carotis interna – kazuistika
- Jubileum prof. MUDr. Milana Profanta, CSc.
- Životní jubileum doc. MUDr. Jaroslava Slípky, CSc.
- Odešel doc. MUDr. František Šram, CSc.
- Doc. MUDr. Zdeněk Kasl, CSc., odešel
- Otochirurgický workshop v Kajetanoch
- Správa z Open Medical Institute (OMI) – Salzburg Weill Cornell seminára otológie a chirurgie spánkovej kosti
- Vyjádření k válce na Ukrajině
- ENT bodies stand up for Ukraine STATEMENTS IN FULL
- Historie ORL – 100 let
- Editorial
- Adaptace a validace české verze dotazníku pro hodnocení příznaků nosní obstrukce (NOSE-cz)
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Izolovaná lézia n. hypoglossus ako dôsledok aneuryzmy arteria carotis interna – kazuistika
- Adaptace a validace české verze dotazníku pro hodnocení příznaků nosní obstrukce (NOSE-cz)
- Mikroprostředí spinocelulárního karcinomu hlavy a krku jako analogie hojící se rány
- Inflamatorní myofibroblastický tumor v otorinolaryngologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



