-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Oxidativní stres a karcinogeneze - teoretický úvod
Oxidative Stress and Carcinogenesis - Theoretical Introduction
Potentially causal relationship between oxidative stress and cancer attracted much attention over the past several years since balance between pro-oxidant and antioxidant capacities is supposed to play an important role in cancer development.
Reactive oxygen species (ROS) is a term usually reserved to describe group of highly reactive forms of oxygen carrying one or more unpaired electrons. They include superoxide anion, hydrogen peroxide, hydroxyl radical, singlet oxygen, etc. Surplus electrons, unused for generation of proton gradient, can interact with oxygen to produce superoxide. If not neutralized rapidly enough by the action of antioxidative enzymes and non-enzymatic antioxidants, the intracellular structures are damaged by oxidation.
Source of ROS evoking oxidative stress is either exogenous or endogenous. The most important exogenous oxidants are ozone and cigarette smoke. Endogenously, numerous inflammatory cells, e.g. eosinophils, alveolar macrophages, etc., release ROS. However, mitochondria, more precisely protein complexes of the mitochondrial respiratory chain, are a dominant source of endogenous ROS. Pro-oxidant and antioxidant capacities in a healthy cell are kept in dynamic equilibrium by neutralizing overproduction of ROS and rebuilding of damaged intracellular structures.
Clinical and experimental studies have provided sufficient background supporting an important role of oxidative stress in cancer development. Oxidative stress is related to cancer in multiple ways. First, oxidative stress can mediate oxidative damage to DNA and thereby initially promote carcinogenesis. Second, many malignant cells have an abnormal ability to cope with oxidative stress due to alterations in their antioxidant properties. One of the cancers with strongest link to oxidative damage and oxidative stress is head and neck squamous cell carcinoma since tobacco and alcohol as sources of massive quantities of ROS are clearly identified as etiologic factors of these malignancies.
The authors present theoretical background of genesis and effect of oxidative stress in head and neck cancer. Furthermore, hypotheses of its impact on carcinogenesis are discussed.Key words:
oxidative stress, antioxidative enzymes, head and neck cancer, carcinogenesis, reactive oxygen species, oxygen free radicals.
Autoři: Richard Salzman 1
; J. Tomandl 2; L. Pácal 3; K. Kaňková 3; Z. Horáková 1
; R. Kostřica 1
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u sv. Anny, Brno ; přednosta prof. MUDr. R. Kostřica, CSc. 1; Biochemický ústav LF MU, Brno 2; Ústav experimentální patofyziologie LF MU, Brno 3
Vyšlo v časopise: Otorinolaryngol Foniatr, 56, 2007, No. 1, pp. 39-44.
Kategorie: Souborné referáty
Souhrn
V posledních letech je věnována značná pozornost problematice oxidativního stresu ve vztahu k nádorovým onemocněním.
Volné kyslíkové radikály o jsou molekuly s jedním nebo více volnými elektrony, které se velmi pohotově vážou s nitrobuněčnými strukturami za poškozování jejich funkce. Mezi hlavní volné radikály (VR) patří superoxidový anion, hydroxylový radikál, singletový kyslík, peroxynitrit, peroxid vodíku atd.
Za fyziologických podmínek je v každé buňce stav dynamické rovnováhy, která je udržována odstraňováním nově vznikajících VR a reparací oxidativním stresem poškozených buněčných struktur.
Všeobecný konsenzus přijímá významnou roli oxidativního stresu v karcinogenezi. Předpokládá se, že část nádorových onemocnění vzniká při dlouhodobé oxidativní zátěži v prostředí chronického zánětu. Je prokázaný vztah významných zdrojů VR (kouření, alkohol) v etiologii karcinomů hlavy a krku.
Kauzalita vztahu oxidativního stresu a rakoviny je podmíněná chronickým poškozováním struktury DNA volnými radikály. V případě nadměrného poškozování DNA organismus nestíhá reparovat pozměněnou DNA, která má pak významný mutagenní potenciál.
Autoři v předkládaném sdělení popisují souhrn teoretických poznatků o vzniku, působení oxidativního stresu a ochraně před ním. Dále uvádí přehled hypotéz jeho vztahu ke kancerogenezi.Klíčová slova:
oxidativní stres, antioxidativní enzymy, nádory hlavy a krku, karcinogeneze, volné kyslíkové radikály.ÚVOD
V posledních letech je studiu oxidativního stresu u onkologických nemocných věnována značná pozornost. Oxidativní stres můžeme definovat jako stav překonání antioxidativní obrany buňky volnými kyslíkovými radikály (VR). Dochází k němu při zvýšené produkci VR nebo při nedostatečné aktivitě antioxidativní obrany buňky.
VR jsou látky pohotově reagující s buněčnými strukturami díky přítomnosti jednoho nebo více nepárových elektronů. Mezi VR zahrnujeme superoxidový anion, hydroxylový radikál, singletový kyslík, peroxynitrit, peroxid vodíku atd. Produkce VR je endogenní nebo exogenní. Klinicky významné zejména ve vztahu k onkologii hlavy a krku jsou zejména kouření a konzumace alkoholu (19).
Mitochondrie prozánětlivě působících buňek (eozinofily, alveolární makrofágy atd.) jsou významným endogenním zdrojem VR. I za fyziologických podmínek unikají ojedinělé elektrony z dýchacího řetězce, které následně reagují s kyslíkem za tvorby superoxidového anionu. Antioxidativní enzymy 1. stupně (superoxiddismutáza, SOD) jej mění v peroxid vodíku. Vzhledem k oxidativní kapacitě peroxidu vodíku musí být i tento neutralizován antioxidativními enzymy 2. stupně, katalázou v peroxizomech (CAT) a glutathionperoxidázou v cytoplazmě a v mitochondriích (GPx) (obr. 1). Nejsou-li VR neutralizovány dostatečně rychle antioxidativními enzymy nebo neenzymatickými antioxidanty, dochází k poškození biomolekul a buněčných struktur (27). Mezi poškozované buněčné struktury patří membrány, kde vlivem VR dochází k poškozování membránových fosfolipidů, kdy jedním z produktů je i malondialdehyd (MDA). Jeho hladina vypovídá o míře expozice buňky oxidativnímu stresu. Působením VR též dochází k modifikaci struktury proteinů a zlomům DNA (21). Oxidativním stresem modifikovaná DNA je geneticky nestabilní, čímž má větší tendenci k mutagenezi.
Obr. 1. Metabolismus volných kyslíkových radikálů v buňce. 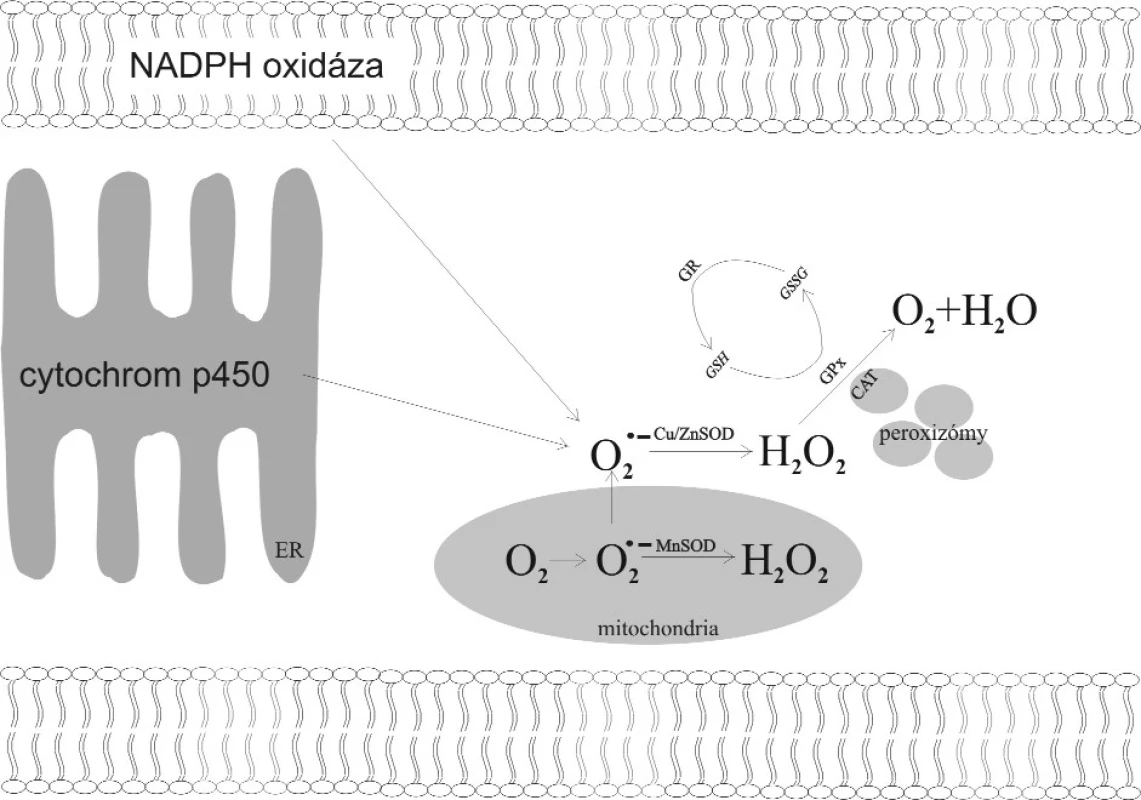
Řada autorů v posledních letech popsala několik úrovní vztahu oxidativní zátěže k riziku vzniku a prognóze rakoviny obecně. Jednak VR oxidativně poškozují DNA, jejichž mutace jsou dávány do souvislosti s karcinogenezí. Dále většina maligních buněk postrádá fyziologickou schopnost vypořádat se s oxidativním stresem kvůli změněné aktivitě AOE (4).
Předpokládá se úzký vztah mezi spinocelulárními karcinomy hlavy a krku a oxidativním stresem, protože alkohol a kouření jako zdroje masivní oxidativní zátěže jsou jasně přijímány jako etiologické faktory těchto malignit (4).
Vzhledem k působení chemoterapie i ozáření na maligní buňky VR a díky alteraci mechanismů neutralizujících oxidativní zátěž u těchto buněk, lze predikovat i vztah oxidativního stresu k rezistenci u adjuvantní terapie. Zdá se, že chemo - i radiorezistence může být podmíněna neschopností buňky vypořádat se s oxidativním stresem.
V onkologii hlavy a krku zatím nebyly žádné významné onkomarkery zavedeny do rutinní praxe. Dle nejnovějších poznatků se právě markery oxidativního stresu teoreticky nabízejí jako vhodné ukazatele.
Zdroje volných radikálů
VR podle původu můžeme rozdělit na endogenní, které jsou produkované v organismu, a exogenní, které se do organismu dostávají ze zevního prostředí.
Mitochondrie je organela zodpovědná za aerobní dýchání a je hlavním místem tvorby endogenních VR. Za fyziologických podmínek unikají četné elektrony (e-) z dýchacího řetězce. Podle Curtina množství e- reagujících s jinými molekulami za tvorby VR představuje až 1-2 % všech e- přenášených v dýchacím řetězci (7). Další zdroje endogenního VR jsou enzymatické reakce katalyzované oxidázami (zejména xanthinoxidázou) nebo kaskáda arachidonové kyseliny (28).
Důležitou součástí zánětlivé odpovědi je využití VR produkovaných v polymorfonukleárech a makrofágách proti mikrobiálním patogenům. Primárním zdrojem endogenních VR při rozpoznání mikroorganismů je NADPH ve fagocytech. Tento proces se nazývá „oxidative burst“. V případě, že se přísně regulovaná tvorba VR vymkne kontrole, poškozují nejen patogeny samotné, ale i tkáně organismu vlastní. Příkladem může být ARDS, kdy pneumocyty vystavené bakteriálním toxinům či aktivované komplementem chemotakticky, přivolávají aktivované neutrofily, kterými produkované VR vedou k poškození kapilárních membrán buněk a následně ke zvýšení permeability buněčných membrán. Je obecně známo, že eozinofily hrají důležitou roli u astmatu. Eozinofilní peroxidáza, která je obsažena v jejich specifických granulech, uvolňuje VR po aktivaci specifickými stimuly (3. Agosti v souladu s Ayarsem potvrzují významný potenciál peroxidázy produkované v eozinofilech poškozovat buňky respiračního epitelu – pneumocyty 2. typu (1) a buňky nosního epitelu (2).
Dále nutno zmínit VR, které se dostávají do organismu ze zevního prostředí. V mnoha moderních městech se hladiny oxidačních látek v atmosféře díky industrializaci výrazně zvýšily. Nejvýznamnějšími oxidanty zevního prostředí jsou ozon a cigaretový kouř. Vykouření jedné cigarety představuje zatížení organismu až 1017 volných radikálů (6, 21). Inhalované exogenní VR se dostávají do kontaktu s velkou plochou respiračního epitelu, čímž se plíce stávají oxidativním stresem nejvíce ohroženým orgánem. Exogenní VR jsou tvořeny taky vlivem alkoholu, ionizujícího záření, ultrafialového světla (např. v slunečném záření) či xenobiotik.
Poškozování makromolekul oxidativním stresem
Na buněčné úrovni VR poškozují celou řadu buněčných struktur jako fosfolipidy buněčných membrán, nukleové kyseliny a bílkoviny. Nejzávažnější a nejlépe prostudována je lipidová peroxidace, při které vlivem VR dochází k neenzymové peroxidaci polynenasycených mastných kyselin membránových fosfolipidů (obr. 2). Jediná molekula VR vyvolá vznik velkého množství molekul hydroperoxidů v buněčné membráně, čímž se zvyšuje její permeabilita. Tento stav vede k poruše základních buněčných funkcí či dokonce ke smrti buňky (3). Jedním z produktů lipidové peroxidace je i malondialdehyd (MDA), který se stanovuje jako marker míry oxidativního poškození buňky.
Obr. 2. Schéma lipidové peroxidace 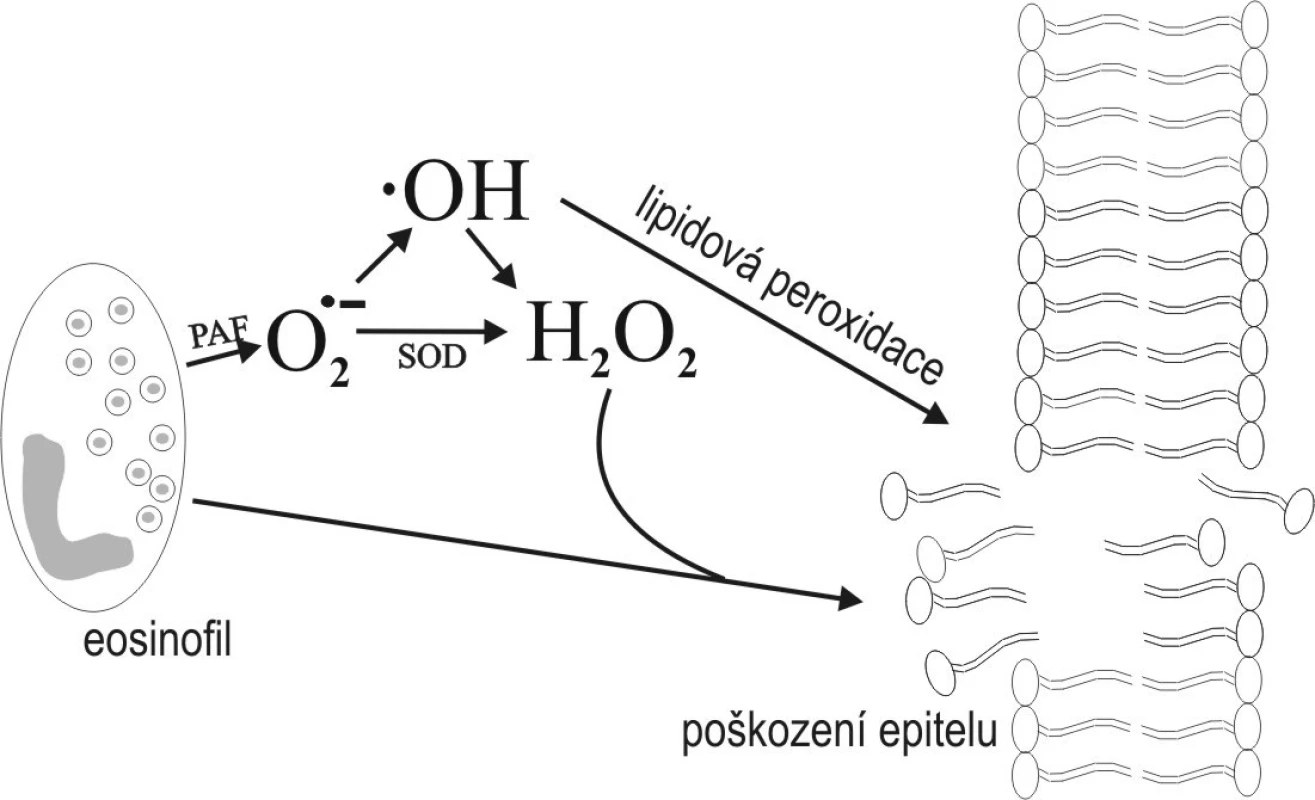
Oxidační modifikace proteinů probíhá podobně jako u lipidů. Vznikající hydroperoxidy se vážou na kov v aktivním centru enzymů, např. na železo u katalázy, čímž jej deaktivují. Na molekulární úrovni VR modulují zánětlivý proces stimulací uvolňování histaminu žírnými buňkami a aktivací kaskády arachidonové kyseliny. Na tkáňové úrovni VR zvyšují kontraktilitu hladkých svalů dýchacích cest, vyvolávají down regulaci ß-adrenergních receptorů, zvyšují permeabilitu endotelu cév, způsobují produkci viskózního sekretu, bronchiální hyperreaktivitu a dysfunkci ciliárního transportu (28).
Antioxidativní ochranný systém
Vzestup koncentrace kyslíku v zemské atmosféře před 2,5 miliardami let fotosyntetickou aktivitou sinic musel způsobit stres, který mohly přežít jen druhy, u nichž se vyvinuly mechanismy chránící před kyslíkem a jeho metabolity (20). Organismus se brání tvorbě nadměrného množství VR opravou a novotvorbou kyslíkem poškozovaných struktur, regulací exprese a aktivity enzymů tvořících VR nebo eliminací již vytvořených endogenních či exogenních VR v organismu, tzv. scavengery. Např. první linie obrany vychytává exogenní VR ještě v tracheobronchiálním sekretu, tedy dříve než mohou proniknout intracelulárně a způsobit poškození buněčných struktur.
Antioxidativní enzymy
CuZnSOD nebo SOD1 - Měďnato-zinečnatá superoxiddismutáza se nachází v cytoplazmě prakticky všech buněk vyšších živočichů, zejména v erytrocytech, hepatocytech a neuronech. Gen pro CuZnSOD je lokalizovaný na chromozomu 21. Jeho mutace je popisována u jedinců s familiární amyotrofickou laterální sklerózou (30).
MnSOD nebo SOD2 – Superoxiddismutáza obsahující mangan, je popisována v mitochondriích, tedy v buněčné organele, kde se tvoří většina VR. U savců jsou nejvyšší hladiny v buňkách srdce, mozku, ledvin a játrech. Její gen je lokalizovaný na 6. chromozomu. Zatím je jen málo známých mutací MnSOD. Nejvíce pozornosti je věnováno záměnám nukleotidů na pozicích 47 a -9 podmiňujících změny v pořadí aminokyselin (Ala/Tre a Ala/Val) a způsobujících změnu aktivity exprimovaného proteinu (25). Podobnou změnu fenotypu způsobuje změna nukleotidů na pozici 245 (Ile/Tre). Varianta s isoleucinem má až 3x vyšší enzymovou aktivitu (32).
EC-SOD nebo SOD3 – Extracelulární forma superoxiddismutázy, obsahující rovněž měď a zinek, byla prokázána v plazmě a lymfě. Váže se na heparan sulfát a proteoglykany endotelu cév (30). Sandstrom zjistil až 10x vyšší hladinu EC-SOD v plazmě u 2 % švédské populace vyvolanou záměnou aminokyseliny Arg za Gly na pozici 213 (25). Tato změna pravděpodobně snižuje afinitu EC-SOD ke strukturám endotelových buněk. Incidence EC-SOD napovídá, že se s velkou pravděpodobností jedná o genetickou predispozici k vyšší hladině zmíněného enzymu.
GPx1 – Selen, obsahující glutathionperoxidáza kódována na 3. chromozomu, je exprimován u lidí zejména v cytoplazmě erytrocytů, buněk ledvin a jater. Několik známých mutací nemá vliv na aktivitu enzymu. Ratnasinghe prokázal asociaci mezi jednou variantou polymorfismu GPx1 na pozici 198 s rakovinou plic. Rovněž myši neschopné exprimovat GPx1 mají normální fenotyp, ale jsou citlivější na zvýšení oxidativního stresu vyvolaného paraquatem nebo H2O2. (22)
GPx2 – Cytoplazmatická glutathionperoxidáza, obsahující selen, je primárně tvořena v gastrointestinálním traktu savců, kde chrání před toxicitou pozřených lipidových peroxidů. Její gen se nachází se na 14. chromozomu.
GPx3 – Extracelulární glutathionperoxidáza se tvoří zejména v plazmě a její gen je lokalizován na 5. chromozomu. Jejím hlavním úkolem je redukovat hydroperoxidy komplexních lipidů, např. fosfatidylcholinu, v extracelulárních tekutinách.
CAT – Molekula katalázy, obsahující porfyrinový kruh se železem, je tvořena v peroxizomech erytrocytů. CAT je jedním z nejefektivnějších známých enzymů. Gen pro ní byl prokázán na 11. chromozomu. Hunt zjistil její up-regulaci při zvýšeném oxidativním stresu (14).
Glutathionový redoxní cyklus tvořený glutathionem (GSH), GPx a glutathionreduktázou (GR) je pravděpodobně nejdůležitější buněčný antioxidativní systém. Podílí se nejen na vychytávání VR, ale i na regulaci intracelulární redoxní rovnováhy. GPx redukuje H2O2 za současné oxidace GSH na jeho oxidovanou formu s disulfidovým můstkem (GSSG). GSSG je poté zpátky regenerován GR na GSH a opět připravený k vychytávání H2O2. Schopnost buňky tvořit GSH, ať novou syntézou nebo redukcí GSSG, je důležitým faktorem efektivnosti antioxidativní obrany.
Genetický podklad antioxidativních obranných mechanismů
Kapacita antioxidativních systémů buňky je závislá na genetické predispozici každého jedince. AOE u zdravého jedince musí zvládat neutralizaci jak fyziologicky tvořeného množství VR, tak i zvýšenou oxidativní zátěž, např. při zánětu. Právě geneticky podmíněná schopnost adaptovat efektivitu antioxidativní obrany na zvýšenou oxidativní zátěž je pravděpodobně zodpovědná za interindividuální variabilitu a rozdílnou klinickou manifestaci oxidativního stresu.
V současnosti jsou známé lokusy většiny významných AOE. Genetická variabilita u lidí je z větší části podmíněna variantami nukleotidů na určité pozici řetězce DNA, tzv. polymorfismy jediného nukleotidu (single nucleotide polymorphism, SNP). Většina SNP je němá bez jakéhokoliv vlivu na funkci proteinů. Naopak některé SNP výrazně podmiňují fenotyp (9).
Četné výzkumy se věnují sledování fenotypu různých polymorfismů AOE. Forsbergová uvádí, že polymorfismus u CAT signifikantně ovlivňuje její hladinu v buňkách, a tím i schopnost buňky bránit se oxidativnímu stresu (10). Fu uzavírá, že delece genů pro GPx1 u myší nevyvolá žádnou změnu fenotypu při běžné oxidativní zátěži, ale hepatocyty těchto myší se stanou senzitivnější k elevovanému oxidativnímu stresu (11).
Předpoklad geneticky podmíněné schopnosti onkologického pacienta posílit antioxidativní obranu v situaci zvýšené tvorby VR nádorovou tkání byl publikován Genkingerem. Pozoroval nižší riziko vzniku rakoviny obecně u heterozygotů Ala/Val (12) v souboru 6151 dárců krve.
Oxidativní stres a nádory hlavy a krku
Řada autorů v posledních letech popsala několik úrovní vztahu oxidativní zátěže k riziku vzniku a prognóze rakoviny obecně. Předpokládá se, že část nádorových onemocnění vzniká při dlouhodobé oxidativní zátěži v prostředí chronického zánětu (collitis ulcerosa-kolorektální karcinom, virová hepatitis-hepatocelulární karcinom atd.) (8). Dále je prokázaná role významných exogenních zdrojů VR (kouření, alkohol) v etiologii rakoviny. Předpokládá se zvláště úzký vztah mezi spinocelulárními karcinomy hlavy a krku a oxidativním stresem, protože alkohol a kouření jako zdroje masivní oxidativní zátěže jsou jasně přijímány jako etiologické faktory těchto malignit (4). Ke karcinogenezi přispívá i akumulace mutagenního potenciálu v případě, že organismus nestíhá reparovat oxidativním stresem poškozenou DNA. Oxidativní zátěž se ještě posílí u již vytvořené malignity, protože většina maligních buněk postrádá fyziologickou schopnost vypořádat se s oxidativním stresem kvůli změněné aktivitě AOE (4). Dále někteří autoři popisují i samotnou nádorovou tkáň jako zdroj rostoucího množství VR (5, 13, 29). Zatím není úplně objasněno, který zdroj oxidativní zátěže hraje nejdůležitější roli. Domníváme se, že in vivo se jedná spíše o kombinaci výše popsaných zdrojů VR, kdy jednotlivé zdroje mohou v různých fázích karcinogeneze hrát více nebo méně dominantní roli.
Několika autory popsaná intenzivnější lipidová peroxidace a nižší aktivita AOE u pacientů s karcinomy hlavy a krku (17, 18, 23, 26, 31) odpovídá zvýšenému oxidativnímu stresu u onkologických nemocných. Může se jednat o vyšší riziko vzniku rakoviny u pacientů s dlouhodobou expozicí vysokým hladinám VR nebo naopak vyšší oxidativní zátěž může vznikat v důsledku obrovského množství VR uvolňovaného samotnou nádorovou tkáňí. Po chirurgické resekci nádoru dochází k poklesu lipidové peroxidace a zvýšení aktivity AOE (5, 29). Hrizostov dokonce 10-20 dní po resekci tumoru zjistil normalizaci hodnot MDA jako ukazatele oxidativní zátěže v plazmě (13). Naopak Samir popsal elevaci produktů lipoperoxidace 3 týdny po laryngektomii (24). Szuster-Ciesielská zjistila zvýšenou hladinu VR korelující se stadiem u laryngeálního karcinomu (29). Podobně Yigitbasi popsal nepřímou úměru mezi aktivitou SOD a stupněm diferenciace (33). Je zajímavé, že Bohn nezjistil rozdílnou hladinu oxidativního stresu měřenou ihned po ukončení kurativního ozáření a 6 týdnů poté (4). Plazmatická hladina MDA, jako produktu lipoperoxidace korelující s expozicí buňky oxidativnímu stresu, je zvýšená u recidivující nemoci (16, 23).
V souladu s dostupnými literárními zdroji věříme, že nádorová tkáň je významným zdrojem VR. Narůstající množství nádorové tkáně (vyšší stadium nebo recidiva) koreluje s větším oxidativním stresem. Během destrukce nádorové tkáně radioterapií by mělo docházet k poklesu VR podobně jako po chirurgické resekci tumoru (13). Naopak samotná radioterapie je zdrojem masivní oxidativní zátěže. Z předchozího vyvozujeme, že snížení produkce VR nádorovými buňkami během ozařování je pravděpodobně substituováno oxidativním stresem vyvolaným radioterapií.
Vzhledem k působení chemoterapie i ozáření na maligní buňky volnými radikály a díky alteraci mechanismů neutralizujících oxidativní zátěž u těchto buněk, lze predikovat i vztah oxidativního stresu k rezistenci u adjuvantní terapie. Zdá se, že chemo - i radiorezistence může být podmíněna schopností buňky vypořádat se s oxidativním stresem. Navíc toxicita chemo/radioterapie je nejspíš ovlivněna neschopností zdravých buněk vypořádat se s masivními dávkami VR během celkově podávané adjuvantní terapie.
V onkologii hlavy a krku zatím nebyly žádné sérové nádorové markery s dostatečnou senzitivitou a specificitou zavedeny do rutinní praxe. Dle nejnovějších poznatků právě markery oxidativního stresu teoreticky nabízejí velký potenciál.
V dostupné literatuře se nám nepodařilo dohledat teoretický podklad funkce VR při metastazování. Využití VR maligními buňkami se nabízí hned v několika fázích procesu metastatické diseminace (intravazace, záchyt ve vzdálené tkáni, extravazace). Nejen v této oblasti je nutný další důkladný výzkum.
Potenciální využití studia oxidativního stresu v onkologii nádorů hlavy a krku
Výsledky výzkumů z posledních let nás opravňují předpokládat, že významný podíl na vzniku, progresi a následné prognóze nádorů hlavy a krku hrají exogenní zdroje volných kyslíkových radikálů jako kouření a konzumace alkoholu. Podaří-li se prokázat geneticky podmíněnou schopnost jedince vypořádat se s nadměrným oxidativním stresem, bude možné postavit hypotézu, že nositelé určité genetické varianty daného polymorfismu budou náchylnější ke vzniku onkologického onemocnění, popřípadě k jeho agresivnějšímu průběhu.
Již naše pilotní výsledky naznačují, že dle některých parametrů oxidativního stresu je možné předvídat větší lokoregionální diseminaci nebo časnější recidivu. Pokud se nám podaří potvrdit např. zvýšení určitého parametru oxidativního stresu u pacientů s výrazným metastatickým potenciálem do krčních uzlin, tak u této skupiny nemocných bude provedena elektivní bloková disekce. Naopak skupina nemocných s nízkou hladinou zmíněného parametru bude ušetřena zákroku na lymfatickém systému na krku, který je spojen se známými riziky a komplikacemi. Podobně při průkazu korelace mezi např. vysokou hladinou určitého parametru oxidativního stresu a délkou remise, bude možné vysokou hladinu zmíněného parametru označit jako rizikový faktor časné recidivy a přiklonit se k radikálnější adjuvantní terapii. Na základě dnes dostupných teoretických poznatků lze předpokládat, že mezi parametry oxidativního stresu mohou být nalezeny prognostické onkologické markery se všemi významnými důsledky pro klinickou praxi.
ZÁVĚR
Výsledky recentních výzkumů nás opravňují předpokládat, že významný podíl na vzniku, progresi a následné prognóze nádorů hlavy a krku hraje oxidativní stres. Proto lze předpokládat, že mezi parametry oxidativního stresu budou nalezeny prognostické onkologické markery se všemi významnými důsledky pro klinickou praxi. Vhodnými jsou zejména parametry vystavení buňky oxidativnímu stresu (MDA). Dále aktivita některých AOE by mohla predikovat senzitivitu nádorových buněk a míru toxicity ve zdravých buňkách během radio - nebo chemoterapie. Výzkum oxidativního stresu v onkologii hlavy a krku je jen na začátku. Dnes máme k dispozici dostatečný teoretický základ k hledání klinických vztahů mezi onkologickou charakteristikou pacientů a parametry oxidativního stresu.
Poděkování:
Práce byla podpořena grantem IGA MZ ČR č. 10/II NR/7996-3.
Došlo 6. 10. 2006
MUDr. Richard Salzman
Klinika otorinolaryngologie a chirurgie hlavy a krku
LF MU a FN u sv. Anny
Pekařská 53
625 00 Brno
Zdroje
1. Agosti, J. M., Altman, L. C., Ayars, G. H. et al.: The injurious effect of eosinophil peroxidase, hydrogen peroxidase and habides on pneumocytes in vitro. Journal of Allergy and Clinical Immunology, 79, 1987, s. 496-504.
2. Ayars, G. H., Altman, L. C., McManus, M. M. et al.: The injurious effect of eosinophil peroxidase-halide system and major basic protein in human nasal epithelium in vitro. American Review of Respiratory Disease, 140, 1989, s. 125-131.
3. Barnes, P. J.: Reactive oxygen species and airway inflammation. Free Radical Biology&Medicine, 9, 1990, s. 235-243.
4. Bohn, S. K., Smeland, S., Sakhi, A. K.: Post-radiotherapy plasma total glutathione is associated to outcome in patients with head and neck squamous cell carcinoma. Cancer Letters. 18, 2, s. 240-247
5. Bhuvarahamurthy, V., Balasubramanian, N., Govindasamy, S.: Effect of radiotherapy and chemoradiotherapy on circulating antioxidant system of human uterine cervical carcinoma. Molecular and Cellular Biochemistry, 158, 1996, 1, s. 17-23.
6. Comhair, S., Thomassen, M. J., Erzurum, S. C.: Differential induction of extracellular glutathione peroxidase and nitric oxidesynthase 2 in airways of healthy individuals exposed to 100% oxygen or cigarette smoke. American Journal of Respiratory Cell and Molecular Biology, 23, 2000, s. 350-354.
7. Curtin, J. F., Donovan, M., Cotter, T. G.: Regulation and measurement of oxidative stress in apoptosis. Journal of Immunological Methods, 265, 2002, s. 49-72.
8. Dreher, D., Junod, A. F.: Role of oxygen free radicals in cancer development. European Journal of Cancer, 32, 1, 1996, s. 30-38.
9. Forsberg, L., de Faire, U., Morgenstern, R.: Oxidative stress, human genetic variation, and disease. Archives of Biochemistry and Biophysics, 389, 1, 2001, s. 84-93.
10. Forsberg, L., Lyrenas, L., de Faire, U., Morgenstern, R.: A common functional C-T substitution polymorphism in the promoter region of the human catalase gene influences transcription factor binding, reporter gene transcription and is correlated to blood catalase levels. Free radical biology&medicine, 30, 5, 2001, s. 500-505.
11. Fu, Y., Cheng, W. H., Porres, J. M., Ves, D. A., Lei, X. G.: Knock-out of cellular glutathione peroxidase gene renders mice susceptible to diquat-induced oxidative stress. Free radical Biology&Medicine, 27, 1999, 5-6, s. 605-611.
12. Genkinger, J. M., Platz, E. A., Hoffman, S. C.: C47T polymorhism in manganese superoxide dismutase, antioxidant intake and survival. Mechanisms of Ageing and Development, 127, 2006, 4, s. 371-377.
13. Hrizostov, D., Gadjeva, V., Vlaykova, T., Dimitrov, G.: Evaluation of oxidative stress in patients with cancer. Archives of Physiology and Biochemistry, 109, 2001, 4, s. 331-336.
14. Hunt, C. R., Sim, J. E., Sullivan, S. J. et al.: Genomic instability and catalase gene amplification induced by chronic exposure to oxidative stress. Cancer Research, 58, 2003, s 3986-3992.
15. Chistyakov, D. A:, Savostanov, K. V., Zotova, E. V., Nosikov ,V. V.: Polymorphisms in the Mn-SOD and EC-SOD genes and their relationship to diabetic neuropathy in type I diabetes mellitus. BMC Medical Genetics, 2, 2000, s. 4-10.
16. Jaloszynski, P., Jaruga, O., Olinski, R., Biczysko, W., Szyfter, W., Nagy, E. et al.: Oxidative DNA base modifications and polycyclic aromatic hydrocarbon DNA adducts in squamous cell carcinoma of larynx. Free Radicals Research, 37, 2003, 3, s. 231-240.
17. Kaynar, H., Meral, M., Turhan, H., Keles, M., Celik, G., Akcay, F.: Glutathione peroxidase, glutathione-S-transferase, catalase, xanthine oxidase, Cu-Zn superoxide dismutase activities, total glutathione, nitric oxide and malondialdehyde levels in erythrocytes of patients with small cell and non-small cell lung cancer. Cancer Letters, 227, 2005, 2, s. 133-139.
18. Korotkina, R N., Matskevitch, G. N., Devlikano, A. S., Vishnevskii, A. A., Kunitsyn, A. G., Karelin, A. A.: Activity of glutathione metabolizing and antioxidant enzymes in malignant and benign tumors of human lungs. Bulletin of experimental Biology and Medicine, 133, 2002, 6, s. 606-608.
19. Nadif, R.: Effect of TNF and LTA polymorphisms on biological markers of response to oxidative stimuli in coal miners. Journal of Medical Genetics, 40, 2003, s. 96-103.
20. Otto-Knapp, R., Jurgovski, K., Schierhorn, K. et al.: Antioxidative enzymes in human nasal mucosa after exposure to ozone. Possible role of GSTM1 deficiency. Inflammation Research, 52, 2003, s. 51-55.
21. Racek, J.: Oxidační stres a možnosti jeho ovlivnění. Praha, Galen, 2003, s. 90.
22. Ratnasinghe, D., Tangrea, J. A., Andersen, M. R. et al.: glutathione peroxidase codon 198 polymorphism variant increases lung cancer risk. Cancer Research, 60, 2000, s. 6381-6383.
23. Sabitha, K. E., Shyamaladevi, C. S.: Oxidant and antioxidant activity changes in patients with oral cancer and treated with radiotherapy. Oral Oncology, 35, 1999, s. 273-277.
24. Samir, M., el Kholy, N. M.: Thiobarbituric acid reactive substances in patients with laryngeal cancer. Clinical Otolaryngology and Allied Science, 24, 1999, 3, s. 232-234.
25. Sandstrom, J., Karlsson, K., Edlund, T., Marklund, S. L.: Heparin-affinity patterns and composition of extracellular superoxide dismutase in human plasma and tissues. Biochemical Journal, 294, 1993, s. 853-857.
26. Seven, A., Civelek, S., Inci E., Inci, F., Korkut, N., Burcak, G.: Evaluation of oxidative stress parameters in blood of patients with laryngeal carcinoma. Clinical Biochemistry. 32, 5, 1999, s. 369-373.
27. Subapriya, R., Kumaraguruparan, R., Nagini, S., Thangavelu, A.: Oxidant-antioxidant status in oral precancer and oral cancer patients. Toxicology Mechanisms and Methods, 13, 2003, s. 77-81.
28. Szalagatys, A., Korzon, M.: The role of oxidative stress in pathogenesis of asthma. Medical Science Monitor, 9, 2003, 4, s. 89-93.
29. Szuster-Ciesielska, A., Hryciuk-Umer, E., Stepulak, A., Kupisz, K., Kandefer-, M.: Reactive oxygen species production by blood neutrophils of patients with laryngeal carcinoma and antioxidative enzyme activity in their blood. Acta Oncologica. 43, 2004, 3, s. 252-258.
30. Štípek, S., Borovanský, J., Čejková, J. et al.: Antioxidanty a volné radikály ve zdraví a nemoci. Praha, Grada Publishing, 2000, s. 320.
31. Taysi, S., Uslu, C., Akcay, F., Sutbeyaz, M. Y.: Malondiadehyde and nitric oxide levels in the plasma of patients with advanced laryngeal cancer. Surgery Today, 33, 2003, 9, s. 651-654.
32. Tomblyn, M., Kasarskis, E. J., Xu, Y. St. Clair, D. K.: Distribution of MnSOD polymorphisms in sporadic ALS patients. Journal of Molecular Neuroscience, 10, 1998, s. 65-66.
33. Yigitbasi, O G., Guney, E., Haghighi, N., Dogan, P., Saraymen, R., Balkanli, S.: Oxidant and antioxidant status in larynx squamous cell carcinomas. Journal of Experimental and Clinical Cancer Research, 19, 2000, 4, s. 447-451.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2007 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosine nově bez indikačních a preskripčních omezení
- Lokální antiseptická terapie faryngitidy – účinnost oktenidinu a zachování integrity střevní mikrobioty
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
- Kvalita života u pacientů s tracheostomií
- Rizikové faktory tranzitorní hypoparatyreózy a stanovení jejich statistické významnosti po operacích štítné žlázy
- Role superoxiddismutázy u spinocelulárních karcinomů hlavy a krku – pilotní výsledky
- Výsledky léčby u časných stadií glotického karcinomu hrtanu
- Chylózní píštěle
- Komplexní reedukace hlasu v AFC
- Oxidativní stres a karcinogeneze - teoretický úvod
- The International Otopathology Society (a.k.a. The Schuknecht Society) Eleventh Triennial Meeting
- 4th International Symposium on Middle Ear Mechanics in Research and Otology (MEMRO 2006)
- Update in Otology and Otologic Surgery
- Up-dated Management of Vertigo and Vestibular Disorders (Marseille Training Course 2006)
- František Ninger ve vzpomínkách Jana a Ivana Hybáškových
- Životní jubilea členů naší společnosti v roce 2007
- Kalendář akcí České společnosti otorinolaryngologie a chirurgie hlavy a krku a dalších oznámených schůzí, kongresů a kurzů v ČR a v zahraničí
- Mikrobiální osídlení zdravého zevního zvukovodu
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kvalita života u pacientů s tracheostomií
- Výsledky léčby u časných stadií glotického karcinomu hrtanu
- Chylózní píštěle
- Oxidativní stres a karcinogeneze - teoretický úvod
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



