-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hyperparatyreóza
Hyperparathyroidism
Hyperparatyreóza (HPT) je poměrně časté endokrinní onemocnění, nejčastěji se vyskytuje jako primární (PHPT), která zaujímá třetí místo podle výskytu endokrinních chorob. Hlavním projevem choroby je nadměrná tvorba parathormonu (PTH) se současně se zvětšujícími příštítnými tělísky (PT). Vyskytuje se v několika formách, a to při patologických stavech majících příčinu v samotných PT, či sekundárně při poruchách kalciového metabolismu. V určování diagnózy jsou kromě anamnestických dat prioritní výsledky biochemických hodnot. K nejdůležitějším patří hladiny imunoreaktivního PTH (iPTH) v plazmě a hodnoty Ca a P v séru, dále základní biochemické hodnoty funkce ledvin, pankreatu, event. kostního metabolismu. Diagnóza se rovněž opírá o nálezy zobrazovacích technik, k základním vyšetřením se řadí sonografie a scintigrafie. Na základě shrnutí laboratorních výsledků a nálezů zobrazovacích technik je indikována chirurgická nebo konzervativní terapie.
V posledních letech se výrazně zlepšila péče o pacienty s HPT. Jistě k tomu přispěly i možnosti přesnější lokalizace hyperprodukující tkáně PT pomocí zobrazovacích metod, které jsou vodítkem k výběru nejefektivnějšího a nejšetrnějšího operačního řešení. Tento souhrnný článek s potřebnými informacemi týkajícími se hyperparatyreózy, je určen především pro kolegy v předatestační přípravě.
Keywords:
hyperparathyroidism – imaging procedures – review
Autoři: Daniela Chroustová; David Zogala
Působiště autorů: Ústav nukleární medicíny, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze, ČR
Vyšlo v časopise: NuklMed 2021;10:42-51
Kategorie: Přehledová práce
Souhrn
Hyperparatyreóza (HPT) je poměrně časté endokrinní onemocnění, nejčastěji se vyskytuje jako primární (PHPT), která zaujímá třetí místo podle výskytu endokrinních chorob. Hlavním projevem choroby je nadměrná tvorba parathormonu (PTH) se současně se zvětšujícími příštítnými tělísky (PT). Vyskytuje se v několika formách, a to při patologických stavech majících příčinu v samotných PT, či sekundárně při poruchách kalciového metabolismu. V určování diagnózy jsou kromě anamnestických dat prioritní výsledky biochemických hodnot. K nejdůležitějším patří hladiny imunoreaktivního PTH (iPTH) v plazmě a hodnoty Ca a P v séru, dále základní biochemické hodnoty funkce ledvin, pankreatu, event. kostního metabolismu. Diagnóza se rovněž opírá o nálezy zobrazovacích technik, k základním vyšetřením se řadí sonografie a scintigrafie. Na základě shrnutí laboratorních výsledků a nálezů zobrazovacích technik je indikována chirurgická nebo konzervativní terapie.
V posledních letech se výrazně zlepšila péče o pacienty s HPT. Jistě k tomu přispěly i možnosti přesnější lokalizace hyperprodukující tkáně PT pomocí zobrazovacích metod, které jsou vodítkem k výběru nejefektivnějšího a nejšetrnějšího operačního řešení. Tento souhrnný článek s potřebnými informacemi týkajícími se hyperparatyreózy, je určen především pro kolegy v předatestační přípravě.
Klíčová slova:
hyperparatyreóza – zobrazovací metody – přehled
Anatomie, fyziologie a patofyziologie příštítných tělísek
PT jsou 4 malé, čočkovité útvary, přiléhající na zadní stranu štítné žlázy. Za normálních okolností rozlišujeme 2 horní a 2 dolní tělíska. Horní PT jsou umístěna ve viscerální oblasti krku posteromediálně ve vztahu ke štítné žláze, blízko tracheoezofagového žlábku. Dolní PT jsou variabilnější ve svém umístění, často jsou lokalizována na posterolaterální ploše dolního pólu štítné žlázy. (Obr. 1) PT jsou normálně 6 mm dlouhá, v příčném řezu mají 3–4 mm a v předozadním řezu 1–2 mm. Obvyklá hmotnost tělíska je 29,5 ± 17,8 mg (průměr ± SD). 1,2,3 Ektopické PT může být umístěno pod dolními póly štítné žlázy nebo v hrudníku, a to buď v thyrothymickém vazu nebo v krčním thymu.
Obr. 1. Poloha PT, jejich cévní zásobení a vztah k průběhu n. laryngeus recurrens. Se souhlasem a laskavostí převzato z knihy Hyperparatyreóza autorů Adámek & Naňka (2006). 1 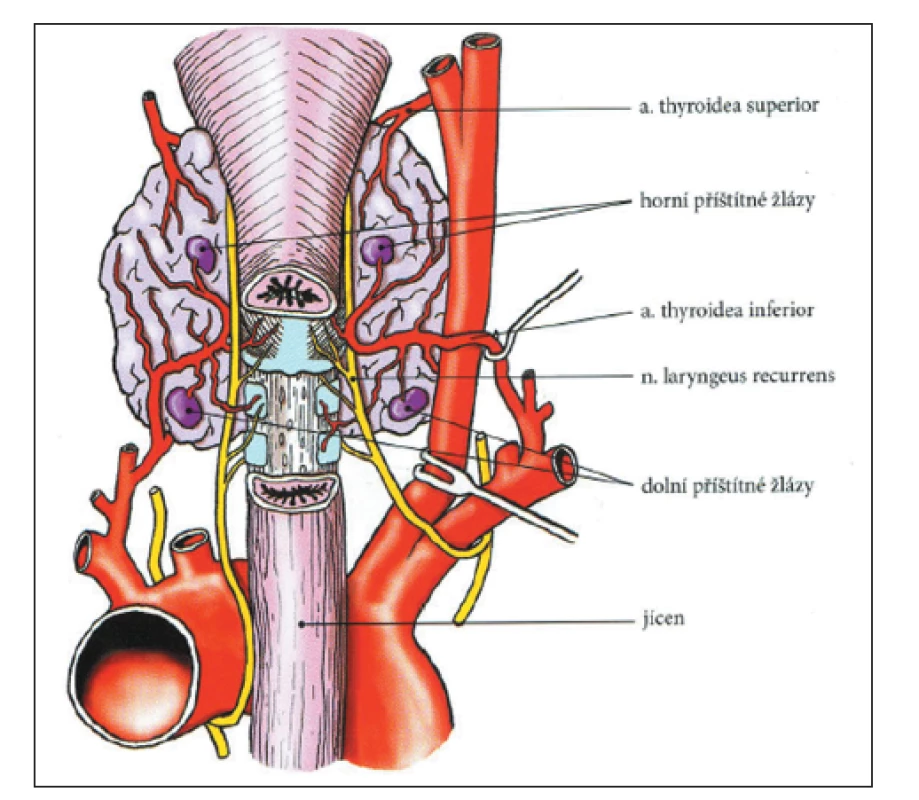
PT sehrávají významnou úlohu při udržování normálních hodnot Ca a anorganických fosfátů v plazmě prostřednictvím PTH, a to společně s ještě dalšími kalcioprotektivními látkami: kalcitoninem a dále kalcitriolem, 1,25-dihydroxycholekalciferol-aktivním metabolitem vitamínu D. Koncentrace ionizovaného Ca je hlavním regulátorem sekrece PTH v PT. Jedním z nejdůležitějších účinků PTH je aktivace 1-α-hydroxylázy v ledvině s následnou tvorbou 1-α-25-dihydroxycholekalciferolu, který zvyšuje absorpci Ca a P ze střeva, mineralizuje osteoid a zvyšuje zpětné vstřebávání Ca ledvinami. Aktivací osteoklastů dochází k osteolytické resorpci kostní hmoty s uvolňováním Ca a organických součástí kostní tkáně. Kostní změny vyvolané nadbytečnou produkcí PTH se nazývají hyperparatyreózní osteodystrofie a vyskytují se s výraznou širokou variabilitou postižení. Výsledkem je řídnutí kortikálních kostí a spongiózní přestavba se vznikem až charakteristických spongiózních cyst a obrovsko-buněčných hnědých tumorů, které lze dobře detekovat jak pomocí rtg technik, tak i scintigraficky. (Obr. 2) V ledvinách PTH zvyšuje vylučování fosfátů močí snížením jejich zpětné resorpce a zvyšuje zpětnou tubulární resorpci Ca. Výsledná hyperkalciúrie a přitom zvýšené vylučování fosfátů mohou vést k nefrokalcinóze a zvýšené tvorbě ledvinových kamenů. 1
Obr. 2. Scintigrafie skeletu a CT u 33leté pacientky s PHPT s hnědými tumory ve skeletu. Vlevo: celotělová scintigrafie skeletu pomocí 99mTc-HDP (v přední a zadní projekci) s vícečetnými ložisky patologicky zvýšené akumulace radiofarmaka zejména v oblasti lebky, v levé lopatce, v pánvi a kostech dolních končetin.
Vpravo: CT vyšetření pánve téže pacientky s průkazem vybraného osteolytického ložiska v oblasti pravé kosti kyčelní v axiálním, koronálním a sagitálním řezu.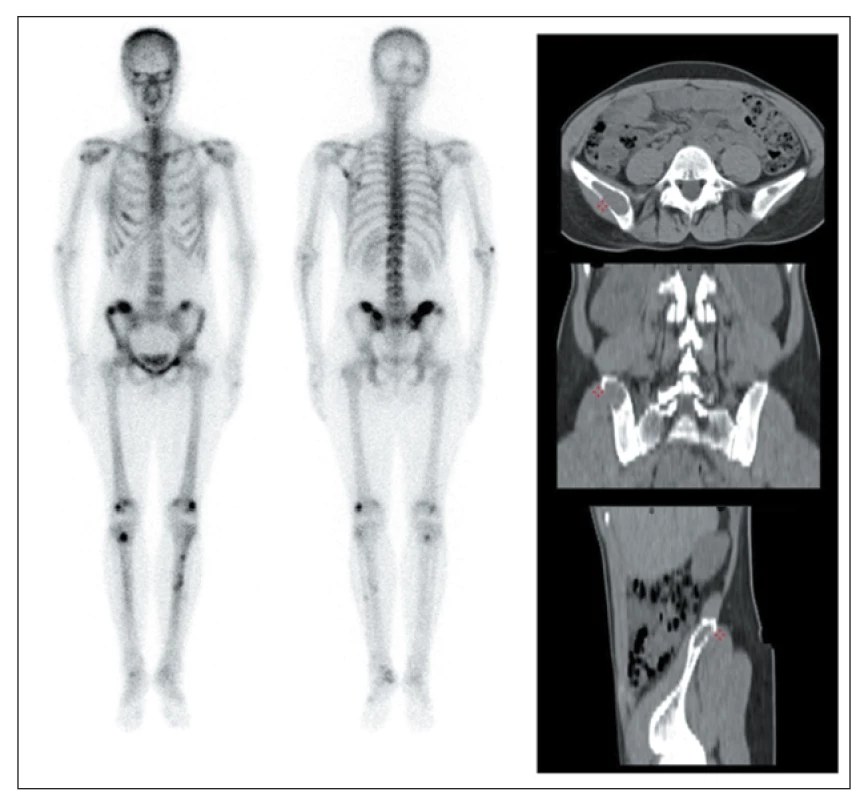
Formy HPT
1. Primární hyperparatyreóza (PHPT) je onemocnění vyvolané zvýšenou produkcí PTH, což vede ke generalizované poruše Ca, P a kostního metabolismu. Projevuje se nejčastěji zvětšením obvykle jednoho či dvou PT v podobě adenomu. Choroba může vzniknout na genetickém podkladě jako familiární HPT, což je autosomálně dominantní onemocnění. Vyskytuje se samostatně nebo jako součást mnohočetné endokrinní neoplasie (MEN). Existuje několik forem:
MEN 1 se vyznačuje společným výskytem HPT a nádorů hypofýzy a pankreatu (gastrinom, inzulinom, méně často glukagonom),
MEN 2 je charakterizována současným výskytem HPT s feochromocytomem a medulárním karcinomem štítné žlázy. 1,4
MEN 4 je velmi vzácná forma MEN charakterizované nádory PT a přední hypofýzy, pravděpodobně spojené s nádory nadledvin, ledvin a reprodukčních orgánů. 5
Další jednotkou je familiární benigní hypokalciurická hyperkalcémie (FBHH). Postižení jedinci jsou heterozygotní nositelé inaktivační mutace v genu pro Ca senzitivní receptor s autosomálně dominantním typem dědičnosti. Funkčním následkem je snížená citlivost PT na výši kalcémie, takže k útlumu sekrece PTH dochází až při vyšších hladinách kalcémie, neboť normální hladiny Ca v plazmě jsou vnímány jako nízké.
2. Sekundární hyperparatyreóza (SHPT) vzniká sekundárně u řady stavů s nízkou hladinou ionizovaného Ca, která vede ke zvýšené sekreci PTH. Projevuje se zvětšením více PT s histologickým potvrzením hyperplazie PT.
3. Terciální hyperparatyreóza (THPT) vzniká u pacientů s protrahovanou SHPT, nejčastěji u nemocných po transplantaci ledvin, u kterých pak vlivem relativně autonomní hyperfunkce a zvětšení PT nedochází k normalizaci koncentrace Ca v séru. 1
4. Kvartérní hyperparatyreóza (KHPT) je vzácná forma SHPT, při které hyperkalcémie při primární hyperfunkci adenomu PT způsobila renální insuficienci s následnou sekundární hyperplazií zbylých PT.
Primární HPT
Toto onemocnění se může vyskytovat v každém věku, v dětství je poměrně vzácné. Postihuje třikrát častěji ženy než muže a tento rozdíl se s věkem stupňuje. Největší frekvence onemocnění je ve věkové skupině 40–60 roků. Na PHPT je nutno pomýšlet vždy u žen kolem 50 let, u nichž je diagnostikována hyperkalcémie. Prevalence se celosvětově pohybuje v rozmezí 0,1–0,7 %. 6 Incidence tohoto onemocnění v ČR se udává kolem 25 na 100 tisíc, prevalence kolem 1/1000. 7
Patologickým podkladem PHPT jsou 3 patologické stavy:
1. adenom PT je benigní tumor postihující zpravidla jednu žlázu a je z 80–90 % nejčastější příčinou PHPT, dva a více adenomů jsou příčinou PHPT v 11 %.
2. hyperplazie PT postihuje zpravidla všechna tělíska a jako příčina vzniku PHPT se uvádí okolo 10 %.
3. karcinom PT je vzácnou příčinou PHPT cca v 0,5–1 %. 1,5
Diagnostika PHPT se opírá jak o klinické, tak zejména laboratorní vyšetření.
Klinicky se PHPT projevuje nejčastěji následujícími příznaky: bolestmi v kostech, nefrolitiázou, gastrointestinálními obtížemi, psychickými obtížemi a únavou. Často ji doprovází i další nespecifické příznaky, kdy pacient uvádí pocity vyčerpání, slabosti, depresivní stavy, bolesti kloubů, nechutenství, nauzeu, obstipaci aj. Příznaky mohou mít různou intenzitu. Mezi příznaky orgánového postižení patří nefrolitiáza, patologické fraktury, peptický vřed, pankreatitida a hypertenze.
K diagnostice významně přispívá laboratorní vyšetření s nálezy hyperkalcémie a zvýšené hladiny iPTH, obvykle je snížená hladina P a zvýšen je poměr chloridů k P. V moči může být normální nebo zvýšená koncentrace Ca. Výrazně zvýšená hladina cirkulujícího PTH vede k hyperkalcémii a hypofosfatémii, stimuluje osteoklastogenezi a novotvorbu kosti, může navodit fibrózní přestavbu kosti, tvorbu cyst a obrovsko-buněčných hnědých nádorů. (Obr. 2) Dochází ke zvýšenému počtu remodelačních cyklů v kostech a remodelace vede ke zvýšené resorpci kosti, která převažuje nad zvýšenou novotvorbou organické kostní matrix. Kostní změny mohou být v rozsahu od difuzní osteopenie až po těžké změny s osteolytickými ložisky. 4,8
Normokalcemická PHPT
V posledních letech se do popředí zájmu endokrinologů dostává normokalcemická HPT (NPHPT). Jedná se o variantu PHPT, která se vyznačuje trvale zvýšenou hladinou PTH spolu s normálními koncentracemi sérového Ca při současném vyloučení sekundárních příčin zvýšené koncentrace PTH. K nim patří např. insuficience vitamínu D, chronické onemocnění ledvin, léčba pomocí léků, které zvyšují hodnoty PTH (thiazidy, bifosfonáty, denosumab, lithium), dále hyperkalciúrie a okultní malabsorpční syndromy. 4,9–12
V literatuře je NPHPT vysvětlována jen mírnou nadprodukcí PTH a rovněž je přičítána kostní a renální rezistenci na biologický účinek PTH 13, které se projevují odlišným renálním tubulárním účinkem PTH se sníženou reabsorpcí Ca, nedochází ke snížení tubulární fosfátové reabsorpci a stimulace syntézy 1,25 dihydroxyvitamínu D je rovněž potlačena. NPHPT může do hyperkalcémické formy přecházet, případně být její lehčí formou. 14–17
Diagnostika se opírá o laboratorní vyšetření s posouzením kalcémie podle hladin celkového sérového Ca a hladiny ionizovaného Ca. Jejich normální hodnoty stanoví příslušná laboratoř. Za hyperkalcémii jsou považovány koncentrace celkového Ca > 2,6 mmol/l a hladiny ionizovaného Ca > 1,32 mmol/l. K diferenciální diagnostice je ovšem třeba znát také hladiny fosfátů a 25(OH) vitamínu D.
Sekundární HPT
SHPT vzniká u řady stavů s nízkou hladinou ionizovaného kalcia stimulující zvýšenou sekreci PTH.
Hlavním jejím projevem je relativně zvýšená produkce PTH s kontinuálním zvětšením PT. 18,19 PT reagují tzv. hyperplazií, projevující se zvětšením více tělísek, které však obvykle nedosahuje rozměrů jako při primární poruše PT, kdy se zvětšuje obvykle jedno PT v podobě adenomu. Lokalizace PT je tedy právě u SHPT obtížnější než při PHPT.
Diagnostika SHPT se opírá především o biochemické vyšetření.
Klinicky se SHPT projevuje zejména bolestmi v kostech a kloubech, které svou nespecifičností jsou pro diagnózu málo přínosné. Vzácnějšími příznaky jsou kalcifikace v měkkých tkáních (v podkoží, periartikulárně) nebo syndrom červených očí při kalcifikaci ve spojivce a rohovce.
Laboratorní nálezy signalizují hypokalcémii, hyperfosfatémii a vzestup PTH. Při výrazné hypokalcémii se mohou objevit poruchy srdečního rytmu až srdeční selhání, zvýšená nervosvalová dráždivost, někdy až tetanie. V pokročilých fázích místo hypokalcémie nastupuje hyperkalcémie, ohlašující riziko mimo kostních kalcifikací.
Průkaz zvětšených PT pomocí zobrazovacích metod
Za normálních okolností nelze PT zobrazit žádnou ze zobrazovacích metod (rtg, CT, MR, sonografie, metody nukleární medicíny), protože velikost PT je pod rozlišovací schopností těchto metod. Hyperfunkční PT lze scintigraficky detekovat, pokud dosáhnou rozměrů alespoň 5 mm popř. hmotnosti okolo 100 mg. K jejich zobrazení lze využít řadu dalších technik od sonografie až po využití náročnějších zobrazovacích metod (MRI, hybridní systémy).
K základnímu vyšetření PT patří sonografie a scintigrafie.
Sonografie
Celkově sonografie představuje vyšetření první volby pro svou dostupnost a snadnou proveditelnost, dále nízkou cenu, minimální zátěž a riziko pro pacienta. Sonografie však má i své limity, k nejdůležitějším patří to, že touto technikou není možné zachytit ektopické mediastinální PT. 18,20 Při selhání tohoto vyšetření (tzn. nenalezení zvětšeného PT) nastupují další zobrazovací metody. 1
Metody nukleární medicíny
Nukleární medicína se v průběhu let snažila přispět svými metodami k zobrazení hyperfunkčních PT. V roce 1980 byla poprvé úspěšně zobrazena PT pomocí chloridu [201Tl] thalného. V průběhu následujících let bylo vyvinuto několik dalších radiofarmak využívaných k diagnostice hyperfunkčních PT různým způsobem. Patří k nim 99mTc-MIBI (methoxy-isobutyl-isonitril) nebo 99mTc-tetrofosmin k určení lokalizace PT, 99mTc-NaTcO4 (pertechnetát) a 123I pro vyšetření štítné žlázy, dále z pozitronových radiofarmak lze jmenovat 11C-methionin 8,21 nebo 18F-FDG (fluorodeoxyglukóza) a v poslední době 18F-FCH (fluorocholin). 22,23
Přestože zcela specifické radiofarmakum pro zobrazení PT dosud neexistuje, byly vyvinuty různé postupy zobrazení s použitím subtrakční techniky.
První subtrakční metody k detekci PT se prováděly pomocí 99mTc-MIBI a 123I. Výhodou 123I je jeho dobrá akumulace a organifikace ve štítné žláze, umožňující její kvalitní zobrazení. Nevýhodou je poměrně vysoká cena tohoto radiofarmaka a delší doba minimálně 2 hodiny mezi intravenózní aplikací a možností zobrazování, čímž se prodlužuje procedura vyšetření. 5 Na druhou stranu umožňuje simultánní snímání štítné žlázy použitím 123I s akvizicí PT pomocí 99mTc-MIBI, díky rozdílné energii obou radiofarmak (159 keV a 140 keV).
Subtrakční metoda s použitím 2 radiofarmak zaznamenala v klinické praxi řadu variant, ať už volbou radiofarmaka nebo použitím digitálního zpracování obrazů. 18,24 Pro subtrakci se rovněž využívá 99mTc-NaTcO4, který je denně dostupný, levný, má nižší radiační zátěž než 123I a obrazy štítné žlázy lze provést za 15–20 minut po intravenózní aplikaci. Po odečtení obrazů se zvětšené PT v místě své lokalizace zobrazuje jako ložisko zvýšené akumulace.
Další technikou k detekci PT je dvoufázová scintigrafie pomocí 99mTc-MIBI, která je založena na rozdílně kinetice radiofarmaka ve štítné žláze a v tkáních PT, tedy na poznatku, že se 99mTc-MIBI rychleji vyplavuje z tyreoidální tkáně než z hyperplastického PT. Mechanismus akumulace 99mTc-MIBI není přesně znám, mimo jiné závisí na kapilární permeabilitě, lokální perfuzi a počtu mitochondrií v buňkách PT, na které se 99mTc-MIBI váže. 1 Častěji MIBI zůstává konstantně vázáno v PT (pravděpodobně v důsledku vazby na mitochondrie nebo sníženou expresí P-glykoproteinu 25), zatímco ze štítné žlázy je vyplaveno. Za normálních okolností (bez hyperfunkce) je akumulace MIBI v PT nízká a nelze je scintigraficky zobrazit.
Při dvoufázové technice se provádí obrazy v časových odstupech, časné za 5–10 minut a pozdní za 2 hodiny po aplikaci 99mTc-MIBI, s předpokladem zobrazení hyperakumulujícího PT na pozdním obraze.
Při vyšetření pacientů touto metodou bylo prokázáno, že lze při užití SPECT určit patologii PT přibližně v 60 % případů. 26,27,28
V některých případech mohou být rychlosti vyplavování ze štítné žlázy a hyperplastických PT podobné a průkaz PT na pozdních obrazech může chybět. 23
Zobrazení PT a štítné žlázy lze provést různými technikami nukleární medicíny, buď pomocí planární scintigrafie nebo SPECT vyšetřením s použitím paralelních kolimátorů či planární scintigrafie pomocí pinhole kolimátoru. 22,23 V posledních letech je preferována SPECT. 3,24,26,29–31
Nejčastější rozdíly v porovnání chirurgických a scintigrafických výsledků pomocí 99mTc-MIBI se týkaly nesprávně pozitivních nálezů, a to při hodnocení počtu hyperfunkčních PT, kdy scintigraficky detekovaná PT nebyla potvrzena chirurgicky. Nesprávně negativní výsledky se týkaly malých lézí, ev. jejich lokalizace (maskování aktivitou jiných struktur – např. štítné žlázy, zejména při fokální hyperfunkci). Roli může mít i histologické složení hyperfunkčního PT – akumulace MIBI je vyšší u adenomů z oxyfilních buněk bohatých na mitochondrie. Naopak může chybět u adenomů z buněk hlavních. 32,33
Nukleární medicína přispívá rovněž při provádění radiačně navigované paratyreoidektomie při miniinvazivních chirurgických výkonech. Po aplikaci 99mTc-MIBI a provedení scintigrafických obrazů je v časovém odstupu po aplikaci radiofarmaka, obvykle za 2–3 hodiny, proveden chirurgický výkon. K identifikaci patologického PT je používána detekční sonda, která zvětšené PT určí podle měřené radioaktivity a zvukové signalizace. 22,23,34,35
RTG metody
Z rentgenologických metod je k detekci PT využívána počítačová tomografie (CT). V současné době lze využít spirální CT, které umožňuje rychlé zobrazení souvislého anatomického prostoru bez dechových a pohybových artefaktů. Adenomy PT mají nativně denzitu podobnou svalům, postkontrastně se jejich denzita zvyšuje. Senzitivita CT vyšetření se pohybuje v rozmezí 40–90 %. Nesprávně pozitivní nález může zavinit uzel ve štítné žláze nebo vinutá céva, nesprávně negativní nálezy jsou nejčastěji způsobeny ektopicky uloženým tělískem nebo tělískem ve štítné žláze. CT vyžaduje rovněž aplikaci jódového kontrastu, který nelze podat pacientům s alergií na jódové KL a s renální insuficiencí. Nálezy komplikují i artefakty způsobené kontrastní náplní žil v horním mediastinu. 1
V současnosti se do popředí zobrazování patologické paratyreoidální tkáně dostává tzv. four-dimensional computed tomography (4D CT), čtyřrozměrná počítačová tomografie. 8,36–38 Princip této metody tkví v provedení 4 fází zobrazení krku a hrudníku. PT jsou obvykle bohatě vaskularizovaná a v časné fázi se tedy výrazně sytí kontrastní látkou. Rychle se ale odsycují a v pozdních fázích se stávají hypodenzní.
1. fáze skenování se provádí před aplikací kontrastní látky (KL).
2. fáze se provádí za 30 s po aplikaci KL.
3. pozdní fáze se provádí po ukončení 2. fáze, obvykle za 45 s po aplikaci KL.
4. pozdní fáze se provádí za 30–45 s po skončení 3. fáze.
Nevýhodou metody je vyšší radiační zátěž a potřeba aplikace jodové KL. Proto byly zkoušeny pouze 2 fáze arteriální a venózní, které vedly ke snížení radiační dávky a v praxi se osvědčily jako dostačující při detekci hyperfunkčních PT. 5
Cílem je identifikovat patologické PT s upřesněním jeho lokalizace a odlišením od okolních orgánů a tkání v jednotlivých fázích. (Obr. 3) V několika publikacích je tato metodika skenování doporučována, zejména pokud na sonografii a MIBI scintigrafii byl negativní výsledek, dále po předchozích neúspěšných operacích PT, popřípadě u pacientů s multiglandulárním postižením PT nebo u pacientů s jen středně zvýšenými laboratorními hodnotami PTH a Ca.
Obr. 3. Fázové axiální 4D CT obrazy u pacientky s primární hyperparatyreózou.
Dorzálně od pravého laloku štítné žlázy se zobrazuje uzel (a) nativně hypodenzní, (b) v arteriální fázi hyperdenzní, (c) ve venózní fázi prakticky isodenzní s parenchymem štítné žlázy. Operačně a histologicky potvrzen adenom PT. Obrazy zapůjčeny s laskavostí MUDr. Vladimíra Černého Ph.D. z Radiologické kliniky VFN Praha.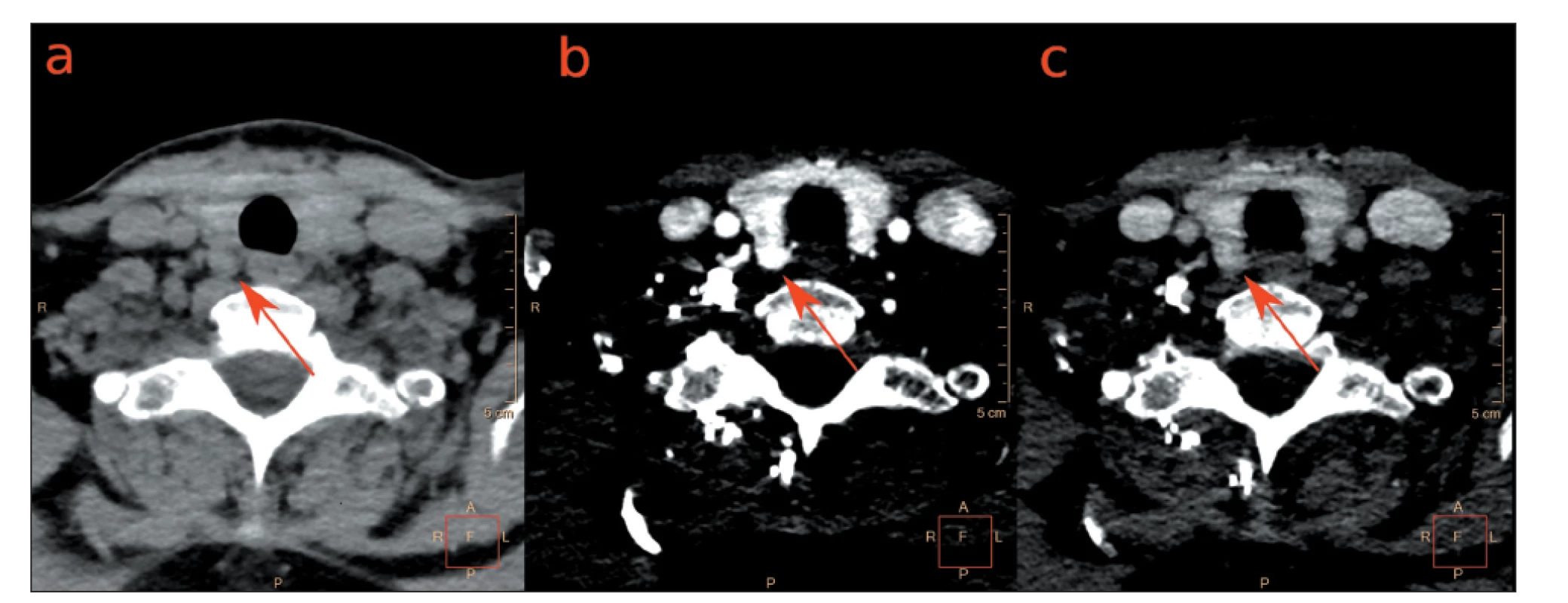
Do přehledu zobrazovacích technik nutno zařadit i magnetickou rezonanci (MRI). Běžně se toto vyšetření při hyperparatyreóze neindikuje. Sensitivita MRI je podobná jako při MIBI vyšetření, specificita je nižší 20, obtížné je odlišení hyperfunkčních PT od lymfatických uzlin. 1 MRI se provádí s aplikací KL gadolinia, což ji limituje u pacientů s renálním postižením nebo s implantovaným pacemakerem. Roli při volbě MRI hraje i dostupnost a cena vyšetření, náročnější interpretace nálezů. V některých případech je indikována jako doplňující vyšetření při nejednoznačných hodnoceních pomocí předchozích technik. 1,8
Hybridní skenery
K přesnějšímu zobrazení PT přispěl rozvoj hybridních skenerů, které umožňují propojit funkční scintigrafickou detekci s anatomickým určením PT pomocí CT. Vyšetření 99mTc-MIBI/SPECT/CT využívá kombinaci metabolického a morfologického vyšetření a významně napomáhá k lokalizaci zvětšeného PT, a to zejména u ektopicky uložených PT na krku i v hrudníku. 39,40 SPECT/CT pomocí 99mTc-MIBI přispěla k rozvoji miniinvazivních operačních výkonů na základě zlepšení předoperační lokalizace patologického PT a snížila tak frekvenci bilaterální krční operace s revizí všech čtyř PT. 3,39,41
Další možností detekce PT je aplikace pozitronového radiofarmaka a využití pozitronové emisní tomografie (PET) v kombinaci s CT nebo MRI. 5 K těmto účelům se jeví jako vhodný 18F-FCH. 32 Jako fosfolipidový analog se integruje do nových membrán proliferujících buněk a jeho uptake roste zvýšenou regulací cholin kinázy. Tato zvýšená regulace fosfolipid-dependentní cholin kinázy se u hyperfunkčních PT vztahuje k sekreci PTH. 41 V posledních letech se začínají uplatňovat v detekci PT kromě 18F-FCH 5,32 i další radiofarmaka s použitím PET/CT, např. pomocí 11C-methioninu. 8,21,32 Zkušenosti s detekcí zvětšených PT pomocí tohoto radiofarmaka jsou velmi dobré, hlavním limitujícím faktorem jeho běžnějšího využití je krátký fyzikální poločas 11C – 20,3 min, tedy vyžadující přítomnost cyklotronu v místě vyšetřování. 5
V současnosti nachází své uplatnění v diagnostice zvětšených PT i MRI v probíhajících studiích v kombinaci s PET vyšetřením, ať u pomocí 18F-FCH nebo 11C-methioninu. 5
Terapie HPT
Chirurgická léčba
Chirurgická léčba je prioritní zejména u PHPT. Je prokázáno, že chirurgickou léčbou je možno dosáhnout trvalých léčebných výsledků, zejména úpravou hyperkalcémie. Následně dochází ke zvýšení kostní denzity a snižuje se tak riziko fraktur a rozvoj nefrolitiázy. 1,44 Celkově tedy zvyšuje kvalitu života. Podle uložení PT se odehrává strategie chirurgické léčby s různými modifikacemi postupů od bilaterální standardní operace až po miniinvazivní výkony. V současnosti jsou preferovány právě miniinvazivní chirurgické výkony paratyreoidektomie:
a) otevřená miniinvazivní paratyreoidektomie
b) videoasistovaná paratyreoidektomie
c) radiačně navigovaná paratyreoidektomie
Všechny tyto operační výkony jsou indikovány u diagnosticky jednoznačného jednostranného nálezu patologicky zvětšeného PT bez patologie na štítné žláze a jsou prováděny v celkové nebo lokální anestezii.
K operační terapii při SHPT se přistupuje při selhání konzervativní terapie 1,45, a to zejména:
a) při nálezech vysoké hyperkalcémie a hyperfosfatémie při vysoké hladině PTH
b) u těžkých forem osteitis fibrózy s nadprodukcí PTH
c) při metastatických kalcifikacích v měkkých tkáních a vysoké hladině PTH
d) při výrazně zvýšené hladině PTH a nálezu výrazně zvětšených PT.
Medikamentózni léčba
Konzervativní medikamentózní léčbě přísluší nezastupitelné místo u nemocných, u kterých je chirurgický postup kontraindikován. Používají se bifosfonáty, které snižují resorpci kosti a jsou indikovány zejména při osteoporóze. U nemocných s výraznou hyperkalcémií se podávají spíše kalcimimetika, která snižuji citlivost receptorů na Ca a vedou k poklesu sérové hladiny Ca a PTH. 19,46–48 Kalcimimetika (cinacalcet) jsou vhodná také pro přípravu nemocných před chirurgickou léčbou, zejména u nemocných s SHPT. 49 U těchto pacientů je ordinována dieta s omezením P, podávání vazačů P, korekce kalcémie a terapie vitamínem D. Při selhání ledvin nastupuje dialyzační terapie s úpravou fosfatémie a kalcémie. Dlouhotrvající hypokalcémie a hyperfosfatémie mohou vést ke vzniku autonomní sekrece PTH a hyperkalcémie, což je označováno za THPT. 3,50 U pacientů s touto diagnózou se mohou vyskytovat další kostní a kardiovaskulární komplikace. 51
Současný vyšetřovací postup vyšetření PT v ČR zahrnuje:
A) Kombinaci dvoufázového SPECT/CT pomocí 99mTc-MIBI a subtrakční SPECT metody s odečtem 99mTc-NaTcO4/SPECT obrazů štítné žlázy od časného 99mTc-MIBI/SPECT
Příprava pacienta
1. 2–3 měsíce před vyšetřením bez aplikace jódové KL při rtg vyšetření.
2. Vysazení substituční terapie hormony štítné žlázy obvykle po dobu 3 týdnů před provedením scintigrafie štítné žlázy.
3. U pacientů se SHPT se doporučuje vysadit aktivní vitamín D na minimálně 1 týden, při suplementaci nativním vitamínem D pak 4 týdny. Kalcimimetika by měla být přerušena nejméně 2 týdny před scintigrafickým zobrazením PT. 19
Provedení
Pacient je uložen na posuvné lůžko kamery s fixací hlavy s cílem zabránit jejímu nežádoucímu pohybu v průběhu akvizice. Fixace a dodržení shodné polohy hlavy a krku jsou zásadně důležité pro úspěšnou subtrakci. Následuje intravenózní aplikace 99mTc-MIBI s aktivitou podle hmotnosti pacienta (400–700 MBq 99mTc-MIBI). Za 5 minut po aplikaci radiofarmaka je spuštěna časná fáze SPECT/CT se širokým polem zobrazení. V zorném poli kamery musí být zachycena celá oblast krku a mediastina, obvykle nastavená od příušních žláz po bránici. (Obr. 4)
Akviziční parametry SPECT snímání: 120 projekcí po 3 stupních, čas na projekci 20 s, matice 128 x 128.
Parametry nízkodávkového CT: proud 2,5 mA, napětí 140 kV, tloušťka řezu 10 mm, řezy jsou rekonstruovány v matici 256 x 256, rychlost rotace rentgenky 2,5 rotace/min.
Za 2–2,5 hodiny po aplikaci radiofarmaka následuje pozdní SPECT nebo SPECT/CT se stejnými předvolenými parametry akvizice jako u časné fáze a při stejném nastavení pacienta. (Obr. 5)
Pro odečet 99mTc-NaTcO4/SPECT obrazů štítné žlázy od časného 99mTc-MIBI/SPECT je jiný den provedena scintigrafie štítné žlázy, opět s provedením SPECT. (Obr. 6) Pacientovi je intravenózně aplikováno 200 MBq 99mTc-NaTcO4 (s úpravou aktivity podle hmotnosti pacienta). Za 15 minut po aplikaci je provedeno snímání štítné žlázy.
Obr. 6 (nahoře) SPECT štítné žlázy pomocí 99mTc-NaTcO4.
99mTc-NaTc04 SPECT štítné žlázy pro odečet obrazů s chyběním aktivity těsně pod dolním pólem pravého laloku štítné žlázy.
Parametry SPECT snímání: 120 projekcí po 3 stupních, čas na projekci 20 s, matice 128 x 128.
Toto vyšetření se neprovádí u pacientů po tyreoidektomii, při zablokovaní štítné žlázy (Amiodaron, předchozí aplikace jodové KL), při atrofii žlázy z důvodů dlouhodobé substituce vysokými dávkami hormonů.
Vyhodnocení scintigrafických dat
Získaná data ze SPECT vyšetření PT (časná a pozdní fáze) a štítné žlázy jsou zrekonstruována a vyhodnocena.
Na časných obrazech je fyziologická distribuce 99mTc-MIBI ve štítné žláze, ve slinných žlázách, u mladých lidí v oblasti brzlíku, dále v srdci, v játrech, v kostní dřeni, někdy v hnědé tukové tkáni. 6 Obrazy z provedených vyšetření jsou hodnoceny vizuálně pomocí volume rendering metody s nálezem ložisek zvýšené akumulace MIBI odpovídající zvětšeným PT. (Obr. 4 a 5) Hyperplastická PT jsou velikostně menší než adenomy.
Subtrakce 99mTc-NaTcO4/SPECT obrazů štítné žlázy od časného 99mTc-MIBI/SPECT
Rutinně prováděná planární subtrakce trpí všemi známými nedostatky planárního zobrazení, proto je výhodné provádět subtrakci tomografickou (ze SPECT vyšetření) i za cenu vyšší technické náročnosti.
Subtrakci lze hodnotit subjektivně, tedy hledat vizuální rozdíly v oblastech typických pro lokalizaci PT. Tomografické snímky je vhodné identickým způsobem zrekonstruovat a ořezat tak, aby obsahovaly jen oblasti štítné žlázy a slinných žláz se získáním kvalitní prostorové registrace. (Obr. 7)
Obr. 7 (vpravo) Porovnání SPECT obrazů 99mTc-NaTcO4 a SPECT obrazů časného 99mTc-MIBI. Použit program Subractor (Ing. Jiří Trnka, Ph.D.)
Horní řada: obrazy časného 99mTc- -MIBI v transaxiálním, koronálním a sagitálním řezu.
Dolní řada: 99mTc-NaTcO4 obrazy štítné žlázy.
Subtrakce musí být především provedena lékařem vizuálně, což usnadňuje důsledná prostorová registrace obrazů. V porovnání obou vyšetření je patrné hyperakumulující ložisko v oblasti těsně pod dolním pólem pravého laloku štítné žlázy, svědčící pro adenom PT, který byl následně operačně a histologicky potvrzen.
Úskalí při scintigrafii pomocí 99mTc-MIBI, se kterými je nutno počítat:
1. Normální distribuce 99mTc-MIBI kromě PT je ve štítné žláze, slinných žlázách, částečně v kostní dřeni, svalech, v myokardu, dále i v jiných tumorózních procesech maligních i benigních, což při hodnocení distribuce MIBI ve sledované oblasti při malých velikostech PT může způsobit negativní nález.
2. Rychlejší vyplavení aktivity z PT vede k tomu, že na pozdním obraze již nejsou patrná.
3. Uzlová konfigurace štítné žlázy vede ke komplikacím při subtrakci s obrazy štítné žlázy.
4. Atypická uložení PT, k přesnějšímu popisu jejich lokalizace je lepší použít plnohodnotného CT s kontrastem.
5. Reoperace a následně změněný pooperační terén může komplikovat hodnocení.
B) Vyšetření PET/CT pomocí 18F-FCH
Hlavní indikace 18F-FCH je určena pro management pacientů s ca prostaty a diagnostiku hepatocelulárního karcinomu. Pozitivita 18F-FCH byla nalezena i u jiných nemaligních a zánětlivých lézí, např. i hyperplastických PT. V současné době je PET s 18F-FCH pro lokalizační diagnostiku HPT indikována a hrazena jako modalita druhé linie v případě nekonkluzivního nálezu USG a jedné další konvenční metody.
Příprava
Pacient je vyšetřován nalačno, vzhledem k CT vyšetření s aplikací jódové KL dodrží obvyklou přípravu.
Provedení
Obvyklá aktivita se pohybuje kolem 150 MBq. Doporučené akumulační časy jsou v literatuře relativně heterogenní. Shoda je vesměs na časném snímání cca 5–20 min po aplikaci RF. V případě nejasnosti nálezu je možné doplnit scan po 60 min. Vzhledem k malým rozměrům PT je vhodné nastavit pro akvizici delší časy na pozici postele, v závislosti na parametrech používané kamery. Rozsah akvizice by měl pokrýt krk od slinných žláz po bránici. CT lze s výhodou provést ve vícefázovém režimu (viz 4D-CT výše), kombinují se tak benefity morfologického i funkčního zobrazení, daní je zvýšení radiační zátěže.
Akviziční a rekonstrukční parametry PET: 70 cm transaxiální FOV, matice 256 x 256, rekonstrukce na pracovní stanci PET/CT (3 iterace, 32 subsetů, 6,0 mm filtr, s korekcí Time of Flight a Resolution Recovery). Akviziční a rekonstrukční parametry CT: helikální mód, napětí 120–140 kV, proud 30–250 mA, rychlost rotace 0,7 s, matice 512 x 512, rekonstrukce filtrovanou zpětnou projekcí.
Úskalí při vyšetření PET/CT pomocí 18F-FCH
FCH vykazuje pozitivní nález i u jiných (ne)maligních tumorů a zánětlivých lézí, rovněž se lze setkat s komplikacemi anomálního zobrazení štítné žlázy, event. intrakapsulárního uložení PT. Falešně pozitivní nálezy mohou být u pacientů užívajících lithium, s tumory štítné žlázy, s karcinomy PT, při výskytu zánětlivých či tumorózních lymfatických uzlin, u metastáz ve štítné žláze. Falešně negativní nálezy mohou být u ektopického PT, hyperplastických PT, celkově u PT menší velikosti a u multiglandulárního postižení. 5,53,54
PET/CT pomocí 18F-FCH má několik výhod
Patří k nim především detekce menších lézí již okolo 4–5 mm, což lze využít u pacientů s SHPT. Má lepší rozlišení po využití kontrastu zejména u pacientů s reoperací. Doba vyšetření je kratší a radiační zátěž je nižší než při scintigrafii s 99mTc-MIBI, jak je potvrzeno v literatuře. 5 Umožňuje více provádět miniinvazivní jednostranné výkony. 32,41 Senzitivita vyšetření pomocí FCH/PET/CT oproti protokolu MIBI/SPECT/CT v diagnostice zvětšených PT je vyšší o 10–15 %, specificita je srovnatelná a dosahuje 96 %. 32,43
Příklad využití PET/CT pomocí 18F-FCH v případě negativního nálezu scintigrafie pomocí 99mTc-MIBI.
Žena, r. 1947, s dg PHPT, laboratorními hodnotami: Ca 2,58, PTH 130 pg/ml.
Na sonografii byl obraz autoimunitní tyreopatie s pseudonodózní přestavbou bez jasného ložiska svědčícího pro PT.
Scintigrafie pomocí 99mTc-MIBI: provedené obrazy časné MIBI, pozdní MIBI a scintigrafie štítné žlázy pomocí 99mTc-NaTcO4 (Obr. 8), ani po odečtu obrazů štítné žlázy od časného MIBI, neprokázaly ložisko, které by svědčilo pro přítomnost zvětšeného PT.
Obr. 8 Obrazy SPECT pomocí 99mTc-MIBI a – časné MIBI; b – pozdní MIBI s vyplavením aktivity ze štítné žlázy a bez průkazného hyperakumulujícího ložiska, které by svědčilo pro zvětšené PT; c – scintigrafie štítné žlázy pomocí 99mTc-NaTcO4. 
Následně indikováno PET/CT pomocí 18F-FCH, která prokázala adenom pravého horního PT v úrovni horní části pravého laloku štítné žlázy, uloženého velmi blízko páteře. (Obr. 9)
Obr. 9 Vlevo PET snímek pomocí 18F-FCH a vpravo PET/CT snímky v sagitální a koronální rovině s drobným hyperakumulujícím ložiskem lokalizovaným v úrovni okraje horního pólu pravého laloku štítné žlázy dorzálně prevertebrálně. Histologicky potvrzen adenom pravého horního PT. 
Závěr
S rozvojem miniinvazivních chirurgických postupů stoupá počet pacientů indikovaných ke scintigrafii s cílem určení přesné identifikace a lokalizace patologických PT. Radionuklidové metody mohou tak významně přispívat ke kvalitní péči o pacienty v endokrinologické, osteologické a nefrologické praxi.
Daniela Chroustová, David Zogala
Ústav nukleární medicíny, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze, ČR
daniela.chroustova@vfn.cz
Zdroje
- Adámek S, Naňka 0 et al. Primární hyperparathyreóza. Diagnostika a terapie. Praha, Galén, 2006, 202 p
- Vaz A, Griffiths M. Parathyroid imaging and localization using SPECT/CT: Initial results. JNMT 2011;39 : 195-200
- Eslamy HK, Ziessman HA. Parathyroid scintigraphy in patients with primary hyperparathyroidism: 99mTc-sestamibi SPECT and SPECT/CT. Radio Graphics 2008;28 : 1461-1476
- Bandeira L, Bilezikian J. Primary hyperparathyroidism. F1000 Researsch 2016; (F1000Faculty Rev): 1(doi:10.12688/1000research.7039.1)
- Petranovič Ovčariček P, Giovanella L, Gasset I C et al. The EANM practice guidelines for parathyroid imaging. Eur J Nucl Med Mol Imaging [online]. 2021. [cit. 2021-04-10]. Dostupné na: https://tech.snmjournals.org/content/41/1/55.2
- Fraser WD. Hyperparathyroidism. Lancet 2009;374 : 145–158
- Broulík P, Adámek S, Tvrdoň J et al. Primární hyperparatyreóza. Postgraduální medicína 2007;7 : 711-716
- Khan AA, Hanley DA, Rizzoli R et al. Primary hyperparathyroidism: review and recommendations on evaluation, diagnosis, and management. A Canadian and international consensus. Osteoporos Int 2017;28 : 1-19
- Cusano NE, Silverberg SJ, Bilezikian JP. Normocalcemic primary hyperparathyroidism. J Clin Densitom 2013;16 : 33-39
- Bilezikian JP, Brandi ML, Eastell R et al. Guidelines for the management of asymptomatic primary hyperparathyroidism: Summary statement from the fourth international workshop. J Clin Endocrinol Metab 2014;99 : 3561-3569
- Eastell R, Brandi ML, Costa AG et al. Diagnosis of asymptomatic primary hyperparathyroidism: proceedings of the Fourth International Workshop. J Clin Endocrinol Metab 2014;99 : 3570-3579
- Nordenstrom E, Katzman P, Bergenfelz A. Biochemical diagnosis of primary hyperparathyroidism: Analysis of the sensitivity of total and ionized calcium in combination with PTH. Clin Biochem 2011;44 : 849-852
- Maruani G, Hertig A, Paillard M, et al. Normocalcemic primary hyperparathyroidism: Evidence for generalized target-tissue resistance to parathyroid hormone. J Clin Endocrinol Metab 2003;88 : 4641-4648
- Silverber SJ, Walker MD, Bilezikian JP. Asymptomatic primary hyperparathyroidism. J Clin Denzitom 2013;16 : 14-21
- Parfitt AM, Rao DS, Kleerekoper M. Asymptomatic primary hyperparathyroidism discovered by multichannel biochemical screening: clinical course and considerations bearing on the need for surgical intervention. J Bone Miner Res 1991;6 Suppl 2 : 97-101
- Lowe H, McMahon DJ, Rubin MR et al. Normocalcemic primary hyperparathyroidism: further characterization of a new clinical phenotype. J Clin Endocrinol Metab 2007;92 : 3001-3005
- Koumakis E, Souberbielle JC, Sarfati E et al. Bone mineral density evolution after successful parathyroidectomy in patients with normocalcemic primary hyperparathyroidism. J Clin Endocrinol Metab 2013;98 : 3213-3220
- Rubello D, Gross MD, Mariani G et al. Scintigraphic techniques in primary hyperpa-rathyroidism: from pre-operative localization to intra-operative imaging. Eur J Nucl Med Mol imaging 2007;34 : 926-933 http://dx.doi.org/10.1007/s00259-007-0388-3.
- Komata H, Fukagawa M. Regression of parathyroid hyperplasia by calcimimetics – fact or illusion? Nefrol Dial Transplant 2009; 24 : 707-709
- Taylor A, Schuster DM, Alazraki N. A clinician’s guide to nuclear medicine, Chapter 10, The Parathyroids, pp. 215-225, published by The Society of Nuclear Medicine, 2006.
- Hayakawa N, Nakamoto Y, Kurihara K et al. A comparison between 11C-methionine PET/CT and MIBI SPECT/CT for localization of parathyroid adenomas/hyperplasia. Nuclear Medicine Communications 2015;36 : 53–59
- Hindie E, Ugur O, Fuster D et al. 2009 EANM parathyroid guidelines. Eur J Nucl Med Mol Imaging 2009;36 : 1201-1216
- Greenspan BS, Dillehay G, Intenzo C et al. SNM Practice Guideline for Parathyroid Scintigraphy 4.0*. Journal of Nuclear Medicine Technology 2012;40 : 1-8
- Neumann DR, Obuchowski NA, Di Filippo FP. Preoperative 123I/99mTc-sestamibi subtraction SPECT and SPECT/CT in primary hyperparathyroidism. J Nucl Med 2008;49 : 2012-2017 http://dx.doi.org/10.2967/jnumed.108.054858.
- O’Doherty MJ, Kettle AG. Parathyroid imaging: preoperative localization. Nuc Med Commun 2003;24 : 125-131 http://dx.doi.org/10.1097/00006231-200302000-00004.
- Lorberboym M, Minski I, Macadziob S et al. Incremental diagnostic value of preoperative 99mTc-MIBI SPECT in patients with a parathyroid adenoma. J Nucl Med 2003;44 : 904–908
- Siegel A, Mancuso M, Seltzer M. The spectrum of positive scan patterns in parathyroid scintigraphy. Clin Nucl Med 2007;32 : 770-774
- Gonzalez VG, Orellana BP, Lopez MJ et al. Early parathyroid MIBI SPECT imaging in the diagnosis of persistent hyperparathyroidism. Clin Nucl Med 2008;33 : 475-478 http://dx.doi.org/10.1097/RLU.0b013e3181779310.
- Rubello D, Casara D, Pagetta C et al. Determinant role of Tc-99m MIBI SPECT in the localization of a retrotracheal parathyroid adenoma successfully treated by radioguided surgery. Clin Nucl Med 2002;27 : 711–715
- Slater A, Gleeson FV. Increased sensitivity and confidence of SPECT over planar imaging in dual-phase sestamibi for parathyroid adenoma detection. Clin Nucl Med 2005;30 : 1–3
- Wong KK, Fig LM, Gross MD et al. Parathyroid adenoma localization with 99mTc-Sestamibi SPECT/CT: a meta-analysis. Nucl Med Commun 2015;36 : 363–375
- Michaud L, Balogova S, Burgess A et al: A pilot comparis of 18F-fluorocholine PET/CT, ultrasonography and 123I/99mTc-sestaMIBI dual-phase dual-isotope scintigraphy in thepreoperative localization of hyperfunctioning parathyroid glands in primary or secondary hyperparathyroidism. Medicine 2015;94 : 1-15
- Zajíčková K, Zogala D, Kubinyi J. Parathyroid imaging by (18)F-fluorocholine PET/CT in patients with primary hyperparathyroidism and inconclusive conventional methods: clinico-pathological correlations. Physiol Res. 2018;67(Suppl 3):S551-S557 doi: 10.33549/physiolres.934029. PMID: 30484682
- Placzkowski K, Christian R, Chen H. Radiogiuded parathyroidectomy for recurrent parathyroid cancer. Clin Nucl Med 2007;32 : 358-360
- Garcia-Talavera P, Gonzalez C, Garcia-Talavera JR. Radioguided surgery of primary hyperparathyroidisms in a population with a high prevalence of thyroid pathology. Eur J Nucl Med Mol Imaging 2010;37 : 2060-2067 http://dx.doi.org/10.1007/s00259-010-1462-9
- Kelly HR, Hamberg LM, Hunter GJ. 4D-CT for preoperative localization of abnormal parathyroid glands in patients with hyperparathyroidism: Accuracy and ability to stratify patients by unilateral versus bilateral diseaase in surgary-naive and re-exploration patients. AJNR Am J Neuroradiol 2014;35 : 176-181
- Hoang JK, Sung W, Bahl M et al. How to perform parathyroid 4D CT: Tips and Traps for technique and interpretation. Radiology 2014;270 : 15-24
- Chazen JL, Gupta A, Dunning A et al. Diagnostic accuracy of 4D-CT for parathyroid adenomas and hyperplasia. AJNR Am J Neuroradiol 2012;33 : 429-433
- Krausz Y, Bettman L, Guralnik L: Technetium -99m-MIBI SPECT/CT in primary hyperparathyroidism. World J Surg 2006;30 : 76-83 http://dx.doi.org/10.1007/s00268-005-7849-2.
- Akram K, Parker JA, Donohoe K et al. Role of single photon emission computed tomography/computed tomography in localization of ectopic parathyroid adenoma: A pictorial case series and review of the current literature. Clin Nucl Med 2009;34 : 500-502 http://dx.doi.org/10.1097/RLU.0b013e3181abb619.
- Taubman ML, Goldfarb M, Lew JI. Role of SPECT and SPECT/CT in the surgical treatment of primary hyperparathyroidism. International Journal of Molecular Imaging,2011;ID141593, doi: 10.1155/2011141593.
- Kluijfhout WP, Vriens MR, Valk G et al. 18F-Fluorocholine PET-CT enables minimal invasive parathyroidectomy in patients with negative sestamibi SPECT-CT and ultrasound: A case report. Int JSurg Case Rep 2015; 13 : 73-75.
- Lezaic L, Rep S, Sever MS et al. 18-F-Fluorocholine PET/CT for localization of hyperfunctioning parathyroid tissue in primary hyperparathyroidism : a pilot study. Eur J Nucl Med Mol Imaging 2014;41 : 2083-2089
- Madkhali T, Alhefdhi A, Chen H et al. Primary hyperparathyroidism. Ulus Cerrahi Derg 2016;32 : 58-66 Doi. 10.5152/UCD.2015.3032.
- Sobotková D, Nedbálková H, Zharfbin A. Patogeneze, diagnóza a léčba sekundární hyperparatyreózy při chronické renální nedostatečnosti. ZDN LL 2000; 27
- Meola M, Petrucci I, Barsotti G. Long-term treatment with cinacalcet and conventional therapy reduces parathyroid hyperplasia in severe secondary hyperparathyroidism. Nephrol Dial Transplant 2009;1-8 doi:10.1093/ndt/gfn654.
- Linderberg JS. Calcimimetics: A new tool for management of hyperparathyroidism and renal osteodystrophy in patients with chronic kidney disease. Kidney International 2005;67 : 533-536
- Leere JS, Karmisholt J, Robaczyk M et al. Contemporary medical management of primary hyperparathyroidism: a systematic review. Frontiers in Endocrinilogy 2017;8 : 1-11 Doi:10.3389/fendo.2017.00079.
- Šiprová H, Souček M, Šipr K. Nové pohledy na primární hyperparatyreózu v Internistické praxi, Interni Med. 2016;18 : 134–136
- Thomas DL, Bartel T, Menda Y et al. Single photon emission computed tomography (SPECT) should be routinely performed for the detection of parathyroid abnormalities utilizing technetium-99m sestamibi parathyroid scintigraphy. Clin Nucl Med 2009;34 : 651-655 http://dx.doi.org/10.1097/RLU.0b013e3181b591c9.
- Joy MS, Karagiannis PC, Peyerl FW. Outcomes of secondary hyperparathyroidism in chronic kidney disease and the direct costs of treatment. JMCP 2007;13 : 397-411
- Mapelli P, Busnardo E, Magnani P et al. Incidental finding of parathyroid adenoma with 11C-choline PET/CT. Clin Nucl Med 2012;37 : 593–595
- Grimaldi S, Young J, Kamernicky P et al. Chalenging pre-surgical localization of hyperfunctioning parathyroid glands in primary hyperparathyroidism: the added value 18F-Fluoricholine PET/CT. Eur J Nucl Med Mol Imaging 2018;45 : 1772-1780
- Imperiale A, Taieb D, Hindie E. 18F-Fluoricholine PET/CT as a second line Nuclear imaging technique before surgery for primary hyperparathyroidism. Eur J Nucl Med Mol Imaging 2018;45 : 654-657
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek Sonda do historieČlánek Co je na obrázku?Článek MUDr. Jaroslav BúřilČlánek Historický kvíz
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2021 Číslo 3- Časná regrese nádoru jako marker celkového přežití v 1. linii léčby mCRC
- Intersticiální plicní procesy a jejich fibrotická progrese
- Komorbidity u idiopatické plicní fibrózy – dlouho přehlížený problém
- Idiopatická plicní fibróza z pohledu ambulantního pneumologa
- Domácí léčba imunoglobuliny pro vrozený protilátkový imunodeficit
Nejčtenější v tomto čísle- Hyperparatyreóza
- Pracoviště nukleární medicíny Institut klinické a experimentální medicíny Praha 4
- Významné životní jubileum slaví
- Co je na obrázku?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





