-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mechanobiologie kancerogeneze
Mechanobiology of cancerogenesis
Background: Within the tumour microenvironment, tumour cells are exposed to different mechanical stimuli such as compression stress, cell-cell and cell-extracellular matrix traction forces, interstitial fluid pressure, and shear stress. Cells actively sense and process this information by the mechanism of mechanotransduction to make decisions about their growth, motility, and differentiation. Indeed, the mechanical properties of the tumour microenvironment can deeply influence the behaviour of cancer cells and promote cancerogenesis. During tumour progression, desmoplasia arises and a positive feedback loop between the stiffening extracellular matrix and the properties enabling tumour expansion is established. Tumour cells can use mechanic stimuli to promote proliferation, increase their migratory and invasive potential, and induce therapeutic resistance. Mechanobiology is a progressive multidisciplinary field which studies how mechanical forces influence the behaviour of cells or tissues and may provide some interesting targets for cancer therapy. Purpose: In this review, we discuss the mechanical properties of cancer cells and describe the tumour promoting effect of the transformed extracellular matrix. We propose that the differences in the mechanobiology of cells and extracellular matrix are significant enough to facilitate tumorigenesis and may provide interesting targets for cancer therapy.
Keywords:
mechanobiology – cancer – extracellular matrix – mechanotransduction – shear stress – therapy resistence
Autoři: Martina Raudenská 1; Jiří Navrátil 2; MUDr. Jaromír Gumulec 2; Michal Masařík 1-3
Působiště autorů: Fyziologický ústav, LF MU Brno 1; Ústav patologické fyziologie, LF MU Brno 2; BIOCEV – Biotechnologické a biomedicínské centrum AV ČR, PF UK a 1. LF UK, Vestec 3
Vyšlo v časopise: Klin Onkol 2021; 34(3): 202-210
Kategorie: Přehled
doi: https://doi.org/10.48095/ccko2021202Souhrn
Východiska: V mikroprostředí nádoru a v průběhu metastazování jsou nádorové buňky vystaveny různým mechanickým stimulům. Příkladem je tlakové napětí, tahové síly mezi buňkami či buňkou a extracelulární matrix, tlak intersticiální tekutiny a smykové napětí. Buňky aktivně snímají a zpracovávají tyto mechanické informace procesem mechanotransdukce a na základě těchto signálů rozhodují o svém růstu, pohyblivosti a diferenciaci. Mechanické vlastnosti nádorového mikroprostředí mohou tedy zásadně ovlivnit chování nádorových buněk a významně podpořit kancerogenezi. Během progrese nádoru se mění mechanické vlastnosti extracelulární matrix v důsledku desmoplastické reakce. Následně vzniká pozitivní zpětnovazebná smyčka mezi tuhou, desmoplastickou extracelulární matrix a vlastnostmi podporujícími expanzi nádoru, jelikož nádorové buňky mohou pomocí mechanických stimulů zvýšit svoji proliferaci, migrační a invazivní potenciál i terapeutickou rezistenci. Mechanobiologie je progresivní multidisciplinární obor, který studuje, jak mechanické síly ovlivňují chování buněk či tkání, a může poskytnout nové atraktivní cíle pro léčbu nádorového onemocnění. Cíl: V tomto přehledovém článku pojednáváme o mechanických vlastnostech nádorových buněk a popisujeme účinek transformované extracelulární matrix na progresi nádoru. Domníváme se, že rozdíly v mechanobiologii buněk a extracelulární matrix jsou zásadní pro rozvoj nádorů a mohly by poskytnout zajímavé cíle pro léčbu.
Klíčová slova:
mechanobiologie – nádorová onemocnění – extracelulární matrix – mechanotransdukce – smykové napětí – rezistence vůči léčbě
Úvod
Buňky aktivně snímají a zpracovávají mechanické signály poskytované extracelulárním prostředím a na jejich základě pak rozhodují o svém růstu, pohyblivosti a diferenciaci. Buňky také samy o sobě vyvíjejí mechanické síly na okolní prostředí. Mezi základní mechanické síly patří tahová síla, tlaková síla a smykové napětí. V lidském těle se vyskytují buňky, které jsou na specifický mechanický stres adaptovány (krevní elementy jsou adaptovány na smykové napětí či tlakovou sílu, svalové buňky jsou adaptovány na tahovou či tlakovou sílu). Podobné mechanizmy adaptace mohou být zneužívány nádorovými buňkami. Podoblast biofyziky, která se zaměřuje na výzkum mechanických vlastností živých systémů a jejich vliv na chování a morfogenezi buněk či tkání, se nazývá biomechanika [1]. Pochopit základní mechanizmy dané deregulací mechanických vlastností buněk a extracelulární matrix (ECM) je velmi důležité, neboť se významně podílejí na patogenezi onemocnění, jako je rakovina či fibróza. Během všech stadií kancerogeneze, od ztráty kontroly buněčné proliferace po rozvoj nádoru, invazi a metastázy, dochází ke změnám v buněčné i extracelulární mechanice, které významně zasahují do maligní transformace. Mechanické vlastnosti transformující se tkáně jsou významně ovlivněny desmoplastickou reakcí, tlakovými silami způsobenými expanzí nádoru a tahovými silami rigidní ECM. V reakci na vysokou tahovou sílu (důsledek zvýšené tuhosti ECM v nádorovém mikroprostředí) se u nádorových buněk aktivují mechanosenzitivní signální dráhy. Mezi ně patří např. signalizace YAP/ TAZ, která se podílí na proliferaci, dediferenciaci, invazi a rezistenci nádorových buněk, a signalizace fokální adhezívní kinázy (FAK). Aktivace FAK vede ke zrání fokálních adhezí a zvýšené kontraktilitě aktomyozinu prostřednictvím aktinových stresových vláken (obr. 1) [2,3].
Na rozdíl od vysoké mechanické variability tkání, v nichž vzniká primární nádor, téměř všechny metastatické buňky absolvují stejnou fyzikální selekci, protože opouštějí primární nádor, migrují skrze okolní tkáně, procházejí oběhovým systémem a nakonec infiltrují nové cílové tkáně. Všechny tyto mechanické stresy mohou ovlivnit přežití buněk a schopnost vytvářet metastatická ložiska. Výsledný efekt mechanického stresu na progresi nádoru je dán velikostí stresu, dobou jeho trvání, směrovostí mechanické síly, stejně jako viskoelasticitou a tuhostí nádorových buněk a ECM [2].
Tkáně a buňky intenzivně reagují na mechanické podněty a je stále zřejmější, že invaze nádorových buněk je do určité míry zprostředkována právě biomechanickými faktory. V některých případech se ukázalo, že vliv mechanické signalizace dokonce převládá nad genomovými defekty. Je známo, že buňky nacházející se v netransformovaném mikroprostředí mohou mít pozoruhodný stupeň genetického poškození, ale zůstávají fenotypově benigní [4–6]. To je přičítáno signalizačním a mechanickým vlivům okolí [7].
Extracelulární matrix a biomechanická regulace buněčné migrace
Tkáně jsou složeny z buněčné a mezibuněčné hmoty, která tvoří organizovanou síť ECM. ECM poskytuje buňkám nejen fyzickou oporu, ale slouží také jako ligand pro buněčné integriny, jež přenáší signály regulující mnoho buněčných procesů vč. růstu, migrace, diferenciace, přežití, homeostázy a morfogeneze [8]. ECM se skládá z velké řady makromolekul, jejichž přesné složení a specifické struktury se liší od tkáně k tkáni. Hlavní složkou ECM jsou vláknité proteiny, jako jsou kolageny, elastiny, fibronektiny, lamininy, glykoproteiny, proteoglykany a glykosaminoglykany [9]. Během tumorigeneze dochází k výrazným změnám ve složení a struktuře ECM, které vedou k nadměrné fibrotizaci nádorového stromatu. Fibrotizace je dynamický proces vyznačující se nadměrným ukládáním složek ECM a uvolňováním proteolytických enzymů, které ECM remodelují. Zatímco v nemaligní tkáni můžeme nalézt svinutá a krátká vlákna kolagenu, v primárním nádoru jsou vlákna kolagenu vysoce propojená a organizovaná [10]. Reorganizace a zvýšené hladiny kolagenu-I spojené se zvýšenou tuhostí ECM byly nalezeny ve stromatu téměř všech solidních nádorů, vč. nádorů prsu [11], slinivky břišní [12] a prostaty [13]. Ke zvýšené tuhosti ECM v nádorovém mikroprostředí vede např. nadměrná aktivita lysyloxidázy (LOX) [3,8]. LOX katalyzuje přeměnu molekul lysinu na vysoce reaktivní aldehydy, jež vytvářejí příčné vazby v proteinech ECM. U transgenních myší geneticky predisponovaných k tvorbě nádorů prsu nebo pankreatu, které byly léčeny inhibitory zaměřenými na LOX, bylo zabráněno ztuhnutí ECM a nádory se vyvinuly o poznání později. Navíc byly tyto nádory lépe přístupné terapii a celkový výskyt metastáz byl snížen, což pravděpodobně odráží méně invazivní povahu nádorových buněk ve tkáni ošetřené LOX inhibitory [10,14,15]. Tato zjištění naznačují, že tuhá, fibrotická ECM podporuje progresi nádorového onemocnění.
Obr. 1. Mechanické podněty působící na nádorové buňky. 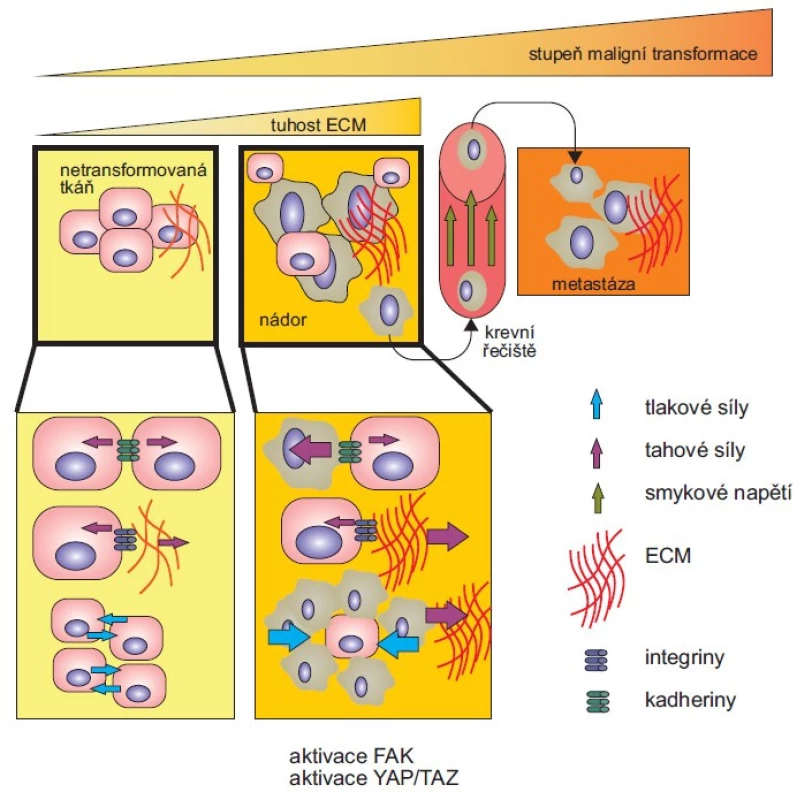
Během progrese onemocnění působí na nádorové buňky různorodé mechanické podněty. V netransformované tkáni jsou síly mezi buňkami a extracelulární matrix (ECM) vyvážené. V reakci na vysokou tahovou sílu (důsledek zvýšené tuhosti ECM v nádorovém mikroprostředí) se u nádorových buněk aktivují mechanosenzitivní signální dráhy. Mezi ně patří např. signalizace YAP/TAZ, která se podílí na proliferaci, dediferenciaci, invazi a rezistenci nádorových buněk a signalizace fokální adhezivní kinázy (FAK). Aktivace FAK vede ke zvýšené migraci buněk prostřednictvím zrání fokálních adhezí a zvýšené kontraktility aktomyozinu prostřednictvím aktinových stresových vláken. Expanze nádorových buněk omezená okolním stromatem stlačuje jak nádor, tak sousední stromální tkáň, což způsobuje zvýšení intersticiálního tlaku. Zvýšená tuhost ECM posiluje její odolnost proti kompresi a zhoršuje mechanický stres. Vysoký intersticiální tlak uvnitř nádoru vytváří gradient, který vyvolává tok tekutiny z jádra nádoru na periferii, což podporuje metastatické šíření nádorových buněk. Po úniku z primárního nádoru migrují nádorové buňky podél kolagenových vláken směrem k vaskulatuře. Cirkulující nádorové buňky jsou v cévách vystaveny smykovému napětí, kterému se musí přizpůsobit. Upraveno dle [2]. Nádorové buňky migrují do intersticiální tkáně pomocí migračních struktur, jako jsou invadopodia, lamelipodia a filopodia. Filopodia a lamelipodia jsou dynamické membránové struktury vytvářené na vedoucím okraji (leading edge) migrující buňky. Síla pohánějící jejich růst je generována koordinovanou polymerací aktinových vláken, které jsou organizovány do rozvětvených sítí v lamelipodiích, a paralelních svazků ve filopodiích [16]. Invadopodia jsou speciální struktury bohaté na F-aktin, vznikají na ventrální straně buněčné membrány a degradují ECM pomocí matrixových metaloproteináz uvolňovaných na jejich konci. Průnikem invadopodií dochází k narušení ECM a vytvoření otvorů, kterými buňky následně mohou migrovat [17].
Mechanické vlastnosti ECM mohou mít zásadní dopad na tvorbu a aktivitu invadopodií, filopodií i lamelipodií, čímž ovlivňují buněčnou invazi a migraci [18–20]. Tvorba filopodií předchází vzniku lamelipodií. Filopodia mohou fungovat jako „mechanické antény“ sloužící k hodnocení tuhosti ECM, jelikož vykazují silnou preferenci pro tužší oblasti substrátu, zatímco z oblastí měkkých jsou častěji stahována zpět k buňce [19]. Tato data naznačují, že tuhost substrátu podporuje migrační fenotyp buněk a navádí pohyb buňky směrem k tužšímu prostředí (durotaxe). Durotaxe může mimo jiné vysvětlovat cílenou migraci nádorových buněk ven z primárního nádoru a jejich následnou intravazaci do vaskulatury [21]. Nejvyšší hustota fibrilárních kolagenů je totiž často ve stromální tkáni sousedící s invadujícím epitelem [10] a cévy propojené s nádorem bývají významně tužší než cévy nalezené v normální tkáni [22]. Vznik oblasti nádorového mikroprostředí s odlišnou tuhostí ECM vede k vytvoření gradientu endogenní tuhosti, jenž může podporovat migraci nádorových buněk [11,23]. V tomto kontextu je zajímavé, že dvěma orgány nejčastěji postiženými tvorbou metastáz jsou játra a plíce, které často trpí chronickou fibrózou a ztrátou elasticity v důsledku stárnutí a obezity [24–26].
Proces, který umožňuje zvýšení migrace v důsledku vyšší tuhosti ECM, se nazývá mechanotransdukce (obr. 2).
Obr. 2. Mechanotransdukce a její vliv na vlastnosti nádorových buněk. 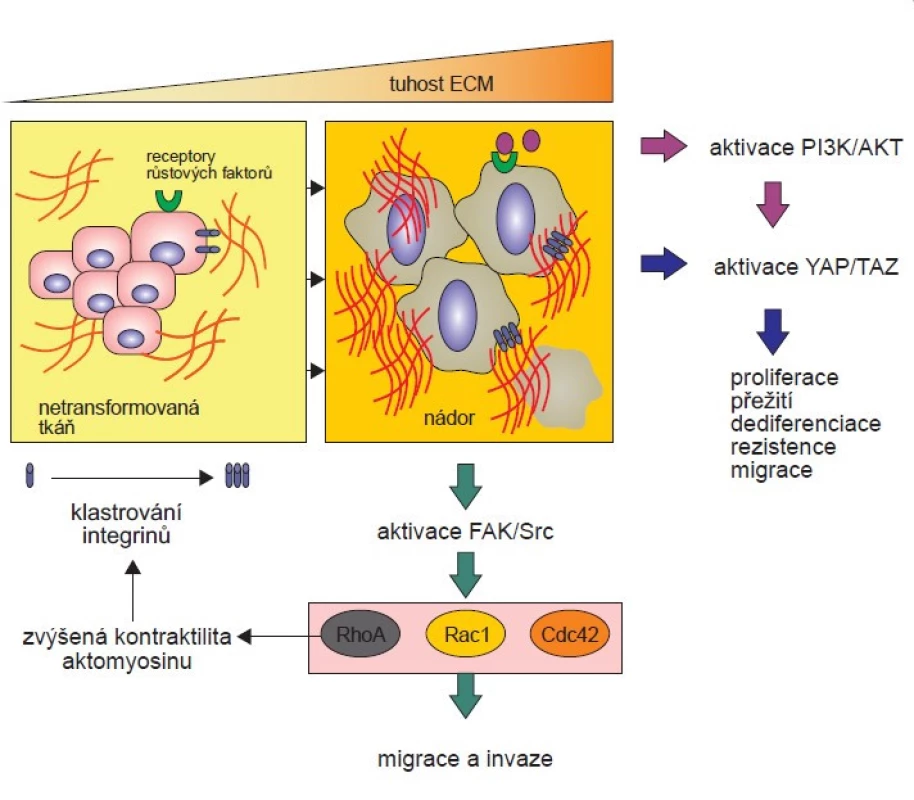
Tuhá extracelulární matrix (ECM) aktivuje mechanotransdukční signální dráhy, které řídí buněčnou proliferaci, invazi a migraci. Zvýšená depozice a těsné provázání kolagenu vyztužuje ECM a spouští klastrování integrinů, což následně vede k aktivaci fokální adhezívní kinázy (FAK) a tvorbě komplexu FAK-Src. Tuhá ECM může také podporovat signalizaci fosfatidylinositol-3-kinázy (PI3K) potencováním signálů přenášených z buněčných povrchových receptorů, jako jsou receptory růstových faktorů, a aktivovat signální dráhu YAP/TAZ, která se podílí na proliferaci, dediferenciaci, invazi a rezistenci nádorových buněk. Komplex FAK-Src a PI3K mohou aktivovat GTPázy Rac1 a Cdc42, které řídí vznik migračních membránových struktur. V pozdějších fázích buněčné adheze aktivita Rac1 a Cdc42 klesá, zatímco aktivita RhoA se postupně zvyšuje, což vede k tvorbě stresových vláken, zvyšuje se kontraktilita aktomyozinu a dochází k zrání fokálních adhezí. Při mechanotransdukci buňky převádějí extracelulární mechanické signály na intracelulární biochemickou aktivitu. Zásadní roli v mechanotransdukci hrají zřejmě integriny. Integriny jsou transmembránové proteiny, jejichž aktivace spojuje ECM s cytoskeletem buňky, což umožňuje šíření mechanických signálů zvenčí do buňky. Komplex ECM-integrin-cytoskelet tu působí jako molekulární spojka reagující na vnější mechanické síly [10,27]. Tuhá ECM způsobuje klastrování integrinů, zvyšuje nábor talinu a vinkulinu a podporuje autofosforylaci FAK na tyrozinu 397, což následně podporuje sestavení komplexu FAK-Src. Aktivované funkce FAK-Src podporují buněčnou motilitu, progresi buněčného cyklu a přežití buněk. Komplex FAK-Src je aktivován u mnoha typů nádorových buněk a generuje signály vedoucí k růstu nádoru a metastázování [28]. Jedním z takových signálů je aktivace GTPáz Rac a Cdc42, které řídí vznik migračních struktur skrze růst a kontrakci F-aktinových vláken a prostřednictvím proteinů, jako je Arp2/ 3 či myozin [29]. Rac řídí spíše tvorbu lamelipodií a Cdc42 vznik filopodií [30, 31]. Na vzniku filopodií se podílí např. myozin X (Myo10) interagující s integrinem-b a proteinem Arp2/ 3 [32]. Nadměrná exprese Myo10 podporuje tvorbu filopodií a migraci nádorových buněk [33,34]. Buňky, které nejsou schopny tvořit komplex Arp2/ 3-vinkulin, vykazují sníženou tvorbu lamelipodií. Tvorba komplexu Arp2/ 3-vinkulin vyžaduje aktivaci kinázy PI3K a GTPázy Rac1 [35], jež jsou samy o sobě také významně ovlivňovány mechanickými signály [29,36–38]. Během raných stadií aktivace integrinů zabezpečuje signalizace komplexu FAK-Src vysunutí migračních struktur v místech ligace integrinu, a to prostřednictvím Rac a Cdc42. Současně je potlačována kontraktilita aktomyozinu udržováním aktivity RhoA na nízké úrovni [39]. Naopak v pozdějších fázích signalizace integrinů aktivity Rac1 a Cdc42 klesají, zatímco aktivita RhoA se postupně zvyšuje, což vede k tvorbě stresových vláken, zvyšuje se kontraktilita aktomyozinu a zrání fokálních adhezí [40]. Tento proces umožňuje synchronizaci vysouvání migračních struktur a přitáhnutí buněk do jimi vytyčeného směru. Důležité také je, že integriny mohou synergizovat s receptory růstových faktorů, a zvýšit tak buněčnou invazi a migraci, a to prostřednictvím aktivity kináz Src a PI3K [41,42].
Fyzikální vlastnosti ECM účinně regulují rovněž autofagii, což je degradativní proces hojně využívaný nádorovými buňkami v případě, že jsou vystaveny nepříznivým podmínkám [43,44]. V prostředí s vysokou tuhostí ECM dochází ke zvýšení autofagie v důsledku mechanotransdukční signalizace YAP/ TAZ. YAP a TAZ proteiny jsou transkripční koaktivátory kódované paralogními geny, které se pohybují mezi cytoplazmou a jádrem. V jádře se párují s transkripčními faktory rodiny TEAD vázajícími DNA a regulují genovou expresi. Autofagie aktivovaná pomocí YAP/ TAZ je nezbytná pro dediferenciaci a získání kmenových vlastností. Naopak nízká tuhost ECM vede k utlumení mechanické signalizace, zpomaluje degradaci autofagozomů a rekapituluje účinky inhibice YAP/ TAZ [45].
Tuhost ECM a rezistence vůči léčbě
Aktivace signálních drah Src a PI3K zprostředkovaná integriny, která primárně souvisí s tuhostí ECM a byla zmiňována v předchozí kapitole, může rovněž významně ovlivňovat rezistenci nádorových buněk vůči léčbě [35,42]. Abnormality signálních drah zahrnujících PI3K/ AKT a Src byly nalezeny u mnoha typů nádorů a úzce souvisejí s růstem, apoptózou, invazí, metastázami, epitelovo-mezenchymovou tranzicí, kmenovostí buněk a rezistencí vůči léčbě [46,47]. Jedním z mnoha příkladů může být rezistence vůči inhibitorům anaplastické lymfomové kinázy (ALK) zprostředkovaná aktivací Src [48]. Inhibitory ALK (krizotinib, alektinib, lorlatinib) jsou využívány při léčbě nádorů plic. Terapeutická odpověď závisející na hustotě ECM byla pozorována také u sorafenibu, což je multikinázový inhibitor indikovaný k léčbě pokročilého karcinomu ledvin, hepatocelulárních karcinomů a nádorů štítné žlázy. Účinnost sorafenibu byla výrazně snížena u nádorů charakteristických tuhou ECM bohatou na kolagen [49]. Dalším příkladem nádorů, jejichž rezistence je závislá na tuhosti ECM, jsou nádory pankreatu, které patří k vůbec nejtužším karcinomům. Tuhost nádorového mikroprostředí následně indukuje rezistenci na paklitaxel. Naopak efektivita gemcitanibu tuhostí prostředí zřejmě ovlivněna není [50]. Závislost efektivity léčiva na tuhosti ECM byla pozorována také u cisplatiny, oxaliplatiny, 5-fluorouracilu, doxorubicinu a paklitaxelu [51–54].
Mechanotransdukce jako terapeutický cíl
Vzhledem k vazbám mezi fibrózou tkáně, tuhou ECM a rezistencí nádorů vůči léčbě by se zdálo být lákavou strategií potlačení aktivity enzymů zapojených do síťování strukturních fibrilárních kolagenů, např. LOX. Inhibitory LOX vyvolaly obrovskou naději, zejména proto, že v posledním desetiletí bylo vydáno několik přesvědčivých prací, které potvrzují schopnost těchto inhibitorů snížit fibrózu tkáně, a potlačit tak progresi nádorového onemocnění [55–57]. Navzdory slibným výsledkům LOX inhibitorů je jistá opatrnost na místě, jelikož bylo zjištěno, že exprese genu pro lysyloxidázu inhibuje transformační aktivitu onkogenu Ras [58].
Dalším atraktivním terapeutickým přístupem je ovlivnění mechanotransdukce a modulace buněčné odpovědi na tuhost ECM. Kináza FAK je centrální signální molekula pro signály zprostředkované b1-integrinem a hraje zásadní roli pro přežití buněk po ozáření [59]. Terapeutické cílení na kinázu FAK pomocí inhibitorů na bázi malých molekul bylo testováno v preklinických a klinických studiích, které prokázaly jistou účinnost u různých typů nádorů [60]. Inhibice FAK autofosforylace pomocí inhibitoru Y15 např. snížila proliferaci nádorových buněk tlustého střeva a zvýšila účinnost chemoterapie [61]. Inhibitor Y15 způsoboval regresi lidských nádorů pankreatu transplantovaných do myší a jeho účinky byly synergické s chemoterapií gemcitabinem [62]. Klinická studie (fáze II) inhibitoru FAK defactinibu (VS-6063) u dříve léčeného pokročilého nemalobuněčného karcinomu plic s mutací KRAS prokázala mírné prodloužení doby bez progrese onemocnění [63]. Lze předpokládat, že účinky FAK inhibitorů budou výraznější při synergickém působení s dalšími terapeutiky. V současné době probíhají pokusy o posílení účinnosti léčby kombinací inhibitorů FAK s cytotoxickou chemoterapií, cílenou terapií nebo imunoterapií [64]. Např. inhibitor FAK – C4 – byl vysoce účinný v kombinaci s doxorubicinem při inhibici růstu xenoimplantátů nádoru prsu u myší [65].
Jelikož je kináza FAK aktivována integriny, je logické, že proběhla řada pokusů o inhibici jejich signalizace. Více než 30 let experimentálního výzkumu poskytlo přesvědčivé důkazy o tom, že integriny jsou důležitými mediátory progrese nádorů, a preklinické výsledky naznačují, že jsou také potenciálně hodnotnými terapeutickými cíli. Přesto žádná klinická studie dosud nedokázala uspokojivě potvrdit terapeutický přínos inhibice integrinů u onkologických pacientů [66]. V budoucnu je třeba identifikovat prognostické markery pro výběr pacientů, kteří by mohli mít výraznější prospěch z inhibice integrinů v kombinačních strategiích. Např. farmakologická inhibice KEAP1 nebo mTOR společně s inhibicí b1-integrinu a receptoru epidermálního růstového faktoru zvýšila účinnost radioterapie u karcinomů v oblasti hlavy a krku [67].
Dalším přístupem k obnovení senzitivity nádorových buněk vůči léčbě je alternativní využití snadno dostupných a ověřených léčiv. Lipofilní statiny, které jsou široce využívány k léčbě kardiovaskulárních onemocnění a vysokého cholesterolu, se ukázaly být nadějné při léčbě pacientů s onemocněními spojenými s fibrózou. Statiny jsou schopny ovlivňovat proliferaci, migraci a přežití nádorových buněk regulací klíčových signálních proteinů, jako jsou např. YAP a TAZ [68–71]. Aktivita signálů YAP/ TAZ je řízena signální drahou SREBP/ mevalonát. Inhibice enzymu určujícího rychlost této dráhy (3-hydroxy-3-methylglutaryl-koenzym A reduktáza) statiny je v rozporu s nukleární lokalizací YAP/ TAZ a jejich vlivem na transkripci [71].
Smykové napětí (shear stress)
Pokud nádorová buňka úspěšně unikne za hranice své primární tkáně a dorazí do vaskulatury nebo lymfatického systému, musí se vypořádat se zcela novou sadou mechanických sil, zejména s těmi, které souvisejí s tokem tekutiny a srážkami s jinými buňkami a strukturami. Kromě anoikis a zabíjení cirkulujících nádorových buněk (circulating tumour cells – CTC) přirozenými zabíječi (NK-buňky) je hlavní příčinou smrti CTC právě mechanické poškození plynoucí ze smykového napětí [72]. Zatímco v intersticiální tekutině jsou nádorové buňky vystaveny smykovému napětí okolo 0,01 Pa (tj. 0,1 dyn/ cm2), v cirkulaci se toto napětí zvyšuje na 0,5–30 dyn/ cm2. Smykové napětí je významně vyšší v těsné blízkosti velkých cév, srdečních turbulencí a bifurkací krevních cév [73]. Pouze CTC, které překonají, nebo dokonce využívají účinků smykového napětí, mohou založit metastázu, u ostatních dochází k zástavě buněčného cyklu či buněčné smrti, jež je tím pravděpodobnější, čím déle se CTC nacházejí v cirkulaci [74,75]. Mechanický stres vytvářený intersticiálními a krevními toky by mohl u „mechanicky rezistentních“ CTC dokonce přispět k metastatickému procesu posílením buněčné invaze a adheze na krevní cévy [76]. Smykové napětí může např. v nádorových buňkách zvýšit aktivaci FAK, a tím posílit adhezi ke kolagenu. V souladu s tímto poznatkem je fakt, že inhibice FAK významně snížila schopnost metastatických buněk adherovat v jaterních sinusoidech [77]. Zdá se také, že fyziologické klidové hladiny smykového napětí v cévách (5–30 dyn/ cm2) sice inhibují proliferaci „mechanicky rezistentních“ CTC, ale stimulují jejich migraci a adhezi, zatímco úrovně smykového napětí dosažené při intenzivním tělesném cvičení (60 dyn/ cm2) způsobují smrt těchto CTC [2,78].
Míra smykového napětí se rovněž podílí na regulaci signalizace transkripčního koaktivátoru YAP1, který je aktivován během růstu a progrese mnoha solidních nádorů, vč. melanomu, gliomu, karcinomu plic, jater či prsu, kolorektálního karcinomu a karcinomu pankreatu. Aktivace YAP podporuje přežití, proliferaci, migraci a metastázování nádorových buněk. Může také zprostředkovávat rezistenci k chemoterapii, radioterapii nebo imunoterapii [79]. Lee et al ukázali, že YAP1 a jeho cílové geny byly aktivovány při smykovém napětí 0,05 dyn/ cm2. Tato aktivace podpořila schopnost prostatických nádorových buněk migrovat, zatímco vyšší intenzita smykového napětí (5 dyn/ cm2), typická pro venózní nebo arteriální tok, tuto migraci inhibovala [80].
Mechanické vlastnosti nádorových buněk
Základní mechanická vlastnost zásadní pro migraci nádorové buňky je její tuhost (tj. schopnost odolávat elastickým deformacím). Během progrese buňky z plně diferencovaného, postmitotického stavu do replikující se pohyblivé a nesmrtelné nádorové buňky se zásadně remodeluje její cytoskelet. Z uspořádané a poměrně rigidní struktury se architektura cytoskeletu u nádorové buňky mění do dynamičtějšího, nepravidelnějšího a poddajnějšího stavu. Změny zahrnují snížení množství základních polymerů a doplňkových proteinů a restrukturalizaci dostupné cytoskeletální sítě [81,82]. Jelikož cytoskelet významně ovlivňuje mechanické vlastnosti buněk, je tato restrukturalizace cytoskeletu reflektována ve výsledné tuhosti buňky. V mnoha studiích bylo pozorováno, že nádorové buňky jsou obvykle charakteristické vyšší elastickou deformabilitou než jejich nemaligní protějšky [83], což by se mohlo zdát nelogické, jelikož jsou tyto buňky schopny mnohem lépe migrovat a v přítomnosti integrinů vyvíjí větší kontraktilní sílu. Je to dáno mimo jiné tím, že ne všechny typy buněčné migrace využívané nádorovými buňkami vyžadují vysokou míru kontraktility aktomyozinu, která je spojena s vyšší buněčnou tuhostí (např. pohyb pomocí pseudopodií, améboidní pohyb pomocí buněčných výčnělků či migrace pomocí osmotického motoru vysokou míru kontraktility nevyžadují) [84,85]. V nepřítomnosti tuhé ECM (což je případ mnoha mechanobiologických experimentů) nehrají integriny v migraci zásadní roli a nádorové buňky volí jiný typ pohybu, a to pohyb nezávislý na kontrakcích aktomyozinu [84]. Vysoká míra kontraktility může také nádorovým buňkám v určitém kontextu udělovat evoluční nevýhodu, jelikož se mohou stát snadněji potravou měkčích kanibalských nádorových buněk [85]. Nižší buněčná tuhost nádorových buněk může být dána rovněž aktivací autofagie a rozkladem buněčných proteinů pomocí autofagických procesů, které pomáhají nádorovým buňkám dediferencovat, což následně může zvýšit jejich rezistenci vůči léčbě [44,45]. Souvislost mezi nízkou buněčnou tuhostí a rezistencí vůči léčbě byla potvrzena např. u leukemických buněk po působení daunorubicinu. Měkčí buňky vykazovaly rezistenci k daunorubicinu a změnu v mnoha mechanizmech souvisejících s rezistencí vůči léčivům, vč. snížené citlivosti na indukci apoptózy, zvýšené metabolické aktivity a regulace klíčových genů zapojených do exportu léčiv ven z buňky [86].
V kontextu celé buňky se na deformabilitě buněk nejvíce podílí jádro, a právě jádro je limitujícím faktorem při migraci skrze tuhou ECM za nepřítomnosti proteolytických enzymů, které by vytvořily dostatečně velké póry [83,84,87]. Zatímco tvar cytoskeletu bývá vysoce adaptivní díky rychlé remodelaci cytoskeletálních struktur, schopnost jádra procházet úzkými prostory je omezenější. Invadopodia jsou schopna vtěsnat se do pórů o velikosti cca 1 µm2 [88], nicméně pokud je pór v ECM < 7 µm2, jádro nádorové buňky se neprotáhne bez pomoci proteolytické degradace ECM [84,89]. Vyšší deformabilita jádra by umožnila nádorové buňce migrovat skrze těsné prostory s menším rizikem nevratného poškození jaderné membrány. V souladu s tím byla u nádorových buněk nalezena modifikovaná struktura jádra a odlišné složení jaderné membrány [90]. Až na několik výjimek mají jádra normálních buněk elipsoidní tvar s hladkými obrysy. Naopak nádorové buňky jsou identifikovatelné podle zvýšené velikosti jader, nepravidelných kontur jaderné membrány a narušené distribuce chromatinu [91].
Na mechanické vlastnosti jaderné membrány má zásadní roli exprese laminu A [92]. Nižší úrovně exprese laminů typu A byly spojeny se zvýšenou invazivitou buněk, ale rovněž s větší náchylností k prasknutí jaderného obalu a s tím spojené zvýšené míře genetické nestability [93]. Snižování jaderné tuhosti prostřednictvím snížení exprese laminu A rovněž zhoršuje přežití nádorových buněk vystavených smykovému napětí a snižuje signalizaci pomocí dráhy PI3K/ AKT, která je pro nádorové buňky velmi významná [94,95]. Nádorové buňky vyznačující se nízkou expresí laminu A by mohly být tedy snáze terapeuticky cílitelné pomocí látek poškozujících DNA [96].
Závěr
V mikroprostředí nádoru jsou nádorové buňky vystaveny řadě různých mechanických stimulů. Mezi těmito stimuly a signalizací uvnitř buňky existuje úzké spojení díky mechanizmům mechanotransdukce. Na rozdíl od vysoké variability selekčních tlaků působících při vzniku primárního nádoru jsou téměř všechny metastatické buňky vystaveny podobné fyzikální selekci. Pochopení mechanických sil zapojených do aktivace signálů vedoucích k maligní transformaci buněk a jejich úspěšné diseminaci po organismu je klíčem k vývoji účinných terapeutik k léčbě nádorů.
Obdrženo/Submitted: 17. 8. 2020
Přijato/Accepted: 23. 12. 2020doc. RNDr. Michal Masařík, Ph.D.
Ústav patologické fyziologie, LF MU
Kamenice 5
625 00 Brno
e-mail: masarik@med.muni.cz
Zdroje
- Jansen KA, Donato DM, Balcioglu HE et al. A guide to mechanobiology: where biology and physics meet. Biochim Biophys Acta 2015; 1853(11, Pt B): 3043–3052. doi: doi: 10.1016/ j.bbamcr.2015.05.007.
- Northcott JM, Dean IS, Mouw JK et al. Feeling stress: the mechanics of cancer progression and aggression. Front Cell Dev Biol 2018; 6 : 17. doi: 10.3389/ fcell.2018.00017.
- Lu P, Weaver VM, Werb Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol 2012; 196(4): 395–406. doi: 10.1083/ jcb.201102147.
- Morgan JE, Gross JG, Pagel CN et al. Myogenic cell proliferation and generation of a reversible tumorigenic phenotype are triggered by preirradiation of the recipient site. J Cell Biol 2002; 157(4): 693–702. doi: 10.1083/ jcb.200108047.
- Gieni RS, Hendzel MJ. Mechanotransduction from the ECM to the genome: are the pieces now in place? J Cell Biochem 2008; 104(6): 1964–1987. doi: 10.1002/ jcb.21364.
- Bissell MJ, Kenny PA, Radisky DC. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harb Symp Quant Biol 2005; 70 : 343–356. doi: 10.1101/ sqb.2005.70.013.
- Allard D, Stoker M, Gherardi E. A G2/ M cell cycle block in transformed cells by contact with normal neighbors. Cell Cycle 2003; 2(5): 484–487.
- Bonnans C, Chou J, Werb Z. Remodelling the extracellular matrix in development and disease. Nat Rev Mol Cell Biol 2014; 15(12): 786–801. doi: 10.1038/ nrm3904.
- Theocharis AD, Skandalis SS, Gialeli C et al. Extracellular matrix structure. Adv Drug Deliv Rev 2016; 97 : 4–27. doi: 10.1016/ j.addr.2015.11.001.
- Levental KR, Yu H, Kass L et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell 2009; 139(5): 891–906. doi: 10.1016/ j.cell.2009.10. 027.
- Acerbi I, Cassereau L, Dean I et al. Human breast cancer invasion and aggression correlates with ECM stiffening and immune cell infiltration. Integr Biol (Camb) 2015; 7(10): 1120–1134. doi: 10.1039/ c5ib00040h.
- Mahadevan D, Von Hoff DD. Tumor-stroma interactions in pancreatic ductal adenocarcinoma. Mol Cancer Ther 2007; 6(4): 1186–1197. doi: 10.1158/ 1535-7163.mct-06-0686.
- Tuxhorn JA, Ayala GE, Smith MJ et al. Reactive stroma in human prostate cancer: induction of myofibroblast phenotype and extracellular matrix remodeling. Clin Cancer Res 2002; 8(9): 2912–2923.
- Miller BW, Morton JP, Pinese M et al. Targeting the LOX/ hypoxia axis reverses many of the features that make pancreatic cancer deadly: inhibition of LOX abrogates metastasis and enhances drug efficacy. EMBO Mol Med 2015; 7(8): 1063–1076. doi: 10.15252/ emmm.201404827.
- Pickup MW, Laklai H, Acerbi I et al. Stromally derived lysyl oxidase promotes metastasis of transforming growth factor-b-deficient mouse mammary carcinomas. Cancer Res 2013; 73(17): 5336–5346. doi: 10.1158/ 0008-5472.can-13-0012.
- Svitkina TM. Filopodia and Lamellipodia. [online]. Available from: https:/ / www.researchgate.net/ publication/ 301856217_Filopodia_and_Lamellipodia.
- Alblazi KM, Siar CH. Cellular protrusions--lamellipodia, filopodia, invadopodia and podosomes--and their roles in progression of orofacial tumours: current understanding. Asian Pac J Cancer Prev 2015; 16(6): 2187–2191. doi: 10.7314/ apjcp.2015.16.6.2187.
- Collin O, Tracqui P, Stephanou A et al. Spatiotemporal dynamics of actin-rich adhesion microdomains: influence of substrate flexibility. J Cell Sci 2006; 119 (Pt 9): 1914–1925. doi: 10.1242/ jcs.02838.
- Wong S, Guo WH, Wang YL. Fibroblasts probe substrate rigidity with filopodia extensions before occupying an area. Proc Natl Acad Sci USA 2014; 111(48): 17176–17181. doi: 10.1073/ pnas.1412285111.
- Fraley SI, Wu PH, He L et al. Three-dimensional matrix fiber alignment modulates cell migration and MT1-MMP utility by spatially and temporally directing protrusions. Sci Rep 2015; 5 : 14580. doi: 10.1038/ srep14580.
- Han W, Chen S, Yuan W et al. Oriented collagen fibers direct tumor cell intravasation. Proc Natl Acad Sci USA 2016; 113(40): 11208–11213. doi: 10.1073/ pnas.1610347113.
- Lopez JI, Kang I, You WK et al. In situ force mapping of mammary gland transformation. Integr Biol (Camb) 2011; 3(9): 910–921. doi: 10.1039/ c1ib00043h.
- Provenzano PP, Eliceiri KW, Campbell JM et al. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Med 2006; 4(1): 38. doi: 10.1186/ 1741-7015-4-38.
- Stella GM, Kolling S, Benvenuti S et al. Lung-seeking metastases. Cancers (Basel) 2019; 11(7): 1010. doi: 10.3390/ cancers11071010.
- Centeno BA. Pathology of liver metastases. Cancer Control 2006; 13(1): 13–26. doi: 10.1177/ 107327480601300103.
- Zeisberg M, Kalluri R. Cellular mechanisms of tissue fibrosis. 1. Common and organ-specific mechanisms associated with tissue fibrosis. Am J Physiol Cell Physiol 2013; 304(3): C216–C225. doi: 10.1152/ ajpcell.00328.2012.
- Wang N, Butler J, Ingber D. Mechanotransduction across the cell surface and through the cytoskeleton. Science 1993; 260(5111): 1124–1127. doi: 10.1126/ science.7684161.
- Mitra SK, Schlaepfer DD. Integrin-regulated FAK-Src signaling in normal and cancer cells. Curr Opin Cell Biol 2006; 18(5): 516–523. doi: 10.1016/ j.ceb.2006.08.011.
- Price LS, Leng J, Schwartz MA et al. Activation of Rac and Cdc42 by integrins mediates cell spreading. Mol Biol Cell 1998; 9(7): 1863–1871. doi: 10.1091/ mbc.9.7.1863.
- Steffen A, Ladwein M, Dimchev GA et al. Rac function is crucial for cell migration but is not required for spreading and focal adhesion formation. J Cell Sci 2013; 126 (Pt 20): 4572–4588. doi: 10.1242/ jcs.118232.
- Nobes CD, Hall A. Rho, rac, and cdc42 GTPases regulate the assembly of multimolecular focal complexes associated with actin stress fibers, lamellipodia, and filopodia. Cell 1995; 81(1): 53–62. doi: 10.1016/ 0092-8674(95)90370-4.
- He K, Sakai T, Tsukasaki Y et al. Myosin X is recruited to nascent focal adhesions at the leading edge and induces multi-cycle filopodial elongation. Sci Rep 2017; 7(1): 13685. doi: 10.1038/ s41598-017-06147-6.
- Berg JS, Cheney RE. Myosin-X is an unconventional myosin that undergoes intrafilopodial motility. Nat Cell Biol 2002; 4(3): 246–250. doi: 10.1038/ ncb762.
- Makowska KA, Hughes RE, White KJ et al. Specific myosins control actin organization, cell morphology, and migration in prostate cancer cells. Cell Rep 2015; 13(10): 2118–2125. doi: 10.1016/ j.celrep.2015.11.012.
- DeMali KA, Barlow CA, Burridge K. Recruitment of the Arp2/ 3 complex to vinculin : coupling membrane protrusion to matrix adhesion. J Cell Biol 2002; 159(5): 881–891. doi: 10.1083/ jcb.200206043.
- Paterno J, Vial IN, Wong VW et al. Akt-mediated mechanotransduction in murine fibroblasts during hypertrophic scar formation. Wound Repair Regen 2011; 19(1): 49–58. doi: 10.1111/ j.1524-475X.2010.00643.x.
- Xue Z, Zhang W, Desai LP et al. Increased mechanical strain imposed on murine lungs during ventilation in vivo depresses airway responsiveness and activation of protein kinase Akt. J Appl Physiol (1985) 2013; 114(11): 1506–1510. doi: 10.1152/ japplphysiol.01460.2012.
- Rubashkin MG, Cassereau L, Bainer R et al. Force engages vinculin and promotes tumor progression by enhancing PI3K activation of phosphatidylinositol (3,4,5)-triphosphate. Cancer Res 2014; 74(17): 4597–4611. doi: 10.1158/ 0008-5472.can-13-3698.
- Arthur WT, Petch LA, Burridge K. Integrin engagement suppresses RhoA activity via a c-Src-dependent mechanism. Curr Biol 2000; 10(12): 719–722. doi: 10.1016/ s0960-9822(00)00537-6.
- Huveneers S, Danen EH. Adhesion signaling – crosstalk between integrins, Src and Rho. J Cell Sci 2009; 122(8): 1059–1069. doi: 10.1242/ jcs.039446.
- Huynh J, Bordeleau F, Kraning-Rush CM et al. Substrate stiffness regulates PDGF-induced circular dorsal ruffle formation through MLCK. Cell Mol Bioeng 2013; 6(2): 10.1007/ s12195-013-0278-7. doi: 10.1007/ s12195-013-0278-7.
- Azimifar SB, Böttcher RT, Zanivan S et al. Induction of membrane circular dorsal ruffles requires co-signalling of integrin-ILK-complex and EGF receptor. J Cell Sci 2012; 125 (Pt 2): 435–448. doi: 10.1242/ jcs.091652.
- Li X, Zhou Y, Li Y et al. Autophagy: a novel mechanism of chemoresistance in cancers. Biomed Pharmacother 2019; 119 : 109415. doi: 10.1016/ j.biopha.2019.109415.
- Balvan J, Gumulec J, Raudenska M et al. Oxidative stress resistance in metastatic prostate cancer: renewal by self-eating. PLoS One 2015; 10(12): e0145016. doi: 10.1371/ journal.pone.0145016.
- Totaro A, Zhuang Q, Panciera T et al. Cell phenotypic plasticity requires autophagic flux driven by YAP/ TAZ mechanotransduction. Proc Natl Acad Sci USA 2019; 116(36): 17848–17857. doi: 10.1073/ pnas.1908228 116.
- Jiang N, Dai Q, Su X et al. Role of PI3K/ AKT pathway in cancer: the framework of malignant behavior. Mol Biol Rep 2020; 47(6): 4587–4629. doi: 10.1007/ s11033-020-05435-1.
- Windham TC, Parikh NU, Siwak DR et al. Src activation regulates anoikis in human colon tumor cell lines. Oncogene 2002; 21(51): 7797–7807. doi: 10.1038/ sj.onc.1205989.
- Yoshida R, Sasaki T, Minami Y et al. Activation of Src signaling mediates acquired resistance to ALK inhibition in lung cancer. Int J Oncol 2017; 51(5): 1533–1540. doi: 10.3892/ ijo.2017.4140.
- Nguyen TV, Sleiman M, Moriarty T et al. Sorafenib resistance and JNK signaling in carcinoma during extracellular matrix stiffening. Biomaterials 2014; 35(22): 5749–5759. doi: 10.1016/ j.biomaterials.2014.03.058.
- Rice AJ, Cortes E, Lachowski D et al. Matrix stiffness induces epithelial-mesenchymal transition and promotes chemoresistance in pancreatic cancer cells. Oncogenesis 2017; 6(7): e352. doi: 10.1038/ oncsis.2017.54.
- Schrader J, Gordon-Walker TT, Aucott RL et al. Matrix stiffness modulates proliferation, chemotherapeutic response, and dormancy in hepatocellular carcinoma cells. Hepatology 2011; 53(4): 1192–1205. doi: 10.1002/ hep.24108.
- Liu C, Liu Y, Xie HG et al. Role of three-dimensional matrix stiffness in regulating the chemoresistance of hepatocellular carcinoma cells. Biotechnol Appl Biochem 2015; 62(4): 556–562. doi: 10.1002/ bab.1302.
- You Y, Zheng Q, Dong Y et al. Matrix stiffness-mediated effects on stemness characteristics occurring in HCC cells. Oncotarget 2016; 7(22): 32221–32231. doi: 10.18632/ oncotarget.8515.
- Joyce MH, Lu C, James ER et al. Phenotypic basis for matrix stiffness-dependent chemoresistance of breast cancer cells to doxorubicin. Front Oncol 2018; 8 : 337. doi: 10.3389/ fonc.2018.00337.
- Orafaie A, Matin MM, Sadeghian H. The importance of 15-lipoxygenase inhibitors in cancer treatment. Cancer Metastasis Rev 2018; 37(2): 397–408. doi: 10.1007/ s10555-018-9738-9.
- Saatci O, Kaymak A, Raza U et al. Targeting lysyl oxidase (LOX) overcomes chemotherapy resistance in triple negative breast cancer. Nat Commun 2020; 11(1): 2416. doi: 10.1038/ s41467-020-16199-4.
- Cox TR, Rumney RM, Schoof EM et al. The hypoxic cancer secretome induces pre-metastatic bone lesions through lysyl oxidase. Nature 2015; 522(7554): 106–110. doi: 10.1038/ nature14492.
- Min C, Kirsch KH, Zhao Y et al. The tumor suppressor activity of the lysyl oxidase propeptide reverses the invasive phenotype of Her-2/ neu-driven breast cancer. Cancer Res 2007; 67(3): 1105–1112. doi: 10.1158/ 0008-5472.can-06-3867.
- Eke I, Deuse Y, Hehlgans S et al. b₁Integrin/ FAK/ cortactin signaling is essential for human head and neck cancer resistance to radiotherapy. J Clin Invest 2012; 122(4): 1529–1540. doi: 10.1172/ jci61350.
- Golubovskaya VM. Targeting FAK in human cancer: from finding to first clinical trials. Front Biosci (Landmark Ed) 2014; 19 : 687–706. doi: 10.2741/ 4236.
- Heffler M, Golubovskaya VM, Dunn KM et al. Focal adhesion kinase autophosphorylation inhibition decreases colon cancer cell growth and enhances the efficacy of chemotherapy. Cancer Biol Ther 2013; 14(8): 761–772. doi: 10.4161/ cbt.25185.
- Hochwald SN, Nyberg C, Zheng M et al. A novel small molecule inhibitor of FAK decreases growth of human pancreatic cancer. Cell Cycle 2009; 8(15): 2435–2443. doi: 10.4161/ cc.8.15.9145.
- Gerber DE, Camidge DR, Morgensztern D et al. Phase 2 study of the focal adhesion kinase inhibitor defactinib (VS-6063) in previously treated advanced KRAS mutant non-small cell lung cancer. Lung Cancer 2020; 139 : 60–67. doi: 10.1016/ j.lungcan.2019.10.033.
- Mohanty A, Pharaon RR, Nam A et al. FAK-targeted and combination therapies for the treatment of cancer: an overview of phase I and II clinical trials. Expert Opin Investig Drugs 2020; 29(4): 399–409. doi: 10.1080/ 13543784.2020.1740680.
- Kurenova EV, Hunt DL, He D et al. Small molecule chloropyramine hydrochloride (C4) targets the binding site of focal adhesion kinase and vascular endothelial growth factor receptor 3 and suppresses breast cancer growth in vivo. J Med Chem 2009; 52(15): 4716–4724. doi: 10.1021/ jm900159g.
- Alday-Parejo B, Stupp R, Rüegg C. Are integrins still practicable targets for anti-cancer therapy? Cancers 2019; 11(7): 978. doi: 10.3390/ cancers11070978.
- Klapproth E, Dickreuter E, Zakrzewski F et al. Whole exome sequencing identifies mTOR and KEAP1 as potential targets for radiosensitization of HNSCC cells refractory to EGFR and b1 integrin inhibition. Oncotarget 2018; 9(26): 18099–18114. doi: 10.18632/ oncotarget.24266.
- Huang SW, Chyuan IT, Shiue C et al. Lovastatin-mediated MCF-7 cancer cell death involves LKB1-AMPK-p38MAPK-p53-survivin signalling cascade. J Cell Mol Med 2020; 24(2): 1822–1836. doi: 10.1111/ jcmm.14879.
- Kidera Y, Tsubaki M, Yamazoe Y et al. Reduction of lung metastasis, cell invasion, and adhesion in mouse melanoma by statin-induced blockade of the Rho/ Rho-associated coiled-coil-containing protein kinase pathway. J Exp Clin Cancer Res 2010; 29(1): 127. doi: 10.1186/ 1756-9966-29-127.
- Wang Z, Zhang L, Wan Z et al. Atorvastatin and caffeine in combination regulates apoptosis, migration, invasion and tumorspheres of prostate cancer cells. Pathol Oncol Res 2020; 26(1): 209–216. doi: 10.1007/ s12253-018-0415-7.
- Sorrentino G, Ruggeri N, Specchia V et al. Metabolic control of YAP and TAZ by the mevalonate pathway. Nat Cell Biol 2014; 16(4): 357–366. doi: 10.1038/ ncb2936.
- Huang Q, Hu X, He W et al. Fluid shear stress and tumor metastasis. Am J Cancer Res 2018; 8(5): 763–777.
- Mitchell M, King M. Computational and experimental models of cancer cell response to fluid shear stress. Front Oncol 2013; 3 : 44: doi: 10.3389/ fonc.2013.00044.
- Wirtz D, Konstantopoulos K, Searson PC. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nat Rev Cancer 2011; 11(7): 512–522. doi: 10.1038/ nrc3080.
- Fan R, Emery T, Zhang Y et al. Circulatory shear flow alters the viability and proliferation of circulating colon cancer cells. Sci Rep 2016; 6 : 27073. doi: 10.1038/ srep27073.
- Davies PF, Spaan JA, Krams R. Shear stress biology of the endothelium. Ann Biomed Eng 2005; 33(12): 1714–1718. doi: 10.1007/ s10439-005-8774-0.
- von Sengbusch A, Gassmann P, Fisch KM et al. Focal adhesion kinase regulates metastatic adhesion of carcinoma cells within liver sinusoids. Am J Pathol 2005; 166(2): 585–596. doi: 10.1016/ s0002-9440(10)62280-8.
- Regmi S, Fu A, Luo KQ. High shear stresses under exercise condition destroy circulating tumor cells in a microfluidic system. Sci Rep 2017; 7(1): 39975. doi: 10.1038/ srep39975.
- Thompson BJ. YAP/ TAZ: drivers of tumor growth, metastasis, and resistance to therapy. BioEssays 2020; 42(5): 1900162. doi: 10.1002/ bies.201900162.
- Lee HJ, Diaz MF, Price KM et al. Fluid shear stress activates YAP1 to promote cancer cell motility. Nat Commun 2017; 8 : 14122. doi: 10.1038/ ncomms14122.
- Guck J, Schinkinger S, Lincoln B et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophys J 2005; 88(5): 3689–3698. doi: 10.1529/ biophysj.104.045476.
- Rao KM, Cohen HJ. Actin cytoskeletal network in aging and cancer. Mutat Res 1991; 256(2–6):139–148. doi: 10.1016/ 0921-8734(91)90007-x.
- Alibert C, Goud B, Manneville JB. Are cancer cells really softer than normal cells? Biol Cell 2017; 109(5): 167–189. doi: 10.1111/ boc.201600078.
- Paul CD, Mistriotis P, Konstantopoulos K. Cancer cell motility: lessons from migration in confined spaces. Nat Rev Cancer 2017; 17(2): 131–140. doi: 10.1038/ nrc.2016.123.
- Sun Q, Luo T, Ren Y et al. Competition between human cells by entosis. Cell Res 2014; 24(11): 1299–1310. doi: 10.1038/ cr.2014.138.
- Islam M, Mezencev R, McFarland B et al. Microfluidic cell sorting by stiffness to examine heterogenic responses of cancer cells to chemotherapy. Cell Death Dis 2018; 9(2): 239. doi: 10.1038/ s41419-018-0266-x.
- Lautscham Lena A, Kämmerer C, Lange Janina R et al. Migration in confined 3D environments is determined by a combination of adhesiveness, nuclear volume, contractility, and cell stiffness. Biophys J 2015; 109(5): 900–913. doi: 10.1016/ j.bpj.2015.07.025.
- Schoumacher M, Goldman R D, Louvard D et al. Actin, microtubules, and vimentin intermediate filaments cooperate for elongation of invadopodia. J Cell Biol 2010; 189(3): 541–556. doi: 10.1083/ jcb.200909113.
- Wolf K, Te Lindert M, Krause M et al. Physical limits of cell migration: control by ECM space and nuclear deformation and tuning by proteolysis and traction force. J Cell Biol 2013; 201(7): 1069–1084. doi: 10.1083/ jcb.201210152.
- Denais C, Lammerding J. Nuclear mechanics in cancer. Adv Exp Med Biol 2014; 773 : 435–470. doi: 10.1007/ 978-1-4899-8032-8_20.
- Zink D, Fischer AH, Nickerson JA. Nuclear structure in cancer cells. Nat Rev Cancer 2004; 4(9): 677–687. doi: 10.1038/ nrc1430.
- Rowat AC, Jaalouk DE, Zwerger M et al. Nuclear envelope composition determines the ability of neutrophil-type cells to passage through micron-scale constrictions. J Biol Chem. 2013; 288(12): 8610–8618. doi: 10.1074/ jbc.M112.441535.
- Burke B. When cells push the envelope. Science 2016; 352(6283): 295–296. doi: 10.1126/ science.aaf7 735.
- Mitchell MJ, Denais C, Chan MF et al. Lamin A/ C deficiency reduces circulating tumor cell resistance to fluid shear stress. Am J Physiol Cell Physiol 2015; 309(11): C736–C746. doi: 10.1152/ ajpcell.00050.2015.
- Kong L, Schäfer G, Bu H et al. Lamin A/ C protein is overexpressed in tissue-invading prostate cancer and promotes prostate cancer cell growth, migration and invasion through the PI3K/ AKT/ PTEN pathway. Carcinogenesis 2012; 33(4): 751–759. doi: 10.1093/ carcin/ bg s022.
- Park S, Kim YS, Kim DY et al. PI3K pathway in prostate cancer: all resistant roads lead to PI3K. Biochim Biophys Acta Rev Cancer 2018; 1870(2): 198–206. doi: 10.1016/ j.bbcan.2018.09.001.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2021 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Léčba nemetastatického kastračně rezistentního karcinomu prostaty
- Sociální faktory mají vliv na průběh a prognózu maligní nemoci
- Léčba nemetastatického kastračně refrakterního karcinomu prostaty
- Indikace žilních vstupů v onkologii – doporučení národních odborných společností a současný stav v ČR
- Mechanobiologie kancerogeneze
- COVID-19 a onkologické ochorenie
- Genetické a epigenetické základy radiorezistence nádorových buněk prostaty
- Epiteloidní hemangioendoteliom v PET/ CT obraze
- Využití PET/ CT s markerem hypoxie (18F-FMISO) v plánování radioterapie
- Lipozomální irinotekan – nová možnost systémové léčby karcinomu pankreatu
- Aktuality z odborného tisku
- Životné jubileum doc. MU Dr. Juraja Kaušitza, CSc.
- Jubileum prvej dámy radiačnej onkológie na Slovensku – MUDr. Eva Siracká, DrSc.
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Indikace žilních vstupů v onkologii – doporučení národních odborných společností a současný stav v ČR
- Epiteloidní hemangioendoteliom v PET/ CT obraze
- COVID-19 a onkologické ochorenie
- Mechanobiologie kancerogeneze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



