-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam aberantně aktivované dráhy Hedgehog/Gli pro nádorovou progresi
Importance of Aberrantly Activated Hedgehog/Gli Pathway in Tumour Progression
Background: Cancer is the second most common cause of death in the Czech Republic. The treatment of this disease is very exhausting for the patients and the treatment has often limited success only. The disease often relapses after a period of remission. Moreover, metastases often appear in lungs, liver or other organs and worsen patient’s prognosis and probability of survival. The Hedgehog (Hh) signaling pathway is one of the important pathways that affects initiation and maintenance of various types of tumours. When aberrantly activated, Hh signaling pathway helps cells escape apoptosis, disturbs cell energy metabolism, influences the process of epithelial-mesenchymal transition, helps to escape immune system, maintains cancer stem cells and supports metastasis. The role of Hh signaling cascade in tumour initiation, maintenance and progression is intensively studied. Several types of inhibitors of this pathway were developed. The most intensively studied were inhibitors of the receptor Smoothened. Due to commonly occurring resistance, the research of other groups of inhibitors is in the centre of interest. These new drugs do not target receptor Smoothened but proteins standing downstream of Smoothened (inhibition of final Gli transcription factors). The drugs could give new hope to patients whose treatment fails.
Purpose: This review summarizes the findings about the role of Hh signaling pathway in tumour development and describes the progress in the development of targeted inhibitors of this pathway.
Keywords:
molecular targeted therapy – apoptosis – epithelial-mesenchymal transition – metastasis – drug resistance – Hedgehog signaling pathway – Cancer stem cells
Autoři: Kateřina Kreisingerová; Ubica Ondrušová; Pavel Horák; Jiří Vachtenheim
Působiště autorů: Ústav lékařské biochemie a laboratorní diagnostiky, 1. LF UK a VFN Praha
Vyšlo v časopise: Klin Onkol 2020; 33(3): 177-183
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2020177Souhrn
Východiska: Nádorová onemocnění jsou druhou nejčastější příčinou úmrtí v České republice. Léčba tohoto typu onemocnění je pro pacienty velmi náročná a její úspěšnost je často limitovaná kvůli častým relapsům. Navíc se mohou objevit metastázy, nejčastěji v plicích a játrech, které zhoršují pacientovu prognózu na přežití. Signální dráha Hedgehog (Hh) je jednou z významných signalizačních kaskád, které ovlivňují rozvoj a následné udržování mnoha typů nádorů. Její aberantní signalizace pomáhá buňkám uniknout apoptóze, narušuje energetický metabolizmus buněk, má vliv na proces epiteliálně-mezenchymálního přechodu, pomáhá nádorovým buňkám uniknout imunitnímu systému, udržuje nádorové kmenové buňky a podílí se na tvorbě metastáz. Role signální dráhy Hh v rozvoji, udržování a progresi nádorů je intenzivně studovaná. Bylo vyvinuto několik typů inhibitorů této signální dráhy. Nejvíce studované byly inhibitory receptoru Smoothened, ale vzhledem k často vznikající rezistenci se nyní dostává do popředí výzkum dalších skupin inhibitorů, které cílí mimo receptor Smoothened. Zdá se, že tyto inhibitory by mohly pomoci překonat rezistenci inhibicí přímých efektorů dráhy, tj. transkripčních faktorů Gli, nezávisle na membránové signalizaci. Tyto nové léky dávají naději pacientům, u kterých v současné době léčba selhává.
Cíl: Tento souhrnný článek se snaží shrnout poznatky o roli signální dráhy Hh v rozvoji nádorů a popisuje některé zásadní pokroky ve vývoji cílených inhibitorů této dráhy.
Klíčová slova:
apoptóza – epiteliálně-mezenchymální přechod – metastázy – chemorezistence – cílená molekulární terapie – signální dráha Hedgehog – nádorové kmenové buňky
Úvod
Signální dráha Hedgehog (Hh) /Gli je evolučně velmi konzervovaná od Drosophily po člověka. Poprvé byla popsána v roce 1980, kdy Nüsslein-Volhard a Wieschaus provedli velký screening mutací, které měnily vývoj tělního plánu larev octomilky [1]. Od té doby je tato dráha předmětem intenzivního výzkumu a ukázalo se, že hraje zásadní roli v embryonálním vývoji, ve kterém ovlivňuje diferenciaci buněk, proliferaci a polarizaci tkání. Hh signalizace je důležitá ve vývoji mozečku, mužského reproduktivního traktu, kostí, střeva nebo neurální trubice [2]. V dospělosti je aktivita dráhy ve většině tkání velmi nízká, ale je důležitá pro udržování kmenových buněk a je součástí reparace a regenerace tkání [3–5]. Aberantní aktivace dráhy Hh byla nalezena u mnoha typů nádorů, vede k rozvoji metastáz a podílí se na rezistenci k chemoterapii [6].
Signální dráha Hedgehog a aktivace transkripčních faktorů Gli
Signální dráha je aktivována navázáním ligandu na transmembránový receptor Patched (Ptch). Byly identifikovány tři různé ligandy, které aktivují dráhu Hh. Jsou to Sonic Hedgehog (Shh), Desert Hedgehog (Dhh) a Indian Hedgehog (Ihh). Tyto ligandy mají v embryonálním vývoji různou tkáňovou expresi. Všechny tři ligandy se mohou vázat na receptor Ptch a tím spustit Hh signalizaci [7]. Pokud nedojde k navázání ligandu, neaktivovaný receptor Ptch blokuje receptor Smoothened (Smo). Tím je signalizace inaktivovaná a transkripční faktory Gli 1–3 neaktivují transkripci cílových proonkogenních genů. Pokud ligand aktivuje Ptch, dojde k uvolnění blokace receptoru Smo a ten se dostává na povrch primárního cilia a následně ovlivňuje cytoplazmatický komplex složený z proteinů Suppression of Fused (SuFu), Gli a dalších proteinů. Následně dochází k uvolnění proteinů Gli z komplexu, vzniku jejich aktivních forem a tím aktivaci signální dráhy Hh. Gli proteiny jsou zinc-fingerové transkripční faktory. Nyní jsou známy 3 varianty těchto proteinů. Gli1 je aktivátor dráhy Hh, váže se na promotory cílových genů a tím spouští jejich transkripci. Gli2 je také považovaný především za aktivátor transkripce, nicméně má i represorovou doménu a může se jako represor chovat. Protein Gli3 může být aktivátorem nebo represorem dráhy Hh, záleží na buněčném kontextu. Aktivace dráhy Hh má za následek spuštění transkripce cílových genů. Těmi jsou v první řadě komponenty dráhy Hh (Gli1, Ptch1, Ptch2, Hhip), dále regulátory buněčného cyklu (CCDN2, CCNE1, cyklinD2), regulátory apoptózy (BCL-2, survivin, PAX6), geny epiteliálně-mezenchymálního přechodu (epithelial-mesenchymal transition – EMT) ZEB1, ZEB2, Twist2 [7–10] a mnoho dalších, převážně proonkogenních genů (obr. 1).
Obr. 1. Signální dráha Hedgehog (Hh).
V nepřítomnosti Hh ligandu receptor Patched (Ptch) blokuje receptor Smoothened (Smo) a z proteinového komplexu, tvořeného proteiny Gli, SuFu a dalšími, se uvolňuje represorová forma Gli proteinů. Represorové Gli proteiny blokují transkripci cílových genů dráhy Hh. Po aktivaci receptoru Ptch ligandem dráhy Hh (v tomto případě Shh), dochází k translokaci receptoru Smo na povrch primárního cilia, následně dojde k ovlivnění proteinového Gli/SuFu komplexu, ze kterého se uvolňují aktivní formy Gli faktorů. Po jejich translokaci do jádra aktivují transkripci cílových genů dráhy Hh.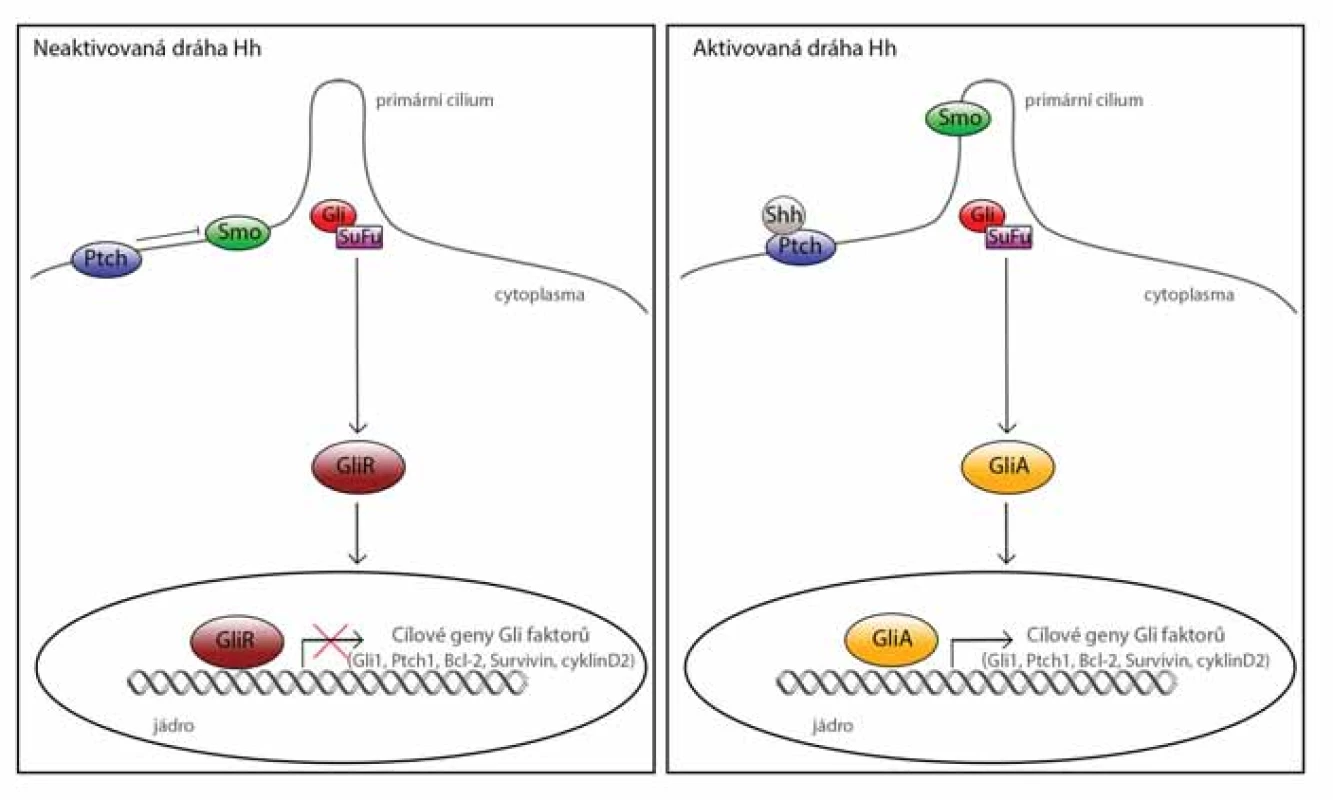
K aktivaci Gli faktorů však může dojít i nekanonicky. To znamená, že Gli faktory jsou přímo aktivovány proteiny z jiných signálních drah a procesu aktivace se v tomto případě neúčastní upstream receptory dráhy Hh, tj. Ptch a Smo. Nekanonická signalizace je častá především u maligních onemocnění. Většina signálních drah, které nekanonicky aktivují Gli faktory, jsou stejně jako dráha Hh významné pro rozvoj malignit a porozumění jejich propojení je tedy zcela zásadní. Pozitivní regulační vliv na transkripční aktivitu Gli má například dráha KRAS-MEK-ERK u buněk karcinomu žaludku [11]. Podobně bylo prokázáno, že Ras-MEK/AKT stimuluje transkripční aktivitu Gli1 u melanomu [12]. Dalším důležitým faktorem, který ovlivňuje Gli faktory, je růstový transformující faktor beta (TGF-b), který je důležitý během embryonálního vývoje a při udržování homeostázy dospělých tkání. TGF-b je zásadní pro expresi Gli a pro proliferaci cyklopamin-rezistentních buněk karcinomu slinivky [13]. Analýza Gli2 promotoru prokázala, že SMAD3 a b-katenin se vážou na Gli2 promotor v odpovědi na TGF-b, a Gli2 se proto dá považovat za přímý transkripční cíl TGF-b [14]. Důležitá signální dráha PI3K-AKT-mTOR, která se účastní mnoha buněčných procesů, také dokáže nekanonicky ovlivňovat aktivaci Gli. PI3K brání proteazomové degradaci Gli2 a usnadňuje tak aktivaci Gli2 a jeho translokaci do jádra [15]. Bylo popsáno mnoho dalších proteinů, které ovlivňují Gli faktory, patří mezi ně proteinkináza C, DYRK1 a DYRK2 kinázy nebo 5’-adenosinmonofosfát-aktivovaná proteinkináza (AMPK) [16,17]. Je jasné, že nekanonická signalizace je u nádorových onemocnění stejně důležitá jako signalizace kanonická, oba dva typy se v nádorech často vyskytují společně. Výzkum léčby nádorových onemocnění by měl tedy směřovat ke kombinované terapii, která bude blokovat jak klasickou dráhu Hh, tak samotné Gli faktory, případně jejich další spouštěče.
Role Hh v nádorové progresi
Je zřejmé, že dráha Hh je významná při rozvoji mnoha typů nádorů. Zásadní vliv hraje dráha Hh v rozvoji meduloblastomu [18], bazaliomu [19], karcinomu pankreatu [20] nebo karcinomu plic [21]. U mnoha dalších typů tumorů tato dráha přispívá k rozvoji nádorové progrese. Téměř všechny zásadní změny, které vedou k progresi nádorů, jsou nějak ovlivňovány dráhou Hh. K těmto významným případům patří například uniknutí programované buněčné smrti, ovlivnění činnosti telomerázy, angiogeneze, narušení energetického metabolizmu buněk, EMT, uniknutí imunitnímu systému, ovlivnění genomové stability nebo ovlivnění schopnosti tvořit metastázy a udržování viability nádorových kmenových buněk. V dalším textu jsou blíže popsány některé tyto případy, u kterých je význam dráhy Hh zcela zřejmý a prokázaný.
Apoptóza
Apoptóza neboli programovaná buněčná smrt je proces, který řídí autodestrukci buněk, které jsou natolik poškozené, že na ně nestačí reparační mechanizmy buňky. Narušení procesu apoptózy ovlivňuje homeostázu buněk a následně i tkání a je považováno za silně proonkogenní činitel. Ukazuje se, že signální dráha Hh je významným regulátorem apoptózy. Hh signalizace ovlivňuje expresi některých proapoptotických i antiapoptotických proteinů a tím určuje, zda buňka vstoupí do apoptózy, nebo ne. Dvě vědecké skupiny v roce 2004 současně prokázaly, že antiapoptotický protein BCL2 je přímým transkripčním cílem Gli faktorů. Jejich výsledky se lišily tím, že jedna skupina určila za hlavní regulátor BCL2 protein Gli1 [22], zatímco druhá považovala za regulátor genu BCL2 transkripční faktor Gli2 [23]. V roce 2011 byl další antiapoptotický protein XIAP označen jako transkripční cíl faktoru Gli2 [24]. Zvýšení hladiny antiapoptotického proteinu survivinu v nádorových buňkách bylo také připsáno signální dráze Hh [10]. Vysoká exprese survivinu byla v nádorových buňkách snížena pomocí inhibitoru GANT61, což je specifický inhibitor faktorů Gli. Za hlavní mediátor exprese byl v této studii označen faktor Gli2, který aktivoval expresi survivinu mnohem více než Gli1. V jiné nedávné studii autoři prokázali, že Hh neovlivňuje jen antiapoptotické proteiny, ale také proteiny proapoptotické. U buněk TP53-mutovaného rhabdomyosarkomu a meduloblastomu autoři ukázali, že snížení exprese proteinu Gli1 zvyšuje expresi proapoptotického proteinu Noxa. Podle této studie Gli1 reprimuje protein Noxa pravděpodobně přes early growth response protein 1 (EGR1) [25]. Nejznámější nádorový supresor p53 je také ovlivňován dráhou Hh. Signalizace Hh aktivuje ubikvitin ligázu Mdm2, která ubikvitinuje právě protein p53, čímž snižuje množství akumulovaného proteinu p53 v buňkách [26]. Na cholangiokarcinomových buňkách bylo ukázáno, že Hh signalizace také dokáže ovlivnit, jak konkrétně bude apoptóza probíhat, zda vnější apoptotickou cestou, nebo vnitřní (mitochondriální) cestou. Hh reguluje expresi XIAP proteinu (viz výše), který reprimuje vnější apoptotickou dráhu. Zablokování Hh signalizace vede ke snížení exprese XIAP proteinu a tím se v buňkách opět může aktivovat vnější apoptotická dráha [24]. Ze stavu současného poznání můžeme vyvodit, že dráha Hh narušuje rovnováhu apoptotických signálů v nádorových buňkách a vychyluje ji směrem k potlačení apoptózy. Tímto Hh signalizace velmi přispívá k iniciaci nádorového bujení a k dalšímu růstu již rozvinutých nádorů.
EMT a schopnost nádorů metastazovat
Epiteliálně-mezenchymální přechod (EMT) je buněčný mechanizmus, který je velmi důležitý v průběhu embryonálního vývoje a během reparace tkání. Epiteliální fenotyp buněk se v procesu EMT mění na fenotyp mezenchymový. EMT významně ovlivňují vývojové dráhy Wnt, Notch a Hedgehog (Hh). Proces EMT je také velmi důležitý během rozvoje nádorového bujení, umožňuje buňkám primárního nádoru uvolnit se do krve nebo lymfy a následně se usadit ve vzdálených orgánech s úplně jiným prostředím, než jaké bylo v primárním nádoru. Během procesu EMT dochází ke snížení adhezivity buněk, ke ztrátě buněčné polarity a získání invazivních a migračních vlastností [27]. Pro indukci EMT stačí v buňce aktivovat několik faktorů, jako například ZEB1 a ZEB2, LEF-1, Snail1 a Snail2 (Slug).
Během procesu EMT dochází ke snížení nebo úplnému vymizení exprese E-cadherinu, který je běžnou adhezivní molekulou v buňkách. Dále se zvyšuje exprese mezenchymálních markerů, jakými jsou vimentin, N-cadherin a fibronektin [28]. U většiny typů nádorových buněk již byla prokázána souvislost mezi dráhou Hh a EMT a migračními schopnostmi buněk. Přímý vliv Hh/Gli dráhy na EMT byl prokázán v klinické studii zkoumající pacientky s karcinomem prsu, kde vysoké hladiny Shh/Gli1 korelovaly s vysokou expresí proteinů Snail1 a vimentinu a s nízkou expresí E-cadherinu. V pokusech na buněčných kulturách pak zablokování faktorů Gli1 a Gli2 pomocí specifického inhibitoru GANT61 vedlo ke snížení invazivity a migrace buněk [29]. Podobné jsou výsledky klinické studie zabývající se karcinomem jícnu. Aberantní exprese Gli1 a Gli2 korelovala se sníženou expresí E-cadherinu a zvýšenou expresí proteinů Snail1, Slug, N-cadherinu a vimentinu. Inhibice Gli faktorů i v tomto případě snížila mobilitu a invazivitu buněk [30]. U pankreatických nádorových buněk podobných kmenovým buňkám (cancer stem-like cells – CSLC) dráha Hh ovlivňuje EMT a další invazivní vlastnosti. Inhibice Hh signalizace Smo (knockdown receptoru Smo) snížila až inhibovala proces EMT, invazivitu, chemorezistenci, plicní metastázy a tumorigenezi pankreatických CSLC [31]. Zdá se, že Gli1 nemá u pankreatických buněk vliv na iniciaci EMT, ale podporuje EMT indukovanou TGF-b1 a epidermálním růstovým faktorem (epidermal growth factor – EGF) [32]. TGF-b1 podobně zvyšuje expresi Gli u nemalobuněčného karcinomu plic a tím přispívá k rozvoji EMT [33].
Role Hh signalizace v procesu EMT a ve schopnosti buněk metastazovat je méně jasná u nádorů prsu. Podle studie publikované v roce 2017 se zdá, že nemetastazují buňky, které prošly procesem EMT, ale buňky z okolí těch, které procesem EMT prošly. Migrační schopnosti těchto buněk se pravděpodobně zvyšují díky parakrinní aktivaci faktorů Gli [34]. Hh signalizace také zvyšuje migrační schopnosti a invazivitu nádorových buněk tím, že aktivuje AKT dráhu a následně aktivuje matrix metaloproteinázy. Matrix metaloproteináza 9 (MMP-9) je takto upregulovaná například u karcinomu žaludku [35], u dlaždicového karcinomu dutiny ústní [36] a společně s matrix metaloproteinázou 2 (MMP-2) je zvýšená u buněk hepatocelulárního karcinomu [37].
Nádorové kmenové buňky
Za nádorové kmenové buňky (cancer stem cells, CSC) je považována malá frakce nádorových buněk, která získala vlastnosti podobné kmenovým buňkám. Především jde o schopnost sebeobnovy buněk, které jsou považovány za jakési „jádro“ nádoru. CSC jsou také rezistentní vůči chemoterapii a rekrutují se z nich metastatické buňky. Obecně se tedy předpokládá, že tyto buňky jsou zodpovědné za udržování a rozvoj nádorů a také za rezistenci vůči protinádorové léčbě [38]. CSC mají aberantně aktivované různé signální dráhy, které během normálního vývoje hrají důležitou roli v embryonálním vývoji a při diferenciaci buněk. Není tedy překvapivé, že dráha Hh je považovaná za jednu z klíčových cest pro rozvoj a udržení vlastností nádorových kmenových buněk [39]. Předpokládá se, že Hh mimo jiné aktivuje expresi genů, které jsou považovány za markery kmenovosti buněk. Jeden z těchto genů, transkripční faktor Nanog, je přímým transkripčním cílem signální dráhy Hh [40]. Hh signalizace dále ovlivňuje i další markery kmenových buněk: SOX2, Bmi1 a OCT4 [41,42]. Role Hh v udržování CSC byla popsána u mnoha typů nádorů, např. u akutní a chronické myeloidní leukemie, mnohočetného myelomu, karcinomu prsu nebo gliomu [43,44].
Cílená terapie
Vzhledem ke stále lepšímu poznání prostředí nádorů, procesů iniciace, progrese a metastazování nádorů se také rozvíjí oblast cílené léčby nádorů. V posledních letech bylo připraveno mnoho nízkomolekulárních inhibitorů jednotlivých komponentů dráhy Hh. Jako první byl z rostliny Veratrum Californicum izolován inhibitor cyklopamin, který způsobuje závažné vývojové abnormality u zvířat. V roce 1998 bylo prokázáno, že tento alkaloid inhibuje Hh signalizaci přímým navázáním na receptor Smo [45]. Další zkoumání však ukázalo, že cyklopamin má poměrně nízkou účinnost, a navíc jej nelze užívat perorálně. Další zkoumání brzy přineslo účinnější deriváty cyklopaminu, například sonidegib (erismodegib, LDE-225), saridegib (patidegib, IPI-926) a vismodegib (GDC-0449). Dva inhibitory Smo byly schváleny americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration – FDA) i Evropskou lékovou agenturou (European Medicines Agency – EMA) pro léčbu bazaliomu. Prvním z nich je vismodegib. Byl schválen FDA v roce 2012 pro léčbu metastatického bazaliomu [46]. V roce 2013 pak byl schválen také EMA. Od té doby proběhlo několik dalších klinických studií, které studovaly vliv vismodegibu u dalších typů nádorů. U žádné však výsledky nedopadly tak dobře jako u bazaliomu. Vismodegib se například testoval jako monoterapie u pacientů s metastatickým kastračně rezistentním karcinomem prostaty; testovaná léčba však neprokázala výraznou klinickou aktivitu vismodegibu [47]. V dalších studiích byl vismodegib použit jako součást kombinované terapie. Například u pacientů s metastatickou formou kolorektálního karcinomu byl vismodegib podáván v kombinaci s bevacizumabem a chemoterapií. Vliv tohoto typu léčby na prodloužení pacientova života se však v této studii signifikantně neprokázal [48]. Další klinické studie stále probíhají nebo jsou ve fázi hledání vhodných pacientů [49]. Druhým inhibitorem Smo, který je schválený FDA a EMA je sonidegib [50]. Oba úřady jej schválily v roce 2015 k léčbě lokálně pokročilého bazaliomu, který není vhodný k chirurgické léčbě nebo radioterapii. Další inhibitor Smo patidegib (saridegib) měl slibné výsledky ve fázi II klinických zkoušek a nyní začíná fáze III klinických zkoušek, kdy preparát bude podáván ve formě 2% gelu k lokální aplikaci. Testovací léčba je určena pro pacienty s Gorlinovým syndromem, který způsobuje chronickou formu bazaliomu. Léčba patidegibem má za cíl snížit celkový počet bazaliomů, což by mělo vést ke snížení počtu nutných operací. V současné době je tato studie ve fázi hledání pacientů, kteří se zúčastní klinické zkoušky [51]. Zatím posledním inhibitorem Smo schváleným FDA je glasdegib. Byl schválen v roce 2018 k léčbě nově diagnostikované akutní myeloidní leukemie u pacientů ≥ 75 let nebo u pacientů, u kterých je vyloučena intenzivní indukční chemoterapie. Léčba glasdegibem je doprovázena podáváním nízkých dávek cytarabinu [52]. Dalších inhibitorů Smo je celá řada a jsou intenzivně studovány; patří mezi ně například taladegib nebo itrakonazol, což je látka s protiplísňovými vlastnostmi. Problémem však je, že v mnoha nádorech je receptor Smo mutovaný a výše zmíněné Smo inhibitory jsou tedy méně účinné nebo neúčinné. Neúčinnost Smo inhibitorů i při nemutovaném Smo je lehce vysvětlitelná tím, že dráha Hh může být velmi často aktivována nekanonicky jinými signálními cestami a nepotřebuje tedy upstream signální podněty. Tento problém se nyní obchází použitím inhibitorů jiných komponent dráhy Hh. Například inhibitor robotnikinin se váže na extracelulární Shh a blokuje tak Shh signalizaci [53]. Shh také blokují protilátky 5E1, 3H8 a 6D7 (MEDI-5307) [54]. Další skupinou jsou inhibitory Gli faktorů. Nízkomolekulární inhibitory GANT58 a GANT61 zabraňují vazbě Gli proteinů na DNA v jádře a tak blokují jejich transkripční aktivitu [55]. Tyto inhibitory zatím nejsou používány v klinických studiích, nicméně jsou intenzivně zkoumány v in vitro, popř. in vivo studiích se slibnými výsledky. Prokázalo se, že mnoho typů nádorových buněk je senzitivních ke GANT61 in vitro a že GANT61 tyto buňky zabíjí procesem apoptózy [56–58]. V další studii GANT61 v kombinaci s obatoclaxem (inhibitor rodiny proteinů BCL2) působil velmi slibně na buňky maligního melanomu [59]. Mezi Gli inhibitory patří také oxid arsenitý, látka schválená FDA pro léčbu akutní promyelotické leukemie [60].
Léková rezistence
Problémem cílené léčby nádorů je, že během ní často vzniká de novo získaná rezistence k danému typu léčby. V případě dráhy Hh se nyní řeší především rezistence vůči inhibitorům Smo, která snižuje možnosti léčby i eradikace CSC [61]. Na významu získávají inhibitory Smo, které mají jiný mechanizmus účinku než cyklopamin a jeho deriváty a jiné běžné inhibitory Smo. Například itrakonazol je považován za inhibitor Smo, nicméně neblokuje přímo molekulu Smo, ale zabraňuje kumulaci Smo v primárním ciliu. Kumulace a aktivace Smo v primárním ciliu je zásadní krok v Hh signalizaci; narušení tohoto procesu má za následek přerušení signalizační dráhy [62]. Itrakonazol (inhibitor Smo) a oxid arsenitý (inhibitor Gli), ať každý zvlášť, nebo v kombinaci, inhibují růst meduloblastomu a bazaliomu u myší in vivo a prodlužují život myší s meduloblastomem s mutovaným Smo, který je rezistentní vůči léčbě [63]. Další důležitou kategorií jsou inhibitory „downstream“ od Smo, které jsou nyní předmětem intenzivního zkoumání. Inhibitor Gli faktorů GANT61 má slibné výsledky v in vitro i in vivo studiích, nicméně zatím neprobíhá žádná klinická studie.
Na druhou stranu léčba Hh inhibitory může zvýšit citlivost buněk/tumorů rezistentních vůči určitému typu léčby, například vůči radioterapii. U buněk karcinomu prostaty GANT61 zvýšil citlivost rezistentních buněk vůči radioterapii jak in vitro, tak in vivo. U myšího modelu in vivo se citlivost k nové léčbě projevila snížením nádorového růstu a byla spojená se sníženou proliferací a zvýšenou apoptózou [64]. Podobně je u lidského glioblastomu častá snížená citlivost nádoru vůči léčbě chemoterapeutikem temozolomidem. Poté, co byly buňky gliomu vystaveny působení GANT61, reagovaly zvýšením citlivosti k temozolomidu [65]. V další studii bylo prokázáno, že Hh signalizace chránila buňky hepatocelulárního karcinomu před účinkem ionizační radioterapie; umlčení dráhy Hh pomocí protilátky proti Shh a pomocí Gli1 siRNA zvrátilo tento jev a buňky byly následně k terapii citlivé [66]. Jako další příklad lze uvést studie kastračně rezistentního karcinomu prostaty, kdy kombinace umlčení fosfolipázy Ce a inhibice Gli faktorů pomocí GANT61 vedla ke zvýšení citlivosti buněk vůči enzalutamidu, který je jedním z mála účinných léků na tento typ karcinomu [67].
Závěr
Z výše popsaného souhrnu je zřejmé, že výzkum signální dráhy Hh od jejího popsání v roce 1980 pokračuje poměrně rychle. Dráha Hh je zásadní pro správný embryonální vývoj. I když se zdá, že základní kostra signální dráhy je dobře prozkoumaná, stále chybí některé důležité informace o jejím fungování. Není například známý přesný mechanizmus, jakým Ptch blokuje receptor Smo. Informace o propojení Hh signalizace s jinými signálními dráhami, popř. informace o aktivaci Hh komponent pomocí jiných signálních drah určitě není kompletní a na tomto poli může dojít k mnoha průlomovým objevům. Aberantní aktivace dráhy Hh je spojená s rozvojem různých typů nádorů. Poznatky o tom, že dráha Hh je velice důležitá v iniciaci, růstu, rozvoji i udržení nádorového bujení, následoval úspěšný vývoj cílených Hh inhibitorů. Problematická je ovšem nízká účinnost mnohých z nich, přítomnost závažných nežádoucích účinků nebo vznikající rezistence k dané léčbě. Hh inhibitory jsou stále testovány v různých preklinických i klinických studiích, většinou se jedná o inhibitory receptoru Smo. Snad se brzy objeví další klinické studie testující např. léčbu pomocí specifických inhibitorů faktorů Gli. Můžeme doufat, že některé z klinických studií přinesou takové výsledky, které umožní uvedení alespoň některých inhibitorů do klinické praxe a výrazně zlepší nové možnosti léčby onkologických pacientů.
Práce byla podpořena institucionálním projektem Univerzity Karlovy PROGRES Q25.
This work was supported by the institutional project of Charles University PROGRES Q25.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Mgr. Kateřina Kreisingerová
Ústav lékařské biochemie a laboratorní diagnostiky
1. LF UK a VFN
Kateřinská 32
121 08 Praha 2
e-mail: katerina.vlckova@lf1.cuni.cz
Obdrženo/Submitted: 28. 10. 2019
Přijato/Accepted: 24. 2. 2020
Zdroje
1. Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila. Nature 1980; 287 (5785): 795–801. doi: 10.1038/287795a0.
2. Ingham PW, McMahon AP. Hedgehog signaling in animal development: paradigms and principles. Genes Dev 2001; 15 (23): 3059–3087. doi: 10.1101/gad.938601.
3. Machold R, Hayashi S, Rutlin M et al. Sonic hedgehog is required for progenitor cell maintenance in telencephalic stem cell niches. Neuron 2003; 39 (6): 937–950. doi: 10.1016/s0896-6273 (03) 00561-0.
4. Lowry WE, Richter L, Yachechko R et al. Generation of human induced pluripotent stem cells from dermal fibroblasts. Proc Natl Acad Sci U S A 2008; 105 (8): 2883–2888. doi: 10.1073/pnas.0711983105.
5. Watkins DN, Berman DM, Burkholder SG et al. Hedgehog signaling within airway epithelial progenitors and in small-cell lung cancer. Nature 2003; 422 (6929): 313–317. doi: 10.1038/nature01493.
6. Hanna A, Shevde LA. Hedgehog signaling: modulation of cancer properties and tumor microenvironment. Mol Cancer 2016; 15 : 24. doi: 10.1186/s12943-016-0509-3.
7. Skoda AM, Simovic D, Karin V et al. The role of the Hedgehog signaling pathway in cancer: A comprehensive review. Bosn J Basic Med Sci 2018; 18 (1): 8–20. doi: 10.17305/bjbms.2018.2756.
8. Katoh Y, Katoh M. Hedgehog target genes: mechanisms of carcinogenesis induced by aberrant Hedgehog signaling activation. Curr Mol Med 2009; 9 (7): 873–886. doi: 10.2174/156652409789105570.
9. Milla LA, Gonzalez-Ramirez CN, Palma V. Sonic Hedgehog in cancer stem cells: a novel link with autophagy. Biol Res 2012; 45 (3): 223–230. doi: 10.4067/S0716-97602012000300004.
10. Vlčková K, Ondrušová L, Vachtenheim J et al. Survivin, a novel target of the Hedgehog/GLI signaling pathway in human tumor cells. Cell Death Dis 2016; 7: e2048. doi: 10.1038/cddis.2015.389.
11. Seto M, Ohta M, Asaoka Y et al. Regulation of the Hedgehog signaling by the mitogen-activated protein kinase cascade in gastric cancer. Mol Carcinog 2009; 48 (8): 703–712. doi: 10.1002/mc.20516.
12. Stecca B, Mas C, Clement V et al. Melanomas require HEDGEHOG-GLI signaling regulated by interactions between GLI1 and the RAS-MEK/AKT pathways. Proc Natl Acad Sci U S A 2007; 104 (14): 5895–5900. doi: 10.1073/pnas.0700776104.
13. Dennler S, Andre J, Alexaki I et al. Induction of sonic hedgehog mediators by transforming growth factor-beta: Smad3-dependent activation of Gli2 and Gli1 expression in vitro and in vivo. Cancer Res 2007; 67 (14): 6981–6986. doi: 10.1158/0008-5472.CAN-07-0491.
14. Dennler S, Andre J, Verrecchia F et al. Cloning of the human GLI2 promoter: transcriptional activation by transforming growth factor-beta via SMAD3/beta-catenin cooperation. J Biol Chem 2009; 284 (46): 31523–31531. doi: 10.1074/jbc.M109.059964.
15. Riobo NA, Lu K, Ai X et al. Phosphoinositide 3-kinase and Akt are essential for sonic Hedgehog signaling. Proc Natl Acad Sci U S A 2006; 103 (12): 4505–4510. doi: 10.1073/pnas.0504337103.
16. Gu D, Xie J. Non-canonical Hh signaling in cancer-current understanding and future directions. Cancers (Basel) 2015; 7 (3): 1684–1698. doi: 10.3390/cancers7030857.
17. Pietrobono S, Gagliardi S, Stecca B. Non-canonical Hedgehog signaling pathway in cancer: activation of GLI transcription factors beyond Smoothened. Front Genet 2019; 10 : 556. doi: 10.3389/fgene.2019.00556.
18. Archer TC, Weeraratne SD, Pomeroy SL. Hedgehog-GLI pathway in medulloblastoma. J Clin Oncol 2012; 30 (17): 2154–2156. doi: 10.1200/JCO.2011.41.1181.
19. Pellegrini C, Maturo MG, Di Nardo L et al. Understanding the molecular genetics of basal cell carcinoma. Int J Mol Sci 2017; 18 (11): E2485. doi: 10.3390/ijms18112485.
20. Thayer SP, di Magliano MP, Heiser PW et al. Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis. Nature 2003; 425 (6960): 851–856. doi: 10.1038/nature02009.
21. Abe Y, Tanaka N. The Hedgehog signaling networks in lung cancer: The mechanisms and roles in tumor progression and implications for cancer therapy. Biomed Res Int 2016; 2016 : 7969286. doi: 10.1155/2016/7969286.
22. Bigelow RL, Chari NS, Unden AB et al. Transcriptional regulation of bcl-2 mediated by the sonic Hedgehog signaling pathway through Gli-1. J Biol Chem 2004; 279 (2): 1197–1205. doi: 10.1074/jbc.M310589200.
23. Regl G, Kasper M, Schnidar H et al. Activation of the BCL2 promoter in response to Hedgehog/GLI signal transduction is predominantly mediated by GLI2. Cancer Res 2004; 64 (21): 7724–7731. doi: 10.1158/0008-5472.CAN-04-1085.
24. Kurita S, Mott JL, Cazanave SC et al. Hedgehog inhibition promotes a switch from Type II to Type I cell death receptor signaling in cancer cells. PLoS One 2011; 6 (3): e18330. doi: 10.1371/journal.pone.0018330.
25. Meister MT, Boedicker C, Klingebiel T et al. Hedgehog signaling negatively co-regulates BH3-only protein Noxa and TAp73 in TP53-mutated cells. Cancer Lett 2018; 429 : 19–28. doi: 10.1016/j.canlet.2018.04.025.
26. Abe Y, Oda-Sato E, Tobiume K et al. Hedgehog signaling overrides p53-mediated tumor suppression by activating Mdm2. Proc Natl Acad Sci U S A 2008; 105 (12): 4838–4843. doi: 10.1073/pnas.0712216105.
27. Matějka VM, Fínek J, Králíčková M. Epithelial-mesenchymal transition in tumor tissue and its role for metastatic spread of cancer. Klin Onkol 2017; 30 (1): 20–27. doi: 10.14735/amko201720.
28. Gonzalez DM, Medici D. Signaling mechanisms of the epithelial-mesenchymal transition. Sci Signal 2014; 7 (344): re8. doi: 10.1126/scisignal.2005189.
29. Riaz SK, Ke Y, Wang F et al. Influence of SHH/GLI1 axis on EMT mediated migration and invasion of breast cancer cells. Sci Rep 2019; 9 (1): 6620. doi: 10.1038/s41598-019-43093-x.
30. Wang L, Jin JQ, Zhou Y et al. Gli is activated and promotes epithelial-mesenchymal transition in human esophageal adenocarcinoma. Oncotarget 2018; 9 (1): 853–865. doi: 10.18632/oncotarget.22856.
31. Wang F, Ma L, Zhang Z et al. Hedgehog signaling regulates epithelial-mesenchymal transition in pancreatic cancer stem-like cells. J Cancer 2016; 7 (4): 408–417. doi: 10.7150/jca.13305.
32. Liu Q, Sheng W, Dong M et al. Gli1 promotes transforming growth factor-beta1 - and epidermal growth factor-induced epithelial to mesenchymal transition in pancreatic cancer cells. Surgery 2015; 158 (1): 211–224. doi: 10.1016/j.surg.2015.03.016.
33. Maitah MY, Ali S, Ahmad A et al. Up-regulation of sonic Hedgehog contributes to TGF-beta1-induced epithelial to mesenchymal transition in NSCLC cells. PLoS One 2011; 6 (1): e16068. doi: 10.1371/journal.pone.0016068.
34. Neelakantan D, Zhou H, Oliphant MU et al. EMT cells increase breast cancer metastasis via paracrine GLI activation in neighbouring tumour cells. Nat Commun 2017; 8 : 15773. doi: 10.1038/ncomms15773.
35. Yoo YA, Kang MH, Lee HJ et al. Sonic Hedgehog pathway promotes metastasis and lymphangiogenesis via activation of Akt, EMT, and MMP-9 pathway in gastric cancer. Cancer Res 2011; 71 (22): 7061–7070. doi: 10.1158/0008-5472.
36. Fan HX, Wang S, Zhao H et al. Sonic Hedgehog signaling may promote invasion and metastasis of oral squamous cell carcinoma by activating MMP-9 and E-cadherin expression. Med Oncol 2014; 31 (7): 41. doi: 10.1007/s12032-014-0041-5.
37. Chen JS, Huang XH, Wang Q et al. Sonic Hedgehog signaling pathway induces cell migration and invasion through focal adhesion kinase/AKT signaling-mediated activation of matrix metalloproteinase (MMP) -2 and MMP-9 in liver cancer. Carcinogenesis 2013; 34 (1): 10–19. doi: 10.1093/carcin/bgs274.
38. Holčaková J, Nekulová M, Orzol P et al. Mechanisms of drug resistance and cancer stem cells. Klin Onkol 2014; 27 (Suppl 1): S34–S41. doi: 10.14735/amko20141s34.
39. Takebe N, Miele L, Harris PJ et al. Targeting Notch, Hedgehog, and Wnt pathways in cancer stem cells: clinical update. Nat Rev Clin Oncol 2015; 12 (8): 445–464. doi: 10.1038/nrclinonc.2015.61.
40. Po A, Ferretti E, Miele E et al. Hedgehog controls neural stem cells through p53-independent regulation of Nanog. EMBO J 2010; 29 (15): 2646–2658. doi: 10.1038/emboj.2010.131.
41. Gopinath S, Malla R, Alapati K et al. Cathepsin B and uPAR regulate self-renewal of glioma-initiating cells through GLI-regulated Sox2 and Bmi1 expression. Carcinogenesis 2013; 34 (3): 550–559. doi: 10.1038/emboj.2010.131.
42. Clement V, Sanchez P, de Tribolet N et al. HEDGEHOG-GLI1 signaling regulates human glioma growth, cancer stem cell self-renewal, and tumorigenicity. Curr Biol 2007; 17 (2): 165–172. doi: 10.1016/j.cub.2006.11.033.
43. Cochrane CR, Szczepny A, Watkins DN et al. Hedgehog signaling in the maintenance of cancer stem cells. Cancers (Basel) 2015; 7 (3): 1554–1585. doi: 10.3390/cancers7030851.
44. Campbell V, Copland M. Hedgehog signaling in cancer stem cells: a focus on hematological cancers. Stem Cells Cloning 2015; 8 : 27–38. doi: 10.2147/SCCAA.S58613.
45. Cooper MK, Porter JA, Young KE et al. Teratogen-mediated inhibition of target tissue response to Shh signaling. Science 1998; 280 (5369): 1603–1607. doi: 10.1126/science.280.5369.1603.
46. Xin M. Hedgehog inhibitors: a patent review (2013-present). Expert Opin Ther Pat 2015; 25 (5): 549–565. doi: 10.1517/13543776.2015.1019864.
47. Maughan BL, Suzman DL, Luber B et al. Pharmacodynamic study of the oral Hedgehog pathway inhibitor, vismodegib, in patients with metastatic castration-resistant prostate cancer. Cancer Chemother Pharmacol 2016; 78 (6): 1297–1304. doi: 10.1007/s00280-016-3191-7.
48. Berlin J, Bendell JC, Hart LL et al. A randomized phase II trial of vismodegib versus placebo with FOLFOX or FOLFIRI and bevacizumab in patients with previously untreated metastatic colorectal cancer. Clin Cancer Res 2013; 19 (1): 258–267. doi: 10.1158/1078-0432.CCR-12-1800.
49. National Library of Medicine, Bethesda (MD, US), c2000 [online]. Dostupné z: https: //clinicaltrials.gov/ct2/home.
50. Casey D, Demko S, Shord S et al. FDA approval summary: Sonidegib for locally advanced basal cell carcinoma. Clin Cancer Res 2017; 23 (10): 2377–2381. doi: 10.1158/1078-0432.CCR-16-2051.
51. Study of patidegib topical gel, 2%, for the reduction of disease burden of persistently developing basal cell carcinomas (BCCs) in subjects with basal cell nevus syndrome (Gorlin syndrome) [online]. Dostupné z: https: //clinicaltrials.gov/ct2/show/NCT03703310?term=patidegib&draw=2&rank=1.
52. Norsworthy KJ, By K, Subramaniam S et al. FDA approval summary: Glasdegib for newly diagnosed acute myeloid leukemia. Clin Cancer Res 2019; 25 (20): 6021–6025. doi: 10.1158/1078-0432.CCR-19-0365.
53. Stanton BZ, Peng LF. Small-molecule modulators of the sonic Hedgehog signaling pathway. Mol Biosyst 2010; 6 (1): 44–54. doi: 10.1039/b910196a.
54. Michaud NR, Wang Y, McEachern KA et al. Novel neutralizing Hedgehog antibody MEDI-5304 exhibits antitumor activity by inhibiting paracrine Hedgehog signaling. Mol Cancer Ther 2014; 13 (2): 386–398. doi: 10.1158/1535-7163.
55. Lauth M, Bergstrom A, Shimokawa T et al. Inhibition of GLI-mediated transcription and tumor cell growth by small-molecule antagonists. Proc Natl Acad Sci U S A 2007; 104 (20): 8455–8460. doi: 10.1073/pnas.0609699104.
56. Reda J, Vachtenheim J, Vlckova K et al. Widespread expression of Hedgehog pathway components in a large panel of human tumor cells and inhibition of tumor growth by GANT61: Implications for cancer therapy. Int J Mol Sci 2018; 19 (9): E2682. doi: 10.3390/ijms19092682.
57. Pan D, Li Y, Li Z et al. Gli inhibitor GANT61 causes apoptosis in myeloid leukemia cells and acts in synergy with rapamycin. Leuk Res 2012; 36 (6): 742–748. doi: 10.1016/j.leukres.2012.02.012.
58. Tong W, Qiu L, Qi M et al. GANT-61 and GDC-0449 induce apoptosis of prostate cancer stem cells through a GLI-dependent mechanism. J Cell Biochem 2018; 119 (4): 3641–3652. doi: 10.1002/jcb.26572.
59. Vlčková K, Réda J, Ondrušová L et al. GLI inhibitor GANT61 kills melanoma cells and acts in synergy with obatoclax. Int J Oncol 2016; 49 (3): 953–960. doi: 10.3892/ijo.2016.3596.
60. Beauchamp EM, Ringer L, Bulut G et al. Arsenic trioxide inhibits human cancer cell growth and tumor development in mice by blocking Hedgehog/GLI pathway. J Clin Invest 2011; 121 (1): 148–160. doi: 10.1172/JCI42874.
61. Peer E, Tesanovic S, Aberger F. Next-generation Hedgehog/GLI pathway inhibitors for cancer therapy. Cancers (Basel) 2019; 11 (4): 538. doi: 10.3390/cancers11040538.
62. Kim J, Tang JY, Gong R et al. Itraconazole, a commonly used antifungal that inhibits Hedgehog pathway activity and cancer growth. Cancer Cell 2010; 17 (4): 388–399. doi: 10.1016/j.ccr.2010.02.027.
63. Kim J, Aftab BT, Tang JY et al. Itraconazole and arsenic trioxide inhibit Hedgehog pathway activation and tumor growth associated with acquired resistance to smoothened antagonists. Cancer Cell 2013; 23 (1): 23–34. doi: 10.1016/j.ccr.2012.11.017.
64. Gonnissen A, Isebaert S, McKee CM et al. The hedgehog inhibitor GANT61 sensitizes prostate cancer cells to ionizing radiation both in vitro and in vivo. Oncotarget 2016; 7 (51): 84286–84298. doi: 10.18632/oncotarget.12483.
65. Li J, Cai J, Zhao S et al. GANT61, a GLI inhibitor, sensitizes glioma cells to the temozolomide treatment. J Exp Clin Cancer Res 2016; 35 (1): 184. doi: 10.1186/s13046-016-0463-3.
66. Chen YJ, Lin CP, Hsu ML et al. Sonic Hedgehog signaling protects human hepatocellular carcinoma cells against ionizing radiation in an autocrine manner. Int J Radiat Oncol Biol Phys 2011; 80 (3): 851–859. doi: 10.1016/j.ijrobp.2011.01.003.
67. Sun W, Li L, Du Z et al. Combination of phospholipase Ce knockdown with GANT61 sensitizes castration-resistant prostate cancer cells to enzalutamide by suppressing the androgen receptor signaling pathway. Oncol Rep 2019; 41 (5): 2689–2702. doi: 10.3892/or.2019.7054.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek EditorialČlánek Aktuality z odborného tiskuČlánek Predstavujeme nové knihyČlánek Oncology in pictures
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Editorial
- Hladiny NT-proBNP a troponínu T u onkologických pacientov – stručný prehľad
- Význam aberantně aktivované dráhy Hedgehog/Gli pro nádorovou progresi
- Vztah mezi polymorfismem XPG rs17655G>C a XPF rs1799801T>C a náchylností k malignímu melanomu kůže: důkazy ze studie případů a kontrol, systematický přehled a metaanalýza
- Hodnotenie kvality života u pacientov s nádormi hlavy a krku
- Vztah profilu exprese genu FOXR2 a markerů epitelo-mezenchymální tranzice u epiteliálního karcinomu vaječníků
- Súčasné možnosti včasného záchytu kardiotoxicity cytostatickej liečby
- Prognostické faktory přežití u pacientů s hepatocelulárním karcinomem léčených pomocí transarteriální chemoembolizace
- Kompletná odpoveď na chemoterapiu pri metastatickom karcinóme pankreasu spojenom s dvojitou heterozygotnou zárodočnou mutáciou génov BRCA2 a CHEK2 – kazuistika
- Dlouhodobý efekt erlotinibu u pacienta s nemalobuněčným karcinomem plic ve 3. linii protinádorové léčby – kazuistika
- Aktuality z odborného tisku
- Predstavujeme nové knihy
- Terapie trifluridinem/tipiracilem a regorafenibem u pacientů s předléčeným metastatickým kolorektálním karcinomem – zkušenosti z České republiky
- Oncology in pictures
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hladiny NT-proBNP a troponínu T u onkologických pacientov – stručný prehľad
- Kompletná odpoveď na chemoterapiu pri metastatickom karcinóme pankreasu spojenom s dvojitou heterozygotnou zárodočnou mutáciou génov BRCA2 a CHEK2 – kazuistika
- Hodnotenie kvality života u pacientov s nádormi hlavy a krku
- Význam aberantně aktivované dráhy Hedgehog/Gli pro nádorovou progresi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



