-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rizika solidních nádorů u heterozygotních přenašečů recesivních syndromů
Risks of Solid Tumors in Heterozygous Carriers of Recessive Syndromes
Expanded gene panel testing for hereditary cancer predispositions using massive parallel sequencing can identify heterozygous pathogenic variants of genes that cause autosomal recessive inherited cancer syndromes. There are no clinical guidelines regarding assessment of the risk of developing solid tumors or for developing appropriate surveillance strategies for heterozygotes for most of these genes, nor is there delineation with respect to the management for genetic testing of relatives and partners. Based on current knowledge, our aim was to create “Czech guidelines” for these cases. Here, we present an overview of the selected genes for autosomal recessive inherited tumor syndromes. The genes were divided into two groups: genes causing Fanconi anemia and genes causing other autosomal recessive inherited tumor syndromes. A summary table was created for each group. The table shows the population frequency of heterozygotes, the cancer risk for heterozygotes, the proposed surveillance strategy, and recommendations for family prediction and genetic testing of partners. Predictive testing should be performed in the case of heterozygotes that have an increased risk of cancer and/or as prerequisite to further reproduction of heterozygotes for a given gene with significant population frequency (this allows an estimation of the risk of autosomal recessive syndrome for children of heterozygote for mutation). These suggestions and recommendations are based on current knowledge and would need to be further corrected in the future based on increasing knowledge of existing or as-yet-unidentified genes.
The authors thank to all the staff of the Molecular Genetic Laboratory of the GENNET
Medical Genetics and Reproductive Medicine Center for their cooperation.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 21. 3. 2019Accepted: 2. 5. 2019
Keywords:
Mutation – hereditary cancer syndromes – autozomal recessive inheritance – heterozygote – risk of cancer – predictive testing
Autoři: Monika Koudová; Alena Puchmajerová
Působiště autorů: Centrum lékařské genetiky a reprodukční medicíny GENNET, Praha
Vyšlo v časopise: Klin Onkol 2019; 32(Supplementum2): 14-23
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2019S14Souhrn
Rozšířené panelové testování dědičných nádorových dispozic metodou masivně paralelního sekvenování vede k nálezu heterozygotních patogenních variant v genech pro autozomálně recesivně dědičné nádorové syndromy. Ke stanovení míry rizika rozvoje solidních nádorů a vhodné dispenzarizace pro heterozygoty nejsou u většiny těchto genů v současnosti k dispozici klinická guidelines ani není definován postup pro další genetické vyšetření v rodině a u jejich partnerů. Naším cílem bylo na základě současných poznatků vytvořit „české guidelines“ pro tyto případy. V předkládané práci uvádíme přehled vybraných genů pro autozomálně recesivně dědičné nádorové syndromy, rozdělený do dvou skupin – geny pro Fanconiho anémii a geny pro ostatní autozomálně recesivně dědičné nádorové syndromy. V každé části je vytvořena souhrnná tabulka, která obsahuje frekvenci heterozygotů mutace daného genu v populaci, riziko nádorů u heterozygotů a návrh dispenzarizace a doporučení pro predikce v rodině a ke genetickému vyšetření partnerů heterozygotů. Prediktivní vyšetření je vhodné provádět tam, kde je u heterozygotů zvýšené riziko nádorových onemocnění a/nebo je předpoklad další reprodukce a vyšší frekvence heterozygotů v populaci, tedy i zvýšeného rizika autozomálně recesivního syndromu pro děti nosiče mutace. Uvedené návrhy a doporučení vycházejí ze současných poznatků a v budoucnosti je bude potřeba dále korigovat dle přibývajících znalostí o stávajících nebo dalších, dosud neprozkoumaných, genech.
Klíčová slova:
dědičné nádorové syndromy – autozomálně recesivní dědičnost – heterozygot – mutace – riziko nádorů – prediktivní testování
Úvod
Hereditární nádorové syndromy představují okolo 3 % všech nádorových onemocnění a jsou způsobeny vrozenými nebo de novo vzniklými zárodečnými mutacemi v predisponujících, vysoce penetrantních genech. Vyšetřování germinálních nádorových dispozic je v současnosti prováděno metodou masivně paralelního sekvenování (next generation sequencing – NGS) a je cíleno na celé skupiny genů, které mohou být asociovány s rizikem rozvoje nádorového onemocnění, tzv. NGS onkopanely [1]. Většina genetických pracovišť v ČR využívá onkopanel CZECANCA (CZEch CAncer paNel for Clinical Application) vyvinutý Kleiblem et al (Ústav biochemie a experimentální onkologie, 1. LF UK v Praze) [2], který zahrnuje targetové sekvenování 226 genů pro klinické a/nebo výzkumné účely. Pro komplexní vyšetření genů je kromě detekce jednonukleotidových polymorfizmů a krátkých indelů nutné vyhodnotit i větší přestavby genů nebo jednotlivých exonů, tzv. variabilitu v počtu kopií (copy number variations – CNV). Detekce CNV je standardně prováděna pomocí analýzy MLPA (multiplex ligation-dependent probe amplification) s využitím komerčních kitů pro jednotlivé geny [3]. S rozvojem bioinformatické analýzy je vyhodnocení CNV možné také na základě principu normalizace vzorků amplikonového sekvenování panelu z hlediska hloubky sekvenování a výpočtu multifaktoriálních dat pro jednotlivé amplikony, jako např. ONCOCNV [4] nebo CNVkit [5]. Hodnocení klinického významu nalezených variant podléhá kodifikovaným pravidlům dle ACMG [6], ENIGMA [7] a Sherloc [8]. Od ledna 2018 je minimální počet reportovaných genů v souvislosti s úhradou genetického laboratorního vyšetření ze zdravotního pojištění pacienta ČR v rámci tzv. Stratifikace výkonů odbornosti 816 (Laboratoř lékařské genetiky) definován balíčkovým výkonem 94981 – Hereditární nádorové syndromy (NGS do 100 genů). Vykázání a úhrada tohoto výkonu ze zdravotního pojištění je podmíněna kompletním NGS vyšetřením vč. CNV předem definovaných 22 genů – ATM, APC, BARD1, BRCA1, BRCA2, BRIP1, CDH1, CHEK2, EPCAM, MLH1, MSH2, MSH6, MUTYH, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, RAD51D, STK11, TP53 [9]. Tento výkon lze vykázat pouze jednou za život pojištěnce, ale vybrané geny nepokrývají veškeré potřeby klinické praxe, neboť nezahrnují všechny klinicky významné geny, jejichž vyšetření může být v indikovaných případech klinickým genetikem požadováno. Za optimální postup pro genetické laboratoře se proto v případě panelového sekvenování u pacienta doporučuje reportovat všechny zjištěné klinicky významné varianty class 4–5, tj. varianty suspektně patogenní a patogenní (dále v článku označené jako mutace) u všech klinicky významných genů daného onkopanelu. Laboratoř by měla ve svých standardních operačních postupech a na výsledné laboratorní zprávě vždy definovat seznam aktuálně hodnocených a reportovaných genů. Ten by měl být pravidelně aktualizován a postupně rozšiřován tak, jak budou k dispozici nová publikovaná guidelines a informace o klinickém významu dalších genů v asociaci s rizikem rozvoje nádorů.
S rozšířeným panelovým NGS testováním souvisí i vyšší záchyt tzv. neočekávaných nálezů, tj. nálezu patogenních variant v genech, které nemusí být vždy spojeny s daným nádorovým onemocněním vyskytujícím se u pacienta nebo v jeho rodině, ale jsou důležité z hlediska stanovení predispozice k jiným nádorům u pacienta nebo pro primární prevenci dědičného nádorového onemocnění dále v rodině. Mezi ně patří i prokázané heterozygotní mutace v genech pro autozomálně recesivně (AR) dědičné nádorové syndromy. Tyto geny patří do skupin genů většinou se střední až nízkou penetrancí (za arbitrárně stanovenou hranici se pro geny s nízkou penetrancí považuje relativní riziko ~2 a pro geny se střední penetrancí se relativní riziko vyskytuje v intervalu 2–5 [10]) a jejich mutace jsou v populaci relativně časté (1–30 %), na rozdíl od mutací vysoce penetrantních genů (~0,1–0,01 %). I když se tyto geny vyznačují klinicky méně závažným ovlivněním rizika onemocnění, jejich vysoká alelická frekvence umožňuje kooperativní účinek nízko či středně penetrantních alel, a tím mohou být příčinou zvýšeného výskytu nádorového onemocnění v rodinách [9]. Ke stanovení míry rizika rozvoje solidních nádorů a doporučení sledování heterozygotních nosičů mutací nejsou u většiny těchto genů v současnosti k dispozici klinická guidelines a není jasně definován postup vyšetřování dalších pokrevních příbuzných a partnerů k zajištění primární prevence AR dědičného onemocnění u dětí pacienta a v jeho rodině. Cílem tohoto článku je proto vytvořit „české guidelines“ pro tyto případy s ohledem na jejich četnost, abychom poskytovali těmto pacientům a jejich rodinám na všech genetických pracovištích optimální a srovnatelnou péči.
Autozomálně recesivně dědičné nádorové syndromy
AR dědičné nádorové syndromy jsou způsobeny bialelickými mutacemi genů kódujících enzymy zajištující reparaci DNA. Důsledkem poruchy těchto reparačních procesů je hypersenzitivita k určitým genotoxickým agens a narušení strukturní integrity chromozomů, proto hovoříme o tzv. syndromech chromozomální nestability. V předkládané práci uvádíme přehled vybraných genů pro AR dědičné nádorové syndromy rozdělený do dvou skupin – geny pro Fanconiho anémii a geny pro ostatní AR dědičné nádorové syndromy. V každé části je vytvořena jedna souhrnná tabulka, která je pak doplněna podrobnějšími informacemi v textu. V tabulce je k danému genu uvedena frekvence heterozygotů v populaci, riziko nádorů u heterozygotů, doporučení dispenzarizace, predikce v rodině a vyšetření partnera.
Fanconiho anémie
Fanconiho anémie (FA) je heterogenní onemocnění, v současné době je popsáno až 22 genů, které jsou za toto onemocnění zodpovědné. Podle mutovaného genu je pacient zařazen do příslušné komplementační skupiny [11,12]. Dědičnost je AR, v důsledku bialelické mutace příslušného genu. Výjimkou je autozomálně dominantní dědičná FA-R v důsledku heterozygotní mutace genu RAD51 a gonozomálně recesivní dědičná FA-B v důsledku hemizygotní mutace genu FANCB. Frekvence přenašečů FA v populaci je uváděna cca 1 z 181. Incidence FA v populaci je uváděna cca 1 z 130 000. Nejvíce pacientů (60–70 %) je zařazeno do komplementační skupiny FA-A v důsledku mutace genu FANCA, frekvence přenašečů je cca 1 z 235. FA je charakterizována typickými klinickými projevy, jako je malý vzrůst, mikrocefalie, skeletální anomálie, abnormální kožní pigmentace, opoždění vývoje, vrozené srdeční vady, vrozené vady ledvin, u některých typů FA i vrozené vady mozku. V první dekádě života se manifestuje pancytopenií, která vede k selhání kostní dřeně. Pacienti s FA mají zvýšené riziko hematologických malignit a solidních tumorů. Pro komplementační skupinu D1 není typickým projevem na rozdíl od ostatních skupin selhávání kostní dřeně, ale časně se manifestující leukemie a specifické solidní tumory, nejčastěji meduloblastom a Wilmsův tumor ledvin. Etiologicky vzniká v důsledku bialelické mutace genu BRCA2 [13,14]. Pro komplementační skupinu FA-S jsou typické i faciální stigmatizace, vysoké riziko nádorů, především karcinomu prsu a vaječníků. Etiologicky je zodpovědná bialelická mutace genu BRCA1, která bývá většinou letální, a dosud byly popsány jen ojedinělé případy [15,16]. U některých typů FA je zvýšené riziko nádorových onemocnění i u heterozygotů mutace příslušného genu (tab. 1). Frekvence heterozygotů mutace jednotlivých genů v populaci uvedená v tabulce je přibližná a je stanovena podle udávané frekvence FA v populaci 1 z 130 000 a je vypočtena podle odhadovaného zastoupení jednotlivých komplementačních skupin FA.
Nádorová onemocnění u nosičů mutace genů BRCA1 a BRCA2 a doporučená preventivní opatření jsou popsána v článku Foretové et al [17].
U nosiček mutace genu BRIP1 (BRCA1 interaction protein C-terminal helicase 1 gene) je podle NCCN (National Comprehensive Cancer Network) guidelines zvýšené riziko karcinomů ovaria stejného histologického typu jako u nosiček mutace BRCA genů [18–20]. Celoživotní riziko (do 80 let věku) je uváděno okolo 6 %. Jako preventivní opatření je uváděna preventivní adnexektomie, která by měla být provedena ve 45–50 letech života. V případě výskytu karcinomu ovaria v rodině v mladším věku se tato preventivní operace doporučuje i v mladším věku. Souvislost mutací genu BRIP1 se zvýšeným rizikem karcinomu prsu nebyla jednoznačně prokázána, i když je v některých publikacích možná souvislost uváděna vč. databází OMIM a ClinVar [21–23].
Gen PALB2 (partner a localizátor of BRCA2) je tumor supresorový gen kódující PALB2 protein, jehož funkcí je vázat a stabilizovat BRCA2 protein. Patří mezi středně penetrantní geny vyššího řádu pro dědičnou predispozici ke vzniku karcinomu prsu. U nosiček mutace genu PALB2 je výrazně zvýšené riziko vzniku karcinomu prsu, a to 2–6krát oproti běžné populaci – pro ženy ve věku 70 let se celoživotní kumulativní riziko karcinomu prsu pohybuje od 33 % (v případě negativní rodinné anamnézy) až po 58 % (v případě dvou a více pokrevních příbuzných s karcinomem prsu). Mírně zvýšené je také riziko vzniku dalších nádorů, především pankreatu, ovaria (u žen) a prostaty (u mužů).
S ohledem na funkční blízkost PALB2 s BRCA2 a podobné spektrum nádorové dispozice u nosičů mutací v těchto genech mají být nosičky patogenních mutací genu PALB2 zařazeny do sledovacích programů, stejně jako nosičky mutací v genu BRCA2 a v případě vysoké rodinné zátěže, kdy patogenní mutace segreguje s nádorovým onemocněním, i vč. doporučení preventivních chirurgických zákroků (preventivní adnexektomie a mastektomie) [18,19,22,24,25]. Asociace se zvýšeným rizikem karcinomu ovaria nebyla sice zatím u nosiček mutace genu PALB2 jednoznačně prokázána, přesto je vhodné tuto preventivní operaci doporučit minimálně v těch rodinách, kde se karcinom ovaria vyskytuje.
Nosičky mutací v genu RAD51C mají zvýšené riziko karcinomu ovarií – celoživotní riziko je udáváno 5–10 %, vyšší riziko karcinomu prsu u nosiček mutace genu RAD51C nebylo zatím jednoznačně prokázáno, i když mutace genu RAD51C byly popsány i v rodinách s karcinomem prsu. Literatura neudává doporučené sledování pro nosičky mutace v tomto genu, plán preventivního sledování pro nosičky mutace genu RAD51C se stanovuje především podle empirických rizik nádorových onemocnění stanovených na základě anamnestických údajů v rodině. Sledování na mamologii je u nosiček mutace genu RAD51C doporučováno, stejně jako u žen se středním rizikem karcinomu prsu, pokud z genealogie nevyplývá empirické riziko karcinomu prsu vyšší. U nosiček mutace genu RAD51C by ale měla být zvážena preventivní adnexektomie ve 45–50 letech (event. dříve, věk posuzovat podle nejčasnějšího výskytu karcinomu ovaria v rodině, podobně jako u nosiček mutace genu BRIP1) [18,20,22,23].
Gen XRCC2 se účastní v rámci 4dílného komplexu (RAD51B, RAD51C, RAD51D, XRCC2) opravy deoxyribonukleové kyseliny (DNA) – dvojvláknových zlomů homologní rekombinací – a je jedním z genů, které zřejmě zvyšují riziko karcinomu prsu. Asociace mutací tohoto genu s tímto nádorovým onemocněním a jinými nádory zatím ale není zcela jasná a bude v budoucnosti předmětem dalších studií. Literatura neudává doporučené sledování pro nosičky mutace v tomto genu, plán preventivního sledování pro nosičky mutace genu XRCC2 se stanovuje především podle empirických rizik nádorových onemocnění stanovených na základě anamnestických údajů v rodině.
V některých dostupných publikacích byl popsán vyšší záchyt mutace genů FANCA, FANCC, FANCD2, XRCC2, FANCI, FANCM u pacientů s nádorovým onemocněním, především s karcinomem prsu a pankreatu ve srovnání s neselektovanou populací. Střední riziko karcinomu prsu je uváděno u nosiček heterozygotní mutace genů FANCA, FANCC a FANCM [26–28]. Heterozygotní nosičství mutace genů FANCC a XRCC9 [27,29] je zřejmě rizikovým faktorem pro karcinom pankreatu. U heterozygotních nosičů mutace genů FANCD2 a FANCI je uváděno obecně vyšší riziko nádorových onemocnění, zatím není blíže specifikováno [30]. Literatura neudává doporučení ohledně preventivního sledování u nosičů/ek mutace v těchto genech v heterozygotním stavu. V případě nosičství mutace genů FANCA, FANCC, FANCM je vhodné ženy sledovat podobně jako ženy se středním rizikem karcinomu prsu, pokud z genealogie nevyplývá riziko vyšší. Preventivní opatření z důvodu rizik dalších nádorových onemocnění je vhodné určit podle rizik plynoucích z rodinné anamnézy.
U ostatních genů, které jsou popisovány v souvislosti s AR dědičnou FA, nebylo zvýšené riziko nádorových onemocnění pro jejich nosiče heterozygotní mutace popsáno.
Prediktivní vyšetření členů rodiny je vhodné tam, kde je u nosičů heterozygotní mutace zvýšené riziko nádorových onemocnění a/nebo kde je předpoklad další reprodukce a frekvence heterozygotů v populaci vyšší než 1/500 (0,2 %), neboť v takovém případě nosičům mutace doporučujeme i vyšetření partnera. Vyšetření partnera by mělo zahrnovat vyšetření celého genu. U genů s frekvencí heterozygotů v populaci méně než 1/500 je reziduální riziko AR dědičného onemocnění méně než 1/2 000, tj. 0,05 %. Naše závěry a doporučení shrnuje tab. 1.
Tab. 1. Komplementační skupiny Fanconiho anémie, jejich geny, riziko nádorových onemocnění u heterozygotů, frekvence heterozygotů v populaci. 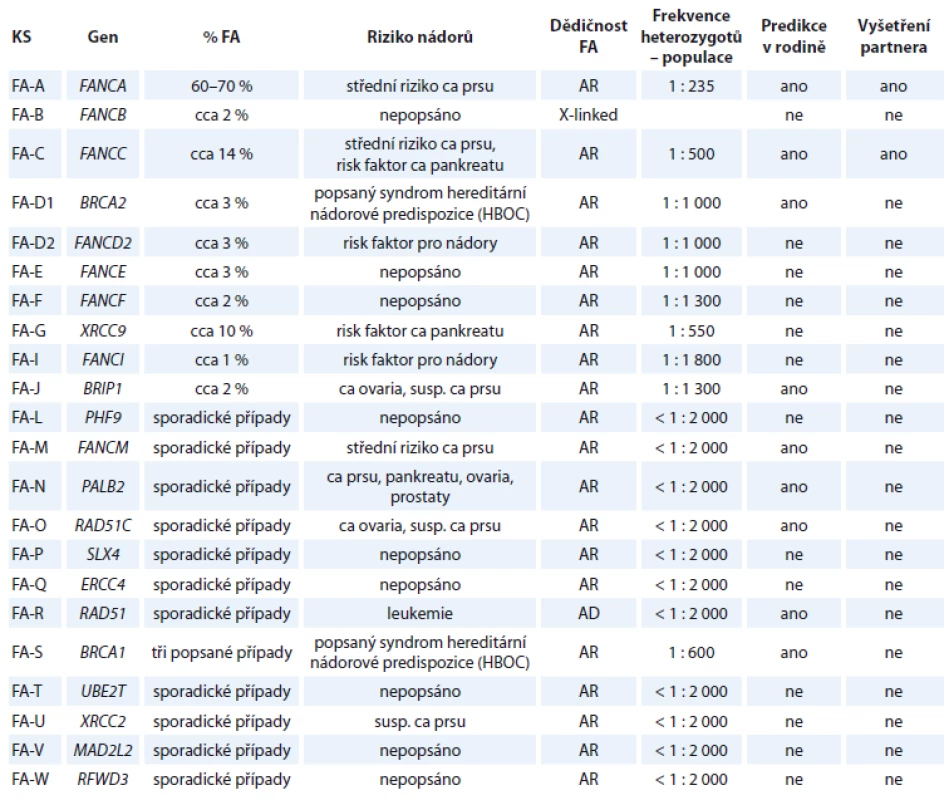
KS – komplementační skupina FA, FA – Fanconiho anémie, ca – karcinom, susp. – suspektní, HBOC – hereditární karcinom prsu a vaječníků, AR – autozomálně recesivní, AD – autozomálně dominantní, X-linked – dědičnost vázaná na chromozom X Geny pro ostatní AR dědičné nádorové syndromy
NBN
Gen NBN (NBS1; OMIM*602667) kóduje protein nibrin. Nibrin je spolu s proteiny MRE11/RAD50 součástí heterotrimerního MRN komplexu, který má základní úlohu v reparaci dvouřetězcových zlomů a procesech rekonfigurace imunitních genů, telomer a meiotické rekombinace. Bialelické mutace v genu NBN způsobují AR onemocnění Nijmegen Breakage Syndrom (NBS, OMIM*251260) charakterizovaný mikrocefalií, růstovou retardací, imunodeficiencí, hypersenzitivitou na ionizující záření a zvýšeným rizikem vzniku lymfoidních malignit [31]. Většina NBS pacientů pochází z východní Evropy a je homozygotní pro mutaci c.657_661del (dřívější název c.657del5, p.Lys219Asnfs*16, rs587776650), která vede ke vzniku dvou trunkačních fragmentů p26-and p70 nibrinu. Vysoká frekvence heterozygotních nosičů této mutace (1/130–1/177) byla popsána u slovanské populace v Polsku, České republice, Slovensku, Ukrajině a Německu, zvláště pak mezi pacienty s onkologickým onemocněním [31,32]. V literatuře je u nosičů této mutace opakovaně popsáno zvýšené riziko rozvoje nádorů (OR 2,79), především karcinomu prsu (OR 2,51), prostaty (OR 5,87) a lymfomů (OR 2,93) [33]. V publikované české studii se ale výskyt této mutace u pacientek s karcinomem prsu nelišil od výskytu v kontrolní populaci [34]. Dále byly v genu NBN ve zvýšené frekvenci prokázány dvě missense mutace. Mutace c.643C>T (p.Arg215Trp, rs34767364) je uváděna v databázi ClinVar jako patogenní ve vztahu k NBS a dle metaanalytických studií v heterozygotním stavu statisticky významně nezvyšuje riziko karcinomu prsu, ale může zvyšovat riziko jiných nádorů (OR 1,77) [33]. Místo mutace je lokalizováno mezi dvěma BRCT (C-terminální doména proteinu BRCA1) doménami a poškozuje jejich orientaci, tím je po indukci poškození DNA znemožněna vazba histonu γ-H2AX, což vede ke zpoždění v reparaci dvouřetězcových zlomů DNA (double strand break) [35]. Mutace c.511A>G (p.Ile171Val, rs61754966) genu NBN změnou struktury proteinu vede k poškození jedné z N-terminálních BRCT domén, což naruší interakci s dalšími proteiny DNA reparace a buněčné regulace. Mutace byla popsána u slovanských pacientů s NBS. Dle metaanalýz je u nosičů této mutace zvýšené riziko rozvoje nádorů (OR 3,93), především lymfomů (OR 25,98) [36], ale jedná se o mutaci s vysokou četností v evropské populaci – 0,2 % (ExAC). Ve vztahu k nádorovým onemocněním bychom za rizikovou alelu s mírnou až střední penetrancí mohli považovat mutaci c.657del5, ostatní dvě mutace c.643C>T a c.511A>G bychom ve vztahu k nádorům v současnosti měli hodnotit spíše jako risk faktory a dát doporučení ke sledování dle empirického rizika vyplývajícího z rodinné anamnézy. Konkrétní plán sledování pro nosiče mutace c.657del5 NBN genu literatura neuvádí. Pro ženy platí doporučení jako u žen se středně zvýšeným rizikem karcinomu prsu, event. vyšším, pokud tomu bude odpovídat empirické riziko vyplývající z rodinné anamnézy (viz Clausovy tabulky k odhadu empirického rizika na www.linkos.cz):
- samovyšetření prsů každý měsíc;
- klinické vyšetření 1krát ročně;
- ultrazvukové vyšetření prsu nebo mamografie 1krát ročně (metodu určí radiodiagnostik podle charakteru prsní žlázy) od 40 let, u pozitivní rodinné anamnézy o 10 let dříve, než byl nejčasnější výskyt nádoru v rodině;
- gynekologické vyšetření 1krát ročně vč. transvaginálního ultrazvuku.
Pro muže doporučujeme populační screening karcinomu prostaty pohmatem skrz konečník a z krve stanovení prostatického antigenu 1krát ročně s časnějším začátkem, tj. od 45 let, event. se začátkem 5–10 let před výskytem karcinomu prostaty v rodině. Pro ženy i muže dále platí běžný populační screening kolorektálního karcinomu – test na okultní krvácení do stolice 1krát ročně od 50 let, od 55 let kolonoskopické vyšetření (při negativitě 1krát za 10 let) nebo test na okultní krvácení do stolice 1krát za 2 roky a event. další vyšetření s přihlédnutím k případným jiným onkologickým onemocněním v rodině. Nosiči mutací NBN genu mohou být více citliví na ionizující záření, proto je vhodné pokud možno snížit frekvenci rentgenového záření a vyvarovat se nadměrnému slunění (ultrafialové (UV) záření).
Vzhledem k tomu, že se všechny tři uvedené mutace genu NBN vyskytují v české populaci ve zvýšené frekvenci a současně patří mezi nejčastěji detekované, doporučujeme v případě jejich nálezu prediktivní vyšetření pokrevních příbuzných, tj. rodičů (k určení dědičné linie mutace), sourozenců a dětí. Pro nosiče mutace pak nastavení vhodné onkologické prevence, a pokud jsou ve fertilním věku a plánují rodinu, provést vyšetření genu NBN u jejich partnerů k prevenci NBS v rodině. Za dostatečné lze považovat vyšetření partnerů na výše uvedené tři časté mutace NBN genu, neboť reziduální riziko přenašečství NBN mutace u partnera ze středoevropské populace je při negativním výsledku takového vyšetření nevýznamné, u pacienta z ostatních populacích je 1/514. Riziko postižení potomka NBS při negativním výsledku partnera ze středoevropské populace pak je téměř zanedbatelné, u partnera z jiné než středoevropské populace je 1/2 000.
RAD50
Gen RAD50 (OMIM* 604040) kóduje další z proteinů, který je součástí již zmíněného MRN komplexu. Bialelické mutace v tomto genu způsobují AR dědičný NBS-like syndrom (OMIM *613078), který je charakterizován podobným fenotypem jako NBS, tj. mikrocefalií, poruchou růstu, chromozomální instabilitou a středně zvýšenou citlivostí na radiaci, ale bez imunodeficitu a rizika malignity. Heterozygotní nosičství mutací v genu RAD50 bylo v literatuře spojováno s mírně zvýšeným rizikem rozvoje nádorových onemocnění, především karcinomu prsu a vaječníků, ale podle posledních studií jsou mutace spíše prediktorem horšího přežití pacientek s karcinomem prsu než zvýšeného rizika. Nosičství mutací v genu RAD50 je v naší populaci vzácné, v čínské populaci je frekvence tří nejčastějších mutací zastoupena v 0,18 % [37]. Jedná se o vzácné mutace a vzhledem k zatím ne zcela jasné asociaci se zvýšeným rizikem rozvoje nádorů není nutné v případě nálezu mutace provádět další prediktivní vyšetření v rodině. Rizika pro pokrevní příbuzné a sledování doporučit dle empirického rizika vyplývajícího z RA, riziko onemocnění NBS-like syndromem pro budoucí dítě nosiče mutace je zanedbatelné a není důvodem k vyšetření partnera.
MRE11
Gen MRE11 (OMIM*600814) kóduje další z proteinů MRN komplexu, který se vyznačuje endonukleázovou a 3’k 5’ exonukleázovou aktivitou. Bialelické mutace v tomto genu jsou příčinou vzácného AR dědičného onemocnění ataxia teleangiectasia-like disorder 1 (ATLD1, OMIM*604391), které je klinicky velmi podobné onemocnění ataxia teleangiectasia, ale pacienti nemají teleangiektázie. Homozygotní trunkační mutace genu MRE11 byly popsány také u AR onemocnění nephronophthisis-related ciliopathies (NPHP-RC), které patří mezi AR dědičné poruchy řasinek s multisystémovým postižením ledvin, sítnice, jater a mozečku [38]. Mutace v tomto genu jsou ještě vzácnější než v genu RAD50, v naší studii jsme tuto mutaci prokázali pouze u jedné pacientky. Jedná se o vzácné mutace a vzhledem k zatím ne zcela jasné asociaci se zvýšeným rizikem rozvoje nádorů není nutné provádět další prediktivní vyšetření v rodině nebo vyšetření partnera, podobně jako v případě mutace genu RAD50.
LIG4
Gen LIG4 (OMIM*601837) kóduje DNA ligázu LIG4, která je nezbytná pro rekombinaci a opravu DSB pomocí nehomologního spojování konců vláken DNA. Bialelické mutace v genu LIG4 způsobují vzácné AR onemocnění LIG4 syndrom (OMIM*606593), který klinicky upomíná NBS. Na světě bylo popsáno jen několik pacientů s tímto syndromem, mutace tohoto genu jsou v naší populaci vzácné. Dle některých studií se mohou polymorfizmy genu LIG4 podílet na multifaktoriálním „risk skóre“ rozvoje karcinomu prsu pravděpodobně z důvodu ovlivnění DNA reparace [39]. Vzhledem k uvedenému není v současnosti nutné provádět další prediktivní vyšetření v rodině nebo vyšetření partnera.
MUTYH
Gen MUTYH (MYH; OMIM*604933) kóduje enzym MYH glykosylázu, která se podílí na odstraňování chyb replikace DNA při přípravě k dělení buněk. Bialelické zárodečné mutace v genu MUTYH způsobují AR dědičnou polypózu střev (MUTYH-asociovaná polypóza, MAP, OMIM*608456) charakterizovanou mnohočetnými střevními polypy, s průměrným věkem diagnózy kolem 55 let (počet polypů je celkově menší než u FAP, pohybuje se od 5 do několika set). Pacienti s MAP mají zvýšené riziko rozvoje kolorektálního karcinomu a také polypózy horního gastrointestinálního traktu (tubulární nebo tubulovilózní adenomy) [40]. Frekvence přenašečů mutace MUTYH genu je v evropské populaci odhadována na 1/80 (1–1,5 %), ale popsané mutace vykazují významnou populační specificitu. V severozápadní Evropě převažují dvě mutace – c.536A>G (p.Tyr179Cys, rs34612342, dříve označovaná jako Y165C) v exonu 7 a c.1187G>A (p.Gly396Asp, rs36053993, dříve G382D) v exonu 13, které tvoří až 80 % všech reportovaných mutací MUTYH genu, zatímco v asijské populaci nebyly tyto mutace zatím popsány [41].
U heterozygotů patogenní mutace MUTYH genu je popsáno asi 2krát zvýšené riziko rozvoje kolorektálního karcinomu (colorectal cancer – CRC) od 45 let (OR 1,5–2,1), které odpovídá riziku CRC u prvostupňových příbuzných pacienta se sporadickým časným CRC [41]. Některé studie uvádějí také 2krát zvýšené riziko karcinomu prsu, především ve specifických populacích (židovská, holandská) [42], v italské populaci dokonce i u mužů [43]. Mírně zvýšená nad běžné populační riziko jsou i rizika rozvoje dalších nádorových onemocnění (dělohy, žaludku, jater), sumárně jsou však tato rizika stále spíše nízká, bez speciálních doporučení stran preventivního sledování [44].
Pro nosiče mutace hodnotíme riziko CRC a doporučujeme sledování jako pokrevním příbuzným pacienta se sporadickým CRC ve věku do 45 let, tj. empirické riziko CRC je 5krát zvýšené nad populační riziko, které je v ČR 3,13 % pro ženy a 6,44 % pro muže. Pro ženy platí doporučení jako u žen se středně zvýšeným rizikem karcinomu prsu, event. vyšším, pokud tomu bude odpovídat empirické riziko vyplývajícího z rodinné anamnézy (viz Clausovy tabulky k odhadu empirického rizika na www.linkos.cz). Doporučené schéma sledování u nosičů mutace genu MUTYH:
koloskopické vyšetření ve 2–5letých intervalech od 45 let (5letý interval v případě normálního nálezu v tlustém střevě, při nálezu benigních změn každé 2–3 roky dle typu změn, jako je četnost a velikost adenomů, dysplastické změny), u pozitivní rodinné anamnézy je vhodné začít se sledováním o 5–10 let dříve před nejčasnějším výskytem nádoru v rodině;
- test na okultní krvácení do stolice 1krát ročně (mezi koloskopiemi), při makroskopickém výskytu krve ve stolici koloskopie okamžitě, test na okultní krvácení neprovádět;
- další vyšetření s přihlédnutím k případným jiným onkologickým onemocněním v rodině.
- Pro ženy dále vhodné:
- samovyšetření prsů každý měsíc;
- klinické vyšetření 1krát ročně;
- ultrazvukové vyšetření prsu nebo mamografie 1krát ročně (metodu určí radiodiagnostik podle charakteru prsní žlázy) od 40 let, u pozitivní rodinné anamnézy o 10 let dříve, než byl nejčasnější výskyt nádoru v rodině;
- gynekologické vyšetření 1krát ročně vč. transvaginálního ultrazvuku.
Pro muže platí dále populační screening karcinomu prostaty.
Doporučujeme prediktivní vyšetření pokrevních příbuzných a pro nosiče mutace pak nastavení vhodné onkologické prevence a v případě plánování reprodukce vyšetření genu MUTYH u jejich partnerů k prevenci MAP v rodině. Za dostatečné lze považovat vyšetření partnerů na výše uvedené dvě nejčastější mutace MUTYH genu, neboť reziduální riziko přenašečství MUTYH mutace u partnera z evropské populace bude při negativním výsledku vyšetření nevýznamné.
ATM
Gen ATM (OMIM* 607585) kóduje protein, který je umístěn primárně v jádře buněk, kde pomáhá řídit rychlost růstu a dělení buněk. Hraje také důležitou roli v normálním vývoji a aktivitě několika tělesných systémů, vč. nervového a imunitního systému, kde pomáhá rozpoznávat vlákna DNA poškozená jak chemickými látkami, tak zářením. Bialelické zárodečné mutace v genu ATM způsobují onemocnění ataxia teleangiectasia (AT). Klinickému obrazu dominují neurologické příznaky (cerebelární ataxie s rozvojem již v době, kdy dítě začíná chodit) a teleangiektázie bulbů a v oblastech exponovaných slunečnímu záření (přítomné kolem 7. roku věku). Pacienti mají defekt buněčné i protilátkové imunity a jsou infertilní. Dvě třetiny pacientů mají zvýšenou hladinu sérového alfa-fetoproteinu. Až 30 % pacientů s AT onemocní nádorem, nejčastěji se jedná o leukemie a lymfomy, v dospělosti je riziko rozvoje i jiných nádorů (např. žaludku, meduloblastomu, gliomu). V rámci léčby je u pacientů s AT nutné vyvarovat se zvýšené radiační zátěže, nelze používat konvenční dávky radioterapie ani radiomimetické chemoterapie. Frekvence přenašečů mutace ATM genu je odhadována v populaci až na 1 % a popsány jsou populačně specifické mutace (např. u Amišů nebo na Sardinii) [45]. Nosičky mutace ATM genu mají až 3–5krát zvýšené riziko karcinomu prsu (celoživotní kumulativní riziko je cca 38 %, celkově se pohybuje dle studií mezi 17–52 %) a měly by být sledovány od 40 let dle doporučení pro ženy s vysokým rizikem karcinomu prsu vč. každoroční magnetické rezonance prsou. Riziko rozvoje karcinomu prsu se zdá být závislé na typu mutace ATM genu, například missence mutace c.7271T>G (p.Val2424Gly, rs28904921) je díky dominantně negativními vlivu na funkci proteinu spojena až s 69% rizikem karcinomu prsu, tedy mnohem vyšším, než je udáváno u jiných trunkačních mutací [46]. Dle NCCN není u nosiček ATM mutace jasně prokázán benefit z provedení preventivní bilatelární mastektomie ke snížení rizika, ale na základě nálezu nebo rodinné anamnézy lze tento výkon i u těchto pacientek doporučit. Ačkoli je některými studiemi uváděno i mírně zvýšené riziko karcinomu vaječníků, není důvodem k preventivní operaci. Dle NCCN studie WECAR prokázala zvýšené riziko vzniku kontralatelárního karcinomu prsu po expozici radiaci u nosiček ATM mutace, ale jiná metaanalýza neprokázala kontraindikaci radiační terapie standardními dávkami záření, v současnosti tedy dle NCCN neexistují jednoznačné důkazy proti radiační terapii pacientek – nosiček ATM mutace, ale je vhodné k tomuto riziku v rámci léčby pacientky přihlédnout. Některé studie popisují asi 2–3krát vyšší riziko rozvoje i dalších nádorů, především gastrointestinálního traktu (karcinom slinivky, jícnu, žaludku a kolorekta), prostaty a lymfoblastických malignit, ale jasné schéma doporučeného sledování literatura neuvádí [45]. U nosičů mutace je popsána vyšší mortalita nejen z důvodu rizika rozvoje nádorů, ale i rizika rozvoje ischemické choroby srdeční [46].
Pro nosičky mutace ATM platí doporučení jako pro ženy s vysokým rizikem vzniku karcinomu prsu:
- samovyšetření prsů každý měsíc;
- klinické vyšetření 1krát ročně;
- harmonogram vyšetření prsů od 40 let (u pozitivní rodinné anamnézy o 10 let dříve, než byl nejčasnější výskyt nádoru v rodině) – střídat po půlročních intervalech ultrazvuk a magnetickou rezonanci, event. mamografii – vhodné individuálně posuzovat, zhodnotí radiodiagnostik podle typu žlázy, po profylaktické bilaterální mastektomii roční kontroly prsů vhodnou zobrazovací metodou;
- gynekologické vyšetření 2krát ročně vč. transvaginálního ultrazvuku.
Pro muže je vhodný populační screening karcinomu prostaty, ale s časnějším začátkem od 45 let. Dále pro muže i ženy doporučujeme:
- koloskopické vyšetření ve 3–5letých intervalech od 45 let (5letý interval v případě normálního nálezu v tlustém střevě, při nálezu benigních změn každé 2–3 roky dle typu změn, jako je četnost a velikost adenomů, dysplastické změny), u pozitivní rodinné anamnézy je vhodné začít se sledováním o 5–10 let dříve před nejčasnějším výskytem nádoru v rodině;
- test na okultní krvácení do stolice 1krát ročně (mezi koloskopiemi);
- další vyšetření s přihlédnutím k případným onkologickým onemocněním v rodině, vhodný ultrazvuk břišních orgánů každoročně od 30 let;
- ochranu před ionizujícím zářením – pokud možno eliminovat či snížit frekvenci rentgenového vyšetření nebo terapie a vyvarovat se nadměrného slunění (UV záření).
Doporučujeme prediktivní vyšetření pokrevních příbuzných a pro nosiče mutace pak nastavení vhodné onkologické prevence a v případě plánování reprodukce vyšetření celého genu ATM u partnerů heterozygotů k prevenci AT u jejich dětí.
BLM
Gen BLM (RECQL3; OMIM*604610) kóduje protein z rodiny RecQ helikáz. Tyto enzymy uvolňují obě vlákna molekuly DNA, což je nezbytné pro několik procesů v buněčném jádru, vč. replikace DNA při přípravě buněčného dělení a opravy poškozené DNA. Helikázy RecQ pomáhají udržovat strukturu a integritu DNA, proto jsou někdy označovány jako tzv. „správci genomu“. Bialelické zárodečné mutace v genu BLM způsobují vzácné AR dědičné onemocnění Bloomův syndrom (BS, OMIM* 210900), který se vyznačuje prenatální i postnatální růstovou retardací, mikrocefalií, typickými kožními příznaky (teleangiektázie, hypo-a hyperpigmentace), opakovanými infekty z důvodu defektu imunity, předčasným stárnutím a zvýšeným rizikem vzniku různých typů nádorů – v dětství lymfoidních malignit (leukemie, Hodgkinův lymfom) a Wilmsova tumoru a v dospělosti malignitami gastrointestinálního traktu (jícnu, tlustého střeva) a ledvin. Muži s BS jsou často neplodní a u žen s BS se rozvíjí menopauza již po 30. roce. Pacienti s BS jsou fotosenzitivní, tj. mají zvýšenou citlivost na sluneční záření (typický erytém v obličeji po oslunění) [47]. Frekvence přenašečů mutací BLM genu se odhaduje na 1/1 800, s významně vyšším výskytem až 1/100 v aškenázské židovské populaci [48]. Ve slovanské populaci je nejčastější mutace c.1642C>T (p. Gln548Ter, rs200389141). Heterozygotní nosičství této mutace je v literatuře spojováno se zvýšeným rizikem rozvoje karcinomu prsu (asi dvojnásobně oproti populačnímu riziku), event. dalších nádorů (karcinomu kolorekta a ovaria) [49]. Konkrétní plán sledování pro nosiče mutace BLM genu literatura neuvádí. Pro ženy platí doporučení jako u žen se středně zvýšeným rizikem karcinomu prsu, event. vyšším, pokud tomu bude odpovídat empirické riziko vyplývající z rodinné anamnézy.
WRN
WRN gen (RECQL2; OMIM*604611) kóduje multifunkční jaderný protein z rodiny RecQ helikáz s exonukleázovou a helikázovou aktivitou a patří (podobně jako BLM) mezi geny, které kódují protein z rodiny RecQ helikáz. Bialelické mutace způsobují AR dědičný Wernerův syndrom (WS; OMIM* 277700), jehož klinické projevy předčasného stárnutí (katarakta, subkutánní kalcifikace, poruchy kožního pigmentu a vředy, předčasné šedivění a plešatost, předčasná arterioskleróza, předčasná menopauza, poruchy cyklu a neplodnost) se manifestují od puberty. U pacientů je významně zvýšené riziko rozvoje nádorů kůže (melanom, bazocelulární karcinom), mezenchymálních nádorů (liposarkom, fibrosarkom) a leukemie [50]. Frekvence přenašečů v populaci je odhadována na 1/300–500, v Japonsku, na Sardinii a v Itálii je WS častější, s frekvencí nosičů 1/150. Nejčastěji je v japonské populaci detekována splicing mutace c.3139-1G>C (rs113993961), u pacientů nejaponské populace mutace c.1105C>T (p.Arg369Ter, rs17847577), která je současně druhou nejčastější mutací v japonské populaci, proto se předpokládá, že jde o „mutační hotspot“ napříč všemi etnickými skupinami [51]. U heterozygotních nosiček mutací a variant v genu WRN byla v několika studiích popsána asociace se zvýšeným rizikem rozvoje karcinomu prsu [52,53]. Za současného stavu poznání považujeme mutaci genu WRN za variantu s mírnou až střední penetrancí ve vztahu ke karcinomu prsu a pro pacientky doporučujeme sledování jako u žen se středně zvýšeným celoživotním rizikem vzniku karcinomu prsu, event. vyšším, pokud tomu bude odpovídat empirické riziko vyplývající z rodinné anamnézy. Lze doporučit ochranu kůže před ionizujícím zářením a nadměrným sluněním (UV záření).
SBDS
SBDS gen (OMIM*607444) kóduje SBDS protein, jehož funkce není zatím přesně známa, dle studií má význam pro zpracování RNA a tvorbu ribozomů. Bialelické mutace způsobují AR dědičný Shwachman-Diamond syndrom (SDS; OMIM*260400), který se manifestuje chronickou leukopenií, poruchou zevně sekretorické funkce pankreatu, anomáliemi skeletu a dysfunkcí kostní dřeně vč. zvýšeného rizika rozvoje myelodysplastického syndromu / akutní myeloidní leukemie. Neutropenie se manifestuje často již v kojeneckém věku. U části pacientů se rozvíjí selhání kostní dřeně. Popisovány jsou také metafyzární dysostózy, anomálie žeber a hrudního koše, osteoporóza, neprospívání, porucha růstu. Frekvence přenašečů mutací SBDS v populaci je odhadována na 1/224 [54]. Nejčastěji detekovanými mutacemi u pacientů jsou c.258+2T>C (rs113993993) a c.183_184delinsCT (p.Lys62Ter, rs120074160) [55]. Byla popsána i komplexní alela c.[183_184delinsCT; 258+2T>C], která vzniká konverzí genu SBDS s jeho pseudogenem SBDSP, proto je nutné u pacienta s těmito mutacemi provést vyšetření rodičů k určení pozice mutací trans/cis. Ačkoli podle některých studií heterozygoti s jednou patogenní alelou SBDS mohou mít vyšší než průměrné riziko pro aplastickou anémii [56], tak dle jiných studií aplastická anémie nebyla pozorována u nosičů mutace z více než 200 rodin se SDS v Severní Americe a frekvence heterozygotní mutace byla stejná u pacientů s akutní myeloidní leukemií jako u zdravých kontrol [57]. Prediktivní vyšetření příbuzných doporučujeme z důvodu prevence SDS v rodině, ale při genetické konzultaci je nutné zdůraznit, že i když se jedná o AR dědičné onemocnění, tak v 10 % případů postižený jedinec nese jednu patogenní mutaci od rodiče a druhá vznikla de novo [58]. V případě plánování rodiny doporučujeme vyšetření partnera na výše uvedené dvě nejčastější mutace SBDS genu.
ERCC2
Gen ERCC2 (OMIM* 126340) kóduje XPD protein, který je podjednotkou skupiny proteinů TFIIH komplexu, jehož hlavní funkcí je genová exprese a reparace poškozené DNA vlivem UV záření, ale i radiací, chemickými látkami a volnými radikály. Bialelické mutace v genu ERCC2 způsobují vzácná AR dědičná onemocnění, Xeroderma pigmentosum, skupina D (XP typ D, OMIM*278730) a fotosenzitivní trichothiodystrofii 1 (OMIM*601675), ale popisovány jsou také kombinované klinické projevy XP s trichothiodystrofií (XP/TTD komplex) nebo s Cockaynovým syndromem (XP/CS komplex). Tato onemocnění jsou charakterizována hypersenzitivitou k UV záření s kožními a neurologickými projevy. Pacienti s XP mají kožní změny v oblastech exponovaných slunečnímu záření a rozvíjejí mnohočetné kožní malignity (bazocelulární a squamózní karcinomy, melanomy) s průměrným věkem manifestace prvního nádoru v 8 letech a zvýšené je riziko i dalších nádorů (melanomu oka, karcinomu jazyka, plic, žaludku, nádorů mozku a leukemie). Buňky pacientů s XP jsou hypersenzitivní i k mutagenům typu benzopyrenů obsažených v cigaretovém kouři, proto by pacienti měli být chráněni před pasivním kouřením. Na světě bylo popsáno jen několik pacientů s těmito syndromy. Mutace genu ERCC2 jsou v naší populaci vzácné, frekvence nosičů mutací ve všech genech asociovaných s XP (XPA, ERCC3, XPC, ERCC4, ERCC5) se odhaduje na 1/330 [59]. Heterozygotní mutace genu ERCC2 byly prokázány ve skupině pacientů s HBOC, vč. českých pacientů, nicméně také u kontrolní populace [60]. Asociace mutací ERCC2 v heterozygotním stavu s nádorovým onemocněním není zcela jasná a bude v budoucnosti předmětem dalších studií. Za současného stavu poznání se tedy nelze k jejich významu přesněji vyjádřit a ani je pro klinické účely dále v rodině nebo u partnerů nosičů vyšetřovat. Nosičům mutací genu ERCC2 lze mimo sledování dle empirických rizik doporučit roční kontroly kůže, ochranu proti UV záření (oděv, krémy s vysokým faktorem, brýle s UV filtrem, minimalizovat denní pobyt venku) a nekuřáctví.
Naše závěry a doporučení shrnuje tab. 2.
Tab. 2. Geny pro autozomálně recesivní dědičné syndromy, frekvence heterozygotů v populaci, riziko nádorů u heterozygotů a dispenzarizace, predikce v rodině a vyšetření partnera. 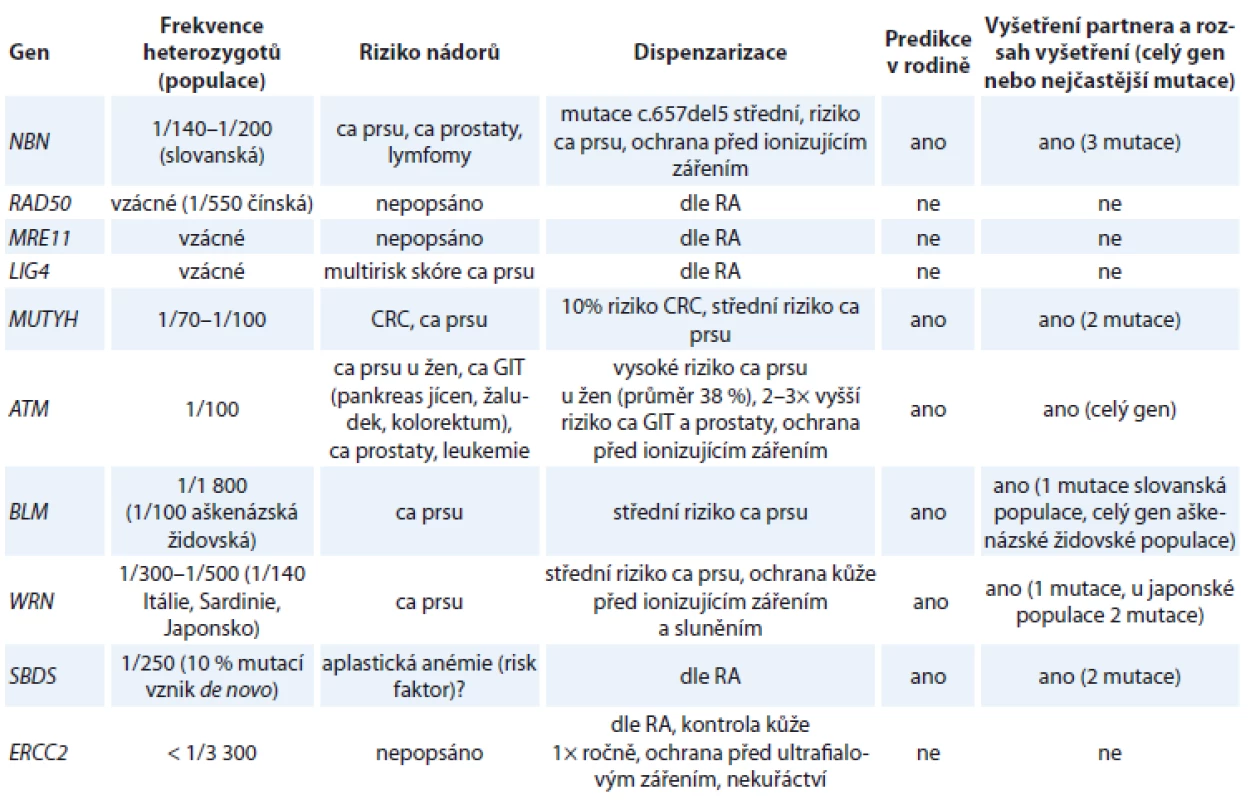
ca – karcinom, CRC – kolorektální karcinom, GIT – gastrointestinální trakt, RA – rodinná anamnéza Závěr
V případě onkogenetického vyšetření pacienta metodou NGS a nálezu mutace nebo suspektně patogenní varianty (class 4) v genu pro některý z AR dědičných nádorových syndromů, i mimo oblast naší indikace, bychom o tomto nálezu měli pacienta informovat a doporučit vhodné preventivní onkologické sledování dle rizika. Současně je nutné řešit i otázku prediktivního testování ostatních členů rodiny. Důležitými aspekty pro rozhodnutí, zda provádět prediktivní vyšetření dále v rodině nebo u partnerů pacienta, jsou jednak rizika nádorových onemocnění u heterozygotů mutace příslušného genu a jednak výše rizika onemocnění AR dědičným syndromem pro potomky, které se odvíjí od frekvence nosičů mutace příslušného genu v populaci. Prediktivní vyšetření členů rodiny na přítomnost mutace příslušného genu je proto vhodné nabídnout tam, kde je u nosičů heterozygotní mutace zvýšené riziko nádorových onemocnění a výsledek tohoto vyšetření ovlivní preventivní péči o tyto pacienty (preventivní sledování, operace). Pokud u heterozygotů určitého genu není zatím jasná asociace s nádory a je teprve předmětem dalšího zkoumání, není nyní přínosné prediktivní vyšetření v rodině dále provádět. V případě nálezu mutace u osob plánujících reprodukci je vhodné vyšetřit i jejich partnera, ale doporučení a rozsah tohoto vyšetření závisí na frekvenci heterozygotů v populaci partnera a zda se v daném genu vyskytují určité specifické mutace ve vysoké frekvenci, či nikoli. Vyšetření partnera tedy může zahrnovat celý gen (např. geny FANCA, ATM) nebo jen nejčastější mutace daného genu (např. geny NBN, SBDS, MUTYH apod.), neboť reziduální riziko nosičství mutace a riziko AR syndromu pro budoucí dítě po vyloučení těchto nejčastějších mutací u partnera bude velmi významně snížené až zanedbatelné. U partnerů –nosičů mutace genu BRCA1 – toto není obecně nabízeno i z důvodu převážně letálního efektu bialelické mutace genu BRCA1. V případě konsanguinity mezi partnery doporučujeme vyšetření partnera cíleně jen na zjištěnou mutaci příslušného genu, i u genů s nízkou frekvencí heterozygotů v populaci.
V souvislosti s přibývajícími znalostmi o daných genech a mutacích v rámci budoucího poznání a na základě výsledků dalšího zkoumání bude nutné námi uvedená doporučení a návrhy dále revidovat a zpřesňovat. V současné éře exomového a genomového sekvenování lze očekávat nové poznatky nejen k stávajícím, ale i dalším, dosud neprozkoumaným genům, kde bude také potřeba sjednotit postupy v rámci reportování nálezů a doporučení ke sledování a dalšímu testování v rodině pacienta.
Autorky práce děkují všem pracovníkům Molekulárně genetické laboratoře Centra lékařské genetiky a reprodukční medicíny GENNET za spolupráci.
Autorky deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Monika Koudová
Centrum lékařské genetiky a reprodukční medicíny GENNET
Kostelní 9
170 00 Praha 7
e-mail: monika.koudova@gennet.cz
Obdrženo: 21. 3. 2019
Přijato: 2. 5. 2019
Zdroje
1. Rahman N. Mainstreaming genetic testing of cancer predisposition genes. Clin Med 2014; 14 (4): 436–439. doi: 10.7861/clinmedicine.14-4-436.
2. Soukupova J, Zemankova P, Lhotova K et al. Validation of CZECANCA (CZEch CAncer paNel for Clinical Application) for targeted NGS-based analysis of hereditary cancer syndromes. PLoS One 2018; 13 (4): e0195761. doi: 10.1371/journal.pone.0195761.
3. MRC-Holland. [online]. Available from: https: //www.mlpa.com.
4. ONCOCNV: Detection of copy number changes in deep sequencing data. [online]. Available from: http: //boevalab.com/ONCOCNV.
5. CNVkit 0.9.6. [online]. Available from: https: //pypi.org/project/CNVkit/.
6. 3. Richards S, Aziz N, Bale S et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 2015; 17 (5): 405–424. doi: 10.1038/gim.2015.30.
7. 4. Eccles DM, Mitchell G, Monteiro AN et al. BRCA1 and BRCA2 genetic testing-pitfalls and recommendations for managing variants of uncertain clinical signifikance. Ann Oncol 2015; 26 (10): 2057–2065. doi: 10.1093/annonc/mdv278.
8. 5. Nykamp K, Anderson M, Powers M et al. Sherloc: a comprehensive refinement of the ACMG-AMP variant classification criteria. Genet Med 2017; 19 (10): 1105–1117. doi: 10.1038/gim.2017.37.
9. Informace pro poskytovatele hrazených služeb – laboratoř lékařské genetiky a sdílené odbornosti pro rok 2018. [online]. Dostupné na: https: //www.vzp.cz/o-nas/aktuality/informace-pro-poskytovatele-hrazenych-sluzeb-laborator-lekarske-genetiky-a-sdilene-odbornosti-pro-rok-2018.
10. Pohlreich P, Kleibl Z, Kleiblová P et al. Klinický význam analýz genů středního rizika pro hodnocení rizika vzniku karcinomu prsu a dalších nádorů v České republice. Klin Onkol 2012; 25 (Suppl): S59–S66. doi: 10.14735/amko20121S59.
11. Fanconi anemia. [online]. Dostupné z: https: //www.omim.org/search/?index=entry&start=1&limit=10&sort=score+desc%2C+prefix_sort+desc&search=FANCONI+ANEMIA.
12. Mehta PA, Tolar J. Fanconi Anemia. GeneReviews® 2018. [online]. Available from: https: //www.ncbi.nlm.nih.gov/books/NBK1401/.
13. Svojgr K, Sumerauer D, Puchmajerova A et al. Fanconi anemia with biallelic FANCD1/BRCA2 mutations – case report of a family with three affected children. Eur J Med Genet 2016; 59 (3): 152–157. doi: 10.1016/j.ejmg.2015.11.013.
14. Puchmajerová A, Švojgr K, Novotná D et al. Fanconi Anemia, Complementation Group D1 Caused by Biallelic Mutations of BRCA2 Gene – Case Report. Klin Onkol 2016; 29 (Suppl 1): S89–S92. doi: 10.14735/amko2016 S89.
15. Freire BL, Homma TK, Funari MF et al. Homozygous loss of function BRCA1 variant causing a Fanconi-anemia-like phenotype, a clinical report and review of previous patients. Eur J Med Genet 2018; 61 (3): 130–133. doi: 10.1016/j.ejmg.2017.11.003.
16. Sawyer SL, Tian L, Kähkönen M et al. Biallelic mutations in BRCA1 cause a new Fanconi anemia subtype. Cancer Discov 2014; 5 (2): 135–142. doi: 10.1158/2159-8290.CD-14-1156.
17. Foretová L, Navrátilová M, Svoboda M et al. Doporučení pro sledování žen se vzácnějšími genetickými příčinami nádorů prsu a ovarií. Klin Onkol 2019; 32 (Suppl 2): 2S6–2S13. doi: 10.14735/amko2019S6.
18. NCCN Guidelines 2019. Genetic/familial high-risk assessment: breast and ovarian. [online]. Available from: https: //www2.tri-kobe.org/nccn/guideline/gynecological/english/genetic_familial.pdf.
19. Ramus SJ, Song H, Dicks E et al. Germline mutations in the BRIP1, BARD1, PALB2, and NBN genes in women with ovarian cancer. J Natl Cancer Inst 2015; 107 (11). doi: 10.1093/jnci/djv214.
20. Eoh KJ, Kim JE, Park HS et al. Detection of germline mutations in patients with epithelial ovarian cancer using multi-gene panels: beyond BRCA1/2. Cancer Res Treat 2018; 50 (3): 917–925. doi: 10.4143/crt.2017.220.
21. Easton DF, Lesueur F, Decker B et al. No evidence that protein truncating variants in BRIP1 are associated with breast cancer risk: implications for gene panel testing. J Med Genet 2016; 53 (5): 298–309. doi: 10.1136/jmedgenet-2015-103529.
22. Lu HM, Li S, Black MH et al. Association of breast and ovarian cancers with predisposition genes identified by large-scale sequencing. JAMA Oncol 2018. doi: 10.1001/jamaoncol.2018.2956.
23. Sato K et al. Mutation status of RAD51C, PALB2 and BRIP1 in 100 Japanese familial breast cancer cases without BRCA1 and BRCA2 mutations. Cancer Sci 2017; 108 (11): 2287–2294. doi: 10.1111/cas.13350.
24. Shimelis H, LaDuca H, Hu C et al. Triple-negative breast cancer risk genes identified by multigene hereditary cancer panel testing. J Natl Cancer Inst 2018. doi: 10.1093/jnci/djy106.
25. Piffer A, Luporsi E, Mathelin C. PALB2, a major susceptibility gene for breast cancer. Gynecol Obstet Fertil Senol 2018; 46 (10–11): 701–705. doi: 10.1016/j.gofs.2018.08. 006.
26. Litim N, Labrie Y, Desjardins S et al. Polymorphic variations in the FANCA gene in high-risk non-BRCA1/2 breast cancer individuals from the French Canadian population. Mol Oncol 2013; 7 (1): 85–100. doi: 10.1016/j.molonc.2012.08.002.
27. Thompson ER, Doyle MA, Ryland GL et al. Exome sequencing identifies rare deleterious mutations in DNA repair genes FANCC and BLM as potential breast cancer susceptibility alleles. PLoS Genet 2012; 8 (9): e1002894. doi: 10.1371/journal.pgen.1002894.
28. Kiiski JI, Pelttari LM, Khan S. Exome sequencing identifies FANCM as a susceptibility gene for triple-negative breast cancer. Proc Natl Acas Sci USA 2014; 111 (42): 15172–15177. doi: 10.1073/pnas.1407909111.
29. van der Heijden MS, Yeo CJ, Hruban RH et al. Fanconi anemia gene mutations in young-onset pancreatic cancer. Cancer Res 2003; 63 (10): 2585–2588.
30. Seguí N, Mina LB, Lázaro C. Germline mutations in FAN1 cause hereditary colorectal cancer by impairing DNA repair. Gastroenterology 2015; 149 (3): 563–566. doi: 10.1053/j.gastro.2015.05.056.
31. Seemanova E, Varon R, Vejvalka J et al. The Slavic NBN Founder Mutation: a role for reproductive fitness? PLoS One 2016; 11 (12): e0167984. doi: 10.1371/journal.pone.0167984.
32. Maurer MH, Hoffmann K, Sperling K et al. High prevalence of the NBN gene mutation c.657-661del5 in Southeast Germany. J Appl Genet 2010; 51 (2): 211–214.
33. Gao P, Ma N, Li M et al. Functional variants in NBS1 and cancer risk: evidence from meta-analysis of 60 publications with 111 individual studies. Mutagenesis 2013; 28 (6): 683–697. doi: 10.1093/mutage/get048.
34. Mateju M, Kleiblova P, Kleibl Z et al. Germline mutations 657del5 and 643C>T (R215W) in NBN are not likely to be associated with increased risk of breast cancer in Czech women. Breast Cancer Res Treat 2012; 133 : 809–811. doi: 10.1007/s10549-012-2049-x.
35. di Masi A, Viganotti M, Polticelli F et al. The R215W mutation in NBS1 impairs gamma H2AX binding and affects DNA repair: molecular bases for the severe phenotype of 657del5/R215W Nijmegen breakage syndrome patients. Biochem Biophys Res Commun 2008; 369 (3): 835–840. doi: 10.1016/j.bbrc.2008.02.129.
36. Zhang Y, Zhou J, Lim CU. The role of NBS1 in DNA double strand break repair, telomere stability, and cell cycle checkpoint control. Cell Res 2006; 16 (1): 45–54. doi: 10.1038/sj.cr.7310007.
37. Fan C, Zhang J, Ouyang T et al. RAD50 germline mutations are associated with poor survival in BRCA1/2-negative breast cancer patients. Int J Cancer 2018; 143 (8): 1935–1942. doi: 10.1002/ijc.31579.
38. Hildebrandt F. Exome resequencing identifies novel NPHP genes, implicating DNA damage response signaling in the pathogenesis of ciliopathies. Cilia 2012; 1 (Suppl 1) O2. doi: 10.1186/2046-2530-1-S1-O2.
39. Xie S, Shan XF, Shang K et al. Relevance of LIG4 gene polymorphisms with cancer susceptibility: evidence from a meta-analysis. Sci Rep 2014; 4 : 6630. doi: 10.1038/srep06630.
40. Plevova P, Štekrova J, Kohoutova M et al. Familiární adenomatózní polypóza. Klin Onkol 2009; 22 (Suppl): S16–S19.
41. Aretz S, Genuardi M, Hes FJ et al. Clinical utility gene card for: MUTYH-associated polyposis (MAP), autosomal recessive colorectal adenomatous polyposis, multiple colorectal adenomas, multiple adenomatous polyps (MAP) – update 2012. Eur J Hum Genet 2013; 21 (1). doi: 10.1038/ejhg.2012.163.
42. Rennert G, Lejbkowicz F, Cohen I et al. MutYH mutation carriers have increased breast cancer risk. Cancer 2012; 118 (8): 1989–1993. doi: 10.1002/cncr.26506.
43. Rizzolo P, Silvestri V, Bucalo A et al. Contribution of MUTYH variants to male breast cancer risk: results from a multicenter study in Italy. Front Oncol 2018; 8 : 583. doi: 10.3389/fonc.2018.00583.
44. Win AK, Reece JC, Dowty JG. Risk of extracolonic cancers for people with biallelic and monoallelic mutations in MUTYH. Int J Cancer 2016; 139 (7): 1557–1563. doi: 10.1002/ijc.30197.
45. Gatti R, Perlman S. Ataxia-telangiectasia. GeneReviews 2016. [online]. Available from: https: //www.ncbi.nlm.nih.gov/books/NBK26468.
46. van Os NJ, Roeleveld N, Weemaes C M et al. Health risks for ataxia-telangiectasia mutated heterozygotes: a systematic review, meta-analysis and evidence-based guideline. Clin Genet 2016; 90 (2): 105–117. doi: 10.1111/cge.12710.
47. Cunniff C, Bassetti JA, Ellis NA. Bloom’s syndrome: clinical spectrum, molecular pathogenesis, and cancer predisposition. Mol Syndromol 2017; 8 (1): 4–23. doi: 10.1159/000452082.
48. Fu W, Ligabue A, Rogers KJ et al. Human RECQ helicase pathogenic variants, population variation and „missing“ diseases. Hum Mutat 2017; 38 (2): 193–203. doi: 10.1002/humu.23148.
49. Sokolenko AP, Iyevleva AG, Preobrazhenskaya EV et al. High prevalence and breast cancer predisposing role of the BLM c.1642 C>T (Q548X) mutation in Russia. Int J Cancer 2012; 130 (12): 2867–2873. doi: 10.1002/ijc.26342.
50. Oshima J, Martin GM, Hisama FM. Werner Syndrome. GeneReviews® 2016. [online]. Available from: https: //www.ncbi.nlm.nih.gov/books/NBK1514.
51. Yokote K, Chanprasert S, Lee L. WRN mutation update: mutation spectrum, patient registries, and translational prospects. Hum Mutat 2017; 38 (1): 7–15. doi: 10.1002/humu.23128.
52. Wang Z, Xu Y, Tang J et al. A polymorphism in Werner syndrome gene is associated with breast cancer susceptibility in Chinese women. Breast Cancer Res Treat 2009; 118 (1): 169–175. doi: 10.1007/s10549-009-0327-z.
53. Ding SL, Yu JC, Chen ST et al. Genetic variation in the premature aging gene WRN: a case-control study on breast cancer susceptibility. Cancer Epidemiol Biomarkers Prev 2007; 16 (2): 263–269. doi: 10.1158/1055-9965.EPI-06-0678.
54. Orphanet. The portal for rare diseases and orphan drugs. [online]. Available from: https: //www.orpha.net.
55. Nelson A, Myers K. Shwachman-Diamond Syndrome. Genereviews 2018. [online]. Available from: https: //www.ncbi.nlm.nih.gov/books/NBK1756/.
56. Calado RT, Graf SA, Wilkerson KL et al. Mutations in the SBDS gene in acquired aplastic anemia. Blood 2007; 110 (4): 1141–1146. doi: 10.1182/blood-2007-03-080044.
57. Aalbers AM, Calado RT, Young NS et al. Absence of SBDS mutations in sporadic paediatric acute myeloid leukaemia. Br J Haematol 2013; 160 (4): 559–561. doi: 10.1111/bjh.12134.
58. Baskin B, Steele L, Rommens JM et al. De novo mutations causing shwachman-diamond syndrome and a founder mutation in SBDS in the French Canadian population. J Invest Genom 2014. [online]. Available from: https: //medcraveonline.com/JIG/JIG-01-00008.php.
59. Rump A, Benet-Pages A, Schubert S et al. Identification and functional testing of ercc2 mutations in a multi-national cohort of patients with familial breast-and ovarian cancer. PLoS Genet 2016; 12 (8): e1006248. doi: 10.1371/journal.pgen.1006248.
60. Lehmann AR, McGibbon D, Stefanini M. Xeroderma pigmentosum Orphanet. J Rare Dis 2011; 6 : 70. doi: 10.1186/1750-1172-6-70.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2019 Číslo Supplementum2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- GAPPS – syndrom adenokarcinomu žaludku a mnohočetné polypózy žaludku v 8 rodinách testovaných v Masarykově onkologickém ústavu – prevence vč. profylaktické gastrektomie
- Syndrom BAP1 – predispozice k malignímu mezoteliomu, kožnímu a uveálnímu melanomu, renálnímu karcinomu a dalším nádorům
- Syndrom DICER1
- Rizika solidních nádorů u heterozygotních přenašečů recesivních syndromů
- Karcinom prsu u nosiček mutací v genu BRCA1/2 – léčíme ho jinak? Zaměřeno na systémovou terapii u mutací v genu BRCA1/2
- Editorial
- Zhodnocení účinnosti neoadjuvantní chemoterapie s platinovým derivátem u pacientek se zárodečnou mutací v genech BRCA a BRCA2 – retrospektivní analýza souboru pacientek s karcinomem prsu léčených v MOÚ Brno
- Dědičné mutace v genu CHEK2 jako příčina dispozice k nádorům prsu – typy mutací, jejich biologická a klinická relevance
- Dvacet let molekulární analýzy genů BRCA1 a BRCA2 v MOÚ – aktuální vývoj v klasifikaci nálezů
- Doporučení pro sledování žen se vzácnějšími genetickými příčinami nádorů prsu a ovarií
- Přínos masivního paralelního sekvenování pro diagnostiku dědičných forem nádorů ovaria v České republice
- Vzácné pediatrické ovariální tumory a jejich genetické příčiny
- Polypózy zažívacího traktu a Lynchův syndrom z pohledu patologa
- Nové poznatky o geneticky podmíněných nádorech tlustého střeva a polypózách gastrointestinálního traktu
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dědičné mutace v genu CHEK2 jako příčina dispozice k nádorům prsu – typy mutací, jejich biologická a klinická relevance
- Rizika solidních nádorů u heterozygotních přenašečů recesivních syndromů
- Doporučení pro sledování žen se vzácnějšími genetickými příčinami nádorů prsu a ovarií
- GAPPS – syndrom adenokarcinomu žaludku a mnohočetné polypózy žaludku v 8 rodinách testovaných v Masarykově onkologickém ústavu – prevence vč. profylaktické gastrektomie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



