-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaExtravazace (paravazace) cytostatik – doporučení pro standardní péči v rámci České republiky ze spolupráce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry
Extravasation (Paravasation) of Chemotherapy Drugs – Recommendations for Standard Care in the Czech Republic based on Consolations between Representatives of the Supportive Care Group of the Czech Society for Oncology, Oncology Section of the Czech Nurses Association, and the Society for Ports and Permanent Catheters
Background: Extravasation (paravasation) of chemotherapy drugs is a very significant complication in the treatment of cancer patients. Preventive and therapeutic interventions reduce the risk of this complication or the extent of its consequences. A working group of authors from expert groups prepared recommendations for standard care. Purpose: To prepare a basic summary of recommended interventions for daily practice, based on knowledge from long-term, proven, evidence-based practice or on consensus opinions of representatives of expert groups. Results: Preventive measures are essential and include early consideration of long-term venous access device indications, choice of injection site, venous line control before each chemotherapy drug application, and patient education. Interventions in cases of extravasation mainly involve the application of antidotes (dimethylsulfoxide, hyaluronidase, and dexrazoxane) and the application of dry cold or heat, depending on the type of cytostatic drug. Corticosteroids injected subcutaneously, moist heat or cooling, and compression, are not recommended. Conclusion: The recommended procedures will contribute to reducing the risk and consequences of extravasation. The range of recommended interventions can be expanded depending on individual clinical workplace policy and needs.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 28. 9. 2019
Accepted: 13. 10. 2019
Keywords:
nursing – extravasation
Autoři: S. Vokurka 1; V. Maňásek 2; D. Navrátilová Hrabánková 3; S. Šípová 1; L. Turková 4; E. Hajnová Fukasová 5; Z. Sýkorová 6; Š. Kozáková 7; R. Mazúr 8; J. Wintnerová 9
Působiště autorů: Onkologická a radioterapeutická klinika LF UK a FN Plzeň 1; Komplexní onkologické centrum, Nemocnice Nový Jičín 2; I. interní klinika – klinika hematologie VFN v Praze 3; Interní hematologická klinika FN Královské Vinohrady, Praha 4; Klinika onkologická FN Ostrava 5; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 6; Ústavní lékárna, Masarykův onkologický ústav, Brno 7; Nemocnice Znojmo 8; Klinika dětské hematologie a onkologie FN Motol, Praha 9
Vyšlo v časopise: Klin Onkol 2019; 32(6): 463-468
Kategorie: Sdělení
doi: https://doi.org/10.14735/amko2019463Souhrn
Východiska: Extravazace (paravazace) cytostatik jsou velmi významnou komplikací při léčbě onkologických pacientů. Preventivní a léčebné intervence snižují riziko komplikace nebo rozsah následků. Pracovní skupina autorů z odborných skupin připravila doporučení standardní péče. Cíl: Základní souhrn doporučených postupů pro základní denní praxi, definovaných na základě poznatků z dlouhodobé, ověřené, prokázané praxe nebo ze shodných názorů zástupců odborných skupin. Výsledky: Preventivní opatření jsou zásadním opatřením a zahrnují včasné zvážení indikace dlouhodobých žilních vstupů, volbu místa vpichu, kontrolu žilní linky před každou aplikací cytostatika a edukaci pacienta. Řešení extravazace především zahrnuje aplikaci antidot (dimethylsulfoxid, hyaluronidáza, dexrazoxan) a aplikaci suchého chladu nebo tepla podle typu cytostatika. Nejsou doporučovány kortikoidy subkutánně, vlhké teplo nebo chlazení, komprese. Závěr: Doporučené postupy přispívají k redukci rizika a následků extravazace. Individuálně na pracovištích může být rozsah doporučených intervencí rozšiřován.
Klíčová slova:
ošetřovatelství – extravazace
Úvod
Extravazace (paravazace) cytostatik z periferních žil jsou obávanou a reálnou komplikací při léčbě onkologických pacientů. Jde o velmi aktuální a s ohledem na možné zdravotní následky velmi důležitou problematiku, která na některých pracovištích není stále definována k řešení v žádném standardním postupu, příp. jsou některé doporučené intervence sporné, opomíjené či si vzájemně napříč rozličnými centry, příp. publikacemi, odporují. Tento dokument shrnuje potřebný a zcela základní souhrn poznatků odpovídajících péči založené na poznatcích z dlouhodobé, ověřené či důkazní praxe nebo vycházející ze shodných názorů expertů odborných pracovních skupin. Zdroje, ze kterých bylo čerpáno, jsou uvedeny samostatně na konci dokumentu [1–7].
Postupy a intervence uvedené v tomto doporučení lze považovat za základní a pro běžnou praxi napříč pracovišti ČR za plně realizovatelné, a tedy standardní. Tento dokument ve formě doporučení si neklade za cíl a ani nemůže vymezit rozsah poskytované péče při extravazaci, která individuálně na jednotlivých pracovištích může rozsah zde uvedeného výrazně překračovat a rozšiřovat.
Pracovní skupina, která připravila tento dokument, zahrnuje zástupce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry. Členové pracovní skupiny vyvinuli maximální snahu o vytvoření písemného dokumentu, který definuje několik prakticky nesporných a v běžné denní onkologické praxi českých center velmi dobře přijatelných a realizovatelných bodů standardní péče a ošetření v rámci extravazace cytostatik s přihlédnutím k běžné dostupnosti prostředků v ČR.
Definice extravazace (paravazace) cytostatika z periferní žíly
Jedná se o situaci, kdy dojde k úniku cytostatika aplikovaného nitrožilně mimo žilní lumen do okolních tkání. Podle typu cytostatika a uniklého objemu dochází k poškození tkání různé intenzity a rozsahu. Podle potenciálu působit poškození tkání se cytostatika dělí na vezikanty (zpuchýřující), iritanty (dráždivé) a nonvezikanty (nedráždivé) (tab. 1). V praxi musí být pozornost věnována všem případům extravazace s ohledem na možnost individuálně výraznějších reakcí i při úniku cytostatik nedráždivých (nonvezikanty).
Tab. 1. Cytostatika a další onkologická léčiva rozdělená podle potenciálu působit poškození tkání při extravazaci. 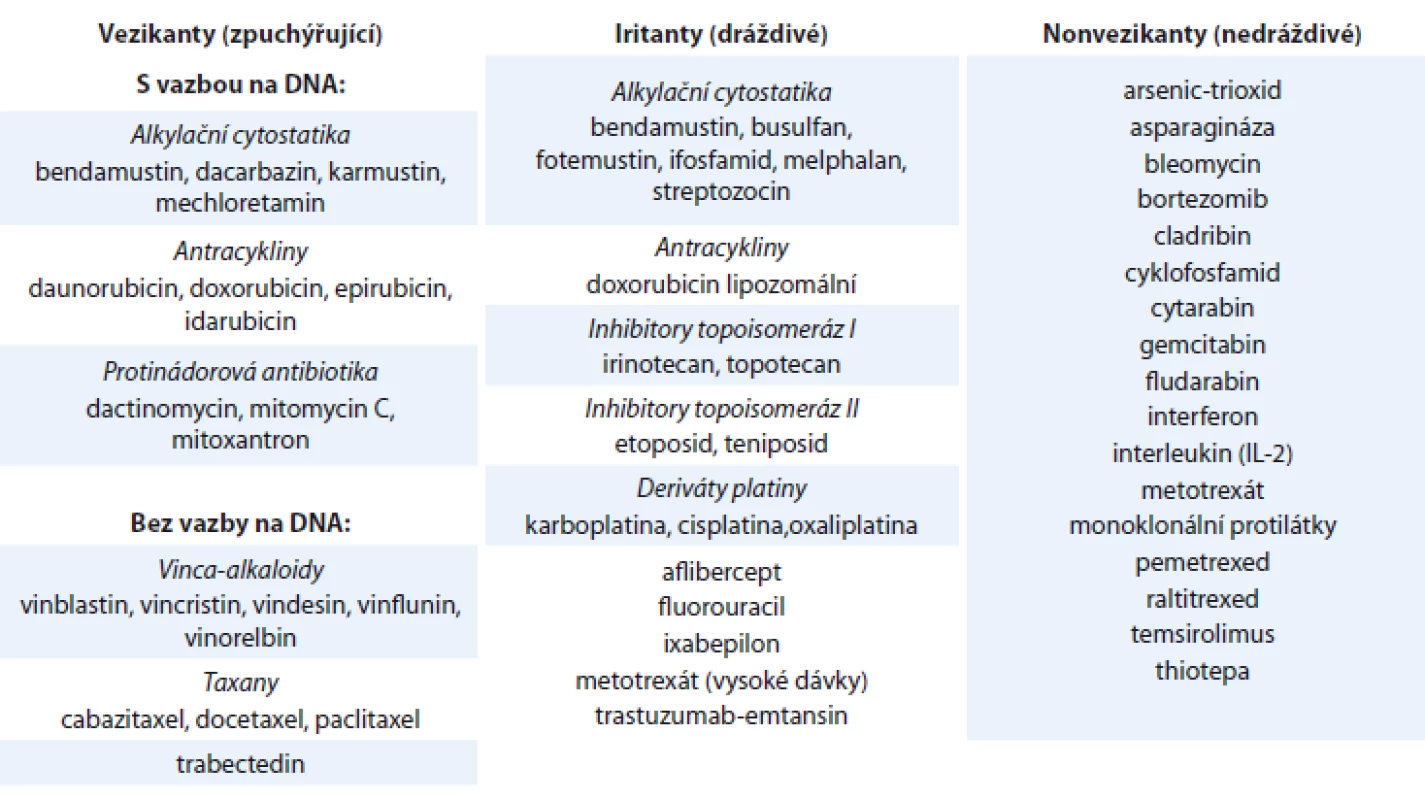
Zásady prevence extravazace
Preventivní opatření jsou zásadní podmínkou pro minimalizaci rizika extravazace a jejích následků. Je doporučeno:
- S ohledem na délku indikované chemoterapie, charakter cytostatik, způsob podání (několikahodinové až několikadenní kontinuální aplikace) a další individuální okolnosti (např. spolupráce pacienta, stav periferních žil horních končetin, potřeba dalších intravenózních (i.v.) aplikací) obecně upřednostnit volbu středně-a dlouhodobých žilních vstupů, jako jsou např. periferně zavedená centrální žilní kanyla (peripherally inserted central catheter – PICC), tunelizované centrální žilní katetry a porty (viz také dále odstavec Indikace permanentních žilních vstupů).
- Nezavádět periferní žilní vstup v oblasti kloubů, dolní končetiny, končetiny s lymfedémem nebo v oblasti, kde je riziko vzniku lymfedému (např. stav po exenteraci axily apod.), v místě hematomů a zánětů, při anamnéze opakovaně neúspěšných venepunkcí a v místě nebo distálně od místa předchozího náběru krve a nitrožilní aplikace. Rizikové jsou žíly drobné, fragilní, tvrdé, sklerotické, příliš pohyblivé (např. u seniorů). Rizikovými faktory pro extravazaci jsou stavy s insuficiencí cirkulace (Raynaudův syndrom, symptomatický diabetes mellitus, cévní onemocnění, lymfedém, syndrom horní duté žíly – vena cava superior), obezita, neuropatie omezující schopnost vnímat případný rozvoj paravazace, prolongovaná aplikace infuze.
- Upřednostňovat jako vhodné místo vstupu dostatečně široké žíly předloktí. Neměla by se používat volární (dlaňová) strana zápěstí a dolní končetiny, nejsou doporučeny žíly v kubitální jamce a na dorzu ruky. Individuálně lze při velmi dobré kvalitě žíly a spolupráci pacienta v případě nutnosti akceptovat i krátkodobé zavedení periferního žilního vstupu na dorzu ruky. Oblast dorza ruky však není obecně doporučena obzvlášť pro aplikaci zpuchýřujících cytostatik (vezikanty), kdy je nutno brát zřetel na těsný vztah šlach, svalů, cév a nervů v oblasti dorza ruky a s tím související vysoké nebezpečí závažných poškození až s nekrózou tkání při extravazaci rizikových cytostatik. Mezi ně řadíme především vezikanty, které se vážou na DNA a kde je poškození tkání nevratné, a vysoce riziková jsou také cytostatika ze skupiny vezikantů bez vazby na DNA (tab. 1).
- Kontrolovat žilní linku aspirací krve a proplachem 10–20 ml fyziologického roztoku před aplikací každého cytostatika.
- Edukovat pacienta o projevech extravazace a nutnosti hlášení, provádět pravidelné kontroly stavu a příznaků extravazace v pravidelných intervalech během aplikace.
Zásady řešení extravazace (schéma 1)
- Ihned ukončit aplikaci cytostatika, zachovat klid a rozvahu, uklidnit pacienta a komunikovat s ním, ponechat žilní vstup na místě, pokusit se o zpětné nasátí z postižené oblasti a poté vstup odstranit (v případě extravazace cytostatik ze skupiny taxanů (cabazitaxel, docetaxel, paclitaxel) a vinca-alkaloidů (vinblastin, vincristin, vindesin, vinorelbin) může být vstup ještě ponechán pro možnost využití k aplikaci hyaluronidázy), netlačit na postiženou oblast, žádné vlhké obklady (pouze suché působení tepla nebo chladu podle typu cytostatika – viz dále), elevace a úleva postižené končetiny, označení oblasti extravazace, vedení dokumentace.
- Informovat lékaře o vzniklé situaci k zajištění ordinace úkonů a dalších případných individuálních postupů dle metodik pracoviště (např. forma hlášení a evidence události, vedení dokumentace).
- Nejsou doporučovány kortikoidy injekčně k lokální aplikaci do postiženého místa.
- Aplikace speciálních antidot podle typu cytostatika:
Schéma 1. Extravazace (paravazace) cytostatik – schematické zobrazení. V případě extravazace do podkoží např. u portu nebo PICC katetru postupujte jako u paravenózní aplikace. 
PICC – periferně zavedená centrální žilní kanyla, SPC – Souhrn údajů o přípravku, i.v. – intravenózně, s.c. – subkutánně, DMSO – dimethylsulfoxid Dostupnost přípravků může být limitována registrací a dovozem. Je doporučeno vyvinout maximální snahu o zajištění pohotovostní zásoby na pracovišti.
4.1 DMSO 99% – „scavanger“ – vychytává volné kyslíkové radikály, urychluje clearance extravazátu z tkání a je doporučen pro lokální aplikaci po extravazaci antracyklinů (daunorubicin, doxorubicin, epirubicin, idarubicin), mitomycinu C a cisplatiny. V případě extravazace antracyklinů se DMSO aplikuje tehdy, když nebude použit dexrazoxan (viz níže). První dávka DMSO je aplikována optimálně do 10 min po paravazaci na místo postižení do oblasti velikostí dvakrát větší, než je postižená plocha, čtyři kapky na plochu povrchu kůže o velikosti 10 cm2, bez tlaku rozetřít sterilní gázou, 3krát denně po dobu min. 1 týdne (v případě extravazace doxorubicinu (TEVA) uvádí Souhrn údajů o přípravku (Summary of product characteristics – SPC) [7] aplikace minimálně 14 dní s chlazením oblasti po aplikaci). Místo nezakrývejte obvazem ani oděvem. Aktuální dostupnost v ČR: DMSO – Dimethylsulfoxid 99%, surovina (dimethylsulfoxid 99% 50 gm) v kapalném skupenství pro magistraliter přípravu v lékárně, expedice z lékárny individuálně v množství a způsobem dle potřeb a procesů pracoviště, použitelnost 6 měsíců.
4.2 Hyaluronidáza (150 U/ml) – v případě extravazace cytostatik ze skupiny taxanů (cabazitaxel, docetaxel, paclitaxel) a vinca-alkaloidů (vinblastin, vincristin, vindesin, vinorelbin). Enzymaticky degraduje kyselinu hyaluronovou, která je jednou z hlavních složek v mezibuněčném prostoru tkání. Odbourávání mezibuněčné hmoty a zvýšení permeability vazivových tkání zlepšuje absorpci uniklého cytostatika. V SPC s hyaluronidázou není exaktně stanoven postup pro použití v případě extravazace, nicméně obecně je doporučeno podání do 1 hod po parazavaci. Obvyklá dávka je 1 ml (150 IU) hyaluronidázy na 1 ml paravazátu [8]. V 1 ml aqua pro injectione může být naředěno 150–1 500 IU hyaluronidázy, 0,4 ml může být podáno kanylou těsně před odstraněním, zbylé množství se aplikuje do okolí paravazátu podkožně. Optimální je užití jehly o velikosti 25 G nebo 27 G a požadovaný objem podat v pěti dávkách do okolí paravazátu. Na každou aplikaci je vhodné užít jinou jehlu. Maximální denní dávky v chirurgii při i.v. aplikaci jsou do 4 500 U, resp. 30 ml. Aktuální dostupnost v ČR: Hylase Dessau, bal. à 10 amp. à 150 IU, SÚKL t. č. neregistrováno.
4.3 Dexrazoxan – chelatační činidlo, vazbou na železo omezuje vznik komplexů antracyklin železo produkujících kardiotoxické radikály. Uplatňuje se v případě řešení extravazací antracyklinů (daunorubicin, doxorubicin, epirubicin, idarubicin). Dexrazoxan byl ve studiích podáván nitrožilně po dobu 3 dnů (1 000, 1 000 a 500 mg/m2), s iniciální dávkou nejpozději 6 hod po extravazaci. S infuzí dexrazoxanu nemá být aplikován DMSO a studené obklady by měly být odstraněny 15 min před podáváním a během podávání dexrazoxanu. Je doporučeno podat dexrazoxan i.v. do velké žíly v oblasti vzdálené od místa extravazace, optimálně na kontralaterální končetině. Aktuální dostupnost v ČR: Cyrdanax 20 mg/ml inf. plv., dexrazoxanum 250 mg nebo 500 mg v lahvičce, úprava dávky, rekonstituce a další ředění dle příbalových instrukcí léčiva.
- Aplikace suchého tepla nebo chladu:
Ideálně např. ve formě gelových sáčků krytých do vhodné, suché bavlněné nebo lněné textilie nebo papírové utěrky, aby nedošlo k přímému kontaktu gelového sáčku a kůže.
Suché teplo – za účelem disperze a diluce extravazátu, použít v případě extravazace oxaliplatiny, taxanů a vinca-alkaloidů. Aplikovat v úvodu 20–60 min, dále 4krát denně 15–20 min po dobu 1–2 dnů.
Suchý chlad – za účelem ohraničení a neutralizace extravazátu, použít v případě extravazace cisplatiny ošetřované DMSO a dále vezikantů s vazbou na DNA (tab. 1), suchý chlad lze jinak využít také u extravazací všech dalších cytostatik, kromě těch doporučených k aplikaci suchého tepla. Aplikovat v úvodu 20–60 min, dále 4krát denně 15–20 min po dobu 1–2 dnů.
- Ochrana před působením slunce při extravazaci dacarbazinu.
- Zajištění následných kontrol a sledování vývoje.
Extravazace do podkoží z centrálního žilního vstupu
V případě extravazace do podkoží s dobrou dostupností (např. oblast nad membránou žilního portu nebo jeho okolí) lze použít zásady jako v případě extravazace z periferní žíly (zastavení infuze a aspirace roztoku ponechaným centrálním žilním katétrem) uvedené výše. Při horší lokalizovatelnosti extravazátu, větším objemu, podezření na kumulaci léčiva v mediastinu, pohrudnici nebo v podkožní oblasti hrudníku a krku je vždy nutné provést obratem vyšetření výpočetní tomografií k dokumentaci postižené oblasti. S ohledem na charakter cytostatika se doporučuje individuální plán péče ve spolupráci s hrudními chirurgy, pneumology a se zajištěním pečlivé observace s kontrolami vývoje v době alespoň do 2 týdnů (chirurgická intervence, podání antibiotik, intravenózních kortikoidů a analgetik). Dexrazoxan je doporučen při extravazaci antracyklinů.
Indikace permanentních žilních vstupů
Indikace pro elektivní zavedení střednědobého nebo dlouhodobého žilního vstupu v onkologii vychází ze zhodnocení stavu žilního systému pacienta, délky plánované terapie, vlastností léčiva a frekvence jeho podávání. Je vhodné vybrat optimální druh žilního vstupu před zahájením protinádorové léčby, indikace z důvodu vyčerpání periferního přístupu s poškozením žil by měla být minulostí.
- Hledisko časové – uvažujte o zavedení permanentního žilního vstupu v případě, že je plánována léčba delší než 1 měsíc. Volit lze mezi PICC kanylou, tunelizovanou centrální venózní kanylou a nitrožilním portem. Při trvání léčby do 3 měsíců může být optimální možností PICC, při předpokládané délce léčby více než 6 měsíců je doporučován port. Pro délku léčby 3–6 měsíců lze zvolit kterýkoli z uvedených vstupů, záleží především na stavu žilního systému a preferenci pacienta. Ambulantní dlouhodobá léčba s frekvencí podání léčiv každé 3–4 týdny je vhodná k zavedení portu, naopak u střednědobé terapie s častější aplikací do žilního řečiště je vhodnější PICC nebo tunelizovaná centrální venózní kanyla. Žilní vstup lze využít rovněž ke krevním odběrům, pacient nemusí podstupovat opakované venepunkce, což je výhodou zvlášť v případě léčby pacienta po chirurgické intervenci v axile.
- Hledisko cytostatika – do centrálního řečiště je doporučeno podávat především cytostatika, která mají chemické vlastnosti poškozující endotel, anebo ta, která nesou riziko poškození pacienta v případě extravazace. V tomto ohledu jsou nejnebezpečnější vezikanty, zpuchýřující cytostatika (tab. 1). Celá řada dalších cytostatik má potenciál poškození tkání, přičemž z běžně užívaných látek jde především o tato dráždivá cytostatika (iritanty) – melfalan, ifosfamid, etoposid, 5-fluorouracil, metotrexát, platinové deriváty, irinotekan a topotekan.
Modelové příklady:
- 4krát chemoterapie AC (doxorubicin, cyklofosfamid) při karcinomu prsu → PICC, 6 měsíců léčba AC-T (P) → port;
- malignity s dlouhodobou adjuvancí a/anebo s potenciálem více cyklů terapie, jako jsou např. kolorektální karcinom, karcinom ovaria, metastatický karcinom prsu → port;
- malignity s nejistou délkou léčby v úvodu, jako např. lokoregionálně pokročilý spinocelulární karcinom jícnu → PICC;
- nádory hlavy a krku, obzvláště v případě tracheostomie → PICC;
- lymfomy s bulky postižením → port.
Závěr
Zajištění spolehlivého a bezpečného žilního vstupu je nedílnou součástí péče o aktivně léčené onkologické pacienty. Z důvodu možných závažných trvalých následků extravazace rizikových cytostatik ze skupiny vezikantů a iritantů je nutné dodržovat doporučené postupy ve vztahu k prevenci a léčbě extravazace. V době narůstajícího počtu onkologických pacientů, ať už s vyššími riziky extravazace (vyšší věk pacientů, obezita, komorbidity), nebo naopak s předpokladem potřeby zachovaného periferního žilního řečiště do budoucna (nižší věk pacientů, prodloužení života obecně), je nezbytně nutné věnovat zvýšenou pozornost indikacím pro zavedení středně-nebo dlouhodobých žilních vstupů, které jsou navíc v dnešní době poměrně dobře dostupné.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Samuel Vokurka, Ph.D.
Onkologická a radioterapeutická klinika
LF UK a FN Plzeň
alej Svobody 80
304 60 Plzeň
e-mail: vokurka@fnplzen.cz
Obdrženo: 28. 9. 2019
Přijato: 13. 10. 2019
Zdroje
1. Pittiruti M, Capozzoli G, Delfino A (eds.). Venous access – a practical textbook. Rome: Antonio Delfino Editore 2018.
2. Maňásek V. Extravazace cytostatik – prevence a doporučené postupy. Klin Onkol 2016; 29 (2): 93–99. doi: 10.14735/amko201693.
3. Charvát J et al. Žilní vstupy dlouhodobé a střednědobé. Praha: Grada Publishing 2016.
4. Pérez Fidalgo JA, García Fabregat L, Cervantes A et al. Management of chemotherapy extravasation: ESMO–EONS Clinical Practice Guidelines. Ann Oncol 2012; 23 (Suppl 7): vii167–vii173. doi: 10.1093/annonc/mds294.
5. Mader I, Fürst-Weger PR, Mader RM et al. Extravasation of cytotoxic agents: compendium for prevention and management. New York: Springer 2010.
6. Gallieni M, Pittiruti M, Biffi R. Vascular access in oncology patients. CA Cancer J Clin 2008; 58 (6): 323–346. doi: 10.3322/CA.2008.0015.
7. SPC – DOXORUBICIN TEVA 2 mg/ml, prášek pro koncentrát pro infuzní roztok (č.j. 28185/2016). Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls124962/2009.
8. SPC – Hylase “Dessau” 150 IU. Prášek pro přípravu injekčního roztoku. Příloha č. 2 k rozhodnutí o převodu registrace sp.zn.sukls26323/2013.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2019 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- Tranzice péče o onkologické pacienty z dětského do dospělého věku
- Sarkopenie u metastatického kolorektálního karcinomu
- Nezhoubné nádory a pseudotumory v porta hepatis maskující perihilární cholangiokarcinom
- Epidemiologické trendy onkologických onemocnění u dětí a adolescentů v období 1994–2016 v České republice
- Ukrajinské údaje o prognostických faktorech a výsledcích léčby u pacientů s periferními T lymfomy
- Výsledky léčby bortezomibem a thalidomidem u nově diagnostikovaných netransplantovaných pacientů s mnohočetným myelomem jsou srovnatelné
- Analýza exprese dlouhé nekódující RNA LINC01433 u karcinomu plic
- Vzácný nález hereditární zátěže u mladé pacientky s hyperkalcemickým malobuněčným karcinomem hrdla dělohy
- Extravazace (paravazace) cytostatik – doporučení pro standardní péči v rámci České republiky ze spolupráce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry
- Aktuality z odborného tisku
- Spomienka na prof. MUDr. Ľudovíta Milana Jurgu, DrSc.
- Maligní onemocnění, psychika a stres. Příběhy pacientů s komentářem psychologa
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Extravazace (paravazace) cytostatik – doporučení pro standardní péči v rámci České republiky ze spolupráce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry
- Vzácný nález hereditární zátěže u mladé pacientky s hyperkalcemickým malobuněčným karcinomem hrdla dělohy
- Tranzice péče o onkologické pacienty z dětského do dospělého věku
- Výsledky léčby bortezomibem a thalidomidem u nově diagnostikovaných netransplantovaných pacientů s mnohočetným myelomem jsou srovnatelné
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



