-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
PDLIM2 a jeho role v onkogenezi – tumor supresor nebo onkoprotein?
PDLIM2 and Its Role in Oncogenesis – Tumor Suppressor or Oncoprote?
PDZ and LIM domain containing protein 2 (PDLIM2), also known as Mystique or SLIM, is a member of the actinin – associated LIM family of proteins that play essential roles in cytoskeletone organization, cell differentiation and have been associated with oncogenesis. PDLIM2 is cytoskeletal and nuclear protein encoded by the Mystique gene localized on chromosome 8p21. PDLIM2 regulates stability and activity of several transcription factors, e. g. NF κB or STAT, and its deregulation is associated with several malignancies. PDLIM2 expression has been connected with both tumor suppression and tumorigenesis. PDLIM2 levels are epigenetically suppressed in different cancers due to Mystique promoter hypermetylation that blocks its transcription. PDLIM2 re expression is able to inhibit tumorigenicity and induces tumor cell death both in vitro and in vivo, which suggest potential tumor suppressor role of PDLIM2. On the other hand, PDLIM2 is highly expressed in cancer cell lines derived from metastatic cancer and its expression is associated with tumor progression and metastasis formation, indicating pro oncogenic role of PDLIM2. The aim of this review is to summarize current knowledge on the role of PDLIM2 in tumor formation and development, focusing on its prospective role as therapeutic target and offering potential explanations of its different functions in oncogenesis that were identified so far.
Key words:
PDLIM2 protein – COP9 signalosome (CSN) – oncogenesis – 5 - aza - 2’ - deoxycytidine – cancer – metastasis
This study was supported by Czech Science Foundation (project No. 14-19250S), European Regional Development Fund and the State Budget of the Czech Republic (OP VaVpI – RECAMO CZ.1.05/2.1.00/03.0101), Brno Ph.D. Talent Scholarship programme – Funded by the Brno City Municipality, by the project MEYS – NPS I – LO1413, MH CZ – DRO (MMCI, 00209805) and BBMRI_CZ (LM2010004).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
27. 3. 2015Accepted:
29. 6. 2015
Autoři: J. Maryáš 1; P. Bouchal 1,2
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno2 Ústav biochemie, PřF MU, Brno 1
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 2): 40-46
doi: https://doi.org/10.14735/amko20152S40Souhrn
PDZ a LIM domény obsahující protein 2 (PDLIM2), jinak také Mystique či SLIM, je nejnovějším členem tzv. s aktininy asociované LIM proteinové rodiny proteinů, jejíž členové jsou zásadním způsobem zapojeni do regulace celé škály biologických procesů včetně organizace buněčného cytoskeletu, buněčné diferenciace či onkogeneze. Samotný PDLIM2 je cytoskeletálně i nukleárně lokalizovaný protein kódovaný genem Mystique lokalizovaném na chromozomu 8p21, který reguluje stabilitu a aktivitu nejrůznějších transkripčních faktorů, např. NF κB či STAT. Deregulace PDLIM2 souvisí s celou řadu patologických stavů včetně onkogeneze, přičemž hladiny tohoto proteinu mohou korelovat jak se vznikem, tak se supresí nádorů. Hladiny PDLIM2 jsou epigeneticky potlačeny u celé řady nádorů a to v důsledku hypermetylace promotoru genu Mystique, která brání jeho transkripci. Reaktivace PDLIM2 je schopna potlačit tumorigenicitu a navodit smrt nádorových buněk in vitro i in vivo, což indikuje potenciální tumor supresivní roli tohoto proteinu. Na druhou stranu u nádorových buněčných linií odvozených od metastazujících nádorů bylo detekováno výrazné zvýšení mRNA i proteinových hladin PDLIM2 a bylo zjištěno, že PDLIM2 je asociován s progresí nádorů a vznikem metastáz, což spíše nahrává pro onkogenní funkci tohoto proteinu. Hlavním cílem této práce je detailněji shrnout dosavadní poznatky o roli PDLIM2 v průběhu vzniku a vývoje nádorů, dále vyzdvihnout jeho potenciální využití v klinické praxi, především jako možného terapeutického cíle a také nabídnout možná vysvětlení dosud zjištěných rozdílných funkcí tohoto proteinu v onkogenezi.
Klíčová slova:
PDLIM2 protein – COP9 signalozom (CSN) – onkogeneze – 5 - aza - 2’ - deoxycytidin – nádory – metastázeÚvod
PDZ a LIM domény obsahující protein 2 (PDLIM2), známý také jako Mystique či SLIM [1], je člen tzv. s aktininy asociované LIM proteinové rodiny (ALP), zahrnující proteiny s N‑terminální PDZ doménou a C‑terminálně lokalizovanou LIM doménou (obr. 1) [2]. Všichni členové ALP proteinové rodiny jsou schopni interagovat s aktinovým cytoskeletem pomocí jejich konzervované 80 – 100 aminokyselin dlouhé PDZ domény, jež zprostředkovává specifické protein‑proteinové interakce, hraje významnou roli v sestavování proteinových komplexů asociovaných s plazmatickou membránou [3] a také v normálním buněčném vývoji [2]. LIM doména členů ALP proteinové rodiny stejně jako PDZ doména zprostředkovává protein‑proteinové interakce, mimoto však vykazuje také E3 ubikvitin ligázovou aktivitu [4]. Interakce LIM domény jsou mnohem variabilnější než v případě domény PDZ [1]. LIM doména je tvořena sekvencí aminokyselin bohatou na cystein, která vytváří dva motivy zinkového prstu a účastní se např. interakcí v signálních drahách zapojených do buněčné diferenciace či souvisejících s onkogenezí [3]. Obecně PDZ a LIM domény obsahující proteiny jsou zapojeny do regulace celé škály biologických procesů včetně organizace buněčného cytoskeletu, buněčné diferenciace, vývoje orgánů, neurální signalizace či onkogeneze [5].
Protein PDLIM2, nejnovější člen ALP proteinové rodiny, je cytoskeletálně i nukleárně lokalizovaný protein regulující stabilitu nejrůznějších transkripčních faktorů v hematopoetických a epiteliálních buňkách, např. transkripčních faktorů NF ‑ κB či STAT zapojených mimo jiné do regulace imunitní odpovědi [6]. PDLIM2 byl prvně identifikován v epiteliálních buňkách sítnice [2], hladiny tohoto proteinu však byly detekovány v celé řadě dalších buněčných linií včetně fibroblastů transformovaných overexpresí IGF‑1R (receptor proinzulinu podobný růstový faktor 1), dále T lymfocytů, makrofágů, dendritických buněk či epiteliálních nádorových buněk, u kterých reguluje buněčnou adhezi a migraci [7]. Protein PDLIM2 je kódován genem Mystique lokalizovaným na chromozomu 8p21 [3], tedy v oblasti, která je velmi často poškozena u celé řady nádorů [8]. Na úrovni cDNA byly detekovány 3 izoformy (Mystique 1– 3), na úrovni proteinu však převládá izoforma 2tvořená 352 aminokyselinami s relativní molekulovou hmotností 37,5 kDa (obr. 1) [3]. Bylo také zjištěno, že exprese Mystique a hladiny proteinu PDLIM2 jsou asociovány jak s nádorovou supresí, tak s tumorigenezí [3,4,6]. Dosavadní poznatky o funkci PDLIM2 v onkogenezi nádorů včetně jeho potenciálního využití v klinické praxi budou rozebrány v následujících částech tohoto článku.
Obr. 1. Domény PDLIM2. 
Protein PDLIM2 je členem ALP proteinové rodiny, zahrnující proteiny s N-terminální PDZ doménou a C-terminálně lokalizovanou LIM doménou [2]. PDZ doména zprostředkovává protein-proteinové interakce a představuje prvních 84 AK na N-konci PDLIM2 [3]. LIM doména je pak lokalizována mezi AK 284-344 PDLIM2 a mimo zprostředkování protein-proteinových interakcí vykazuje také E3 ubiquitin ligázovou aktivitu [4]. PDLIM2 jako nádorový supresor
Jak již bylo uvedeno, exprese genu Mystique a hladiny proteinu PDLIM2 byly za fyziologických podmínek detekovány v celé řadě buněk a tkání [2] a jejich deregulace souvisí s celou řadou patologických stavů včetně onkogeneze, přičemž bylo zjištěno, že hladiny proteinu PDLIM2 korelují jak se vznikem, tak se supresí nádorů [3,4,6]. Tumor supresivní funkce tohoto proteinu byly dosud popsány v souvislosti s T buněčným lymfomem dospělých (ATL) [9 – 12], karcinomem kolorekta [4,13] či s nádory prsu [14,15].
PDLIM2 a jeho tumor supresivní role v T buněčném lymfomu dospělých
T buněčný lymfom dospělých je vysoce agresivní T buněčná malignita vyvolaná infekcí T buněk onkogenním retrovirem HTLV ‑ 1 (lidský T lymfotropický virus 1) [9]. Detailní mechanizmus vedoucí ke vzniku ATL není dosud zcela objasněn, je však zřejmé, že zásadní roli v tomto procesu hraje virový onkoprotein Tax [10]. Tento 40 kDa velký protein, jenž je zásadní pro virovou replikaci [11], vykazuje vlastnosti onkoproteinu, neboť je schopen deregulovat buněčné transkripční faktory regulující buněčný růst a dělení, a to především NF ‑ κB [12]. NF ‑ κB je pětičlenná rodina transkripčních faktorů vytvářejících homo ‑ a heterodimery, které jsou zadržovány v cytoplazmě pomocí inhibičních proteinů κB (IκB) a tím udržovány v inaktivním stavu (regulovány) [16]. Do rodiny NF ‑ κB patří proteiny RELA, RELB, c ‑ Rel, jež jsou syntetizovány ve funkční formě schopné aktivovat transkripci cílových genů a také proteiny NF ‑ κB1 a NF ‑ κB2, jež jsou syntetizovány jako prekurzory neschopné vazby na DNA a jsou aktivovány proteolytickým odštěpením C ‑ koncové domény za vzniku zralých proteinů p50 a p52 [16]. Transkripční faktory NF ‑ κB mohou být aktivovány celou řadou stimulů, např. pro‑zánětlivých cytokinů, a hrají zásadní roli v regulaci zánětlivé imunitní odpovědi, apoptóze, proliferaci a celé řadě dalších buněčných dějů [17]. Deregulace, resp. zvýšená aktivita těchto transkripčních faktorů je průvodním znakem řady chorob včetně tumorigeneze [18]. Existuje několik mechanizmů vedoucích k aktivaci transkripčních faktorů NF-κB, z nichž nejlépe popsané a také nejčastější jsou kanonická (klasická) a nekanonická dráha [16,17]. Kanonická dráha je obvykle spouštěna jako odpověď na virovou či mikrobiální infekci a expozici prozánětlivých cytokinů a zahrnuje především proteiny RELA, c ‑ Rel a p50 [17]. Přítomnost prozánětlivých faktorů vede k aktivaci kinázy TAK1, která dále aktivuje IκB kinázový komplex, ten fosforyluje IκB, navozuje tak jejich ubikvitinaci a proteazomovou degradaci, čímž dochází k uvolnění a translokaci komplexu RELA – p50 do jádra a aktivaci transkripce cílových genů zapojených do regulace zánětlivé imunitní odpovědi, proliferace či migrace [17,18]. Nekanonická dráha je nejčastěji spouštěna různými ligandy TNF cytokinové rodiny (např. TNF-β) [17]. Tyto ligandy aktivují NF ‑ κB indukovanou kinázu, jež následně spouští sled reakcí analogických s kanonickou dráhou, přičemž konečným produktem alternativní dráhy je aktivní heterodimer p52 – RELB, který aktivuje transkripci genů důležitých pro vývoj adaptivní imunitní odpovědi a regulaci apoptózy [17,18]. Onkoprotein Tax zprostředkovává aktivaci kanonické i nekanonické NF ‑ κB dráhy, což hraje zásadní roli v maligní transformaci T buněk infikovaných HTLV ‑ 1 [19]. Zásadní jsou především geny aktivované nekanonickou drahou [20], což potvrzují i studie provedené u jiných typů nádorů [21]. Bylo prokázáno, že protein PDLIM2 funguje jako silný supresor onkoproteinu Tax a tento supresivní efekt PDLIM2 vede k potlačení Tax indukované buněčné transformace a onkogeneze in vitro i in vivo [12]. PDLIM2 reguluje funkce proteinu Tax dvěma způsoby – jednak funguje jako E3 ubikvitin ligáza proteinu Tax, navozuje tedy jeho poly ‑ ubikvitinaci a následnou proteazomovou degradaci (obr. 2) [10], kromě toho však PDLIM2 také přímo interaguje s Tax a transportuje jej z cytoplazmy do nesolubilních jaderných kompartmentů, kde opět dochází k degradaci Tax (obr. 2) [10], což má za následek inhibici drah NF ‑ κB a již zmiňované potlačení buněčné transformace a onkogeneze [12]. PDLIM2 je také schopen přímo inhibovat kanonickou NF ‑ κB dráhu, neboť jako E3 ubikvitin ligáza proteinu p65, hlavního transkripčního faktoru kanonické NF ‑ κB dráhy, navozuje jeho ubikvitinaci a proteazomovou degradaci (obr. 2) [9]. Studie nicméně odhalily, že protein PDLIM2 je u HTLV ‑ 1 transformovaných buněčných linií reprimován a výrazné snížení hladin PDLIM2 bylo také detekováno u primárních buněk pacientů s ATL ve srovnání s kontrolními zdravými buňkami [10]. Ukazuje se, že represe PDLIM2 je důležitý mechanizmus HTLV ‑ 1 zprostředkované tumorigeneze [10]. Bylo prokázáno, že represe PDLIM2 souvisí se zvýšenou aktivitou DNA metyltransferáz (DNMT), konkrétně DNMT1 a DNMT3b, která vede k hypermetylaci promotorové oblasti genu Mystique a potlačení jeho transkripce [10]. Studie dále odhalují, že reaktivace hladin PDLIM2 pomocí hypometylačního agens 5 ‑ aza ‑ 2‘ - deoxycytidinu (5 ‑ aza ‑ dC) je schopna navodit smrt HTLV ‑ 1 transformovaných T buněk [10]. 5 ‑ aza ‑ dC účinkuje jako inhibitor DNA metyltransferáz a v roce 2006 byl schválen americkou FDA (Food and Drug Administration – Úřad pro kontrolu léčiv) pro léčbu myelodisplastického syndromu [22]. Schopnost 5 ‑ aza ‑ dC v závislosti na dávce reaktivovat PDLIM2 a navodit smrt HTLV ‑ 1 transfekovaných T buněk naznačuje potenciální terapeutickou strategii pro ATL [10]. Je nutno říci, že 5 ‑ aza ‑ dC reaktivuje i jiné geny, avšak samotná reaktivace PDLIM2 po transfekci specifickým plazmidem je schopna navodit smrt HTLV ‑ 1 transfekovaných T lymfocytů, což potvrzuje tumor supresivní roli PDLIM2 v onkogenezi ATL [12].
Obr. 2. PDLIM2 a jeho vztah k virovému onkoproteinu Tax a drahám NF-κB. 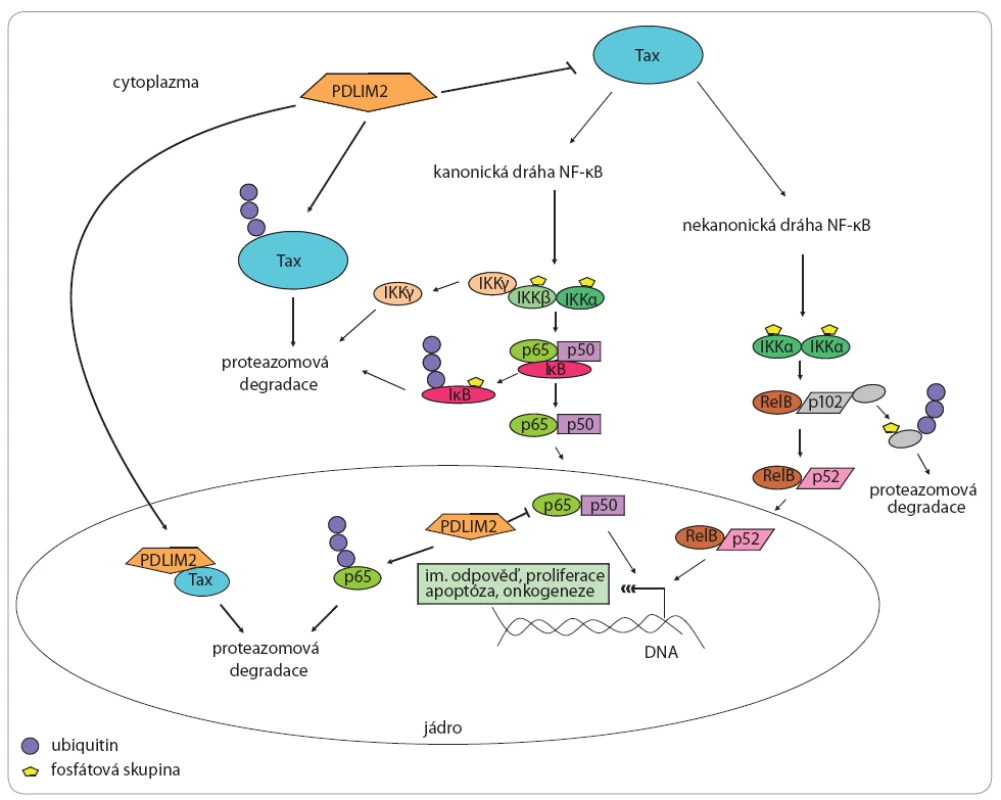
PDLIM2 funguje jako silný supresor virového onkoproteinu Tax [12]. Tento onkoprotein je schopen deregulovat buněčné transkripční faktory, především kanonickou a nekanonickou NF-κB dráhu [12], které hrají zásadní roli v regulaci celé řady dalších buněčných dějů včetně zánětlivé imunitní odpovědi, apoptózy [17] či onkogeneze [18]. PDLIM2 funguje jako supresor Tax a reguluje jeho funkce dvěma hlavními způsoby: v cytoplazmě funguje jako E3 ubiquitin ligáza proteinu Tax, navozující jeho poly-ubiquitinaci a proteazomovou degradaci [10], kromě toho však také přímo interaguje s Tax a transportuje jej z cytoplazmy do jádra, kde opět navozuje jeho degradaci [10]. V jádře funguje PDLIM2 také jako E3 ubiquitin ligáza proteinu p65, hlavního transkripčního faktoru kanonické NF-κB dráhy a navozuje tak jeho ubiquitinaci a protezomovou degradaci [9]. PDLIM2 a jeho tumor supresivní role v kolorektálním karcinomu
Jednou z hlavních predispozic pro vznik a vývoj kolorektálního karcinomu (colorectal cancer – CRC) jsou tzv. IBD (inflamatory bowel disease), tedy chronická zánětlivá onemocnění zahrnující např. Crohnovu chorobu či ulcerózní kolitidu [4]. Deregulace již zmiňovaných transkripčních faktorů NF ‑ κB, jakož i transkripčních faktorů rodiny STAT, hraje zásadní roli při vývoji IBD a s nimi asociovaných nádorů [4,23]. Za fyziologických podmínek je aktivita NF ‑ κB i STAT velmi přísně regulována, přičemž hlavním regulačním mechanizmem je degradace těchto transkripčních faktorů zprostředkovaná proteinem PDLIM2 [4]. PDLIM2 funguje jako E3 ubikvitin ligáza proteinu p65 (obr. 2), nejvýznamnějšího a nejčastěji se vyskytujícího transkripčního faktoru rodiny NF ‑ κB, a také jako E3 ubikvitin ligáza proteinů STAT1, STAT3 či STAT4 [4,13,24]. PDLIM2 tedy navozuje ubikvitinaci a následnou degradaci těchto proteinů a reguluje tak jejich aktivitu [4,13,24]. Některé dosud provedené studie odhalily sníženou expresi PDLIM2 na úrovni mRNA i proteinu u nejrůznějších buněčných linií odvozených od CRC (HCT 116, SNU ‑ 1040, DLD ‑ 1, SW ‑ 480, FET, HT ‑ 29) [4]. Bylo zjištěno, že u kolorektálních nádorových linií dochází k epigenetickému potlačení hladin PDLIM2 hypermetylací promotoru genu Mystique, jež je zprostředkována DNA metyltransferázami DNMT1 a DNMT3b [4], podobně jako je tomu v případě ATL [9 – 12]. Působení hypometylačního 5 ‑ aza ‑ dC na CRC buněčné linie vede k reaktivaci PDLIM2 a je schopno indukovat smrt těchto buněk in vitro i in vivo, což naznačuje potenciální terapeutickou strategii pro CRC [4]. Nedávné studie ovšem odhalují, že k represi PDLIM2 dochází také na posttranskripční úrovni pomocí mikroRNA (miRNA), které se váží na 3‘ nepřekládanou oblast PDLIM2 mRNA a blokují tak její translaci [13]. Konkrétně jde o miR ‑ 221 a miR ‑ 222, přičemž bylo zjištěno, že hladiny těchto mikroRNA jsou u CRC zvýšeny ve srovnání s nenádorovou tkání [13]. Výsledky těchto studií podporují domněnky, že represe PDLIM2 je zásadní mechanizmus napomáhající vzniku CRC a PDLIM2 je tedy důležitý supresor a potenciální terapeutický cíl v onkogenezi CRC [4].
PDLIM2 a jeho tumor supresivní role u nádorů prsu
Tumor supresivní role proteinu PDLIM2 byla popsána také u buněk odvozených od karcinomu prsu [14,15]. Bylo popsáno, že exprese PDLIM2 je epigeneticky reprimována u estrogen receptor (ER) pozitivních (MCF ‑ 7) i negativních (MDA ‑ MB ‑ 231) buněčných linií nádorů prsu ve srovnání s nenádorovými liniemi MCF ‑ 10A (ER negativní) a HMT ‑ 3522 S1 (ER pozitivní) [14]. Suprese PDLIM2 souvisí s konstitutivní aktivitou NF ‑ κB [14], která hraje významnou roli v onkogenezi nádorů prsu [25]. Reaktivace hladin PDLIM2 pomocí 5 ‑ aza ‑ dC vede, stejně jako v případě ATL či CRC, k inhibici NF ‑ κB a potlačení tumorigenicity MCF ‑ 7 a MDA ‑ MB ‑ 231 in vitro i in vivo [14]. Jak již bylo uvedeno, 5 ‑ aza ‑ dC je schopen reaktivovat řadu genů, avšak samotné zvýšení hladin PDLIM2 u buněk MCF ‑ 7 a MDA ‑ MB ‑ 231 stabilně transfekovaných specifickým plazmidem bylo schopno potlačit jejich tumorigenní vlastnosti, což naznačuje potenciální využití PDLIM2 v terapii nádorů prsu [14]. V nedávné době bylo také zjištěno, že exprese genu Mystique, kódujícího protein PDLIM2, je řízena biologicky aktivní formou vitaminu D3 [15]. Vitamin D3je pleiotropní hormon účinkující na řadu tkání a zprostředkovávající nejrůznější biologické odpovědi, mimo jiné vykazuje i protinádorovou aktivitu [26]. Ukazuje se, že protinádorové vlastnosti vitaminu D3 zprostředkovává protein PDLIM2 [15]. Vitamin D3 je schopen přímo aktivovat transkripci genu Mystique, popřípadě potlačit hypermetylaci promotoru tohoto genu a tím zvyšovat hladiny PDLIM2 v buňkách [15]. Schopnost vitaminu D3 reaktivovat hladiny PDLIM2 a potlačit tak vlastnosti nádorových buněčných linií karcinomu prsu naznačují další z možných terapeutických strategií u tohoto typu nádorů [15].
PDLIM2 jako onkoprotein
Kromě studií striktně charakterizujících PDLIM2 jako nádorový supresor existují také studie považující PDLIM2 za onkoprotein, resp. protein s možnou duální funkcí v onkogenezi nádorů [3,6,7]. Jedná se o studie provedené u prostatických a prsních nádorových buněčných linií [3,6,7] a jejich závěry jsou podrobněji rozebrány níže.
PDLIM2 jako onkoprotein u nádorů prostaty
Navzdory tomu, že je represe PDLIM2 asociována s tumorigenezí a PDLIM2 je považován za potenciální nádorový supresor, byly u prostatických nádorových buněčných linií odvozených od metastazujících nádorů detekovány výrazně zvýšené hladiny tohoto proteinu ve srovnání s liniemi odvozenými od nádorů nemetastazujících [7]. Bylo také zjištěno, že hladiny PDLIM2 jsou výrazně vyšší u androgen nezávislých prostatických nádorových linií DU 145 a PC ‑ 3 ve srovnání s androgen závislými liniemi PPC ‑ 1 a Alva ‑ 31 [3]. Stabilní potlačení hladin PDLIM2 v buňkách DU 145 pak vedlo k výraznému snížení jejich migračních vlastností a také k zastavení a reverzi epiteliálně mezenchymální tranzice (EMT) [7], tedy sledu molekulárních a buněčných dějů hrajících velmi významnou roli v progresi a metastazování nádorů [27]. Bylo publikováno, že potlačení hladin PDLIM2 nemá vliv na bazální aktivitu NF ‑ κB [7], což je ovšem v rozporu s výsledky studií považujících PDLIM2 za nádorový supresor, které deklarují ústřední roli PDLIM2 v regulaci aktivity NF ‑ κB [4,14]. Vyšlo najevo, že PDLIM2 je schopen aktivovat COP9 signalozom (CSN), evolučně konzervovaný proteinový komplex složený z osmi podjednotek (CSN1 – 8) [28]. Tento proteinový komplex reguluje ubikvitin konjugační dráhy a tím ovlivňuje degradaci buněčných proteinů (zvýšená degradace p53, SMAD4/ 7, p27Kip1, stabilizace a aktivace c ‑ myc, c ‑ jun a dalších) a regulaci celé řady signálních drah a procesů včetně buněčného cyklu či tumorigeneze [29]. PDLIM2 přímo interaguje a tím aktivuje funkčně nejvýznamnější podjednotku COP9 signalozomu, podjednotku 5 (CSN5) neboli Jab1 [7]. Zvýšené hladiny CSN5 a s tím související zvýšená aktivita COP9 jsou spojovány se vznikem a progresí různých typů nádorů, a regulace hladin CSN5 by tak mohla být potenciálním cílem v terapii nádorů [30]. Všechna tato uvedená zjištění naznačují pro‑tumorigenní funkci PDLIM2 [3]. V souvislosti s již výše deklarovanou tumor supresivní funkcí PDLIM2 se však dá předpokládat, že vztah tohoto proteinu k onkogenezi nádorů je komplikovanější a PDLIM2 by mohl fungovat jako protein s duální funkcí (obr. 3) [7]. Zdá se, že v počátečních fázích tumorigeneze je represe PDLIM2 asociována s transformací buněk a růstem nádorů, v pozdějších fázích je však patrně PDLIM2 reaktivován a jeho přítomnost je asociována s EMT, progresí nádoru a tvorbou metastáz [7]. Reaktivace PDLIM2 je tedy pravděpodobně schopna potlačit tumorigenezi pouze v počátečním stadiu vzniku nádoru, v pozdějších fázích má ale efekt přesně opačný.
PDLIM2 jako onkoprotein ve vztahu k nádorům prsu
Již jsme se zmínili, že hladiny PDLIM2 jsou epigeneticky reprimovány u estrogen receptor (ER) pozitivních (MCF ‑ 7) i negativních (MDA ‑ MB ‑ 231) buněčných linií nádorů prsu ve srovnání s ER pozitivními i negativními nenádorovými liniemi MCF ‑ 10A a HMT ‑ 3522 S1 [14]. V určitém rozporu s tímto tvrzením jsou však výsledky deklarující výrazné zvýšení hladin PDLIM2 v nádorových buněčných liniích odvozených od metastatických nádorů, včetně MDA ‑ MB ‑ 231, ve srovnání s liniemi odvozenými od nádorů nemetastatických [6]. Bylo zjištěno, že hladiny PDLIM2 u linie MDA ‑ MB ‑ 231 (post EMT – bazální subtyp) jsou srovnatelné s hladinami detekovanými u MCF ‑ 10A a jsou výrazně vyšší ve srovnání s ER pozitivní linií MCF ‑ 7 (luminální subtyp), a zdá se tedy, že reflektují diferenciační status prsních nádorových buněk [6]. Stabilní suprese PDLIM2 v buňkách MDA ‑ MB ‑ 231 i MCF ‑ 7 vedla, podobně jako u prostatických nádorových linií, k potlačení jejich migračních schopností, reverzi EMT a aktivaci COP9 signalozomu a opět neměla vliv na bazální aktivitu NF ‑ κB [3,6]. Výsledky těchto studií jsou nicméně znovu v určitém rozporu s výsledky studie Qu et al [14] a také Vanoirbeek [15], jež deklarují, že zvýšení (reaktivace) hladin PDLIM2 v buněčných liniích MCF ‑ 7 a MDA ‑ MB ‑ 231 zprostředkovaná 5 ‑ aza ‑ dC (event. vitaminem D3) potlačuje tumorigenicitu těchto linií, tedy i jejich migrační schopnosti, a inhibuje aktivitu NF ‑ κB [14,15]. Možným vysvětlením nesouladu ve výsledcích těchto studií by mohl být fakt, že jak 5 ‑ aza ‑ dC, tak vitamin D3 reaktivují i jiné geny než Mystique [12,14] a právě produkty těchto genů by event. mohly přispívat k potlačení tumorigenicity nádorových buněčných linií či inhibici NF ‑ κB. Rozpory ve výsledcích dosud provedených studií u prsních nádorových buněk opět nahrávají hypotéze o duální funkci PDLIM2 v onkogenezi nádorů (obr. 3) [6,7]. U normálních epiteliálních buněk je PDLIM2 zřejmě důležitý pro udržení jejich fenotypu [6], což je v souladu s přítomností vysokých hladin tohoto proteinu v nenádorových epiteliálních prsních buňkách MCF ‑ 10A či HMT ‑ 3522 S1 [14]. Je pravděpodobné, že represe PDLIM2 v těchto buňkách vede k jejich maligní transformaci a následná reaktivace PDLIM2 v transformovaných buňkách pak aktivuje EMT, vede k progresi nádorů a přispívá k tvorbě metastáz (obr. 3). Zdá se také, že u buněk sekundárních nádorů (metastáz) dochází k opětovné represi PDLIM2, která aktivuje tzv. mezenchymálně epiteliální tranzici, tedy děj opačný k EMT, a indukuje proliferaci těchto buněk a růst metastáz [7].
Obr. 3. Duální role PDLIM2 v onkogenezi. 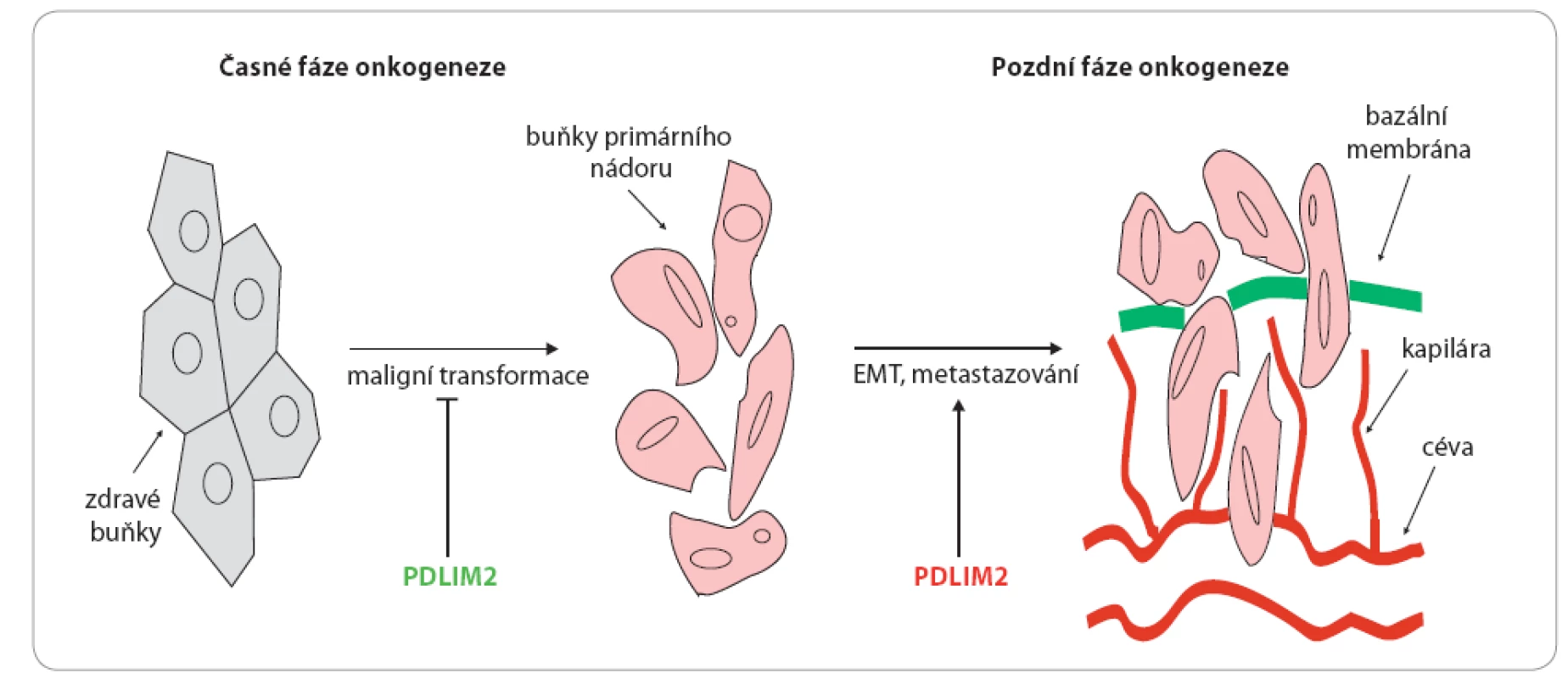
V počátečních fázích onkogeneze je PDLIM2 schopen reprimovat maligní transformaci buněk a růst nádorů, v pozdějších fázích onkogeneze pak bylo prokázáno, že zvýšení hladin PDLIM2 je asociováno s epiteliálně mezenchymální tranzicí (EMT), progresí nádoru a tvorbou metastáz [7], což naznačuje duální roli PDLIM2 v onkogenezi nádorů. Závěr
Na první pohled rozporuplné výsledky dosud provedených studií, považujících PDLIM2 někdy za nádorový supresor, jindy pak za potenciální onkoprotein, naznačují možnou duální funkci proteinu PDLIM2 v onkogenezi nádorů. V počátečních fázích vzniku nádorů působí pravděpodobně jako nádorový supresor, neboť je reprimován a reaktivace hladin PDLIM2 vede k inhibici maligní transformace buněk, v pozdějších fázích onkogeneze však zvýšení hladin PDLIM2 koreluje s progresí a metastazováním nádorů [6,7]. Prohloubení znalostí o funkci PDLIM2 v onkogenezi by tak mohlo vést k nalezení „windows of opportunity“, ve kterých by reaktivace PDLIM2 byla schopna potlačit tumorigenezi a navodit smrt nádorových buněk. Výsledky dosud publikovaných studií také naznačují možnou hormonální regulaci hladin PDLIM2, resp. exprese genu Mystique. Již byl popsán přímý efekt vitaminu D3, jenž se váže na vitamin D3 rozpoznávající oblast promotor genu Mystique a aktivuje tak jeho transkripci [15]. Jelikož byl rovněž popsán funkční antagonizmus mezi jednotlivými hormonálními receptory [31], je možné, že aktivované androgenní či estrogenní receptory mohou určitým způsobem ovlivňovat (blokovat) expresi Mystique, a tedy i hladiny PDLIM2. Bylo totiž zjištěno, že androgen nezávislé prostatické nádorové linie a ER negativní prsní nádorové linie vykazují vyšší mRNA i proteinové hladiny PDLIM2 ve srovnání s androgen závislými či ER pozitivními liniemi [3,6]. Přímý efekt androgenů či estrogenů na expresi Mystique nebyl dosud prozkoumán, ačkoli by si více pozornosti jistě zasloužil. Hlubší studium zasluhuje také vztah mezi PDLIM2 a COP9 signalozomem, potažmo podjednotkou 5 (CSN5) tohoto proteinového komplexu. Ukazuje se totiž, že aktivace COP9, resp. CSN5 hraje důležitou roli v progresi různých typů nádorů a regulace této aktivity, např. prostřednictvím PDLIM2, by mohla být potenciálním cílem v terapii nádorů [30]. Detailnější popis vyžaduje jistě také vztah PDLIM2 k drahám NF ‑ κB, které hrají významnou roli při vzniku a progresi celé řady nádorů [18]. Lze tedy říci, že PDLIM2 je velmi zajímavý protein s komplexní, avšak dosud ne zcela objasněnou funkcí v onkogenezi nádorů, jehož represe v určitých fázích vzniku a vývoje nádorů by mohla být účinnou terapeutickou strategií např. u ATL, CRC či nádorů prsu.
Práce byla podpořena Grantovou agenturou ČR (projekt č. 14-19250S), Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO CZ. 1.05/2.1.00/03.0101), stipendijním programem Brno Ph.D. talent – financuje statutární město Brno, projektem MŠMT – NPU I – LO1413, MZ ČR – RVO (MOÚ, 00209805) a BBMRI_CZ (LM2010004).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Pavel Bouchal, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: bouchal@mou.cz
Obdrženo: 27. 3. 2015
Přijato: 29. 6. 2015
Zdroje
1. Healy NC, O‘Connor R. Sequestration of PDLIM2 in the cytoplasm of monocytic/ macrophage cells is associated with adhesion and increased nuclear activity of NF ‑ kappaB. J Leukoc Biol 2009; 85(3): 481 – 490. doi: 10.1189/ jlb.0408238.
2. Torrado M, Senatorov VV, Trivedi R et al. Pdlim2, a novel PDZ ‑ LIM domain protein, interacts with alpha ‑ actinins and filamin A. Invest Ophthalmol Vis Sci 2004; 45(11): 3955 – 3963.
3. Loughran G, Healy NC, Kiely PA et al. Mystique is a new insulin‑like growth factor ‑ I ‑ regulated PDZ ‑ LIM domain protein that promotes cell attachment and migration and suppresses Anchorage ‑ independent growth. Mol Biol Cell 2005; 16(4): 1811 – 1822.
4. Qu Z, Yan P, Fu J et al. DNA methylation ‑ dependent repression of PDZ ‑ LIM domain‑containing protein 2 in colon cancer and its role as a potential therapeutic target. Cancer Res 2010; 70(5): 1766 – 1772. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 09 ‑ 3263.
5. te Velthuis AJ, Bagowski CP. PDZ and LIM domain‑encoding genes: molecular interactions and their role in development. Scientific World Journal 2007; 7 : 1470 – 1492.
6. Deevi RK, Cox OT, O‘Connor R. Essential function for PDLIM2 in cell polarization in three ‑ dimensional cultures by feedback regulation of the β1 - integrin‑RhoA signaling axis. Neoplasia 2014; 16(5): 422 – 431. doi: 10.1016/ j.neo.2014.04.006.
7. Bowe RA, Cox OT, Ayllón V et al. PDLIM2 regulates transcription factor activity in epithelial ‑ to ‑ mesenchymal transition via the COP9 signalosome. Mol Biol Cell 2014; 25(1): 184 – 195. doi: 10.1091/ mbc.E13 ‑ 06 ‑ 0306.
8. Macartney ‑ Coxson DP, Hood KA, Shi HJ et al. Metastatic susceptibility locus, an 8p hot ‑ spot for tumour progression disrupted in colorectal liver metastases: 13 candidate genes examined at the DNA, mRNA and protein level. BMC Cancer 2008; 8 : 187. doi: 10.1186/ 1471 ‑ 2407 ‑ 8 ‑ 187.
9. Zhao T, Yasunaga J, Satou Y et al. Human T ‑ cell leukemia virus type 1 bZIP factor selectively suppresses the classical pathway of NF ‑ kappaB. Blood 2009; 113(12): 2755 – 2764. doi: 10.1182/ blood ‑ 2008 ‑ 06 ‑ 161729.
10. Yan P, Qu Z, Ishikawa C et al. Human T ‑ cell leukemia virus type I ‑ mediated repression of PDZ ‑ LIM domain‑containing protein 2 involves DNA methylation but independent of the viral oncoprotein tax. Neoplasia 2009; 11(10): 1036 – 1041.
11. Fu J, Yan P, Li S et al. Molecular determinants of PDLIM2 in suppressing HTLV ‑ I Tax ‑ mediated tumorigenesis. Oncogene 2010; 29(49): 6499 – 6507. doi: 10.1038/ onc.2010.374.
12. Yan P, Fu J, Qu Z et al. PDLIM2 suppresses human T ‑ cell leukemia virus type I Tax ‑ mediated tumorigenesis by targeting Tax into the nuclear matrix for proteasomal degradation. Blood 2009; 113(18): 4370 – 4380. doi: 10.1182/ blood ‑ 2008 ‑ 10 ‑ 185660.
13. Liu S, Sun X, Wang M et al. A microRNA 221 - and 222 - mediated feedback loop maintains constitutive activation of NFκB and STAT3 in colorectal cancer cells. Gastroenterology 2014; 147(4): 847 – 859. doi: 10.1053/ j.gastro.2014.06.006.
14. Qu Z, Fu J, Yan P et al. Epigenetic repression of PDZ ‑ LIM domain‑containing protein 2: implications for the biology and treatment of breast cancer. J Biol Chem 2010; 285(16): 11786 – 11792. doi: 10.1074/ jbc.M109.086561.
15. Vanoirbeek E, Eelen G, Verlinden L et al. PDLIM2 expression is driven by vitamin D and is involved in the pro‑adhesion, and anti‑migration and - invasion activity of vitamin D. Oncogene 2014; 33(15): 1904 – 1911. doi: 10.1038/ onc.2013.123.
16. Basak S, Kim H, Kearns JD et al. A fourth IkappaB protein within the NF ‑ kappaB signaling module. Cell 2007; 128(2): 369 – 381.
17. Hayden MS, Ghosh S et al. Shared principles in NF ‑ kappaB signaling. Cell 2008; 132(3): 344 – 362. doi: 10.1016/ j.cell.2008.01.020.
18. Pikarsky E, Porat RM, Stein I et al. NF ‑ kappaB functions as a tumour promoter in inflammation‑associated cancer. Nature 2004; 431(7007): 461 – 466.
19. Yamaoka S, Inoue H, Sakurai M et al. Constitutive activation of NF ‑ kappa B is essential for transformation of rat fibroblasts by the human T ‑ cell leukemia virus type I Tax protein. EMBO J 1996; 15(4): 873 – 887.
20. Higuchi M, Tsubata C, Kondo R et al. Cooperation of NF ‑ kappaB2/ p100 activation and the PDZ domain binding motif signal in human T ‑ cell leukemia virus type 1 (HTLV ‑ 1) Tax1 but not HTLV ‑ 2 Tax2 is crucial for interleukin‑2 - independent growth transformation. of a T ‑ cell line. J Virol 2007; 81(21): 11900 – 11907.
21. Keats JJ, Fonseca R, Chesi M et al. Promiscuous mutations activate the noncanonical NF ‑ kappaB pathway in multiple myeloma. Cancer Cell 2007; 12(2): 131 – 144.
22. Jabbour E, Issa JP, Garcia ‑ Manero G et al. Evolution of decitabine development: accomplishments, ongoing investigations, and future strategies. Cancer 2008; 112(11): 2341 – 2351. doi: 10.1002/ cncr.23463.
23. Qu Z, Fu J, Ma H et al. PDLIM2 restricts Th1 and Th17 differentiation and prevents autoimmune disease. Cell Biosci 2012; 2(1): 23. doi: 10.1186/ 2045 ‑ 3701 ‑ 2 ‑ 23.
24. Guo H, Mi Z, Bowles DE et al. Osteopontin and protein kinase C regulate PDLIM2 activation and STAT1 ubiquitination in LPS‑treated murine macrophages. J Biol Chem 2010; 285(48): 37787 – 37796. doi: 10.1074/ jbc.M110.161869.
25. Biswas DK, Shi Q, Baily S et al. NF ‑ kappa B activation in human breast cancer specimens and its role in cell proliferation and apoptosis. Proc Natl Acad Sci U S A 2004; 101(27): 10137 – 10142.
26. Lopes N, Sousa B, Martins D et al. Alterations in vitamin D signalling and metabolic pathways in breast cancer progression: a study of VDR, CYP27B1 and CYP24A1 expression in benign and malignant breast lesions. BMC Cancer 2010; 10 : 483. doi: 10.1186/ 1471 ‑ 2407 ‑ 10‑483.
27. Nieto MA. Epithelial ‑ Mesenchymal Transitions in development and disease: old views and new perspectives. Int J Dev Biol 2009; 53(8 – 10): 1541 – 1547. doi: 10.1387/ ijdb.072410mn.
28. Lee MH, Zhao R, Phan L et al. Roles of COP9 signalosome in cancer. CelL Cycle 2011; 10(18): 3057 – 3066.
29. Adler AS, Littlepage LE, Lin M et al. CSN5 isopeptidase activity links COP9 signalosome activation to breast cancer progression. Cancer Res 2008; 68(2): 506 – 515. doi: 10.1158/ 0008 ‑ 5472.CAN ‑ 07 ‑ 3060.
30. Shackleford TJ, Claret FX. JAB1/ CSN5: a new player in cell cycle control and cancer. Cell Div 2010; 5(26). doi: 10.1186/ 1747 ‑ 1028 ‑ 5 ‑ 26.
31. Lisse TS, Hewison M, Adams JS. Hormone response element binding proteins: novel regulators of vitamin D and estrogen signaling. Steroids 2011; 76(4): 331 – 339. doi: 10.1016/ j.steroids.2011.01.002.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Analýza změn fosfoproteomu nádorové buněčné linie MDA‑ MB‑ 468 v odpovědi na expresi izoforem p63 pomocí hmotnostní spektrometrie
- „Cukry zasahují“ aneb glykomika na poli nádorových biomarkerů
- Nrf2 – dve tváre regulátora antioxidačného systému
- Editorial
- Polo‑like kináza 1 jako cíl protinádorové terapie
- PDLIM2 a jeho role v onkogenezi – tumor supresor nebo onkoprotein?
- Profil aktivace receptorových tyrozinkináz a mitogenem aktivovaných proteinkináz v terapii Maffucciho syndromu
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
- Imunologické aspekty v onkologii – cirkulující γδ T lymfocyty
- Cirkulující nádorová DNA v krvi a její využití jako potenciálního biomarkeru nádorových onemocnění
- Adenovírusové vektory v génovej terapii
- Nádory u adolescentů
- Bioinformatika a sekvenování nové generace
- IntegRECAMO: úspěšná realizace projektu OP VK
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Adenovírusové vektory v génovej terapii
- Nrf2 – dve tváre regulátora antioxidačného systému
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



