-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prekancerózy jícnu
Premalignant Conditions of the Esophagus
Esophageal cancer has often poor survival when it is diagnosed at the time of clinical symptoms. Precancerous lesions of the esophagus are targets of interest in selected group of patients with important risk factors. Barrett’s esophagus – intestinal metaplasia is the main precursor lesion for the development of esophageal adenocarcinoma, the tumor with increased incidence. The major risk factor for Barrett’s esophagus is long‑term gastroesophageal reflux disease. In addition to antireflux therapy, the endoscopic surveillance and follow‑up are scheduled in order to detect adenocarcinoma and its precursor dysplastic lesions at an early and curable stage. The patients with achalasia, caustic injury of the esophagus and those with head and neck cancer are at increased risk of development of the squamous cell esophageal cancer. The aim of this paper is to provide an overview of the risk factors, epidemiology, screening and surveillance of premalignant lesions of the esophagus. Recent endoscopic and surgical procedures to treat advanced dysplastic lesions and early cancer are discussed.
Key words:
adenocarcinoma – squamous cell carcinoma – Barrett’s esophagus – precancerous conditions – early detection of cancer – endoscopy – digestive system
This study was supported by grant of the Czech Ministry of Health – RVO (FNBr, 65269705).
The author declare he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
12. 9. 2013Accepted:
27. 9. 2013
Autoři: R. Kroupa
Působiště autorů: Interní gastroenterologická klinika LF MU a FN Brno
Vyšlo v časopise: Klin Onkol 2013; 26(Supplementum): 17-21
Souhrn
Nádory jícnu mají obvykle špatnou prognózu, pokud jsou zjištěny v době přítomnosti klinických potíží. Cílené pátrání po nálezech s rizikem přechodu do malignity (tzv. prekancerózách) a aktivní sledování s možností včasné intervence může omezit výskyt pokročilých nádorových onemocnění nebo alespoň umožní stanovení včasné diagnózy s vyhlídkou na lepší prognózu. Hlavní rizikový faktor adenokarcinomu jícnu, nádoru se vzrůstajícím výskytem, je tzv. Barrettův jícen. Tento nález, charakterizovaný přítomností intestinální metaplazie, je podmíněn dlouhodobým drážděním jícnu gastroezofageálním refluxem. Kromě antirefluxní léčby se u Barrettova jícnu doporučuje vyhledávání a cílené endoskopické sledování s cílem záchytu dysplastických změn a časného karcinomu. Rizikové skupiny pro vývoj spinocelulárního karcinomu jícnu zahrnují nemocné s achalázií, poleptáním jícnu a s karcinomem hlavy a krku. Cílem článku je podat přehled o aktuálním stavu znalostí o charakteru premaligních lézí jícnu, jejich prevenci, vyhledávání a dispenzarizaci a o současných možnostech intervence.
Klíčová slova:
adenokarcinom – spinocelulární karcinom – Barrettův jícen – prekancerózy – včasná diagnostika nádoru – digestivní endoskopieÚvod
Nádory jícnu se mohou vyvíjet dlouhou dobu asymptomaticky bez výraznějších klinických projevů. V případě potíží (nejčastěji jako progredující porucha polykání – dysfagie) jsou většinou ve stadiu lokálně pokročilém, s omezenou možností dlouhodobě úspěšné kurativní léčby. Cílené pátrání po nálezech s rizikem přechodu do malignity, tzv. prekancerózách, a aktivní sledování s možností časné intervence může omezit výskyt pokročilých nádorových onemocnění nebo alespoň umožní stanovení časné diagnózy s vyhlídkou na lepší prognózu.
Cílem článku je podat přehled o aktuálním stavu znalostí o charakteru premaligních lézí jícnu, jejich prevenci, vyhledávání a dispenzarizaci a o současných možnostech intervence.
Rizikové faktory vedoucí k vývoji nejčastějších zhoubných nádorů jícnu – spinocelulárního karcinomu a adenokarcinomu – jsou dle epidemiologických dat dobře známy [1]. Bohužel jde často o prakticky obtížně ovlivnitelné faktory, jako jsou kouření, požívání horké a hodně kořeněné stravy, koncentrovaných destilátů, příjem nitrosaminů a obezitu. Snaha o doporučení změny životosprávy bývá zvláště u nejvíce ohrožené skupiny s kumulací rizik nejméně akceptována. Primární prevence nádorů jícnu je tak bohužel spíše teoretická oblast s malým dopadem na denní praxi zdravotní péče. Přesto je důležité motivovat pacienty ke změně zvláště tam, kde je souvislost s vyšším rizikem nádoru jasně podložena (kouření a alkohol, nízký příjem ovoce a zeleniny) [2]. Obecně jsou ve vyšším riziku nádorů jícnu muži a osoby starší 50 let. U adenokarcinomu jsou významnými epidemiologickými rizikovými faktory ještě dlouhotrvající refluxní nemoc jícnu, Barrettův jícen a obezita.
Epidemiologie
Roční incidence nádorů jícnu v České republice byla v roce 2010 5,7/ 100 000 u mužů a 0,96/ 100 000 u žen. Mortalita představuje přibližně 90 % roční incidence. V průběhu posledních 30 let došlo takřka ke zdvojnásobení incidence dle hlášených dat [3]. Celosvětově je nejčastější spinocelulární karcinom, který zahrnuje 80 – 90 % všech nádorů jícnu. Jeho incidence klesá. Výskyt adenokarcinomu jícnu u bělošské populace se od 60. let minulého století zvýšil na 4násobek. Adenokarcinom jícnu nyní tvoří více než polovinu všech nově diagnostikovaných karcinomů v západních rozvinutých zemích [1]. O zastoupení jednotlivých histologických typů nejsou k dispozici dostupná publikovaná česká data.
K vývoji spinocelulárního karcinomu jícnu predisponují stavy, kdy dochází k chronické zánětlivé nebo chemické iritaci sliznice jícnu (tab. 1). Za prekancerózu lze označit následné stavy po poleptání jícnu se strikturami, achalázii jícnu bez ohledu na provedenou terapii a některé vzácné syndromy – tylóza (vrozená hyperkeratóza), Plummer ‑ Vinsonův syndrom (sideropenická anémie, dysfagie, jícnové prstence) [4]. Ve vyšším riziku vzniku metachronního nebo synchronního spinocelulárního karcinomu jsou též nemocní s diagnostikovaným spinocelulárním karcinomem hlavy a krku. Zde jde pravděpodobně o vliv podobných rizik na podobném slizničním terénu [5].
Tab. 1. Choroby/prekancerózy se zvýšeným rizikem vývoje nádorů jícnu. 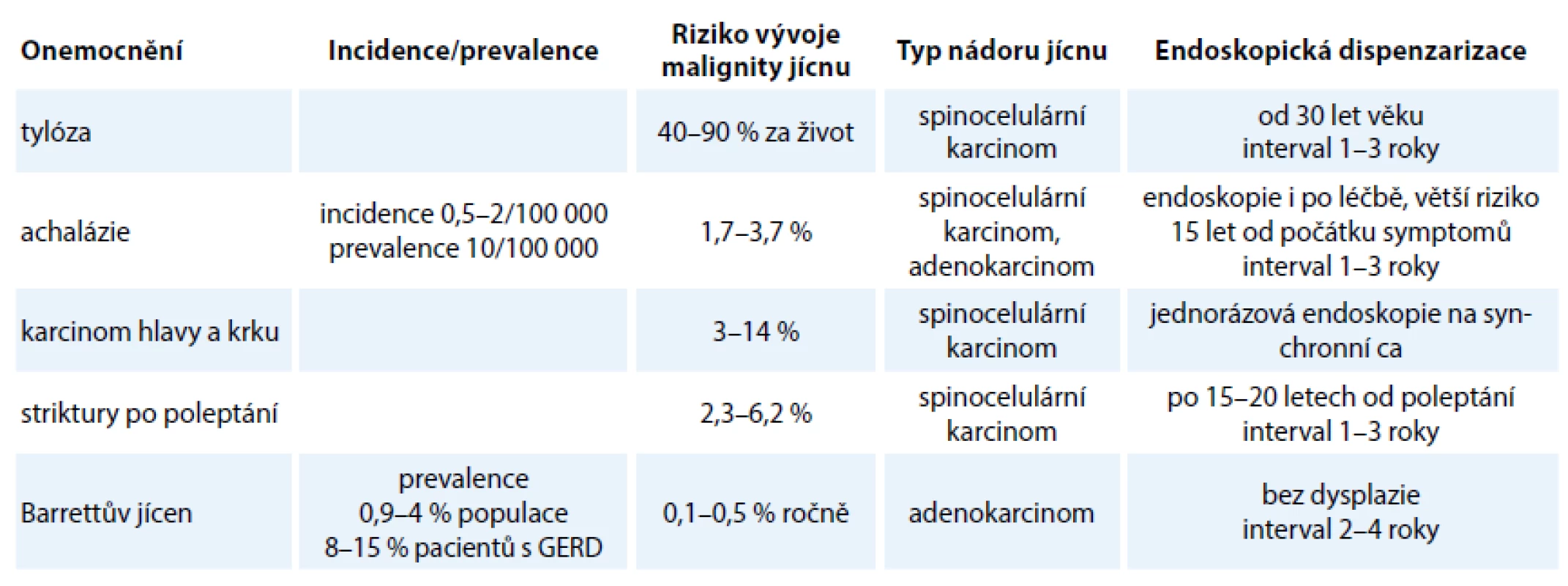
Z rizikové populace pro spinocelulární karcinom jícnu se praktický lékař nebo onkolog nejčastěji potká s pacientem s nádorem hlavy a krku. V rámci stagingového vyšetření by měla být provedena i horní digestivní endoskopie s přehlédnutím sliznice jícnu k detekci případných abnormalit [6]. Výtěžnost vyšetření lze zvýšit použitím moderních endoskopů s elektronickým zpracováním světla i obrazu, nebo využitím speciálního barvení Lugolovým roztokem (normální dlaždicový epitel se barví, dysplastický a nádor nikoli) [7]. Četnost synchronních nádorů jícnu se uvádí v relativně vysokém rozmezí 3 – 13 % [6,8]. Pro pozdější opakované vyšetřování jícnu u nemocných s nádory hlavy a krku neexistují žádná doporučení. U pacientů ve stabilizovaném stavu lze uvažovat o kontrole s odstupem 2 – 4 let, protože riziko zůstává zvýšeno a metachronní nádory jsou popisovány v intervalu s mediánem kolem čtyř let [9]. Těžká intraepiteliální neoplazie nebo některé případy časného povrchového karcinomu jícnu lze efektivně léčit metodou endoskopické resekce nebo radiofrekvenční ablace [6,10].
Dominující prekanceróza, nález v jícnu se zvýšeným rizikem následného vývoje adenokarcinomu, je tzv. Barrettův jícen (BJ). Jde o jeden z projevů (komplikaci) refluxní nemoci jícnu, tj. opakovaného a obtěžujícího návratu žaludečního obsahu do jícnu [11]. Na základě hodnocení refluxních symptomů nelze usuzovat na stupeň změn na sliznici jícnu. U pacientů s letitým dlouhotrvajícím gastroezofageálním refluxem, zvláště u obézních mužů ve věku nad 50 let, je riziko vývoje Barrettova jícnu vyšší [12].
Barrettův jícen je stav, kdy je část původní sliznice jícnu s dlaždicovým epitelem nahrazena epitelem metaplastickým cylindrickým. Tato oblast bývá endoskopicky (makroskopicky) viditelná a histologicky by měla obsahovat tzv. intestinální metaplazii.
Prevalence Barrettova jícnu v obecné populaci je na základě dostupných dat udávána kolem 1,5 %. Barrettův jícen se vyskytuje asi u 9 – 15 % pacientů s refluxní nemocí jícnu (gastroezophageal reflux disease – GERD). Nicméně takřka u poloviny nemocných s adenokarcinomem jícnu nebyly v anamnéze příznaky refluxu přítomny [13]. Stejně tak BJ může být náhodně zachycen u osob se zcela chybějícími refluxními symptomy. Screen-ing BJ v populaci pacientů s GERD nemusí tak vést k významnému dopadu na výskyt adenokarcinomu jícnu v populaci. Jen zřídka je pozorovatelný vznik Barrettova jícnu de novo u pacientů opakovaně endoskopovaných pro refluxní potíže nebo jasná progrese rozsahu BJ v čase. To může svědčit pro relativně náhlý vznik metaplastické sliznice v disponovaném terénu chronického dráždění gastroezofageálním refluxem současně s relativně akutním slizničním poškozením vlivem jiných faktorů. Hojení slizničního defektu pak za jistých podmínek (genetických, přítomnost žlučových kyselin, exprese mediátorů apod.) může vést k přerůstání metaplastického epitelu namísto původního [14].
Endoskopický screening u všech osob s refluxními potížemi není všeobecně akceptován a pravděpodobně není ani dostatečně efektivní. Naopak zvláštní pozornost i s opakovanou endoskopií při dlouhotrvajících potížích by měla být věnována osobám s přítomností rizikových faktorů – věk nad 50 let, mužské pohlaví, přítomnost hiátové hernie, zvýšený BMI a abdominální typ obezity. Při absenci známek Barrettova jícnu na vstupním vyšetření a trvající refluxní symptomatologii vyžadující dlouhodobou udržovací léčbu mohlo by být přínosné opakovat endoskopii s odstupem 5 – 10 let. Záleží na zhodnocení konkrétní situace lékařem a přání pacienta. U pacientů na dlouhodobé udržovací antirefluxní medikaci byl po pěti letech nově zjištěn Barrerttův jícen ve 4 – 10 % dle tíže vstupního nálezu refluxních změn [15].
U zdravých osob je hranice cylindrického žaludečního a dlaždicového jícnového epitelu ve stejné úrovni s morfologickou hranicí jícnu a žaludku. Endoskopicky lze hranici mezi jícnem a žaludkem určit ve výši horního zakončení žaludečních řas. Makroskopicky je možné hranici epitelů vidět jako rozhraní mezi světle růžovým epitelem jícnu a lososově červeným cylindrickým epitelem žaludku. U pacientů s Barrettovým jícnem je toto rozhraní sliznic posunuto proximálně do jícnu ve formě cirkulárního segmentu nebo různě vybíhajících jazyků.
První popis tohoto nálezu pochází z roku 1950 od Normana Barretta. Domníval se, že se jedná o vrozenou abnormalitu. Pozdějším výzkumem se prokázalo, že jde o stav získaný v důsledku dlouhodobého gastroezofageálního refluxu. Relativně vysoký výskyt adenokarcinomu jícnu v terénu Barrettova jícnu ho zařadil mezi prekancerózy. Riziko vývoje adenokarcinomu u osob s Barrettovým jícnem je asi 30 – 40krát vyšší než u osob bez něj.
Adenokarcinom jícnu se vyvine během sledování asi u 0,2 – 0,5 % pacientů s BJ za rok. Dřívější údaje uváděly ještě vyšší incidenci, naopak recentní data podporují dolní hranici rozmezí [16,17].
Riziko vzniku adenokarcinomu stoupá se zachyceným stupněm dysplazie v metaplastickém epitelu. Pro spolehlivé hodnocení stupně dysplazie v Barrettově jícnu (a následně i strategie další péče) je vhodné posouzení patologem specializovaným na tuto oblast, např. formou druhé konzultace [18]. Dysplazii lze hodnotit jako nízký (LGD) a vysoký (HGD) stupeň. Roční riziko adenokarcinomu u LGD je asi 0,5 – 1 %, u HGD 4 – 6 %.
Standardní diagnostika BJ je endoskopická s potvrzeným odběrem biopsie z oblasti distálního jícnu. Neměla by se provádět ve fázi aktivní ezofagitidy, ale až po jejím zhojení při léčbě. Endoskopický nález je popisován pomocí tzv. Pražské C a M klasifikace. Jde o strukturované hodnocení cirkulárního segmentu (C) a maximální výšky vybíhajících jazyků (M).
Stěžejní úkol endoskopické dispenzarizace pacientů s prokázaným BJ je zachycení časných dysplastických a neoplastických změn a možnost jejich kurativního řešení [19].
Moderní endoskopické techniky umož-ňuji detailní přehlédnutí segmentu metaplastické sliznice a záchyt případných viditelných nepravidelností. K vyšetření pacienta s BJ je vhodné využít nejlepší endoskop na pracovišti s vysokým rozlišením. Ke zlepšení vykreslení reliéfu sliznice lze použít lokální aplikaci acidum aceticum. Metaplastický, resp. dysplastický epitel odlišně váže i specifická barviva (metyl modř, Lugolův roztok). Modifikace světelného spektra a elektronické zpracování v endoskopu (NBI, I ‑ scan, FICE) přispěje ke zvýraznění sliznice a cévních struktur a opět záchytu odlišností [20]. Všechny tyto techniky umožňují více času věnovat pátrání po diskrétních abnormalitách a nezačínat odebírat biopsie naslepo, což většinou způsobí krvácení ze sliznice a ztrátu přehlednosti.
V případě, že nejsou abnormity patrné, odebírají se biopsie každé 2 cm ze všech čtyřech kvadrantů (Seattle protokol) (tab. 2) [21].
Tab. 2. Doporučený postup dispenzarizace nemocných s BJ. 
Pacient s BJ by měl dostávat plnou antirefluxní terapii vedoucí k potlačení produkce žaludeční kyseliny inhibitory protonové pumpy (2 × 20 mg omeprazol, 2 × 30 mg lanzoprazol, 2 × 40 mg pantoprazol, 1 – 2 × 40 mg esomeprazol) bez ohledu na přítomnost refluxních symptomů [22]. Nejsou (a pravděpodobně nikdy již nebudou) k dispozici výsledky randomizovaných kontrolovaných studií, jež by svědčily o tom, že adekvátní antisekreční léčba chrání před vznikem karcinomu, ale na její určitý pozitivní vliv lze nepřímo usuzovat z celé řady dat. Snížení rizika vývoje karcinomu nebylo přímo prokázáno ani po účinné antirefluxní operaci. Teoreticky lze předpokládat lepší kontrolu refluxu a nižší vystavení jícnu kontaktu se žaludečním obsahem po úspěšné antirefluxní operaci než při farmakoterapii, avšak signifikantní rozdíl v obou typech léčby nebyl prokázán [23]. Samotná přítomnost Barrettova jícnu není tím faktorem, který by měl určovat indikaci operace. Sledování pacientů i po operaci by mělo být stejné jako bez ní.
Uznávaný důvod k endoskopické intervenci na sliznici Barrettova jícnu je v současné době nález těžké dysplazie pro velké riziko vzniku následného či koincidujícího adenokarcinomu a odstranění již prokázaného adenokarcinomu v časném stadiu [24]. Kontraindikovány jsou léze s vředem a infiltrující sm2 – 3, dále je nutno zhodnotit stupeň diferenciace, makroskopický vzhled a velikost a riziko případného chirurgického výkonu. V případě nevhodnosti endoskopické léčby nebo pokročilého nálezu invazivního karcinomu je na místě chirurgická resekce. Výborné výsledky 5letého přežití pacientů po slizniční resekci časného adenokarcinomu jsou v kontrastu s relativně významnou pooperační morbiditou i mortalitou u chirurgické ezofagektomie.
Rozlišujeme dva základní typy endoskopické léčby – endoskopickou resekci a ablaci [25].
Při resekci je endoskopicky snášena sliznice pomocí vytvoření „pseudopolypů“ podpichem a nasátím do nádstavce endoskopu a následným seříznutím diatermickou kličkou. Materiál lze vybavit k histologickému vyšetření. Někdy je nutné postupovat po částech a i na několik etap. Náročnější technika tzv. submukózní disekce umožní endoskopickou technikou preparovat v podslizniční vrstvě a snést celý segment sliznice vcelku.
Ablační metody vedou různým mechanizmem ke zničení metaplastického epitelu in situ. Nevýhoda je nemožnost histologického zhodnocení celé postižené oblasti. K ablaci lze využít koagulaci pomocí APC (argonové plazmy), fotodynamickou terapii nebo radiofrekvenční ablaci povrchové vrstvy sliznice pomocí elektrody na balónu (systém HALO Barrx). Probíhající studie ukazují na možné perspektivní využití v algoritmu léčby dysplastického Barrettova jícnu s nízkým stupněm recidivy a komplikací [26,27].
Nové možnosti k vyhledávání pacientů s BJ a vyšším rizikem vývoje karcinomu by mohly být založeny na detekci molekulárně biologických markerů (p53, KRT1, COX2) ve sliznici. Vysoká exprese genu cyklooxygenázy 2 a její význam v proliferaci by mohl být teoreticky ovlivnitelný jejími inhibitory. Epidemiologické údaje ukazují na možné snížení rizika karcinomu jícnu u uživatelů kyseliny acetylsalicylové a ostatních nesteroidních antiflogistik. [28]. V tuto chvíli vzhledem k nedostatečně prokázanému přímému pozitivnímu efektu a riziku nežádoucích účinků není léčba selektivními i neselektivními inhibitory COX2 v chemoprofylaxi indikována v klinické praxi.
Závěr
Nejvýznamnější prekanceróza jícnu je tzv. Barrettův jícen. Vzniká v důsledku dlouhotrvajícího gastroezofageálního refluxu. Pacienti s BJ by měli být pravidelně endoskopicky dispenzarizováni. Nezbytná součást léčby je účinná antirefluxní terapie. V případě průkazu těžkého stupně dysplazie nebo časného adenokarcinomu je indikována intervence – endoskopická resekce nebo ablace, případně resekce jícnu.
Z praktického hlediska má význam též vyšetřování a kontroly u pacientů s achalázií, po poleptání jícnu a při současné přítomnosti karcinomu hlavy a krku (tab. 3).
Tab. 3. Souhrn informací o prekancerózách jícnu. 
Práce byla podpořena MZ ČR – RVO (FNBr, 65269705).
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Radek Kroupa, Ph.D.
Interní gastroenterologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: rkroupa@fnbrno.cz
Obdrženo: 12. 9. 2013
Přijato: 27. 9. 2013
Zdroje
1. Magnusková S, Kollárova H, Kamarád V et al. Dvojí tvář rakoviny jícnu – epidemiologie a etiologie. Gastroent Hepatol 2011; 65(5): 255 – 263.
2. Kubo A, Block G, Quesenberry CP Jr. Effects of dietary fiber, fats, and meat intakes on the risk of Barrett‘s esophagus. Nutr Cancer 2009; 61(5): 607 – 616.
3. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita, [cit. 2013 – 8 – 24]. Dostupný z: www.svod.cz.
4. Hirota WK, Zuckerman MJ, Adler DG et al. ASGE guideline: the role of endoscopy in the surveillance of premalignant conditions of the upper GI tract. Gastrointest Endosc 2006; 63(4): 570 – 580.
5. Cooper JS, Pajak T, Rubin P et al. Second malignancies in patients who have head and neck cancer: incidence, effect on survival and implications implications based on the RTOG experience. Int J Radiat Oncol Biol Phys 1989; 17(3): 449 – 456.
6. Vítek P, Komínek P, Kajzrlíková I et al. Endoskopická diagnostika a léčba časného spinocelulárního karcinomu jícnu je možná i v populaci s nízkou incidencí tohoto onemocnění. Endoskopie 2009; 18(4): 161 – 166.
7. Moschler O, Spahn TW, Middelberg ‑ Bisping C et al. Chromoendoscopy is a valuable tool for screening of high‑risk patients with head and neck cancer for early detection of esophageal cancer. Digestion 2006; 73(2 – 3): 160 – 166.
8. Su YY, Chen WC, Chuang HC et al. Effect of routine esophageal screening in patients with head and neck cancer. JAMA Otolaryngol Head Neck Surg 2013; 139(4): 350 – 354.
9. Petit T, Georges C, Jung GM et al. Systematic esophageal endoscopy screening in patients previously treated for head and neck squamous ‑ cell carcinoma. Ann Oncol 2001; 12(5): 643 – 646.
10. Bergman JJ, Zhang YM, He S et al. Outcomes from a prospective trial of endoscopic radiofrequency ablation of early squamous cell neoplasia of the esophagus. Gastrointestinal Endoscopy 2011; 74(6): 1181 – 1190.
11. Vakil N, van Zanten SV, Kahrilas P et al. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence‑based consensus. Am J Gastroenerol 2006; 101(8): 1900 – 1920.
12. Spechler SJ, Sharma P, Souza RF et al. American Gastroenterological Association. American Gastroenterological Association technical review on the management of Barrett‘s esophagus. Gastroenterology 2011; 140(3): e18 – e52.
13. Sharma P. Clinical practice. Barrett‘s esophagus. N Engl J Med 2009; 361(26): 2548 – 2556.
14. Dent J. Barrett‘s esophagus: A historical perspective, an update on core practicalities and predictions on future evolutions of management. J Gastroenterol Hepatol 2011; 26 (Suppl 1): 11 – 30.
15. Malfertheiner P, Nocon M, Vieth M et al. Evolution of gastro‑esophageal reflux disease over 5 years under routine medical care – the ProGERD study. Aliment Pharmacol Ther 2012; 35(1): 154 – 164.
16. Sharma P, Falk GW, Weston AP et al. Dysplasia and cancer in a large multicenter cohort of patients with Barrett’s esophagus. Clin Gastroenterol Hepatol 2006; 4(5): 566 – 572.
17. Hvid ‑ Jensen F, Pedersen L, Drewes AM et al. Incidence of adenocarcinoma among patients with Barrett‘s esophagus. N Engl J Med 2011; 365(15): 1375 – 1383.
18. Ayers K, Shi C, Washington K. Expert pathology review and endoscopic mucosal resection alters the diagnosis of patients referred to undergo therapy for Barrett‘s esophagus. Surg Endosc 2013; 27(8): 2836 – 2840.
19. Martínek J, Zavoral M. Barrettův jícen – jak sledovat a jak léčit. Postgraduální medicína 2009; 11(6): 674 – 682.
20. Gregar J, Procházka V, Lužná P et al. Využití NBI v diagnostice a sledování pacientů s Barrettovým jícnem. Gastroent Hepatol 2012; 66(3): 165 – 169.
21. Voltaggio L, Montgomery EA, Lam ‑ Himlin D. A clinical and histopathologic focus on Barrett esophagus and Barrett‑related dysplasia. Arch Pathol Lab Med 2011; 135(10): 1249 – 1260.
22. Lukáš K, Bureš J, Drahoňovský V et al. Refluxní choroba jícnu. Standardy České gastroenterologické společnosti – aktualizace 2009. Vnitř Lék 2009; 55(10): 967 – 975.
23. Spechler SJ. Barrett esophagus and risk of esophageal cancer: a clinical review. JAMA 2013; 310(6): 627 – 636.
24. Bennett C, Vakil N, Bergman J. Consensus statements for management of Barrett‘s dysplasia and early‑stage esophageal adenocarcinoma, based on a Delphi process. Gastroenterology 2012; 143(2): 336 – 346.
25. Rejchrt S, Repák R, Bureš J. Endoskopická diagnostika a léčba časného adenokarcinomu jícnu. Endoskopie 2009; 18(4): 144 – 149.
26. Martínek J, Falt P, Gregar J et al. Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v ČR. Gastroent Hepatol 2011; 65(5): 279 – 285.
27. Phoa KN, Pouw RE, van Vilsteren FG et al. Remission of Barrett‘s esophagus with early neoplasia 5 years after radiofrequency ablation with endoscopic resection: a Netherlands cohort study. Gastroenterology 2013; 145(1): 96 – 104.
28. Corley DA, Kerlikowske K, Verma R et al. Protective association of aspirin/ NSAIDs and esophageal cancer: a systematic review and meta‑analysis. Gastroenterology 2003; 124(1): 47 – 56.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Prekancerózy v ORL oblastiČlánek EditorialČlánek Prekurzory karcinomu prsuČlánek Prekancerózy žaludkuČlánek Prekancerózy tlustého střeva
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2013 Číslo Supplementum- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Prekancerózy v ORL oblasti
- Prekancerózy jícnu
- Prekancerózy žaludku
- Prekancerózní stavy a rizikové faktory karcinomu pankreatu a žlučových cest
- Editorial
- Premaligní stavy tenkého střeva
- Prekancerózy tlustého střeva
- Prekancerózy v gynekologii – vulva
- Prekancerózy v gynekologii – pochva
- Prekancerózy v gynekologii – děložní hrdlo
- Prekancerózy v gynekologii – endometrium
- Prekancerózy v gynekologii – ovarium
- Prekurzory karcinomu prsu
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prekancerózy žaludku
- Prekancerózy tlustého střeva
- Prekancerózy v gynekologii – vulva
- Prekancerózy v ORL oblasti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



