-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů
The Use of PET/CT Fusion in Radiotherapy Treatment Planning of Non-Small-Cell Lung Cancers
Backgrounds:
Lung cancer is currently the most frequently diagnosed malignant disease worldwide and radiotherapy has a fundamental and irreplaceable role in the therapeutic algorithm of this disease. Conventionally, radiotherapy is planned using CT alone. However, this could be a source of many inaccuracies and errors in the process of contouring the target volumes, the likelihood of which could be decreased by using the data from PET imaging and, ideally, from a fusion of PET and CT (as has already been proven in the diagnosis of lung cancer).Case:
This review is devoted to all important aspects related to the use of PET/CT imaging in radiotherapy treatment planning of non-small-cell lung cancer and to the advantages resulting from its use.Conclusion:
Investigation of PET/CT imaging is a useful tool leading to increased accuracy of contouring of the target volumes. The integration of both diagnostic modalities reduces the limitations of these modalities if used separately. The use of combined PET/CT imaging often leads to an identification of a change in tumor size (it also often uncovers distant metastases) resulting in a change of treatment intention. The change of the target volume size and thus the change of irradiated volume of critical structures could lead to an increase of the dose delivered to the tumor in situations when a reduction of these volumes was reached. Investigation of PET/CT imaging also has a positive impact on subjective approach to contouring by different radiation oncologists.Key words:
lung cancer – radiotherapy – radiotherapy planning – target volumes – investigation of PET/CT imaging
Autoři: R. Vojtíšek; K. Havránek; J. Fínek
Působiště autorů: Radioterapeutické a onkologické oddělení, FN Plzeň
Vyšlo v časopise: Klin Onkol 2011; 24(1): 23-34
Kategorie: Přehledy
Souhrn
Východiska:
Karcinom plic je v současné době celosvětově nejčastěji diagnostikovaným nádorovým onemocněním, v jehož léčebném algoritmu hraje zásadní a nezastupitelné místo radioterapie. Konvenčně je radioterapie plánována pomocí samotného CT vyšetření, což však může být zdrojem mnoha nepřesností a chyb při konturaci cílových objemů. Snížit pravděpodobnost jejich vzniku by mohlo použití dat z vyšetření PET, optimálně z fúze PET a CT vyšetření, jak bylo již dokázáno v diagnostice plicních karcinomů.Cíl:
Tento přehledový článek se podrobně věnuje všem důležitým aspektům týkajícím se využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů a výhodám z toho plynoucích.Závěr:
PET/CT vyšetření je užitečným nástrojem vedoucím ke zvýšení přesnosti konturace cílových objemů. Integrace obou těchto diagnostických metod výrazným způsobem snižuje limity, které tato vyšetření mají, jsou-li použita samostatně. Použití kombinovaného PET/CT vyšetření často vede ke zjištění změny rozsahu nádorového postižení (nezřídka objeví ložiska vzdálené diseminace), důsledkem čehož je i změna léčebného záměru. Změna velikosti cílového objemu a tím i změna ozářeného objemu kritických struktur může vést ke zvýšení aplikované dávky do tumoru v těch situacích, kdy došlo ke zmenšení těchto objemů. Rovněž má PET/CT vyšetření pozitivní vliv na subjektivní pojetí konturace jednotlivými radiačními onkology.Klíčová slova:
karcinom plic – radioterapie – plánování radioterapie – cílové objemy – PET/CT vyšetřeníÚvod
Karcinom plic je celosvětově nejčastěji diagnostikovaným nádorovým onemocněním. V roce 2002 bylo na celém světě toto onemocnění diagnostikováno u 1,35 mil. lidí. Druhým a třetím nejčastěji diagnostikovaným nádorovým onemocněním je karcinom prsu (1,15 mil.), resp. kolorektální karcinom (1 mil.). Karcinom plic je také nejčastější příčinou úmrtí na nádorové onemocnění, v roce 2002 vedl k úmrtí u 1,18 mil. lidí. Na druhém a třetím místě je karcinom žaludku (700 000), resp. karcinom jater (598 000) [1].
V rozvinutých zemích incidence a mortalita karcinomu plic u mužů klesá a u žen se pomalu začíná stabilizovat, což je pravděpodobně způsobeno změnami v kuřáckých návycích u obou pohlaví. Naopak v některých méně rozvinutých zemích pokračuje vzestupná tendence způsobená zejména endemickým nadužíváním tabákových výrobků [2].
Ve Spojených státech amerických jsou nádory plic také nejčastější příčinou úmrtí na nádorové onemocnění u mužů i u žen. Incidence a mortalita u mužů mezi roky 1990 a 2005 poklesla [3].
Česká republika není v této oblasti žádnou výjimkou, karcinom plic u nás zaujímá čelní postavení v incidenci a mortalitě, u mužů se jedná o nejčastější nádorové onemocnění vůbec (nepočítáme-li nádory kůže), u žen pak zaujímá třetí místo za nádory prsu a tlustého střeva. V roce 2006 bylo hlášeno 4 529 nových případů u mužů, tj. 90,3 případu/100 000 (v roce 2002 byla incidence 91,4/100 000) a 1 659 nových případů u žen, tj. 31,6 případu /100 000 (v roce 2002 to bylo 26,8/100 000). Agresivní chování nádoru se odráží i v jeho vysoké mortalitě, která činila v roce 2006 u mužů 81,1/100 000 (v roce 2002 86/100 000), u žen byla mortalita 27,6/100 000 (v roce 2002 24,3/100 000), tedy 4 065, resp. 1 451 úmrtí v důsledku onemocnění plicním karcinomem. Je zřejmé, že v České republice dochází k pomalému poklesu incidence a mortality u mužů, naopak u žen přetrvává pozvolný nárůst těchto ukazatelů [4]. V kontextu tvrzení o pokračující vzestupné tendenci incidence plicního karcinomu u ženské populace se řadíme na úroveň méně rozvinutých zemí.
Plicní (bronchogenní) karcinomy se obecně dělí na dva základní typy – skupinu nemalobuněčných plicních karcinomů (non-small-cell lung cancer – NSCLC), která se podílí na celkovém zastoupení plicních karcinomů 75–80 %, a malobuněčný plicní karcinom (small--cell lung cancer – SCLC), zaujímající zbývajících 20–25 %. Oba typy se od sebe liší jak biologickým chováním a prognózou, tak i léčebnou strategií.
Plánování radioterapie nemalobuněčných plicních karcinomů
Cílové objemy jsou v radioterapii obecně definovány podle doporučení ICRU (International Commission on Radiation Units and Measurements) Report 50 a 62 [5,6]. GTV (GTV-T, GTV-N) se konturuje jak v plicním (GTV-T), tak i mediastinálním okně (GTV-N) CT řezů. Lymfatické uzliny, které jsou větší než 1 cm, jsou obecně považovány za pozitivní a měly by být tedy zahrnuty do GTV-N. Nespornou výhodou v hodnocení jejich postižení se zdá být využití PET/CT, jak bude níže ještě podrobněji rozebráno. V roce 2000 publikovali Giraud et al [7] radiologicko-histopatologickou studii, která ve svém závěru navrhla a doporučila následující velikosti lemů CTV kolem GTV k tomu, aby bylo dosaženo 95% pokrytí mikroskopické choroby v plicním parenchymu. Je to 6 mm pro dlaždicobuněčné karcinomy a 8 mm pro adenokarcinomy a ostatní histologické typy. Lemy je však nutno definovat přísně individuálně a vždy přizpůsobovat konkrétnímu nálezu, nelze je používat nekriticky. Konturovat bezpečnostní lemy, tedy PTV (internal margin IM + set up margin SM), je nutné opět přísně individuálně v závislosti na pohybu tumoru a podle vyhodnocení systematických a náhodných chyb na každém jednotlivém pracovišti [8].
Existuje několik situací, které způsobují radiačnímu onkologovi problémy při konturaci cílových objemů. V první řadě jsou to tumory způsobující atelektázu, kdy je velmi obtížné až nemožné odlišit vlastní tumor od kolabované plíce (obr. 1 a 2). Rovněž přesné ohraničení spikulárních lézí a lézí v přítomnosti dystelektatických změn je velmi obtížné. Protože i nezvětšené lymfatické uzliny mohou být infiltrované nádorovými buňkami a protože zvětšené uzliny nemusí být nutně postižené nádorem, nelze brát konvenční (na velikosti založená) kritéria pro posouzení stavu lymfatických uzlin za přesná. Kromě zobrazovacích metod detekujících změny anatomických poměrů (RTG, CT, MR atd.) jsou dnes k dispozici také zobrazovací metody funkční, jako je například pozitronová emisní tomografie (PET), jejímž principem je detekce metabolických změn uvnitř buněk za použití radiofarmak příbuzných endogenním molekulám [9].
Obr. 1. Infiltrovaná oblast kolabované plíce – PET vyšetření. 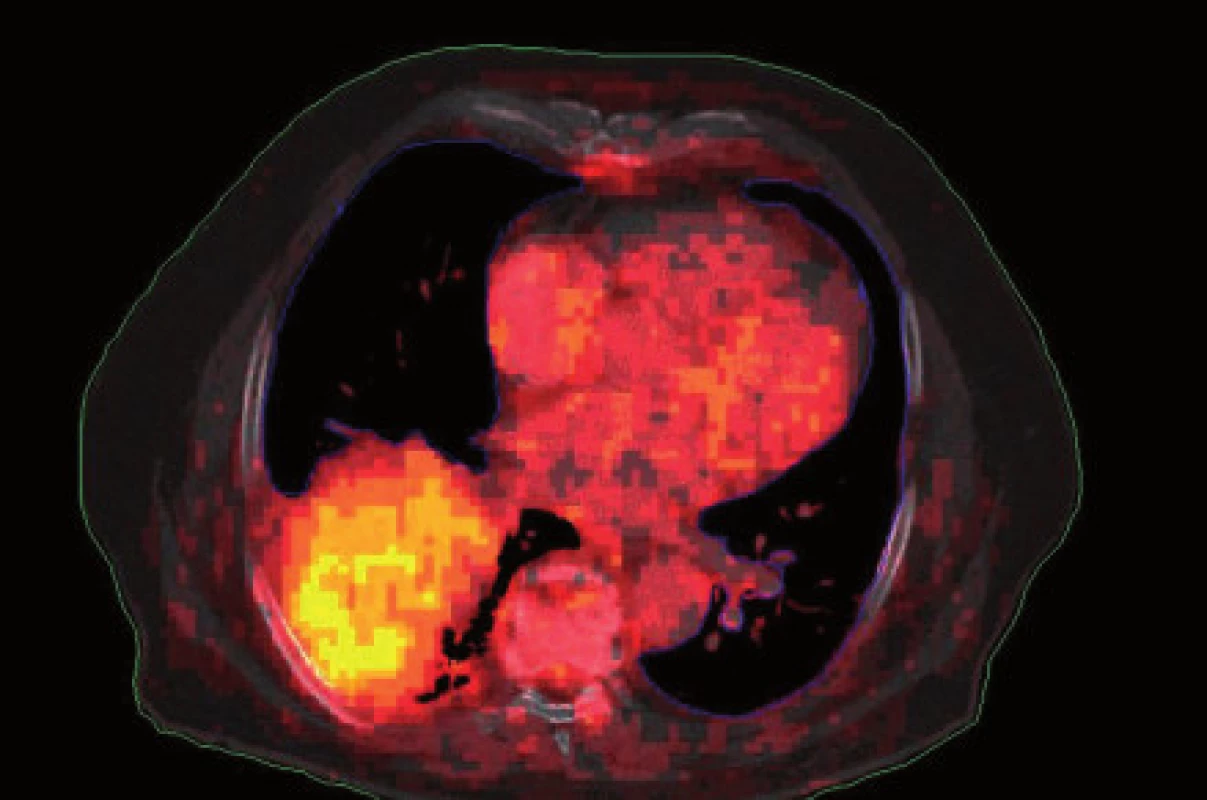
Obr. 2. Stejný pacient jako na obr. 1. Konturace cílového objemu bez znalosti nálezu na PET. 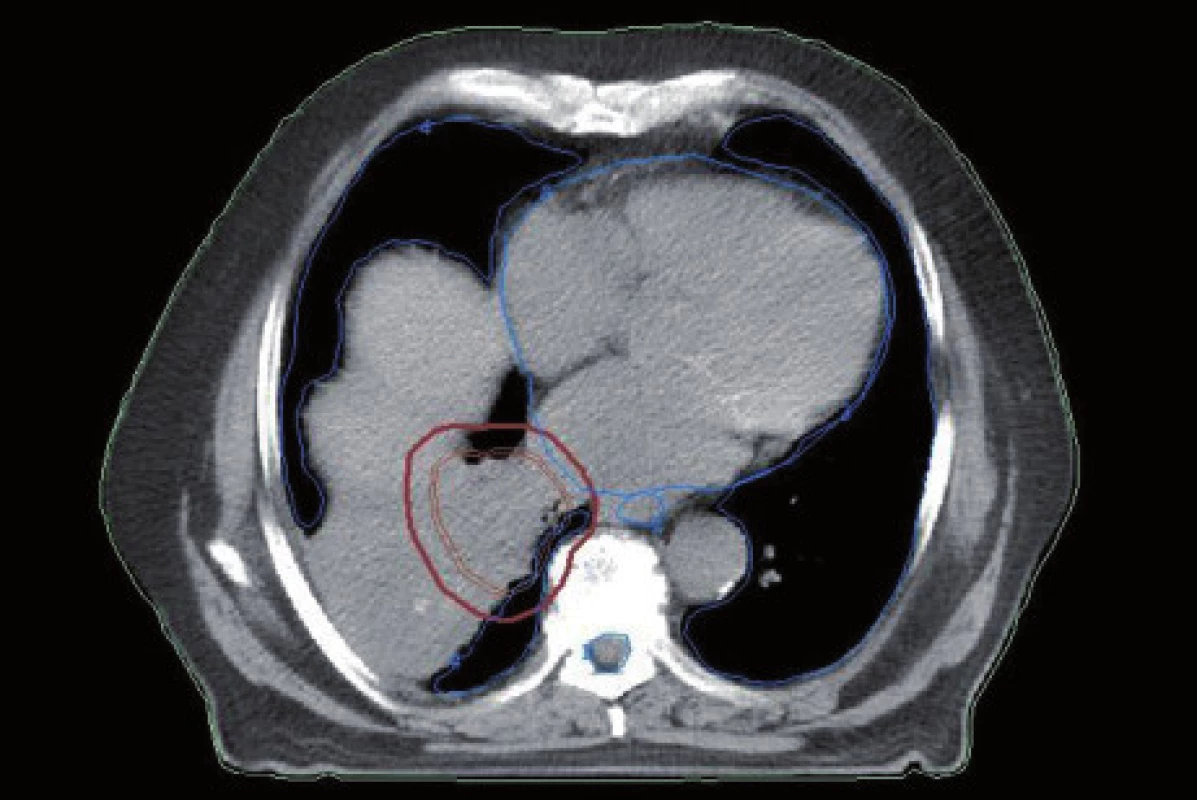
Nejčastěji užívaným radiofarmakem je 18F-fluorodeoxyglukóza (FDG), která dovoluje zobrazit nádorové buňky na základě zvýšeného metabolizmu glukózy v nádorových buňkách ve srovnání s normálními buňkami. Tento mechanizmus byl poprvé popsán Warburgem [10] ve 30. letech 20. století. 18F-fluorodeoxyglukóza je fosforylována uvnitř buňky na FDG-6-fosfát a ten je zde akumulován z důvodu nedostatečné aktivity fosfatázy v nádorových buňkách. Glukózové transportní proteiny se také spolupodílejí na zvýšeném transportu FDG do nádorových buněk [11]. Právě vyšší množství glukózových transportérů a hexokinázy a nižší množství glukóza-6-fosfatázy odlišuje nádorové buňky od buněk normálních [12]. Zobrazení pomocí PET je tedy založeno na metabolických neboli funkčních změnách buněk, což může pomoci detekovat subklinický tumor, neboť ke změnám na molekulární úrovni dochází dříve než k anatomickým změnám. Stejně je tomu i u normálně vyhlížejících lymfatických uzlin [9].
Limitací PET vyšetření je nedostatečná informace o přesné anatomické lokalizaci léze, špatná prostorová rozlišovací schopnost [13] a také ta skutečnost, že FDG není specifická pro nádorovou tkáň. Ke zvýšení diagnostické jistoty, k přesnější definici cílových objemů a tak i ke zmenšení rozpaků radiačního onkologa při konturaci přispívá hybridní vyšetření PET a CT, čili fúze PET/CT, která v sobě kombinuje jak detekci změn anatomických poměrů, tak i funkčních změn. V dnešní době lze tato dvě vyšetření provést na jednom vyšetřovacím stole, ve stejné vyšetřovací poloze nemocného. První prototyp kombinovaného integrovaného PET/CT skeneru byl vyvinut v Pittsburgu roku 1998 [14] a komerčně dostupným se stal na jaře 2001 [15].
Kombinované vyšetření má prokázanou vyšší diagnostickou přesnost než samotné CT či PET. V diagnostice nemalobuněčných plicních karcinomů je senzitivita tohoto vyšetření 89%, specificita 94% a celková diagnostická přesnost 93% [16]. Senzitivita samotného CT vyšetření je 57% a specificita 82% (tab. 1) [17]. Je zřejmé, že použití integrovaného PET/CT je mnohem přesnější než vizuální korelace PET a CT vyšetření provedených samostatně [16,18].
Plánování radioterapie s pomocí PET/CT vyšetření
Definice GTV
Nejdůležitějším momentem při plánování radioterapie je přesná definice a konturace cílového objemu a to zejména vlastního nádorového ložiska – GTV. Limity, s kterými se musíme při konturaci vypořádat, byly již uvedeny výše. Fúzí CT s PET se předpokládá zvýšení přesnosti konturace a omezení geometrické nepřesnosti. V první řadě je potřeba přiblížit způsoby definice GTV na obrázcích z PET. Jelikož se jedná o funkční zobrazovací metodu, GTV je definován podle poněkud odlišných principů než podle zobrazovacích metod detekujících anatomické změny.
SUV
SUV (standardized uptake value) je semi-kvantitativní bezrozměrná hodnota, která by měla odlišit normální a abnormální akumulaci použitého radiofarmaka. Definována je jako poměr aktivity na jednotku objemu zájmové oblasti a aktivity na jednotku objemu celého těla [22]. Všeobecně byly a stále ještě jsou hodnoty SUV nad 2,5 považované za ukazatele přítomnosti maligní tkáně, ale také se ví, že hodnoty kolem 2,5 mohou vykazovat také nemaligní tkáně. A naopak, malé nádory mohou vykazovat SUV menší než 2,5 [23]. Použití této hodnoty může zákonitě vést k falešně negativnímu hodnocení malých pozitivních uzlin z důvodu nízkého SUV způsobeného parciálním objemovým efektem. Navíc některé dobře diferencované plicní karcinomy mají nízký SUV, zatímco některé zánětlivé procesy mají hodnoty SUV vyšší než 2,5 [24]. K určení okrajů GTV se tedy příliš nehodí, jedná se o nepřesnou metodu, jak bude ještě níže rozebráno. Existuje množství faktorů, které ovlivňují akumulaci radiofarmaka ve tkáni. Jedná se zejména o množství podané dávky/aktivity, krevní perfuzi danou tkání, inzulinovou rezistenci organizmu, čas snímání aktivity po aplikaci a dýchací pohyby [25].
Hranice GTV
Rozlišovací schopnost PET je poměrně malá, průměrně asi 4,5 mm, a proto bývají okraje zobrazeného tumoru poněkud rozmazané. Tato situace je také ovlivněna používaným softwarem, kontrastem mezi tumorem a pozadím a jinými artefakty [26].
Literárně je popsáno několik možností a způsobů, jak definovat hranice GTV na PET skenech. Historicky první a v současnosti asi nejpoužívanější metoda je využití všech dostupných klinických nálezů, zkušeností a znalostí plánujícího radiačního onkologa, neboli metoda vizuálního hodnocení.
Druhým způsobem, který byl v několika studiích zkoumán, je použití matematických automatických či semi-automatických modelů k určování hranic. K hodnocení se používají určité prahové cut-off hodnoty, a to buď procento maximální hodnoty SUV (nejčastěji 40 % [27–29], 42 % [30,31] a 50 % [20,26,32]), anebo absolutní hodnota SUV (zpravidla SUV 2,5 [33]) – do cílového objemu jsou zahrnuty oblasti s hodnotou vyšší, než je hodnota uvedená jako prahová. V nukleární medicíně je dobře známo, že výběr prahové hodnoty závisí na velikosti, tvaru léze a kontrastu, a je jasně prokázáno, že znalost velikosti, tvaru a kontrastu před vyšetřením může pomoci lépe specifikovat prahové hodnoty k přesnému hodnocení objemu tumoru [34].
Použití hodnoty SUV 2,5 doporučili Hong et al [35], kteří porovnávali velikosti GTV u 19 pacientů s NSCLC. GTV byl definován vždy na podkladě CT (GTVCT), PET při použití prahové hodnoty SUV 2,5 (GTVSUV 2,5) a SUV 40 % (GTVSUV 40%). Signifikantní rozdíl (rozdíl větší než 25 %) byl pozorován u 58 % pacientů (11 z 19) pro GTVSUV 2,5 a u 95 % (18 z 19) pro GTVSUV 40% oproti původnímu GTVCT. Dva největší rozdíly byly způsobené atelektázou. Procentuální rozdíl mezi GTVSUV 2,5 a GTVSUV 40% byl konstantní u tumorů s maximálním SUV větším než 7, dále byly popisovány pouze minimální rozdíly mezi těmito objemy při velmi vysokých hodnotách maximálního SUV. Opačně je tomu u hodnot SUV maximálně kolem 4–6. Zde byly poměrně velké rozdíly v objemech. Nejlepší korelace byla zaznamenána pro prahové metody v tomto rozmezí u nádorů kolem 90 cm3, tzn. pro poměrně malé nádory.
Pro danou problematiku je zásadní práce Nestleho et al [36] z roku 2005. Na souboru 25 pacientů s NSCLC porovnávali 4 metody navzájem (1. GTV hodnocené vizuálně – GTVviz, 2. GTVSUV 40%, 3. GTVSUV 2,5, 4. GTV podle algoritmu porovnávajícího intenzitu aktivity nádoru a pozadí – GTVbg) navzájem a korelovali je s definicí GTV podle CT–GTVCT. Konturované objemy se zvětšovaly od GTVSUV 40% (střední objem 53,6 cm3), GTVbg (94,7 cm3), GTVviz (157,7 cm3) až k GTVSUV 2,5 (164,6 cm3). Zjištěné rozdíly dobře korelovaly s maximálním SUV, nádorovou homogenitou a velikostí léze. U nehomogenních lézí vedl GTVSUV 40% k vizuálně neadekvátnímu pokrytí nádoru u 3 z 8 pacientů. Ve srovnání s ostatními objemy nekoreloval také tento jediný objem (GTVSUV 40%) s GTVCT. Autoři nepovažují hodnotu SUV 2,5 za příliš vhodnou pro určení prahu při hodnocení mediastinálních uzlin vzhledem k přítomnosti struktur v pozadí s relativně vysokou aktivitou.
Biehl et al [37] se pokusili zjistit, která z prahových hodnot SUV generuje nejlepší volumetrickou shodu s objemem GTV podle CT vyšetření. Zjistili, že pro různě velké objemy jsou vhodné různé prahové hodnoty. Na souboru 20 pacientů s periferně uloženými NSCLC, které byly dobře ohraničeny, popisují nejlepší volumetrickou shodu pro tumory větší než 5 cm v průměru v oblasti SUV 15 ± 6 %, pro tumory o velikosti 3–5 cm v oblasti SUV 24 ± 9 % a pro tumory menší než 3 cm v oblasti SUV 42 ± 2 %, pro všechny tumory pak v oblasti SUV 24 + 13 %. Objemy s prahem SUV 20 % nadhodnotily objem GTV dle CT u všech 4 tumorů menších než 3 cm a podhodnotily u všech 6 tumorů větších než 5 cm. Objemy s prahem SUV 40 % minimálně nadhodnotily objem GTV dle CT u všech 4 tumorů menších než 3 cm a podhodnotily u všech 16 tumorů větších než 3 cm. Autoři proto považují jednoprahový model za neadekvátní, minimálně z výše uvedené objemové závislosti a také vzhledem k nehomogenní akumulaci radiofarmaka v tumoru.
Nahradit stávající koncept GTV (gross tumor volume) přiléhavějším termínem pro konturaci dle PET/CT navrhli Ashamalla et al [38]. Kombinaci anatomické, tedy strukturální, a funkční informace nazývají ABC (Anatomic Biologic Contour). Stejní autoři se rovněž nespokojují s koncepcí prahových hodnot, neboť popisují na svém souboru PET nálezů u pacientů s NSCLC oblast „halo“ kolem oblasti maximálního SUV. Tato „halo“ oblast je široká 2 ± 0,5 mm a má hodnotu SUV 2 ± 0,4. Doporučují ji vždy zabírat do GTV bez ohledu na absolutní či relativní hodnotu SUV.
Je pochopitelné, že se objevují další a další metody a pokusy, jak nejlépe definovat GTV na základě PET vyšetření, většinou vycházející z modelových studií. Jednou takovou je snaha určit relativní prahovou hodnotu (relative threshold level) na základě subtrakce aktivity pozadí, která nepatrně ovlivňuje výsledný tvar signálu a vede k poklesu celkové aktivity obrazu. Davis et al [39] použili subtrakci pozadí k vytvoření fixní prahové hodnoty k určení rozměru PET signálu. Toto by mohlo sloužit jako první krok před vlastní konturací radiačním onkologem, většinou je tato velikost v porovnání s CT mírně podhodnocena.
Některá pracoviště si vytvářejí vlastní modely a formule pro definování prahové hodnoty. Například Black et al [40] navrhli a používají hodnotu SUV podle regresní fukce založené na fantomové studii a využívající hodnotu SUVmean: (0,3069 × SUVmean) + 0,5853.
V současné době neexistuje žádný zlatý standard pro určení prahové hodnoty. Prahy vytvářejí pouze zdání objektivity, jsou příliš zjednodušující a nepřesné. Jejich význam se nesmí přecenit, neboť mohou vést k signifikantním chybám v odhadu objemu tumoru [41]. Je nutné uvažovat i o dalších faktorech kromě samotné přítomnosti tumoru, které mohou ovlivnit akumulaci radiofarmaka. Například nekrotické nebo hypoxické tumory mohou mít nízký nebo žádný metabolizmus FDG, přesto by tyto oblasti měly být zahrnuty do GTV. Toto je také jeden z důvodů, proč není vhodné používat zmíněné matematické algoritmy [19]. Dalším momentem omezujícím použití prahových metod je pohyb tumoru při vyšetření. PET vyšetření poskytuje obrázek nádoru ve všech krajních polohách při dýchání, tzn. že velikost zobrazené léze je větší než skutečnost a její okraje jsou méně intenzivní a rozmazané [42]. Na druhou stranu toto však pomáhá lépe definovat „internal margin“ (IM) [21], což je bezpečnostní lem kolem CTV, který kompenzuje nepřesnosti způsobené pohybem a změnou velikosti jednotlivých orgánů a který je součástí PTV. Tyto limity pravděpodobně odstraní použití dýcháním řízené 4D-PET/CT, ostatní limity výše uvedených metod to přesto neodstraní.
Získat onu magickou linii mezi maligní a normální tkání je prozatím nemožné. K tomu, aby se podařilo určit kritéria pro stanovení vhodných prahových hodnot, by byla zapotřebí korelace s patologickým nálezem excidovaného tumoru, což je však u pacientů s NSCLC více než obtížné [24].
Tuto subkapitolu lze uzavřít tak, že jako nejlepší přístup k definici GTV se jeví konturace okrajů tumoru na CT komponentě fúze. Ten nejzásadnější přínos PET/CT u nemalobuněčných plicních karcinomů spočívá spíše v přesnějším hodnocení rozsahu nádorové choroby ve smyslu kategorií N a M než ve smyslu kategorie T [19].
Rozdíly v konturaci cílových objemů a léčebné strategii při použití PET/CT vs CT
Z uvedených informací o výhodách a významu zobrazení pomocí funkční zobrazovací metody vyvstává logicky otázka, zda-li může použití této nové metody ovlivnit velikost cílových objemů, změnit známý rozsah nádorového onemocnění a z toho vyplývající léčebnou strategii. V současné době, kdy je většina velkých pracovišť vybavena integrovaným PET/CT, narůstá vhodnost začlenit toto vyšetření do plánovacího procesu radioterapie nejen plicních karcinomů, ale i jiných maligních onemocnění. Nejprve je nutné odpovědět si na otázku, je-li toto vyšetření skutečně tak přínosné, jak se na první pohled zdá, a pro jaké situace se ve skutečnosti hodí nejvíce.
Na začátku zkoumání stály studie, které se snažily retrospektivně zjistit přínos PET vyšetření pro plánování radioterapie plicních karcinomů. Kiffer et al [43] porovnávali koronární řezy ze stážovacího PET vyšetření s AP snímky vzniklými na klasickém RTG simulátoru, na kterých byl vyznačen ozařovaný objem. Z 15 pacientů by 4 (26,7 %) pacienti měli tento objem ovlivněn nálezem z PET.
Nálezy ze stážovacího PET vyšetření byly také použity v podobné studii Nestleho et al [26]. Autoři retrospektivně porovnávali AP portálové snímky vzniklé na základě CT vyšetření s AP portálovými snímky, do kterých byl zakomponován nález z PET. U 12 z 34 (35 %) pacientů došlo ke změně tvaru a velikosti portálového pole, v 10 případech došlo ke zmenšení velikosti, a to zejména u pacientů s dystelektatickými a atelektatickými změnami způsobenými primárním tumorem.
Jedna z prvních publikovaných studií hodnotících přínos integrovaného PET/CT pro plánování radioterapie obecně byla práce švýcarského kolektivu (Ciernik et al [44]) z roku 2003, který hodnotil celkem 39 pacientů s různými typy nádorů (nádory hlavy a krku, rekta, anu, gynekologické malignity), mezi nimiž bylo také 6 plicních karcinomů (4krát NSCLC). Porovnávali velikost cílového objemu na základě konturace podle CT a PET/CT, jako cut-off hodnotu významnosti změny si zvolili 25 % pro GTV a 20 % pro PTV. Tyto hodnoty by měly eliminovat metodologické nejistoty [45]. V 56 % všech případů došlo ke změně GTV o více než 25 % a k modifikaci PTV ve 46 %, léčebná strategie byla změněna u 16 % pacientů. PET/CT vyšetření změnilo léčebnou strategii, dávku či velikost cílových objemů u 63 % případů. Co se týká plicních tumorů, GTV se zmenšilo u 4 pacientů a zvětšilo u 1 pacienta. Mimochodem, největší změny velikosti GTV byly zaznamenány u nádorů rekta.
Ještě o rok dříve publikovali Erdi et al [30] práci s velmi skromným počtem 11 pacientů s NSCLC a hodnotili vliv následně provedeného PET vyšetření po klasickém CT vyšetření (pouze softwarová fúze, nikoliv integrované vyšetření) na konturaci cílových objemů. U 7 pacientů došlo ke zvětšení cílových objemů (v průměru o 19 %) zejména vlivem nově zjištěných pozitivních uzlinových oblastí a u 4 pacientů došlo ke zmenšení (průměrně o 18 %), to bylo způsobeno především vynecháním atelektatických oblastí z cílového objemu.
Italové Brianzoni et al [29] přispěli do diskuze prací hodnotící 28 pacientů (24× plicní karcinom a 4× NHL v krční oblasti) vyšetřených na integrovaném PET/CT přístroji. Prahovou hodnotu akumulace (hranice GTV) si určili SUV 40 %. Celkem bylo v této práci hodnoceno pouze 25 případů, neboť ve zbývajících 3 případech došlo k modifikaci stadia, která vedla ke změně léčebného záměru. U 14 (56 %) pacientů nevedla informace z PET k signifikantní změně GTV nebo CTV, zatímco u 11 (44 %) pacientů tato informace vedla ke změně cílových objemů – u 5/11 došlo ke zmenšení (2× vlivem přítomné atelektázy, 3× falešně pozitivní uzliny na CT) a u 6/11 došlo ke zvětšení (3× falešně negativní uzliny na CT, 3× lepší konturace GTV v terénu atelektázy).
Ashamalla et al [38] porovnávali konturaci GTV a PTV podle CT a PET/CT snímků vytvořených na integrovaném přístroji u 19 pacientů s NSCLC ve stadiu II–IIIB, přičemž zvolili stejnou cut-off hodnotu významnosti rozdílu jako Ciernik et al, tj. 25 % pro GTV a 20 % pro PTV. K významné změně velikosti GTV došlo u 10 (52 %) pacientů – u 5/10 bylo zaznamenáno zvětšení, u stejného množství pacientů zmenšení velikosti. Změny velikosti PTV bylo dosaženo u 8 (42 %) pacientů.
Jinou možností porovnání velikostí cílového objemu tvořeného pomocí CT a pomocí PET/CT kromě srovnávání na základě absolutních či relativních rozdílů je použití tzv. indexu konformity (conformality index), což je poměr průsečíků dvou GTV a jejich sjednocení (0–1, čím blíže k hodnotě 1, tím lepší konformita). Hodnocení tohoto indexu využili Gondi et al [42] při porovnávání velikostí cílových objemů konturovaných na základě samotných CT dat a na základě softwarové fúze PET/CT. Jejich soubor čítal 14 pacientů s NSCLC a výsledkem byl střední index konformity 0,44 (0,00–0,87), tzn. že 44 % sjednocení se překrývá. U 12 (85,7 %) pacientů vedlo přidání PET dat ke zmenšení GTV – u 11 (78,6 %) pacientů došlo k redukci velikosti o více než 5 %.
Grills et al [46] zase k hodnocení shody/neshody vytvořili vzoreček pro získání tzv. matching indexu (rovněž rozměr 0–1), který také kvantifikoval stupeň shody. Porovnávány byly plány 21 pacientů s NSCLC ve stadiích I–IIIB. Autoři práce vytvořili 3 sady konturací: 1) podle CT (s pomocí stagingového PET, tzn. vizuální fúze obou modalit), 2) podle samotného PET, 3) podle fúze PET a CT, tedy softwarová fúze. Z 20 hodnotitelných konturací primárního tumoru (GTV-T) bylo 10 (50 %) konturovaných podle CT větších než těch konturovaných podle PET, 7 (33 %) jich bylo menších a 3 (14 %) zůstaly stejné. Co se týká konturace primárního tumoru a postižených uzlin, tj. GTV-T a GTV-N, 11/21 (52 %) pacientů mělo CT objem větší než PET objem, 6/21 (29 %) menší a 4/21 (19 %) mělo oba objemy stejné. Ačkoliv někdy došlo ke kvantitativní shodě, kvalitativně byly objemy odlišné – střední matching index pro objemy GTV-T a GTV-T a N byl 0,65, tj. byla pozorována pouze 65% shoda. Fúzovaný objem byl větší než samotné CT a PET objemy v 60 % (12/20), menší v 25 % (5/20) a stejný u 15 % (3/20). Při porovnání plánů CT a PET/CT autoři zjistili, že by došlo k významnému poddávkování u 40 % pacientů v případě, že by byl použit plán vytvořený pouze podle CT.
Bradley et al [27] porovnávali vytvořené plány u 26 pacientů s NSCLC stadia I–III. Každý plán byl však vytvořen jiným lékařem, jeden konturoval cílové objemy podle CT a druhý podle PET/CT (pro ohraničení GTV použili prahovou hodnotu SUV 2,5). Změna TNM klasifikace byla pozorována u 8/26 (31 %) pacientů, u 2 bylo zjištěno metastatické onemocnění a tito pacienti nebyli dále hodnoceni. U 14/24 (58 %) pacientů PET zřetelně změnil velikost cílových objemů. Jako změny byly hodnoceny nádorové nebo uzlinové oblasti zahrnuté do GTV v jedné sadě, ale nezahrnuté ve druhé. U 3 pacientů pomohlo PET vyšetření odlišit tumor od kolabované atelektatické plíce (došlo ke zmenšení objemu), neočekávané uzlinové postižení bylo detekováno na PET u 10 pacientů a 1 pacient měl další nádorové ložisko ve stejném laloku (objem se zvětšil).
Samozřejmě ani PET/CT není nejpřesnější metodou v predikci nádorového uzlinového postižení, jak již bylo opakovaně uvedeno v předchozím textu. O tom, že nejpřesnější metodou je bioptické vyšetření uzlin, není pochyb. Vanuytsel et al [47] porovnávali teoretické předléčebné objemy GTV vytvořené na základě CT a na základě kombinace PET/CT proti histologickým nálezům. Ze 73 hodnotitelných pacientů s CT či PET pozitivními lymfatickými uzlinami by objem GTV dle CT zahrnoval všechny skutečně postižené mediastinální uzliny v 75 % a GTV dle PET/CT v 89 %.
K podobným závěrům došli o 7 let později kanadští autoři Faria et al [19]. Ti retrospektivně hodnotili přínos fúze PET/CT u 32 pacientů na základě porovnání velikosti cílových objemů podle CT a podle PET/CT, stejně tak zkoumali i vliv kombinovaného vyšetření na TNM klasifikaci. Nálezy poté ještě srovnávali s patologickým vyšetřením vzorků z mediastina a z primárního tumoru. Patologické nálezy měnily stadium vytvořené podle CT u 22 (69 %) pacientů a podle PET/CT u 16 (50 %) pacientů, nejčastěji se měnilo N stadium. Nálezy z PET/CT měnily TNM klasifikaci u 15 (44 %) pacientů ve srovnání se samostatným CT, nicméně pouze 7 z oněch 15 změn bylo potvrzeno patologickým vyšetřením. PET/CT měnilo konturaci GTV u 18 (56 %) pacientů, u 16 z nich byl rozdíl v GTV větší než 30 % a u 2 byl změněn stav lymfatických uzlin. U 12/18 pacientů bylo pozorováno zmenšení a u 6/18 pacientů zvětšení velikosti původního GTV.
Opakovaně již bylo naznačeno, že PET/CT vyšetření může vést ke změně stagingu onemocnění a tím i ke změně strategie léčby. Němečtí autoři Paulsen et al [48] publikovali své zkušenosti s prováděním PET/CT na integrovaném přístroji u pacientů s nádory různých lokalit. V souboru bylo celkem 21 pacientů s NSCLC, u kterých bylo PET/CT provedeno pro účely radioterapie (7×), v rámci diagnostiky (11×) a během radioterapie (4×). V 17 (81 %) případech byly získány nové nálezy, které vedly ke změně léčebného přístupu u 10 (48 %) pacientů. Tab. 2 sumarizuje výsledky výše uvedených studií.
Vliv změny velikosti cílového objemu na ozáření kritických struktur
Změna velikosti cílových objemů ve svém důsledku vede také ke změně ozářeného objemu kritických struktur, ať už ke zmenšení, nebo ke zvětšení. Velikost ozáření kritické struktury se zpravidla vyjadřuje prostřednictvím dávkově-objemových charakteristik, které v mnoha případech také slouží jako významné prediktory pozdní toxicity. K nejvýznamnějším prediktorům toxicity normálních tkání při radioterapii plicních karcinomů patří MLD (mean lung dose – střední dávka v plíci), V20 (objem plíce, který obdrží dávku vyšší než 20 Gy) a MED (mean esophageal dose – střední dávka v jícnu) [49,50]. Dojde-li kupříkladu ke zmenšení GTV u pacientů s atelektázou, dávky na kritické struktury se také zmenší a tím se sníží i pravděpodobnost pneumonitidy a esofagitidy a naopak [27,50].
V roce 2005 referovali Deniaud-Alexandre et al [20] v poměrně rozsáhlé studii srovnávající konturace cílových objemů prostřednictvím CT a PET/CT (koregistrace zvlášť, softwarová fúze) o vlivu změny těchto objemů na ozáření kritických struktur. Hodnotili však pouze stupeň ozáření plic (V20) a srdce (V36). Z původních 101 pacientů bylo do hodnocení zařazeno 92 pacientů (8× PET objevilo ložisko vzdálené metastázy a 1× se jednalo o extenzivní hrudní postižení, rovněž znemožňující léčbu s kurativním záměrem). Velikost GTV se zmenšila u 21 (23 %) pacientů, medián změny byl 32,7 % (2,5–143 %) a u 24 (26 %) pacientů se velikost GTV zvětšila, medián změny 18,5 % (1,5–77,5 %). Redukce velikosti GTV byla větší než 25 % u 7 pacientů (6× se to týkalo GTV-T, 1× GTV-N, ve 3 případech byla přítomná atelektáza), naopak ke zvětšení velikosti GTV o více než 25 % došlo u 14 pacientů (11× GTV-T, 3× GTV-N, 4× byla přítomná atelektáza). Modifikace GTV vedla ke změně PTV u 43 pacientů, u 20 z nich došlo ke zmenšení velikosti (medián 25,5 %) a u 23 ke zvětšení (medián 30,5 %). Z celkového počtu 81 pacientů, kteří obdrželi dávku vyšší nebo rovnu 60 Gy, byl pozorován pokles hodnoty V20 u 22 pacientů (medián změny 12,5 %) a u 15 pacientů byl pozorován její vzestup (medián 154 %). Hodnota V36 pro predikci kardiální toxicity stoupla u 8 pacientů (medián 53,5 %) a klesla u 14 pacientů (medián 65,5 %). Multivariantní analýza prokázala, že pouze tumor způsobující atelektázu je jediným nezávislým faktorem, který vede k signifikantní modifikaci velikosti GTV použitím PET/CT vyšetření.
Ceresoli et al [45] ve své studii nepopisují signifikantní rozdíly týkající se ozářených objemů normálních tkání v těch případech, kde bylo použito PET/CT ke konturaci. K mírnému poklesu došlo pouze u hodnoty Dmax. na oblast míchy. V jejich skromné práci na souboru 21 pacientů srovnávali opět podobné parametry jako mnohé již uvedené práce. Ve 48 % (10/21 pacientů) byla změněna TNM klasifikace přidáním informace z PET (4× upstaging, 6× downstaging), u 3 pacientů tato změna vedla ke změně léčebné strategie na paliativní. U oněch hodnotitelných (tedy radikálně léčených) byla pozorována změna ve velikosti objemu GTV (o více než 25 %) u 7/18 (39 %) pacientů – 5 jich mělo větší GTVPET/CT zejména zahrnutím pozitivních uzlinových oblastí, 2 pacienti měli tento objem menší vlivem vynechání zvětšených negativních uzlin a atelektatické oblasti).
Australský kolektiv autorů (MacManus et al [51]) nezjistil signifikantní rozdíl mezi hodnotami MLD a V20 (p = 0,801, resp. 0,816) u plánů vzniklých na základě CT a PET/CT (vizuální fúzí) u 10 pacientů s NSCLC, ačkoliv ve všech případech byla část PTVPET/CT (10–40 %) mimo PTVCT, ve 3 případech byl dokonce celý objem uložen mimo PTVCT (lokalizační chyba). U 5 pacientů byla přítomna atelektáza, kterou jasně odlišilo PET. Ve 3 případech byl objem PTVPET/CT větší o více než 10 % než PTVCT, v 6 případech byl menší o více než 10 % a v 1 případě byl téměř identický, ačkoliv se oba objemy téměř minuly. Přehled viz tab. 3.
Možnosti eskalace dávky, vliv změny velikosti cílového objemu na TCP
Logicky se nabízí úvaha nad možností eskalace dávky při lepší a přesnější lokalizaci cílového objemu a v situacích, kdy jsou normální tkáně poněkud více šetřeny. Je jednoznačně popsán vztah mezi celkovou dávkou, lokální kontrolou a přežitím nemocných léčených pro nemalobuněčný plicní karcinom [52,53]. Dávky mezi 60–70 Gy v léčbě lokoregionálně pokročilého nádoru jsou spojeny s častými lokálními relapsy a velice chmurným pětiletým přežitím [54].
Van Der Wel et al [55] vytvořili modelovou studii, ve které se snažili zjistit, jaké dávkové eskalace by mohli být schopni dosáhnout při dodržování tolerančních limitů v situaci, kdy zjistili sníženou radiační expozici jícnu a plic použitím informace z PET (jednalo se o vizuální fúzi CT a PET). Hodnotili 21 pacientů s NSCLC s uzlinovým stavem N2–N3 dle CT. U 7 (33 %) pacientů došlo k downstagingu, u 5 zůstalo stadium stejné a u 9 pacientů zjistili mediastinální postižení v jiné uzlinové oblasti, než bylo původně uvažováno. Radiační pole se zmenšila u 11 pacientů, u 3 se zvětšila a u 7 zůstala beze změny. Aplikovaná dávka by mohla být zvýšena z 56 ± 5,4 Gy na 71 ± 13,7 Gy (p = 0,038), TCP (tumor control probability) by se tím zvýšilo z 14,2 ± 5,6 % na 22,8 ± 7,1 % (p = 0,026).
Velmi podobným způsobem k problematice přistoupili holandští autoři (De Ruysscher et al [56]), kteří také hodnotili změnu výše dávek aplikovaných do kritických struktur a vliv na možnou eskalaci dávky a tím i zvýšení hodnoty TCP. Do studie bylo zařazeno 21 pacientů s lokálně nebo lokoregionálně pokročilým NSCLC, jejichž plán byl vytvořen jak podle CT, tak i podle PET/CT a jednalo se o involved field radioterapii. K posouzení expozice jícnu a plic použili hodnoty MED a V55, resp. MLD (mean lung dose) a V20. Informace z PET/CT vedly k signifikantnímu poklesu dozimetrických parametrů u jícnu i u plic. Celkem 2/3 plánů bylo změněno na základě informace z PET, u 2 pacientů se cílový objem zvětšil, u 12 se zmenšil a u 7 zůstal stejný. Výše uvedené nálezy byly podkladem pro modelování dávkové eskalace. Dávka by se mohla zvýšit z 55,2 ± 2,0 Gy na 68,9 ± 3,3 Gy (p = 0,002) a TCP by se tak zvýšilo z 6,3 ± 1,5 % na 24,0 ± 5,6 % (p = 0,01).
Využít PET/CT vyšetření k dávkové eskalaci se pokusili také Gillham et al [57] tím způsobem, že během radikální radioterapie (involved field) u 10 pacientů s NSCLC provedli PET/CT po 50 Gy nebo 60 Gy. Jejich cílem bylo zvýšení původně ordinované dávky 66 Gy na 78 Gy za předpokladu redukce velikosti cílového objemu a dodržení tolerančních limitů kritických struktur. U všech pacientů došlo k redukci velikosti cílového objemu (medián 22 %), ale pouze u 4/10 (40 %) byla možná eskalace dávky do 78 Gy. Hodnota TCP byla zvýšena o pouhých 8 % i přes uvedenou dávkovou eskalaci.
Pozitivní vliv PET/CT vyšetření na subjektivní pojetí konturace jednotlivými radiačními onkology
Je poměrně dobře známým faktem, že se liší tvar i velikost cílových objemů konturovaných jednotlivými radiačními onkology na základě samotného CT vyšetření, a to nejen u plicních karcinomů [58], ale i u jiných nádorových lokalit. Každá konturace je zatížená určitou mírou nepřesnosti, ať už vlivem nezkušenosti radiačního onkologa, nebo limitací zobrazovací metody pro ten či onen cílový objem. Několik faktorů již dříve uvedených se podílí na tom, že stejně definovaný cílový objem může být různými radiačními onkology zakreslen odlišně. Začlenění metabolických zobrazení do procesu plánování (tzv. multidimensional conformal radiotherapy) [59] by mohlo tyto rozdíly zmenšovat.
Ciernik et al [44] v již zmíněné práci popisují na souboru 39 pacientů s různými nádorovými onemocněními (6 případů bronchogenního karcinomu) zmenšení rozdílů při konturaci GTV dvěma nezávislými radioterapeuty (inter-observer variability) podle PET/CT (integrované) ve srovnání s použitím samostatného CT vždy u stejného pacienta. Střední rozdíl objemů signifikantně poklesl z původních 26,6 cm3 na 9,1 cm3. Toto zmenšení bylo rovněž spojeno se zmenšením standardní odchylky z 38,3 cm3 na 13,3 cm3 (p = 0,02).
Ke stejnému závěru došli i Ashamalla et al [38] kteří porovnávali konturace u 19 pacientů s nemalobuněčným karcinomem plic ve stadiích II–IIIB mezi 2 radiačními onkology na podkladě CT vs PET/CT. Variabilita mezi radioterapeuty poklesla u GTV ze středního rozdílu objemů 28,3 cm3 na 9,12 cm3. U PTV došlo ke změně z 69,8 cm3 na 23,9 cm3. U 16 pacientů (84 %) byl zjištěn rozdíl menší než 10 % ve velikosti GTV při plánování dle PET/CT, u samostatného CT byl tento rozdíl zjištěn pouze u 7 pacientů (37 %).
Víme už, že nemáme-li k dispozici integrované PET/CT, je lepší použít softwarovou fúzi samostatně po sobě provedených vyšetření PET a CT než se spoléhat na vizuální fúzi [16], protože tato zásadním způsobem snižuje variabilitu (inter - i intra-observer variability) konturovaných objemů, což může přispět k přesnosti plánování a ve svém důsledku také ke zvýšení pravděpodobnosti lokální kontroly, jak popisují ve své práci Fox et al [31]. Autoři do své retrospektivní studie zkoumající inter-observer a intra-observer variability zahrnuli 19 pacientů s nemalobuněčným plicním karcinomem. Devět nádorových objemů bylo konturováno dvěma radiačními onkology na podkladě softwarové fúze PET/CT, 10 objemů pak na podkladě vizuální fúze PET a CT rovněž dvěma radiačními onkology (inter-observer variablity). Další radiační onkolog poté provedl nové konturace u všech pacientů (všechny již byly tímto radiačním onkologem konturovány při původním plánování před mediánem doby 40 měsíců). Vzniklo tak 10 nových konturací podle softwarové fúze a 9 podle vizuální fúze (intra-observer variability). Autoři hodnotili tzv. index konkordance (poměr průniku obou objemů/jejich spojení). Při hodnocení inter-observer variability na základě vizuální fúze byl zjištěn medián indexu konkordance 61 % (44–78 %) a na základě softwarové fúze 70 % (56–89 %). Hodnocením intra-observer variability byl zjištěn medián indexu konkordance u páru softwarová fúze/vizuální fúze 58 % (42–84 %) a u páru softwarová fúze/softwarová fúze 71 % (52–83 %). Lze tedy přepokládat, že použitím integrovaného PET/CT je možné dosáhnout ještě lepší konkordance. Přehled studií nabízí tab. 4.
Budoucnost, perspektivy
Co lze očekávat v blízké budoucnosti stran použití PET/CT vyšetření u plicních karcinomů nejen v plánování radioterapie?
S vysokou pravděpodobností se do klinické praxe začlení použití nových radiofarmak, nebo chcete-li tracerů. Víme, že rezistenci nádorů k radioterapii způsobují mimo jiné hypoxické suboblasti nádorového ložiska. V těchto místech také často vzniká lokální rekurence [60] a právě tyto oblasti by mohly být ozářeny vyšší dávkou, například v rámci tzv. dose sculpting (painting) při použití techniky IMRT. Tímto tracerem pro hypoxické buňky je 18F-FMISO (18F-fluoromisonidazol). Také se zkoušejí různé markery buněčné proliferace inkorporující se do DNA jako thymidinový analog 3´-deoxy-3´-(18F) fluorothymidin (FLT) [61] a tracery k zobrazení angiogeneze nebo apoptózy [34].
Velkým problémem pro přesnou definici a určení hranic cílových objemů je ten fakt, že se nádorové ložisko během pomalého snímání PET pohybuje a tím vznikají rozmazané okraje, které způsobují zdání většího objemu než na CT vyšetření. I při použití samostatného CT vyšetření existuje určitá nepřesnost způsobená dýchacími pohyby. Nejlepší metodou, jak zachytit pohyb tumoru, je použití 4D-CT (respiratory gating system), při kterém se dechové exkurze snímají např. infračervenou kamerou a CT je snímáno jen v určitých fázích respiračního cyklu. Tím je dosaženo větší přesnosti při konturaci, a tak se mohou dále zmenšit nežádoucí účinky na okolní tkáně redukcí jejich expozice [15]. Podobným způsobem se pravděpodobně do praxe uvede také 4D-PET/CT [42]. Moderní radioterapeutické přístroje jsou již také vybaveny různými dechově řízenými systémy, které spouštějí paprsek ve zvolené fázi dechového cyklu.
Rovněž dochází a bude nadále docházet k vývoji moderních radioterapeutických technik, například již zmíněné IMRT techniky, použití protonové terapie a stereotaktické extrakraniální radioterapie (stereotactic body radiation therapy – SBRT), jejichž použití je závislé na přesné lokalizaci cílového objemu. SBRT jistě najde své uplatnění v léčbě nižších stadií plicních karcinomů, neboť v sobě kombinuje 3D konformní radioterapii a systémy kontrolující přesnou polohu tumoru. V současné době probíhá RTOG studie fáze II (RTOG 0618 [62]) zkoumající aplikaci dávky 60 Gy ve 3 frakcích (BED 180 Gy) u nemocných s operabilními tumory I. stadia a periferně uloženými tumory II. stadia nemalobuněčného plicního karcinomu. Jiná RTOG studie fáze II (RTOG 0915 [63]) porovnává 2 režimy stereotaktické radioterapie u pacientů s inoperabilními nemalobuněčnými plicními karcinomy periferně uloženými – 1 × 34 Gy (BED 78 Gy) vs 4 × 12 Gy (BED 125 Gy).
PET/CT může vést k vytvoření individuální shrinking field techniky, jinými slovy k redukci velikosti cílového objemu během radioterapeutického kurzu, což může usnadnit dávkovou eskalaci [57]. To je principem tzv. adaptivní radioterapie.
Závěr
Plánování radioterapie plicních karcinomů využívající data z PET/CT vyšetření je užitečným nástrojem vedoucím ke zvýšení přesnosti konturace cílových objemů. Má také pozitivní vliv na subjektivní pojetí konturace jednotlivými radiačními onkology. Integrace obou diagnostických metod výrazným způsobem snižuje limity těchto vyšetření, které mají, jsou-li použity samostatně. PET/CT umožňuje snadno klasifikovat struktury neznámého významu, jako například malé uzliny nebo měkké tkáně přiléhající k tumoru a mající podobnou denzitu na CT [44]. Pro plánování 3D konformní radioterapie je nezbytné použití kontrastního PET/CT protokolu, který zaručuje přesnější definici nádorového rozsahu [64]. Použití kombinovaného PET/CT vyšetření vede často ke zjištění změny v rozsahu nádorového postižení (nezřídka objeví ložiska vzdálené diseminace), tím i ke změně léčebného záměru. Změna ve velikosti cílového objemu a tím i změna ozářeného objemu kritické struktury může vést ke zvýšení aplikované dávky do tumoru tam, kde došlo ke zmenšení těchto objemů. Nejčastější klinickou situací vedoucí ke zmenšení cílového objemu je přítomnost atelektázy (obr. 3–10). K ověření toho, zda-li použití PET/CT fúze při plánování radioterapie skutečně zlepší léčebné výsledky nebo kvalitu života, je třeba dalších klinických studií.
Obr. 3. Dlaždicobuněčný karcinom způsobující atelektázu. Kontrurace na základě CT dat. 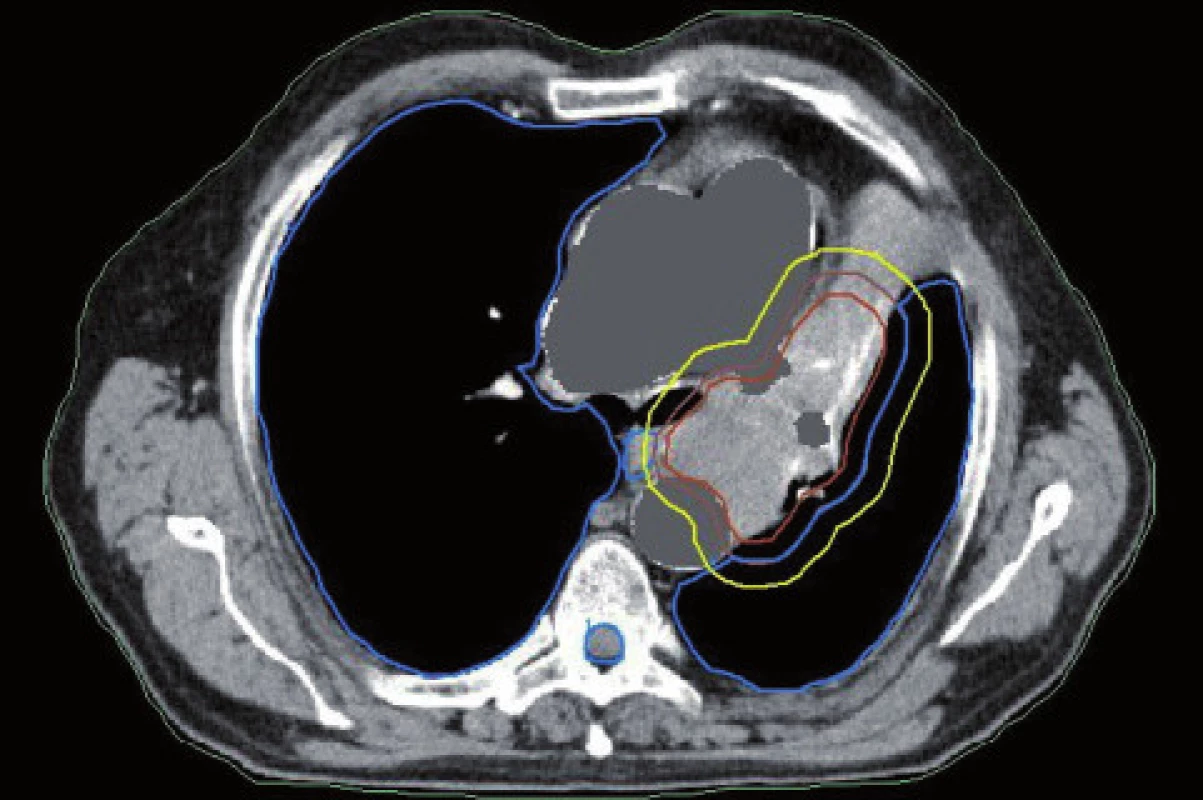
Obr. 4. Dlaždicobuněčný karcinom způsobující atelektázu, stejný pacient jako na obr. 3. Kontrurace na základě PET/CT dat. Zde je patrné zmenšení velikosti PTV vynecháním části kolabované plíce. 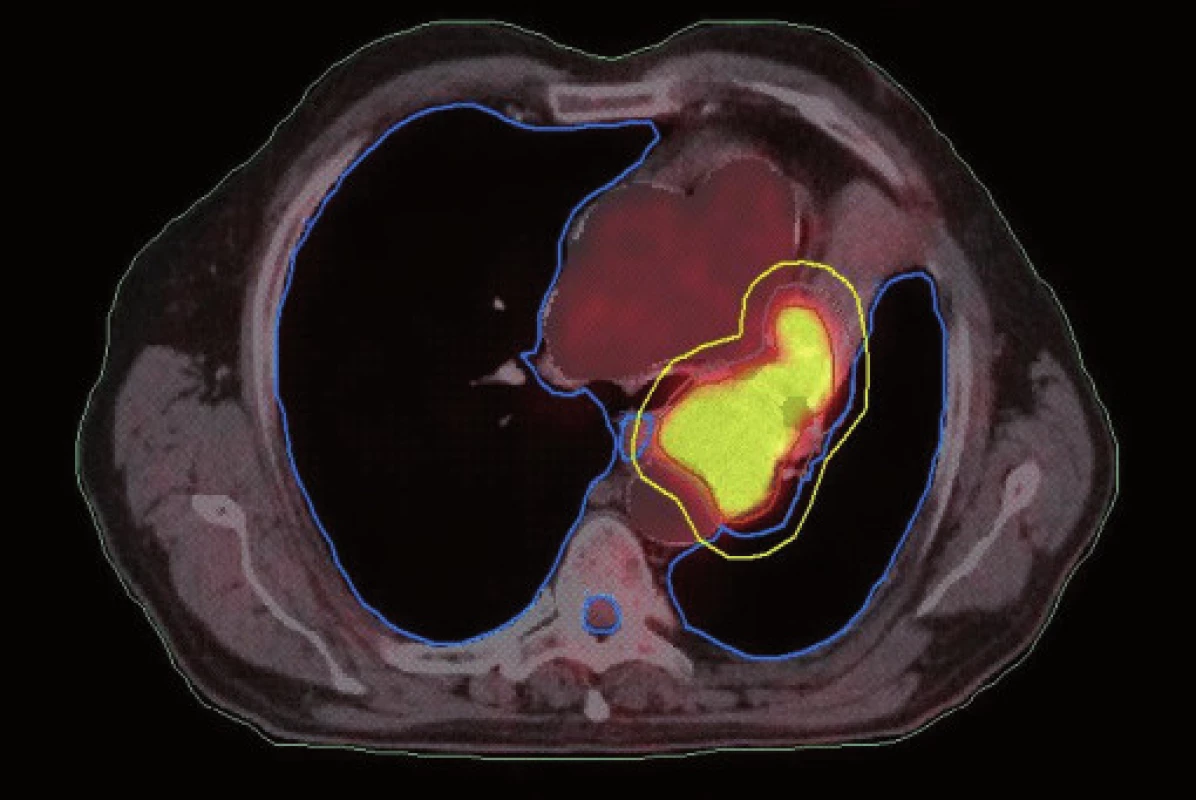
Obr. 5. Dávkové rozložení pro konturaci z obr. 3. Světle modře je vyznačena 95% izodóza. 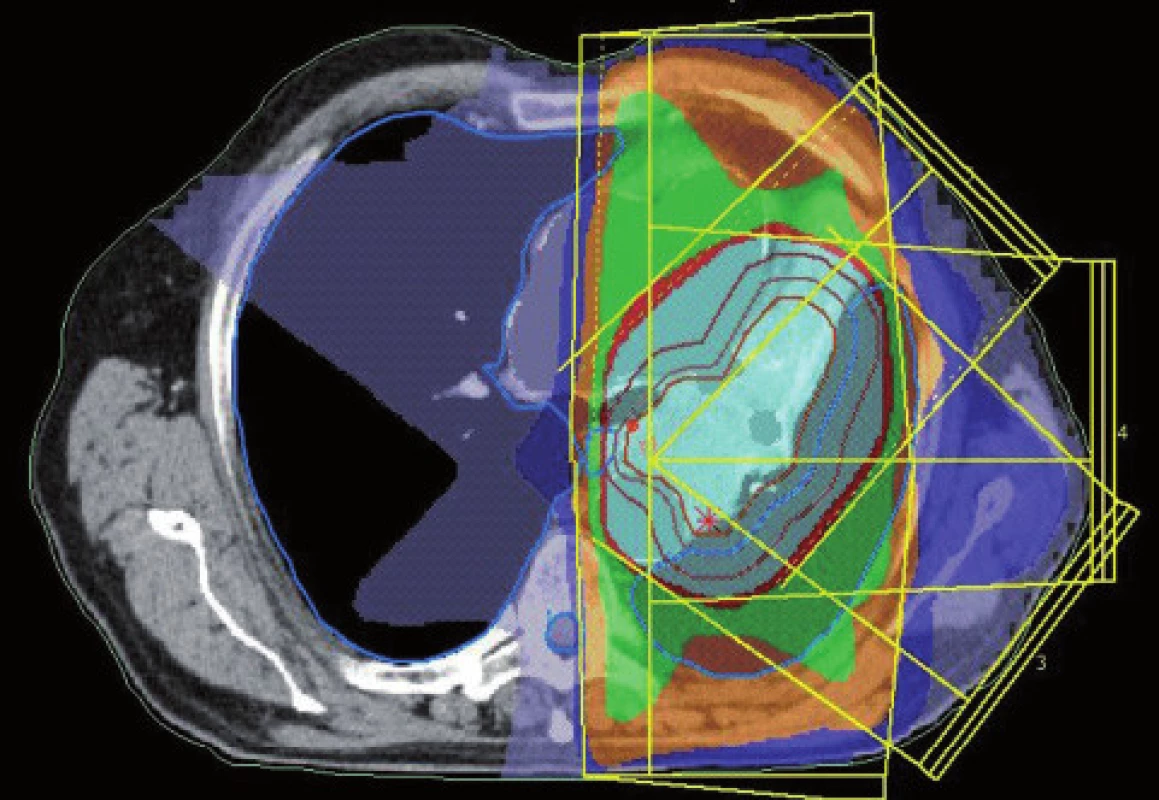
Obr. 6. Dávkové rozložení pro konturaci z obr. 4. Světle modře je vyznačena 95% izodóza. Diskrétní zmenšení léčeného objemu. 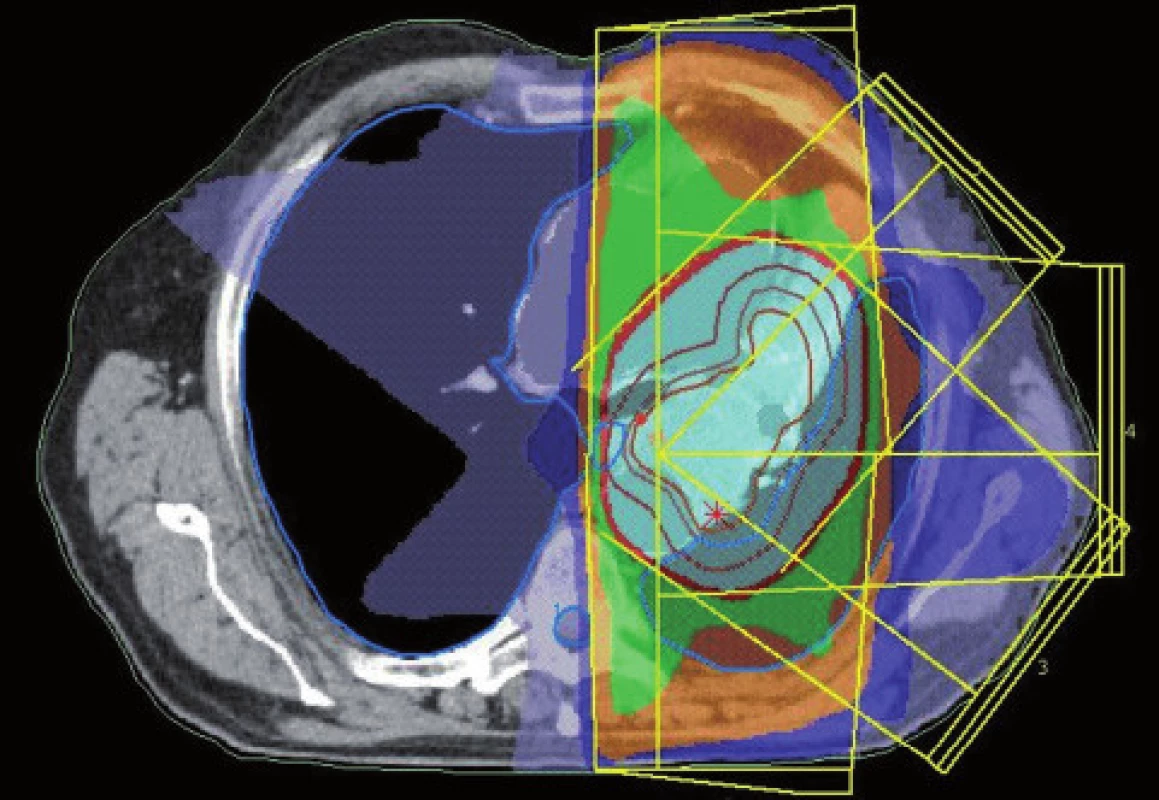
Obr. 7. Konturace podle CT dat u stejného pacienta jako na obr. 3–6, jiná úroveň. 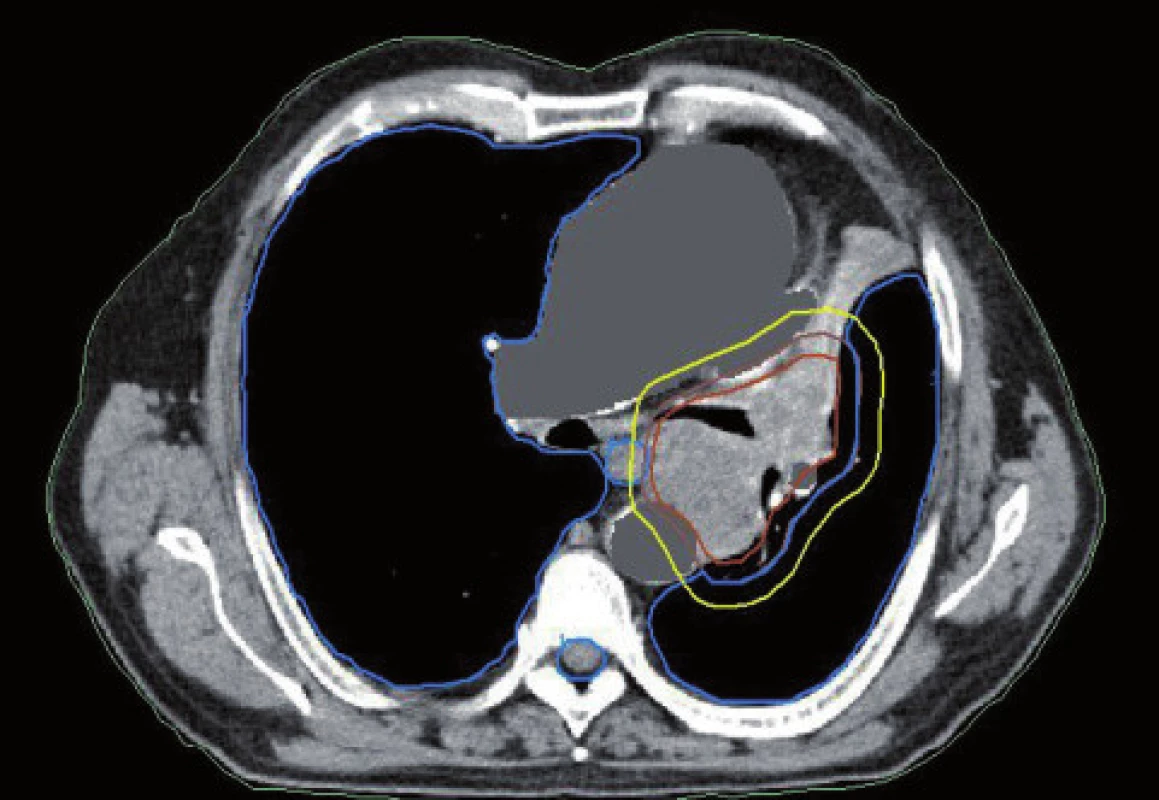
Obr. 8. Konturace podle PET/CT ve stejném řezu jako na obr. 7. Evidentní zmenšení velikosti cílového objemu. 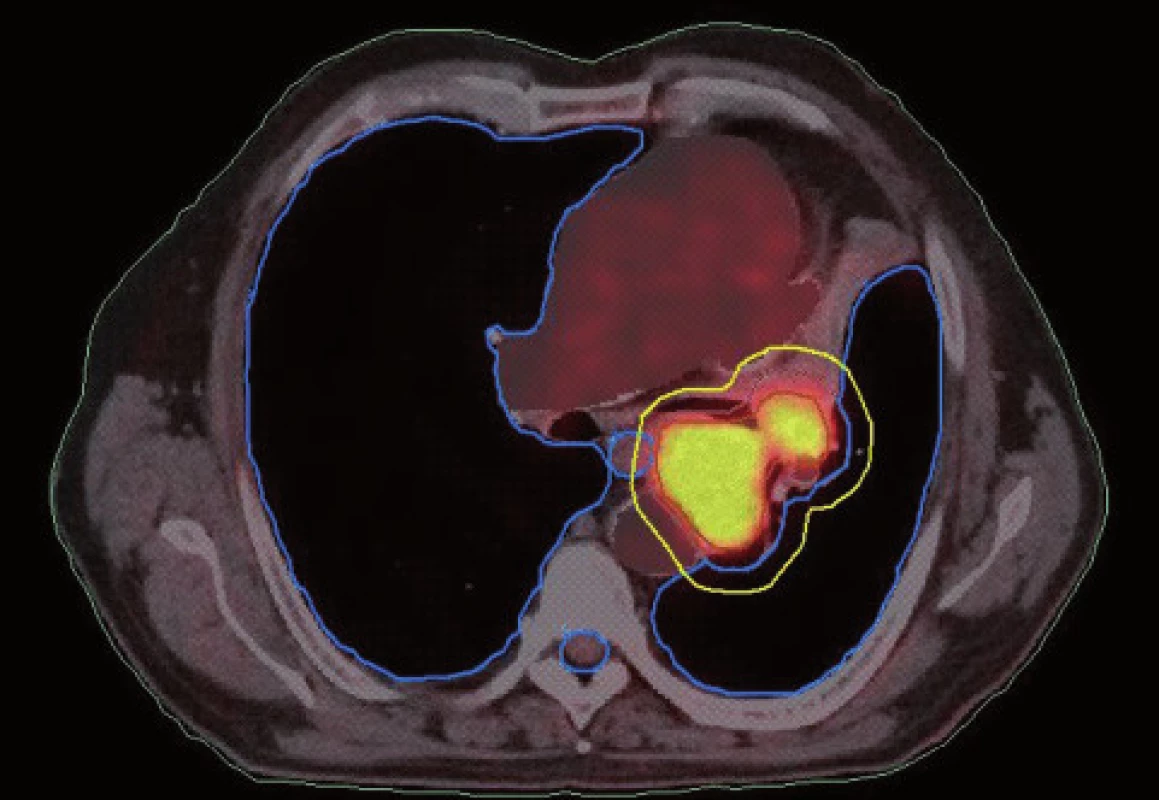
Obr. 9. Dávkové rozložení pro konturaci z obr. 7. Světle modře je vyznačena 95% izodóza. 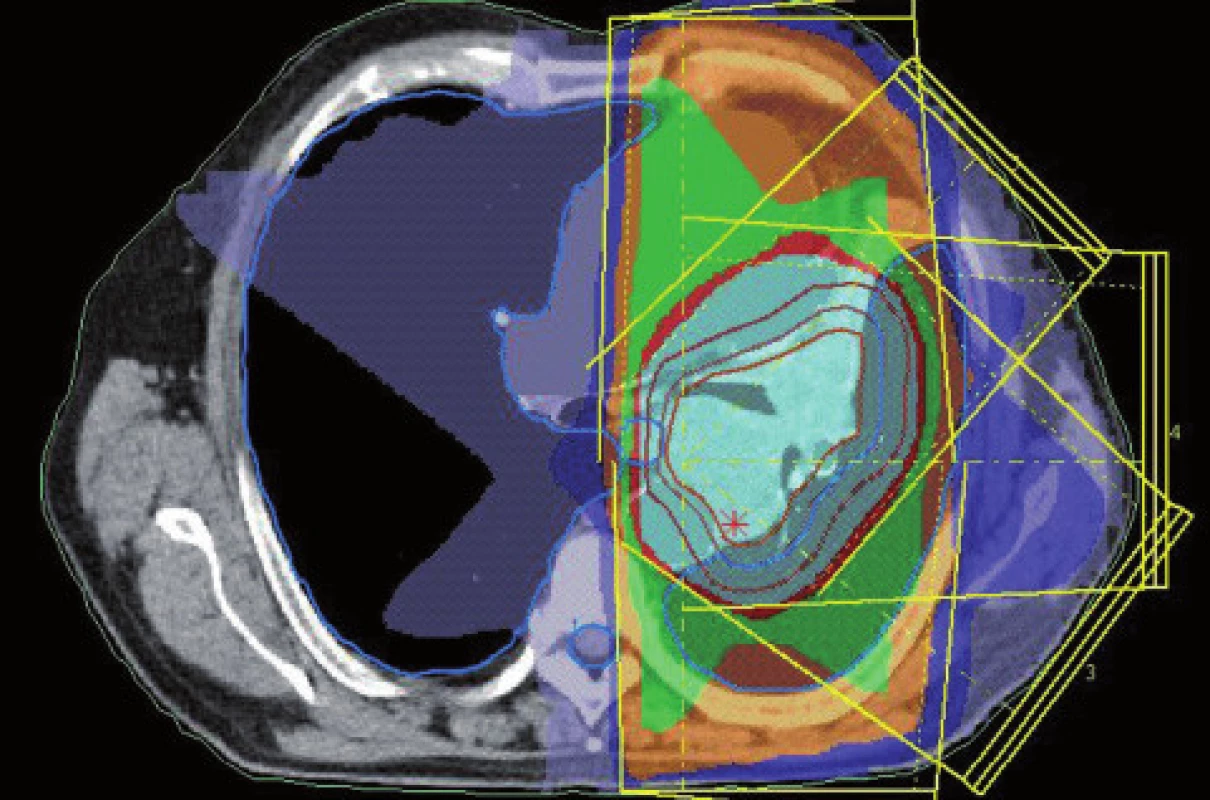
Obr. 10. Dávkové rozložení pro konturaci z obr. 8. Světle modře je vyznačena 95% izodóza. Evidentní zmenšení léčeného objemu. 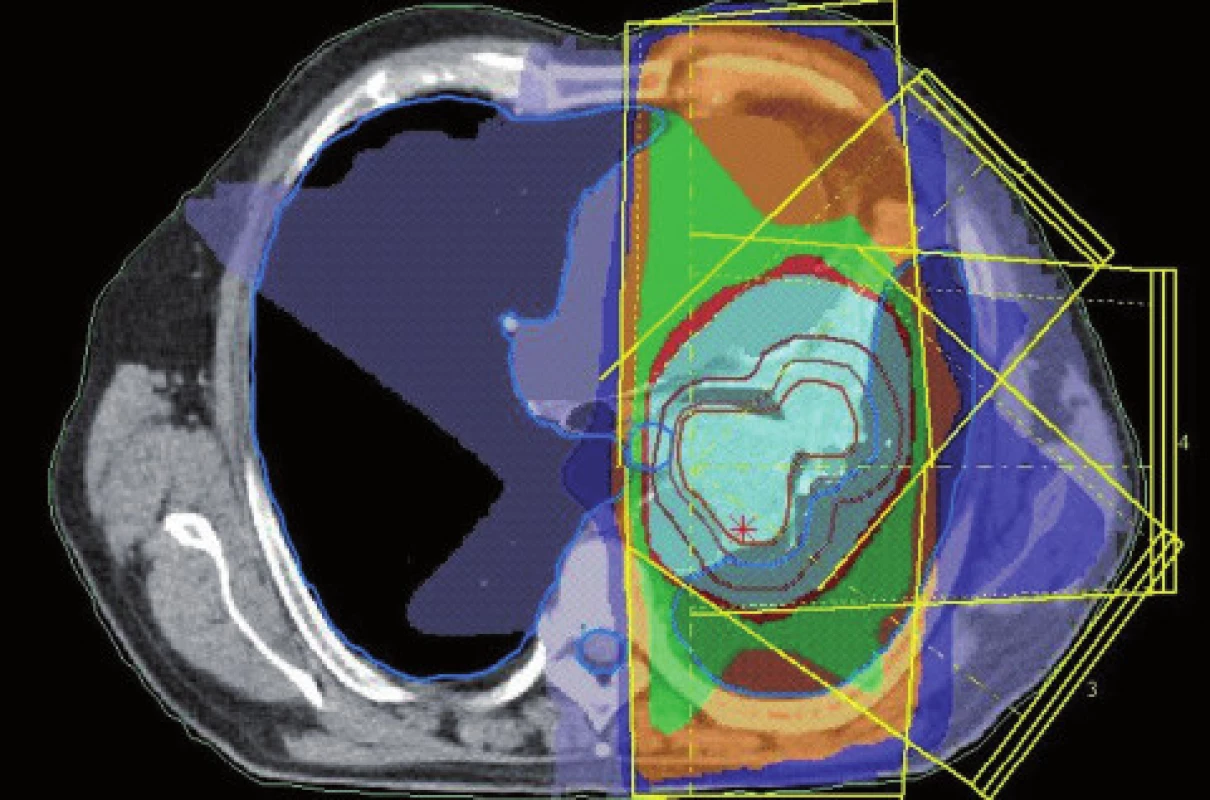
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Radovan Vojtíšek
Radioterapeutické a onkologické oddělení
Fakultní nemocnice Plzeň
Doudlevecká 69
301 00 Plzeň
e-mail: vojtisekr@fnplzen.cz
Obdrženo/Submitted: 15. 8. 2010
Přijato/Accepted: 3. 9. 2010
Zdroje
1. Parkin DM, Bray F, Ferlay J et al. Global cancer statistics, 2002. CA Cancer J Clin 2005; 55(2): 74–108.
2. Youlden DR, Cramb SM, Baade PD. The International Epidemiology of Lung Cancer: geographical distribution and secular trends. J Thorac Oncol 2008; 3(8): 819–831.
3. Jemal A, Siegel R, Ward E et al. Cancer statistics, 2009. CA Cancer J Clin 2009; 59(4): 225–249.
4. ÚZIS ČR, NOR ČR. Novotvary 2006. Cancer Incidence 2006 in the Czech Republic. http://www.uzis.cz/publikace/novotvary-2006.
5. ICRU. Prescribing, Recording and Reporting Photon Beam Therapy (Report 50). Bethesda: International Commission for Radiation Units and Measurements 1993 : 71.
6. ICRU Report 62. Prescribing, recording and reporting photon beam therapy (Suppl. to ICRU Report 50). Bethesda: International Commission for Radiation Units and Measurements 1999.
7. Giraud P, Antoine M, Larrouy A et al. Evaluation of microscopic tumor extension in non-small-cell lung cancer for three-dimensional conformal radiotherapy planning. Int J Radiat Oncol Biol Phys 2000; 48(4): 1015–1024.
8. van Herk M. Errors and margins in radiotherapy. Semin Radiat Oncol 2004; 14(1): 52–64.
9. Macapinlac HA, Apisarnthanarax S, Thorstad WL et al. Positron emission tomography imaging for target determination and delineation. In: Chao KSC et al. Practical essentials of intensity modulated radiation therapy. 2nd ed. Philadelphia: Lippincott Williams & Wilkins, 2005 : 62–81.
10. Warburg O, Wind F, Negelein E. The metabolism of tumors in the body. J Gen Physiol 1927; 8(6): 519–530.
11. Pauwels EK, Ribeiro MJ, Stoot JH et al. FDG accumulation and tumor biology. Nucl Med Biol 1998; 25(4): 317–322.
12. Smith TA. FDG uptake, tumour characteristics and response to therapy: a review. Nucl Med Commun 1998; 19(2): 97–105.
13. Macapinlac HA. Clinical applications of positron emission tomography/computed tomography treatment planning. Semin Nucl Med 2008; 38(2): 137–140.
14. Beyer T, Townsend DW, Brun T et al. A combined PET/CT scanner for clinical oncology. J Nucl Med 2000; 41(8): 1369–1379.
15. Gámez C, Rosell R, Fernández A et al. PET/CT fusion scan in lung cancer: current recommendations and innovations. J Thorac Oncol 2006; 1(1): 74–77.
16. Lardinois D, Weder W, Hany TF et al. Staging of non-small-cell lung cancer with integrated positron-emission tomography and computed tomography. N Engl J Med 2003; 348(25): 2500–2507.
17. Toloza EM, Harpole L, McCrory DC. Noninvasive staging of non-small cell lung cancer: a review of the current evidence. Chest 2003; 123 (1 Suppl): 137S–146S.
18. Antoch G, Stattaus J, Nemat AT et al. Non-small cell lung cancer: dual-modality PET/CT in preoperative staging. Radiology 2003; 229(2): 526–533. Epub 2003 Sep 25.
19. Faria SL, Menard S, Devic S et al. Impact of FDG-PET/CT on radiotherapy volume delineation in non-small-cell lung cancer and correlation of imaging stage with pathologic findings. Int J Radiat Oncol Biol Phys 2008; 70(4): 1035–1038.
20. Deniaud-Alexandre E, Touboul E, Lerouge D et al. Impact of computed tomography and 18F-deoxyglucose coincidence detection emission tomography image fusion for optimization of conformal radiotherapy in non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2005; 63(5): 1432–1441.
21. MacManus MP, Hicks RJ, Matthews JP et al. Metabolic (FDG-PET) response after radical radiotherapy/chemoradiotherapy for non-small cell lung cancer correlates with patterns of failure. Lung Cancer 2005; 49(1): 95–108.
22. Thie JA. Understanding the standardized uptake value, its methods, and implications for usage. J Nucl Med 2004; 45(9): 1431–1434.
23. Mah K, Caldwell CB. Biological target volume. In: Paulino A, Teh BS. PET/CT in radiotherapy treatment planning. Elsevier Press 2008 : 52–89.
24. Paulino AC, Johnstone PA. FDG-PET in radiotherapy treatment planning: Pandora‘s box? Int J Radiat Oncol Biol Phys 2004; 59(1): 4–5.
25. Huang SC. Anatomy of SUV. Standardized uptake value. Nucl Med Biol 2000; 27(7): 643–646.
26. Nestle U, Walter K, Schmidt S et al. 18F-deoxyglucose positron emission tomography (FDG-PET) for the planning of radiotherapy in lung cancer: high impact in patients with atelectasis. Int J Radiat Oncol Biol Phys 1999; 44(3): 593–597.
27. Bradley J, Thorstad WL, Mutic S et al. Impact of FDG-PET on radiation therapy volume delineation in non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2004; 59(1): 78–86.
28. Giraud P, Grahek D, Montravers F et al. CT and (18)F-deoxyglucose (FDG) image fusion for optimization of conformal radiotherapy of lung cancers. Int J Radiat Oncol Biol Phys 2001; 49(5): 1249–1257.
29. Brianzoni E, Rossi G, Ancidei S et al. Radiotherapy planning: PET/CT scanner performances in the definition of gross tumour volume and clinical target volume. Eur J Nucl Med Mol Imaging 2005; 32(12): 1392–1399.
30. Erdi YE, Rosenzweig K, Erdi AK et al. Radiotherapy treatment planning for patients with non-small cell lung cancer using positron emission tomography (PET). Radiother Oncol 2002; 62(1): 51–60.
31. Fox JL, Rengan R, O‘Meara W et al. Does registration of PET and planning CT images decrease interobserver and intraobserver variation in delineating tumor volumes for non-small-cell lung cancer? Int J Radiat Oncol Biol Phys 2005; 62(1): 70–75.
32. Mah K, Caldwell CB, Ung YC et al. The impact of (18)FDG-PET on target and critical organs in CT-based treatment planning of patients with poorly defined non-small-cell lung carcinoma: a prospective study. Int J Radiat Oncol Biol Phys 2002; 52(2): 339–350.
33. Videtic GM, Rice TW, Murthy S et al. Utility of positron emission tomography compared with mediastinoscopy for delineating involved lymph nodes in stage III lung cancer: insights for radiotherapy planning from a surgical cohort. Int J Radiat Oncol Biol Phys 2008; 72(3): 702–706.
34. Jarritt PH, Carson KJ, Hounsell AR et al. The role of PET/CT scanning in radiotherapy planning. Br J Radiol 2006; 79 (Spec No 1): S27–S35.
35. Hong R, Halama J, Bova D et al. Correlation of PET standard uptake value and CT window-level thresholds for target delineation in CT-based radiation treatment planning. Int J Radiat Oncol Biol Phys 2007; 67(3): 720–726.
36. Nestle U, Kremp S, Schaefer-Schuler A et al. Comparison of different methods for delineation of 18F-FDG PET-positive tissue for target volume definition in radiotherapy of patients with non-small cell lung cancer. J Nucl Med 2005; 46(8): 1342–1348.
37. Biehl KJ, Kong FM, Dehdashti F et al. 18F-FDG PET definition of gross tumor volume for radiotherapy of non--small cell lung cancer: is a single standardized uptake value threshold approach appropriate? J Nucl Med 2006; 47(11): 1808–1812.
38. Ashamalla H, Rafla S, Parikh K et al. The contribution of integrated PET/CT to the evolving definition of treatment volumes in radiation treatment planning in lung cancer. Int J Radiat Oncol Biol Phys 2005; 63(4): 1016–1023.
39. Davis JB, Reiner B, Huser M et al. Assessment of 18F PET signals for automatic target volume definition in radiotherapy treatment planning. Radiother Oncol 2006; 80(1): 43–50.
40. Black QC, Grills IS, Kestin LLet al. Defining a radiotherapy target with positron emission tomography. Int J Radiat Oncol Biol Phys 2004; 60(4): 1272–1282.
41. Yaremko B, Riauka T, Robinson D et al. Threshold modification for tumour imaging in non-small-cell lung cancer using positron emission tomography. Nucl Med Commun 2005; 26(5): 433–440.
42. Gondi V, Bradley K, Mehta M et al. Impact of hybrid fluorodeoxyglucose positron-emission tomography/computed tomography on radiotherapy planning in esophageal and non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2007; 67(1): 187–195.
43. Kiffer JD, Berlangieri SU, Scott AM et al. The contribution of 18F-fluoro-2-deoxy-glucose positron emission tomographic imaging to radiotherapy planning in lung cancer. Lung Cancer 1998; 19(3): 167–177.
44. Ciernik IF, Dizendorf E, Baumert BG et al. Radiation treatment planning with an integrated positron emission and computer tomography (PET/CT): a feasibility study. Int J Radiat Oncol Biol Phys 2003; 57(3): 853–863.
45. Ceresoli GL, Cattaneo GM, Castellone P et al. Role of computed tomography and [18F] fluorodeoxyglucose positron emission tomography image fusion in conformal radiotherapy of non-small cell lung cancer: a comparison with standard techniques with and without elective nodal irradiation. Tumori 2007; 93(1): 88–96.
46. Grills IS, Yan D, Black QC et al. Clinical implications of defining the gross tumor volume with combination of CT and 18FDG-positron emission tomography in non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2007; 67(3): 709–719.
47. Vanuytsel LJ, Vansteenkiste JF, Stroobants SG et al. The impact of (18)F-fluoro-2-deoxy-D-glucose positron emission tomography (FDG-PET) lymph node staging on the radiation treatment volumes in patients with non-small cell lung cancer. Radiother Oncol 2000; 55(3): 317–324.
48. Paulsen F, Scheiderbauer J, Eschmann SM et al. First experiences of radiation treatment planning with PET/CT. Strahlenther Onkol 2006; 182(7): 369–375.
49. Kwa SL, Lebesque JV, Theuws JC et al. Radiation pneumonitis as a function of mean lung dose: an analysis of pooled data of 540 patients. Int J Radiat Oncol Biol Phys 1998; 42(1): 1–9.
50. Singh AK, Lockett MA, Bradley JD. Predictors of radiation-induced esophageal toxicity in patients with non-small-cell lung cancer treated with three-dimensional conformal radiotherapy. Int J Radiat Oncol Biol Phys 2003; 55(2): 337–341.
51. MacManus M, D‘Costa I, Everitt S et al. Comparison of CT and positron emission tomography/CT coregistered images in planning radical radiotherapy in patients with non-small-cell lung cancer. Australas Radiol 2007; 51(4): 386–393.
52. Rengan R, Rosenzweig KE, Venkatraman E et al. Improved local control with higher doses of radiation in large-volume stage III non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2004; 60(3): 741–747.
53. Willner J, Baier K, Caragiani E et al. Dose, volume, and tumor control prediction in primary radiotherapy of non-small cell lung cancer. Int J Radiat Oncol Biol Phys 2002; 52(2): 382–389.
54. Saunders M, Dische S, Barrett A et al. Continuous, hyperfractionated, accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small cell lung cancer: mature data from the randomised multicentre trial. CHART Steering committee. Radiother Oncol 1999; 52(2): 137–148.
55. van Der Wel A, Nijsten S, Hochstenbag M et al. Increased therapeutic ratio by 18FDG-PET CT planning in patients with clinical CT stage N2-N3M0 non-small-cell lung cancer: a modeling study. Int J Radiat Oncol Biol Phys 2005; 61(3): 649–655.
56. De Ruysscher D, Wanders S, Minken A et al. Effects of radiotherapy planning with a dedicated combined PET-CT-simulator of patients with non-small cell lung cancer on dose limiting normal tissues and radiation dose-escalation: a planning study. Radiother Oncol 2005; 77(1): 5–10. Epub 2005 Jul 12.
57. Gillham C, Zips D, Pönisch F et al. Additional PET/CT in week 5-6 of radiotherapy for patients with stage III non-small cell lung cancer as a means of dose escalation planning? Radiother Oncol 2008; 88(3): 335–341.
58. Giraud P, Elles S, Helfre S et al. Conformal radiotherapy for lung cancer: Different delineation of the gross tumour volume (GTV) by radiologists and radiation oncologists. Radiother Oncol 2002; 62(1): 27–36.
59. Ling CC, Humm J, Larson S et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. Int J Radiat Oncol Biol Phys 2000; 47(3): 551–560.
60. Gagel B, Reinartz P, Demirel C et al. [18F] fluoromisonidazole and [18F] fluorodeoxyglucose positron emission tomography in response evaluation after chemo-/radiotherapy of non-small-cell lung cancer: a feasibility study. BMC Cancer 2006; 6 : 51.
61. Kenny LM, Aboagye EO, Price PM. Positron emission tomography imaging of cell proliferation in oncology. R Coll Radiol 2004; 16(3): 176–185.
62. Radiation Therapy Oncology Group. RTOG 0618. A Phase II Trial of Stereotactic Body Radiation Therapy (SBRT) in the Treatment of Patients with Operable Stage I/II Non-Small Cell Lung Cancer. http://www.rtog.org/members/protocols/0618/0618.pdf.
63. Radiation Therapy Oncology Group. RTOG 0915. A Randomized Phase Ii Study Comparing 2 Stereotactic Body Radiation Therapy (Sbrt) Schedules For Medically Inoperable Patients With Stage I Peripheral Non-Small Cell Lung Cancer. http://www.rtog.org/members/protocols/0915/0915.pdf.
64. Pfannenberg AC, Aschoff P, Brechtel K et al. Low dose non-enhanced CT versus standard dose contrast-enhanced CT in combined PET/CT protocols for staging and therapy planning in non-small cell lung cancer. Eur J Nucl Med Mol Imaging 2007; 34(1): 36–44.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Ischemická choroba srdca a hypertenzia ako neskoré následky liečby nádorov testis – prehľad
- Využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů
- Editorial
- Algoritmus separace plazmatických buněk ze vzorků kostní dřeně
- Antineoplastické účinky simvastatínu u experimentálnej rakoviny prsníka
- Oportunní infekce mozku u pacientů po komplexní terapii nádorového onemocnění
- Vulvárna intraepiteliálna neoplázia
- Vývoj nových léčiv u solidních nádorů – změna pohledu na optimální design klinických studií
- Postavení Avastinu v léčbě karcinomu prsu v Evropě a v USA
- V Brně vzniká špičkové centrum pro výzkum nádorových onemocnění díky podpoře z evropských fondů
- XVIII. Fórum onkologů – zpráva z jednání v Brně dne 5. 11. 2010
- Best of ASCO® Czech Republic 2011
- Zápis ze schůze výboru České onkologické společnosti dne 21. 12. 2010 ve VFN Praha
- Zápis ze schůze výboru České onkologické společnosti dne 18. 1. 2011 ve FNB Praha
- Tematický seznam publikací vydaných v Klinické onkologii v roce 2009 a 2010
- Bazocelulárny karcinóm kože – biologické správanie nádoru a prehľad najvýznamnejších molekulových ukazovateľov progresie ochorenia v praxi patológa
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Bazocelulárny karcinóm kože – biologické správanie nádoru a prehľad najvýznamnejších molekulových ukazovateľov progresie ochorenia v praxi patológa
- Vulvárna intraepiteliálna neoplázia
- Využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů
- Oportunní infekce mozku u pacientů po komplexní terapii nádorového onemocnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání







