-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Lenalidomid v léčbě mnohočetného myelomu
Lenalidomide in the Treatment of Multiple Myeloma
We present the case of a 58-year old patient with relapsed multiple myeloma, in which lenalidomide was used in combination with dexamethasone after the failure of previous treatment modalities. The progression of the myeloma was clinically manifested by painful swelling of the patient’s left arm caused by an extensive osteolytic lesion of the bone. After one month of therapy with lenalidomide and dexamethasone, a significant decrease in the paraprotein level was detected. Later, the clinical finding on the left arm was normalized too and concurrently the X ray image shows the production of new bone.
Key words:
multiple myeloma – treatment – lenalidomide
Autoři: K. Machálková; V. Maisnar
Působiště autorů: Oddělení klinické hematologie, II. interní klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Klin Onkol 2009; 22(3): 117-120
Kategorie: Kazuistiky
Souhrn
Je popsán případ 58letého pacienta s progresí mnohočetného myelomu, u kterého byl po selhání předchozích léčebných modalit k terapii použit lenalidomid v kombinaci s dexametazonem. Klinicky se progrese onemocnění u pacienta projevovala bolestivým otokem pravé paže souvisejícím s rozsáhlou osteolytickou destrukcí humeru. Již měsíc po zahájení léčby lenalidomidem došlo k významnému poklesu hladiny paraproteinu, později i k normalizaci klinického nálezu na paži a současně byly na rentgenu humeru patrny známky novotvorby kosti.
Klíčová slova:
mnohočetný myelom – léčba – lenalidomidÚvod
U pacientů s mnohočetným myelomem došlo v posledních letech k výraznému zlepšení léčebných výsledků díky využití nových léků, jejichž hlavními představiteli jsou v současnosti thalidomid, bortezomib a nově i lenalidomid. První zkušenosti s posledně jmenovaným lékem bylo zatím možné v České republice získat jen díky podpůrnému programu firmy Celgene nebo v rámci klinických studií. V následujícím textu uvádíme kazuistiku pacienta léčeného lenalidomidem na našem pracovišti.
Kazuistika
58letý pacient byl na naší klinice sledován s diagnózou mnohočetného myelomu od roku 2006. Prvním projevem onemocnění byla v březnu roku 2006 patologická fraktura humeru, která byla řešena osteosyntézou. Dle histologie kostní tkáně z osteolytického ložiska se jednalo o plazmocytom. Na základě doplněných vyšetření byla stanovena diagnóza mnohočetného myelomu – vstupně stadium II A dle Durie-Salmona (v kostní dřeni 10% plazmatických buněk, v séru paraprotein IgG kappa 6,38g/l, rtg skeletu s postižením levého humeru, dále suspektní osteolytické ložisko v acetabulu pravého kyčelního kloubu, hemoglobin 152g/l, kreatinin 72 μmol/l a kalcium 2,35 mmol/l) a IPS 1 (International Prognostic System) (albumin 45,7g/l, beta 2 mikroglobulin 1,7mg/l). Pacientovi byly v rámci indukční léčby podány čtyři cykly chemoterapie VAD (vincristin, adriamycin, dexametazon), následně separační cyklofosfamid (2,5g/m2) a po přípravném režimu Mel 200 u něho byla v září 2006 provedena autologní transplantace periferních kmenových buněk. Výsledkem této léčby bylo pouze dosažení stabilizace onemocnění – kostní dřeň bez infiltrace plazmatickými buňkami, koncentrace paraproteinu v séru ale poklesla o méně než 50% výchozí hodnoty (na 4,1g/l). Od února 2007 proto nemocný dostával udržovací léčbu interferonem alfa (3 × 3 mil. IU/týden).
V listopadu 2007 si pacient při kontrole stěžoval na nově vzniklou bolestivou rezistenci v oblasti levého klíčku – na rentgenu bylo potvrzeno nové osteolytické ložisko v levé klavikule, navíc došlo k mírné progresi osteoporózy v levém humeru. V kostní dřeni sice nebyla prokázána infiltrace plazmocyty, došlo však k významnému nárůstu koncentrace paraproteinu v séru (na 7,7g/l) – stav byl na základě uvedených nálezů vyhodnocen jako lokální progrese onemocnění. Následovala radioterapie na oblast levého klíčku (10 × 3 Gy), levý humerus z důvodu přítomné kovové osteosyntézy a nepřítomnosti zřejmé osteolýzy ozářen nebyl. I přes zahájenou lokální léčbu však došlo k další progresi choroby, která se projevila dalším nárůstem koncentrace paraproteinu v séru (v lednu 2008 již 8,6g/l) a současně progresí nálezu na levém humeru ve smyslu osteolýzy v místě úvodní patologické fraktury. Proto byly od ledna 2008 podány čtyři cykly chemoterapie bortezomib/dexametazon, které však neměly žádný léčebný efekt. Laboratorně byl patrný další nárůst koncentrace paraproteinu v séru (v květnu 2008 dosáhl max. hodnoty 11,7g/l) a současně se objevily klinické známky lokální progrese, kdy na levé paži vznikla objemná solidní expanze s bolestivým otokem celé levé horní končetiny (obr. 1). Pro rtg potvrzenou progresi destrukce kosti bylo nutno provést revizi osteosyntézy s další stabilizací.
Obr. 1. Rtg levého humeru před zahájením léčby lenalidomidem. 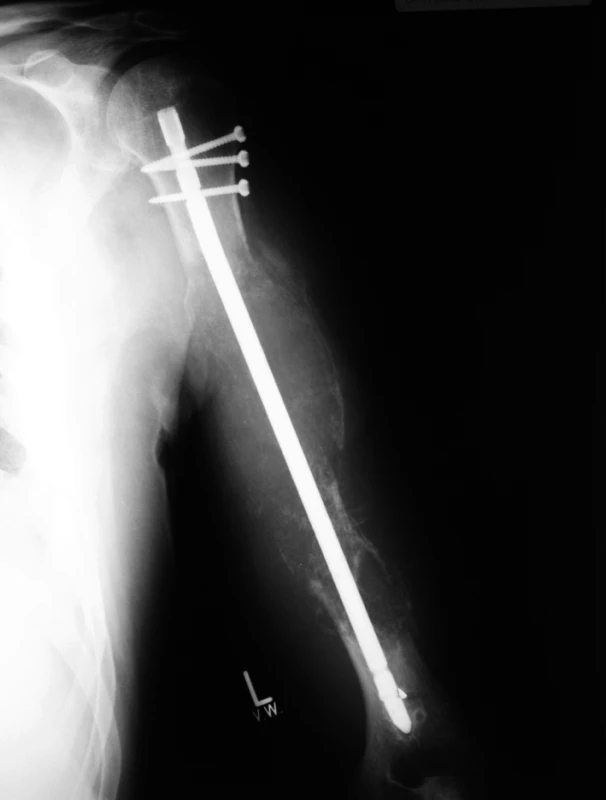
Pro neúčinnost předchozích léčebných postupů bylo od května 2008 zahájeno podávání lenalidomidu (Revlimid) v kombinaci s dexametazonem (lenalidomid v dávce 25mg/den 1.–21. den, dexametazon v dávce 40mg při prvních čtyřech cyklech den 1.–4, 9.–12, 17.–20., při dalších cyklech pouze den 1.–4.). Již po měsíci léčby touto kombinací došlo k výraznému poklesu koncentrace paraproteinu v séru (1,9g/l v květnu 2008), klinicky došlo k ústupu bolestivého otoku levé paže, na rentgenu humeru byly přítomny známky novotvorby kostní tkáně (obr. 2) a nemocný byl znovu schopen levou rukou vykonávat běžné činnosti.
Obr. 2. Rtg levého humeru v průběhu léčby lenalidomidem. 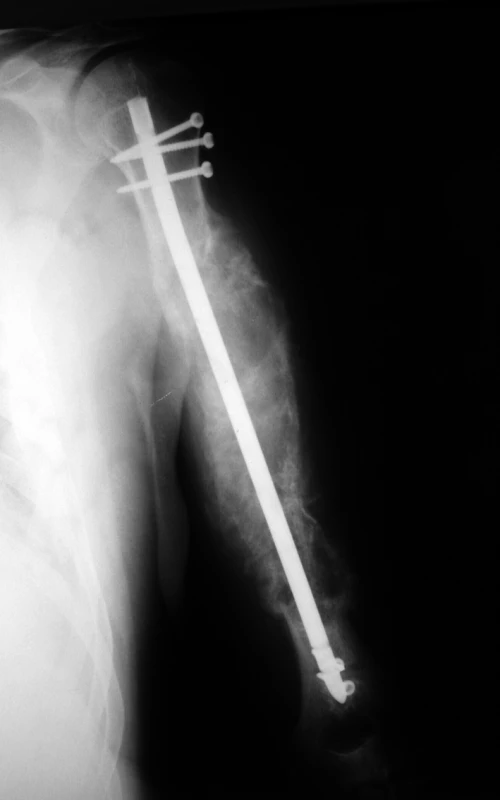
Diskuze
Lenalidomid je imunomodulační látka strukturálně podobná thalidomidu, která byla vyvinuta s cílem redukovat toxicitu thalidomidu, a naopak potencovat jeho účinek [1]. Jeho použití je prozatím indikováno v léčbě refrakterního či relabujícího myelomu u pacientů, kteří absolvovali alespoň jednu předchozí linii léčby myelomu. Do budoucna lze počítat i s jeho využitím v rámci indukční léčby mnohočetného myelomu vzhledem ke skutečnosti, že na rozdíl od thalidomidu a bortezomibu nejde o neurotoxický lék. Současné doporučené dávkování však většinou provází významná toxicita hematologická [2,3].
Mechanizmus účinku lenalidomidu je komplexní a není zcela přesně vysvětlen. Znám je jeho efekt imunomodulační a protinádorový. Současně ovlivňuje průběh onemocnění cestou inhibice angiogeneze a snížením schopnosti plazmocytů adherovat k buňkám stromatu kostní dřeně [1].
K ověření účinnosti a bezpečnosti lenalidomidu proběhly dvě multicentrické, randomizované, dvojitě zaslepené a placebem kontrolované studie – MM-009 v severní Americe [3] a MM-010 v západní Evropě, Austrálii a Izraeli [2]. Pacientům s myelomem, kteří absolvovali alespoň jednu předchozí léčebnou linii, byl podáván buď lenalidomid s dexametazonem, nebo samotný dexametazon. V obou studiích byl medián věku pacientů 63 let, srovnatelné bylo i zastoupení mužů a žen. Jednalo se o pacienty významně předléčené jak thalidomidem, tak bortezomibem, po předchozí transplantaci autologní či alogenní (graf 1). Pacienti ve skupině lenalidomid/dexametazon užívali 25mg lenalidomidu perorálně jednou denně 1.–21. den a placebové tobolky jednou denně 22.–28. den každého 28denního cyklu. Pacienti ve skupině placebo/dexametazon užívali jednu tobolku placeba po celou dobu 28denního cyklu. Pacienti v obou léčených skupinách užívali perorálně 40mg dexametazonu jednou denně, a to 1.–4., 9.–12. a 17.–20. den cyklu po první čtyři cykly terapie, poté byla dávka dexametazonu snížena na 40mg jednou denně 1.–4. den cyklu. Studie pokračovala, dokud u pacientů nedošlo k progresi choroby či neakceptovatelné toxicitě léčby [2,3]. Výsledky v obou studiích byly prakticky srovnatelné, jako základní parametry účinnosti byly hodnoceny čas do progrese (time to progression, TTP) a odpověď na léčbu (tab. 1). U pacientů léčených kombinací lenalidomid/dexametazon byl čas do progrese signifikantně delší než u pacientů léčených placebem s dexametazonem – medián TTP 48,3 vs 20,1 týdne. Vzhledem ke skutečnosti, že ve skupině lenalidomid/dexametazon byla významně vyšší i četnost odpovědí na léčbu a kompletních remisí (graf 2), byly obě studie předčasně odslepeny, tak aby i pacienti ve skupině placebo/dexametazon mohli profitovat z léčby kombinací lenalidomid/dexametazon [4].
Graf 1. Předléčenost pacientů ve studii MM-009 a MM-010. SCT – stem cell transplatation (transplantace kmenových buněk krvetvorby). 
Tab. 1. Souhrn výsledků studií MM-009 a MM-010. 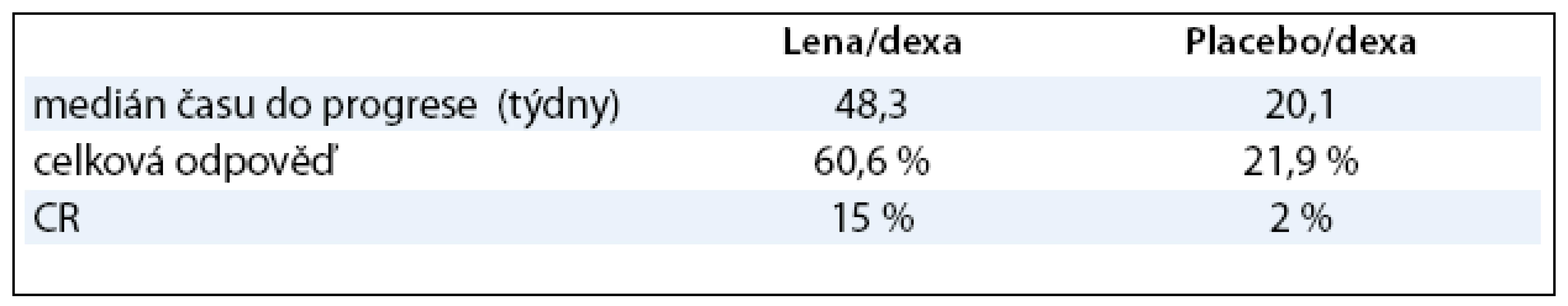
Graf 2. Odpověď na léčbu ve studii MM-009 a MM-010. PR – partial remission, CR – complete remission, nCR – near complete remission, lena – lenalidomide, dexa – dexametazon. 
Mezi hlavní nežádoucí účinky lenalidomidu patří hematologická toxicita – především neutropenie (včetně grade 4), ale také trombocytopenie a anémie [2,3]. Z tohoto důvodu nesmí být léčba lenalidomidem zahájena při ANC (absolute neutrophil count) nižším než 1,0 × 109/l a počtu trombocytů nižším než 75 × 109/l, pokud tento nález nelze vysvětlit masivní infiltrací kostní dřeně nádorovými plazmocyty. Proto především na počátku léčby jsou nutné častější kontroly krevního obrazu – doporučují se kontrolní odběry 1krát týdně po dobu prvních dvou měsíců, dále potom 1krát měsíčně. V případě neutropenie či trombocytopenie je nutné redukovat dávku lenalidomidu, obecně se ale nemá podávat méně než 5mg lenalidomidu denně [4]. Mezi další nežádoucí účinky při léčbě lenalidomidem patří zvýšené riziko žilního trombembolizmu. Proto je nutné profylaktické zajištění antikoagulační léčbou po celou dobu terapie, jako nejvhodnější se vzhledem k relativně časté hematologické toxicitě jeví použití nízkomolekulárního heparinu. Mezi častější nežádoucí účinky lenalidomidu dále patří únava, nespavost, průjem, svalové křeče, infekce [2,3,4]. Nově je u lenalidomidu předpokládána i možnost teratogenity, u opic totiž byly pozorovány obdobné deformace jako při podávání thalidomidu (tj. fokomelie) [4]. Absolutní kontraindikací podávání lenalidomidu je proto těhotenství a u žen ve fertilním věku je nutné před podáním léčby zahájit účinnou kontracepci a současně pravidelně provádět těhotenský test před zahájením léčby, v jejím průběhu 1× měsíčně a ještě 1 měsíc po ukončení léčby lenalidomidem [1,4]. Případy výskytu periferní neuropatie, zácpy a sedativních účinků byly pozorovány jen ojediněle, což představuje hlavní výhodu oproti thalidomidu a bortezomibu. Lenalidomid tedy nezhoršuje periferní neuropatii související s předchozí léčbou thalidomidem či bortezomibem [5].
Vzhledem ke skutečnosti, že větší část lenalidomidu je vylučována v nezměněné formě ledvinami, je doporučeno během léčby pravidelné sledování renálních funkcí [4]. Bylo prokázáno, že při odpovídající redukci dávky lenalidomidu a dexametazonu lze tuto kombinaci bezpečně a účinně použít u všech stupňů renálního selhání [5,6]. U pacientů s poruchou jaterních funkcí doporučení k léčbě lenalidomidem zatím neexistují. Lenalidomid není metabolizován enzymy cytochromu P450, přesto je doporučeno případné častější sledování koncentrací současně podávaných léků, u nichž je to možné (např. digoxin) [4].
Závěr
Na základě studií MM-009 a MM-010 bylo od května 2007 schváleno použití lenalidomidu u nemocných s mnohočetným myelomem v rámci Evropské unie [1]. Omezením při použití lenalidomidu je kromě vysoké ceny léčby především jeho hematologická toxicita. Zatím doporučená dávka 25mg denně bude v kombinovaných režimech pravděpodobně vysoká. V současné době proto pokračuje hledání optimálních kombinací lenalidomidu s jinými látkami za účelem dosažení maximálního efektu léčby za současného snížení nežádoucích účinků léčby na minimum. Zahájeny byly již i studie zkoumající možnost využití lenalidomidu v rámci indukční léčby nově diagnostikovaného mnohočetného myelomu. Díky možnosti perorálního podávání se zdá být lenalidomid vhodným lékem i v rámci dlouhodobé udržovací léčby [6]. Zdá se tedy, že se s tímto slibným lékem budeme v budoucnu setkávat u našich nemocných stále častěji.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Kateřina Machálková
Oddělení klinické hematologie,II. interní klinika
Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: machalkovak@seznam.cz
Zdroje
1. Armoiry X, Aulagner G, Facon T. Lenalidomide in the treatment of multiple myeloma: a review. J Clin Pharm Ther 2008; 33(3): 219–226.
2. Dimopoulos M, Spencer A, Attal M et al. Lenalidomide plus Dexamethasone for relapsed or refraktory multiple myeloma. N Engl J Med 2007; 357 : 2123–2132.
3. Weber DM, Chen C, Niesvizky R et al. Lenalidomide plus Dexamethasone for Relapsed Multiple Myeloma in North America. N Engl J Med 2007; 357 : 2133–2142.
4. Celgene corporation – Summary of Product Characteristics. 92 stran, poslední aktualizace 2. 5. 2008.
5. Cavo M et al. Lenalidomide in relapsed/refraktory multiple myeloma: overall survival. Leukemia Res 2008; 32 (Suppl 1): S12–S19.
6. Cavo M et al. Lenalidomide: towards a new standart in the optima management of multiple myeloma. Leukemia Res 2008; 32 (Suppl 1): S20–S24.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2009 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Dlhodobé výsledky chirurgickej liečby pľúcnych metastáz u pacientov s germinatívnymi nádormi testis
- Clostridium difficile Associated Diarrhoea – problém onkologického pacienta?
- Lenalidomid v léčbě mnohočetného myelomu
- Poznámky ke 4. vydání klasifikace lymfomů WHO
- Zápis ze schůze výboru České onkologické společnosti dne 22. 5. 2009 na MOÚ Brno
- Hodnotenie vedľajších účinkov inhibítorov aromatázy v klinických a experimentálnych štúdiách
- Nová radiofarmaka a aplikace pozitronové emisní tomografie na Masarykově onkologickém ústavu v Brně
- Využití PET/CT vyšetření při plánování radioterapie nádorů ORL oblasti
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnotenie vedľajších účinkov inhibítorov aromatázy v klinických a experimentálnych štúdiách
- Využití PET/CT vyšetření při plánování radioterapie nádorů ORL oblasti
- Clostridium difficile Associated Diarrhoea – problém onkologického pacienta?
- Nová radiofarmaka a aplikace pozitronové emisní tomografie na Masarykově onkologickém ústavu v Brně
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



