-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Farmakologická léčba osteoporózy ve vysokém věku
Pharmacological treatment of osteoporosis in old age
With a growing elderly population, the incidence of osteoporotic fractures will increase over the coming decades. In old age, osteoporotic fractures are associated with a substantial burden in terms of morbidity and mortality and higher costs for society compared with fractures in younger individuals. Nevertheless, osteoporosis in old age continues to be underdiagnosed and undertreated. Multiple competing factors: frailty, comorbidities, falls, polypharmacy and drug interactions, and other factors influence our approach to fracture prevention in this population. Most studies show continued efficacy of pharmacologic interventions in age group ≥ 75–80 years, although they are largely limited by small sample sizes. We herein review the available evidence of pharmacologic interventions for fracture risk reduction in this population.
Keywords:
sarcopenia – aging – osteoporosis – fracture prevention – pharmacologic intervention
Autoři: Vít Zikán
Působiště autorů: Osteocentrum, 3. interní klinika 1. LF UK a VFN Praha
Vyšlo v časopise: Geriatrie a Gerontologie 2022, 11, č. 1: 15-24
Kategorie: Přehledový článek
Souhrn
Stárnutí populace povede k významnému nárůstu incidence osteoporotických zlomenin v následujících dekádách. Osteoporotické zlomeniny jsou ve vyšším věku zatíženy vysokou morbiditou a mortalitou a také vyššími ekonomickými náklady pro společnost ve srovnání se zlomeninami u mladších osob. Přesto je osteoporóza ve vysokém věku nedostatečně diagnostikována a zůstává neléčena. Přístupy k prevenci zlomenin u starší populace ovlivňuje mnoho přidružených faktorů: komorbidity, křehkost, pády, polypragmazie, lékové interakce a další faktory. Většina studií ukazuje pokračující účinnost farmakologických intervencí i ve věkové skupině ≥ 75–80 let, i když jsou data do značné míry limitována velikostí studované populace. V tomto přehledu uvádíme přehled dostupných důkazů o účinnosti a bezpečnosti farmakologické léčby pro snížení rizika zlomenin v této populaci.
Klíčová slova:
osteoporóza – sarkopenie – stárnutí – farmakologická intervence – prevence zlomenin
Úvod
Osteoporóza je systémové metabolické onemocnění skeletu charakterizované nízkou kostní hmotou a poškozením kvality kostní tkáně s následným zvýšením křehkosti kostí a rizikem zlomenin po nepřiměřeně malé zátěži.(1) Po dosažení maxima kostní hmoty dochází u obou pohlaví již kolem 3. dekády života k postupnému úbytku trámčité kostní hmoty (0,5 – 1,5 % ročně). K urychlení úbytku trámčité kosti dochází u žen v období menopauzy a u mužů v případě hypogonadismu. Úbytek kortikální kosti nabývá na významu u obou pohlaví po 65.–70. roce života. Ztráta kostní hmoty ve stáří (involuční osteoporóza) a neobratlové zlomeniny jsou pak důsledkem zejména zvýšené intrakortikální porozity.(2) Odhaduje se, že do 80 let věku bývá dosaženo ztráty až 50 % kostní hmoty. Osteoporotické zlomeniny, zejména zlomeniny obratlových těl a proximálního femuru, vedou k invaliditě, závislosti postižených osob na pomoci druhých a k předčasnému úmrtí.(3,4) S prodlužující se střední délkou života se výskyt zlomenin v příštích dekádách bude zvyšovat.(5) Výskyt zlomenin u žen ve věku ≥ 80 let je významně vyšší než u mladších žen(6) a zlomeniny mají v tomto věku také závažnější důsledky jak pro pacienta, tak pro ekonomiku ve srovnání se zlomeninami u mladších osob.(7) Zlomeniny kyčle jsou nejzávažnější osteoporotické zlomeniny s vysokým rizikem úmrtí. Velká část pacientů (více než 50 %), kteří jsou přijati do nemocnice se zlomeninou kyčle, jsou starší 80 let.(8) Po 50. roce života dochází k postupnému úbytku i svalové hmoty 1–2 % ročně. Po 70. roce se ztráta svalové síly dále prohlubuje přibližně o 25–40 % za dekádu.(9) Klinicky se ztráta svalové hmoty a síly související s věkem označuje jako sarkopenie. Svalová síla je důležitá pro periostální stimulaci a udržení kostní novotvorby. Současná ztráta kostní a svalové hmoty se označuje termínem osteosarkopenie, jejíž prevalence se pohybuje mezi 5–40 %, s vyšší prevalencí u starších osob s pády a zlomeninami.(10) Involuční osteoporóza a sarkopenie patří k biologickým projevům syndromu křehkosti (frailty syndrome). Osteoporotické zlomeniny u osob nad 80 let jsou častěji náchylné ke komplikacím, zejména proto, že ke zlomeninám dochází v populaci „křehkých“ osob s dalšími komorbiditami. Syndrom křehkosti představuje stav, kdy je jedinec více zranitelný a více náchylný ke komplikacím, kdy jedna nepříznivá událost (např. banální infekt) vyvolá kaskádu dalších následků.(11) Například 1. rok po zlomenině kyčle zůstává až 40 % pacientů neschopno samostatné chůze, 33 % z nich je zcela závislých na péči druhých a mortalita se udává až 20 % u žen a 37 % u mužů.(12,13) Zvýšená mortalita po zlomeninách kyčle u křehkých pacientů nebyla přitom pozorována pouze během 1. roku po zlomenině, ale i v následujících letech.(14) Zvýšená morbidita a mortalita je dokumentována i po klinických zlomeninách obratlů.(15)
Nedostatečná diagnostika a léčba osteoporózy
Navzdory narůstajícím důkazům o vysoké prevalenci a závažnosti osteoporózy u starších osob je osteoporóza ve stáří stále v moha zemích EU nedostatečně diagnostikována a zůstává bez léčby.(16,17) Dokonce i u nemocných přijatých do nemocnice se zdokumentovanými zlomeninami není osteoporóza, zejména u osob starších 80 let, léčena.(16) Důvody pro nezahájení léčby mohou být různorodé, osteoporóza i zlomeniny mohou být považovány za přirozenou součást stárnutí a jsou upřednostněna jiná doprovodná onemocnění.(18) Je přitom prokázáno, že prodělaná zlomenina dramaticky zvyšuje riziko následných zlomenin (spouští „kaskádu dalších zlomenin“), zejména během prvního roku, a to bez ohledu na její lokalizaci.(19) Léčba by měla být po zlomenině zahájena co nejdříve, aby se předešlo dalším zlomeninám.(20) Farmakologická léčba by měla být zvažována u všech osob s vysokým rizikem zlomenin. Lepší zacílení terapeutických intervencí pro prevenci osteoporotických zlomenin začíná diagnózou, identifikací rizikových faktorů a posouzením rizika zlomenin.(21) Mezinárodní nadace pro osteoporózu (IOF) a Evropská společnost pro klinické a ekonomické aspekty osteoporózy a osteoartrózy publikovala doporučení pro diagnostiku a management osteoporózy v roce 2013 a tato doporučení recentně aktualizovala.( 22) Podobně pracovní skupina pro sarkopenii u starších osob (EWGSOP) publikovala definici sarkopenie v roce 2010 a aktualizovala ji v roce 2019.(23)
Nefarmakologická opatření v prevenci zlomenin
Prevence zlomenin u osob ve vysokém věku je podstatně složitější než u mladších pacientů. Kromě léčby řady chronických onemocnění, která mohou přispívat jak k osteoporóze, tak k celkové křehkosti, je nezbytné snížit i riziko pádů, ke kterému přispívá řada neskeletálních faktorů. S věkem klesá množství kostní i svalové hmoty a zhoršují se psychické, fyzické i sociální funkce jedince. Mezi časté symptomy patří slabost, únava, ztráta fyzické aktivity a zhoršení životního stylu a mobility. Pacienti mohou trpět malnutricí a ztrátou tělesné hmotnosti. Koncept syndromu frailty usnadňuje lepší pochopení heterogenity ve starší populaci a podporuje studium procesu stárnutí (obr. 1). Umožňuje lépe cílit preventivní opatření se zaměřením na zlepšení fyzické zdatnosti a snížení výskytu pádů a zlomenin.(24,25)
Obr. 1. Osteoporóza je pouze jedním z rizikových faktorů zlomenin 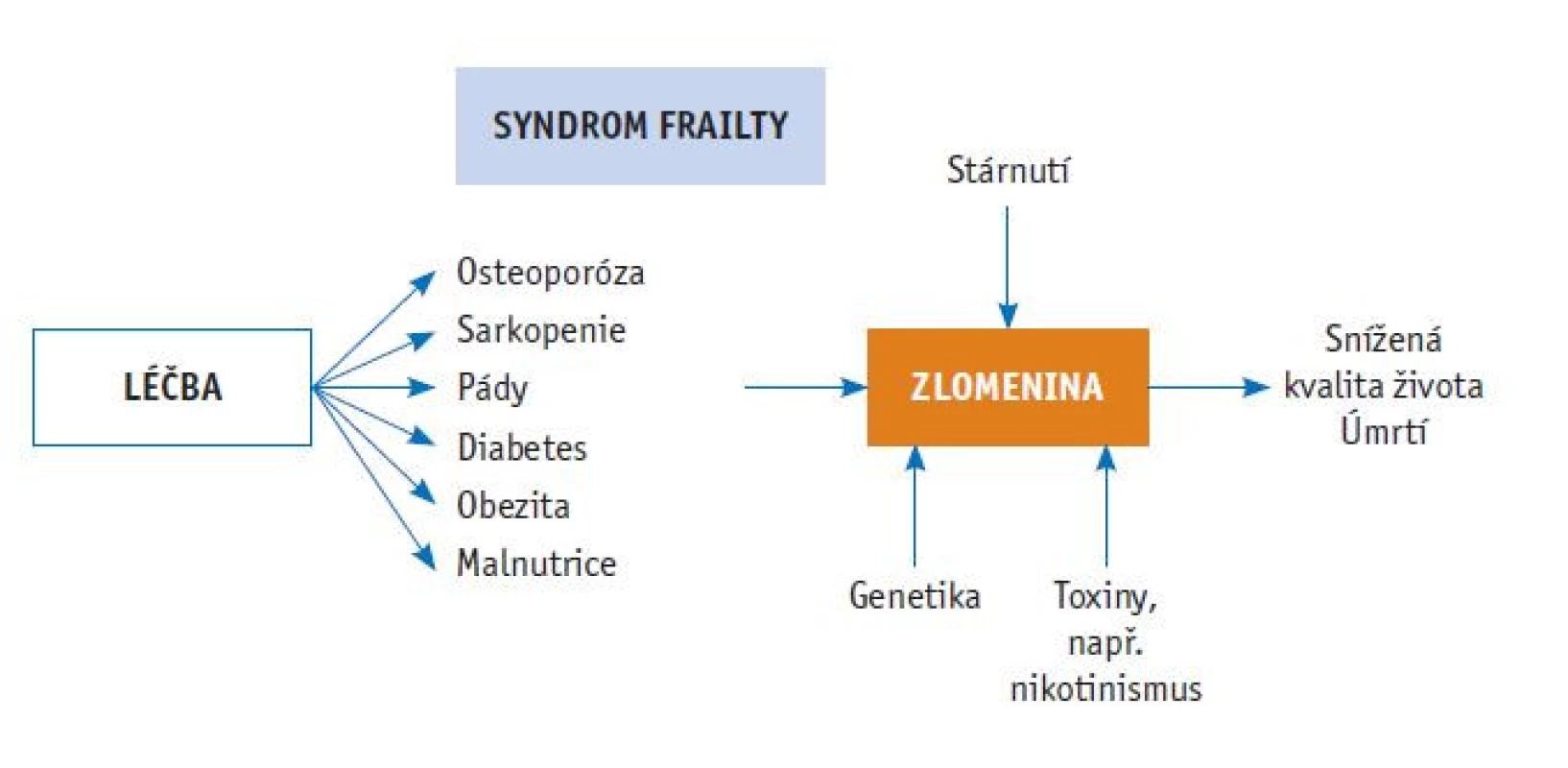
Dietní příjem bílkovin
Malnutrice a zejména nízký příjem kvalitních bílkovin patří mezi hlavní rizikové faktory pro rozvoj sarkopenie a syndromu frailty.(26) Podle jedné studie se protein-kalorická malnutrice vyskytuje u 4–10 % seniorů žijících doma, u 15–38 % institucializovaných a u 30–70 % hospitalizovaných seniorů.(27) V klinických studiích je jako nutriční marker využívána mj. plazmatická koncentrace IGF-I (inzulinu podobný růstový faktor).(28) Tento důležitý trofický hormon, který zprostředkovává účinky růstového hormonu a mj. působí stimulačně na svalové a kostní buňky, reguluje zpětnou reabsorpci fosfátů v ledvinách a má stimulační účinek na tvorbu kalcitriolu. Jeho produkce v játrech může být vážně inhibována špatnou výživou. Navýšení příjmu bílkovin může vést k rychlé normalizaci hladin IGF-I i u křehkých seniorů po zlomenině. Denní příjem bílkovin je u starších osob s ohledem na zhoršené využití bílkovin doporučeno navýšit na 1,0 až 1,2 g / kg tělesné hmotnosti.(29)
Suplementace vápníkem a vitaminem D
U všech pacientů s osteoporózou nebo při vyšším riziku osteoporózy je vhodné zajistit dostatečný příjem vápníku a vitaminu D. U postmenopauzálních žen a u mužů nad 50 let je doporučený celkový příjem vápníku 1000–1200 mg denně (preferenčně fermentované mléčné výrobky a při nedostatečném příjmu umělé přípravky vápníku). Při negativní vápníkové bilanci (nízký denní příjem a/nebo snížená dostupnost vápníku) se rozvijí sekundární hyperparatyreóza a dochází k úbytku kortikální kosti. Účinnost střevní absorpce vápníku klesá s věkem a v důsledku nedostatku estrogenů a vitaminu D nebo při nadbytku kortizolu (léčbě glukokortikoidy). V případě suplementace vápníkem je vhodné, aby jednotlivá porce elementárního vápníku nepřesahovala 500 mg (saturace aktivních transportních mechanismů). Pro střevní absorpci vápníku ze suplementů je důležitá současná přítomnost stravy. Dostupnost vápníku ze suplementů ve formě uhličitanu vápenatého bude omezená při užití nalačno, zejména při achlorhydrii (nebo při léčbě inhibitory protonové pumpy). Vápník se také dostatečně nevstřebává, pokud je přijímán současně s potravinami s vyšším obsahem fosfátů, tuků, vlákniny a kyseliny fytové a šťavelové (vazba vápníku ve střevě). Vitamin D je nezbytný pro účinnou střevní absorpci vápníku a má rovněž přímé účinky na kostní a svalové buňky. S věkem významně klesá schopnost tvorby vitaminu D v kůži a zdroje vitaminu D jsou v ČR omezené (potraviny nejsou fortifikovány vitaminem D a z běžné stravy získáme maximálně 1/10 doporučené denní dávky). Nedostatek vitaminu D je definovaný při koncentraci 25-hydroxyvitaminu D (25OHD) < 50 nmol/l, resp. < 75 nmol/l (tab. 1).
Tab. 1. Prahové hladiny 25-hydroxyvitaminu D v séru a jejich vliv na muskuloskeletální systém 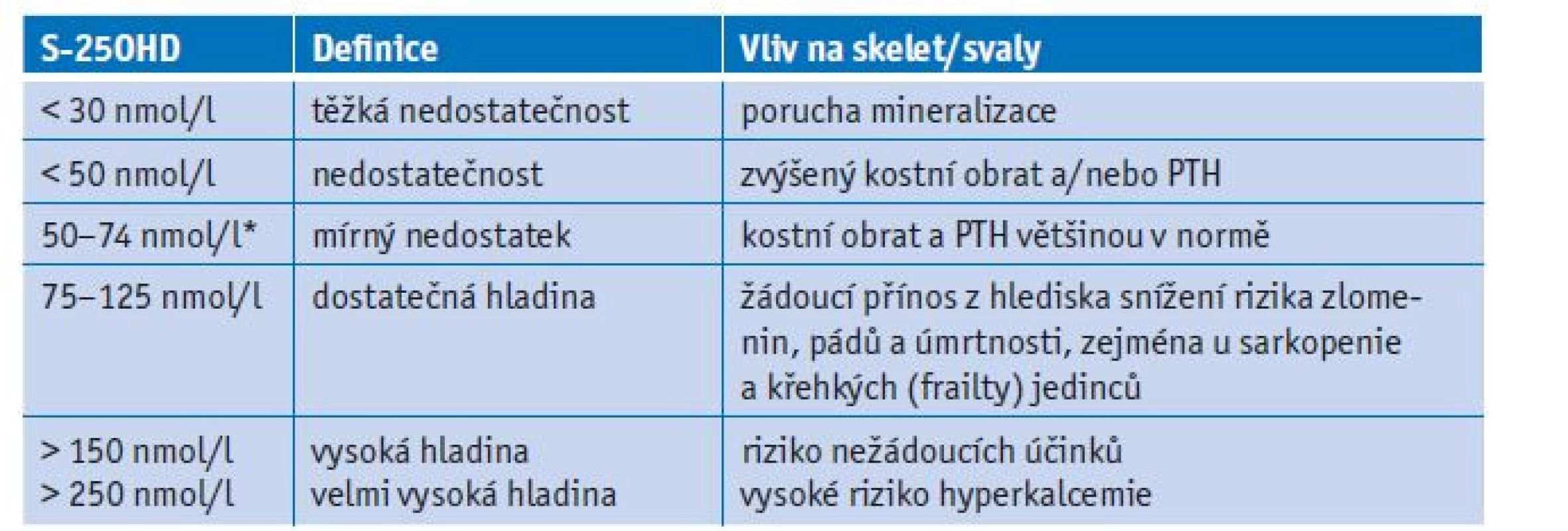
PTH – parathormon; S-25OHD – 25-hydroxyvitamin D.
*Někteří autoři doporučují prahovou hodnotu 25OHD 50 nmol/l, zatímco jiní se zaměřují na ≥ 75 nmol/l. Tato diskuse je z velké části založena na absenci standardizace testů pro 25OHD (86).Nedostatkem vitaminu D trpí zejména v zimních a jarních měsících více než 60 % osob starších 65 let. Nejnižší koncentrace 25OHD jsou dokumentovány u institucializovaných seniorů.(30) V metaanalýze 11 studií (31 000 pacientů) bylo nejnižší riziko zlomenin u pacientů s plazmatickou koncentrací 25OHD ≥ 60 nmol/l ve srovnání s těmi, kteří měli hladiny 25OHD < 30 nmol/l.(31) Přibývá důkazů, že suplementace cholekalciferolem má i další příznivé extraskeletální účinky, zejména pro funkci svalů a posturální stabilitu.(32) Nízké koncentrace 25OHD v séru (< 25 nmol/l) u osob ≥ 65 let vedou ke snížení svalové síly a zvyšují riziko pádů a zlomenin kyčle.(33,34) Byla nalezena také signifikantní korelace mezi nízkou hladinou 25OHD (< 30 nmol/l) a sníženou svalovou sílou a výkonností u dospělých ve věku ≥ 80 let.(35,36) Suplementace vitaminem D může zlepšit BMD (bone mineral density) a svalovou sílu, zejména u pacientů s hypovitaminózou D.(37) Bischoff-Ferrari a spol.(38) v metaanalýze klinických studií ukázali, že zvýšení sérových hladin 25OHD snížilo výskyt pádů u starších osob o 19 %. Nízké hladiny, ale i vysoké hladiny 25OHD v séru asociovaly se zvýšenou úmrtností (charakter tzv. U-křivky).(39,40)
Jak pro zdraví skeletu v prevenci sekundární hyperparatyreózy, tak pro snížení rizika pádů u osob ≥ 65 let věku je doporučován denní příjem cholekalciferolu v dávce 800 –1000 IU, případně 6000–7000 IU týdně.(41,42) Pro snížení rizika pádů se udává optimální hladina 25OHD v séru alespoň 75 nmol/l.(43) K dosažení této koncentrace, zejména u pacientů s prokázanou osteoporózou a/nebo sarkopenií, může být po omezenou dobu (2–3 měsíce) nezbytná suplementace až 4000 IU denně.(44) Avšak účinnost dávek pro prevenci pádů nad 1000 IU denně nebyla v randomizovaných kontrolovaných studiích prokázána. Například u pacientů se zlomeninou kyčle nebyl denní příjem 2000 IU cholekalciferolu v prevenci pádů účinnější než 800 IU denně.(45) V případě těžkého deficitu vitaminu D (< 30 nmol/l) doporučujeme užívat p.o. cholekalciferol v dávce 4000–6000 IU denně nebo 60 000 IU jedenkrát týdně po dobu 2 měsíců s následnou kontrolou 25OHD a úpravou suplementace. U pacientů s gastrointestinálními chorobami a s malabsorpcí nebo u obézních musí být optimální dávkování suplementace vápníkem a vitaminem D stanoveno individuálně a léčba musí být pečlivě monitorována (riziko hyperkalciurie a hyperkalcemie). Doporučuje se dávkovat vitamin D v denních nebo týdenních dávkách. Naproti tomu se ukázalo, že intermitentní aplikace velmi vysokých dávek vitaminu D (např. jednorázová perorální dávka 500 000 IU za rok) zvyšuje riziko pádů, zejména v prvních 3 měsících, kdy se hladina 25OHD v séru zvýšila nad 112 nmol/l. Další recentní studie ukázala, že měsíční vysoká dávka vitaminu D (60 000 IU měsíčně) zvyšuje riziko pádů ve srovnání s dávkou 24 000 IU měsíčně.(46) Suplementace vápníkem a vitaminem D by měla být zaměřena na osoby s prokázaným nedostatkem vápníku a/nebo vitaminu D nebo s jeho rizikem (např. věk ≥ 75 let, dlouhodobá imobilizace, institucionalizované a obézní osoby). Nedávná metaanalýza například zjistila, že vitamin D podávaný společně s vápníkem snižuje riziko zlomenin kyčle u institucionalizovaných osob, ale nikoli u starších lidí žijících komunitně.(47)
Nežádoucí účinky suplementace vápníkem a vitaminem D
Suplementace vitaminem D je bezpečná, ale doporučuje se opatrnost, pokud se po zahájení léčby vyskytne nevolnost, zvracení nebo nadměrná žízeň, protože tyto příznaky mohou naznačovat nediagnostikovanou primární hyperparatyreózu nebo předávkování vitaminem D. Nežádoucí účinky hyperkalcemie/ hyperkalciurie a nefrolitiáza jsou častěji spojeny s vysokou hladinou 25OHD v séru (> 125 nmol/l). Tato hodnota je udávána jako horní mez, nad kterou se zvyšuje riziko komplikací.(48) Omezení příjmu vápníku a vitaminu D je nezbytné u pacientů s rizikem hyperkalcemie a hyperkalciurie, např. při primární hyperparatyreóze, idiopatické hyperkalciurii nebo při sarkoidóze (extrarenální tvorba kalcitriolu aktivovanými makrofágy). Při chorobách ledvin, kde je porušena hydroxylace 25OHD na kalcitriol, je vhodné zvažovat užití aktivního metabolitu vitaminu D alfakalcidiolu (1α–hydroxycholekalciferol). Léčba ale vyžaduje pečlivou monitoraci kalcemie a kalciurie. U pacientů s kalcium-oxalátovou urolitiázou není vhodné snižovat příjem vápníku potravou (kalcium váže oxaláty ve střevě a snížení příjmu vápníku paradoxně zvyšuje riziko urolitiázy). V posledních letech jsou diskutovány otázky týkající se bezpečnosti užívání doplňkového vápníku s vitaminem D a bez něj kvůli možnému zvýšení kardiovaskulárního rizika. Byť v současné době neexistuje žádný nepochybný důkaz, že doplňky vápníku zvyšují kardiovaskulární riziko, je vhodné napravit nedostatek vápníku přednostně zvýšením jeho příjmu ve stravě (doporučovány jsou zejména fermentované mléčné výrobky) a suplementaci umělými přípravky vápníku využít až v případě intolerance mléčných výrobků.(49)
Strategie prevence pádů u starších jedinců
Starší lidé jsou více náchylní k pádům.(50) K dalšímu zvýšení rizika pádů dochází po velkých zlomeninách kvůli kombinaci ztráty svalové hmoty a síly během období rekonvalescence a poruchy rovnováhy.(51) Bez nápravných opatření může riziko pádů po zlomenině přetrvávat až 10 let.(52) Mezi další (vnitřní) rizikové faktory pádů patří poruchy chůze, závratě a ortostatická hypotenze, zrakové postižení, deprese, funkční a kognitivní poruchy, nízká tělesná hmotnost, inkontinence moči, chronická muskuloskeletální bolest a věk ≥ 80 let.(53) I když řada rizikových faktorů pro pády není modifikovatelná, jako věk a komorbidity, které špatně reagují na léčbu (např. neurologický deficit, neuromuskulární a muskuloskeletální choroby), jiné jsou do určité míry modifikovatelné. Mezi modifikovatelné faktory patří úprava snížené zrakové ostrosti, snížení dávkování nebo přerušení léků, které mohou snižovat kvalitu vědomí a/ nebo rovnováhu a úprava domácího prostředí (korekce kluzkosti podlahy a rohože, zlepšení osvětlení, montáž zábradlí do koupelny ad.). Nutriční management v kombinaci s pravidelnou fyzickou aktivitou/ cvičením (zaměřený na silový trénink a rovnováhu) snižují riziko pádů. Doplňky stravy s vysokým obsahem bílkovin a vitaminu D v kombinaci s přiměřenou fyzickou aktivitou a pravidelným cvičením zlepšily svalovou sílu a pohyblivost.(54) Cvičební programy, které se zaměřují na chůzi, svalovou koordinaci a funkční úkoly, stejně jako posilovací cvičení snižují riziko pádů.(55) Zvláště účinný v prevenci pádů je trénink rovnováhy, např. tai-chi.(54) Cvičební program by se měl pravidelně opakovat nejméně jednou týdně.(56) Zatímco pozitivní účinek cvičení na svalovou sílu, rovnováhu nebo chůzi se v klinických studiích vždy neprojevil sníženým výskytem zlomenin, je vždy zřetelný pozitivní dopad cvičení na kvalitu života.(57) Ke snížení fyzické zdatnosti a křehkosti u starších dospělých přispívá i obezita. Sarkopenie v kombinaci s obezitou (tzv. sarkopenická obezita) zvyšuje riziko ztráty tělesné zdatnosti prostřednictvím více synergických efektů.(58) Intervenční strategie v boji proti sarkopenické obezitě zahrnuje redukci hmotnosti, omezení kalorií a cvičení. U starších dospělých je třeba se vyvarovat polypragmazie a medikace, která je spojena s vyšším rizikem pádů.(59)
Účinnost a bezpeč nost farmakologické léčby ve věku > 75–80 let
Účinnost dostupné farmakologické léčby osteoporózy je dobře dokumentována zejména v prevenci zlomenin obratlů a méně již u neobratlových zlomenin a zlomenin kyčle. Většina randomizovaných klinických studií byla provedena u žen po menopauze ve věku 50 až 80 let (tab. 2) a důkazy o účinnosti farmakologické léčby ve vysokém věku (80+) jsou zejména z následných subanalýz těchto studií.(60)
Tab. 2. Účinnost léčby (snížení rizika zlomenin podle rtg) u postmenopauzálních žen s osteoporózou 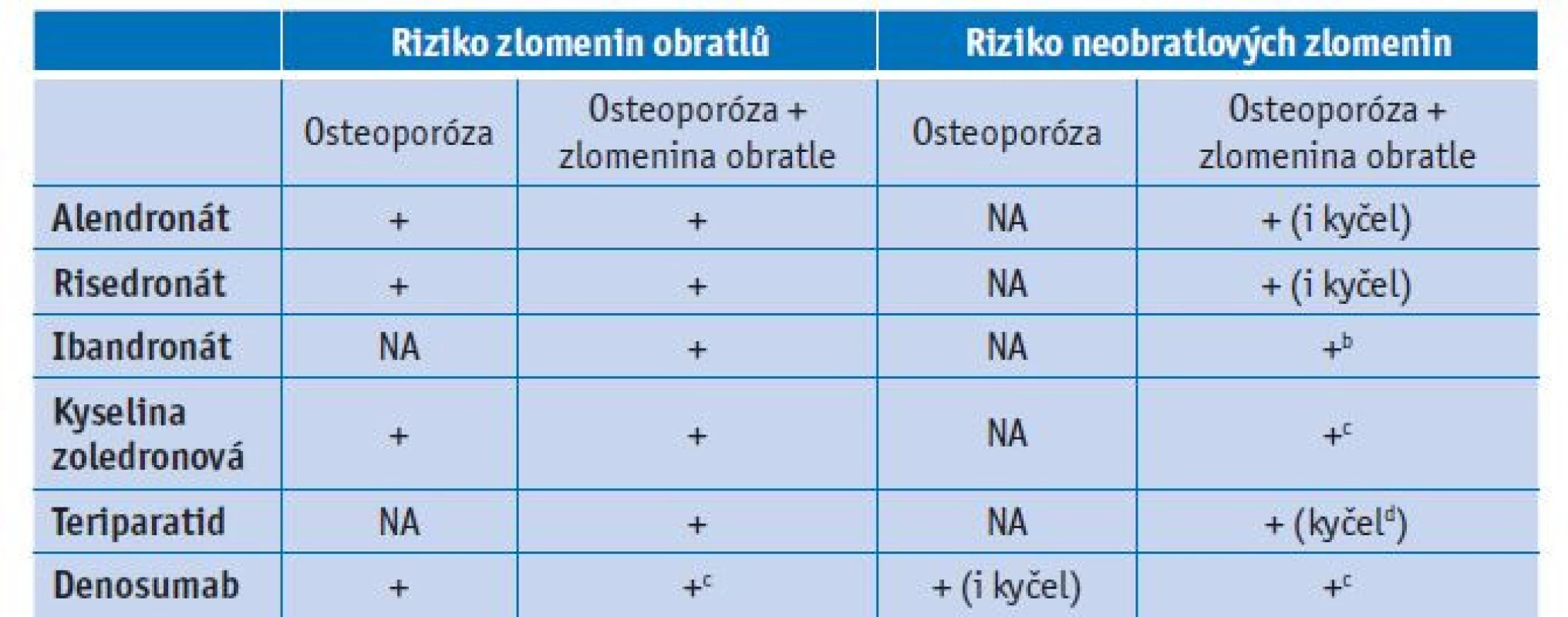
NA – není dostupná evidence; b – podskupina pacientů (subanalýza studie); c – smíšená skupina (se zlomeninou obratle i bez zlomeniny obratle); d – metaanalýza 4 observačních studií; RCT – randomizované klinické studie Léčba by měla být bezpečná i u starších křehkých osob s komorbiditami a se zvýšeným rizikem nežádoucích účinků léčby. Hlavní problémy týkající se medikamentózní terapie ve vyšším věku zahrnují mj. sníženou střevní absorpci (tedy nižší biologickou dostupnost perorální léčby), pomalejší rychlost metabolismu, sníženou funkci ledvin, vyšší citlivost tkání (např. kůže) a množství dalších léků, které pacient dlouhodobě užívá (více interakcí pro metabolismus léků stejně jako účinky na cílové orgány). V následujících částech jsou vyhodnoceny dostupné důkazy o účinnosti a bezpečnosti antiosteoporotické léčby osteoporózy u osob ve vysokém věku (nad 75–80 let). Farmakologická léčba osteoporózy, která je dostupná v ČR pro prevenci a léčbu osteoporotických zlomenin, zahrnuje jak osteoanabolicky působící teriparatid, tak antiosteoresorpční léčbu aminobisfosfonáty (alendronát, risedronát, ibandronát a kyselinu zoledronovou) a biologickou léčbu denosumabem (monoklonální protilátka proti RANKL). Z nových léků s osteoanabolickým účinkem bude dostupný romosozumab (monoklonální protilátka proti sklerostinu), která zvyšuje tvorbu kosti a zároveň inhibuje kostní resorpci. Optimální léčba osteoporózy je sekvenční léčba, která je neúčinnější ve sledu osteoanabolicky působící lék, např. teriparatid nebo romosozumab, a následná antiosteoresorpční léčba.
Alendronát
Post hoc analýza starších žen zařazených do pivotní studie FIT (Fracture Intervention Trial) ukázala podobnou účinnost ve snížení rizika zlomenin alendronátem u žen ve věku ≥ 75 let ve srovnání s mladšími ženami (aby se zabránilo 1 zlomenině obratle, musí být léčeno 8 žen ve věku ≥ 75 let [75–82 let] ve srovnání s 9 mladšími ženami).(61,62) Do retrospektivní případové studie z národní švédské databáze zlomenin (Fractures and Fall Injuries in the Elderly Cohort, FRAILCO) byli zařazeni muži i ženy ve věku ≥ 80 let (průměrný věk 85,7 roku) s prevalentní zlomeninou, 1961 pacientů užívalo alendronát v průměru 3,5 roku a kontrolní neléčená skupina zahrnovala 7844 osob.(63) Během průměrné doby sledování 18 měsíců byl ve skupině léčené alendronátem zjištěn významně nižší výskyt zlomenin kyčle (HR = 0,62, 95% CI 0,49–0,79) i hlavních osteoporotických zlomenin (HR = 0,68, 95% CI 0,56–0,83). Léčba alendronátem byla navíc spojena se snížením mortality (HR = 0,88, 95% CI 0,82–0,95) i po adjustaci na komorbidity. Tyto výsledky ukazují pokračující účinnost alendronátu při snižování rizika zlomenin ve vyšším věku a srovnatelnou bezpečnost léčby.
Risedronát
Randomizovaná pivotní studie s risedronátem (Hip Intervention Program) zahrnovala rameno, kde byly ženy ve věku ≥ 80 let s alespoň jedním neskeletálním rizikovým faktorem pro zlomeninu kyčle (např. obtížné postavení ze sedu a obtížná chůze nebo zranění související s pádem v předchozím roce). Ve studii byly ženy randomizovány k léčbě risedronátem v dávce 2,5 mg (n = 1281) a 5 mg denně (n = 1292) nebo placebem (n = 1313) po dobu 3 let.(64) Prevalentní zlomeninu obratle mělo ~ 45 % žen a 45 % mělo deficit vitaminu D 25OHD < 40 nmol/l. Léčba risedronátem (obě skupiny) v této věkové skupině nevedla k významnému snížení výskytu zlomenin kyčle (RR = 0,8, 95% CI 0,6 – 1,2). U většiny léčených žen ale nebyla známa počáteční hodnota BMD a pouze u 16 % žen byla prokázána osteoporóza. Následná post hoc analýza u žen ve věku 70 až 100 let s prokázanou osteoporózou (podle kritérií BMD a přítomnosti alespoň jedné zlomeniny obratle) ukázala významné snížení výskytu zlomenin kyčle (RR = 0,54, 95% CI 0,32–0,91).(65) Souhrnná analýza ze studie HIP a studií VERT (Vertebral Efficacy with Risedronate Therapy – mezinárodní a americké rameno) hodnotila riziko zlomenin u žen ≥ 80 let (průměrný věk 83 let) s osteoporózou (průměrné T-skóre -3) užívajících denně 5 mg risedronátu nebo placebo.(66) Většina žen (84 %) měla prevalentní zlomeninu obratle. Riziko zlomenin obratlů bylo významně sníženo již po roce léčby o 81 % (HR = 0,19; 95% CI = 0,09–0,40) a po 3 letech léčby o 44 % (HR = 0,56; 95% CI = 0,39–0,81). U neobratlových zlomenin se incidence významně nelišila ve skupině léčené a ve skupině s placebem.(64,66) Tento rozdíl v přínosu léčby v prevenci obratlových vs. neobratlových zlomenin u starších osob lze vysvětlit skutečností, že risedronát příznivě ovlivňuje BMD, což je v souladu s významným snížením rizika zlomenin obratlů. Léčba risedronátem ale nemá vliv na neskeletální rizikové faktory zlomenin, jako jsou poruchy chůze a riziko pádů. Tyto neskeletální faktory jsou zvláště důležité v patogenezi neobratlových zlomenin, jako jsou zlomeniny kyčle. Naproti tomu obratlové zlomeniny jsou často atraumatické, a proto jsou těmito neskeletálními rizikovými faktory méně ovlivněny. Dalším vysvětlením tohoto rozporu mezi starší a mladší populací v prevenci nevertebrálních zlomenin může být nedostatečný počet zlomenin, a tudíž malá statistická síla provedených analýz.
Kyselina zoledronová
Pivotní studie HORIZON-PFT (Health Outcome and Reduced Incidence with Zoledronic Acid One Yearly) prokázala, že kyselina zoledronová je účinnou léčbou u postmenopauzálních osteoporotických žen (průměrný věk 73 let), přičemž po 3 letech léčby došlo k významnému snížení rizika obratlových i neobratlových zlomenin včetně zlomenin kyčle.(67) V následné studii HORIZON-Recurent Fracture Trial (HORIZON-RFT) u pacientů po zlomenině kyčle (průměrný věk 74,4 roku) léčba kyselinou zoledronovou významně snížila riziko nových obratlových i neobratlových zlomenin.(68) Následná post hoc analýza studií HORIZON-PFT a HORIZON-RFT(69) byla zaměřena na starší postmenopauzální ženy ve věku ≥ 75 let (průměrný věk 79,4 roku) s osteoporózou (T-skóre ≤ − 2,5 v krčku stehenní kosti nebo ≥ 1 prevalentní zlomeninou obratle nebo kyčle). Po 3 letech byla incidence zlomenin obratlů a neobratlových zlomenin významně nižší v léčené skupině ve srovnání s placebem (HR = 0,34; 95% CI = 0,21–0,55; HR = 0,73; 95% CI = 0,6–0,9). Tento přínos byl srovnatelný se snížením RR u mladších žen (< 75 let) ve studiích HORIZON-PFT a HORIZON-RFT, což řadí kyselinu zoledronovou mezi účinné léčebné prostředky pro prevenci zlomenin obratlů i neobratlových zlomenin i u žen starších 75 let. Také incidence zlomenin kyčle byla u starších žen (≥ 75 let) nižší u léčených, ale nebylo dosaženo statistické významnosti (HR = 0,82; 95% CI = 0,56–1,2). Přes tento nedostatek přímých důkazů o účinnosti kyseliny zoledronové na zlomeniny kyčle v populaci (≥ 75 let), zejména u mužů, lze snížení rizika zlomenin extrapolovat ze studií HORIZON, které zahrnovaly i ženy v této věkové skupině.(68–70) Je možné, že u starších žen je větší vliv neskeletálních rizikových faktorů zlomenin nebo že počet léčených byl příliš malý z hlediska průkazu statistické významnosti. Bylo dokumentováno snížení úmrtnosti v populaci 1688 žen, které neprodělaly zlomeniny (HR = 0,51, 95% CI 0,30–0,87). U starších žen s osteopenií (průměrný věk 71 let) vedla infuze kyseliny zoledronové každých 18 měsíců k významnému snížení celkového výskytu karcinomů za 6 let (RR = 0,69, 95% CI 0,53–0,90), což bylo pozorováno nejvíce u karcinomu prsu (RR = 0,59, 95% CI 0,35–0,98)(71,72) Preklinické studie naznačují, že extraskeletální účinky kyseliny zoledronové mohou být způsobeny jejím působením na signální dráhy zodpovědné za buněčné stárnutí (podobně působí tzv. senolytika), je však nezbytný další výzkum.(73)
Denosumab
Analýza podskupiny žen ve věku ≥ 75 let léčených denosumabem po dobu 3 let ve studii FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months) prokázala snížení rizika zlomenin obratlů (RR = 0,36, 95% CI 0,25 – 0,53), ale nikoliv neobratlových zlomenin (RR = 0,84, 95% CI 0,63–1,12).(74,75) Následná analýza žen ve věku 75 až 90 let (průměrný věk 78,2 roku) prokázala významné snížení incidence zlomenin kyčle (snížení absolutního rizika o 1,4 %, p < 0,01).(76) Denosumab je tedy účinnou léčbou v prevenci zlomenin obratlů a kyčle u starších osob. Tento výsledek byl v rozporu s bisfosfonáty, kde nebylo prokázáno žádné významné snížení rizika zlomenin kyčle u risedronátu a kyseliny zoledronové u starších osob, ačkoliv jak již bylo zmíněno, lze to vysvětlit nedostatkem statistické síly v těchto podskupinových analýzách.(76) Nicméně je lákavé spekulovat, že toto pozorování redukce zlomeniny kyčle při léčbě denosumabem je způsobeno jeho výraznými účinky na kortikální kost na rozdíl od BP. Kortikální porozita je skutečně jedním z hlavních determinantů rizika nevertebrálních zlomenin, včetně rizika zlomeniny kyčle. Navzdory omezeným údajům o účinnosti denosumabu proti zlomeninám v nejstarší věkové skupině přibývá důkazů o jeho potenciálních příznivých extraskeletálních účincích na pády nebo sarkopenii, i když se může jednat o nepřímé účinky. Pilotní studie (proof-of-concept), která hodnotila tělesné složení pomocí (DXA) a svalovou sílu u 18 postmenopauzálních žen (průměrný věk 65 let) léčených denosumabem a 20 žen léčených alendronátem nebo kyselinou zoledronovou, dokumentovala významné zvýšení svalové síly a nárůst beztukové tělesné hmoty (lean mass) u žen léčených denosumabem.(77) Ve srovnání se samotnou kyselinou zoledronovou u 79 starších dospělých žijících komunitně (průměrný věk 80 let) bylo u léčených denosumabem zjištěno zlepšení rovnováhy, zatímco zlepšení v testech zdatnosti bylo srovnatelné s kyselinou zoledronovou.(78) Analýza 5 randomizovaných klinických studií, které porovnávaly denosumab s placebem (průměrný věk 71,8 roku), dokumentovala malé, ale významné snížení četnosti pádů u obou pohlaví (HR = 0,79; 95% CI 0,66–0,93); větší snížení bylo zjištěno u jedinců mladších 75 let.(79)
Teriparatid (PTH 1-34)
Pivotní studie FPT (Fracture Prevention Trial) prokázala, že léčba teriparatidem (N-terminální část molekuly PTH, PTH 1-34 20 μg 1x denně s.c.) u postmenopauzálních žen s předchozí zlomeninou obratle (průměrný věk 69,5 roku) významně snižuje riziko obratlových i neobratlových zlomenin.(80) Subanalýza žen ve věku ≥ 75 let (rozmezí 75 až 86 let) prokázala významné snížení výskytu zlomenin obratlů (RR = 0,35), ale nikoliv neobratlových zlomenin (RR = 0,75).(81) Léčba vedla k významnému nárůstu BMD v bederní páteři (+ 9 %) i v krčku femuru (+ 2 %) oproti placebu. Vliv teriparatidu na BMD a zlomeniny nezávisel na věku. Nesignifikantní vliv na riziko nevertebrálních fraktur u velmi starých osob je vysvětlován malým počtem nevertebrálních fraktur ve starší podskupině. Subanalýza zahrnovala jen 23 žen léčených teriparatidem a 25 žen ve skupině s placebem ve věku ≥ 80 let.(82) Snížení rizika zlomenin u osob ve věku ≥ 75 let bylo dokumentováno dále v observační studii EFOS (European Forsteo Observational Study). V této studii bylo zjištěno významné snížení intenzity bolesti zad a zlepšení pohyblivosti a denních aktivit u léčených teriparatidem.(83) V retrospektivní studii sledující 316 mužů a žen léčených teriparatidem ve věku ≥ 80 let s osteoporózou (rozmezí 80 až 97 let) asi polovina (n = 154) přerušila léčbu pro nedostatek motivace (28 %), přestěhování (18 %), jiná onemocnění (18 %), úmrtí nesouvisející s léčbou teriparatidem (17 %) nebo nežádoucí účinky (nejčastěji nevolnost, 12 %).(84) Ve věkové skupině ≥ 80 let ti, kteří dokončili 2 roky terapie, měli významný nárůst BMD v bederní páteři (+14 %) a v krčku stehenní kosti (+4,5 %). Nebyly zaznamenány žádné závažné nežádoucí účinky, které by se lišily od placebové skupiny. Ženy léčené anabolickými látkami vyžadují antiresorpční léčbu, aby se zachoval terapeutický přínos po ukončení anabolické terapie. Sekvenční anabolická terapie následovaná antiresorpční léčbou může pomoci dosáhnout terapeutického cíle zvýšení a udržení BMD, a tím snížit riziko budoucích zlomenin u žen s osteoporózou s vysokým rizikem zlomeniny.
Bezpečnost farmakologické léčby
Velké pivotní studie i následná klinická praxe ukázaly, že léčba osteoporózy je obecně dobře snášena, s nežádoucími účinky, které bývají mírné až středně závažné. V populaci ve věku nad 80 let jsou však údaje omezené a může se uplatňovat řada nepříznivých faktorů, jako jsou snížená střevní absorpce vápníku, pomalejší metabolismus a vylučování léků, doprovodné komorbidity, polypragmazie a nízká compliance a adherence k léčbě.
Aminobisfosfonáty (BP)
Léčba p.o. BP může způsobit dyspepsii, nauzeu, zvracení a bolesti břicha, zejména v epigastriu v důsledku lokální iritace nebo ulcerace jícnu a žaludku. Riziko je zejména u pacientů s dysfagií, při onemocnění jícnu a gastroduodena. Riziko mohou zvyšovat současně podávaná nesteroidní antirevmatika. Léčba p.o. BP není vhodná u pacientů s anamnézou krvácení do GIT v posledním roce a při zvýšeném riziku tohoto krvácení, např. při antikoagulační léčbě. Perorální BP (zejména risedronát) byly v klinických studiích velmi dobře tolerovány i ve vysokém věku, a dokonce i u osob s vysokým rizikem gastrointestinálních příhod a nebyly spojeny se zvýšenou frekvencí těchto nežádoucích účinků ve srovnání s placebem. V klinické praxi ale může být léčba perorálními BP obtížná vzhledem k nutnosti dodržení přísných pokynů pro příjem (např. zůstat ve vzpřímené poloze po dobu alespoň 30 minut po užití léku) u osob s kognitivním nebo fyzickým deficitem. Navíc perorální léčba osteoporózy (spolu se suplementací vápníkem a vitaminem D) zvyšuje „tabletovou zátěž“, což může vést k nižší compliance.
Intravenózní BP, jako je kyselina zoledronová, jsou vhodnou alternativou u osob, které netolerují perorální BP nebo mají nízkou compliance a adherenci k této léčbě. U i.v. forem BP vzniká, zejména po 1. aplikaci, tzv. reakce akutní fáze (horečka, bolest hlavy, nauzea, bolesti kostí, myalgie a artralgie) s ústupem do 1–3 dnů. Před aplikací BP je vždy nezbytné upravit případnou hypokalcemii, hypomagnezemii nebo hypovitaminózu D (vyloučit malabsorpci nebo hypoparatyreózu) a po celou dobu léčby BP zajistit dostatečný denní příjem vápníku a vitaminu D. Ojediněle byly hlášeny případy poškození funkce ledvin a akutní selhání ledvin po podání kys. zoledronové. Opatrnost je nezbytná především u pacientů s již existující renální nedostatečností a při současné léčbě diuretiky nebo nefrotoxickými léky. Podávání kys. zoledronové se nedoporučuje u pacientů se závažným poškozením funkce ledvin (clearance kreatininu < 35 ml/min). Před každou infuzí kyseliny zoledronové by měl být pacient dostatečně hydratován. Podání infuze kys. zoledronové by mělo trvat nejméně 15 minut.
Denosumab
Obecně byl denosumab ve studii FREEDOM dobře tolerován. V post hoc analýze u žen ve věku ≥ 75 let nebyly zaznamenány žádné významné rozdíly v bezpečnostním profilu mezi subjekty léčenými placebem a denosumabem. Incidence nežádoucích účinků byla podobná jako u celkové populace FREEDOM. Post hoc analýza neprokázala významný nárůst nežádoucích příhod u žen ve věku ≥ 75 let, i když v pivotní studii byl zaznamenán vyšší výskyt ekzémů a celulitidy vyžadující hospitalizaci (0,3 % oproti < 0,1 %). Denosumab není vylučován ledvinami, a proto úprava dávkování při renální insuficienci není nutná. Pacienti ale mohou být ohroženi hypokalcemií (k největšímu poklesu kalcemie dochází přibližně 7–10 dní po podání denosumabu), proto je před léčbou nezbytné vyloučit hypokalcemii, hypomagnezemii a nedostatek vitaminu D a během léčby trvale zajišťovat dostatečný denní příjem vápníku a vitaminu D. Na rozdíl od BP, jejichž účinky na kost přetrvávají i řadu let po vysazení, je působení denosumabu plně reverzibilní. Přerušení léčby denosumabem ale vede k rychlému vzestupu kostní resorpce (během 3–6 měsíců po přerušení léčby) s významnou ztrátou BMD (klesá během 12 měsíců) a s nárůstem rizika vícečetných zlomenin obratlů, zejména u pacientů s prevalentními zlomeninami obratlů. Pacient by měl být o tomto riziku informován již při zahájení léčby. Po přerušení léčby denosumabem je proto nezbytné navázat léčbou BP.(85)
Vzácné nežádoucí účinky antiresorpční léčby
Mezi velmi vzácné nežádoucí účinky patří riziko osteonekrózy čelisti (ONJ) a atypické zlomeniny. Riziko ONJ je při léčbě BP nebo denosumabem u pacientů léčených pro osteoporózu jen hraničně zvýšené oproti incidenci ONJ v běžné populaci. Před zahájením léčby BP je doporučeno preventivní odborné ošetření chrupu (sanace infekčních ložisek), pravidelné preventivní kontroly u stomatologa a dodržování zásad dentální hygieny po celou dobu léčby. Vzhledem k možnému negativnímu vlivu dlouhodobé léčby BP na kvalitu kosti (riziko vzniku atypických zlomenin) bylo navrženo dočasné přerušení nebo změna dlouhodobé léčby BP (drug holiday). Toto doporučení ale nebylo zkoumáno u osob starších 80 let. U mladších osob by léčba p.o. BP měla trvat kontinuálně nejméně 3–5 let. Doporučujeme léčbu BP dočasně přerušit u pacientů, kteří užívali alendronát po dobu pěti let nebo kteří dostávali kyselinu zoledronovou jednou ročně po dobu tří let, pokud je jejich BMD stabilní a neměli po dobu léčby nízkotraumatické zlomeniny. Delší dobu léčby zvažujeme u pacientů s vysokým rizikem zlomenin a při užití BP s kratším poločasem v kosti (risedronát). Délka přerušení léčby je individuální (zvažujeme riziko zlomenin) a vyžaduje monitoraci k ověření trvání účinku léčby (BMD, markery kostní remodelace zpravidla po 1–2 letech). U pacientů s těžkou osteoporózou a s vysokým rizikem zlomenin je vhodné zvažovat sekvenční léčbu s teriparatidem.
Teriparatid
V post hoc analýzách pivotní studie u žen ve věku ≥ 75 let nedošlo k žádnému nárůstu nežádoucích účinků u žen léčených teriparatidem ve srovnání s placebem. Častěji byl hlášen pouze průjem, zatímco katarakta, pruritus a úbytek hmotnosti byly hlášeny méně často u osob ≥ 75 let ve srovnání s mladší věkovou skupinou. V klinické praxi je hlavní nevýhodou teriparatidu každodenní subkutánní podávání, které může být pro starší pacienty zátěží. Monitorování kalcemie nebo kalciurie není vyžadováno, opatrnost je ale nutná u pacientů s urolitiázou. Léčba je kontraindikována u dětí a dospívajících, dále při hyperparatyreóze nebo hyperkalcemii, u primárních tumorů kostí, myelomu nebo při metastatickém postižení skeletu a u pacientů s vyšším rizikem osteosarkomu, tedy u Pagetovy kostní choroby, a u pacientů, kteří prodělali léčebnou radiaci skeletu.
Závěr
Osteoporotické zlomeniny ve vysokém věku, zvláště u nejstarší věkové skupiny ≥ 80 let, vytváří významnou zdravotní, sociální a ekonomickou zátěž. Dopad zlomenin na život pacientů je obrovský a často předznamenává přechod k plné závislosti. Skutečnost, že mnoho starších lidí po zlomeninách a s vysokým rizikem následných zlomenin není léčeno, je alarmující. Dostupné údaje z klinických studií i z klinické praxe ukazují, že účinnost a bezpečnost farmakologické léčby je podobná jako u mladších osob. V klinické praxi je ale nezbytné zvažovat specifické problémy, jako jsou komorbidity, polypragmazie, nonadherence a intolerance, které mohou ovlivnit volbu terapie. Příjem perorálních BP je spojen s dobře známými gastrointestinálními nežádoucími příznaky. Navíc adherence k perorálním BP je nízká. Tyto faktory činí z parenterální léčby kyselinou zoledronovou atraktivní volbu v léčbě osteoporózy, zejména u starších a křehkých pacientů. Z hlediska účinnosti a bezpečnosti je vhodnou volbou u pacientů i biologická léčba denosumabem, která na rozdíl od BP neovlivňuje negativně renální funkce. Hlavním rizikem této léčby je ale rychlá ztráta kostní hmoty a vícečetné zlomeniny obratlů spojené s vynechanou dávkou nebo přerušením léčby. Pro pacienty s těžkou osteoporózou a velmi vysokým rizikem zlomenin (po recentní zlomenině obratle nebo kyčle) je optimální sekvenční léčba, která je nejúčinnější ve sledu osteoanabolicky působící lék (teriparatid) a následná antiosteoresorpční léčba. Pro plnou účinnost farmakologické léčby je nezbytné zajistit další opatření, jako je adekvátní nutrice, zejména dostatek kvalitních bílkovin, vápníku a vitaminu D. Úspěch léčby závisí v neposlední řadě na dobré dlouhodobé spolupráci mezi lékařem a pacientem.
doc. MUDr. Vít Zikán, Ph.D.
Dlouhodobě se zabývá diagnostikou a léčbou osteoporózy a dalších metabolických onemocnění skeletu. Působí jako docent vnitřního lékařství na 1. LF UK v Praze a pracuje na 3. interní klinice VFN jako vedoucí lékař Osteocentra. Je členem výboru Společnosti pro metabolická onemocnění skeletu ČLS JEP a členem redakční rady časopisu Clinical Osteology. Pravidelně přednáší na odborných akcích doma i v zahraničí a publikuje v odborném písemnictví (je autorem nebo spoluautorem více než 200 článků a odborných sdělení, z toho 45 v časopisech s uváděným IF). Podpořeno MZ ČR – RVO VFN64165 a programem COOPERATIO, vědní oblast „Metabolic Diseases“.
Korespondenční adresa:
doc. MUDr. Vít Zikán, Ph.D.
Osteocentrum, 3. interní klinika
1. LF UK a VFN Praha
U Nemocnice 1, 128 00 Praha 2
e-mail: vit.zikan@vfn.cz
Zdroje
1. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. Osteoporosis prevention, diagnosis, and therapy. JAMA 2001; 285 : 785–795.
2. Khosla S. Pathogenesis of age-related bone loss in humans. J Gerontol A Biol Sci Med Sci 2013; 68(10): 1226–1235.
3. Bliuc D, Nguyen ND, Milch VE, et al. Mortality risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. JAMA 2009; 301 : 513–521.
4. Hernlund E, Svedbom A, Ivergård M, et al. Osteoporosis in the European Union: medical management, epidemiology and economic burden. A report prepared in collaboration with the International Osteoporosis Foundation (IOF) and the European Federation of Pharmaceutical Industry Associations (EFPIA). Arch Osteoporos 2013; 8(1): 136.
5. Gullberg B, Johnell O, Kanis J. World-wide projections for hip fracture. Osteoporos Int 1997; 7 : 407–413.
6. Mitchell WK, Williams J, Atherton P, et al. Sarcopenia, dynapenia, and the impact of advancing age on human skeletal muscle size and strength; a quantitative review. Front Physiol 2012; 3 : 260.
7. Kirk B, Miller S, Zanker J, Duque G. A clinical guide to the pathophysiology, diagnosis and treatment of osteosarcopenia. Maturitas 2020; 140 : 27–33.
8. Amin S, Achenbach SJ, Atkinson EJ, et al. Trends in fracture incidence: a population-based study over 20 years. J Bone Miner Res 2014; 29 : 581–589.
9. Ström O, Borgström F, Kanis JA, et al. Osteoporosis: burden, health care provision and opportunities in the EU. Arch Osteoporos 2011; 6 : 59–155.
10. Chevalley T, Guilley E, Herrmann FR, et al. Incidence of hip fracture over a 10-year period (1991 – 2000): reversal of a secular trend. Bone 2007; 40 : 1284–1289.
11. Gielen E, Verschueren S, O’Neill TW, et al. Musculoskeletal frailty: a geriatric syndrome at the core of fracture occurrence in older age. Calcif Tissue Int 2012; 91(3): 161–177.
12. International Osteoporosis Foundation [webpage on the Internet]. Facts and statistics. Available from: https: //www.iofbonehealth. org/facts-statistics. [accessed December 1, 2016].
13. Kaufman JM. Management of osteoporosis in older men. Aging Clin Exp Res. 2021; 33(6): 1439 – 1452.
14. Haentjens P, Magaziner J, Colon - -Emeric CS, et al. Meta-analysis: excess mortality after hip fracture among older women and men. Ann Intern Med 2010; 152(6): 380–390.
15. Gielen E, Vanderschueren D, Callewaert F, Boonen S. Osteoporosis in men. Best Prac Res Clin Endocrinol Metab 2011; 25(2): 321–335.
16. Feldstein A, Elmer PJ, Orwoll E, et al. Bone mineral density measurement and treatment for osteoporosis in older individuals with fractures: a gap in evidence-based practice guideline implementation. Arch Intern Med 2003; 163(18): 2165–2172.
17. Hernlund E, Svedbom A, Ivergård M, et al. Osteoporosis in the European Union: medical management, epidemiology and economic burden. Arch Osteoporos 2013; 8 : 136.
18. Vandenbroucke A, Luyten FP, Flamaing J, Gielen E. Pharmacological treatment of osteoporosis in the oldest old. Clin Interv Aging 2017; 12(6): 1065–1077.
19. Broy SB. The Vertebral Fracture Cascade: Etiology and Clinical Implications. J Clin Densitom 2016; 19(1): 29–34.
20. Kanis JA, Johansson H, Odén A, et al. Characteristics of recurrent fractures. Osteoporos Int 2018; 29(8): 1747–57.
21. Kanis JA, Harvey NC, McCloskey E, et al. Algorithm for the management of patients at low, high and very high risk of osteoporotic fractures. Osteoporos Int 2020; 31(1): 1–12.
22. Kanis JA, Cooper C, Rizzoli R, Reginster J-Y. Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis (ESCEO) and the Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2019; 30(1): 3–44.
23. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019; 48(4): 601.
24. Kojima G. Frailty as a Predictor of Future Falls Among Community-Dwelling Older People: A Systematic Review and Meta-Analysis. J Am Med Dir Assoc 2015; 16(12): 1027–33.
25. Dent E, Morley JE, Cruz-Jentoft AJ, et al. Physical Frailty: ICFSR International Clinical Practice Guidelines for Identification and Management. J Nutr Health Aging 2019; 23(9): 771–87.
26. Genaro PS, Martini LA. Effect of protein intake on bone and muscle mass in the elderly. Nutr Rev 2010; 68 : 616–623.
27. Raynaud-Simon A, Revel-Delhom C, Hebuterne X. Clinical practice guidelines from the French Health High Authority: nutritional support strategy in protein-energy malnutrition in the elderly. Clin Nutr 2011; 30 : 312–319.
28. Livingstone C. Insulin-like growth factor-I (IGF-I) and clinical nutrition. Clin Sci (Lond) 2013; 125 : 265–280.
29. Mithal A, Bonjour JP, Boonen S, et al. Impact of nutrition on muscle mass, strength, and performance in older adults. Osteoporos Int 2013; 24 : 1555–1566.
30. Lips P. Vitamin D deficiency and secondary hyperparathyroidism in the elderly: consequences for bone loss and fractures and therapeutic implications. Endocr Rev 2001; 22(4): 477–501.
31. Bischoff-Ferrari HA, Willett WC, Orav EJ, et al. A pooled analysis of vitamin D dose requirements for fracture prevention. N Engl J Med 2012; 367 : 40–49.
32. Boersma D, Demontiero O, Mohtasham AZ, et al. Vitamin D status in relation to postural stability in the elderly. J Nutr Health Aging 2012; 16 : 270–275.
33. Visser M, Deeg DJ, Lips P. Low vitamin D and high parathyroid hormone levels as determinants of loss of muscle strength and muscle mass (sarcopenia): the Longitudinal Aging Study Amsterdam. J Clin Endocrinol Metab 2003; 88(12): 5766–5772.
34. Cauley JA, Lacroix AZ, Wu L, et al. Serum 25-hydroxy vitamin D concentrations and risk for hip fractures. Ann Intern Med 2008; 149(4): 242–250.
35. Aspell N, Laird E, Healy M, et al. Vitamin D deficiency is associated with impaired muscle strength and physical performance in community - dwelling older adults: findings from the English Longitudinal Study of Ageing. Clin Interv Aging 2019; 14 : 1751–1761.
36. Aspell N, Laird E, Healy M, et al. The prevalence and determinants of vitamin D status in communitydwelling older adults: results from the English Longitudinal Study of Ageing (ELSA). Nutrients 2019; 11(6): 1253.
37. Zhao JG, Zeng XT, Wang J, Liu L. Association between calcium or vitamin D supplementation and fracture incidence in community dwelling older adults: a systematic review and meta-analysis. JAMA 2017; 318(24): 2466–2482.
38. Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB, et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. BMJ 2009.
39. Gaksch M, Jorde R, Grimnes G, et al. Vitamin D and mortality: individual participant data meta-analysis of standardized 25-hydroxyvitamin D in 26916 individuals from a European consortium. PLoS One 2017; 12(2): e0170791.
40. Crowe FL, Thayakaran R, Gittoes N, et al. Non-linear associations of 25-hydroxyvitamin D concentrations with risk of cardiovascular disease and all-cause mortality: results from the health improvement network (THIN) database. J Steroid Biochem Mol Biol 2019; 195 : 105480.
41. Dawson-Hughes B, Mithal A, Bonjour JP, et al. IOF position statement: vitamin D recommendations for older adults. Osteoporos Int 2010; 21(7): 1151–1154.
42. Bouillon R, Van Schoor NM, Gielen E, et al. Optimal vitamin D status: a critical analysis on the basis of evidence-based medicine. J Clin Endocrinol Metab 2013; 98(8): E1283–E1304.
43. Lappe JM, Binkley N. Vitamin D and Sarcopenia/Falls. J Clin Densitom 2015; 18(4): 478–482.
44. American Geriatrics Society Workgroup on Vitamin D Supplementation for Older Adults. Recommendations abstracted from the American Geriatrics Society Consensus Statement on vitamin D for prevention of falls and their consequences. J Am Geriatr Soc 2014; 62(1): 147–152.
45. Bischoff-Ferrari HA, Dawson - -Hughes B, Platz A, et al. Effect of high-dosage cholecalciferol and extended physiotherapy on complications after hip fracture: a randomized controlled trial. Arch Intern Med 2010; 170(9): 813–820.
46. Bischoff-Ferrari HA, Dawson-Hughes B, Orav EJ, et al. Monthly high-dose vitamin D treatment for the prevention of functional decline: a randomized clinical trial. JAMA Intern Med 2016; 176(2): 175–183.
47. Bolland MJ, Grey A, Gamble GD, Reid IR. The effect of vitamin D supplementation on skeletal, vascular, or cancer outcomes: a trial sequential meta-analysis. Lancet Diabetes Endocrinol 2014; 2(4): 307–320.
48. Rizzoli R, Boonen S, Brandi ML, et al. Vitamin D supplementation in elderly or postmenopausal women: a 2013 update of the 2008 recommendations from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). CurrMed Res Opin 2013; 29 : 305 – 313.
49. Verbrugge F, Gielen E, Milisen K, Boonen S. Who should receive calcium and vitamin D supplementation? Age Ageing 2012; 41(5): 576–580.
50. Tom SE, Adachi JD, Anderson FA Jr, et al. Frailty and fracture, disability, and falls: a multiple country study from the global longitudinal study of osteoporosis in women. J Am Geriatr Soc 2013; 61 : 327–334.
51. Body JJ, Bergmann P, Boonen S, et al. Non-pharmacological management of osteoporosis: a consensus of the Belgian Bone Club. Osteoporos Int 2011; 22 : 2769–2788.
52. Gerdhem P, Ringsberg KA, Akesson K. The relation between previous fractures and physical performance in elderly women. Arch Phys Med Rehabil 2006; 87 : 914–917.
53. AGS/BGS/AAOS Guideline for the prevention of falls in older persons. American Geriatrics Society, British Geriatrics Society, and American Academy of Orthopaedic Surgeons Panel on Falls Prevention. J Am Geriatr Soc 2001; 49 : 664–672.
54. Robertson MC, Campbell AJ, Gardner MM, et al. Preventing injuries in older people by preventing falls: a metaanalysis of individual - level data. J Am Geriatr Soc 2002; 50 : 905–911.
55. Howe TE, Rochester L, Neil F, et al. Exercise for improving balance in older people. Cochrane Database Syst Rev 2011.
56. Sherrington C, Henschke N Why does exercise reduce falls in older people? Unrecognised contributions to motor control and cognition? Br J Sports Med 2013; 47 : 730–731.
57. Kanemaru A, Arahata K, Ohta T, et al. The efficacy of home-based muscle training for the elderly osteoporotic women: the effects of daily muscle training on quality of life (QoL). Arch Gerontol Geriatr 2010; 51 : 169–172.
58. Batsis JA, Villareal DT. Sarcopenic obesity in older adults: aetiology, epidemiology and treatment strategies. Nat Rev Endocrinol 2018; 14(9): 513–537.
59. American Geriatrics Society 2012 Beers Criteria Update Expert Panel American Geriatrics Society updated Beers Criteria for potentially inappropriate medication use in older adults. J Am Geriatr Soc 2012; 60 : 616–631.
60. Rizzoli R, Branco J, Brandi M-L, et al. Management of osteoporosis of the oldest old. Osteoporos Int 2014; 25 : 2507–2529.
61. Ensrud KE, Black DM, Palermo L, et al. Treatment with alendronate prevents fractures in women at highest risk: results from the Fracture Intervention Trial. Arch Intern Med 1997; 157(22): 2617 – 2624.
62. Black DM, Cummings SR, Karpf DB, et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group. Lancet 1996; 348(9041): 1535–1541.
63. Axelsson KF, Wallander M, Johansson H, et al. Hip fracture risk and safety with alendronate treatment in the oldest old. J Intern Med 2017; 282(6): 546–559.
64. McClung MR, Geusens P, Miller PD, et al. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. N Engl J Med 2001; 344(5): 333–340.
65. Masud T, McClung M, Geusens P. Reducing hip fracture risk with risedronate in elderly women with established osteoporosis. Clin Interv Aging 2009; 4 : 445–449.
66. Boonen S, McClung MR, Eastell R, et al. Safety and efficacy of risedronate in reducing fracture risk in osteoporotic women aged 80 and older: implications for the use of antiresorptive agents in the old and oldest old. J Am Geriatr Soc 2004; 52(11): 1832–1839.
67. Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007; 356(18): 1809–1822.
68. Lyles KW, Colon-Emeric CS, Magaziner JS, et al. Zoledronic acid in reducing clinical fracture and mortality after hip fracture. N Engl J Med 2007; 357(18): 1799 – 1809.
69. Boonen S, Black DM, Colon Emeric CS, et al. Efficacy and safety of a once yearly intravenous zoledronic acid 5 mg for fracture prevention in elderly postmenopausal women with osteoporosis aged 75 and older. J Am Geriatr Soc 2010; 58(2): 292–299.
70. Black DM, Delmas PD, Eastell R, et al. Once yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007; 356(18): 1809–1822.
71. Reid IR, Horne AM, Mihov B, et al. Effects of zoledronate on cancer, cardiac events, and mortality in osteopenic older women. J Bone Miner Res 2020; 35(1): 20–27.
72. Reid IR, Horne AM, Mihov B, et al. Fracture prevention with zoledronate in older women with osteopenia. N Engl J Med 2018; 379(25): 2407–2416.
73. Lee SH, Rigas N, Martin CE, et al. Zoledronic acid impairs oral cancer stem cells by reducing CCL3. Oncol Rep 2021; 45(1): 291–298.
74. McClung MR, Boonen S, Torring O, et al. Effect of denosumab treatment on the risk of fractures in subgroups of women with postmenopausal osteoporosis. J Bone Miner Res 2012; 27(1): 211–218.
75. Cummings SR, San Martin J, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009; 361(8): 756–765.
76. Boonen S, Adachi JD, Man Z, et al. Treatment with denosumab reduces the incidence of new vertebral and hip fractures in postmenopausal women at high risk. J Clin Endocrinol Metab 2011; 96(6): 1727–1736.
77. Bonnet N, Bourgoin L, Biver E, et al. RANKL inhibition improves muscle strength and insulin sensitivity and restores bone mass. J Clin Invest 2019; 129(8): 3214 – 3223.
78. Phu S, Bani Hassan E, Vogrin S, et al. Effect of denosumab on falls, muscle strength, and function in community dwelling older adults. J Am Geriatr Soc 2019; 67(12): 2660–2661.
79. Chotiyarnwong P, McCloskey E, Eastell R, et al. A pooled analysis of fall incidence from placebo controlled trials of denosumab. J Bone Miner Res 2020; 35(6): 1014–1021.
80. Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hor¬mone (1–34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001; 344(19): 1434–1441.
81. Boonen S, Marin F, Mellstrom D, et al. Safety and efficacy of teriparatide in elderly women with established osteoporosis: bone anabolic therapy from a geriatric perspective. J Am Geriatr Soc 2006; 54(5): 782–789.
82. Boonen S, Marin F, Mellstrom D, et al. Safety and efficacy of teriparatide in elderly women with established osteoporosis: bone anabolic therapy from a geriatric perspective. J Am Geriatr Soc 2006; 54(5): 782–789.
83. Walsh JB, Lems WF, Karras D, et al. Effectiveness of teriparatide in women over 75 years of age with severe osteoporosis: 36-month results from the European Forsteo Observational Study (EFOS). Calcif Tissue Int 2012; 90(5): 373 – 383.
84. Niimi R, Kono T, Nishihara A, et al. Usefulness of daily teriparatide treatment in elderly patients over 80 years of age. Osteoporos Int 2016; 27(5): 1869–1874.
85. Tsourdi E, Langdahl B, Cohen-Solal M, et al. Discontinuation of denosumab therapy for osteoporosis: a systematic review and position statement by ECTS. Bone 2017; 105 : 11–17.
86. Sempos CT, Binkley N. 25-hydroxyvitamin D assay standardisation and vitamin D guidelines paralysis. Public Health Nutr 2020; 23(7): 1153–64.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2022 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Trazodon pohledem praktického lékaře
-
Všechny články tohoto čísla
- Editorial
- Farmakologická léčba osteoporózy ve vysokém věku
- Programy prevence osteoporotických zlomenin v České republice
- EUROSAF – evropská prospektivní observační studie účinnosti a bezpečnosti antikoagulační léčby u geriatrických pacientů s fibrilací síní. Pilotní výsledky preskripce antikoagulační léčby u křehkých seniorů v ČR
- Vliv aerobního pohybového programu ve vodě na kvalitu života související se zdravím u seniorek
- „Střevní helmintóza“ v LDN u pacientky s morbus Parkinson
- Geriatrie a urgentní medicína – opravdu potřebujeme věkově specifické standardy?
- Zemřel docent MUDr. Jiří Neuwirth, CSc., významný internista a geriatr
- Péče poskytovaná geriatrickým pacientům na urgentním příjmu: doporučení Evropské pracovní skupiny Geriatric Emergency Medicine
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Programy prevence osteoporotických zlomenin v České republice
- Farmakologická léčba osteoporózy ve vysokém věku
- Geriatrie a urgentní medicína – opravdu potřebujeme věkově specifické standardy?
- Péče poskytovaná geriatrickým pacientům na urgentním příjmu: doporučení Evropské pracovní skupiny Geriatric Emergency Medicine
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



