-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAktivní přístup k akutně hospitalizovanému geriatrickému pacientovi jako prevence ztráty svalové hmoty a soběstačnosti
Active approach to acute hospitalised geriatric patient for preventing muscle loss and self-sufficiency
Background & aims:
Any acute disease in elderly patients often leads to the loss of muscle mass and self-sufficiency. Recovery of muscle tissue is difficult and thus an acute illness can lead to the need of other persons help. The aim of our study was to determine whether an early physiotherapy and nutritional supplementation affects the development of sarcopenia and patient´s self-sufficiency during the acute illness.Methods:
200 patients over 78 years of age, admitted to geriatric department with an acute illness were enrolled in a prospective, controlled study. Patients were randomized to the control and the intervention group. The intervention consisted of providing nutritional supplements and simultaneously an intensive rehabilitation therapy. Patients were followed for 2 years after discharge.Results:
Nutritional supplements usage led to an increased daily total energy and protein intake, while the daily intake of normal diet was not reduced. Combination of nutritional support and physiotherapy prevented the loss of muscle mass and muscle strength. Self-sufficiency in the intervention group showed a smaller decline than in the control group during the two-year follow-up period.Conclusion:
The results of our prospective randomized study have shown that early administration of nutrition supplements together with an early rehabilitation mitigate the loss of muscle mass and muscle strength in acutely admitted older patients and thus prolongs the period of self-sufficiency.KEYWORDS:
geriatric patient – acute illness – early nutritional support – early rehabilitation – self-sufficiency – muscle mass
Autoři: Z. Dědková; P. Hegerová; B. Jurašková; L. Sobotka
Vyšlo v časopise: Geriatrie a Gerontologie 2017, 6, č. 2: 69-74
Kategorie: Původní práce/studie
Souhrn
Úvod a cíle:
Akutní onemocnění seniorů vede často ke ztrátě svalové hmoty a soběstačnosti. Obnova svalové tkáně je velice obtížná, a tak může proběhlý akutní stav znamenat nutnost dopomoci druhé osoby. Cílem studie bylo zjistit, zda aktivní přístup založený na časné rehabilitaci a nutriční podpoře mohou ovlivnit vývoj sarkopenie a soběstačnosti pacienta během akutního onemocnění.Metodika:
200 pacientů starších 78 let, přijatých k hospitalizaci s akutním onemocněním na geriatrické oddělení, bylo zařazeno do prospektivní randomizované kontrolované studie. Pacienti byli randomizováni do kontrolní a intervenční skupiny. Intervence spočívala v podávání doplňků stravy (600 kcal, 20 g bílkovin denně) s intenzivní rehabilitací. Pacienti byli sledováni 2 roky od propuštění.Výsledky:
Podávání nutričních doplňků vedlo ke zvýšenému dennímu příjmu energie a proteinů, zatímco denní příjem běžné stravy nebyl ovlivněn. Kombinace nutriční podpory a rehabilitace zabránila ztrátě svalové hmoty i svalové síly. Soběstačnost klesala během celého dvouletého sledování u obou skupin pacientů, avšak u pacientů v intervenční skupině došlo k menšímu poklesu soběstačnosti než v kontrolní skupině.Závěr:
Výsledky studie ukázaly, že správně vedená a včasná nutriční a rehabilitační intervence u gerontologického pacienta v době akutního onemocnění zmírní ztrátu svalové hmoty a svalové síly, a tím prodlouží dobu soběstačnosti a nezávislosti seniora.Klíčová slova:
geriatrický pacient – akutní onemocnění – časná nutriční podpora – časná rehabilitace – soběstačnost – svalová hmotaÚvod
Ztrátu svalové hmoty a její funkčnosti je třeba považovat za významný problém veřejného zdravotnictví. Existují práce, které se zabývají ekonomickým dopadem sarkopenie a dokládají, že náklady vzniklé v důsledku sarkopenie představují přibližně 1,5 % celkových výdajů na zdravotní péči(1). Tyto údaje jsou významné ve vztahu ke stárnutí naší populace a nárůstu počtu seniorů. Správná výživa a současná tělesná aktivita jsou jedinými možnostmi, jak zabránit rozvoji a případně akceleraci sarkopenie v průběhu akutního onemocnění a zachovat dostatečné množství svaloviny nezbytné pro překonání akutního stavu a zlepšení následující prognózy geriatrického pacienta.
Akutní onemocnění je pro organismus stresový stav, kdy dochází k utilizaci všech tělesných zásob energie, zejména jsou však postiženy bílkovinné zásoby organismu. Ty jsou reprezentovány především kosterní svalovinou, neboť celkové množství bílkovin je v kosterní svalovině největší. Stresový metabolismus je tedy asociovaný s akcelerovanou ztrátou svalové hmoty, která je prohloubena sníženým energetickým a proteinovým příjmem a sníženou fyzickou aktivitou během akutního onemocnění. Ztráta svalové hmoty u gerontologických pacientů se projeví zhoršením až ztrátou soběstačnosti, což často vede k nutnosti institucionalizace pacienta. Zvyšují se tak náklady na následnou péčí(2).
Byla provedena řada studií s podáváním sippingu během akutního onemocnění v průběhu hospitalizace, v nichž nutriční suplementy přinášejí starším nemocným výrazný efekt. Ve švýcarské studii autoři prokázali, že pacienti v nutričním riziku profitují z podávání sippingu i během krátké hospitalizace, což se projevilo na nutričním stavu, kvalitě života, výskytu komplikací a počtu následných rehospitalizací(3).
Ve studii zaměřené na sledování inaktivity, která provází akutní onemocnění u hospitalizovaných pacientů, bylo sledováno 12 zdravých starších středně aktivních jedinců (průměrný věk 67 let), kteří zůstali nepřetržitě 10 dní na lůžku vyjma osobní hygieny. Byla prokázána výrazná ztráta kosterní svaloviny, zvláště na dolních končetinách. U účastníků došlo za 10 dní k větší ztrátě beztukové tkáně než u mladých jedinců za 28 dní(4), zatímco pokles proteosyntézy a svalové síly byly podobné jako u mladších účastníků za 14 dní(5). Ze studie vyplývá, že klid na lůžku kombinovaný s fyzickým stresem v průběhu hospitalizace může u starších hospitalizovaných pacientů skončit výraznější ztrátou svalové hmoty a funkce(6).
Podvýživa v populaci starších jedinců často nepříznivě ovlivňuje reakci na akutní onemocnění. Přitom je podvýživa běžný stav u starších pacientů žijících v zařízeních pro dlouhodobou péči (85 %), stejně jako u hospitalizovaných pacientů (23–62 %) a u starších jedinců žijících ve vlastní domácnosti (15 %)
Potřeba energie. S věkem je spojen pokles celkového energetického výdeje, což znamená, že klesá i celková energetická potřeba. Průměrná celková energetická potřeba hospitalizovaného geriatrického pacienta je přibližně 1,3násobek BMR (basal metabolit rate) k udržení hmotnosti a 1,5–1,7násobek BMR, pokud je žádoucí váhový přírůstek. Potřeby většiny hospitalizovaných geriatrických pacientů tak splňuje dodání 30–35 kcal/kg/den(8).
Potřeba proteinů. Nové studie ukazují, že starší lidé potřebují v dietě více bílkovin pro udržení a podporu dobrého zdraví, zotavení z nemoci a udržení funkčního stavu než mladší dospělí. Potřebují tak kompenzovat věkem podmíněné změny v metabolismu proteinů, jako je vyšší splanchnická extrakce a nižší anabolická reakce na požité proteiny. Také potřebují více bílkovin na pokrytí potřeb během zánětlivých a katabolických stavů spojených s chronickým a akutním onemocněním, které se běžně pojí se stárnutím. Geriatrickou společností Evropské unie ( EUGMS) ve spolupráci s dalšími vědeckými organizacemi byla jmenována mezinárodní studijní skupina (PROT-AGE Study group) pro určení optimální potřeby bílkovin u starších lidí. PROT-AGE studijní skupina doporučuje u starších lidí (> 65 let) pro udržení a získání svalové hmoty a její funkce průměrný denní příjem proteinů v rozmezí alespoň 1–1,2 g/kg tělesné váhy. Vyšší příjem bílkovin (> 1,2 g/kg tělesné hmotnosti/den) se doporučuje pro ty, kteří cvičí a jsou jinak aktivní. Ještě větší denní dávka bílkovin (1,2–1,5 g/kg tělesné váhy/den) je u většiny starších dospělých potřeba během akutního či chronického onemocnění(9).
Fyzická aktivita seniorů. Přirozený proces stárnutí je provázen progredující ztrátou svalové hmoty, svalové síly a kondice a souhrnně se nazývá sarkopenie(10). Je nejčastěji pozorována u starších dospělých se sedavým způsobem života. Pro vznik věkem podmíněné ztráty svalové hmoty je dominantním faktorem snížená syntéza svalových proteinů spíše než zvýšený rozpad svalových bílkovin. Inaktivita spolu s anabolickou rezistencí jsou hlavními faktory přispívajícími k rozvoji sarkopenie(11). Toto tvrzení je podpořeno pozorováním, že imobilizace indukuje rezistenci svalu k anabolické stimulaci(12). Podobně snížení denního počtu kroků po dobu dvou týdnů indukuje u starších osob anabolickou rezistenci, což ukazuje snížená odpověď ve smyslu snížené syntézy svalových bílkovin na příjem proteinů, sníženou inzulinovou senzitivitu a snížení množství svalové hmoty na končetinách(13).
Přítomnost sarkopenie znamená pro staršího člověka snížení svalové síly, obratnosti, rychlosti a z toho plynoucí riziko pádů, při současné osteoporóze se násobí riziko vzniku závažných komplikací pádů v podobě zlomenin. Přítomnost sarkopenie znamená dvanáctinásobné zvýšení rizika osteoporózy, dvojnásobné riziko pádu v průběhu jednoho roku a téměř trojnásobné zvýšení rizika vzniku osteoporotické fraktury(14).
Stárnoucí sval reaguje na činnost, zvláště na odporové cvičení. Ve studii provedené v domovech důchodců u obyvatel starších 90 let, kteří absolvovali 8týdenní intenzivní odporový trénink, bylo dosaženo významného nárůstu svalové hmoty, svalové síly a rychlosti chůze(15).
Cíle studie
Hlavním cílem našeho projektu bylo v dlouhodobém horizontu zjistit efekt časné nutriční podpory a fyzioterapie během akutní hospitalizace na soběstačnost a tělesnou kondici (na svalovou sílu a množství svalové hmoty) geriatrických pacientů, tedy zjistit, zda je tato intervence dostatečná k prevenci vzniku či prohloubení sarkopenie.
Materiál a metodika
1. Kritéria pro zařazení do studie. Výzkumný soubor tvořili nemocní hospitalizovaní na geriatrickém oddělení Kliniky gerontologické a metabolické (KGM) Fakultní nemocnice Hradec Králové (FNHK).
Vstupní kritéria: věk nad 78 let, akutní příjem k hospitalizaci, soběstačnost pacienta před přijetím (Barthelův index > 60), souhlas s účastí.
Vylučující kritéria: Terminální stadium onemocnění, terminální orgánové selhání, hospitalizace za poslední 3 měsíce nebo více než 2 rehospitalizace za posledních 6 měsíců, nutnost nutriční podpory vzhledem k podvýživě nemocného, nesoběstačnost pacienta před přijetím (Barthelův index ≤ 60), pokročilé stadium demence spojené s nesoběstačností, nesouhlas s účastí.
2. Výběr pacientů a metodika měření. Každý pacient přijímaný na geriatrii (0. den studie), který splňuje vstupní kritéria, byl pomocí randomizace metodou uzavřených obálek přidělen do jedné ze dvou skupin. První skupina byla řazena do programu fyzioterapie a doplňková výživa, tedy skupina s intervencí – IG (100 pacientů), druhá skupina byla kontrolní, tedy CG (100 pacientů).
Frekvence měření: 1. měření – 2. den po příjmu (1. den studie); 2. měření – v den propuštění z nemocnice; 3. měření – v tříměsíčních intervalech vždy po 3 měsících od dimise, celková doba sledování 2 roky.
3. Sledované hodnoty. Věk, pohlaví, hlavní diagnóza při přijetí, počet dní hospitalizace, hmotnost, výška, dynamometrie stisku ruky oboustranně (přístrojem Lutron C. 69800 vsedě, paže v 10° abdukci, loket v 90° flexi), bioimpedance (přístrojem BCM Fresenius Medical Care SBJA0607) – lean tissue mass (LTM), fat adipose tissue (FAT), soběstačnost – dotazník Barthelův index, Lawtonův index, screening nutričního rizika (NRS 2002). V průběhu celé hospitalizace byl denně sledován spontánní příjem stravy metodou čtvrtiny talíře a množství zkonzumovaného sippingu.
4. Metodika intervence. Doplňková výživa ve formě sippingu (nutriční doplněk – 300 kcal, 12 g bílkovin) byla podávána od 2. dne hospitalizace (1. den studie) ve 14. a 19. hodin všem pacientům ve skupině s intervencí k jejich běžné stravě po celou dobu hospitalizace. Celkové energetické množství doplňkové výživy za den bylo: 600 kcal, 24 g bílkovin. Intervence fyzioterapeuta (zajištěna Rehabilitační klinikou FNHK) probíhala u všech pacientů ve skupině s intervencí od 2. dne (1. den studie) do konce hospitalizace celkem 4x denně 6 dní v týdnu takto: a) trénink dolních končetin na bicyklovém ergometru KineTec Cykla 2x denně po dobu 5 minut; b) léčebná tělesná výchova a další techniky fyzioterapie 2x denně po dobu 15 minut.
5. Statistická analýza. Výsledky byly vyjádřeny jako průměr (směrodatná odchylka) nebo procenta. Základní charakteristiky, spontánní příjem stravy a příjem energie a proteinů obou skupin (intervenované – IG a kontrolní –CG) byly po Skewness testu normality porovnány pomocí dvouvýběrového nepárového t-testu (Student t-test pro shodné rozptyly, Aspin-Welch pro neshodné rozptyly) nebo Mann-Whitney testu (NCSS 2007). Efekt intervence (antropometrické změny a změny soběstačnosti) byl testován Mixed Testem (NCSS 2007). Statistický test byl považován za významný při hladině významnosti p < 0,05.
Výsledky
1. Základní data. Celkem bylo zařazeno do studie 200 pacientů, 100 do skupiny kontrolní (CG) a 100 do skupiny s intervencí (IG). Z celkového počtu pacientů bylo v CG 65 % žen, v IG 54 % (p = 0,114), průměrný věk pacientů byl 83,2 let v CG, 83,7 let v IG (p = 0,427). Průměrná délka hospitalizace byla u obou skupin 11,3 dní (p = 0,939). Ve všech dále sledovaných parametrech (BW – hmotnost, BMI – body mass index, FAT – množství tukové tkáně, LTM – množství svalové hmoty, SS – svalová síla, BI – Barthelův index) nebyl v den zařazení do studie statisticky významný rozdíl mezi oběma skupinami. S žádným pacientem ze studie jsme po celou dobu sledování neztratili kontakt, jediným důvodem předčasného ukončení studie bylo úmrtí. Mortalita byla během 2letého sledování 44 pacientů v CG a 47 v IG (p = 0,692) (tab. 1).
Tab. 1. Základní data studie 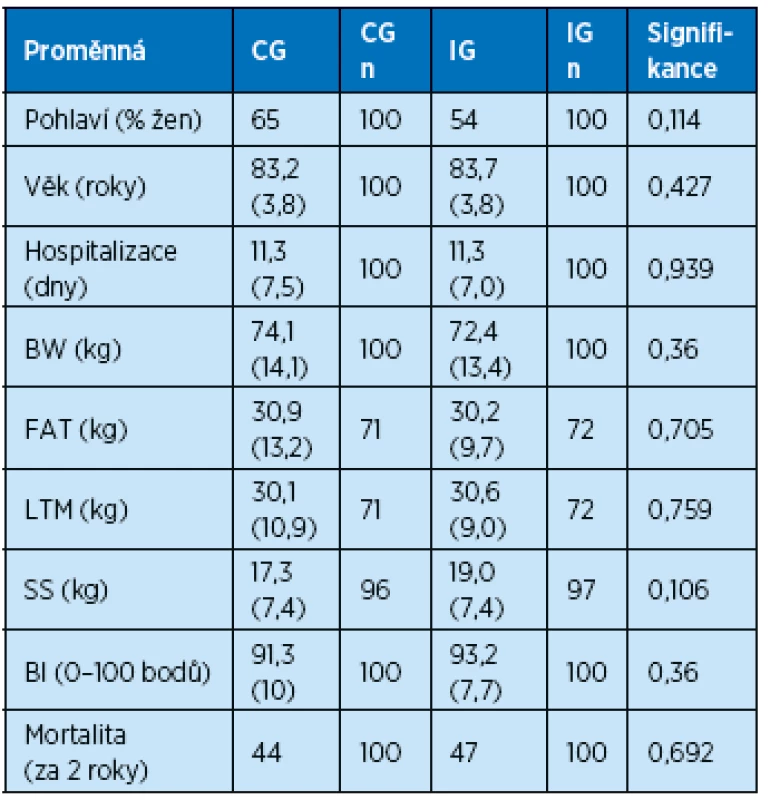
Data jsou průměr (směrodatná odchylka), pohlaví je vyjádřeno v procentech, n = počet pacientů, signifikance = p hodnota 2. Bilance stravy, sipping, příjem proteinů a energie. V naší studii bylo zjištěno, že pacienti během hospitalizace pro akutní onemocnění v průměru zkonzumovali necelé ¾ z každého podávaného hlavního jídla, což činilo v CG 1396 kcal/den a 55,5 g proteinů/den. V IG navíc dostávali pacienti sipping, jehož tolerance byla dobrá (83 % zkonzumovaného množství), a s ním činil denní příjem 1954 kcal a 76,3 g proteinů. Pokud výsledná čísla přepočteme na hmotnost pacientů, dostaneme se v CG na 18,8 kcal/kg/den a 0,75 g proteinů/kg/den, v IG 27 kcal/kg/den a 1,05 g/kg/den. Z výsledků plyne, že v IG byl denní příjem kilokalorií i gramů proteinů signifikantně vyšší než v CG, ani zde však nedosahuje doporučených denních dávek pro akutně nemocného geriatrického pacienta, které činí 30–35 kcal/kg/den(8) a 1,2–1,5 g proteinů/kg/den(9). Denní deficit činil v CG 698,2 kcal a 37,9 g proteinů, v IG 117,1 kcal a 14,3 g proteinů. Z výsledků je patrné, že k dosažení doporučených denních dávek kilokalorií a proteinů by bylo třeba více nutričních suplementů (v našem případě 1 nutriční doplněk = 300 kcal a 12 g proteinů). Otázkou je tolerance dalšího nutričního doplňku a zda by jeho podání nesnížilo množství zkonzumované běžně podávané stravy. Další možností, která by odstranila zbytečné navýšení dodávky kilokalorií při snaze dosáhnout dostatečného příjmu proteinů, je přidávání čistě proteinového doplňku do běžné stravy navíc k dvěma nutričním suplementům či využití proteinově bohatších doplňků (tab. 2, 3).
Tab. 2. Spontánní příjem stravy a sippingu během hospitalizace 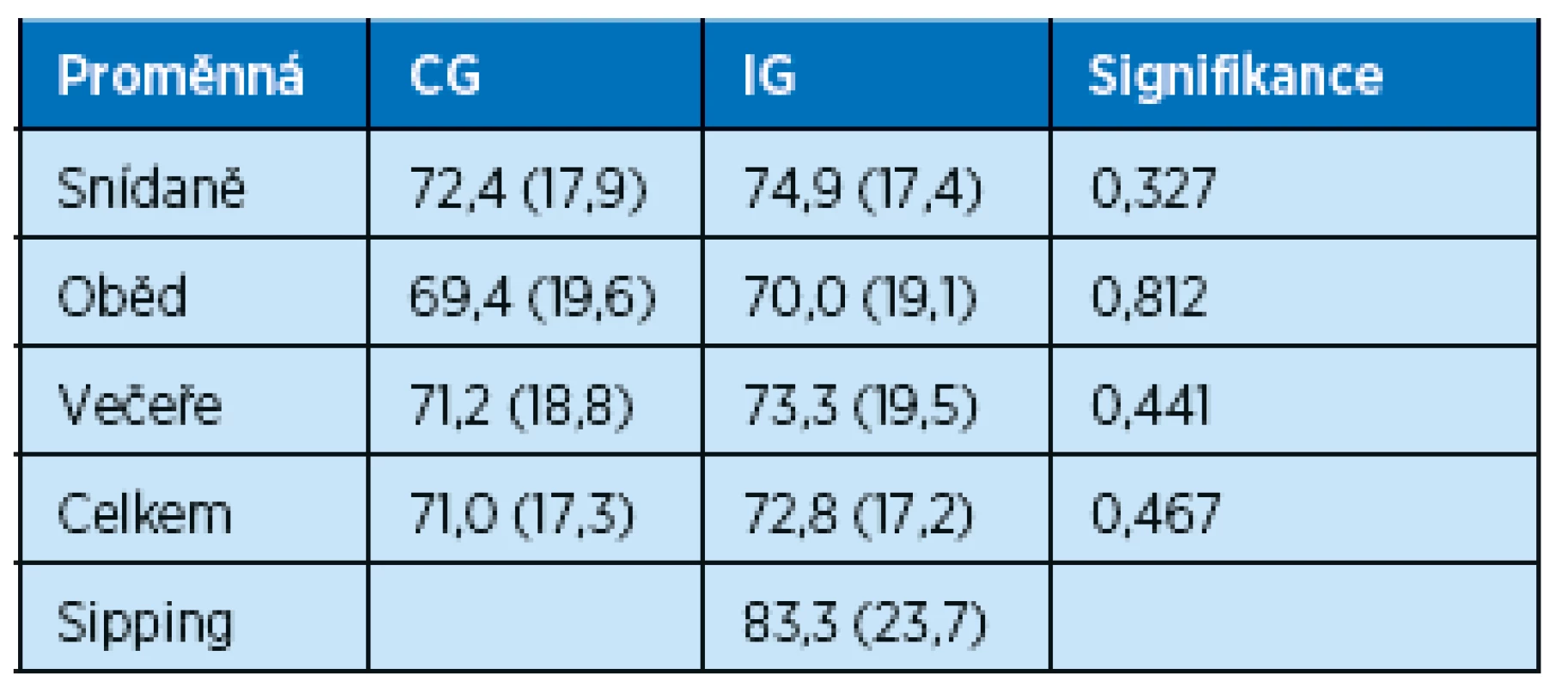
Data jsou procenta (směrodatná odchylka), signifikance = p hodnota Tab. 3. Příjem energie a proteinů během hospitalizace 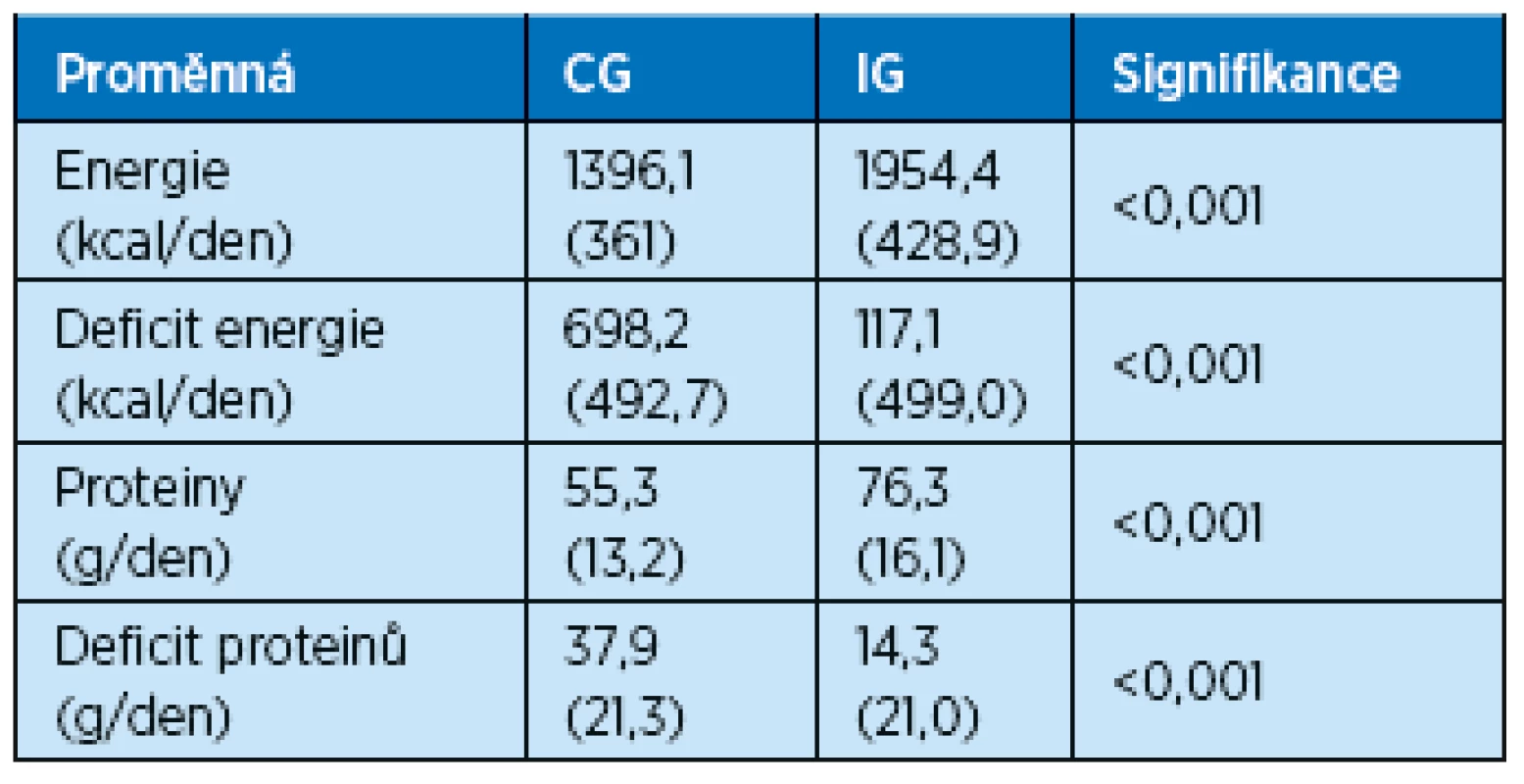
Data jsou průměr (směrodatná odchylka), signifikance = p hodnota 3. Svalová hmota LTM, svalová síla SS. Po proběhlém akutním onemocnění je statisticky významný rozdíl v hmotnosti LTM při propuštění pacientů z nemocnice, kdy v CG dosahuje LTM průměrné hodnoty 27,3 kg, v IG 31,7 kg (p = 0,005). Během hospitalizace došlo ke ztrátě LTM v CG o 2,8 kg, v IG k nárůstu o 1,1 kg. Opačný vývoj má za hospitalizace množství FAT. Taktéž je statisticky významný rozdíl ve svalové síle při propuštění pacientů, kdy v CG je průměrná hodnota SS 16,1 kg, v IG 19,6 (p = 0,002). Během hospitalizace se snížila SS v CG o 1,2 kg, v IG vzrostla o 0,6 kg. Z výsledků je zřejmé, že kombinace nutriční podpory a rehabilitace během akutního onemocnění zabrání ztrátě svalové hmoty a svalové síly během akutní hospitalizace u geriatrických pacientů.
Po propuštění z nemocnice jsou pacienti nadále již bez intervence, což se odráží na vývoji množství svalové hmoty. Ta od propuštění z nemocnice v prvních 3 měsících v IG klesá o 1,5 kg, v CG stagnuje, je zde nárůst pouze o 0,1 kg. Od přijetí do nemocnice, tedy od začátku akutního onemocnění, došlo tudíž v prvních 3 měsících sledování k poklesu množství svalové hmoty v CG o 2,7 kg, v IG pouze o 0,4 kg. Dále dochází v průběhu třech měsíců od začátku akutního stavu k nárůstu svalové síly v CG o 1,3 kg, v IG o 2,2 kg. Je zřejmé, že i po 3 měsících od akutního onemocnění je stav svalových zásob i svalové síly lepší v IG, ač nepokračovala intervence po propuštění.
Pokud porovnáme data po ročním sledování, došlo v CG k poklesu množství svalové hmoty o 1,8 kg, svalová síla vzrostla od nástupu akutního onemocnění o 1,5 kg. V IG došlo během prvního roku ve studii k nárůstu množství svalové hmoty o 1,1 kg a nárůstu svalové síly o 2,6 kg. I po roce od začátku hospitalizace je stav svalových zásob i svalové síly lepší v IG.
Během druhého roku sledování klesá svalová síla i množství svalové tkáně v obou skupinách pacientů, kdy již ani nelze předpokládat vliv intervence během hospitalizace, která trvala v průměru 10 dní, a odpovídá vývoji věkem podmíněnému úbytku svalové hmoty a svalové funkce (tab. 4, 5; graf 1, 2).
Tab. 4. Efekt intervence během 24 měsíců – skladba těla a svalová síla hodnoty 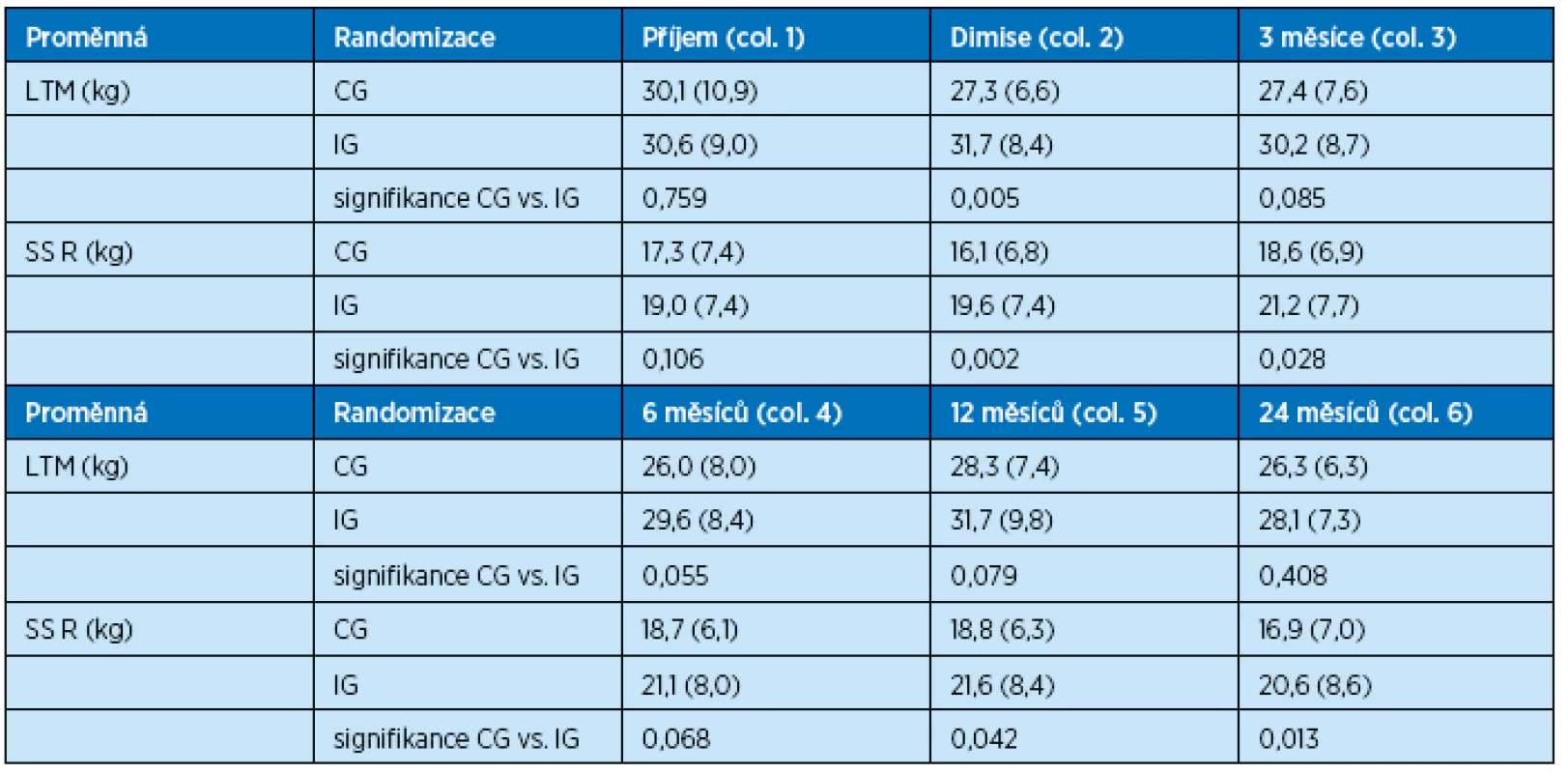
Data jsou průměr (směrodatná odchylka), signifikance = p hodnota Tab. 5. Efekt intervence během 24 měsíců – skladba těla a svalová síla, rozdíly 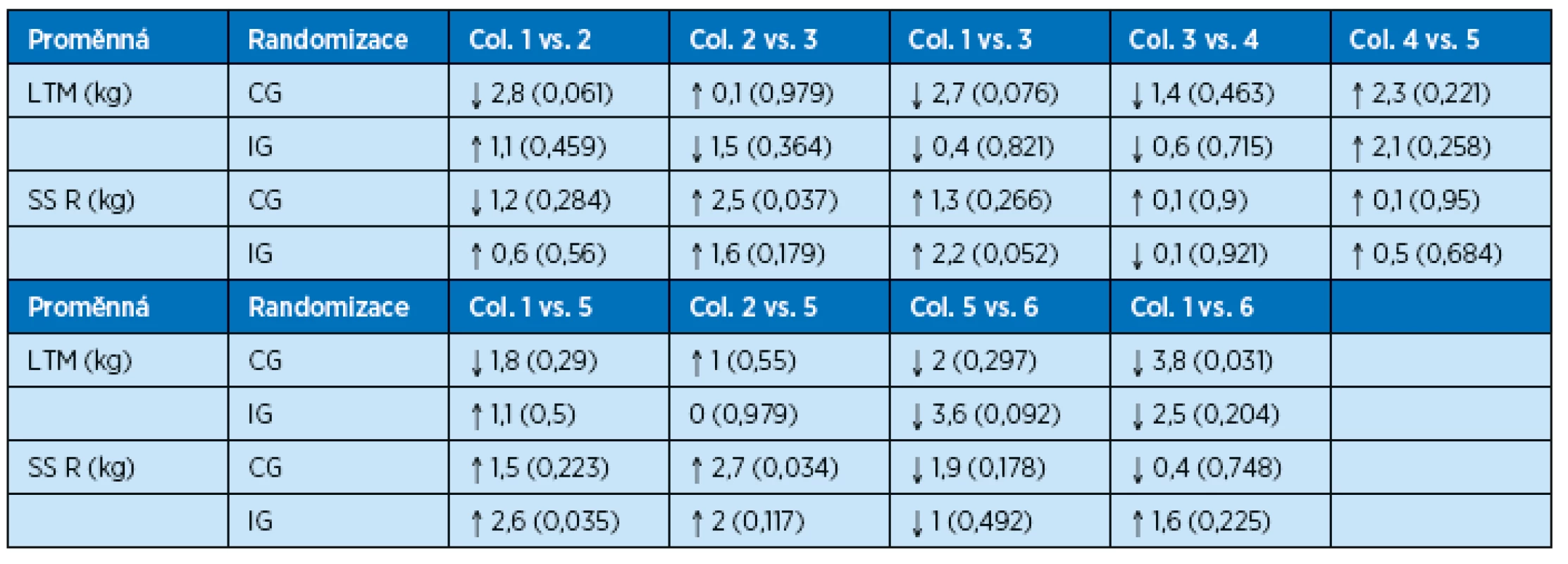
Data jsou rozdíl (p hodnota), ↑ zvýšení, ↓ snížení Graf 1. Vývoj množství svalové hmoty během 24 měsíců 
(1 – příjem, 2 – dimise, 3 – 3 měsíce, 4 – 6 měsíců, 5 – 12 měsíců, 6 – 15 měsíců, 7 – 18 měsíců, 8 – 21 měsíců, 9 – 24 měsíců) Graf 2. Vývoj svalové síly během 24 měsíců 
(1 – příjem, 2 – dimise, 3 – 3 měsíce, 4 – 6 měsíců, 5 – 12 měsíců, 6 – 15 měsíců, 7 – 18 měsíců, 8 – 21 měsíců, 9 – 24 měsíců) 4. Barthelův index – soběstačnost při každodenních činnostech. Soběstačnost klesá během celého dvouletého sledování u obou skupin pacientů. Během prvních 3 měsíců klesá soběstačnost v CG o 8,1 bodů, v IG o 5,1 bodů. Při porovnání dat po ročním sledování došlo v CG k poklesu soběstačnosti o 11,3 bodů, v IG o 9,3 bodů. Během celého dvouletého sledování klesl BI v CG o 14,7 bodů, v IG o 13,3 bodů. Je třeba si uvědomit, že ztráta pouhých pěti bodů BI může znamenat nutnost pomoci druhé osoby při osobní hygieně nebo mobilitě po rovném terénu či jiných úkonech, které člověk v běžném životě během dne provádí. U pacientů, kteří podstoupili během akutní hospitalizace intervenci formou rehabilitace a nutriční podpory, došlo jak po propuštění z nemocnice, tak během celého dvouletého sledování k menší ztrátě soběstačnosti než u pacientů v kontrolní skupině. Z grafu je patrné, že zejména po propuštění z nemocnice není pokles soběstačnosti hodnocené BI tak prudký v IG jako u pacientů z CG (tab. 6, 7; graf 3).
Tab. 6. Efekt intervence během 24 měsíců – soběstačnost hodnoty 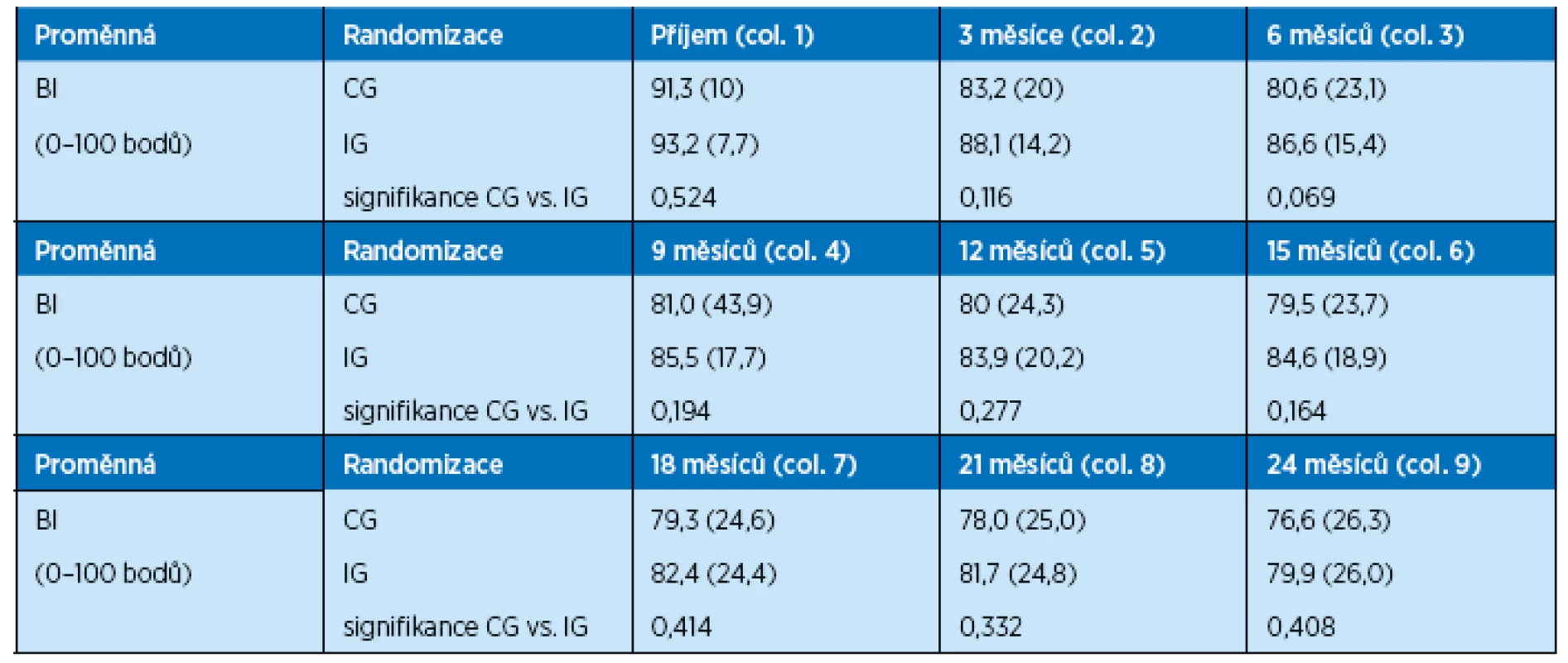
Data jsou průměr (směrodatná odchylka), signifikance = p hodnota Tab. 7. Efekt intervence během 24 měsíců – soběstačnost, rozdíly 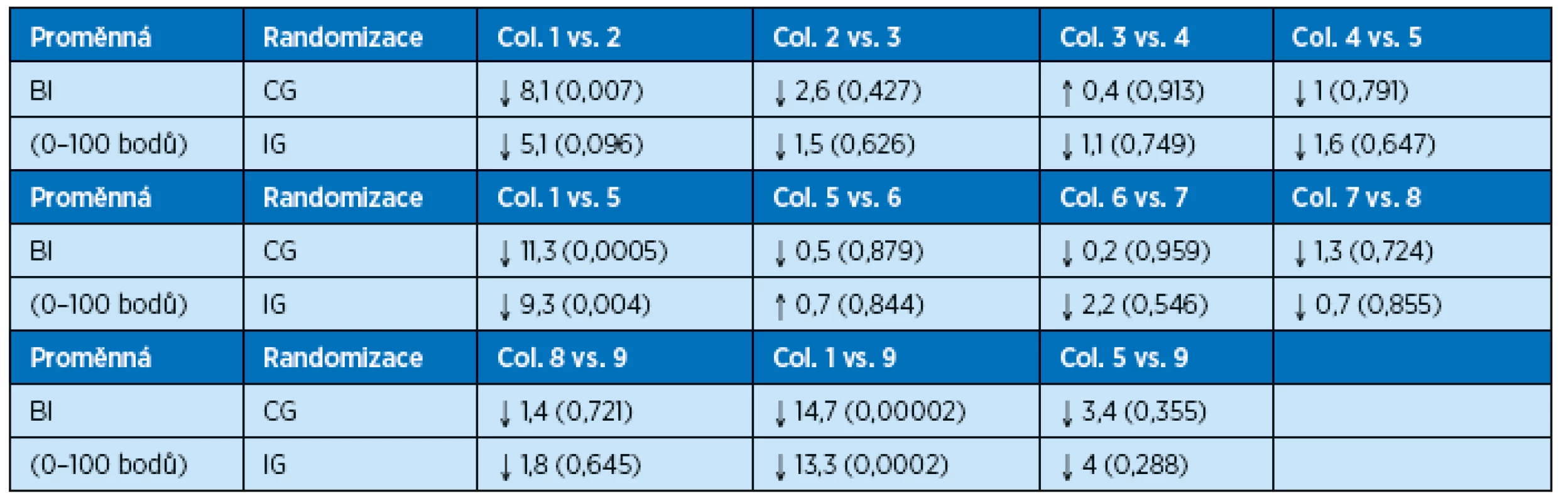
Data jsou rozdíl (signifikance), ↑ zvýšení, ↓ snížení Graf 3. Vývoj Barthelova indexu během 24 měsíců 
(1 – příjem, 2 – dimise, 3 – 3 měsíce, 4 – 6 měsíců, 5 – 12 měsíců, 6 – 15 měsíců, 7 – 18 měsíců, 8 – 21 měsíců, 9 – 24 měsíců) Závěr
Kombinace včasné nutriční podpory a rehabilitace u akutně nemocných gerontologických pacientů v současné době stále ještě není dobře popsána a není součástí běžné denní praxe. V naší studii byl i po roce sledování stav svalové hmoty a svalové síly lepší ve skupině s nutriční a rehabilitační intervencí a došlo během celého dvouletého sledování k menší ztrátě soběstačnosti než u pacientů v kontrolní skupině. Je tedy zřejmé, že správně vedená a včasná nutriční a rehabilitační intervence u gerontologického pacienta v době akutního onemocnění zmírní ztrátu svalové hmoty a svalové síly, a tím prodlouží dobu soběstačnosti a nezávislost seniora, čímž zlepší kvalitu jeho života a současně sníží nežádoucí dopady sociální a ekonomické, které s sebou nízká soběstačnost seniora přináší.
Podpořeno výzkumným úkolem PROGRES - Q40/12.
MUDr. Zuzana Dědková,
MUDr. Petra Hegerová,
MUDr. Božena Jurašková,Ph.D.,
prof. MUDr. Luboš Sobotka, CSc.
III. Interní gerontometabolická klinika LF UK
a FN Hradec Králové
MUDr. Zuzana Dědková
e-mail: z.dedkova@seznam.cz
V roce 2013 atestovala v oboru všeobecné praktické lékařství. Poté pracovala na Poliklinice Týniště nad Orlicí, nyní působí na III. interní gerontometabolické klinice FN Hradec Králové jako postgraduální studentka.
Zdroje
1. Jansen I, Shepard DS, Katzmarzyk PT, et al. The healthcare costs of sarcopenia in the United States. J A Geriatr Soc 2004; 52(1): 80–85.
2. Sobotka L. Vliv malnutrice na průběh akutního onemocnění u gerontologického nemocného. Ces ger rev 2003; 2003(1): 32–35.
3. Starke J, Schneider H, Alteheld B, et al. Short-term individual nutritional care as part of routine clinical setting improves outcome and quality of life in malnourished medical patients. Clin Nutr 2011; 30(2): 194–201.
4. Paddon-Jones D, Sheffield-Moore M, Urban RJ, et al. Essential amino acid and carbohydrate supplementation ameliorates muscle protein loss in humans during 28 days bedrem. J Clin Endocrin Metab 2004; 89(9): 4351–4358.
5. Ferrando AA, Tipton KD, Bamman MM, et al. Resistance exercise maintains skeletal muscle protein synthesis during bed rest. J app Physiol 1997; 82(3): 807–810.
6. Kortebein P, Ferrando A, Lombeida J, et al. Effect of 10 days of bed rest on skeletal muscle in healthy older adults. JAMA 2007; 297(16): 1772–1774.
7. Soenen S, Rayner ChK, Jones KL, et al. The ageing gastrointestinal tract. Cur Opin Clin Nutr Metab Care 2016; 19(1): 12–18.
8. Sobotka L. Basics in clinical nutrition. 4. vyd. Praha: Galén 2011.
9. Bauer J, Biolo G, Cederholm T, et al. Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from the PROT-AGE Study Group. J Am Med Dir Assoc 2013; 14(8): 542–559.
10. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis. Report of the European Working Group on Sarcopenia in Older People. Age Ageing 2010; 39(4): 412–423.
11. Dickinson JM, Volpi E, Rasmussen BB. Exercise and nutrition to target protein synthesis impairments in aging skeletal muscle. Exerc Sport Scien Rev 2013; 41(4): 216–223.
12. Glover EI, Phillips SM, Oates BR, et al. Immobilization induces anabolic resistance in human myofibrillar protein synthesis with low and high dose amino acid infusion. J Physiol 2008; 586(24): 6049–6061.
13. Breen L, Stokes KA, Churchward Venne TA, et al. Two weeks of reduced activity decreases leg lean mass and induces „anabolic resistance“ of myofibrillar protein synthesis in healthy elderly. J Clin Endocrin Metab 2013; 98(6): 2604–2612.
14. Matějovská Kubešová H. Prevence osteoporózy a sarkopenie. Ger Geront 2013; 2(4): 213–215.
15. Fiatarone MA, Marks EC, Ryan ND, et al. High-intensity strength training in nonagenarians. Effects on skeletal muscle. JAMA 1990; 263(22): 3029–3034.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek EditorialČlánek Geriatrie v roce 2017
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2017 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Trazodon pohledem praktického lékaře
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
-
Všechny články tohoto čísla
- Pracovní odpoledne Sekce mladých geriatrů ČGGS ČLS JEP
- Editorial
- Profesor Zdeněk Zadák a jeho krásných osmdesát
- Aktivní přístup k akutně hospitalizovanému geriatrickému pacientovi jako prevence ztráty svalové hmoty a soběstačnosti
- Polyfarmacie a malnutrice ve stáří
- Delirium – nové poznatky a zkušenosti pro praxi
- Paliativní péče v zařízení následné péče (LDN)
- Mimovizuální účinky světla: chronobiologická fototerapie
- Porucha kognice není vždy demence
- Plicní nokardióza u geriatrické pacientky
- Geriatrie v roce 2017
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Delirium – nové poznatky a zkušenosti pro praxi
- Paliativní péče v zařízení následné péče (LDN)
- Plicní nokardióza u geriatrické pacientky
- Porucha kognice není vždy demence
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




