-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pretrvávajúci syndróm po prekonaní infekcie COVID-19
Persisting long-COVID-19 syndrome
Infection caused by new SARS-CoV-2 syndrome brought of problems, scientific, economical, and in societies in all countries in the world. Ongoing disease is followed by several phases, depending on new virus mutations. For the clinical practice it is of importance for either non-vaccinated and as well for vaccinated persons. Long-COVID syndrome represents still open problem in current medicine.
Keywords:
diabetes mellitus – SARS-CoV-2 – long-COVID syndrome
Autoři: Andrej Dukát 1; František Sándor 2; Peter Gavorník 3; Juraj Payer 1
Působiště autorů: V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava 1; Klinika pneumológie a ftizeológie LF UK a UNB, Nemocnica Ružinov, Bratislava 2; Angiologická sekcia Slovenskej lekárskej komory (AS SLK) 3
Vyšlo v časopise: Forum Diab 2022; 11(1): 43-48
Kategorie: Prehľadové práce
Souhrn
Infekcia novým vírusom SARS-CoV-2 priniesla celý rad medicínskych, ekonomických i spoločenských problémov v celej populácii sveta. Ochorenie prechádza viacerými fázami v závislosti na ďalších mutáciách vírusu. Pre klinickú prax však stále viac vystupuje do popredia syndróm po prekonanej infekcii, a to ako u nevakcinovaných, tak i vakcinovaných osobách. Long-COVID-syndróm predstavuje stále otvorený medicínsky problém.
Klíčová slova:
diabetes mellitus – SARS-CoV-2 – long-COVID-19-syndróm
Terminológia
O postkovidovom syndróme sa uvažuje, ak sa nachádza súbor príznakov, ktoré pretrvávajú, alebo sa vyvíjajú po 12 a viac týždňov od vzniku ochorenia COVID-19, ktoré nie je možné vysvetliť inou príčinou.
Terminológia rozoznáva z časového hľadiska 3 kategórie: long-COVID – časové obdobie od 5. týždňa a viac, postakútny COVID – prebiehajúci symptomatický COVID 4–12 týždňov od vzniku infekcie COVID) a post-COVID syndróm – trvajúci 12 a viac týždňov.
Uvedená infekcia môže pravdepodobne postihnúť ktorýkoľvek orgánový systém v ľudskom organizme. Môže byť asymptomatický (s prítomnými patologickými nálezmi), alebo ako oligosymptomatický.
Príčiny
Dlhodobo pretrvávajúce príznaky v rámci tohto syndrómu môžu byť zapríčinené:
• dlhodobým, alebo trvalým postihnutím pľúc, srdca, alebo aj iného orgánu, súvisiace s prekonaním infekcie COVID-19
• syndrómom po intenzívnej starostlivosti postihnutého pacienta (polyneuropatia kriticky chorých, dekubity, svalové atrofie, atď)
• povírusovým únavovým syndrómom
• pokračujúcimi príznakmi COVID-19 (prolongovaným zápalom, endotelovou dysfunkciou a prokoagulačným stavom)
Spoločným denominátorom je endotelová dysfunkcia, pričom je zrejmá aj sekvencia dejov. Primárne miesto infekcie COVID-19 je horný a dolný dýchací trakt. Vírusom asociovaná endotelitída spúšťa hypoperfúzne poškodenia orgánov (pľúca, srdce, obličky, mozog, črevo, gastrointestinálny trakt – GIT) a aditívne je komplikovaná prokoagulačným stavom: trombotické mikrovaskulárne a makrovaskulárne príhody a následkom môže viesť až ku prejavom diseminovanej intravaskulárnej koagulácie (DIC). Celý proces je naviac spojený s jasným imunodeficitným stavom.
Základná vaskulárna stenotizujúco-obliterujúca choroba začína vniknutím vírusu SARS-Cov-2 do endotelu s následnou endotelovou dysfunkciou i štruktúrnym vaskulárnym poškodením, ktoré môže byť spôsobené tiež variabilne: intramurálne (napr. vaskulitídou), intraluminálne (napr. tromboembóliou) alebo extramurálne (napr. kompresiou cievy inflamovanými perivaskulárnymi štruktúrami. Môže sa týkať všetkých druhov ciev (veľkých, stredných i malých artérií, mikrociev – vrátane nutritívnych ciev vasa vasorum i vasa nervorum, vén i lymfových ciev). Niekedy je to naopak dilatačno-ektatická vaskulárna choroba (disekcia, aneuryzma, ruptúra s následným krvácaním). Funkčným následkom je napokon vždy ischémia až nekróza príslušných tkanív a chronické zlyhávanie, či akútne zlyhanie postihnutých orgánov.
Z tohto aspektu je možné považovať koronavírusovú chorobu (COVID-19) za novú multiorgáno-multivaskulárnu infekčnú chorobu s variabilnými klinickými formami a variabilným klinickým priebehom i variabilnými komplikáciami, najmä v závislosti od prítomnosti cievnych rizikových faktorov infikovaného pacienta.
Z epidemiologických dát, ktoré sa týkajú tejto infekcie, máme údaje predovšetkým z mesta Wu-chan (Čína) a z Bergama (Lombardia, Taliansko). Tie jasne ukázali, že dôležitým prognostickým faktorom sú komorbidity. Vo Wu-chane to bolo až v 49 %: hypertenzia (30 %), diabetes mellitus/DM (19 %) a ischemická choroba srdca (8 %). V Lombardii dokonca až v 68 %: hypertenzia (49 %), kardiovaskulárne ochorenie (21 %), hypercholesterolémia (18 %) a DM (17 %). Následne riziko mortality z celkovej vzorky takmer 50 000 pacientov sú: vek > 65 rokov (10 %), prítomné kardiovaskulárne ochorenie: ischemická choroby srdca (10,2 %), srdcové zlyhávanie (15,3 %), arytmie (11,5 %), chronická obštrukčná choroba pľúc (14,2 %) a fajčenie (9,4 %) [1].
Je zrejmé, že vírusová infekcia má teda priamy vplyv na kardiovaskulárny systém a vírusová pneumónia má aditívny účinok na kardiovaskulárne komplikácie. Destabilizácia aterosklerotického plaku a apoptóza kardiomyocytov vedie potom ku závažným stavom ako infarkt myokardu, či srdcové zlyhanie. Vo Wu-chane tvorilo kardiovaskulárne poškodenie 19,7 % prípadov, z toho 77 % tvoril akútny infarkt myokardu. Tí, ktorí mali pozitivitu troponínov, mali až 70% mortalitu.
Srdcové zlyhanie (49 %) malo 52 % mortalitu. Tu sa ukázala byť prediktívna pozitivita NT-proBNP a CRP spolu s troponínmi. V Lombardii predstavovali akútne koronárne syndrómy (typ STEMI) až 60,7 %. Prognosticky nepriaznivé boli koagulopatia, venózny tromboembolizmus a diseminovaná intravaskulárna koagulopatia a ukázala sa potreba monitorovať antitrombínovú aktivitu, protrombínový čas, D-dimér a fibrínový degradačný produkt [2].
Dysfunkcia ľavej komory srdca a zápal vedú k elektrickej instabilite a zníženiu kapacity srdca ako pumpy, arytmie zasa k riziku zastavenia srdca (cardiac arrest). Pôvodne sa myslelo, že zápal srdca (myokarditída) je zriedkavý, avšak akútne poškodenie ako komplikácia vírusovej infekcie je prítomné v 8–12 % [3]. Incidencia na jednotkách intenzívnej starostlivosti (JIS) je 12-násobne vyššia než na ambulanciách a na JIS máva fulminantný priebeh. Zápal s hyperaktiváciou T-lymfocytov sa tu môže spolupodieľať na hypoxii a metabolickom rozvrate [4]. Myokarditída sa však v priebehu času môže vyvinúť aj po vakcinácii (po mRNA-vakcínach), a to predovšetkým významne častejšie u mladších mužov. Je podstatne zriedkavejšia po očkovaní ako po infekcii COVID-19. V literatúre je známa analýza 139 adolescentov z 26 centier v USA a Kanade. Táto sledovaná kohorta mala v polovici prípadov vek 12–16 rokov (53 %), ostatní boli vo veku 16–20 rokov (47 %). Mužské pohlavie bolo vysoko významným faktorom pre incidenciu myokarditídy po vakcinácii (až 91 %). Medián výskytu bol 2 dni (rozsah bol medzi 0–22 dní). U všetkých bola prevažujúcim príznakom bolesť na hrudníku, v 30 % bola pridružená horúčka, v 30 % dýchavica. Zriedkavými nálezmi boli potom palpitácie, vyrážka, konjunktivitída, ďalej bolesť hlavy a myalgie. U postihnutých adolescentov sa predpokladá imunologický podklad. Počas hospitalizácie týchto adolescentov vyžadovalo 20 % pobyt na JIS, 2 potrebovali podporu inotrópnymi látkami, 1 mal arytmiu – komorovú tachykardiu s eleváciami ST-segmentu na EKG. U všetkých týchto pacientov bolo realizované echokardiografické vyšetrenie a u 20 % sa ukázala znížená funkcia (pokles EF). Ako užitočný marker v klinike sa ukázali byť troponíny. O ďalšom priebehu tejto kohorty nie sú známe žiadne údaje. Vyžadujú však opatrnosť pediatrov, zvlášť v súčasnosti, kedy sa širšie rozbieha očkovanie detí starších ako 5 rokov, a zo zvlášť pre údaj, že väčšina myokarditíd v tejto kohorte sa vyskytla po druhej podanej vakcíne. Po prvej podanej vakcíne sa myokarditída vyskytla z uvedených 139 vyskytla u 12, u všetkých ostatných to bolo po druhej podanej vakcíne. Teoreticky sa predpokladá výskyt vakcínou indukovanej myokarditídy (po vakcinácii mRNA vakcínou) u 70 na 1 milión očkovaných.
Arytmie boli vo Wu-chane prítomné v 16,7 % a arytmie boli ako predsieňové, tak aj komplexné komorové a dokonca vedúce k šoku. Na MRI-vyšetreniach boli štrukturálne zmeny myokardu prítomné v 78 %, pozitivita biomarkerov v 76 % a pozitivita biomarkerov zápalu (IL6, TNFα) v 60 %. Patológovia popisujú degeneráciu a nekrózu kardiomyocytov, zápalový infiltrát s monocytmi, lymfocytmi a neutrofilmi a postihnutie endotelu so zápalom a trombózou. Stresom vyvolaná kardiomyopatia klinicky prejavujúca sa s akútnou a tranzitórnou regionálnou dysfunkciou ľavej komory typu tako-tsubo je následkom fyzickej a emočnej záťaže pacienta. Zdravotná kríza, anxieta, stres, strach sa podieľajú na zvýšenej sekrécii katecholamínov a na kardiovaskulárnych komplikáciách. Kým kardiomyopatie pred infekciou COVID-19 sa vyskytovali v 1,5–1,8 %, v súčasnosti stúpli na 7,8 %. V 33 % vedie k dilatačnej kardiomyopatii so zníženou funkciou ľavej komory, ktorá pred infekciou nebola prítomná. Je potrebné tiež pripomenúť, že sa tu môže spolupodieľať aj liečba: chlorochín, INF, bevacizumab. Výsledkom je potom vývoj srdcového zlyhávania so zníženou funkciou ľavej komory srdca, ktorý je prítomný u 23 % pacientov [6]. Či sa jedná o exacerbáciu preexistujúcej ľavokomorovej dysfunkcie alebo novovzniknutej kardiomyopatie, zatiaľ nevieme.
Hypertenzia zvyšuje mortalitu v tejto skupine pacientov o 21,3 % a antihypertenzívna liečba (vrátane zásahu do RAAS) mortalitu nezvyšuje [13]. Riziko venózneho tromboembolizmu je 31–40 %, mortalitné riziko pri vzniku DIC je 71,4 %. Pri celkovom hyperkoagulačnom stave postihuje pľúca aj srdce mikrovaskulárna trombóza, preto sa v liečbe používajú nielen antitrombotiká, ale aj antiagregačná liečba a heparíny. Obezita s BMI > 25 kg/m², DM a zvýšený hsCRP sú ukazovatele ťažkého priebehu ochorenia. Pacienti s DM majú 6-násobne vyššie riziko ochorenia a, čo je horšie, následne odpovedajú na liečbu COVID-19 (ak majú prítomné biomarkery hsCRP, IL6, LDH a D-dimér). Hoci pacienti s DM pred epidémiou COVID-19 mali mortalitu 6-násobne vyššiu než ostatná populácia, v minulom roku táto stúpla u nás (vrátane prítomných kardiovaskulárnych a onkologických pacientov) 9-násobne. Podiel mortality týchto pacientov vzrástol u nás o 45 % a na celkovom počte pacientov s DM počas tejto epidémie vzrástol z 26 % na 29 % [7].
Diagnostika
Príznaky po prekonaní infekcie môžu byť generalizované a môžu sa týkať orgánových systémov: kardiovaskulárne, respiračné, neurologické, gastrointestinálne, metabolické, muskulo-skeletálne, otolaryngologické, dermatologické aj psychiatrické/psychologické, a čo je dôležité, nevieme ich predikovať a nemáme známe špecifické biomarkery. Ich prehľad je schematicky uvedený v tab. 1. Príznaky môžu byť jednotlivé, viaceré, konštantné, prechodné, fluktuujúce, meniace a s časom a taktiež ako u jednotlivých orgánových systémov ich nevieme predikovať.
Tab. 1. Najčastejšie sa vyskytujúce príznaky po prekonaní infekcie COVID-19 
U symptómov po prekonanej infekcii je charakteristické, že pravdepodobnosť vzniku a rozvoja nezávisí od závažnosti prekonanej akútnej infekcie, najčastejšími prejavmi sú dýchavica a únavnosť (potom opresie, bolesti na hrudníku a palpitácie) a symptómy môžu kolísať a meniť sa s časom.
Dispenzár postihnutých pacientov zahrňuje pacientov po hospitalizácii s COVID-19 s pneumóniou a s hypoxémiou, ambulantne liečených pacientov s dokázanou infekciou COVID-19 (pozitivita PCR/antigénového testu) s pretrvávaním symptómov viac ako 12 týždňov, ambulantne liečených pacientov so suspektným COVID-19 (bez vyšetreného PCR/antigénového testu v dobe diagnózy) viac ako 12 týždňov a ambulantne liečených pacientov liečených po COVID-19 pneumónii nezávisle na prítomnosti symptomatológie.
V diagnostike platia všetky princípy platné v medicíne: anamnéza, fyzikálne vyšetrenie a pomocné vyšetrenia, ktoré pracovnú diagnózu podporia. Tieto vyšetrenia sa opierajú predovšetkým o zobrazovacie vyšetrenia (RTG a CT), vyšetrenia pľúcnych funkcií (spirometria, oximetria, pľúcna difúzia) a napokon funkčné záťažové testy (6-minútová chôdza/6-MWT, 1-minútový test vstávania zo stoličky/1MST, niekedy aj CPET). Ich prehľad je uvedený v tab. 2. Pre správnu klinickú prax je potrebné pridržiavanie sa odporúčaní. Vyše 3 desaťročia sú to tzv. guidelines – odporúčania vydávané na základe medicíny dôkazov. Napriek tomu, že stupeň dôkazov IA by sa mal premietnuť do klinickej praxe (napr. v kardiológii v USA sa premietol iba v 33 %) [8]. Pre terajší manažment kovidovej infekcie sú tieto odporúčania taktiež publikované a aká je ich aplikácia pre klinickú prax, ukáže až budúcnosť.
Tab. 2. Prehľad pomocných vyšetrení v diagnostike syndrómu po prekonaní COVID-19 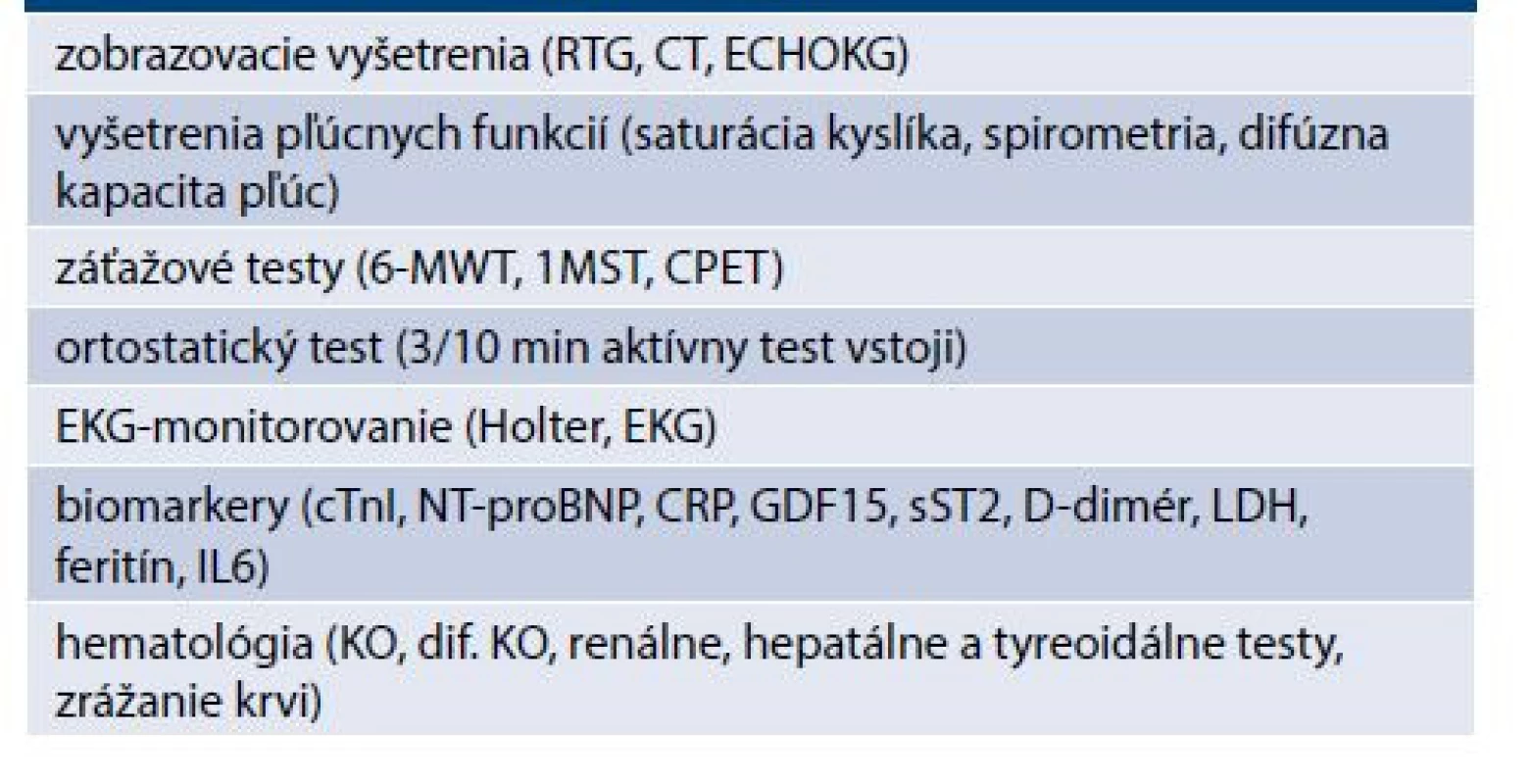
Pri predikcii pacienta, u ktorého je možné predpokladať long-COVID, boli zistené 4 rizikové faktory. Sú to SARS-CoV-2 RNAémia, diabetes mellitus 2. typu (DM2T), virémia EBV (Ebstein-Barr) a prítomnosť autoprotilátok v periférnej krvi pri iniciálnej diagnostike COVID-19. Ak je prítomná virémia EBV, svedčí to o reaktivácii EBV. Z uvedených 4 rizikových faktorov je však najdôležitejšia prítomnosť autoprotilátok, čo je až 2-násobne dôležitým faktorom. Pre prognózu pacientov je preto dôležité včasné zistenie týchto uvedených rizikových faktorov. V súčasnosti sa preto zdôrazňuje ich prediktívne meranie a následné včasné zavedenie antivirotickej liečby. Táto liečba znižuje výskyt následného rozvoja dlhodobého COVID-syndrómu, vrátane neurologických následkov.
Subklinické autoprotilátky, ktoré znižujú anti-SARSCoV - 2 protilátky, svedčia o imunitnej dysregulácii počas infekcie COVID-19. Reaktivácia latentných vírusov sa taktiež podieľa na long-COVID-syndróme. Gastrointestinálne postakútne prejavy ako následky COVID-19 svedčia o expanzii cytotoxických T-buniek. SARS-CoV-2 špecifické T-bunky a cytomegalovírusu špecifické CD8+ T-bunky tak predstavujú unikátnu dynamiku počas zotavovania sa z infekcie COVID-19. Až u 69 % pacientov s COVID-19 sa vyvinie long-COVID-syndróm v rozsahu nových, rekurentných, alebo pretrvávajúcich problémov počas > 4 týždňov po infekcii SARS-CoV-2. Z nich prevažuje strata pamäte, gastrointestinálny distres, únava, strata čuchu, alebo dýchavica.
Negatívna korelácia medzi určitými autoprotilátkami a aj medzi anti-SARS-CoV-2 IgG vysvetľuje fakt, že títo pacienti sú potom náchylnejší na prepuknutie ďalších infekcií. Preto je dnes potrebné ich stanovenie už pri začiatku infekcie, nakoľko predikuje neskoršie prejavy long-COVID. Je to podobné ako pri iných imunobiológiách, napr. systémovom lupus erythematosus, či postakútnom Lymeskom syndróme. Ale aj z hľadiska preventívnych spôsobov liečby (napr. pri náhradnej kortizolovej liečbe) tiež vôbec nevieme, ako sa menia znaky DNA v organizme ako odpoveď na infekciu SARS-CoV-2.
Zvlášť zraniteľnú skupinu predstavujú pacienti, ktorí boli hospitalizovaní pre túto infekciu na JIS. Fyzické, psychické aj kognitívne zmeny sa môžu prejaviť v čase aj o rok neskôr. Takmer 60 % (57,8 %) zamestnaných ľudí, ktorí museli byť hospitalizovaní na JIS, má aj po roku problémy v práci, ktoré vedú k tomu, že môžu pracovať pre ťažkosti len kratšiu dobu a stále sa necítia dobre. V holandskej multicentrickej štúdii malo fyzické ťažkosti 74,3 % (CI 68,3–79,6 %), psychické ťažkosti 26,2% (CI 20,8–32,3 %) a 16,2 % malo kognitívne poruchy. Je treba korektne povedať, že dlhodobé sledovania po infekcii SARS-CoV-2 zatiaľ nepoznáme. Z uvedeného sledovania však vidieť, že dve tretiny mali po prepustení z JIS nové fyzické problémy. Z nich najčastejšie to bola slabosť (38,9 %), stuhnutosť kľbov (26,3 %), bolesť kľbov (25,5 %), svalová slabosť (24,8 %) a myalgie (21,3 %). Z psychických ťažkostí to bola anxieta (17,9 %) a depresia (18,3 %). 9,8 % malo symptómy tzv. posttraumatickej stresovej poruchy. Potrebné je preto počítať s tým, že symptomatológia po hospitalizácii na JIS je vyššia u pacientov s COVID-19 (58 %) než prežívajúcich po hospitalizácii na JIS pre iné príčiny (43 %). Podobné zhoršenie zdravia popisujú pneumológovia po prekonaní akútneho respiračného distres-syndrómu a upozorňujú aj na stratu na telesnej hmotnosti na úkor predovšetkým svalovej hmoty po dlhšom časovom úseku. Pre klinickú prax vyplýva potreba dlhodobého sledovania týchto skupín pacientov, vrátane potreby využívania dlhodobých rehabilitačných programov.
U 20–30 % pacientov s COVID-19 sa vyvinú závažné kognitívne problémy dlho po odoznení akútnych symptómov ochorenia. U časti pretrvávajú od iniciálneho ochorenia a u časti fluktuujú, alebo dochádza ku relapsom s časom. Má súvis s abnormálnou neuronálnou odpoveďou, pre edém cievnej steny pri infekcii, znížením priemeru ciev zodpovedných za dodávku glukózy, kyslíka a potenciáciou stresom navodenému ďalšiemu zníženiu diametru ciev. Častou neurologickou symptomatológiou sú bolesť hlavy, teplota, únava, vizuálne zmeny, strata rovnováhy. S kognitívnou symptomatológiou súvisia zhoršenie pamäte, koncentrácie, deficity pozornosti, sťažené nachádzanie slov a ťažkosti pri verbálnej konverzácii. Keďže symptómy sú pre pacienta často dramatické a významne limitujú jeho každodenné funkcie a kvalitu života, limitácie môžu viesť dokonca až ku strate zamestnania a práce. Rýchlejšie zlepšenie stavu ako štandardná neurologická rehabilitácia prináša možnosť neinvazívnej mozgovej stimulácie alternujúcimi mikropotenciálmi, ktorá zlepšuje krvný prietok v mozgu a očiach. Metóda tACS (transkraniálna stimulácia alternujúcim prúdom – transcranial Alternating Current Stimulation) prináša benefit pre vizuálne a kognitívne deficity u postihnutých pacientov [9].
V súčasnosti prevažujúcim typom infekcie COVID-19 je variant omikron. Kým je menej vulnerabilný u mladších jedincov, je stále vulnerabilný v komunite seniorov. Epidemiologické údaje ukazujú, nehľadiac na údaje zaočkovania, že u seniorov predstavovala úmrtnosť minulé zimné obdobie asi 85 %, pri variante delta 60 % a v súčasnosti pri variante omikron asi 80 %. Napokon sú údaje o rozdieloch u pohlaví pacientov v kontexte infekcie COVID-19. U nevakcinovaných mužov, ktorí zomreli na komplikácie tohto ochorenia, sekčné nálezy poukázali na možný následok postihnutia reprodukčných orgánov, testes. Kriticky chorí muži mali závažné poškodenie aj pre aktivitu vírusu v testes (môžu teda predstavovať určitý rezervoár vírusu). Vírus je aktívny v tejto lokalizácii po dlhú dobu infekcie (napokon je to známe aj pre iné typy vírusov, ako napr. zika, ebola). Je to orgán s najvyššou expresiou receptorov ACE2, ktorá hrá kľúčovú úlohu pre vstup vírusu do vnútra buniek. Priamy vplyv SARS CoV-2 v bunkách testes zrejme dereguluje ACE2 a zvyšuje hladiny angiotenzínu II, silného prozápalového a angiogénneho peptidu. Pri štúdii malého súboru nevakcinovaných mužov so závažným pľúcnym poškodením, hospitalizovaných na JIS, nik nemal skrotálne symptómy, ani podobnú pozitívnu anamnézu. Konvenčný RT-PCR test (reverzná transkripčná polymerázová reťazová reakcia) nedokáže citlivo odhaliť SARSCoV - 2 mRNA v testes. Avšak pri modifikácii testu použitím nanosenzorov je zistiteľný vysoký tropizmus vírusu v testes. Okrem toho je prítomná tamtiež vysoká infekcia v makrofágoch a zárodočných bunkách. Imunitné bunky, ktoré majú „bojovať“ proti vírusu, sú v tomto tkanive infikované a infekcia je aj v zárodočných bunkách, ktoré zodpovedajú za tvorbu spermy. Toto tkanivo predstavuje dôležité miesto pre replikáciu vírusu. Otvorená je teda aj otázka následnej fertility: pri dlhšie trvajúcom závažnom stave pacienta klesá počet prežívajúcich zárodočných buniek, je fluktuácia niekoľkých esenciálnych testikulárnych génov a intratestikulárne hladiny testosterónu sú znížené až 30-násobne [10]. Zotavenie kvality spermy po infekcii COVID-19 bolo až po 3 mesiacoch, napriek neinfekčnosti spermy teda proces úpravy trvá aj niekoľko mesiacov.
Vyšetrenia vzoriek spermy po kratšom čase – mesiac po infekcii – ukázali pokles motility až v 60 % a počtoch spermiogramu o 37 %. Otázka fertility po infekcii SARSCoV - 2 je stále otvorená, keďže impakt ochorenia na testikulárne poškodenie ani pri ich variantoch nepoznáme.
Z epidemiologického hľadiska je dôležité zistenie z japonskej štúdie (grantu) v Kyote, ktoré ukázalo, že variant omikron prežíva na povrchoch plastov a na koži (zo vzoriek pri pitvách tiel pacientov) oveľa dlhšie než ostatné varianty COVID-19 [11]. To môže aj vysvetliť tak rýchle rozšírenie tohoto variantu po celom svete. Jeho vlastnosť je, že má oveľa väčšiu stabilitu než variant delta. Na plaste prežíva v priemere 193,5 hodín, teda niečo viac ako 8 dní. Na porovnanie na plastoch prežívajú ostatné vzorky v priemere 56 hodín. Vzorky omikronu na koži prežívajú v priemere 21,1 hodín (ostatné vzorky prežívajú v priemere 8,6 hodín). Iná je však rezistencia na etanol: kovidové vzorky boli inaktivované na báze alkoholových sanitačných látok do 15 sekúnd.
Syndróm je problémom aj v pediatrii. Spoločne sa označuje ako PIMS (pediatrický zápalový multisystémový syndróm), ktorý zahrňuje febrility, bolesti brucha, hnačky, exantém, bolesti svalov a kľbov po 3–4 týždňoch po prekonaní COVID-19. PIMS je známy približne od júna 2020 z Veľkej Británie. Vyžadoval akútne hospitalizácie na pediatrických JIS (ojedinele skončil aj letálne). Popisovaný bol výskyt hyperinflamačného šoku s črtami podobnými ako u Kawasakiho choroby, resp. Kawasakimu podobný šokový syndróm, alebo toxický šokový syndróm. U všetkých detských pacientov bol sérologický dôkaz infekcie SARS-CoV-2 (ale negatívny ťažký akútny respiračný syndróm koronavírusu, alebo bronchoalveolárnej laváže, či nazofaryngeálneho aspirátu).
Od uvedeného obdobia tento syndróm postihol mnoho detí, ale iba nedávno bol popísaný aj u dospelých (MIS – Multisystem Inflammatory Syndrome). Je to zápalový stav, ktorý postihuje rôzne časti organizmu, vrátane srdca, pľúc, obličiek, mozgu, kože, GIT, alebo očí. Symptómy sú: horúčka počas > 3 dní + 2 z nasledovných: veľmi nízky krvný tlak, bradykardia a poškodenie srdca (opresie a bolesť na hrudníku a pozitivita troponínov), porucha zrážania krvi (dôkaz koagulopatie), akútne GIT ťažkosti (zvracanie, hnačka a bolesť brucha), vyrážka alebo zápalové prejavy (na rukách, nohách a v ústnej dutine, bolesť v krku) a nadmerná únava.
Patofyziológiu MIS zatiaľ nepoznáme. Možné sú okrem poškodenia endotelu a tromboinflamácie aj dysregulácia imunitnej odpovede, či dysregulácia systému renín-angiotenzín - aldosterón. Aj interval medzi infekciou a rozvojom MIS je neznámy. Existuje veľká diverzita klinického priebehu a mechanizmov COVID-19 a post-COVID-19 spojená s poškodením myokardu. Uvedený MIS je potenciálne život ohrozujúca komplikácia prebehlej SARS-CoV-2 infekcie, preto by mali klinici v praxi vedieť o tomto syndróme, aby bol rozpoznaný včas a bola zahájená cielená intenzívna liečba. V súčasnosti je totiž zavedená intravenózna liečba kortikoidmi spolu s podpornou liečbou už štandardným postupom.
Prognostické aspekty
Napriek už dvojročnému trvaniu novej a neznámej epidémie ešte stále vzťah DM a COVID-19 dobre nepoznáme. Ochorenie má však jednoznačne na DM devastujúci účinok, čo predstavuje veľký medicínsky problém súčasnosti. Nielenže diabetici majú potrebu až 3-násobne vyššiej hospitalizácie, ale 30–40 % z nich majú ťažký priebeh ochorenia a následnej mortality. Z hospitalizovaných diabetikov až 21–43 % potrebuje intenzívnu starostlivosť a fatalita je okolo 25 %. Hospitalizačná mortalita je 3-násobne vyššia u diabetes mellitus 1. typu/ DM1T (OR 2,9) a 2-násobne u DM2T (OR 1,8) po adjustácii na komorbidity v porovnaní s nediabetikmi [12].
Hyperglykémia je celkom jasným prediktorom mortality, stanovenie biomarkera HbA1c je teda nevyhnutným vyšetrením daného pacienta. Negatívna mesačná prognóza pre mortalitu je u pacientov pri hladinách glykémie nalačno medzi 6,1–6,9 mmol/l a ≥ 7 mmol/l (OR 2,6–4,0) v porovnaní s euglykémiou ≤ 6,1 mmol/l.
Stále nepoznáme odpoveď, na vzťah infekcie COVID-19 a novovzniknutý diabetes mellitus.
Predpokladá sa, že infekcia môže byť jeho spúšťačom (DM1T aj DM2T). Nevieme tiež, či je DM potom prechodný, alebo trvalý, to ukáže až čas.
Záver
Pacienti s dlhodobým COVID-19 majú symptómy, ktoré sú nápodobné celému spektru stavov a nozologických jednotiek. Pritom je potrebné myslieť aj na sprievodnú liečbu iných syndrómov a ochorení.
Existuje komplexná interakcia rizikových faktorov, ktoré sú spojené s DM a zvýšenou mortalitou na koronavírus. Existuje viacero biologických ciest, ktoré sa podieľajú na tomto zvýšenom riziku u pacientov s DM. Tieto sa ale môžu podieľať aj na viacerých mechanizmoch interakcií s liekmi v danej skupine pacientov. Potenciálnymi rizikami sú predovšetkým starší vek, kardiovaskulárne ochorenie, obezita, DM, hypertenzia, chronické pľúcne a renálne ochorenia, poruchy zrážania krve, nádorové ochorenie, alebo imunosupresívna liečba. Prejavmi potom môžu byť: systémový zápal, poškodenie myokardu ako napr. infarkt myokardu, myokarditída, arytmie, kardiomyopatia typu tako-tsubo, srdcové zlyhanie, tromboembolické príhody, sprievodná liečba ako imunosupresia, či kardiotoxicita.
Títo pacienti potrebujú pomoc od rodiny, priateľov, kolegov a inštitúcií, vrátane komplexného sociálneho a zdravotného zabezpečenia, vrátane komplexnej inštitucionálnej rehabilitácie. V tomto kontexte pretrváva napriek už 2-ročnému trvaniu niekoľkých vĺn epidémie žiaľ trvalé zaostávanie a chýbajúci multidisciplinárny prístup fungujúcej spoločnosti a medicíny u nás. Bude ale nanešťastie ešte viac limitovaný prebiehajúcou novodobou vojnou na východe Európy.
Doručené do redakcie | Received 28. 2. 2022
Prijaté po recenzii | Accepted 2. 3. 2022
prof. MUDr. Andrej Dukát, CSc., FRCP
www. fmed.uniba.sk
Zdroje
1. Harding JL, Pavkov ME, Magliano DJ et al. Global trends in diabetes complications: a review of current evidence. Diabetologia 2019; 62(1): 3–16. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–018–4711–2>.
2. Wu J, Zhang J, Sun X et al. Influence of diabetes mellitus on severity and fatality of SARS-CoV-2 (Covid-19) infection. Diabetes Obes Metab 2020; 22(10):1907–1914. Dostupné z DOI: <http://dx.doi.org/10.1111/dom.14105>.
3. Huang C, Wang Y, Li X et al. Clinical features of patients infected with novel coronavirus in Wuhan, China. Lancet 2020; 395(10223): 497–506. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(20)30183–5>.
4. Wang B, Li R, Lu Z et al. Does comorbidity increase the risk of patients with COVID-19: evidence from meta-analysis. Aging 2020; 12(7): 6049–6057. Dostupné z DOI: <http://dx.doi.org/10.18632/aging.103000>.
5. Wilson FP. How Bad Can Myocarditis Be After COVID Vaccination? Medscape Dec 6, 2021. Dostupné z WWW: <www.medscape.com>.
6. Nägele MP. Endothelial dysfunction in Covid-19: Current findings and therapeutic implications. Atherosclerosis 2020; 314 : 58–62. Dostupné z DOI: <http://doi/10.1016/j.atherosclerosis.2020.10.014>.
7. Morris SB, Noah G, Schwartz NG et al. Case series of multisystem inflammatory syndrome in adults associated with SARSCoV-2 infection – United Kingdom and United States, March-August 2020. MMWR Morb Mortal Wkly Rep 2020; (40): 1450–1456. Dostupné z DOI: <http://dx.doi.org/10.15585/mmwr.mm6940e1>.
8. Bonow RO, Braunwald E. The Evidence Supporting Cardiovascular Guidelines. Is There Evidence of Progress in the Last Decade? JAMA 2019; 321(11): 1053–1054. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2019.2018>.
9. Sabel BA, Zhou W, Huber F et al. Non-invasive brain microcurrent stimulation therapy of long-COVID-19 reduces vascular dysregulation and improves visual and cognitive impairment. Restorat Neurol Neurosci 2021; 39(6): 393–408. Dostupné z DOI: <http://dx.doi,org/10.3233/RNN-211249>.
10. Dubin JM, Bennett NE, Halpern JA. The Adverse Impact of COVID-19 on Men´s Health. Curr Opin 2022; 32(2): 146–151. Dostupné z DOI: <http://dx.doi.org/10.1097/MOU.0000000000000966>.
11. Hirose R, Miyazaki H, Bandou R et al. Stability of SARS-CoV-2 and influenza virus varies across different paper types. J Infect Chemother 2022;2 8(2): 252–256. Dostupné z DOI: <http://doi: 10.1016/j.jiac.2021.11.006>.
12. Heesakkers H, van der Hoeven JG, Corsten S et al. Clinical Outcomes Among Patients With 1-year Survival Following Intensive Care Unit Treatment for COVID-19. JAMA 2022; 327(6): 559–565. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2022.0040>.
13. Chang WT, Toh HS, Liao CT et al. Cardiac Involvement of COVID-19: A Comprehensive Review. Am J Med Sci 2021; 361(1): 14–22. Dostupné z DOI: <http://doi:10.1016/j.amjms.2020.10.002>.Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseForum Diabetologicum
Nejčtenější tento týden
2022 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Infekcia novým koronavírusom COVID-19 a pľúcne komorbidity: pohľad pneumológa
- Diabetes mellitus a obezita (diabezita) a COVID-19
- Starostlivosť o diabetika s ochorením COVID-19: pohľad praktického lekára
- Pandémia COVID-19 a diabetes mellitus
- Diabetes mellitus a COVID-19: obojstranný vzťah
- Implikácie pre liečbu pacientov s diabetes mellitus a infekciou SARS-CoV-2
- Riziko liečby inhibítormi protónovej pumpy vo vzťahu ku ochoreniu SARS-CoV-2
- Pandémia COVID-19 a pľúcne ochorenia
- Pretrvávajúci syndróm po prekonaní infekcie COVID-19
- Liečba metformínom vo vzťahu ku ochoreniu SARS-CoV-2
- COVID 19 a diabetická ketoacidóza: kazuistiky a prehľad
- Kardiovaskulárna a renálna prognóza závisí aj od glykemického stavu osoby
- Novinky v liečbe semaglutidom na kongresoch ADA a EASD v roku 2021
- COVID-19, diabetes mellitus a komorbidity: pohľad kardiológa
- Forum Diabetologicum
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pretrvávajúci syndróm po prekonaní infekcie COVID-19
- Diabetes mellitus a COVID-19: obojstranný vzťah
- Diabetes mellitus a obezita (diabezita) a COVID-19
- Riziko liečby inhibítormi protónovej pumpy vo vzťahu ku ochoreniu SARS-CoV-2
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



