-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnostický význam chemokinu CXCL13 a protilátek proti C6 peptidu u pacientů s neuroborreliózou
Diagnostic relevance of the chemokine CXCL13 and anti-C6 peptide antibodies in patients with neuroborreliosis
Aim of the study:
The study was focused on testing the diagnostic value of detection of the chemokine CXCL13 (B lymphocyte chemoattractant) and anti-C6 peptide (synthetic peptide derived from B. burdorferi VlsE protein) antibodies in patients with neuroborreliosis (NB).Material and methods:
One hundred and twenty-nine patients with clinical suspicion of neuroinfection were included in the study. Eighty patients with NB (positive for antibodies in serum and CSF) were subdivided into four groups (A1–A4) based on positivity/negativity of the antibody index (AI) and pleocytosis. The control group was composed of 49 patients with a negative AI and absence of CSF pleocytosis. Chemokine CXCL13 and anti-C6 antibodies were examined by commercial kits (Human CXCL13/BLC/BCA-1 Immunoassay, R&D Systems, INC, USA and C6 B. burgdorferi (Lyme) ELISA, Immunetics Inc. USA). The CXCL13 cut-off values were set to ≥ 130 pg/ml for the CSF and ≥ 62 pg/ml for the serum.Results:
The highest CSF levels of CXCL13 chemokine were found in group A1 (pleocytosis, AI positive), and they were significantly higher (p < 0.001) comparing with other groups except A3 (pleocytosis, AI negative; p = 0.04). Group A3 also showed significantly higher levels of CXCL13 than groups A2 (without pleocytosis, AI positive; p = 0.005), A4 (without pleocytosis, AI negative), and B (p < 0.001). The differences in the serum CXCL13 levels between groups were non-significant.
The serum anti-C6 antibodies were detected in all NB groups and the positivity rates did not differ between groups (92%) except for A3 where 55% of the patients were positive. In the CSF, the highest anti-C6 sensitivity was found in the patients with a positive AI (A1 88.6%; A2 76.9%) while in the groups with a negative AI, it was low (A3 25%; A4 0%). In group B, anti-C6 antibodies were not detected.Conclusion:
The highest CSF CXCL13 levels were found in early stage NB. Elevated CXCL13 concentrations correlate better with pleocytosis than with AI positivity; however, there exist some patients with a positive AI who have low CXCL13 levels. These patients are most probably those in the late – subacute stage of neuroinfection. The CXCL13 testing seems to be the most diagnostically helpful in the acute stage of NB where AI is still negative. The clinical sensitivity of the C6 ELISA test appears to be insufficient for CSF examination under our conditions. On the contrary, the specificity of this test was proven high, because none of the controls tested positive.KEYWORDS:
neuroborreliosis – anti-C6 peptide antibodies – CXCL13 chemokine – diagnostics
Autoři: D. Pícha; L. Moravcová; D. Smíšková
Působiště autorů: Klinika infekčních nemocí, Univerzita Karlova, 2. lékařská fakulta a Nemocnice Na Bulovce, Praha
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 66, 2017, č. 2, s. 80-85
Kategorie: Původní práce
Souhrn
Cíl práce:
Studie byla zaměřena na ověření klinického významu stanovení chemokinu CXCL13 (chemoatraktant pro B lymfocyty) a protilátek proti C6 peptidu (syntetického antigenu odvozeného z VlsE proteinu B. burgdorferi) u pacientů s neuroborreliózou (NB).Materiál a metody:
Ve studii bylo hodnoceno 129 pacientů. Z toho 80 pacientů s NB (pozitivní antiborreliové protilátky v krvi i moku) bylo dále rozděleno do čtyř skupin (A1–A4) na základě pozitivity/negativity protilátkového indexu (AI) a pleocytózy. Kontrolní skupinu (B) tvořilo 49 pacientů s negativními antiborreliovýmí protilátkami i negativním cytologickým nálezem. Chemokin CXCL13 a anti C6 protilátky byly vyšetřovány komerčními soupravami (Human CXCL13/BLC/BCA-1 Immunoassay ,R&D Systems, INC, USA; C6 B. burgdorferi (Lyme) ELISA, Immunetics INC. USA). Cut-off hranice CXCL13 pro mozkomíšní mok byla stanovena na ≥ 130 pg/ml a pro sérum na ≥ 62 pg/ml.Výsledky:
Nejvyšší koncentrace CXCL13 chemokinu v moku byly nalezeny ve skupině A1 (pleocytóza, pozitivní AI) a byly signifikantně vyšší v porovnání s ostatními skupinami (p < 0,001), kromě skupiny A3 (pleocytóza, negativní AI, (p = 0,04). Skupina A3 měla také signifikantně vyšší koncentrace CXCL13 oproti skupinám A2 (bez pleocytózy, pozitivní AI; p = 0,005), A4 (bez pleocytózy, AI negativní) a B (p < 0,001). Rozdíly v koncentraci CXCL13 v krvi mezi jednotlivými skupinami nebyly statisticky významné. Anti C6 protilátky v séru byly prokázány ve všech skupinách pacientů s NB a jejich výsledky se prakticky nelišily (92 % pozitivních), kromě skupiny A3, kde bylo pozitivních 55 % pacientů. V moku byla nejvyšší senzitivita zachycena u pacientů s pozitivním AI (A1 88,6 %; A2 76,9 %), u pacientů s negativním AI byla senzitivita nízká (A3 25 %; A4 0 %). V kontrolní skupině nebyly anti C6 protilátky prokázány.Závěr:
Nejvyšší koncentrace chemokinu CXCL13 v moku byly nalezeny v časném stadiu NB. Zvýšená koncentrace chemokinu CXCL13 koreluje lépe s pleocytózou než pozitivitou AI, existuje část pacientů s pozitivním AI, kteří mají nízkou koncentraci CXCL13. Zde se jedná nejspíše o pacienty v subakutním stadiu onemocnění. Vyšetření CXCL13 by mohlo být využito zejména u pacientů v akutní fázi NB s dosud negativním AI. Klinická senzitivita C6 ELISA testu se jeví v našich podmínkách zejména pro mozkomíšní mok jako nedostačující. Naopak specifita použité metody byla vysoká, protože ani jeden pozitivní pacient nebyl zjištěn v kontrolní skupině.KLÍČOVÁ SLOVA:
neuroborrelióza – C6-peptid – protilátky – CXCL13 chemokin – diagnostikaÚVOD
Lymeská borrelióza (LB) je jedno z nejrozšířenějších klíšťaty přenášených onemocnění v Evropě a Severní Americe. Vyvolavatelem onemocnění je spirochéta Borrelia burgdorferi sensu lato [1]. LB postihuje více orgánových systémů, přičemž neuroborrelióza (NB) je v Evropě nejčastější forma diseminovaného stadia této infekce [2]. Diagnóza neuroborreliózy je založena na neurologických symptomech, nejčastěji je to obrna lícního nervu, subakutní polyradikulitida (Bannwarthův syndrom) a serózní menigitida, které jsou doplněny laboratorním vyšetřením – průkazem intratekální syntézy specifických antiborreliových protilátek a pleocytózou v mozkomíšním moku. Avšak pleocytóza může někdy chybět a intratekální syntéza (protilátkový index, AI) může být negativní – zejména v časné fázi onemocnění. Na druhou stranu AI může být pozitivní týdny i měsíce po úspěšné antibiotické terapii [3]. Z tohoto důvodu jsou hledány nové biologické markery, které by pomohly onemocnění správně diagnostikovat. V posledních letech byl s tímto záměrem testován diagnostický význam chemokinu CXCL13 a protilátek proti C6 peptidu (syntetickému antigenu odvozenému z VlsE proteinu B. burgdorferi), a to zejména pro časnou diagnostiku NB. CXCL13 je účinný chemoatraktant pro B lymfocyty a u NB je v mozkomíšním moku přítomen hlavně na počátku onemocnění [4, 5]. Přítomnost protilátek proti C6 peptidu byla v akutní fázi NB také studována, i když s nejednoznačnými výsledky [6, 7]. V předkládané studii jsme se pokusili vyhodnotit význam stanovení uvedených markerů v séru a mozkomíšním moku u skupiny pacientů s podezřením na neuroborreliózu (klinický obraz kompatibilní s NB, pozitivita antiborreliových protilátek v séru i v likvoru).
SOUBOR PACIENTŮ A METODIKA
V prospektivně koncipované studii bylo sledováno 129 pacientů s klinickými příznaky suspektní neuroinfekce; 80 pacientů s neuroborreliózou, 49 pacientů, kde nebyla NB diagnostikována (skupina B) bylo použito jako kontroly.
Mezi pacienty s NB byli zařazeni jak pacienti s jednoznačně potvrzenou NB, kteří splňovali EFNS kritéria (typický neurologický obraz, pleocytóza v moku, lokální syntéza specifických protilátek v moku [8], tak také pacienti, kteří splňovali kritéria NB jen částečně (negativní cytologický nález v likvoru, nepotvrzená intratekální syntéza). Diagnóza tedy byla v těchto případech hodnocena jako „pravděpodobná“ nebo „možná“. Soubor byl proto dále stratifikován na skupiny A1 až A4 (tab. 1). Celkový efekt léčby byl hodnocen 3 měsíce po ukončení antibiotické terapie ve škále 1–5, přičemž stupeň 1 znamenal úpravu ad integrum, stupeň 5 beze změny výchozího stavu před léčbou.
Tab. 1. Rozdělení pacientů do skupin podle kritérií neuroborreliózy AB protilátky, AI protilátkový index Table 1. Stratification of patients into groups according to the criteria of neuroborreliosis AB antibodies, AI antibodies index 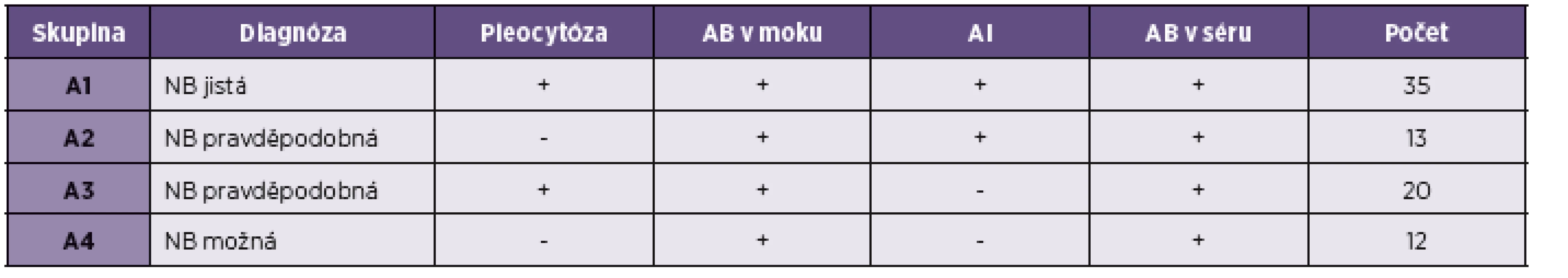
Pacienti v kontrolní skupině (B) byli hospitalizováni s klinickou suspekcí na neuroinfekci, která ale nebyla laboratorně prokázána. Pacienti měli normální laboratorní nález v mozkomíšním moku a nebyly u nich prokázány antiborreliové protilátky. Nejčastější diagnózou byla akutní respirační infekce. Dominující klinická symptomatika byla následující: horečka (20 pacientů), cefalea (15), neurologická symptomatika (13 z toho Bellova paréza 7), jiná (32). Žádný z pacientů neměl lues ani autoimunitní onemocnění, průkaz virových agens v likvoru (PCR) nebyl proveden, nebo byl negativní.
Všichni pacienti byli hospitalizováni, pacienti s NB byli léčeni antibiotiky, jejichž volba a délka podávání závisela na ošetřujících lékařích (3 týdny; většina ceftriaxon, 4 pacienti – deoxymykoin). Antibiotická léčba byla zahájena po odběru krve a moku na vyšetření. Studie byla schválena Etickou komisí Nemocnice Na Bulovce.
Stanovení specifických protilátek bylo prováděno komerční soupravou ELISA-Viditest anti-borrelia recombinant IgG VlsE/IgM (VIDIA s. r. o. ČR). Výsledky byly konfirmovány Western blottingem (Blot-Line Borrelia HGAIgM/HGAIgG TestLine, Clinical diagnostic s. r. o. ČR).
Protilátkový index (AI) byl počítán programem VidiTab (Vidia s. r. o. ČR). Hodnota indexu AI ≥ 1,5 ukazovala na intratekální syntézu specifických protilátek.
Protilátky proti C6 peptidu byly vyšetřovány soupravou C6 B. burgdorferi (Lyme) ELISA (Immunetics INC. USA). Test je validován pro stanovení protilátek v séru, v mozkomíšním moku se používá pouze pro výzkumné účely. Séra byla vyšetřována podle postupu, který udává výrobce, mozkomíšní mok byl naředěn 1 : 5 [6] a dále vyšetřován jako sérum.
Lymfokin CXCL13 byl vyšetřován soupravou Human CXCL13/BLC/BCA-1 Immunoassay (R&D Systems, INC, USA.). Uvedený set je využíván pouze pro výzkumné účely, není určen pro rutinní vyšetřování. Analýza CXCL13 byla prováděna postupem doporučovaným výrobcem. Všechny vzorky byly vyšetřovány duplicitně. Minimální detekovatelná koncentrace CXCL13 byla 7,8 pg/ml. Vzorky s koncentrací > 500 pg/ml (mimo rozsah kalibrační křivky) byly naředěny kalibračním pufrem 10krát a 100krát, poté znovu analyzovány [9].
Statistická analýza: Cut-off hranice pro koncentraci CXCL13 chemokinu v mozkomíšním moku ani v séru není definována. Na rozlišení mezi jednotlivými diagnostickými skupinami byly výsledky koncentrací CXCL13 statisticky vyhodnoceny pomocí softwaru Stata release 9.2 (Stata Corp LP, College Station, TX). Pro porovnání skupin byl použit Mannův-Whitneyův test. Podle kritéria maximalizace součtu dosažené senzitivity a specificity (ROC analýza) byla cut-off pro mozkomíšní mok stanovena na ≥ 130 pg/ml a pro sérum na ≥ 62 pg/ml.
VÝSLEDKY
Ve skupině pacientů s NB bylo celkem 54 nemocných s aseptickou neuroinfekcí (serózní meningitida 20; serózní meningitida s parézou n. VII. 16; meningoradikulitida 12; encefalitida s dalším postižením 6). Izolovaná paréza n. VII se vyskytla u pěti pacientů, periferní neuropatie u 12 a nespecifické příznaky (artralgie, myalgie, únava aj.) 9krát. Průměrný věk pacientů činil 45,5 roku, poměr ženy/muži byl 33/47.
Celkový efekt léčby byl následující: 48 pacientů (58,8 %) se upravilo úplně (stupeň 1), 18 pacientů (22,3 %) mělo velmi dobrý výstup (stupeň 2), 8 pacientů bylo hodnoceno jako (3), žádný na stupni (4) a 6 na stupni (5).
Tabulka 2 a grafy 1 a 2 shrnují výsledky stanovení koncentrace CXCL13 v krvi a mozkomíšním moku u jednotlivých skupin pacientů. Nejvyšší koncentrace CXCL13 v mozkomíšním moku byly nalezeny u skupiny A1 (pleocytóza, pozitivní AI) a tyto parametry odlišovaly skupinu od všech ostatních. Medián koncentrace CXCL13 byl 1 525,06 pg/ml. Skupina A3 (pleocytóza, negativní AI) měla hladinu CXCL13 poněkud nižší, ale stále ještě vysokou – medián 52,6 pg/ml. Koncentrace ve skupinách A2 (bez pleocytózy, AI pozitivní) a A4 (bez pleocytózy, AI negativní) měly koncentrace CXCL13 podstatně nižší hodnotu, medián byl < 7,8 mg/ml (mez detekovatelnosti testu). Párové porovnání prokázalo, že koncentrace CXCL13 ve skupině A1 byly signifikantně vyšší, v porovnání se všemi ostatními skupinami (p < 0,001) kromě A3 (p = 0,04). Podobně byla koncentrace CXCL13 signifikantně vyšší ve skupině A3 oproti ostatním skupinám (p < 0,001 A4, B; p = 0,005 A2). Hodnoty ve skupině A2 byly lehce vyšší než ve skupině A4, rozdíly však nebyly signifikantní.
Tab. 2. Stanovení koncentrace CXCL13 (pg/ml) a protilátek proti C6 peptidu AB protilátky Table 2. Determination of CXCL13 concentrations (pg/ml) and C6 peptide antibody detection AB antibodies 
Graf 1. Výsledky (%) stanovení CXCL13 v jednotlivých skupinách v mozkomíšním moku Figure 1. CSF CXCL13 chemokine (%) into particular groups of patients 
Graf 2. Výsledky (%) stanovení CXCL13 v jednotlivých skupinách v krvi Figure 2. Blood CXCL13 chemokine (%) into pariticular groups of patients 
Při vyšetření krve byly nalezeny minimální rozdíly v koncentraci CXCL13 mezi skupinami, ani v jednom případě nebyly statisticky významné.
Přehled výsledků stanovení anti C6 protilátek v séru a mozkomíšním moku je uveden v tabulce 2. V séru se výsledky stanovení anti C6 protilátek mezi skupinami A1, A2 a A4 prakticky nelišily, kromě skupiny A3. Ve srovnání s průkazem antiborreliových protilátek standardní metodikou (ELISA, WB) bylo anti C6 testem zachyceno o 10 % méně pacientů a ve skupině A3 dokonce o polovinu méně. Výraznější diference ve stanovení anti C6 protilátek byly nalezeny při vyšetření mozkomíšního moku. U pacientů s pozitivním protilátkovým indexem nebyly anti C6 protilátky prokázány ve skupině A1 u 11 % vzorků a ve skupině A2 u 23 %. Z tohoto výsledku vyplývá, že za podmínek použitých ve studii by minimálně 1/4 pacientů nebyla za použití tohoto sérologického testu diagnostikována jako NB. U séropozitivních pacientů bez intratekální syntézy antiborreliových protilátek zůstalo negativních ve skupině A3 dokonce 75 % vyšetřených. Ve skupině A4 byl test zcela negativní.
Při porovnání výsledků stanovení anti C6 protilátek a koncentrace CXCL13 chemokinu v mozkomíšním moku jsme sloučili pacienty s pozitivním a negativním protilátkovým indexem. Důvodem k tomuto přístupu bylo snížit co možná nejméně hendikep nízkých čísel. Výsledky jsou shrnuty v tabulce 3 a grafech 3 a 4. Protilátky proti C6 proteinu i zvýšená koncentrace chemokinu CXCL13 byla zjištěna u 65 % pacientů s pozitivním protilátkovým indexem a pouze u 13 % ze skupiny s negativním indexem. Ve skupině s negativním indexem je patrný i vyšší podíl současně negativních výsledů u obou sledovaných markerů (81 %). Pacienti s pozitivitou protilátek anti-C6 (v krvi a moku) a nízkou hladinou CXCL13 (celkem 10; viz tab. 3), se podle klinických příznaků nelišili od ostatních. Pět z nich bylo ve skupině A1 a 5 ve skupině A2. Pacienti s diskrepancí ve výsledku anti-C6 v moku a séru (celkem 3; mok negativní, krev pozitivní) a zvýšenou hladinu CXCL13 patřili do skupiny A3.
Tab. 3. Porovnání vyšetření chemokinu CXCL13 s anti C6 protilátkami v mozkomíšním moku u pacientů s pozitivním a negativním protilátkovým indexem Table 3. Comparison of the detection of CXCL13 chemokine and antibodies to the C6 peptide in CSF of patients with positive and negative antibody index 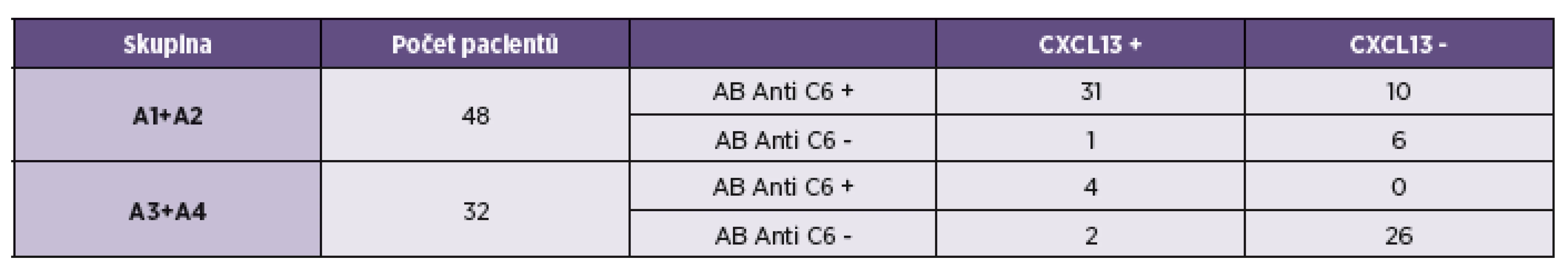
Graf 3. CXCL13 chemokin a anti C6 protilátky u pacientů s pozitivním protilátkovým indexem Figure 3. CXCL13 chemokine and antibodies to the C6 peptide in patients with positive antibody index 
Graf 4. CXCL13 chemokin a anti C6 protilátky u pacientů s negativním protilátkovým indexem Figure 4. CXCL13 chemokine and antibodies to the C6 peptide in patients with negative antibody index 
DISKUSE
Cílem této studie bylo zjistit, zda chemokin CXCL13 nebo protilátky proti C6 peptidu mohou pomoci při diagnostice NB především v nejednoznačných případech, kdy chybí některá z diagnostických kritérií NB. Jak již bylo publikováno, koncentrace CXCL13 v mozkomíšním moku je zvýšena v akutní fázi aseptických a purulentních zánětů CNS včetně NB [4, 5, 9, 10, 11,12]. Také naše výsledky prokázaly zvýšené koncentrace CXCL13 u pacientů s NB i zajímavé rozdíly v rámci jednotlivých podskupin. Absolutně nejvyšší koncentrace i nejvyšší podíl zvýšených hodnot byl ve skupině A1. V této skupině zvýšená koncentrace CXCL13 významně podporuje diagnózu akutní NB, která je však již dostatečně podepřena průkazem pleocytózy a pozitivním AI. Hlavní přínos tohoto vyšetření byl proto očekáván u ostatních, obtížněji definovaných skupin NB. To se potvrdilo u skupiny A3 (pleocytóza, negativní AI). Zde by bylo možné interpretovat zvýšenou hladinu CXCL13 jako časnou fázi onemocnění, kdy ještě nedochází k intratekální produkci specifických antiborreliových protilátek. U skupiny A2 , ačkoliv patří do stejné diagnostické kategorie NB podle pravidel EFNS jako A3 „NB pravděpodobná“ je situace odlišná. Jednalo se o pacienty s pozitivní lokální syntézou protilátek a absencí pleocytózy v moku. Současně ale koncentrace CXCL13 byla nízká – srovnatelná se skupinou A4 a kontrolní skupinou B. Pacienti zařazení do skupiny A2 měli subakutní fázi infekce. Tento fakt podporují zjištění, že pacienti měli prokazatelně delší průběh onemocnění před léčbou. U těchto pacientů byla pozorována také nižší klinická odpověď na antibiotickou terapii na rozdíl od skupin A1 a A3. Důvodem by mohlo být opožděné zahájení léčby nebo vyčerpání kompenzačních možností organismu (nervového systému) během dlouho spontánně probíhající infekce. U poslední skupiny A4, nejméně laboratorně podložené, která podle EFNS klasifikace patří do non-NB kategorie, nízká hladina CXCL13 koreluje s nízkou pravděpodobností aktivní NB u těchto pacientů.
Dalším důležitým faktorem je hodnota cut-off koncentrace CXCL13, kterou výrobce soupravy neuvádí. Přestože se ve všech dosud publikovaných studiích používá diagnostická souprava od jednoho stejného výrobce, jsou nastavené hodnoty cut-off CXCL13 v mozkomíšním moku v jednotlivých pracích dosti rozdílné (např. Wutte et al. [13] 125 pg/ml, van Burget et al. [6] 250 pg/ml, Hytönen et al. [9] 415 pg/ml, Tjernberg et al. [14] 142 pg/ml, Pícha et al. [15] 130 pg/ml). Důvodem mohou být odlišná klinická a laboratorní kritéria, podle kterých jsou pacienti zařazováni do příslušných studií, nebo rozdílné složení kontrolních skupin. Z tohoto důvodu by bylo žádoucí do budoucna stanovit kritéria (klinická i metodologická), která by pomohla definovat fyziologickou koncentraci CXCL13 v mozkomíšním moku. Stanovení koncentrace CXCL13 v krvi nemá praktický význam. Dokládají to nesignifikantní rozdíly mezi kontrolami a pozitivními skupinami a také dříve publikované zkušenosti [16].
Stanovení anti C6 protilátek v mozkomíšním moku u pacientů s pozitivním AI prokázalo senzitivitu 85,4 %. Tato hodnota je vyšší ve srovnání s hodnotou 68 %, kterou ve své práci uvádí Vermeersch et al. [17], ale podstatně nižší než uvádí ve svých studiích Skarpaas et al. [7] 98 % a van Burgel et al. [6] 95 %. Dosažená vysoká senzitivita, kterou udávají posledně dva jmenování autoři, bude zřejmě souviset s výběrem pacientů. Senzitivita v těchto pracích byla počítána výhradně ze skupiny pacientů s jistou NB (splněna všechna kritéria EFNS) a s krátkou dobou obtíží před léčbou. Pacienti s pravděpodobnou NB byli vyloučeni. U námi vyšetřených pacientů bez prokázané intratekální syntézy s pleocytózou byla senzitivita testu nízká (25%). Klinické použití testu se tedy v této aplikaci nejeví příliš přínosné. Avšak pokud je u těchto pacientů silné podezření na neuroborreliózu, vyšetření anti C6 protilátek by mohlo být využito jako doplňující test, neboť záchytnost sérologických testů není jak známo nikdy stoprocentní [18]. Úplná negativita anti C6 protilátek ve skupině A4 podporuje fakt, že u těchto pacientů nešlo o NB.
Výsledky stanovení anti C6 protilátek v séru ve skupině pacientů s pozitivním protilátkovým indexem jsou plně ve shodě s již dříve publikovanými výsledky [7, 19], které udávají senzitivitu anti C6 testu 89–98 % ve srovnání s klasickými ELISA metodami. Zajímavý je však výsledek vyšetření u pacientů ve skupině A3. Z 20 AI negativních pacientů s pleocytózou mělo pouze 11 (55 %) pozitivní C6 test v séru. Jednoznačné vysvětlení neexistuje, ale výsledky naznačují, že senzitivita C6 testu je v tomto případě nedostačující, i když se jedná o pacienty s krátkou inkubační dobou onemocnění, respektive časnou borreliovou infekcí, u kterých by se pozitivita anti C6 protilátek podle literárních zkušeností předpokládala [14]. Přitom vstupní anamnestická data a neurologické symptomy mezi všemi skupinami (A1 až A4) byly podobné. Výsledky stanovení anti C6 protilátek v séru ve skupině A4 koreluje se stanovením antiborreliových protilátek standardní metodikou, ale pro diagnostiku NB nemá nový praktický přínos.
Při současném vyšetření chemokinu CXCL13 a anti C6 protilátek v moku u pacientů s prokázanou intratekální syntézou antiborreliových protilátek (A1, A2) mělo shodně pozitivní a negativní výsledky 37 (78 %) vyšetřených. Rozdíly byly zjištěny u 11 pacientů. V deseti případech byly detekovány anti C6 protilátky při negativitě CXCL13 cytokinu. Domníváme se, že jednoznačné kvalitní vysvětlení tohoto jevu nelze na základě provedených vyšetření podat. Samozřejmě lze uvažovat o tom, zda anti C6 protilátky nejsou častěji pozitivní v časné fázi infekce. To by mohlo být předmětem dalšího výzkumu. U pacientů s negativním protilátkovým indexem (A3, A4) je situace výrazně lepší, shodné výsledky byly nalezeny u 30 (94 %), rozdíly byly pouze ve dvou případech. Jednalo se o pacienty s pleocytózou a negativními anti C6 protilátkami, u kterých byla naměřena zvýšená koncentrace CXCL13 chemokinu. Na základě těchto výsledků usuzujeme, že se u obou pacientů jednalo o časnou fázi infekce.
ZÁVĚR
Zvýšená koncentrace CXCL13 chemokinu v mozkomíšním moku byla prokázána u pacientů v časné fázi NB a velmi dobře korelovala s pleocytózou. Z tohoto důvodu lze uvažovat o maximálním přínosu vyšetření CXCL13 především u pacientů v akutní fázi NB, kdy ještě není přítomna intratekální syntéza antiborreliových protilátek. Na druhou stranu existuje značná část pacientů s NB, kteří pleocytózu v moku nemají, zatímco protilátkový index je pozitivní a koncentrace CXCL13 je nízká. Zde by stanovení nízkých hladin CXCL13 podporovalo diagnózu odeznívající infekce. Jednalo se totiž především o pacienty v subakutním stadiu, kdy byl pozorován delší průběh onemocnění. Diagnostické využití CXCL13 chemokinu by tedy mohlo být přínosem především v těchto klinicky a laboratorně hůře definovaných případech. Podmínkou širšího rozšíření testu v klinické praxi je však standardizace metodiky, zejména stanovení cut-off hodnoty.
Stanovení protilátek proti C6 proteinu mělo u pacientů s NB v mozkomíšním moku nízkou senzitivitu v porovnání s ELISA testem využívajícím směs rekombinantních borreliových antigenů. Je však třeba zdůraznit, že výrobcem je test validován pouze pro vyšetření séra. Pro potenciální využití stanovení anti C6 protilátek v diagnostice NB bude muset dojít do budoucna k jeho optimalizaci, zejména pokud by byl použit pro vyšetření v mozkomíšním moku. Naproti tomu specificita testu se jeví jako vysoká, neboť v kontrolním souboru nebyl zachycen žádný pozitivní pacient.
Poděkování
Autoři by rádi poděkovali RNDr. Marku Malému, CSc., za odborné konzultace při statistickém vyhodnocování výsledků.
Do redakce došlo dne 13. 10. 2016.
Adresa pro korespondenci:
doc. MUDr. Dušan Pícha, CSc.
Nemocnice Na Bulovce
Budínova 67/2
180 81 Praha 8-Libeň
e-mail: dusan.picha@bulovka.cz
Zdroje
1. Sanchez E, Vannier E, Gary P, et al. Diagnosis, treatment, and prevention of Lyme disease, human granulotic anaplasmosis, and babesiosis. JAMA, 2016; 315 (16): 1767–1777.
2. Halperin JJ. Nervous system Lyme disease. Clin Lab Med, 2015; 35 (4): 779–795.
3. Hammers-Berggren S, Hansen K, Lebech AM, et al. Borrelia burgdorferi-specific intrathecal antibody production in neuroborreliosis: a folow-up study. Neurology, 1993; 43 (1): 169–175.
4. Ljøstad U, Mygland A. CSF B – lymphocyte chemoattractant (CXCL13) in the early diagnosis of acute Lyme neuroborreliosis. J Neurol, 2008; 255 (5): 732–737.
5. Rupprecht TA, Pfister HW, Angele B, et al. The chemokine CXCL13 (BLC): A putative diagnostic marker for neuroborreliosis. Neurology, 2005; 65(3); 448–450.
6. van Burgel ND, Branderburg A, Gerritsen HJ, et al. High sensitivity and specificity of the C6-peptide ELISA on cerebrospinal fluid in Lyme neuroborreliosis patients. Clin Microbiol Infect, 2011; 17 (10): 1495–1500.
7. Skarpaas T, Ljøstad U, Søbye M, et al. Sensitivity and specificity of a commercial C6 peptide enzyme immuno assay in diagnosis of acute Lyme neuroborreliosis. Eur J Clin Microbiol Infect Dis, 2007; 26 (9): 675–677.
8. Mygland A, Ljøstad U, Fingerle V, et al. EFNS guidelines on the diagnosis and management of European Lyme neuroborreliosis. Eur J Neurol, 2010; 17 (1): 8–16.
9. Hytönen J, Kortela E, Waris M, et al. CXCL13 and neopterin concentrations in cerebrospinal fluid of patients with Lyme neuroborreliosis and other diseases that cause neuroinflammantion. J Neuroinflamm, 2014; 11 : 103. doi: 10. 1186/1742-2094-11-103.
10. Kowarik MC. Cepok S, Sellner J, et al. CXCL13 is the major determinant for B cell recruitment to the CSF during neuroinflammation. J Neuroinflamm, 2012; 9 : 93. doi: 10. 1186/1742-2094-9-93.
11. Rupprecht TA, Plate A, Adam M, et al. The chemokine CXCL13 is a key regulator of B cell recruitment to the cerebrospinal fluid in acute Lyme neuroborreliosis. J Neuroinflamm, 2009; 6 : 42. doi: 10.1186/1742-2094-6-42.
12. Dersch R, Hottenrott T, Senel M, et al. The chemokine CYXCL13 is elevated in cerebrospinal fluid of patients with neurosyphilis. Fluids Barriers CNS, 2015; 12 : 12. doi: 10.1186/sl2987-015-0008-8.
13. Wutte N, Berghold A, Löffler S, et al. CXCL13 in pediatric and adult neuroborreliosis. Acta Neurol Scand, 2011; 124 (5): 321–328.
14. Tjernberg I, Henningsson AJ, Eliasson I, et al. Diagnostic performance of cerebrospinal fluid chemokine CXCL13 and antibodies to C6-peptide in Lyme neuroborreliosis. J Infect, 2011; 62 (2): 149–158.
15. Pícha D, Moravcová L, Smíšková D. Prospective study on the chemokine CXCL13 in neuroborreliosis and other aseptic neuroinfections. J Neurol Sci, 2016; 15; 368 : 214–20. doi: 10.1016/j.jns.2016.05.059.
16. Wutte N, Berghold A, Krainberg I, et al. Serum CXCL13 chemokine is not a marker for active Lyme borreliosis. Acta Derm Venerol, 2011; 91 (6): 724–724.
17. Vermeesch P, Resseler S, Nackers E, et al. The C6 Lyme antibody test has low sensitivity for antibody detection in cerebrospinal fluid. Diagn Microbiol Infect Dis, 2009; 64 (3): 347–349.
18. Leeflang MMG, Ang CW, Berkhout J, et al. The diagnostic accurancy of serological tests for Lyme borreliosis in Europe: a systematic review and meta-analysis. BMC Infect Dis, 2016; 16 : 140 doi: 10.1186/s12879-016-1468-4.
19. Tjernberg I, Schön T, Ernerudh J, et al. C6-peptide serology as diagnostic tool in neuroborreliosis. APMIS, 2008; 116 (5): 393–399.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2017 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Geny virulence a rezistence k antibiotikům u Campylobacter spp. v České republice
- Efekt adenotómie, alergie a fajčenia na mikrobiálnu kolonizáciu horného aerodigestívneho traktu u detí
- Vliv sepse na úmrtnost v České republice: analýza vícečetných příčin úmrtí
- Diagnostický význam chemokinu CXCL13 a protilátek proti C6 peptidu u pacientů s neuroborreliózou
- Průkaz bakteriálních agens z hemokultur metodou fluorescenční in situ hybridizace
- Štěnice domácí (Cimex lectularius) – biologie, zdravotnický význam, možnosti detekce a hubení
- K významnému životnímu výročí MUDr. Mariny Maixnerové, CSc.
- Nemoc z kočičího škrábnutí – opomíjená zoonóza
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostický význam chemokinu CXCL13 a protilátek proti C6 peptidu u pacientů s neuroborreliózou
- Nemoc z kočičího škrábnutí – opomíjená zoonóza
- Štěnice domácí (Cimex lectularius) – biologie, zdravotnický význam, možnosti detekce a hubení
- Vliv sepse na úmrtnost v České republice: analýza vícečetných příčin úmrtí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



