-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Průkaz životaschopných, metabolicky aktivních kvasinkových buněk pomocí kolorimetrického média
Detection of Viable Metabolically Active Yeast Cells Using a Colorimetric Assay
The increasing concern of yeasts able to form biofilm brings about the need for susceptibility testing of both planktonic and biofilm cells. Detection of viability or metabolic activity of yeast cells after exposure to antimicrobials plays a key role in the assessment of susceptibility testing results. Colorimetric assays based on the color change of the medium in the presence of metabolically active cells proved suitable for this purpose. In this study, the usability of a colorimetric assay with the resazurin redox indicator for monitoring the effect of yeast inoculum density on the reduction rate was tested. As correlation between the color change rate and inoculum density was observed, approximate quantification of viable cells was possible. The assay would be of relevance to antifungal susceptibility testing in both planktonic and biofilm yeasts.
Key words:
yeasts – Candida – biofilm – Alamar blue – resazurin – reduction – colorimetric assay.
Autoři: F. Růžička; V. Holá
Působiště autorů: Mikrobiologický ústav LF a FN u sv. Anny v Brně
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 57, 2008, č. 1, s. 4-7
Souhrn
Rostoucí význam kvasinek schopných tvořit biofilm sebou nese nutnost testování citlivosti jak pro jejich planktonické formy, tak pro formy biofilmové. Průkaz životaschopnosti, případně metabolické aktivity kvasinkových buněk po expozici vůči antimikrobiální látce má klíčovou úlohu při hodnocení výsledků. K tomuto účelu se s výhodou používají kolorimetrická média, která na přítomnost metabolicky aktivních buněk reagují změnou barvy. V této práci byla ověřena možnost využít kolorimetrického média s redoxním indikátorem resazurinem ke sledování vlivu hustoty kvasinkového inokula na rychlost redukce tohoto indikátoru. Bylo zjištěno, že rychlost barevné změny odpovídá hustotě inokula a tímto způsobem lze orientačně kvantifikovat množství životaschopných buněk. Test by bylo možno s výhodou použít nejen pro zjišťování citlivosti planktonických forem kvasinek k antimykotikům, ale i forem biofilmových.
Klíčová slova:
kvasinky – Candida – biofilm – Alamar blue – resazurin – redukce – kolorimetrické médium.Kvasinky patří mezi významné původce nozokomiálních infekcí, jejichž význam vzrostl zvláště v souvislosti s rostoucím počtem imunokompromitovaných pacientů, podáváním antibiotik a stále častějším používáním implantátů v současné medicíně. Zde se jako významný faktor virulence uplatňuje schopnost růstu ve formě biofilmu [4]. Stanovení citlivosti k antimykotikům i dezinfekčním prostředkům pak hraje klíčovou úlohu v boji s těmito infekcemi. Při testování účinku antimykotik a dezinfekčních látek na kvasinky, a zvláště na kvasinky rostoucí ve formě biofilmu, je problémem hodnocení přítomnosti životaschopných mikroorganismů [5, 8].
U planktonických forem se pro stanovení citlivosti asi nejčastěji používá diskových difuzních testů, přestože jejich spolehlivost není zrovna nejvyšší, a E-testů. U obou se zástava růstu mikrobů vlivem antimikrobiální látky projeví vznikem inhibiční zóny. Tyto poměrně snadno proveditelné a jednoduše odečitatelné testy však nelze použít pro zjišťování citlivosti biofilmových forem. Pro tento účel se používají metody založené na principu dilučních či mikrodilučních testů. Při těchto testech je zkoumaná kultura vystavena účinku různých koncentrací testované látky a poté je hodnocena přítomnost mikrobů buď rostoucích – při zjišťování minimální inhibiční koncentrace (MIC) a minimální biofilm inhibiční koncentrace (MBIC), či živých – při stanovení minimální baktericidní koncentrace (MBC) a minimální biofilm eradikující koncentrace (MBEC). Právě průkaz životaschopnosti kvasinkových buněk, případně jejich metabolické aktivity, po expozici vůči antimikrobiální látce hraje u těchto testů klíčovou úlohu pro správné hodnocení výsledků [5, 8 13]. Při stanovení MIC na základě změny turbidity média [10] se obvykle mikrobiální růst hodnotí u planktonických forem. Při testování citlivosti biofilmových forem, stejně jako při stanovení MBC, nejsou turbidimetrické metody příliš vhodné. Buňky v biofilmu, případně buňky v klidové fázi, které nerostou, nemusí zákal vytvořit. To pak může vést k falešně negativním výsledkům [13].
Další možností pro průkaz životaschopných buněk v kultuře vystavené antimikrobiální látce je vyočkování na pevná média a sledování tvorby kolonií. Tato metoda sice dává poměrně spolehlivé výsledky, je však pracná a časově náročná. U biofilmových forem je navíc komplikována skutečností, že je nejprve potřeba rozrušit vrstvu biofilmu na nosiči, nejčastěji pomocí ultrazvuku či vortexováním [3]. Při těchto postupech se výrazně zvyšuje riziko kontaminace vzorku a výsledky mohou být také zkresleny nedokonalou disociací buněčných agregátů.
Jako vhodné řešení detekce vitálních buněk se nabízí použití kolorimetrického média, které by změnou barvy indikovalo metabolickou aktivitu testovaných kvasinek. Pro zjišťování metabolické aktivity a tím i životaschopnosti kvasinkových buněk se často používá test, při kterém jsou tetrazoliové soli redukovány na barevné produkty – formazany [5, 8 13]. Princip dalších, ne příliš často využívaných kolorimetrických metod je založen na fermentaci sacharidů a tím pádem i okyselení média, což vede ke změně barvy přidaného indikátoru pH [6]. Tato metodika však zatím nedoznala většího rozšíření.
Perspektivní, levnou a jednoduchou metodou detekce vitálních buněk je použití kolorimetrického média s redoxním indikátorem resazurinem, který má v oxidované formě barvu sytě modrou a je-li redukován, zrůžoví [9]. Tato látka je hlavní součástí poměrně hojně využívaného redoxního indikátoru Alamar blue [12, 17]. Ve své práci jsme se zaměřili na posouzení možnosti využít resazurin pro kvantifikaci (semikvantifikaci) vitálních kvasinkových buněk v médiu a na zjištění citlivosti této metody.
Materiál a metody
Vliv koncentrace kvasinkových buněk na rychlost redukce resazurinu byl testován na planktonických formách kmenů Candida parapsilosis ATTC 90018, Candida tropicalis ATCC 750, Candida albicans ATTC90028 a ATCC 24433, z které byly získány české sbírky mikroorganismů. Z 48hodinových kultur testovaných kmenů kvasinek byly ve fyziologickém roztoku s fosfátovým pufrem (PBS) připraveny suspenze o hustotě odpovídající stupni 108 kvasinkových buněk/ml. Tyto suspenze byly dále decimálně ředěny PBS tak, že vznikla řada ředění s koncentracemi buněk101 – 107 buněk/ml. Koncentrace buněk v jednotlivých ředěních byla kontrolována jejich dalším ředěním a následným vyočkováním na Sabouraudův agar (HiMedia, Mumbai, Indie). Množství buněk, resp. CFU v suspenzi bylo vypočítáno na základě počtu narostlých kolonií po 48 hodinách kultivace při 30 °C.
Dvaceti mikrolitry každého ředění byly inokulovány tři jamky 96jamkové mikrotitrační destičky (GAMA Group, Trhové Sviny, Česká republika) s rovným dnem, které zároveň obsahovaly 170 μl média RPMI 1640 (HiMedia, Mumbai, Indie) pufrovaného pomocí 0,165 M morfolinopropansulfonové kyseliny (MOPS, Sigma, St. Luis, USA) na pH = 7,0. Do jamek bylo poté přidáno 10 μl 0,02% zásobního roztoku resazurinu. Zásobní roztok byl připraven rozpuštěním sodné soli resazurinu (Sigma, St. Luis, USA) v destilované vodě a sterilizován filtrací. Jako negativní kontrola sloužily jamky se 190 μl sterilního RPMI média a 10 μl zásobního roztoku resazurinu.
Inokulované mikrotitrační destičky byly kultivovány při 37 °C a po 4, 8, 18, 24, 48 a 72 hodinách byla vizuálně hodnocena změna barvy média a pro hodnocení stability barvy byly negativní kontroly dále sledovány i po týdnu kultivace za stejných podmínek. Za pozitivní výsledek byla považována změna barvy z modré na růžovo-fialovou až růžovou. Tmavě fialová barva byla ještě považována za negativní výsledek. Změna média byla hodnocena i pomocí spektrofotometru (Anthos Labtec Instruments 10.500, Salzburg, Austria) při vlnové délce 595 nm, referenční filtr 690 nm.
Výsledky a diskuse
Při vizuálním hodnocení změny barvy kolorimetrického média s resazurinem obsahující různé koncentrace kvasinek jsme zjistili, že koncentrace kvasinkových buněk 106 CFU/ml (CFU – Colony forming unit) vedla ke změně barvy u všech testovaných kmenů do 4–8 hodin. Při množství buněk v médiu 105 CFU/ml i 104 CFU/ml byla změna pozorovatelná za 18 hodin, u nižších koncentrací 103 CFU/ml a 102 CFU/ml za 24 hod. Koncentrace 101 CFU/ml se projevila změnou barvy až za 48 hodin. Redukci resazurinu, která je příčinou změny barvy média, jsme hodnotili na základě poklesu absorbance (A) měřené v oblasti absorpčního maxima resazurinu. Opticky snadno hodnotitelná změna barvy média, kdy došlo k zřetelnému zrůžovění, odpovídala na spektrofotometru naměřeným hodnotám absorbance (A595) v rozmezí 0,810 až 0,790. Dynamika růstu redukce resazurinu v médiu při jednotlivých koncentracích je vidět v grafu 1 a odpovídá vizuálnímu pozorování.
Obr. 1. Vliv koncentrace inokula na dynamiku redukce kolorimetrického média s resazurinem A595, absorbance měřená při λ = 595 nm; t, čas měření; K, negativní kontrola Fig. 1. Effect of inoculum concentration on the resazurin reduction rate in a colorimetric assay A595, absorbance measured at λ = 595 nm; t, measurement time; K, negative control 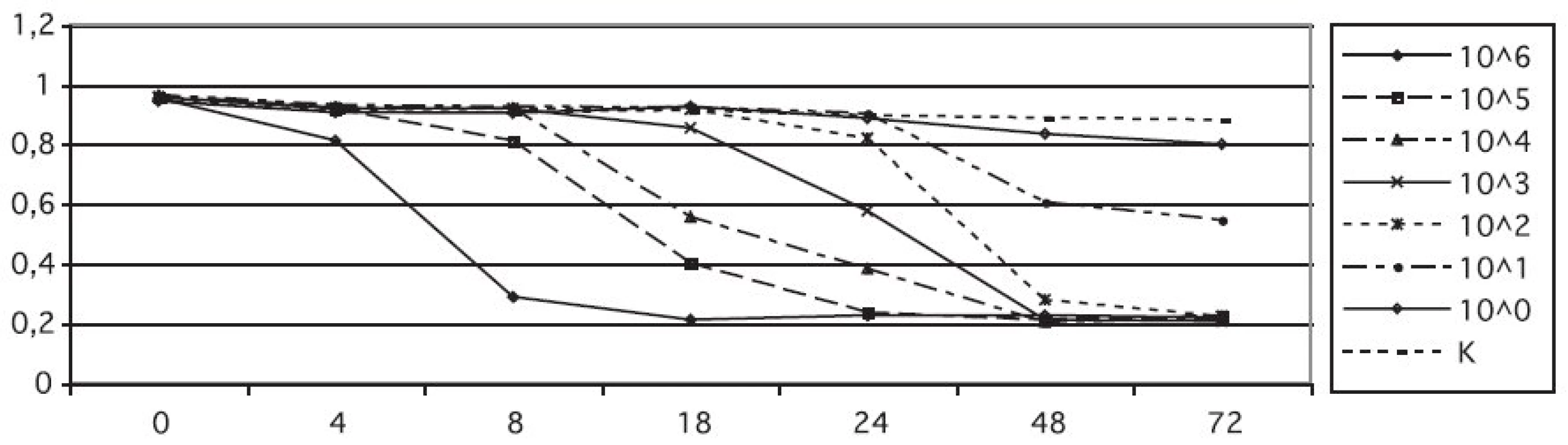
Potvrdili jsme také vysokou stabilitu barvy resazurinu ve sterilním médiu RPMI 1640. V jamkách negativních kontrol se sterilním médiem nedošlo k samovolné změně barvy ani po týdnu sledování a médium zůstalo modré. Také hodnota absorbance sterilního média nepřesáhla A595 = 0,880. V jiných médiích (BHI, živný bujon, Sabouraudův bujon) však docházelo poměrně rychle k samovolné redukci.
Využívání kolorimetrických metod pro detekci růstu či metabolické aktivity buněk založených na principu redoxních indikátorů je poměrně rozšířené. Mezi ně patří i tzv. Alamar blue, jejíž hlavní složku tvoří resazurin [12, 17]. Na redukci modrého resazurinu na růžovo-červený produkt resorufin se podílí enzymy s redukovanými nikotinamidadenindinukleotidfosfátem (NADPH), flavinadenindinukleotidem (FADH2), flavinmononukleotidem (FMNH2) a nikotinamidadenindinukleotidem (NADH) a také cytochromy [13]. Množství těchto látek je v rostoucích, metabolicky aktivních buňkách výrazně zvýšené a změna barvy média tak indikuje jejich přítomnost. Resazurin/Alamar blue je využíván např. pro detekci mikrobiální kontaminace mléka [11] a detekci přežívajících eukaryotických buněk v testech toxicity [10]. Řada autorů prokázala užitečnost doplnění standardních dilučních testů citlivosti resazurinem/Alamar blue, pro snazší hodnocení výsledků, u mnoha mikroorganismů, jako jsou enterokoky, stafylokoky[2], gramnegativní bakterie [1], mykobakteria [9], vláknité houby (Aspergillus) [7]. Zvláště dobře jsou zmapovány možnosti použití této metody při stanovení citlivosti u kvasinek [15, 18] a to i v komerčních testech SensititreYeast One (Trek Diagnostic Systems, Ohio, United States) [14]. Tento indikátor byl také s úspěchem použit pro testování citlivosti stafylokokového biofilmu [13].
Nabízí se tedy využití této metody pro testování citlivosti biofilmových forem kvasinek k antimykotikům. U kvasinkových biofilmů se dosud k hodnocení účinku antifungálních látek využívá především metod založených na průkazu přežívajících buněk pomocí redukce tetrazoliových solí, především MTT, 3-(4,5-dimethylthiazol-2-yl)-2,5-difenyl tetrazolium bromid, a XTT, sodná sůl kyseliny 3’-([1-fenylamino]-karbonyl)-3,4-tetrazolium)-bis(4-metoxy-6-nitro)benzene-sulfonové, na barevné produkty [5, 7, 8, 13]. Tetrazoliové soli jsou však toxické a provedení testů je poměrně pracné a finančně náročnější. U MTT je navíc nutno nerozpustný produkt solubilizovat, nejlépe pomocí dimetylsulfoxidu. Po tomto kroku dochází k destrukci buněk a není tedy možno provádět další měření. XTT zase není efektivně redukován a pro účinnou redukci je nejprve potřeba přidat do reakce menadion [8, 13]. To komplikuje celý postup a může dojít k ovlivnění výsledku reakce.
Použití resazurinu pro průkaz živých, metabolicky aktivních buněk je tedy v porovnání s tetrazoliovými solemi výhodnější, mimo jiné díky nižší ceně a jednoduchosti provedení. Výsledek testu lze odečítat pouhým okem, změna barev je výrazná. Objektivní odečet výsledků lze zajistit použitím spektrofotometru. Na základě rychlosti barevné změny, případně i její intenzity, lze i orientačně kvantifikovat množství životaschopných buněk. Test by bylo možno s výhodou použít nejen pro zjišťování citlivosti planktonických forem kvasinek k antimykotikům, ale i forem biofilmových.
Tato práce byla podpořena grantem IGA MZ NR/7980-3 Interní grantové agentury Ministerstva zdravotnictví České republiky.
Do redakce došlo 17. 1. 2007
MUDr. Filip Růžička, Ph.D.
Mikrobiologický ústav LF MU
Pekařská 53
656 91 Brno
e-mail: fruzic@fnusa.cz
Zdroje
1. Baker, C. N., Banerjee, S. N., Tenover, F. C. Evaluation of Alamar colorimetric MIC method for antimicrobial susceptibility testing of gram-negative bacteria. J Clin Microbiol, 1994, 32, 5, 1261–1267.
2. Baker, C. N., Tenover, F. C. Evaluation of Alamar colorimetric broth microdilution susceptibility testing method for staphylococci and enterococci. J Clin Microbiol, 1996, 34, 11, 2654–2659.
3. Ceri, H., Olson, M. E., Stremick, C., Read, R. R., Morck, D., Buret, A. The Calgary Biofilm Device: new technology for rapid determination of antibiotic susceptibilities of bacterial biofilms. J Clin Microbiol, 1999, 37, 6, 1771–1776.
4. Douglas, L. J. Candida biofilms and their role in infection. Trends Microbiol, 2003, 11, 1, 30–36.
5. Hawser, S. P., Douglas, L. J. Resistance of Candida albicans biofilms to antifungal agents in vitro. Antimicrob Agents Chemother, 1995, 39, 9, 2128–2131.
6. Holá V., Růžička F., Tejkalová R., Votava M. Stanovení citlivosti k antibiotikům u biofilmpozitivních forem mikroorganismů. Klin Mikrobiol Infekc Lek, 2004, 10, 5, 218–222.
7. Jahn, B., Stuben, A., Bhakdi, S. Colorimetric susceptibility testing for Aspergillus fumigatus: comparison of menadione-augmented 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide and Alamar blue tests. J Clin Microbiol, 1996, 34, 8, 2039–2041.
8. Kuhn, D. M., George, T., Chandra, J., Mukherjee, P. K., Ghannoum, M. A. Antifungal susceptibility of Candida biofilms: unique efficacy of amphotericin B lipid formulations and echinocandins. Antimicrob Agents Chemother, 2002, 46, 6, 1773–1780.
9. Martin, A., Camacho, M., Portaels, F., Palomino, J. C. Resazurin microtiter assay plate testing of Mycobacterium tuberculosis susceptibilities to second-line drugs: rapid, simple, and inexpensive method. Antimicrob Agents Chemother, 2003, 47, 11, 3616–3619.
10. National Committee for Clinical Laboratory Standards (NCCLS). Reference method for broth dilution testing of yeasts: Approved standard, NCCLS document M27-A2. 2. vyd. Wayne, Pensylvania: NCCLS, 2002. 29 s., ISBN 1-56238-469-4.
11. Nero, L. A., Beloti, V.; Barros, M. A. F., Santana, E. H. W., Pereira, M. S. et al. Assessment of the efficiency of SimPlate™ total plate count color indicator (TPC CI) to quantify mesophilic aerobic microorganisms in pasteurized milk. Braz J Microbiol, 2002, 33, 44–48.
12. O’Brien, J., Wilson, I., Orton, T., Pognan, F. Investigation of the Alamar blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. Eur J Biochem, 2000, 267, 17, 5421–5426.
13. Pettit, R. K., Weber, C. A., Kean, M. J., Hoffmann, H. et al. Microplate Alamar Blue Assay for Staphylococcus epidermidis Biofilm Susceptibility Testing. Antimicrob Agents Chemother, 2005, 49, 7, 2612–2617.
14. Pfaller, M. A., Espinel-Ingroff, A., Jones, R. N. Clinical evaluation of the Sensititre YeastOne colorimetric antifungal plate for antifungal susceptibility testing of the new triazoles voriconazole, posaconazole, and ravuconazole. J Clin Microbiol, 2004, 42, 10, 4577–4580.
15. Pfaller, M.A., Vu, Q., Lancaster, M., Espinel-Ingroff, A. et al. Multisite reproducibility of colorimetric broth microdilution method for antifungal susceptibility testing of yeast isolates. J Clin Microbiol, 1994, 32, 7, 1625–1628.
16. Ramage, G., Walle, K. V., Wickes, B. L., López-Ribot, J. L. Standardized method for in vitro antifungal susceptibility testing of Candida albicans biofilms. Antimicrob Agents Chemother, 2001, 45, 9, 2475–2479.
17. Rasmussen, E. V. Use of fluorescent redox indicators to evaluate cell proliferation and viability. In Vitro Mol Toxicol, 1999, 12, 47–58.
18. To, W. K., Fothergill, A. W., Rinaldi, M. G. Comparative evaluation of macrodilution and alamar colorimetric microdilution broth methods for antifungal susceptibility testing of yeast isolates. J Clin Microbiol, 1995, 33, 10, 2660–2664.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek TEST
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2008 Číslo 1- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Invazivní pneumokokové onemocnění v České republice v letech 2000–2006
- Problematika vulvovaginálního dyskomfortu z hlediska mezioborové spolupráce
- Epidemie virové hepatitidy typu A v roce 1979 Vzpomínky starého epidemiologa Prvá část
- Karel Raška – Velikán boje proti mikrobům
- Tři noví profesoři mikrobiologie
- Průkaz životaschopných, metabolicky aktivních kvasinkových buněk pomocí kolorimetrického média
- TEST
- Séroprevalencia Toxoplasma gondii u gravidných žien na Slovensku
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Epidemie virové hepatitidy typu A v roce 1979 Vzpomínky starého epidemiologa Prvá část
- Karel Raška – Velikán boje proti mikrobům
- Séroprevalencia Toxoplasma gondii u gravidných žien na Slovensku
- Problematika vulvovaginálního dyskomfortu z hlediska mezioborové spolupráce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



