-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Stevens-Johnsonův syndrom a toxická epidermální nekrolýza z pohledu patologa
Stevens-Johnson syndrome and toxic epidermal necrolysis from pathologist’s point of view
Stevens-Johnson syndrome and toxic epidermal necrolysis (Lyell syndrome) are rare diseases characterized by rapid blistering followed by extensive skin and mucosal exfoliation and constitutional symptoms. In most cases, drugs are the main triggers, but the etiopathogenesis of the diseases is not fully understood. Lyell syndrome is associated with a high mortality rate, reported to be around 35%. Therefore, early diagnosis requiring close interdisciplinary cooperation is essential. The diagnosis based on the clinical picture and a detailed pharmacological history should be confirmed by histopathological examination of the skin specimen, including analysis by direct immunofluorescence.
Keywords:
direct immunofluorescence – toxic epidermal necrolysis – Lyell syndrome – Stevens-Johnson syndrome – histopathological examination
Autoři: Eva Sticová 1; Jitka Kyclová 2; Miroslav Důra 3; Jiří Štork 3; Břetislav Lipový 4
Působiště autorů: Ústav patologie 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 1; Ústav patologie, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno 2; Dermatovenerologická klinika 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice, Praha 3; Klinika popálenin a plastické chirurgie, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno 4
Vyšlo v časopise: Čes.-slov. Patol., 59, 2023, No. 3, p. 124-128
Kategorie: Přehledový článek
Souhrn
Stevens-Johnsonův syndrom a toxická epidermální nekrolýza (Lyellův syndrom) jsou vzácně se vyskytující onemocnění charakterizovaná rychlým vznikem puchýřů s následnou rozsáhlou kožní a slizniční exfoliací doprovázenou celkovými příznaky. Hlavním spouštěčem bývají ve většině případů léky, etiopatogeneze onemocnění však není zcela objasněna. Lyellův syndrom je spojen s vysokou letalitou, v průměru udávanou kolem 35 %, proto je naprosto klíčová včasná diagnostika vyžadující těsnou mezioborovou spolupráci. Diagnóza stanovená na základě klinického obrazu a podrobné farmakologické anamnézy by měla být potvrzena histopatologickým vyšetřením kožního vzorku, vč. vyšetření přímou imunofluorescencí.
Klíčová slova:
přímá imunofluorescence – toxická epidermální nekrolýza – Lyellův syndrom – Stevens-Johnsonův syndrom – histopatologické vyšetření
Toxická epidermální nekrolýza (TEN) je vzácné akutní, život ohrožující onemocnění charakterizované rychlým vznikem puchýřů a rozsáhlou kožní a slizniční exfoliací postihující minimálně 30 % tělesného povrchu (1). Jako první TEN popsal skotský dermatolog Alan Lyell v roce 1956, proto je též nazývána Lyellovým syndromem (2).
V případě menšího rozsahu postižení mluvíme o Stevens-Johnsonově syndromu (SJS), který je považován za nozologickou jednotku s obdobnou etiologií a patogenetickými mechanismy jako TEN, nicméně s mírnějším fenotypem charakterizovaným menší plochou postižené kůže (< 10 %) a dominantním postižením sliznic (1,3). Dle původního konceptu bylo do spektra nekrolytických dermatóz zahrnuto i erythema multiforme major (EM) jako nejmírnější forma onemocnění, nicméně současná pozorování podporují domněnku, že EM, zejména případy spojené s infekcí herpes simplex, je onemocnění odlišné od SJS a TEN (3,4).
Podle četnosti výskytu TEN se jedná o vzácnou nozologickou jednotku s incidencí 0,4-1,9/1 milion obyvatel a rok (5,6). Onemocnění je spojeno s vysokou letalitou, v průměru udávanou kolem 35 % (1,5,6).
Etiopatogeneze SJS a TEN dodnes není zcela jasná, spouštěčem však bývají v převážné většině případů léky. Typicky jde o antibiotika a chemoterapeutika, dále nesteroidní antirevmatika, alopurinol, antiepileptika, kortikosteroidy nebo antidepresiva (1,4). TEN se většinou rozvíjí mezi 7 dny až 8 týdny po podání léku, s maximem vzniku do 2 týdnů. Mezi další vzácné asociace TEN patří systémový lupus erythematodes, angioimunoblastický lymfom T-buněk a hemofagocytární lymfohistiocytóza (7-9). U 5-10 % pacientů se nepodaří nalézt spouštěcí faktor.
V patogenezi onemocnění se pravděpodobně uplatňuje abnormální metabolismus léku, což vede ke zvýšené produkci reaktivních metabolitů a spuštění kaskády imunopatologických procesů. Zvýšená incidence HLA-B12 naznačuje určitou genetickou predispozici u postižených jedinců (1,4). Byla rovněž nalezena významná souvislost mezi HLA-B*5801 a alopurinolem indukovaným SJS/TEN (10) a HLA-B*15 : 02 a karbamazepinem indukovaným SJS/TEN (11). Specifická imunitní reakce u SJS/ TEN je pravděpodobně iniciována cytotoxickými CD8+ T lymfocyty, produkujícími tumor necrosis factor α (TNF-α), granulyzin, perforin a granzym B. Tyto mediátory jsou zodpovědné za nekrózy a zejména za masivní apoptotický zánik keratinocytů epidermis, epitelu sliznic a adnex. Působení cytokinů by vysvětlovalo rozpor mezi rozsahem poškození epitelových struktur a malou intenzitou dermální zánětlivé reakce. Finálním krokem v indukci apoptózy je zřejmě aktivace intracelulárních kaspáz navázáním transmembránového proteinu FasL (CD95L) na jeho cílový receptor na buňkách epidermis FasR (CD95R) (1,4,12).
Obr. 1. Toxická epidermální nekrolýza, kožní léze – klinický obraz. 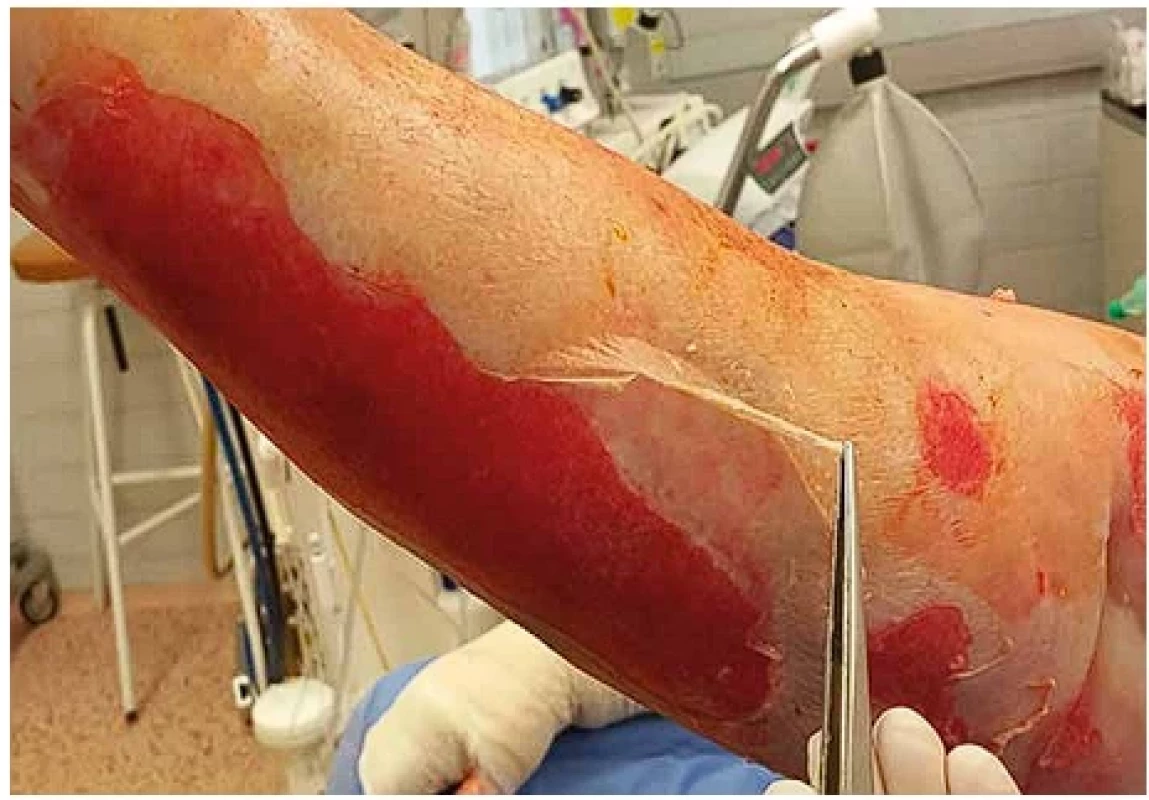
Klinický obraz a prognóza onemocnění
Kožním lézím většinou předcházejí prodromální příznaky připomínající běžnou virózu – horečka, nechutenství, bolest hlavy, kašel, myalgie a může se objevit makulopapulózní exantém kůže. Po několika dnech následuje akutní kožní fáze s tvorbou růžových až červených makul a atypických terčovitých lézí, které rychle progredují a splývají do erytematózních ploch s tmavými centry. Objevují se puchýře a cárovité odlučování epidermis za vzniku rozsáhlých erodovaných ploch (obr. 1). Kožní léze se většinou nejdříve objevují na trupu a proximální části horních končetin, poté i na dalších částech těla. Typickým příznakem je pozitivní Nikolského fenomén, představující snadné odloučení epidermis působením minimálního tlaku na kožní povrch, podmíněné nekrózou bazální vrstvy keratinocytů (obr. 2) (1,4). I při malém tlaku na kožní puchýř dojde k jeho zvětšení a rozšíření do stran (tzv. Asboe-Hansenovo znamení). Současně s kůží jsou u více než 90 % pacientů postiženy i sliznice. Nejčastěji je to sliznice dutiny ústní (obr. 3A), dále oční spojivky (obr. 3B) a sliznice urogenitálního traktu. Méně často mohou být postiženy i sliznice gastrointestinálního traktu, nejčastěji jícnu, a vzácné je i postižení respiračního ústrojí (1,10).
Rozsah postiženého povrchu je jedním z hlavních prognostických ukazatelů, proto byl navržen následující zjednodušený klasifikační systém (1,4):
- postižení <10 % povrchu těla: SJS
- postižení 10-30 % povrchu těla: překryvný syndrom SJS/TEN
- postižení >30 % povrchu těla: TEN
Obr. 2. Pozitivní Nikolského fenomén. 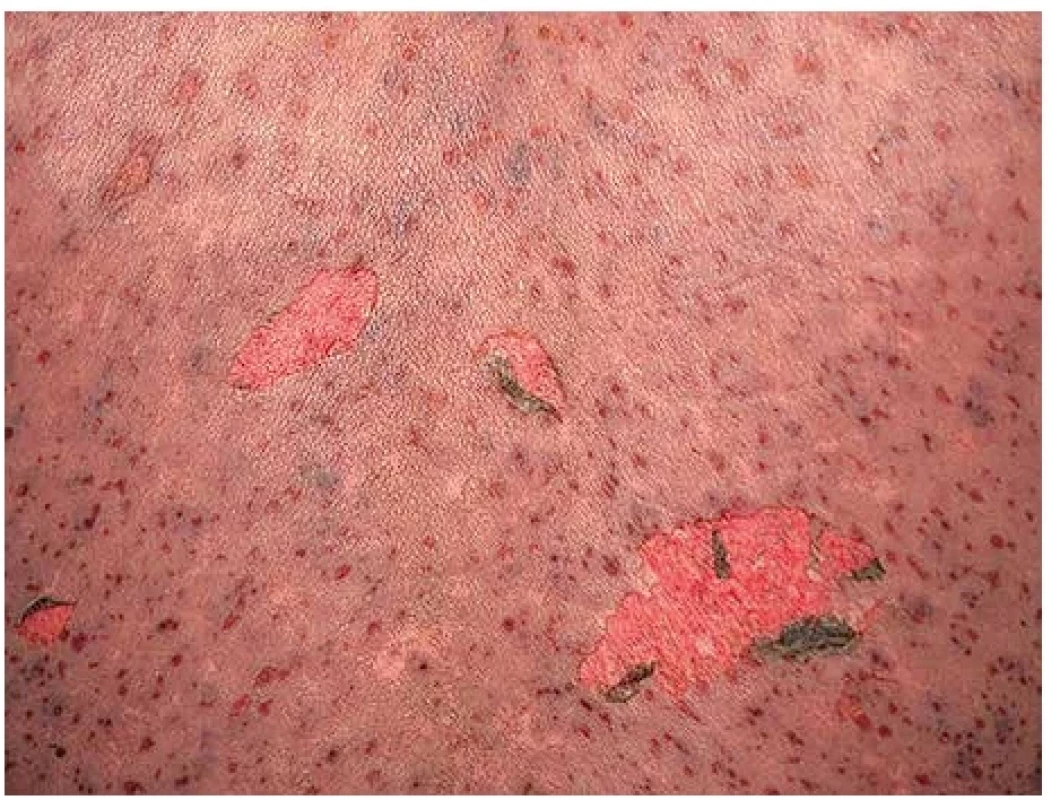
Tab. 1. SCORTEN: Skóre závažnosti onemocnění toxické epidermální nekrolýzy (13). 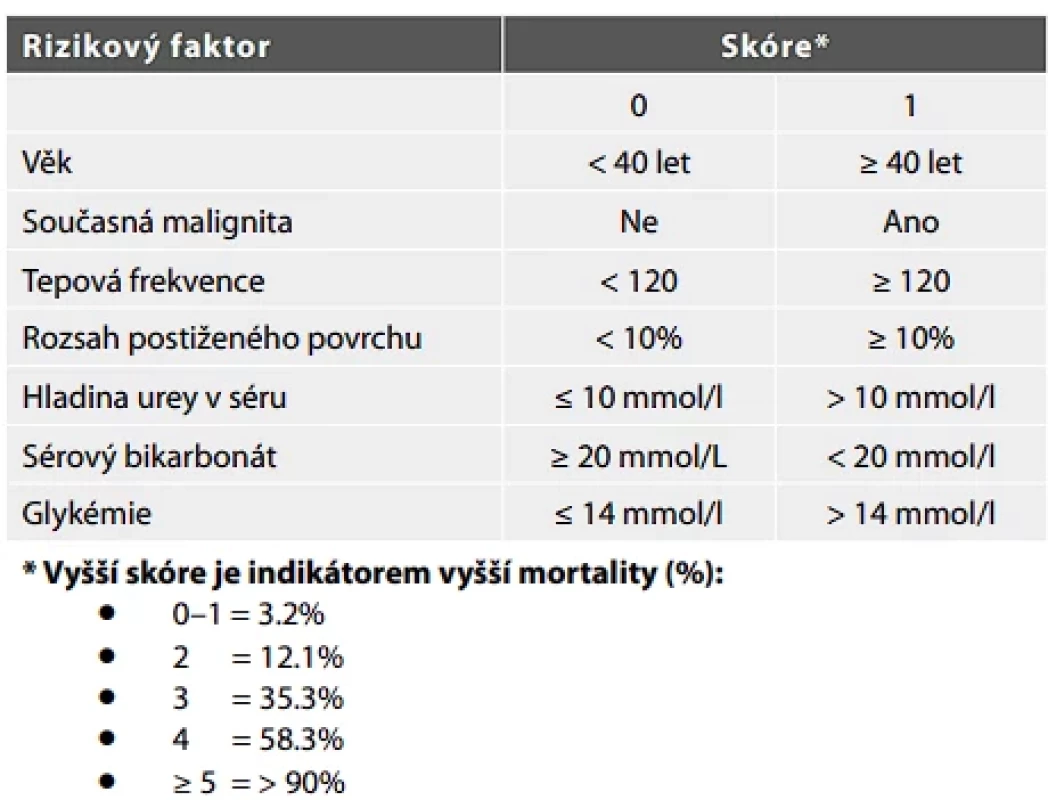
Obr. 3. Toxická epidermální nekrolýza, slizniční léze – klinický obraz. A. Postižení dutiny ústní. B. Postižení spojivky. 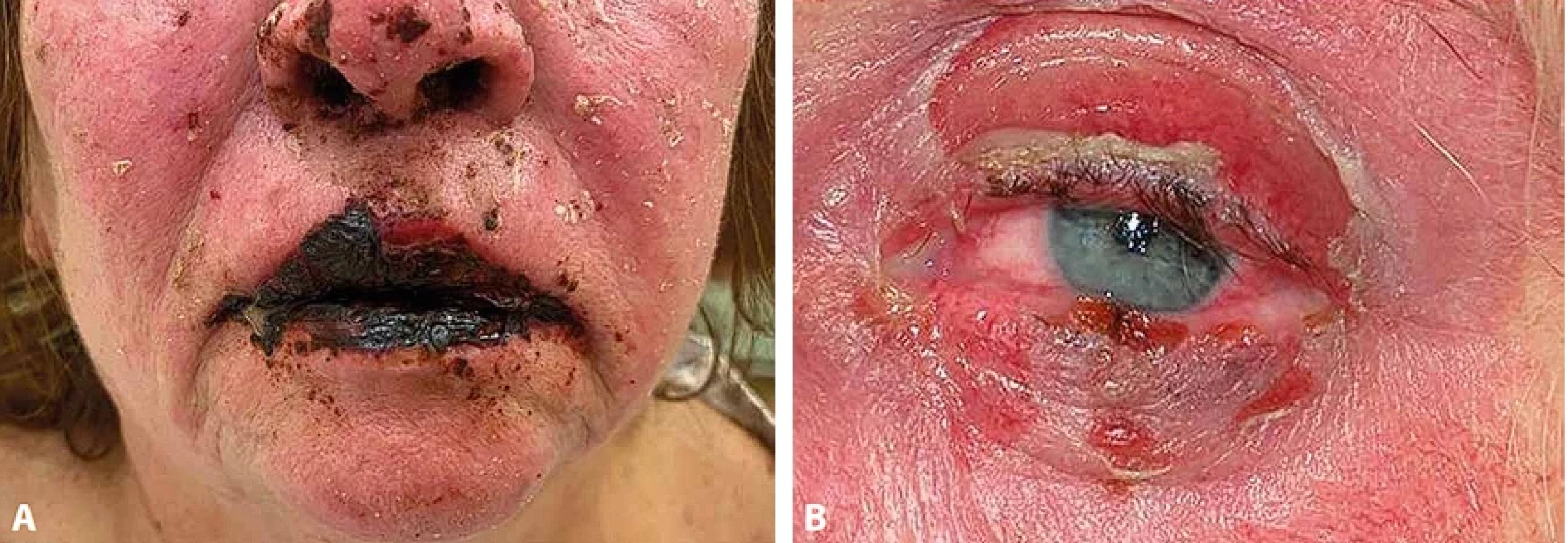
Obr. 4. Toxická epidermální nekrolýza, časná stádia – histopatologický obraz. Apoptotický zánik keratinocytů epidermis s přítomností tzv. satelitních nekróz. Hematoxylin-eozin, pův. zvětšení 200x. 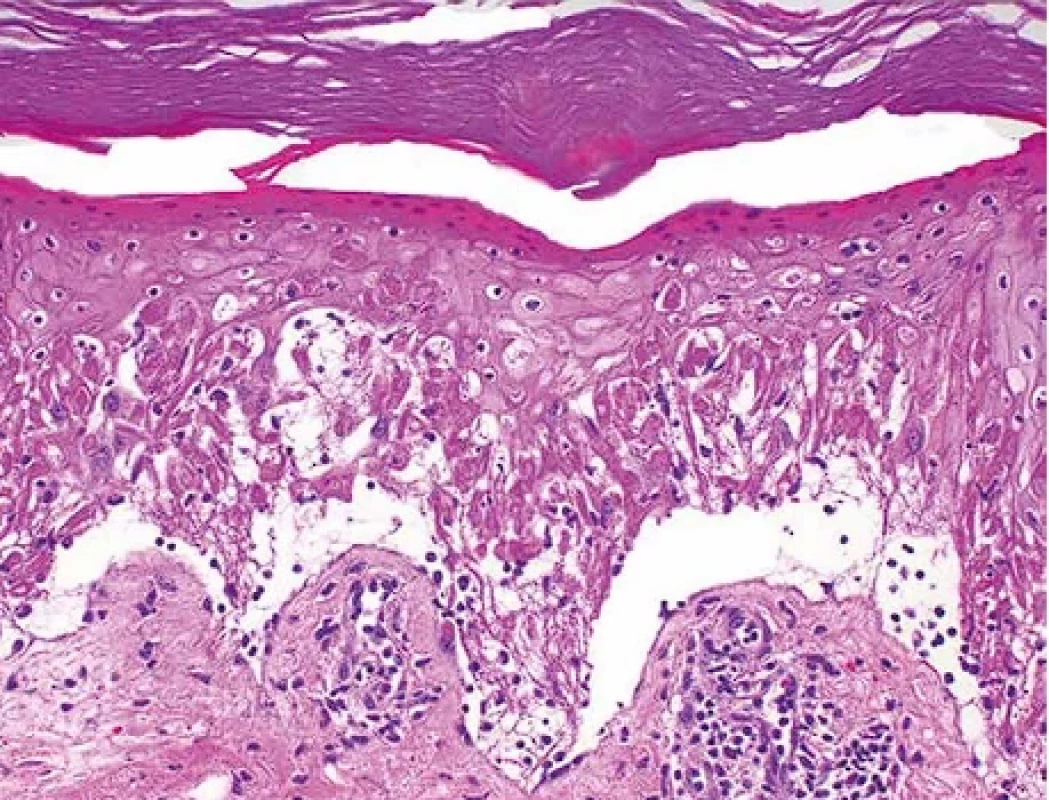
Obr. 5. Toxická epidermální nekrolýza, vyvinutá léze – histopatologický obraz. Kompletní nekrolýza a odloučení epidermálního krytu. Hematoxylin-eozin, pův. zvětšení 200x. 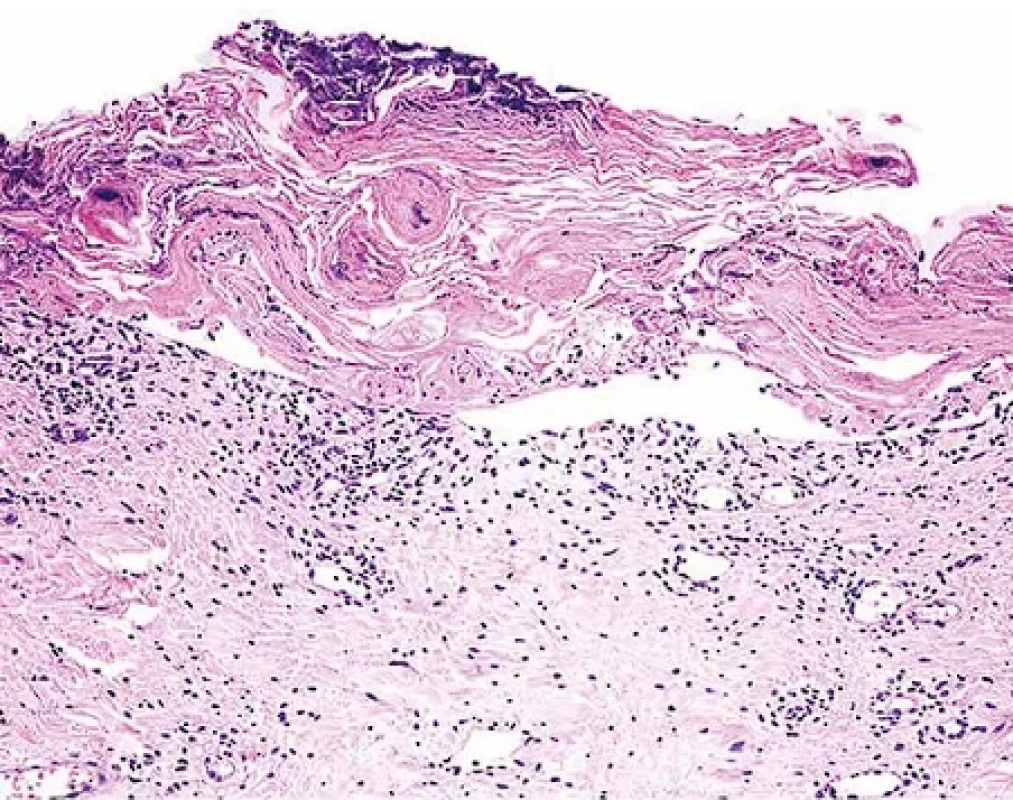
Obr. 6. Toxická epidermální nekrolýza, časná stádia – histopatologický obraz. Postižení epitelu vývodů potních žláz. Hematoxylin-eozin, pův. zvětšení 200x. 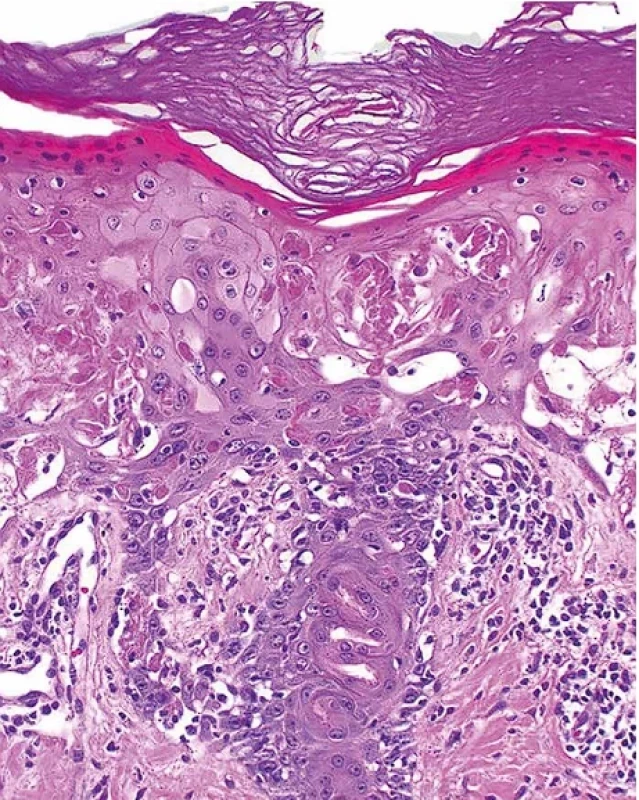
Obr. 7. Stafylokokový syndrom opařené kůže – histopatologický obraz. Intrakorneální akantolýza a separace keratinocytů s tvorbou plošného puchýře. Hematoxylin-eozin, pův. zvětšení 400. 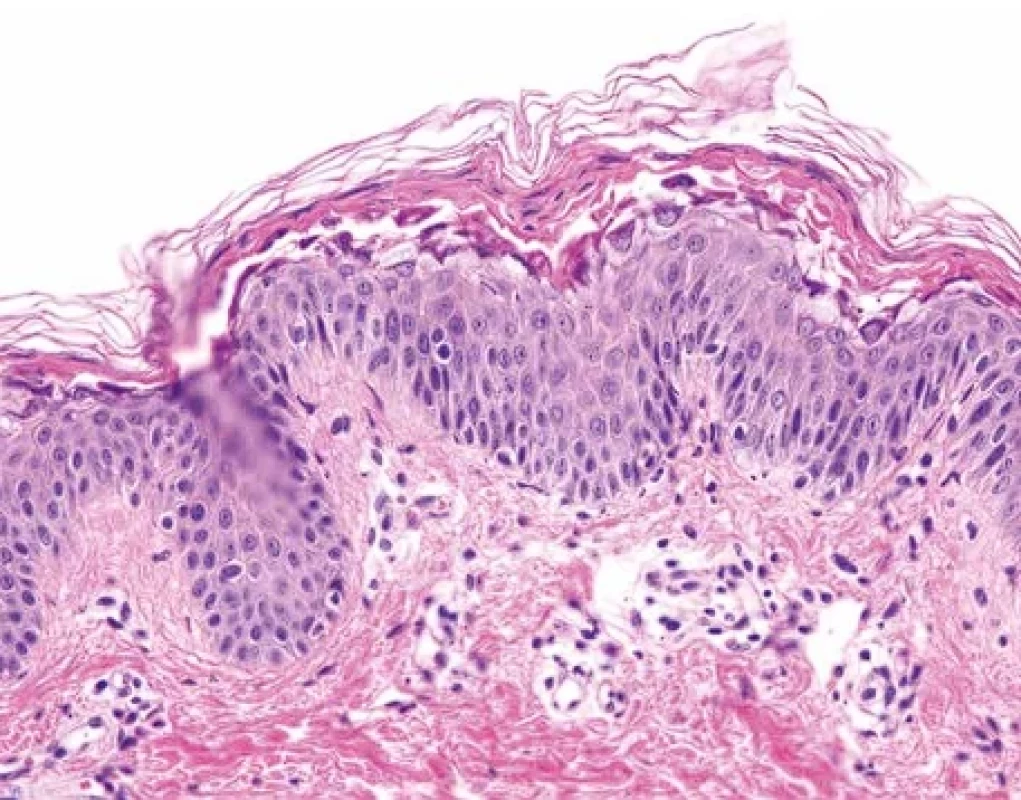
Riziko úmrtí pacientů s TEN lze odhadovat podle tzv. kvantitativního skóre závažnosti onemocnění (severity of illness score, SCORTEN) (13) (tabulka 1). Nejčastější příčinou úmrtí jsou infekční komplikace způsobené řadou potenciálně patogenních mikroorganismů včetně oportunních zástupců, vedoucí k sepsi a multiorgánovému selhání. Mezi typická agens patří nejen bakterie jako Pseudomonas aeruginosa, koaguláza-negativní Staphylococcus či Staphylococcus aureus, ale také kvasinky a plísně. Pacienti s TEN ztrácejí obnaženými kožními plochami velké množství tekutin a je porušena i termoregulační funkce kůže. Dalšími komplikacemi mohou být krvácení z gastrointestinálního traktu či plicní embolie (5,6,12).
Pacienti, kteří přežijí akutní fázi TEN, jsou ohroženi řadou možných pozdních následků. Nejčastější je oční postižení, které zahrnuje syndrom suchého oka (sicca syndrom), dále fotofobii, jizvení rohovky, snížení zrakové ostrosti až úplnou slepotu. Vzhledem k těmto očním komplikacím je nutné včasné vyšetření všech pacientů s TEN očním lékařem (14).
Diagnózu TEN lze zpravidla stanovit na základě podrobné farmakologické anamnézy a klinického nálezu, cenným diagnostickým nástrojem je však i kožní biopsie. Zpravidla se doporučuje odběr nativního vzorku pro rychlé vyšetření technikou zmražených řezů a vyšetření přímou imunofluorescencí (15). Výhodné je odebrat vzorek pro histopatologické vyšetření z přechodu kožní léze (buly) a intaktní kůže.
Histopatologický obraz SJS/TEN
V časných fázích onemocnění dominují epidermální změny se zánikem keratinocytů ve formě tzv. satelitních nekróz, odpovídajících apoptózám individuálních keratinocytů provázeným lymfohistiocytární reakcí, s převahou CD8+ T lymfocytů (obr. 4). V dalším průběhu dochází k nekróze epidermis v celé její tloušťce s destrukcí dermo-epidermální junkce a s tvorbou subepidermální buly (obr. 5). Obdobné změny jako v epidermis nacházíme i v epitelu kožních adnex, zejména vývodů potních žláz (obr. 6). Ve spodině subepidermálního puchýře je zpravidla jen řídký perivaskulární, převážně lymfohistiocytární zánětlivý infiltrát s převažujícím zastoupením CD4+ lymfocytů (15-17). Závěry některých studií ukazují, že větší rozsah epidermálního poškození, resp. vyšší intenzita zánětlivé reakce v koriu mohou být asociovány s vyšší morbiditou, resp. mortalitou pacientů s TEN
(18). Fáze hojení lézí u SJS/TEN může být provázena fibrózou až jizvením dermis s poruchami pigmentace, někdy s přítomností drobných cyst odpovídajících miliím (19).
Přímá imunofluorescence vykazující pozitivitu imunoglobulinů a C3 složky komplementu ve středních partiích epidermis má význam hlavně pro diferenciální diagnózu, kdy pomůže odlišit TEN od autoimunních puchýřnatých onemocnění (20).
Diferenciální diagnóza
Relativně charakteristický klinický obraz podpořený anamnestickými údaji o požití potenciálně rizikového léku je zpravidla pro diagnózu SJS a TEN dostačující. Diagnostické obtíže mohou nastat především v časných fázích onemocnění, případně u méně obvyklého či komplikovaného průběhu.
Epidermální nekrózu provázející TEN je třeba odlišit od ischemického postižení kůže. Ischemická nekróza však bývá zpravidla rozsáhlejší a postihuje i hlubší partie koria, případně podkoží, včetně epitelu adnex. Mohou být současně přítomny známky vaskulitidy kožních cév, lumina cév mohou být obliterována tromby.
Diagnostické obtíže může v některých případech způsobit i akutní generalizovaná exantematózní pustulóza (acute generalized exanthematous pustulosis, AGEP), zvláště, je-li provázena tvorbou bul a extenzivním odlučováním kůže (21,22). TEN může být naopak vzácně komplikována výsevem pustul (23). Přítomnost intrakorneálních a intraepidermálních pustul s mírnou spongiformní pustulací, minimální apoptóza keratinocytů a nápadný dermální edém s neutrofilní celulizací jsou mikroskopické znaky favorizující diagnózu AGEP (21,22).
Další syndrom s řadou klinických podobností se SJS/TEN představuje tzv. DRESS (drug reaction with eosinophilia and systemic symptoms) (24). Podobně jako u TEN není dodnes plně objasněna patofyziologická podstata tohoto potenciálně život ohrožujícího syndromu. I zde je popsána prodromální fáze, ve které dominuje pruritus a febrilie, nicméně ve srovnání s TEN bývá většinou delšího průběhu (může trvat i týdny). Tento stav byl popsán jak u dětí, tak u dospělých. Letalita syndromu dosahuje asi 10 %. Kožní projevy DRESS bývají poměrně variabilní, nejčastěji se syndrom manifestuje jako morbilliformní exantém. Typickým laboratorním a klinickým obrazem u pacientů s DRESS je hepatosplenomegalie, lymfocytóza a v krevním obraze eozinofilie. V mikroskopickém obraze DRESS bývá popisován perivaskulární či pásovitý zánětlivý infiltrát v povrchových partiích koria, s účastí eozinofilních leukocytů a s erytrocytárními extravazáty, někdy s přítomností drobných granulomů. V epidermis bývá mírná spongióza s vakuolární degenerací bazálních keratinocytů (24,25).
Generalizovaná bulózní fixní léková reakce recidivuje vždy po požití stejné látky (časté jsou sulfonamidy), odeznívá do dvou týdnů a zpravidla nepostihuje sliznice. V mikroskopickém obraze nacházíme vakuolizaci bazálních keratinocytů s apoptotickým zánikem buněk epidermis, dermální edém a superficiální i hluboký perivaskulární a intersticiální smíšený zánětlivý infiltrát z lymfocytů, plazmatických buněk, neutrofilních a eozinofilních leukocytů, s výraznou inkontinencí melaninu. Pakliže jsou přítomny puchýře, bývají subepidermálně (26).
Lineární IgA bulózní dermatóza způsobená léky, především vankomycinem, může rovněž připomínat TEN, avšak v typickém případě nacházíme při mikroskopickém vyšetření kožního vzorku neutrofilní mikroabscesy v papilární dermis a při vyšetření přímou imunofluorescencí lineární imunodepozita IgA podél bazální membrány epidermis (27,28).
Zejména u dětských pacientů, vzácněji u imunokompromitovaných dospělých nebo pacientů s chronickým renálním selháním připadá v rámci diferenciální diagnózy TEN v úvahu rovněž stafylokokový syndrom opařené kůže (staphylococcal scalded skin syndrome, SSSS), onemocnění vyvolané exfoliativním exotoxinem produkovaným některými kmeny Staphylococcus aureus (29,30). Právě v těchto případech bývá indikováno vyšetření kožního vzorku formou zmražených řezů, které u SSSS prokáže intrakorneální štěpení s tvorbou puchýře (obr. 7).
Mezi další stavy, které je nutno v rámci diferenciální diagnózy SJS a TEN zvažovat, patří autoimunní onemocnění s tvorbou puchýře, zejména pemphigus vulgaris či bulózní pemfigoid. Rychlé a spolehlivé odlišení těchto jednotek od TEN je možné na základě typického histopatologického nálezu doplněného o vyšetření kožního vzorku přímou imunofluorescencí, které v případě bulózního pemphigoidu prokáže lineární depozita IgG a C3 složky komplementu podél bazální membrány epidermis a typickou intercelulární pozitivitu IgG a C3 u pemphigus vulgaris (31).
ZÁVĚR
TEN je vzácné život ohrožující onemocnění postihující kůži a sliznice, jehož prognóza závisí na včasné diagnostice a zahájení adekvátní terapie. Typický klinický obraz podpořený pozitivní farmakologickou anamnézou je pro diagnózu SJS a TEN často dostačující. V případě jakékoliv diagnostické nejistoty či rozpaků poskytne cennou informaci histopatologické vyšetření kožního vzorku, které se tak stává účinným nástrojem v diagnostickém procesu.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Eva Sticová, Ph.D.,
Ústav patologie 3. lékařské fakulty Univerzity Karlovy a FN Královské Vinohrady
Šrobárova 1150/50, Praha 10, 100 00, e-mail: eva.sticova@fnkv.cz
Zdroje
- Frantz R, Huang S, Are A, Motaparthi K. Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: A Review of Diagnosis and Management. Medicina (Kaunas) 2021; 57(9): 895.
- Lyell A. Toxic epidermal necrolysis: an eruption resembling scalding of the skin. Br J Dermatol 1956; 68(11): 355-61.
- Guvenir H, Arikoglu T, Vezir E, Misirlioglu ED. Clinical Phenotypes of Severe Cutaneous Drug Hypersensitivity Reactions. Curr Pharm Des 2019; 25 : 3840–3854.
- Grünwald P, Mockenhaupt M, Panzer R, Emmert S. Erythema multiforme, Stevens-Johnson syndrom / Toxic Epidermal Necrolysis—Diagnosis and treatment. JDDG J Ger Soc Dermatol 2020; 18 : 547–553.
- Chaby G, Maldini C, Haddad C, Lebrun-Vignes B, et al. Incidence of and mortality from epidermal necrolysis (Stevens-Johnson syndrome/toxic epidermal necrolysis) in France during 2003-16: A four-source capture-recapture estimate. Br. J. Dermatol 2020; 182 : 618–624.
- Surowiecka A, Barańska-Rybak W, Strużyna J. Multidisciplinary Treatment in Toxic Epidermal Necrolysis. Int J Environ Res Public Health 2023; 20(3): 2217.
- Ziemer M, Kardaun SH, Liss Y, Mockenhaupt M. Stevens-Johnson syndrome and toxic epidermal necrolysis in patients with lupus erythematosus: a descriptive study of 17 cases from a national registry and review of the literature. Br J Dermatol 2012; 166(3): 575-600.
- Jones B, Vun Y, Sabah M, et al. Toxic epidermal necrolysis secondary to angioimmunoblastic T-cell lymphoma. Australas J Dermatol 2005; 46 : 187–191.
- Sniderman JD, Cuvelier GD, Veroukis S, et al. Toxic epidermal necrolysis and hemophagocytic lymphohistiocytosis: a case report and literature review. Clin Case Rep 2015; 3 : 121–125.
- Somkrua R, Eickman EE, Saokaew S, et al. Association of HLA-B*5801 allele and allopurinol-induced Stevens–Johnson syndrome and toxic epidermal necrolysis: a systematic review and meta-analysis. BMC Med Genet 201; 12 : 118.
- Amstutz U, Shear NH, Rieder MJ, Hwang S, et al. Recommendations for HLA-B*15 : 02 and HLA-A*31 : 01 genetic testing to reduce the risk of carbamazepine-induced hypersensitivity reactions. Epilepsia 2014; 55(4): 496-506.
- Hasegawa A, Abe R. Recent advances in managing and understanding Stevens-Johnson syndrome and toxic epidermal necrolysis. F1000Res 2020; 9: F1000 Faculty Rev-612.
- Garin S, Fouchard N, Bertocchi M et al. SCORTEN: a severity-of-illness score for toxic epidermal necrolysis. J Invest Dermatol 2000; 115(2): 149–153.
- Fu Y, Gregory DG, Sippel KC, Bouchard CS, Tseng SC. The ophthalmologist‘s role in the management of acute Stevens-Johnson syndrome and toxic epidermal necrolysis. Ocul Surf 2010; 8(4): 193-203.
- Hosaka H, Ohtoshi S, Nakada T, Iijima M. Erythema multiforme, Stevens-Johnson syndrome and toxic epidermal necrolysis: frozen-section diagnosis. J Dermatol 2010; 37(5):407-412.
- Quinn AM, Brown K, Bonish BK, et al. Uncovering histologic criteria with prognostic significance in toxic epidermal necrolysis. Arch Dermatol 2005; 141 : 683–687.
- Iwai S, Sueki H, Watanabe H, Sasaki Y, et al. Distinguishing between erythema multiforme major and Stevens-Johnson syndrome/toxic epidermal necrolysis immunopathologically. J Dermatol 2012; 39(9):781-786.
- Valeyrie-Allanore L, Bastuji-Garin S, Guégan S, Ortonne N, et al. Prognostic value of histologic features of toxic epidermal necrolysis. J Am Acad Dermatol 2013; 68(2): e29-35.
- Sauerbrey W. Zur Wesensfrage der sekundären am Beispiel eines Lyell-Syndroms [The nature of secondary milia on the example of Lyell‘s syndrome]. Z Haut Geschlechtskr 1972; 47(15): 621-624.
- King T, Helm TN, Valenzuela R, Bergfeld WF. Diffuse intraepidermal deposition of immunoreactants on direct immunofluorescence: a clue to the early diagnosis of epidermal necrolysis. Int J Dermatol 1994; 33(9): 634-636.
- Cohen AD, Cagnano E, Halevy S. Acute generalized exanthematous pustulosis mimicking toxic epidermal necrolysis. Int J Dermatol 2001; 40 : 458–461.
- Copaescu AM, Bouffard D, Masse MS. Acute generalized exanthematous pustulosis simulating toxic epidermal necrolysis: case presentation and literature review. Allergy Asthma Clin Immunol 2020; 16 : 9.
- Hague JS, Kaur MR, Hafiji J, Carr RA, et al. Two cases of pustular toxic epidermal necrolysis. Clin Exp Dermatol 2011; 36(1): 42-45.
- Shiohara T, Mizukawa Y. Drug-induced hypersensitivity syndrome (DiHS)/drug reaction with eosinophilia and systemic symptoms (DRESS): An update in 2019. Allergol Int 2019; 68(3): 301-308.
- Owen CE, Jones JM. Recognition and Management of Severe Cutaneous Adverse Drug Reactions (Including Drug Reaction with Eosinophilia and Systemic Symptoms, Stevens-Johnson Syndrome, and Toxic Epidermal Necrolysis). Med Clin North Am 2021; 105(4): 577-597.
- Patel S, John AM, Handler MZ, Schwartz RA. Fixed Drug Eruptions: An Update, Emphasizing the Potentially Lethal Generalized Bullous Fixed Drug Eruption. Am J Clin Dermatol 2020; 21(3): 393-399.
- Nguyen JK, Koshelev MV, Gill BJ, Boulavsky J, et al. A toxic epidermal necrolysis-like presentation of linear IgA bullous dermatosis treated with dapsone. Dermatol Online J 2017; 23(8): 13030/qt4443157h.
- Pereira AR, Moura LH, Pinheiro JR, et al. Vancomycin-associated linear IgA disease mimicking toxic epidermal necrolysis. An Bras Dermatol 2016; 91 : 35–38.
- Jordan KS. Staphylococcal Scalded Skin Syndrome: A Pediatric Dermatological Emergency. Adv Emerg Nurs J 2019; 41(2): 129-134.
- Tseng HC, Wu WM, Lin SH. Staphylococcal scalded skin syndrome in an immunocompetent adult, clinically mimicking toxic epidermal necrolysis. J Dermatol 2014; 41 : 853–854.
- Egami S, Yamagami J, Amagai M. Autoimmune bullous skin diseases, pemphigus and pemphigoid. J Allergy Clin Immunol 2020; 145(4): 1031-1047.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2023 Číslo 3-
Všechny články tohoto čísla
- Klinické a histopatologické aspekty nejčastějších zánětlivých neinfekčních kožních onemocnění
- Stevens-Johnsonův syndrom a toxická epidermální nekrolýza z pohledu patologa
- Revmatoidní uzel mitrální chlopně komplikovaný infekční endokarditidou
- Karcinóm prsníka z vysokých buniek s obrátenou polaritou – opis troch prípadov s prehľadom literatúry
- Klinicko-patologická diagnostika nenádorových onemocnění kůže
- Patologie je královnou medicíny
- Monitor aneb nemělo by vám uniknout, že
- Úskalí diagnostiky v dermatopatologii
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Stevens-Johnsonův syndrom a toxická epidermální nekrolýza z pohledu patologa
- Klinické a histopatologické aspekty nejčastějších zánětlivých neinfekčních kožních onemocnění
- Karcinóm prsníka z vysokých buniek s obrátenou polaritou – opis troch prípadov s prehľadom literatúry
- Úskalí diagnostiky v dermatopatologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



