-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
MOŽNOSTI DIAGNOSTIKY CELIAKIE V BIOPTICKEJ PRAXI
Diagnostic Possibility of Celiac Disease in Bioptic Practise
Celiac disease is frequently a reason for the poor health children, but it also occurs in adults. This disease remains underdiagnosed, and not only in the Slovak and the Czech Republic populations. This is atypical celiac disease with extraintestinal symptomatology. This persistence is often recognized only after relapse. With regard to seeking out risk groups with atypical forms of the disease, there is the possibility of looking for various alternatives and combinations. Early diagnosis is possible and is preferred in clinical practise in the initial stage of the disease. In this work attention is given to the diagnostics of celiac disease in bioptic practise. A group of 40 newly-diagnosed patients – 20 children with typical and 20 adult patients with atypical celiac disease – was selected. All the patients were examined by an expert gastroenterologist. Children and adolescents had typical symptoms, which were clinically expressed as celiac disease. Nevertheless, adult populations were repeatedly investigated without definitive diagnosis. Blood samples were taken for antiendomysial antibody detection, and after a positive result a biopsy of the duodenum was performed. Samples sent for histopathological examination were returned with the diagnostic conclusion of celiac disease. From a subjective point of view, there are no distinctions between the results, and some distinctions exist only in the clinical manifestations of the disease. With a view to increasing the diagnosis of celiac disease, various possibilities are described in this work, possibilities which remain within the specialty of pathology. The basic objective of this study was early, complex diagnosis of celiac disease in its typical and also atypical form. Among the methods are screening antibodies, histochemistry, immunohistochemistry and also electronmicroscopy. In selected parts of the work we present various considerations on the diagnosis of celiac disease, including our own recommendations for bioptic practise.
Key words:
gluten-free diet – celiac disease – diagnostics – gluten – malabsorption syndrome – small bowel
Autoři: Pe. Makovický 1; Pa. Makovický 2; M. Maxová 3
Působiště autorů: Czech University of Life Sciences, Praha 1; Slovenská poľnohospodárska univerzita, Nitra 2; Institut klinické a experimentální medicíny, Praha 3
Vyšlo v časopise: Čes.-slov. Patol., 45, 2009, No. 1, p. 14-18
Kategorie: Původní práce
Souhrn
Celiakia je častou príčinou neprospievania detí, ale vyskytuje sa aj u dospelých. Ochorenie je poddiagnostikované, čo sa nevzťahuje len na populáciu Slovenskej a Českej republiky. Ide o atypickú celiakiu s extraintestinálnou symptomatológiou. Táto ostáva rozpoznávaná často až po relapse. V snahe vyhľadávania rizikových skupín s atypickou formou celiakie hľadajú sa alternatívy a kombinácie rôznych možností. V klinickej praxi sa preferuje možnosť ranej diagnostiky, teda už v iniciálnom štádiu ochorenia. V práci sa venujeme diagnostike celiakie v bioptickej praxi. V súbore 40 novo diagnostikovaných pacientov bola vybratá skupina 20 detí s typickou a 20 dospelých s atypickou celiakiou. Všetci pacienti boli odborne vyšetrený. Deti a adolescenti mali typické príznaky klinicky svedčiace pre celiakiu. Populácia dospelých bola vyšetrovaná opakovane. Bola odobratá krv na detekciu antiendomyziálnych protilátok a po potvrdení jej pozitivity boli biopticky odobraté vzorky z duodena. Vzorky boli odoslané na histopatologické vyšetrenie so záverom celiakie. Zo subjektívneho hľadiska niet rozdielov medzi výsledkami a rozdiely sú len v klinickej manifestácii ochorenia. S cieľom zvýšiť diagnostiku celiakie sú v práci popísané možnosti, ktoré ostávajú v kompetenciách patológov. Hlavným cieľom predloženej práce je včasná komplexná diagnóza celiakie, tak typickej, ako aj atypickej formy. Ide o screening formou sérových protilátok, histochémiu, imunohistochémiu a elektrónovú mikroskopiu. V jednotlivých kapitolách sú uvedené rôzne názory na diagnostiku celiakie, včítane našich vlastných odporúčaní pre bioptickú prax.
Kľúčové slová:
bezlepková diéta – celiakia – diagnostika – lepok – malabsorpčný syndróm – tenké črevoCeliakia je zápalové autoimunitné ochorenie tenkého čreva s precitlivenosťou na lepok (30, 37, 44). Ide o bielkovinový komplex, ktorý je lokalizovaný v povrchovej časti obilninového zrna. Lepok je obsiahnutý prirodzene v mnohých produktoch, ako aditívum v širokej škále potravinárskych výrobkov a aj vo farmaceutikách. Pokiaľ nie je tento z potravy úplne vylúčený, dochádza u vnímavých, resp. predisponovaných osôb k vyčerpaniu imunitného systému. Klinicky sa celiakia manifestuje v širokej škále symptómov a rozlišuje sa viacero foriem ochorenia (1, 12, 43). Histopatologicky sú hlavným prejavom zápalové zmeny sliznice tenkého čreva s atrofiou klkového reliéfu. Ide o typické, ale nie špecifické zmeny s remisiou po nasadení jedinej kauzálnej terapie, spočívajúcej v prísnej bezlepkovej diéte (9, 14, 45).
Ochorenie bolo v minulosti považované skôr za raritné. V súčasnosti to neplatí, ale stále ostáva rozpoznávané až vo floridnom štádiu a neskoro. V početných domácich a aj zahraničných literárnych odkazoch sa uvádza, že v klinickej praxi je poddiagnostikované (10, 13, 21, 24). Na jedného pacienta s typickou celiakiou pripadá niekoľko nediagnostikovaných s atypickou symptomatológiou. Prevalencia ochorenia sa podľa zahraničných literárnych údajov pohybuje okolo 1 : 100, 1 : 200 a 1 : 266 (15, 20). Vzhľadom k uvedenému má Slovenská a Česká republika v porovnaní s okolitými štátmi nízky počet diagnostikovaných pacientov. Podľa odhadu by nediagnostikované formy ochorenia mohli tvoriť skupinu až 70–80 % prípadov u dospelých (42). Ide o atypickú celiakiu, zväčša s extraintestinálnou symptomatológiou. Títo pacienti ostávajú vystavení rizikám neliečenej celiakie, z ktorého najväčším je incidencia malígneho lymfómu. Keďže celiakia sa vyznačuje interdisciplinárnym charakterom, je podľa nás vyhľadávanie rizikových skupín výzva pre všetky lekárske odbory. Je to celosvetový zdravotnícky problém, ktorý sa rieši vo vyspelých štátoch. Vychádzajúc zo súčasného stavu sme si pri koncepcii predloženej práci dali za cieľ poukázať na naše možnosti, ktoré by mohli prispieť k jej diagnostike. Ide o screening formou sérových protilátok, ďalej enzýmovú histochémiu, imunohistochémiu a nakoniec elektrónovú mikroskopiu.
MATERIÁL A METÓDY
Náš súbor tvorí skupina vybraných vzoriek, pochádzajúcich z retrospektívnej štúdie. Súbor bol tvorený 40 biopticky odobratými vzorkami z tenkého čreva. Ide o vzorky od 20 detí a adolescentov s typickou celiakiou, z toho 13 dievčat a 7 chlapcov vo vekovom rozmedzí 2 až 18 rokov a 20 dospelých s atypickou celiakiou, z toho 16 žien a 4 mužov vo vekovom rozmedzí 24 až 63 rokov. Všetky osoby boli odborne vyšetrené u gastroenetrológa, eventuálne na príslušných klinických oddeleniach. Ambulantne, resp. v priebehu hospitalizácie boli vykonané aj vyšetrenia na detekciu protilátok proti endomýziu (AEA). Odobratá vzorka krvi bola spracovaná centrifugáciou, sérum bolo odpipetované do vopred označených skúmaviek a fixované v mraziacom boxe vychladenom na -30 °C. AEA boli stanovované na ľudskom pupočníku, ktorý sme získali odberom po fyziologickom pôrode. Takto získané tkanivo bolo spracované v tvare mozaiky a zmrazené pri teplote -80 °C v podchladenom acetóne/petroléteri. Z mozaikových foriem boli na zmrazovacom mikrotóme narezané sériové rezy o hrúbke 5 μm, ktoré boli nanesené na čisté, odmastené a označené podložné sklíčka. Sklíčka s rezmi boli pri pokojovej izbovej teplote sušené po dobu 30 min a následne fixované v kyvetách s bezvodým acetónom v chladiacom boxe po dobu 5 min. Po fixácii boli sklíčka krátko ešte sušené a potom uložené do kyviet s obsahom fosfátového pufra o pH 7,6 (PBS) po dobu 5 min. Medzitým rozmrazené sérum bolo odpipetované do vopred označených skúmaviek a riedené 1 : 10 s PBS. Sérum bolo podľa označení na podložných sklíčkach aplikované na kryokatové rezy (AEA). Následne boli sklíčka uložené vo vlhkej komôrke k 30-minútovej inkubácii pri pokojovej izbovej teplote. Po inkubácii bolo prebytočné sérum opláchnuté s PBS a sklíčka boli uložené v kyvetách s PBS po dobu 10 min. Po premytí bolo tkanivo prevrstvené konjugátom fluoresceínu (SwAHU IgA/FITZ) a sklíčka boli opäť uložené k inkubácii vo vlhkej komôrke po dobu 30 min. Po inkubácii bol prebytočný konjugát zliaty a sklíčka boli opätovne uložené v kyvetách s PBS po dobu 10 min. Po uplynutí tejto doby boli preparáty opatrne ošetrené suchou gázou a uložené do krabice na preparáty, kde oschli. Takto vyhotovené boli do jedného dňa odčítané v spektre fluorescenčného mikroskopu Nikon s halogénovou lampou 103W. Pri objektívnom hodnotení bola použitá stupnica (pozitívne a negatívne) aj so subjektívnym popisom patológa. Všetky preparáty boli vyhotovené i hodnotené jedným pracovníkom. Po potvrdení pozitivity boli pacienti odosielaný na odborné gastroenterologické vyšetrenie spojené s bioptickým odberom vzoriek z jednotlivých častí duodena (D1, D2, D3). Vzorky boli fixované v 8% roztoku formalínu a kompletne zaliate do parafínu. Na sánkovom mikrotóme boli narezané sériové rezy o hrúbke 5–6 μm. Následne boli rezy farbené prehľadným farbením: hematoxylínom-eozínom (HE) a preparáty boli vyhodnocované subjektívne vo svetelnomikroskopickom obraze mikroskopu Nikon Eclipse E600.
VÝSLEDKY
Vzťahy medzi základnými údajmi a histopatologickými nálezmi
Nálezy sú zdokumentované v tab. 1.
Tab. 1. Vzťahy medzi základnými údajmi a histopatologickými nálezmi 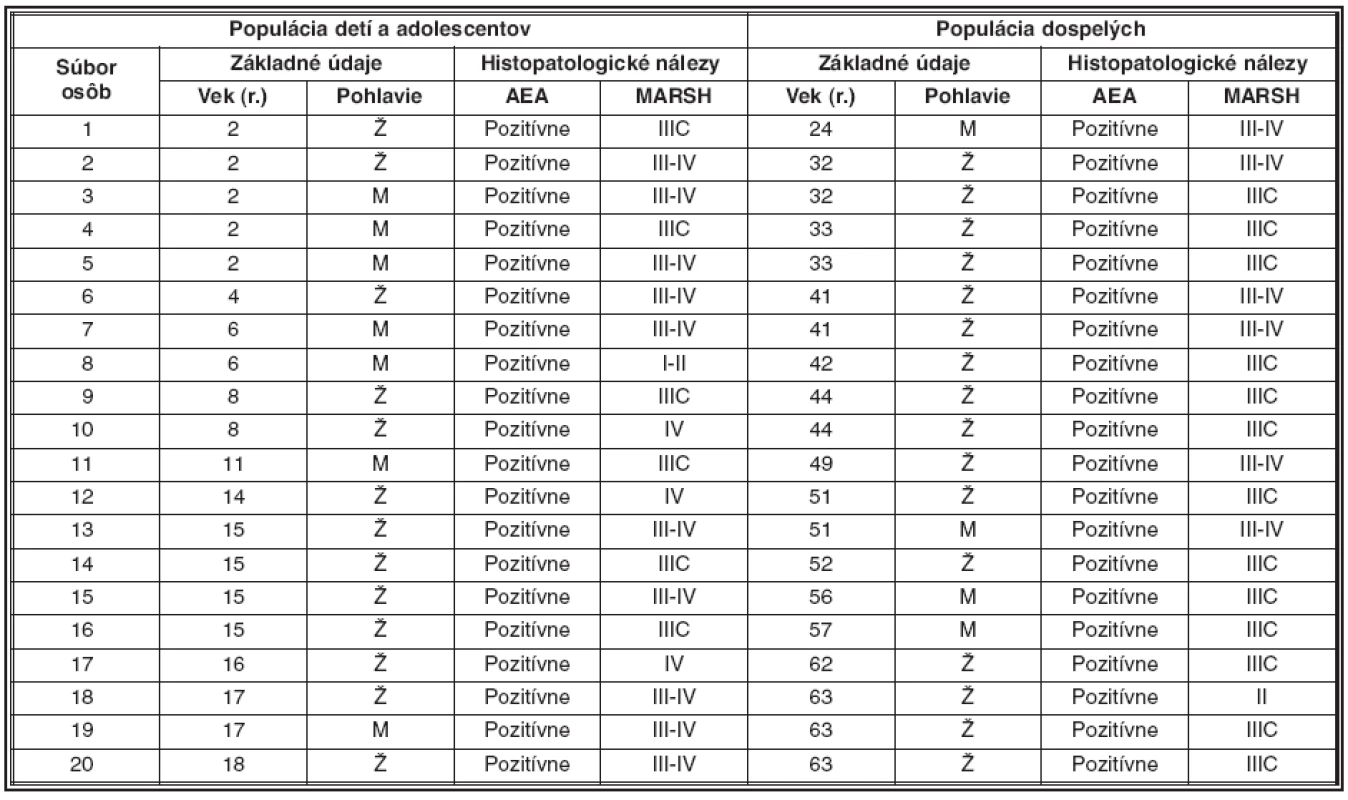
Legenda: Ž – žena, M – muž, AEA – antiendomyziálne protilátky, MARSH – Marshov histologický grading Fluorescenčno mikroskopický nález
Ide o dobre diferencovanú typickú celoplošnú zeleno-žiarivú pozitivitu, ktorá sa odráža jasnou fluorescenciou patričných funkčných miest AEA. Pozitivita sa manifestuje na periférii hladkosvalových buniek a v Whartonovom rôsole v reakcii s retikulárnymi vláknami s dojmom imitácie umelej sieťoviny.
Histopatologický nález
Materiál bol spracovaný vo viacerých sériových častiach s nálezom duodenálnej sliznice. Ide o subtotálnu, totálnu až vilóznu atrofiu klkového reliéfu s chronickým zápalom rôzneho stupňa. Mikroskopický obraz dokumentujúci chronickú enterititídu s vyhladením slizničným reliéfom, ktorý je prestúpený denzným zmiešaným zápalovým inflitrátom s prevahou intraepitelových lymfocytov (obrázok 1). V lamina propria sú mimo toho prítomné aj plazmatické bunky a ojedinelé eozinofily. Histologicky je nález kompatibilný s celiakiou.
Obr. 1. Detailný záber na vyhladenú sliznicu tenkého čreva s chronickým zápalom intraepitelových lymfocytov. HE, 200krát 
DISKUSIA
Celiakia sa považuje za častú príčinu neprospievania detí. Ide o typickú formu, ktorá sa manifestuje klasickou klinickou symptomatológiou. Vyhľadávanie atypických foriem je v klinickej praxi problematickejšie. V literatúre sú k dispozícii početné odkazy na kazuistiky s celiakiou rozpoznanou až relatívne vo vysokom veku (11, 16, 31, 47). Uvedené dokumentujú aj naše výsledky. Zo subjektívneho hľadiska niet rozdielov medzi prípadmi typickej a atypickej celiakie. Rozdiely sú len vo forme, resp. klinickej manifestácii ochorenia. Vo všetkých prípadoch ide o neskoro diagnostikované ochorenie, často až po relapse. V snahe zvýšiť a urýchliť diagnostiku ochorenia hľadajú sa rôzne alternatívy. Z pohľadu patológa sú v diferenciálnej diagnostike metodiky ako sérové protilátky formou nepriamej imunofluorescenie (NIF), enzýmovo histochemické vyšetrenia, imunohistochemické vyšetrenia a elektrónovo mikroskopické vyšetrenie.
Sérové protilátky v diagnostike celiakie
Problematika zavedenia celoplošného screeningu prostredníctvom sérových protilátok formou nepriamej imunofluorescencie (NIF), ktoré sa odčítavajú aj na oddeleniach, resp. ústavoch patológií, bola už viackrát diskutovaná. Bolo opakovane publikované, že screening odhalil veľké množstvo atypických foriem celiakie (5, 6, 19, 26, 50). Sme názoru, že aj v našich podmienkach je screening dobrou metódou, slúžiacou k odhaľovaniu rôznych foriem celiakie. V našej práci sme navrhli, aby sa AEA a tkanivová transglutamináza (t-TG) bežne vyšetrovali už v ambulancii lekára prvého kontaktu (36). Ostatné, ako protilátky proti gliadínu (AGA), proti retikulínu (ARA), proti jejunu (JAB) sa postupne dostávajú na okraj záujmu klinikov. V súčasnosti prevláda v klinickej praxi trend, že pri pozitivite t TG už nie je nutné vyšetrovať iné sérové protilátky. V tomto zmysle uvádzame, že stupeň pozitivity jednotlivých sérových protilátok je odrazom aktivity ochorenia a ich opakovanie po istom časovom intervale umožňuje klinickému kolegovi lepší pohľad na účinnosť nasadenej terapie. Každopádne možno predpokladať, že ostatné sérové protilátky nebudú pri ekvivalencii AEA a t-TG zachované ani v diagnostickom algoritme a zrejme ani v kontrole dodržiavania zásad bezlepkovej diéty. Niektoré literárne údaje dokonca dokumentujú, že k diagnóze stačí už len pozitivita sérových protilátok a biopsiu netreba vždy vykonať, čo je podľa nás veľmi sporný údaj (17).
Histochémia v diagnostike celiakie
O histochemickom vyšetrení sme sa zmienili už v našej predošlej práci (35). V literatúre existujú dva názory na jeho aplikáciu. Prvé hovorí, že toto vyšetrenie je vynikajúcou pomôckou pri diferencionálnej diagnostike selektívnych malabsorbcií. Jeho výsledky môžu pritom poukazovať aj na vývoj ochorenia a obnovu fyziologickej funkcie tenkého čreva (28, 39–41). V protiklade sa uvádza, že erudovaný patológ musí byť schopný posúdiť výšku klkov, hĺbku krýpt, stupeň infiltrátu a vôbec hodnotiť preparáty zahrňujúc kritériá podľa Marsha už z prehľadného farbenia (29). Podľa nás by histochemické vyšetrenie malo byť neoddeliteľnou súčasťou pri diagnostike malabsorpcií v bioptickej praxi. Referovali sme kazuistiku so stanovením diagnózy celiakie u dospelého muža až po relapse ochorenia, pričom histochemické vyšetrenia boli dobrou pomôckou podporujúcou záverečnú diagnózu (33).
Imunohistochémia v diagnostike celiakie
V literatúre nachádzame odkazy aj s doporučením realizácie dôkazu intraepitelových lymfocytov v diagnostike celiakie. Ide o aplikáciu jednotlivých CD protilátok (3, 4, 38). Ich pozitivita bola popísaná najmä v kontexte s malígnym lymfómom (8, 18, 22, 48). Ich aplikáciu považujeme za nutnú v sporných biopsiách. Ide o dôkaz intraepitelových lymfocytov (IEL), ktorých počet stúpa v kontexte s citlivosťou na lepok, pričom klky nemusia byť atrofované, resp. vo svetelnomikroskopickom obraze sú zmeny len jemné. Tieto zmeny môžu ostať prehliadnuté a záverom vyhodnotené ako normálne. Vzhľadom k uvedenému by v budúcnosti možno bolo snáď možno vhodné postaviť včasnú diagnostiku celiakie práve na dôkaze aktivity IEL. Iné práce popisujú význam imunohistochémie pri detekcii proteínov s ich prínosom pri stanovení aktivity choroby aj s možnosťou predikcie rozvoja vilóznej atrofie jejunálnej sliznice (23, 27).
Elektrónová mikroskopia v diagnostike celiakie
V zahraničných prácach nachádzame údaje s nálezom normálnej architektoniky sliznice tenkého čreva vo svetelnomikroskopickom obraze v kontexte s pozitivitou sérových protilátok (7, 32, 46). Klinicky boli prípady uzatvorené ako celiakia. Až elektrónovo mikroskopickým vyšetrením sa podarilo dokázať zmeny na submikroskopickej úrovni, včítane redukcie mikroklkov. Histopatologická diagnóza nemusí byť preto stanovená správne len vyhodnotením v spektre svetelného mikroskopu. Niektoré zahraničné pracoviská začali používať elektrónovo mikroskopické vyšetrenie pri sporných biopsiách. Za spornú biopsiu sa pritom považuje existencia pozitivity sérových protilátok v kombinácii s normálnou svetelnou mikroskopiou vzorky sliznice tenkého čreva. Ide o nákladné vyšetrenie, ktoré je jednak časovo náročné a vyžaduje si aj kvalifikovanú laborantskú silu. Podľa nášho názoru nie je jeho aplikácia nevyhnutná. Možno by bolo vhodné uvažovať o zriadení pracoviska, kde by sa takéto biopsie odosielali. Eventuálne aj enterobiopsie s normálnym nálezom od jedného pacienta, ktoré by boli po čase opakovane posielané na jedno terénne pracovisko.
ZÁVER
Náš súbor osôb s atypickou celiakiou bol do práce zaradený zámerne. Na sprievodnom liste k vyšetreniu vzoriek bola uvedená aj diagnóza R:10, eventuálne jej podtypy. Táto diagnóza patrí medzi symptómové, ktoré sú vykazované pri rozpakoch a to vo všetkých sektoroch zdravotnej starostlivosti. Pacienti opakovane kolujú po oddeleniach, keď sa stráca veľké množstvo financií v circulus vitiosus rôznych vyšetrení. Po stabilizácii zdravotného stavu dochádza k exacerbáciám, pacient nastupuje opätovne na vyšetrenia, až po relaps. Sme presvedčení, že pokiaľ by títo pacienti podstúpili biopsiu, eventuálne vyšetrenie sérových protilátok, tak by sa to odrazilo aj v nákladoch zdravotných poisťovní. Pacient s nerozpoznanou celiakiou je oveľa drahší pre naše zdravotníctvo ako diagnostikovaný. V domácej literatúre nachádzame isté návrhy a riešenia (2, 25, 49). Navrhujeme, aby pacienti z lôžkových oddelení nemohli byť prepustení len s únikovými diagnózami, včítane R:10. Zdravotné poisťovne by nemali pre lôžkové oddelenia takéto výkony preplácať, eventuálne preplácať len minimálnou finančnou výškou. Pacient by nemal byť prepustený z klinického oddelenia, kým nemá definitívne uzatvorenú diagnózu. Ďalšie návrhy a podnety ohľadom úloh na poli celiakie pre zdravotníctvo a sociálnu sféru sme uviedli v inej práci (34).
Požiadali sme štyri Slovenské zdravotné poisťovne o poskytnutie informácie, koľko ich stáli pacienti s diagnózou R:10 za roky 2006 a 2007. Údaje ohľadom financií sme žiadali od pacientov bez ohľadu na vek, ktorí boli ošetrení v nemocniciach Slovenskej republiky. Poskytnuté údaje sú uvedené v tabuľke 2. Je na škodu, že niektoré poisťovne nám nami žiadané údaje neposkytli. Odvolávajúc sa na vlastné stanoviská zavrhli dobrú myšlienku, ktorá mala poslúžiť každému. Pre poisťovne sme vykonávali výkony aj s presvedčením, že sami stoja za svojimi klientmi a za ich záujmami. Záujmami nielen v chorobe navracať im zdravie, či v ohrození chrániť ich život, ale navyše aj viesť ich k aktívnemu boju za svoje zdravie a za to, aby si vážili svoj život.
Tab. 2. Náklady poisťovní na diagnózu R:10 a jej podtypy 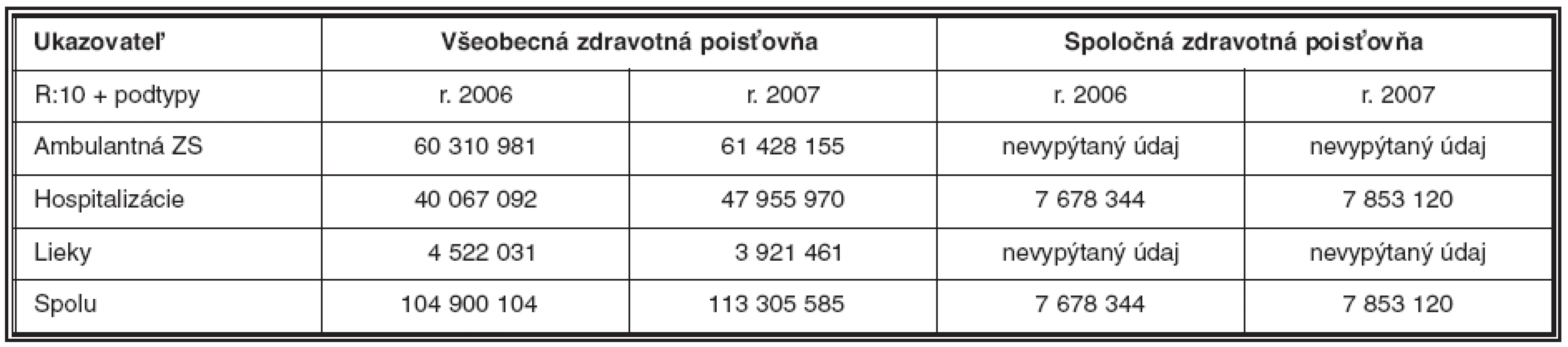
Legenda: ZS – zdravotná starostlivosť Poznámka: hodnoty sú uvedené v Slovenských korunách Poďakovanie
Ďakujeme vedeniu Spoločnej zdravotnej poisťovni a vedeniu Všeobecnej zdravotnej poisťovni za poskytnutie interných údajov z ich databáz.
Práca bola vypracovaná s podporou grantu MSM 6046070901
Ing. Peter Makovický, PhD.
Czech University of Life Sciences
Department of Veterinary Sciences
Kamýcka 129
165 21 Praha 6 – Suchdol
Zdroje
1. Alaedini A., Green P.H.R.: Narrative review: Celiac disease: Understanding a complex autoimmune disorder. Ann. Int. Med., 142, 2005, s. 289–298.
2. Albín A., Bužga R., Dvořáčková J., Šmajstrla V.: Přínos rutinních endoskopických biopsií sliznice duodena pro záchyt celiakie dospělých – první zkušenosti. Prakt. Lék., 79, 1999, s. 151–153.
3. Arato A., Hascek G., Savilahti E.: Immunohistochemical findings in the jejunal mucosa of patients with coeliac disease. Scand. J. Gastroenterol., 33, 1998, s. 3–10.
4. Carbonnel F., dAlmagne H., Lavergne A. et al.: The clinicopathological features of extensive small intestinal CD4 T cell infiltration. Gut., 45, 1999, s. 662–667.
5. Catassi C., Ratsch I.M., Fabiani E. et al.: Celiac-disease in the year 2000 – exploring the iceberg. Lancet, 343, 1994, s. 200 – 203.
6. Catassi C., Fabiani E., Ratsch I.M. et al.: The coeliac iceberg in Italy. A multicentre antigliadin antibodies screening for coeliac disease in school-age subjects. Acta Paed., 85, 1996, s. 29–35.
7. Collin P., Helin H., Maki M., Hallstrom O., Karvonen A.L.: Follow-up of patients positive in reticulin and gliadin antibody tests with normal small-bowel biopsy findings. Scand. J. Gastroenterol., 28, 1993, s. 595–598.
8. de Mascarel A., Belleannée G., Stanislas S. et al.: Mucosal intraepithelial T-lymphocytes in refractory celiac disease: a neoplastic population with a variable CD8 phenotype. Am. J. Surg. Pathol., 32, 2008, s. 744–751.
9. Dickson C.C., Streutker C.J., Chetty R.: Coeliac disease: an update for pathologists. J. Cin. Pathol., 59, 2006, s. 1008–1016.
10. Farrell R.J., Kelly C.: Celiac sprue. N. Engl. J. Med., 346, 2002, s. 180–188.
11. Freeman H.J.: Clinical spectrum of biopsy-defined celiac-disease in the elderly. Can. J. Gastroent., 9, 1995, s. 42 – 46.
12. Frič P.: Komplikace celiakální sprue. Čes.-slov. Gastroent. a Hepatol., 55, 2001, s. 26 – 30.
13. Frič P., Zavoral M.: Celiakální sprue dospělých – opomíjená choroba. Prakt. Lék., 83, 2003, s. 62 – 65.
14. Green P.H.R., Rostami K., Marsh M.N.: Diagnosis of coeliac disease. Best Pract. Res. Clin. Gastroent., 19, 2005, s. 389–400.
15. Guandalini S., Gupta P.: Celiac disease. A diagnostic challenge with many facets. Clin. Appl. Immunol. Rev., 2002, s. 293–305.
16. Hankey G.L., Holmes G.K.T.: Coeliac disease in the elderly. Gut, 35, 1994, s. 65–67.
17. Hill P.G., Holmes G.K.T.: Coeliac disease: a biopsy is not always necessary for diagnosis. Aliment. Pharmacol. Ther., 27, 2008, s. 572–577.
18. Holmes G.K.T., Prior P., Lane M.R., Pope D., Allan R.N.: Malignancy in coeliac disease – effect of a gluten free diet. Gut, 30, 1989, s. 333–338.
19. Ilavská A., Paulovičová E., Mikulecký M.: Význam vyšetrenia sérologických markerov u pacientov s celiakiou. Čas. Lék. Čes., 141, 2002, s. 487–490.
20. Jankowiak C., Ludwig D.: Frequent causes of diarrhea: Celiac disease and lactose intolerance. Med. Klin., 103, 2008, s. 413–422.
21. Kabíček P., Kabíčková E., Frühauf P., Bělohlávek O., Čumlivská E., Kodet R.: Maligní lymfom jako závažná komplikace celiakie diagnostikované v dorostovém věku. Prakt. Lék., 84, 2004, s. 260–262.
22. Kanavaros P., Lavergne A., Galian A. et al.: A primary immunoblastic T malignant lymphoma of the small bowel, with azurophilic intracytoplasmic granules. A histologic, immunologic, and electron microscopy study. Am. J. Surg. Pathol., 12, 1988, s. 641–647.
23. Kolek A., Ehrmann J., Lísová S. et al.: Exprese apoptotických proteinů ve sliznici jejuna u nemocných s celiakií. Čes.-slov. Gastroent. a Hepatol., 57, 2003, s. 87–92.
24. Kolho K.L., Färkkilä M.A., Savilahti E.: Undiagnosed coeliac disease is common in Finnish adults. Scand. J. Gastroenterol., 33, 1998, s. 1280–1283.
25. Kollárová H., Pektor R., Šmajstrla V. et al.: Rutinní biopsie z duodena prováděná během gastroskopie – jedna z možností vyhledávání asymptomatické celiakie. Čes.-slov. Gastroent. a Hepatol., 61, 2007, s. 245–248.
26. Lagerqvist C., Ivarsson A., Juto P., Persson L.A., Hernell O.: Screening for adult coeliac disease – witch serological marker (s) to use?. Int. Med., 250, 2001, s. 241–248.
27. Lísová S., Ehrmann J., Kolek A., Sedláková E., Kolář Z.: Imunohistochemická studie mechanismů apoptózy a proliferace ve sliznici tenkého střeva u celiakální sprue. Čes.-slov. Patol., 41, 2005, s. 85–93.
28. Lojda Z.: Proteinases in pathology. Usefulness of histochemical methods. J. Histochem. Cytochem., 1981, s. 481–493.
29. Lukáš, M.: Celiakie – glutenová enteropatie. Vnitř. Lék., 2003, 49, s. 449–451.
30. Lukáš Z.: Histopatologie a diferenciální diagnostika celiakální sprue. Čes.-slov. Patol., 40, 2004, s. 3–6.
31. Lurie Y., Landau D.A., Pfeffer J., Oren R.: Celiac disease diagnosed in the elderly. J. Clin. Gastroenterol., 42, 2008, s. 59–61.
32. Mäki M., Holm K., Koskimies S., Hällström., Visakorpi J.K.: Normal small bowel biopsy followed by coeliac disease. Arch. Dis. Child., 65, 1990, s. 1137–1141.
33. Makovický, P.: Prípad relapsu celiakie s histologickou a histochemickou analýzou, ako determinant potreby trvalého sledovania pacientov po dovŕšení dospelosti. Čes.-slov. Gastroent. a Hepatol., 58, 2004, s. 102–104.
34. Makovický Pe., Makovický Pa., Jílek F.: Od historických názorov a poznatkov až po súčasné úlohy na poli celiakie. Epidemiol., Mikrobiol., Imunol., 57, 2008, s. 90–96.
35. Makovický P., Makovický P., Greguš M., Klimik M., Zimmermann M.: Histopatologická diagnostika celiakie u dospelých s funkčným dyspeptickým syndrómom. Čes.-slov. Patol., 44, 2008, s. 16–19.
36. Makovický Pe., Makovický Pa., Klimik M., Greguš M., Zimmermann M.: Pozitivita sérových protilátok proti endomýziu, jejunu a histopatologická diagnostika celiakie u detí. Vnitř. Lék., 54, 2008, s. 25–30.
37. Marsh M.N.: Gluten, major histocompatibility complex, and the small intestine: a molecular and imunobiologic approach to the spectrum of gluten sensitivity („Celiac Sprue“). Gastroenterology, 1992, 102, s. 330–354.
38. Mazzarella G., Stefanile R., Camarca A. et al.: Gliadin activates HLA class I-restricted CD8+ T cells in celiac disease intestinal mucosa and induces the enterocyte apoptosis. Gastroenterology, 134, 2008, s. 1017–1027.
39. Meier-Ruge W.A., Bruder E.: Current concepts of enzyme histochemistry in modern pathology. Pathobiol., 75, 2008, s. 233–243.
40. Mercer J., Eagles M.E., Talbot I.C.: Brush border enzymes in coeliac disease: histochemical evaluation. J. Clin. Pathol., 43, 1990, s. 307–312.
41. Naim H.Y.: Molecular and cellular aspects and regulation of intestinal lactase-phlorizin hydrolase. Histol., Histopathol., 16, 2001, s. 553–561.
42. Prokopová L.: Celiakie – závažné onemocnění. Vnitř. Lék., 49, 2003, s. 474–481.
43. Prokopová L.: Celiakie – co má vědět ambulantní internista. Int. Med. pro praxi, 10, 2008, s. 233–239.
44. Robins G., Howdle P.D.: Advances in celiac disease. Cur. Opin. Gastroenterol., 21, 2005, s. 152–161.
45. Rostami K., Kerckhaert J., Tiemessen R. et al.: Sensitivity of antiendomysium and antigliadin antibodies in untreated celiac disease: dissapointing in clinical practise. Amer. J. Gastroent., 94, 1999, s. 888–894.
46. Sbarbati A., Valletta E., Bertini M. et al.: Gluten sensitivity and „normal“ histology: is the intestinal mucosa really normal? Dig. Liv. Dis., 35, 2003, s. 768–773.
47. Siry M., Burges C., Stiens R., Schneider H., Steiff J.: First diagnosis of celiac disease in a 67-year-old female patient. Dtsch. Med. Wochenschr., 125, 2000, s. 932–936.
48. Swinson C.M., Slavin G., Coles E.C., Booth C.C.: Celiac-disease and malignancy. Lancet, 1983, s. 111–115.
49. Utešený J.: Celiakální sprue – editorial. Vnitř. Lék., 54, 2008, s. 7–11.
50. Vivas S., de Morales J.M.R., Martinez J. et al.: Human recombinant anti-transglutaminase antibody testing is useful in the diagnosis of silent coeliac disease in a selected group of at-risk patients. E. J. Gastroent. Hepatol., 15, 2003, s. 479–483.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Goodbye, Bernie!Článek JAK SE VÁM LÍBÍ?Článek Jaká je Vaše diagnóza?Článek Jaká je Vaše diagnóza?
Článek vyšel v časopiseČesko-slovenská patologie

2009 Číslo 1-
Všechny články tohoto čísla
- MOŽNOSTI DIAGNOSTIKY CELIAKIE V BIOPTICKEJ PRAXI
- Jaká je Vaše diagnóza?
- Postradiačná dediferenciácia meningeómu do chondroblastického osteosarkómu
- Jaká je Vaše diagnóza?
- Goodbye, Bernie!
- In memoriam profesor Jan Buček
- JAK SE VÁM LÍBÍ?
- HISTOLOGICKÁ DIFERENCIÁLNÍ DIAGNOSTIKA HYDATIDÓZNÍCH MOL A HYDROPICKÝCH ABORTŮ
- KARCINOM Z MERKELOVÝCH BUNĚK – IMUNOHISTOLOGICKÁ STUDIE V SOUBORU 11 PACIENTŮ
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- HISTOLOGICKÁ DIFERENCIÁLNÍ DIAGNOSTIKA HYDATIDÓZNÍCH MOL A HYDROPICKÝCH ABORTŮ
- Postradiačná dediferenciácia meningeómu do chondroblastického osteosarkómu
- KARCINOM Z MERKELOVÝCH BUNĚK – IMUNOHISTOLOGICKÁ STUDIE V SOUBORU 11 PACIENTŮ
- In memoriam profesor Jan Buček
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



