-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Možnosti využití ligandů prostatického specifického membránového antigenu (PSMA) v diagnostice a léčbě karcinomu prostaty
Possibilities of using prostate specific membrane antigen (PSMA) ligands in the diagnosis and treatment of prostate cancer
Sedláčková H, Dolejšová O, Pitra T, Ferda J, Fer ‑ dová E, Baxa J, Hora M. Possibilities of using prostate specific membrane antigen (PSMA) ligands in the diagnosis and treatment of prostate cancer.
Multiparametric magnetic resonance imaging of prostate (mpMR) or hybrid imaging using positron emission tomography and computed tomography or magnetic resonance imaging (PET/CT, PET/MR) entered into common practice in diagnostics. They have proven to be successful in diagnostics, but also in detection of biochemical recurrence. Due to the low specificity, but also the sensitivity, especially at low prostate specific antigen (PSA) level in the bio ‑ chemical relapse (BCR) PSA ≤ 1 ug/l, new radiotracers are sought to improve diagnostics and then to conduce to the correct treatment decision. Given the fact that the overexpression of PSMA on prostate cancer cells, its further investigated for use in therapy such as radio-guided surgery or radiolabeled with alpha or beta radiation emitters for radiotherapy.
According to the available systematic reviews and clinical trials, the sensitivity and specificity in primary staging of prostate cancer using PSMA ligands is usually above 40% (23–100%) and more than 85% (67–100%), respectively. Whereas in the detection of biochemical relapse the sensitivity is above 75% and the specificity is about 99%. Using PSMA ligands in performing PET/CT or less frequently PET/MRI has the impact on changes in therapeutic procedure, approximately in 21% of patients in primary staging and in patients with biochemical relapse up to 51%.
Current promising results from clinical trials have led to the incorporation of hybrid imaging using PSMA ligands into European urological guidelines.
Keywords:
diagnostics – PET/CT – PET/MRI – prostate cancer – PSMA
Autoři: Hana Sedláčková 1; Olga Dolejšová 1; Tomáš Pitra 1; Jiří Ferda 2; Eva Ferdová 2; Jan Baxa 2; Milan Hora
Působiště autorů: Urologická klinika, Fakultní nemocnice Plzeň 1; Klinika zobrazovacích metod, Fakultní nemocnice Plzeň 2
Vyšlo v časopise: Ces Urol 2020; 24(4): 247-260
Kategorie: Přehledový článek
Souhrn
Sedláčková H, Dolejšová O, Pitra T, Ferda J, Ferdo ‑ vá E, Baxa J, Hora M. Možnosti využití ligandů prostatického specifického membránového antigenu (PSMA) v diagnostice a léčbě karcinomu prostaty.
S nástupem zobrazovacích metod do praxe, jako je multiparametrická magnetická rezonance prostaty (mpMR) nebo hybridní zobrazovací metody pomocí pozitronové emisní tomografie a počítačové tomografie nebo magnetické rezonance (PET/CT, PET/MR), se osvědčily v diagnostice, ale i v detekci biochemické recidivy karcinomu prostaty. Vzhledem k nízké specificitě, ale i senzitivitě prostatického specifického antigenu (PSA) u biochemické recidivy (BCR) zejména při nízkých hodnotách PSA ≤ 1 µg/l, jsou hledány nové radiotracery, které zlepší diagnostiku a posléze přispějí ke správnému výběru léčby. Ligandy PSMA časně vstoupily do klinické praxe, právě pro jejich výbornou míru detekce. Vzhledem k nadměrné expresi PSMA na buňkách karcinomu prostaty je dále zkoumán ve využití v léčbě, jako například radioaktivitou naváděné operace nebo při radioterapii značen emitery alfa nebo beta záření.
Dle dostupných systematických přehledů a studií v primárním stagingu karcinomu prostaty za použití PSMA ligandů se senzitivita pohybuje nad 40 % (23–100 %) a specificita nad 85 % (67–100 %), zatímco v detekci biochemické recidivy je senzitivita nad 75 % a specificita okolo 99 %. Použití PSMA ligandu při provedení PET/CT nebo méně častěji PET/MR má též roli ve změně terapeutického postupu, a to v rámci primárního stagingu zhruba u 21 % pacientů a u pacientů s biochemickým relapsem až u 51 %.
Aktuální slibné výsledky z klinických studií vedly k začlenění hybridního zobrazení pomocí PSMA ligandů do Evropských urologických doporučených postupů.
Klíčová slova:
diagnostika – karcinom prostaty – PET/CT – PET/MR – PSMA
ÚVOD
Karcinom prostaty (KP) je nejčastější maligní nádorové onemocnění u mužů v západních zemích a je druhou nejčastější příčinou úmrtí na nádorová onemocnění (1). Jako u ostatních malignit, přesný staging, ale i restaging je zásadní krok při výběru nejvhodnější terapeutické strategie. Základním cílem stagingu a restagingu je nalézt rozsah a lokalizaci tumoru v prostatě, uzlinové, kostní nebo viscerální metastázy, a tak rozhodnout o nejlepší léčebné metodě (2). Lokalizovaný KP je převážně léčen radikální prostatektomií (RP) nebo radikální radioterapií (rRT), ale až třetina pacientů vykazuje recidivu (3). Vzrůst prostatického specifického antigenu (PSA) je typicky první známkou recidivy a nazývá se recidivou pouze PSA, PSA‑only recurrence, protože pacienti s hodnotou PSA < 10 ng/ml mají typicky negativní výsledky na počítačové tomografii (CT) a 99mTc scintigrafii kostí. Hybridní zobrazení pomocí pozitronové emisní tomografie a počítačové tomografie (PET/CT) založené na cholinu umožnilo detekci místa recidivy při hladinách PSA > 1–2 ng/ ml (1). U pacientů se stoupající hodnotou PSA je dle guidelines doporučena salvage radioterapie (SRT). SRT poskytuje nejlepší výsledky při zahájení terapie u pacientů s recidivou PSA 0,2–0,5 ng/ml. V současné době se v diagnostice, stagingu i restagingu užívá ultrasonografie (US), počítačová tomografie (CT), magnetická rezonance (MR) a scintigrafie kostí (4). Ve skutečnosti však tyto modality mají omezenou diagnostickou přesnost, zejména při detekci subcentimetrových uzlinových metastáz a v lokalizaci místa biochemické recidivy. Více studií ukazuje na nedostatečnou míru senzitivity a specificity, a to zejména u nemocných, kde hladina PSA je pod 3 ng/ml (2), proto je často nutné využívat metody, které se odlišují od konvenčních přístupů k zobrazování většiny nádorů, a to ve stagingu, ale i restagingu KP (5, 6). Předoperační hodnocení metastáz do lymfatických uzlin dokonce i pokročilejšími zobrazovacími metodami, jako je hybridní vyšetření PET/CT založené na cholinu, prokázalo omezenou senzitivitu a specificitu, zejména u pacientů s nízkou hodnotou PSA (7). Počínaje rokem 2012 [18 F] a [68Ga] značené inhibitory prostatického specifického membránového antigenu (PSMA) v zobrazování karcinomu prostaty pomocí pozitronové emisní tomografie (PET) časně vstoupily do klinického vývoje a prokázaly okamžitou naději pro senzitivitu a specificitu v identifikaci lokálního a vzdáleného onemocnění (8). Bylo prokázáno, že 68Ga‑PSMA PET vyšetření detekuje metastatické léze s vynikajícím zobrazením a ve vysoké míře. Při biochemické recidivě tato technologie detekuje metastatické postižení i při nízkých hladinách PSA, méně než 0,5 ng/ml (9). Zobrazení pomocí PET/CT a PET/MR založené na 68Ga‑PSMA začalo být používáno při stagingu a restagingu KP s velmi slibnou diagnostickou přesností (2). 68Ga‑PSMA PET se v celosvětovém měřítku stále častěji používá k posouzení lokálního a metastatického šíření karcinomu prostaty, obvykle u biochemické recidivy nebo u pokročilých onemocnění. Zejména pak staging high‑risk lokalizovaného, pokročilého a metastatického karcinomu prostaty se stává čím dál tím více důležitějším pro správné vedení lokální, ale i systémové terapie (10).
PSMA
Prostatický specifický membránový antigen je transmembránový glykoprotein typu II s intracelulární částí (aminokyseliny 1–18), transmembránovou doménou (aminokyseliny 19–43) a rozsáhlou extracelulární doménou (aminokyseliny 44–750). Gen lidského PSMA byl nalezen v chromozómu 11p11-12, který kóduje expresi PSMA v prostatě (11). PSMA je enzymaticky aktivní pouze ve své dimerní formě, ale jeho funkce pro prostatické buňky je stále neznámá. Dysplastická a neoplastická transformace tkáně prostaty ve výsledku vede k přenosu PSMA z apikální membrány na luminální povrch kanálků.
PSMA má signifikantně zvýšenou expresi v buňkách KP ve srovnání s jinými tkáněmi exprimujícími PSMA, jako jsou ledviny, proximální tenké střevo nebo slinné žlázy. Minimální exprese je také pozorována v mozku. PSMA má důležitou roli v karcinogenezi a progresi KP, v glutamátové neurotransmisi a absorpci kyseliny listové.
Neočekávané místo exprese PSMA je neovaskularizace u všech solidních tumorů, zatímco v normálních cévách exprese PSMA není přítomna. Přesná příčina není známa (12).
PSMA je zvýšeně regulován u KP, u jeho metastatického postižení a u hormonálně refrakterního karcinomu prostaty. Exprese PSMA je inverzně modulována androgenními hladinami (11).
Prostatický specifický membránový antigen je nadměrně exprimován u KP, asi u 90 % všech KP a 100–1 000× více ve srovnání s expresí na normálních epiteliálních buňkách prostaty, slinných žláz, tenkého střeva a renálních tubulech. Byl také nalezen u některých nádorů tenkého střeva, močového měchýře, mozku, prsu a ledvin (2).
PSMA LIGANDY A INHIBITORY
Existují tři typy ligandů nebo inhibitorů PSMA, včetně inhibitorů na bázi fosforu, thiolu nebo močoviny. Inhibitory na bázi močoviny mají nejvyšší afinitu a specificitu pro PSMA. PSMA‑HBED‑CC (PSMA-11) je nejrozšířenějším ligandem, který lze snadno označit izotopem 68Ga za pokojové teploty s dobrou stabilitou a vysokou koncentrací i v malých metastatických ložiscích. Má intenzivní fyziologické vychytávání ve slinný žlázách, játrech, slezině, tenkém střevu a v močovém traktu. 68Ga‑PSMA - I, T a PSMA-617 jsou theranostickými ligandy, které mohou být také značeny Indiem 111 pro radiologicky naváděnou operaci a Luteciem 177 pro cílenou terapii. Dále byly představeny 18 F značené inhibitory PSMA, mají lepší zobrazení než 68Ga a snadnou dostupnost, bohužel ale mají delší poločas (110 minut vs. 68 minut) (2).
V roce 2012 Afshar‑Oromieh et al. oznámili slibné výsledky s použitím 68Ga‑PSMA-11 jako PET/CT radiotraceru u pacientů s karcinomem prostaty a pozdější metaanalýzy potvrdily zjištění a naznačily, že 68Ga‑PSMA PET/CT detekuje KP lépe než radioaktivně značený cholin PET/CT (13).
18 F‑DCFBC (N-[N-[(S)-1,3-dicarboxypropyl]car‑bamoyl]-4-18 F‑fluorobenzyl‑L‑cysteine) a 68Ga ‑ ‑PSMA-11 byly prvními radiotracery pro PET. 18 F značené ligandy využívají průměrně nižší pozitronovou energii, která vede k vyššímu vnitřnímu prostorovému rozlišení. Přestože 18 F‑DCFBC vykazoval trvale vysokou aktivitu v krvi a poměrně nízký poměr tumoru oproti pozadí, druhá generace 18 F‑značeného derivátu močoviny s malou molekulou známou jako 18 F‑DCFPyl (2-(3-{1-carbo‑xy-5-[(6-18 F‑fluoro‑pyridine-3-carbonyl)-amino]pentyl}-ureido)-pentanedioic acid) překonala tato omezení. Nedávno byl představen 18 F značený ligand, 18 F‑PSMA-1007, který využívá velmi nízkou clearance močoviny a potenciálně usnadňuje zkvalitnění hodnocení prostatického lůžka. 18 F‑značené ligandy také nabízejí delší poločas a potenciálně snadnější centralizovanou výrobu a distribuci než sloučeniny označené 68Ga (12).
HODNOCENÍ SNÍMKŮ
Na základě vysoké a specifické cílené hladiny exprese na většině buněk KP, PSMA PET/CT detekuje více než polovinu metastáz do lymfatických uzlin s průměrem ≥ 2,3 mm a více než 90 % lézí s průměrem ≥ 4,5 mm v plánování salvage lymfadenek ‑ tomie. Staging je určen pro celé zorné pole, a to i pro oblasti, které jsou jinak nepřístupné pro operaci nebo biopsii. Na základě těchto jedinečných charakteristik Eiber a kol. navrhli TNM klasifikaci verze 1.0 založenou na molekulárním zobrazení – molecular imaging TNM (miTNM) pro staging KP pro PSMA PET/CT. Tato klasifikace může být též použita pro PSMA PET/MR. miTNM klasifikace slouží ke standardizovanému hodnocení přítomnosti, lokalizaci a rozsahu lokálního KP a jeho pánevního šíření. Dále také ke zjištění přítomnosti, polohy a rozsahu vzdálených metastáz. Výsledky jsou řazeny do kategorií, které popisují hladinu exprese PSMA a schéma postižení kostí, což může odhadnout prognózu pacienta (14).
Je známo, že PSMA exprese založená na imunohistochemii koreluje s diferenciací nádorů a prognózou. Ztráta exprese PSMA v metastázách může naznačovat dediferenciaci a zvyšující se heterogenitu tumoru, což vede k agresivnějším fenotypům. V intraprostatických lézích zobrazených pomocí PET s PSMA‑ligandem je prokázáno, že míra vychytávání koreluje s agresivitou nádoru definovanou pomocí Gleason skóre.
Kategorie byly definovány ve vztahu k vychytávání PSMA ligandu v krevním řečišti, játrech a příušní žláze. Výsledky jsou klasifikovány do kategorií 0, 1, 2, 3, pro žádnou, nízkou, střední nebo vysokou úroveň exprese PSMA. Skóre 2 a 3 jsou považovány za typické pro léze KP (tab. 2).
Tab. 1. Využití PSMA PET/CT (PET/MR) v urologické praxi dle EAU 2020
Tab. 1. Use of PSMA PET/CT (PET/MR) in urological practice according to EAU 2020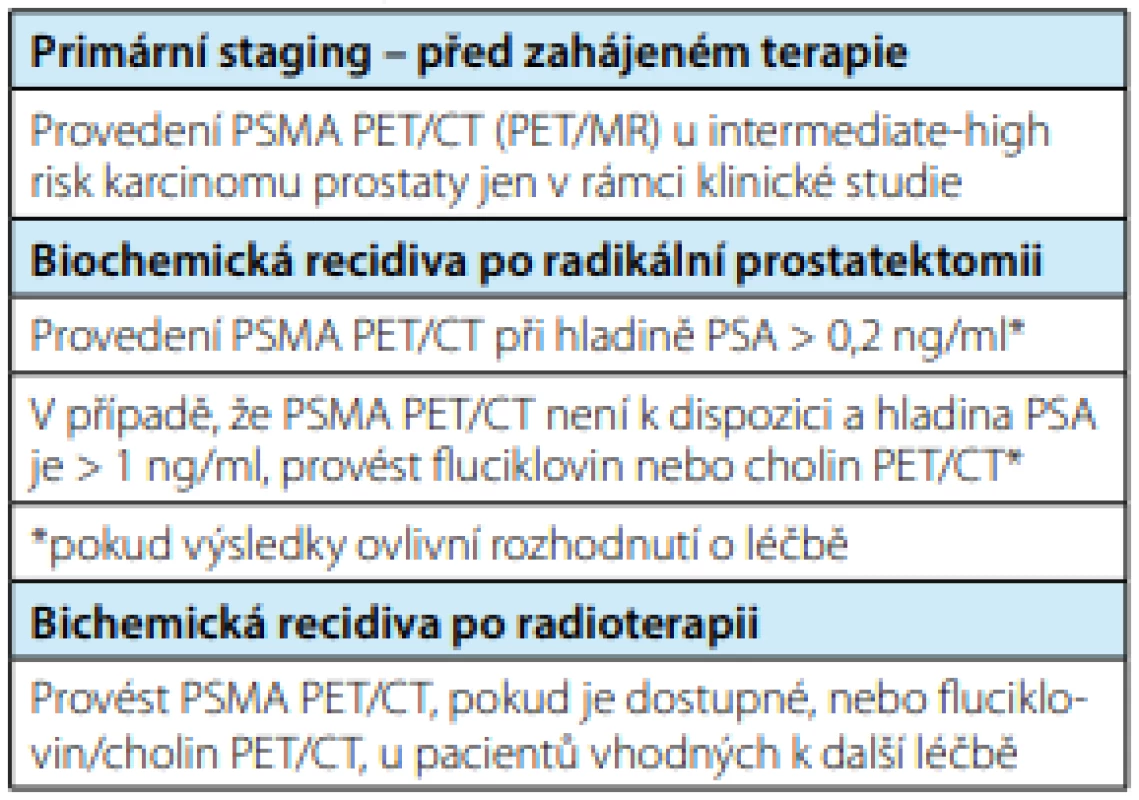
Tab. 2. Molecular Imagine TNM klasifikace; převzato z (14)
Tab. 2. Overview of molecular imagine TMN classification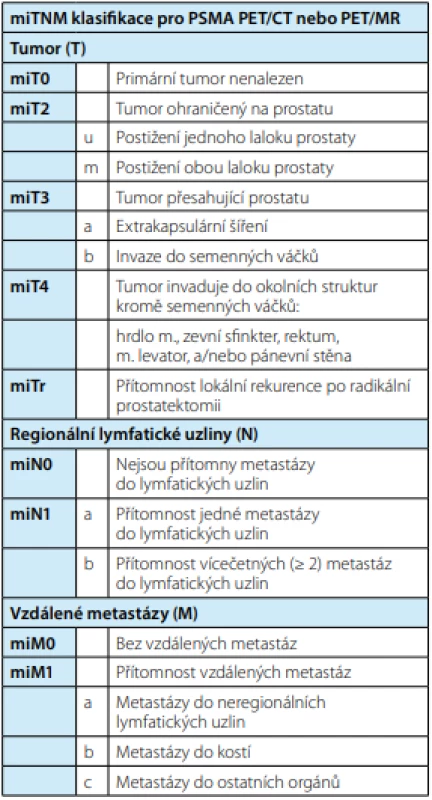
Klasifikace tumoru: miT0 popisuje absenci lokální recidivy jak po radikální prostatektomii, tak po radioterapii. Kategorie miT2-4 definují rozsah lokálního KP. Lokalizovaný nádor je definován jako miT2u pro unifokální a miT2m pro multifokální postižení.
Extraprostatické šíření je klasifikováno do tří kategorií v souladu s klinicko‑patologickou TNM klasifikací: miT3a jako omezené extraprostatické šíření, miT3b šíření do semenných váčků, miT4 jako infiltrace vnějšího svěrače, konečníku, močového měchýře, levatorových svalů a/nebo pánevní stěny (obr. 1).
Obr. 1. Molecular Imagine Tumor klasifikace; převzato z (14)
Fig. 1. Molecular Imagine Tumor classification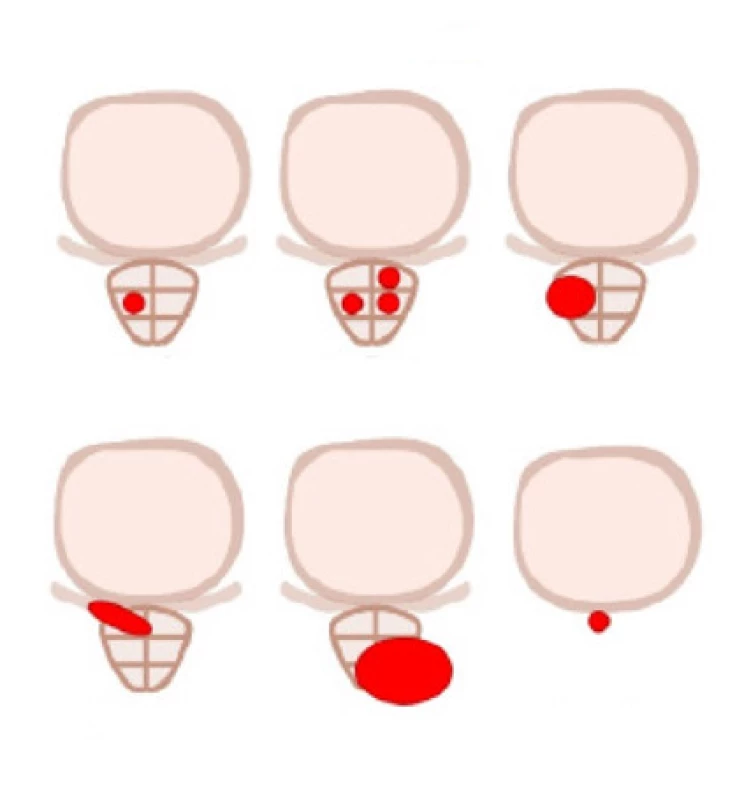
Klasifikace LU: Metastázy do pánevních lymfatických uzlin jsou zařazeny do kategorie miN1a pro postižení jedné LU a miN1b pro vícečetné postižení.
Klasifikace metastáz: V souladu s klinicko‑patologickou TNM klasifikací jsou vzdálené metastázy rozděleny do tří kategorií: miM1a jako postižení mimopánevních LU, kostní metastázy miM1b a orgánové metastázy miM1c. PSMA‑ligand PET/CT se ukázal jako lepší zobrazovací metoda než scintigrafie kostí při popisu rozsahu postižení kostí. Kostní onemocnění je subkategorizováno podle rozsahu postižení na unifokální, oligometastastické, diseminované onemocnění a difuzní postižení kostní dřeně (Obr. 2). Oligometastatické postižení kosti je diagnostikováno v případě tří nebo méně kostních lézí. Postižení kostí může mít významné důsledky pro prognózu a management léčby. Například jedna kostní metastáza-miM1b (uni) může být léčena cílenou radioterapií, zatímco difuzní postižení kostní dřeně signalizuje zvýšené riziko hematotoxicity po radioterapii (14).
Obr. 2. Hodnocení metastáz do lymfatických uzlin a vzdálených metastáz; převzato z (14)
Fig. 2. Evaluation of lymph node metastases and distant metastases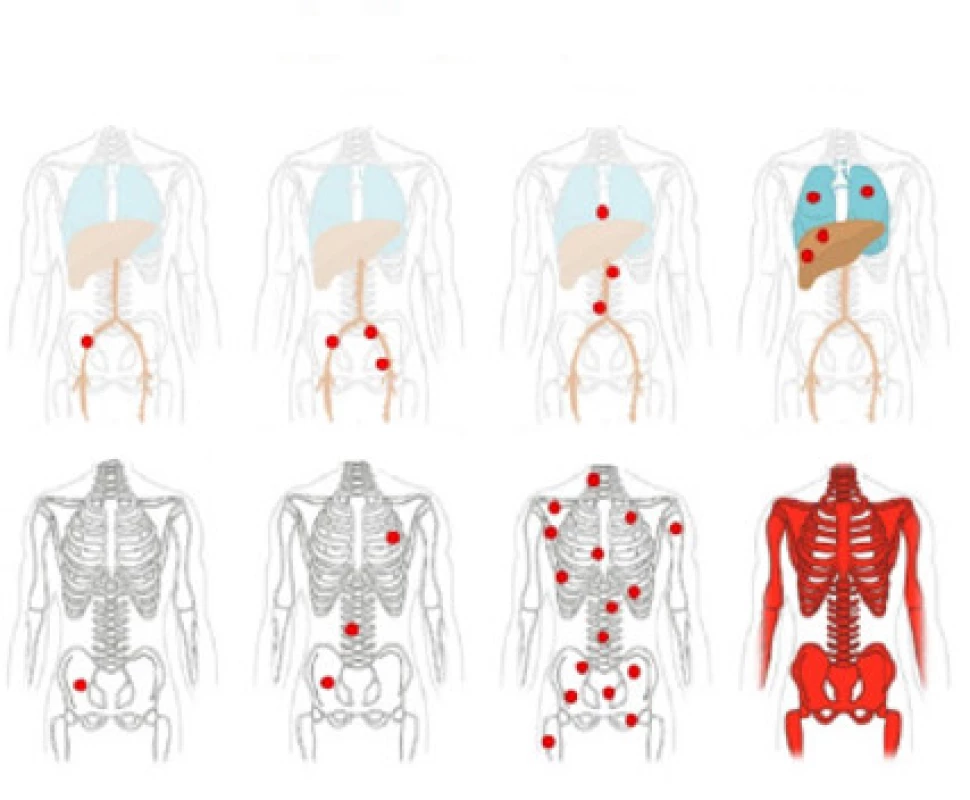
Pro zobrazování prostaty pomocí magnetické rezonance je používán systém PI‑RADS (Prostate Imaging–Reporting and Data Systém). Jedná se o strukturované schéma k hodnocení lézí podezřelých z karcinomu prostaty na snímcích z mpMR prostaty. Bylo vyvinuto i několik dalších schémat, BI‑RADS (Breast Imaging Reporting And Data System) pro zobrazování prsu a pro zobrazování jater LI‑RADS (Liver Imaging Repor ‑ ting and Data Systém). Rowe a kol. inspirováni úspěšnou klinickou implementací těchto variant RADS, vyvinuli systematický přístup k interpretaci výsledků PET pomocí PSMA označený jako PSMA‑RADS verze 1. 0. V nejjednodušším pojetí je PSMA‑RADS uspořádání pro klasifikaci snímků PET značených PSMA a nálezy jsou řazeny do kategorií, které odrážejí pravděpodobnost přítomnosti KP. Systém je optimalizován pro nálezy mimo prostatu a není určen k nahrazení PI‑RADS pro kategorizaci nálezů na MR prostaty.
PSMA‑RADS verze 1.0 je uspořádána jako pěti ‑ bodová stupnice, přičemž vyšší čísla udávají větší pravděpodobnost KP (tab. 3). Ve spodní části stupnice jsou léze PSMA‑RADS-1 a PSMA‑RADS-2, určitě a téměř jistě benigní pro KP. Naproti tomu PSMA‑RADS-4 naznačuje vysokou pravděpodobnost přítomnosti KP a PSMA‑RADS-5 léze představuje téměř jistě KP. Nejsložitější z kategorií PSMA‑RADS verze 1.0 je PSMA‑RADS-3, která je dále rozdělena do čtyř podkategorií, které odrážejí buď nejistotu, zda daná léze je v souladu s KP (PSMA‑RADS-3 A, PSMA - RADS-3 B a některé nálezy PSMA‑RADS-3D), nebo naznačují přítomnost další malignity (PSMA‑RADS-3C a některé nálezy PSMA‑RADS-3D). Celková kategorie snímků odpovídá nejvyšší určené hodnotě. Kromě toho, že PSMA‑RADS poskytuje jasné výsledky zjištěné na PET, má další výhody. Spuštění PSMA‑RADS je v souladu s kvalitou pohybu v diagnostickém zobrazování, přičemž cílem strukturovaného reportu je snížit interpretační rozptyl. Systematický způsob, jakým je třeba kategorizovat nálezy, umožní snadnější harmonizaci údajů při multicentrických studiích (8).
Tab. 3. Přehled klasifikace PSMA-RADS verze 1,0; převzato z (8)
Tab. 3. Overview of classification PSMA-RADS version 1.0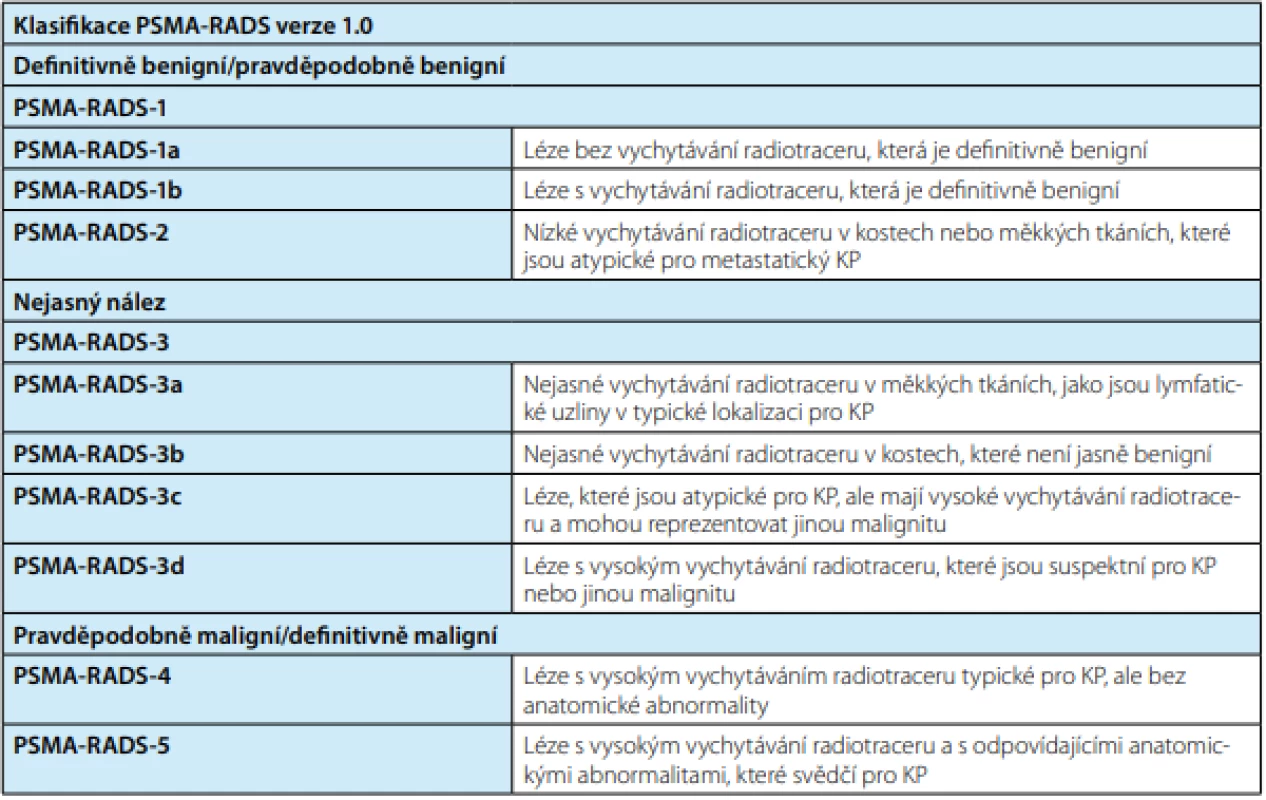
Reálné zobrazení karcinomu prostaty pomocí 68Ga‑PSMA-11 PET/MR je znázorněno na obrázcích 3, 4, 5 provedených Klinikou zobrazovacích metod Fakultní nemocnice v Plzni.
Obr. 3. Karcinom prostaty v pravém laloku se šířením do semenného váčku cT3b
Fig. 3. Prostate cancer in right lobe with right seminal vesicle invasion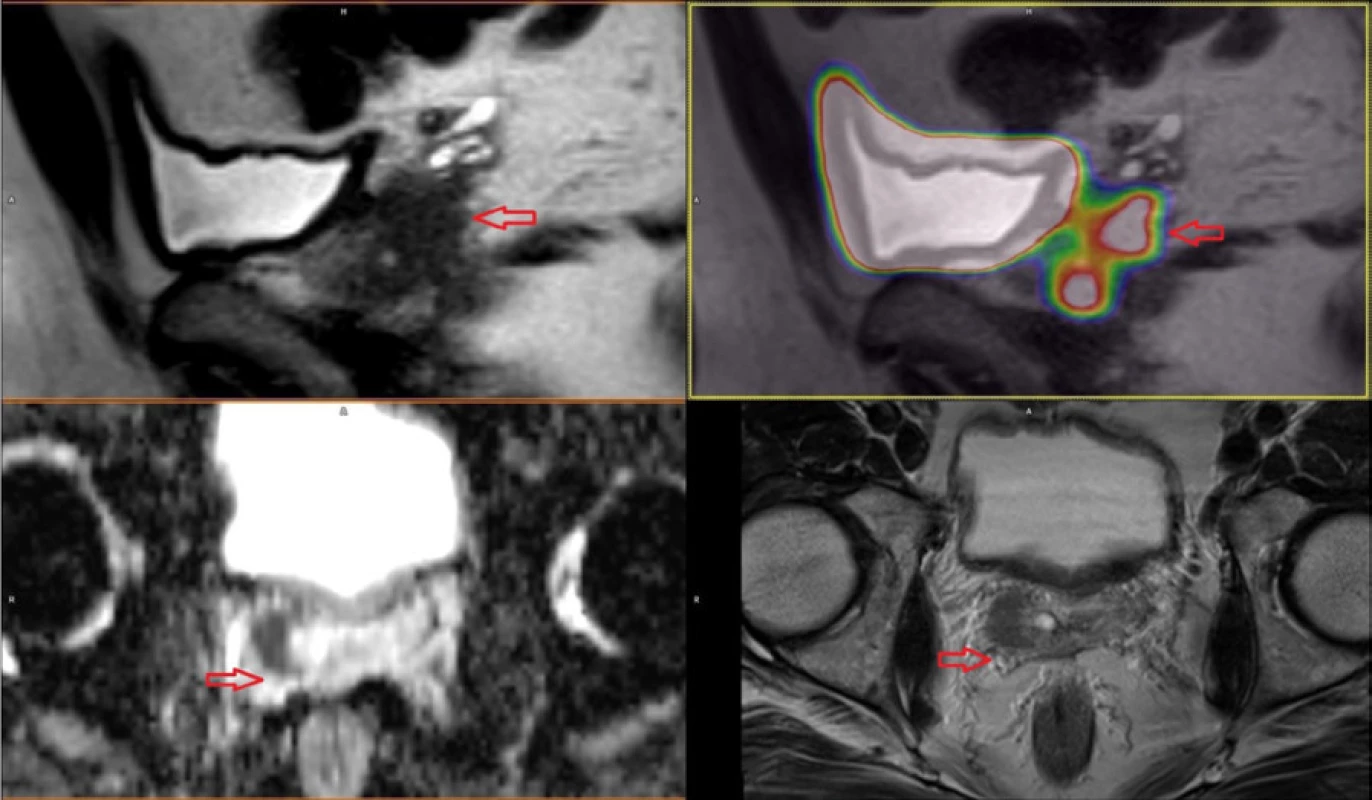
Obr. 4. Metastázy do lymfatických uzlin karcinomu prostaty
Fig. 4. Lymph nodes metastases in prostate cancer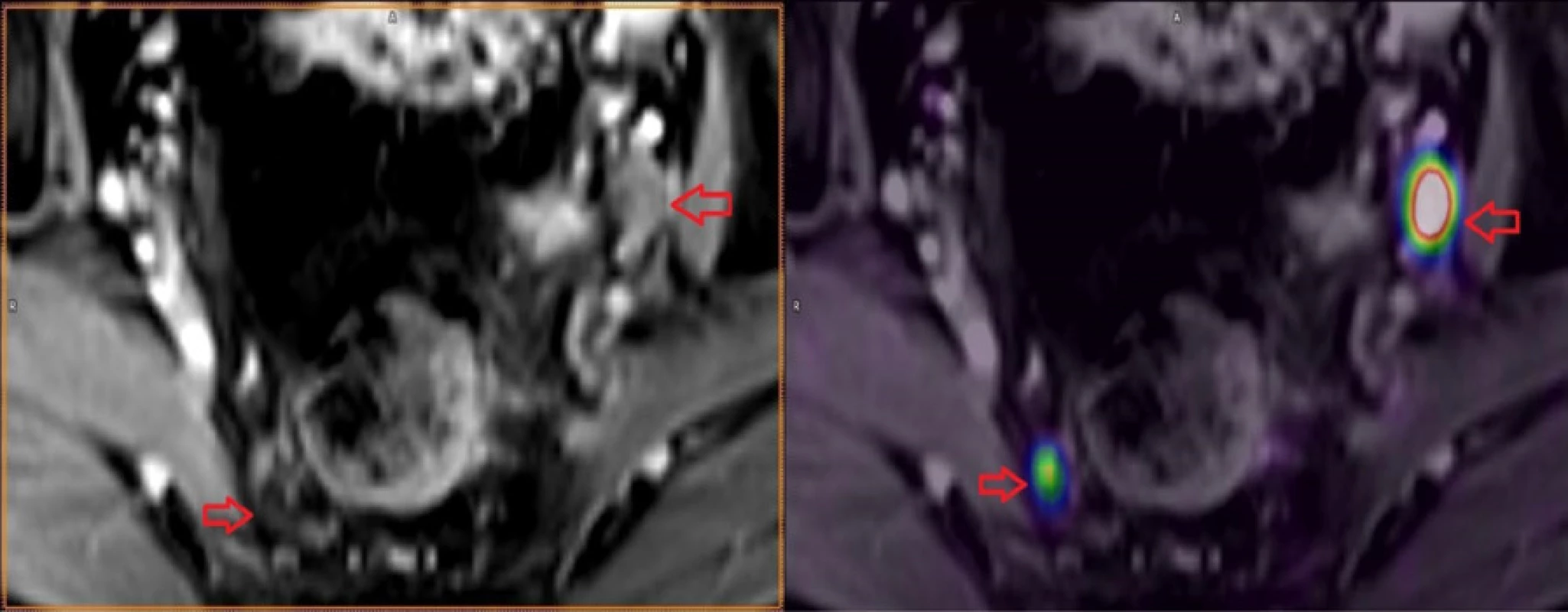
Obr. 5. Vícečetné kostní metastázy u karcinomu prostaty
Fig. 5. Multiple bones metastases in prostate cancer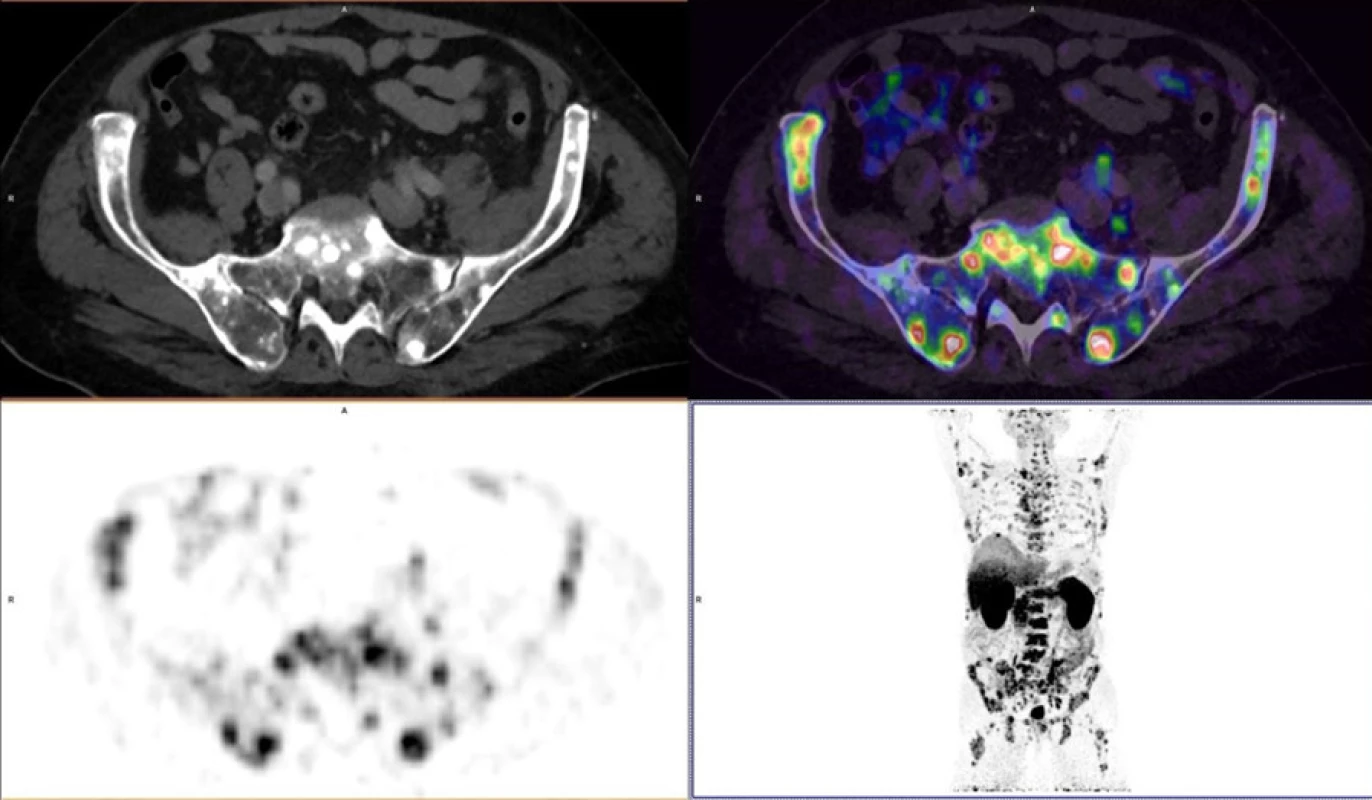
VÝSLEDKY PRO BIOCHEMICKÝ RELAPS
V systematickém přehledu autorů Finn E. von Eyben a kol. bylo zařazeno devět studií pro restaging pomocí Ga‑PSMA PET/CT u mužů s přetrvávající a rostoucí hladinou PSA po počáteční léčbě (1). Sedm studií provedlo pouze restaging 68Ga - PSMA PET/CT, zatímco dvě studie zahrnuli staging i restaging 68Ga‑PSMA PET/CT. U dvou studií byla recidiva PSA po RP, zatímco ostatních sedm studií hlásilo recidivu PSA po RP i RT. Míra detekce byla 50 % pro hodnoty PSA 0,2–0,49ng/ ml, 53 % pro hodnotu PSA 0,5–0,99 ng/ml a dále rostoucí pro zvyšující se hladinu PSA (1).
Přehledový článek Eiber a kol. zmiňuje několik prací. Jedna z největších retrospektivních studií Afshar‑Oromieh a kol. zahrnující 319 pacientů (24 bez předchozí definitivní léčby) zaznamenala míru detekce 88,1 % na pacienta. Eiber a kol. vyšetřili 248 pacientů s biochemickou recidivou (BCR) po radikální prostatektomii a míra detekce byla 89,5 %. Míra detekce pro časnou BCR při hodnotách PSA 0,2–0,5 a 0,5–1 ng/ml byla 57,9 % a 72,7 %. V obou studiích byla detekce nádorů pozitivně spojena s hladinou PSA, nikoliv však s PSA doubling time (12). Několik studií ukázalo zlepšení detekce tumoru s použitím 68Ga‑PSMA-11 v porovnání s cholinovými deriváty pro PET/CT u pacientů s BCR. Například Afshar‑Oromieh a kol. detekovali karci ‑ nom u 32 z 37 pacientů s BCR (86,5 %) s použitím 68Ga‑PSMA-11, zatímco s použitím 18 F‑Cholinu jen 26 z 37 pacientů (70,3 %) (15).
Stále vzrůstají důkazy, že prognóza pacienta je zlepšena zahájením salvage terapie dříve, než hladina PSA přesáhne 0,5 ng/ml. U těchto pacientů byla v různých studiích zjištěna míra detekce pro 68Ga‑PSMA-11 PET/CT v rozmezí 50,0–57,9 % – vyšší než u jakékoli jiné zobrazovací modality. Takže 68Ga‑PSMA-11 PET/CT potenciálně umožňuje účinnější salvage terapii (12).
Rauscher a kol. předkládají výsledky rozsáhlé multicentrické studie, která hodnotí schopnost 68Ga‑PSMA PET/CT identifikovat recidivující KP u mužů po radikální prostatektomii (RP) s hodnotami PSA mezi 0,2 a 1,0 ng/ml. Věrohodnost studie spočívá ve velikosti a homogenitě populace. Muži byli stratifikováni do skupin na základě hodnoty PSA v době provedení PSMA PET/CT na „velmi nízké“ (0,2–0,5 ng/ml) nebo „nízké“ (> 0,5–1,0 ng/ml). Z 1 697 mužů, kteří podstoupili PSMA PET/CT pro biochemickou recidivu, splnilo kritéria pro zařa ‑ zení 272 pacientů. PSMA PET/CT bylo pozitivní u 65 % pacientů, avšak míra detekce byla nižší u mužů s „velmi nízkým“ PSA 55 % vs. 74 % u mužů s „nízkým“ PSA. Lokalizace pozitivních lézí byla primárně v pánevních/retroperitoneálních lymfatických uzlinách, lokální recidiva v prostatickém lůžku a v kostech a toto bylo opět pozitivně korelováno s podskupinami PSA. Jediné klinicko‑patologické znaky, které byly spojeny s pozitivitou vyšetření byly PSA a současná androgen-deprivační tera ‑ pie (ADT), pT stadium, iniciální pN stadium, grade group a předchozí radioterapie nebyly klinicky významné. Jedinečné pro tuto studii je, že autoři poskytují ucelený a komplexní model předpovědi PSMA PET/CT pozitivity pomocí výše uvedených klinicko‑patologických proměnných (12).
V nedávné metaanalýze Perera a kol. identifikovali srovnatelnou PSA stratifikovanou míru detence pozitivních lézí na snímcích u 42 %, 58 %, 76 % a 95 % mužů s hodnotami PSA 0–0,2, 0,2–1, 1–2 a > 2 ng/ml (16).
Publikovaná studie Afshar‑Oromieh a kol. pro posuzování většího souboru pacientů hodnotila 1 007 po sobě jdoucích pacientů po dobu tří let, ale nebyla omezena pouze na pacienty, kteří podstoupili RP primárně. Navzdory větší heterogenitě ve své analýze také zjistili gradaci PSA pro PSMA PET/CT pozitivitu. V podskupině 227 pacientů s PSA v rozmezí 0,2 až 1,0 ng/ml zjistili podobné míry detekce pro „velmi nízké“ (46 %) a „nízké“ kohorty PSA (73 %) (15).
M. Dietlein a kol. srovnali výsledky u selektované skupiny 14 pacientů, kteří byli vyšetřeni 18 F‑DCFPyL PET/CT po 68Ga‑PSMA-11 PET/CT z důvodu negativních nebo nejednoznačných nálezů. 18 F‑DCFPyL PET/CT odhalil další léze u 3 ze 14 pacientů (21,4 %). Tato počáteční data u omezeného počtu pacientů naznačují, že 18 F‑DCFPyL nebyl horší než 68Ga‑PSMA-11. Ukázalo se, že zobrazování pomocí 18 F‑DCFPyL může dokonce projevit zvýšenou citlivost při lokalizaci recidivy po RP i při mírně zvýšené hladině PSA (17).
Recentní review De Visschere a kol. hodnotící detekci zobrazovacích metod u biochemické recidivy karcinomu prostaty pomocí TRUS, CT, scintigrafie kostí, mpMR, wbMR a PET/CT‑MR s radiofarmaky 18 F FDG, 11C choline, 18 F‑CH, 11C acetate, 18 F FACBC (fluciclovine) and PSMA. Pro hodnotu PSA < 0,5 ng/ml je detekce více jak 31,3 % při užití 11C choline PET‑CT a více jak 65 % při užití 68Ga PSMA-11 PET‑CT, zatímco při hodnotě PSA < 0,2 ng/ml je detekce u 68Ga PSMA-11 PET‑CT 11,3 % až 58,3 %. Nicméně míra detekce závisí na hladině PSA v době provedení zobrazovacího vyšetření. CT a scintigrafie kostí, jako běžně používané zobrazovací metody, nejsou dostatečně citlivé při nízkých hodnotách PSA. mpMR je vhodné využít v detekci lokální recidivy, nejlepší výsledky však ukazuje spojení s PET, jako hybridní vyšetřovací metoda s užitím PSMA ligandu (18).
A nakonec Perera a kol. provedli nový systematický přehled a metaanalýzu, do které bylo za ‑ hrnuto 37 článků s celkem 4 790 pacienty. U pacientů s biochemickou recidivou byla pozitivita na 68Ga‑PSMA PET skenech rozdělena dle hodnot PSA. Pro PSA kategorie 0–0,19; 0,2–0,49; 0,5–0,99, 1–1,99; a ≥ 2 ng/ml byla pozitivita v 33 %, 45 %, 59 %, 75 %, a 95 %. Nebyl zaznamenán signifikantní rozdíl mezi GS ≤ 7 a ≥ 8. Avšak vazba 68Ga‑PSMA v prostatickém lůžku byla významně vyšší ve skupině pacientů, kteří podstoupili radioterapii oproti těm, kteří podstoupili radikální prostatektomii (52 % vs. 22 %). V detekci metastáz do lymfatických uzlin byla zaznamenaná vysoká senzitivita (75 %) i specificita (99 %) (10).
VÝSLEDKY PRO PRIMÁRNÍ STAGING
Zobrazení s ligandem PSMA v kombinaci s PET/MR včetně farmakokinetické analýzy nálezu v prostatě a difuzním zobrazením v rozsahu trupu vede k možnosti detekovat přítomnost tkáně s KP i v nezvětšených lymfatických uzlinách (5). V přehledo ‑ vém článku kolektivu autorů von Eyben je zmiňováno sedm studií prezentujících iniciální zobrazení pomocí 68Ga‑PSMA PET/CT nebo PET/MR před definitivní léčbou. Šest studií použilo k vyšetření pouze 68Ga‑PSMA PET/CT, zatímco jedna studie zkoumala obojí jak 68Ga‑PSMA PET/CT (35 paci ‑ entů), tak 68Ga‑PSMA PET/MR (95 pacientů). Pro staging PET/CT nebo PET/MR byla míra detekce 70–80 %, senzitivita byla 61–70 % a specificita 84–97 % (1).
V retrospektivní analýze o 130 pacientech s intermediate až high‑risk KP a následnou pánevní lymfadenektomií (pelvic lymph node dissection – pLND) mělo 68Ga‑PSMA-11 PET/CT vůči konvenčnímu zobrazování senzitivitu 65,9 % oproti 43,9 %. Navíc 68Ga‑PSMA-11 PET mělo vysokou specificitu – vyšší než 95 %. Pro identifikaci kostních metastáz bylo 68Ga‑PSMA-11 PET jednoznačně lepší než scintigrafie kostí v předběžném srovnání (12).
Velký počet studií zkoumal potenciál 68Ga‑PSMA-11 pro lokalizaci intraprostatických lézí. 68Ga‑PSMA-11 PET bylo přímo srovnáváno s mpMR jako běžnou standardní metodou k detekci lokalizace intraprostatických lézí. Giesel a kol. analyzovali shodu mezi metodami. Téměř úplné shody mezi pozitivními nálezy na jedné modalitě s pozitivní korelací na straně druhé byly hodnoty 89,4 % pro mpMR a 96,8 % pro 68Ga‑PSMA-11 PET. Tyto výsledky naznačily potenciální přínos kombinace těchto metod k detekci KP. Použití hybridního zobrazení 68Ga‑PSMA-11 PET/MR bylo analyzováno u 53 pacientů s intermediate až high‑risk KP. Při analýze celé prostaty byla zjištěna vyšší přesnost pro kombinaci mpMR a 68Ga‑PSMA-11 PET. Senzitivita a specificita byla 76 % a 97 % pro hybridní zobrazení pomocí 68Ga‑PSMA-11 PET/MR, 58 % a 82 % pro mpMR a 64 % a 94 % pro 68Ga‑PSMA-11 PET (12).
Rowe a kol. testovali PSMA ligand vázaný na 18 F (18 F‑DCFBC) ve studii o 13 pacientech, kteří podstoupili 18 F‑DCFBC PET/CT před radikální prostatektomií, 12 pacientů současně podstoupilo pánevní MR ke srovnání výsledků. Ačkoli senzitivita pro MR byla lepší než pro 18 F‑DCFBC PET/CT (92 % proti 46 %), tak 18 F‑DCFBC PET/CT mělo vysokou specificitu pro klinicky významné karcinomy s vysokým Gleason skore (≥ 8) a vysokým objemem karcinomu (96 % proti 89 % pro MR). Dále byla zaznamenána korelace mezi stupněm vychytávání radiotraceru a Gleason skóre v dominantním tumoru, přestože malý počet pacientů přispěl k výraznému intervalu spolehlivosti (19) – na rozdíl od větší skupiny pacientů zobrazených pomocí 68Ga‑PSMA-11 (19).
Předběžné údaje pro 18 F‑PSMA-1007 ukázaly vysokou přesnost detekce uzlinového postižení u primárního onemocnění. 18 F‑PSMA-1007 PET/CT správně detekovalo 18 z 19 metastáz do lymfatických uzlin včetně uzlin o průměru menším než 1 mm, výsledky byly ověřeny histopatologicky (20).
Maurer a kol. provedli u 130 pacientů s intermediate-high risk KP vyšetření pomocí 68Ga‑PSMA PET/CT nebo PET/MR před radikální prostatektomií s pánevní LAE. Senzitivita, specificita a přesnost 68Ga‑PSMA PET byly 65,9 %, 98,9 %, a 88,5 % v porovnání s pouze CT nebo MR 43,9 %, 85,4 % a 72,3 % (21).
Další studie u 34 pacientů s intermediate-high risk KP prováděná Herlemann a kol. hodnotila přesnost 68Ga‑PSMA PET/CT pro staging do lymfatických uzlin před LAE a dále byla srovnávána s výsledky konvenčních zobrazovacích metod – CT, s následnou histologickou verifikací ukázala, že 68Ga‑PSMA PET bylo lepší než CT se senzitivitou 88 % vůči 75 % (7).
Uprimny a kol. hodnotili míru vychytávání 68Ga‑PSMA-11 u primárního stagingu karcinomu prostaty vzhledem ke Gleason skore a hodnotě PSA u 90 pacientů. Došli k závěru, že hodnota GS a hladina PSA korelovala s intenzitou akumulace traceru na 68Ga‑PSMA-11 PET/CT. U karcinomů s GS 6, 7a (3+4) i 7 b (4+3) bylo singnifikantně nižší vychatávání 68Ga‑PSMA-11 s hodnotou v medianu SUVmax 5,9; 8,3 a 8,2 v porovnání s pacienty s GS > 7 (median SUVmax 21,2). Pacienti s hodnotou PSA ≥ 10,0 ng/ml vykazovali výrazně vyšší vychytávání než ti s hodnotou PSA < 10,0 ng/ml (median SUVmax versus 17,6 versus 7,7). Z tohoto vyplývá, že provedení 68Ga‑PSMA PET/CT by mělo být přednostně provedeno u pacientů s GS > 7 a hladinou PSA ≥ 10,0 ng/ml v rámci primárního stagingu (22).
ROLE PSMA‑PET/MR V BIOPSII PROSTATY
Nástup mpMR do praxe v detekci KP a využití snímků k cílené biopsii prostaty pomocí kognitivní, nyní převážně softwarové fúze MR/TRUS zlepšil záchyt zejména signifikantního KP (23, 24). Ale některá ložiska mohou být minuta i při cílené biopsii a toto jsou pacienti, kteří představují diagnostickou výzvu. V takovéto rozporuplné diagnostice lze využít metody nukleární medicíny – PET/CT a PET/MR. V diagnostice již používaný 18 F‑flourometylcholin (18 F‑FCH) je nyní nahrazován novými PET tracery, jako je 68Ga‑PSMA (25).
Zettinig a kol. použili PSMA‑PET/MR k provedení cílené biopsie u mužů, kteří měli pozitivní nález na PSMA-PET nebo na MRI prostaty a prokázali, že tato technika je specifická k detekci KP. V této studii 4 z 5 mužů měli pozitivní výsledek při cílené biopsii pomocí PSMA‑PET/MRI (26).
Storz a kol. prezentovali iniciální studii, kde zjišťovali roli 68Ga‑PSMA PET/MR k detekci karcinomu prostaty při cílené biopsii prostaty. KP byl histologicky potvrzen u osmi z celkového počtu 16 pacientů, kteří měli minimálně jednu negativní předešlou biopsii prostaty. Z těchto osmi pacientů mělo šest pozitivní PSMA‑PET/MR a dva s nejednoznačným ložiskem dle PSMA‑PET/MR. Dle těchto iniciálních výsledků se jeví PSMA‑PET/MR jako cenný nástroj k detekci KP s použitím cílené biopsie softwarovou fúzí u pacientů po předchozí negativní biopsii prostaty (27).
DALŠÍ VYUŽITÍ PSMA
Ve druhé linii léčby kastračně rezistentního metastatického karcinomu prostaty (mCRPC) je doporučován Radium-223 (Xofigo™) jako jediný lék specifický pro kostní metastázy s přínosem pro přežití. Pro pacienty s mCRPC a biochemickou recidivou mohou být použity PSMA I a T a PSMA 617 značené beta emitenty jako Lutecium-177 nebo Yttrium-90 (177Lu a 90Yt) nebo alfa emitor jako Bismut-213 (213Bi). Tento přístup je považován za účinný jak pro viscerální, tak pro kostní metastázy. Počáteční zprávy jsou poměrně povzbudivé s poklesem hladiny PSA u 45 % pacientů a další data jsou shromažďována z mnoha center po celém světě. Ledviny a příušní žlázy jsou cílové orgány a dozimetrické studie ukázaly, že léčba 177Lu‑PSMA je bezpečná a kumulativní dávka 30 GBq (810 mCi) může být podána bezpečně (2).
Místo označování ligandu PSMA izotopy emitujícími pozitrony, což se využívá pro účely zobrazování, může být též cíleno na izotopy emitující gama záření a vyzařovaná radioaktivita může být detekována během chirurgického zákroku použitím gama sond poskytujících akustickou zpětnou vazbu. Což může být využito v experimentálním prostředí k radioaktivitou naváděné záchrané lymfadenektomii (radio guided salvage LND) (28). Klinické výsledky jako první byly vyhodnoceny Rauscher a kol., kde bylo použito PSMA značené 111In. Byly porovnány výsledky intraoperační radioaktivity gama sondy s histopatologickými výsledky u 31 mužů s oligometastatickou recidivou v pánevních nebo retroperitoneálních lymfatických uzlinách. Senzitivita, specificita a přesnost byla 92,3 %, 93,5 % a 93,1 %, resp. pozitivní a negativní prediktivní hodnoty byly 88,9 % a 95,6 %. U všech sledovaných mužů došlo k poklesu PSA o > 50 % a 90 % u 76,6 % respektive 53,3 % případech (29). Maurer a kol. provedli podobnou studii u 31 mužů, avšak za využití PSMA značeného 99mTc. Senzitivita byla nižší 83,6 % se specificitou 100 %, přesnost dosáhla 93 %. Po operaci byla pozorována redukce PSA na ≤ 0,2ng/ml u 20 pacientů (64,5 %) (30).
Zhang a kol. prezentovali nové zajímavé údaje za použití rekombinantních CD8+ T buněk, které byly odebrány pacientovi s KP a modifikovány k cílení PSMA exprimujících buněk, aby odolaly hostitelskému TGF‑β. Tyto modifikované imunitní buňky byly použity k inhibici transformovaných PSMA‑exprimujících PC-3 buněk, jako modelu lidské buněčné linie odvozené od kostních metastáz KP jak v in vitro, tak v in vivo experimentech. Autoři navrhují způsob modifikace hostitelské imunitní odpovědi na cílené buňky karcinomu prostaty exprimující specifický ligand buněčného povrchu (v tomto případě PSMA). Toto nové použití PSMA v buněčně řízené imunoterapii otevírá zajímavou a slibnou cestu terapie pro pacienty s aplikací napříč přirozenou historií rakoviny prostaty (31). Zatímco schopnost modifikovat imunitní buňky k cílení buněk exprimujících PSMA přinesla působivé výsledky v preklinických modelech, není zatím jasné, zda se jedná o optimální přístup a ideální cíl v klinickém prostředí. Ověření bude samozřejmě vyžadovat další preklinické modely před tím, než bude technologie připravena k použití v klinických studiích. Tato studie odhaluje další vzrušující cestu pro využití tohoto ligandu (32).
ROLE PSMA PET V TERAPEUTICKÉM POSTUPU
Díky zavedení 68Ga‑PSMA PET/CT do praxe došlo ke zlepšení přesnosti stagingu, a tím i významný potenciál změnit management léčby. Roach a kol. vyšetřili 431 pacientů s intermediate-high risk KP pomocí 68Ga‑PSMA PET/CT a u 21 % došlo ke změně v terapeutickém postupu a u 27 % byl operační výkon rozšířen o pánevní LAE (33).
Metaanalýza Han a kol. poukazuje, že 68Ga‑PSMA PET upravilo vedení léčby u 54 % pacientů. Uvádějí, že část pacientů podstupující RT (z 56 % na 61 %), operaci (z 1 % na 7 %), fokální terapii (z 1 % na 2 %) a multimodální léčbu (z 2 % na 6 %) vzrostla, zatímco u pacientů postupující systémovou terapii (z 26 % na 12 %) a u neléčených pacientů (ze 14 % na 11 %) klesla po 68Ga‑PSMA PET zobrazení (34).
ZÁVĚR
Použití ligandů PSMA pro vyšetření pomocí PET/ CT nebo PET/MR se rychle a široce rozšiřuje a má dopad na management jak v diagnostice, tak v léčbě KP. PSMA ligandy začaly být v klinické praxi užívány s nevídaným tempem, což vede k dramatickému nárůstu v počtu výzkumných publikací. Současné závěry z publikovaných studií tvrdí, že PET vyšetření za použití PSMA ligandů může mít značný vliv na řízení léčby časné recidivy stejně tak, jako na management primární léčby KP. Vedle toho terapeutický přístup hlavně s 177Lu‑PSMA naznačuje, že použití ligandů PSMA je cenné též v léčbě pokročilého onemocnění.
Dle dostupných systematických přehledů a iniciálních studií je dána míra detekce biochemické recidivy KP rozdělené do PSA podkategorií v rozmezí 42–95 % a v rámci primárního stagingu je udávána senzitivita v rozmezí 61–70 % a specificita v rozmezí 84–97 %.
Využití PSMA‑PET/MR při cílené re‑biopsii prostaty se jeví jako cenný nástroj k ozřejmění ložisek původně negativních na mpMR a též je zjištěno, že míra vychytávání tohoto radiofarmaka přímoúměrně roste s GS a hodnotou PSA.
Pro rozumné vytvoření nových algoritmů za použití PSMA tracerů a jejich postupné začlenění do doporučených postupů je zapotřebí kooperace multidisciplinárního týmu – radiolog, onkolog‑radioterapeut a urolog, aby došlo ke zlepšení péče o pacienty pomocí nejmodernějších metod.
Prohlášení o podpoře: Zpracování tohoto sdělení bylo podpořeno programem rozvoje vědních oborů Univerzity Karlovy (Projekt Q39) a MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPI, 00669806).
Hlavní stanovisko: Diagnostika a léčba karcinomu prostaty jsou velmi diskutovanými tématy. Přehledový článek přináší souhrnné informace o nově používaných ligandech prostatického specifického membránového antigenu. Jejich využití v detekci karcinomu prostaty, ale též úlohu v léčbě a zobrazení biochemické recidivy
Major statement: Diagnostics and treatment of prostate cancer are very discussed topics. The review article provides a summary of newly used prostate specific membrane antigen ligands. Their use in the detection of prostate cancer, but also their role in the treatment and imaging of biochemical relapse.
Střet zájmů: Žádný.
Došlo: 13. 9. 2020
Přijato: 3. 11. 2020
Kontaktní adresa:
MUDr. Hana Sedláčková
Urologická klinika, LF UK a FN Plzeň
Edvarda Beneše 13,
305 99 Plzeň
e‑mail: sedlackovah@fnplzen.cz
Zdroje
1. von Eyben FE, Picchio M, von Eyben R, Rhee H, Bauman G. 68Ga‑Labeled Prostate‑specific Membrane Antigen Ligand Positron Emission Tomography/Computed Tomography for Prostate Cancer: A Systematic Review and Meta‑analysis. European Urology Focus 2018; 4(5): 686–693.
2. Zaman M, Fatima N, Zaman A, et al. Diagnostic Challenges in Prostate Cancer and 68Ga‑PSMA PET Imaging: A Game Changer? Asian Pac J Cancer Prev [Internet]. jen 2017 [citován 2. říjen 2019]; 18(10). Dostupné z: http://doi.org/10.22034/APJCP.2017. 18. 10.2625
3. Cary KC, Punnen S, Odisho AY, et al. Nationally representative trends and geographic variation in treatment of localized prostate cancer: the Urologic Diseases in America project. Prostate Cancer Pro ‑ static, DiS 2015; 18(2): 149–154.
4. Dolejsova O, Eret V, Sobrova A, et al. Využití multiparametrickeé magnetické rezonance a srovnaní s ostatními moderními zobrazovacími metodami v predoperační diagnostice karcinomu prostaty. Ces Urol 2014; 18(4): 300–309.
5. Ferda J, Ferdová E, Tupý R, Baxa J. Hybridní zobrazení PET/MR u karcinomu prostaty. Čas Lék čes 2018; 157 : 169–174 : 6.
6. Ferda J, Vokurka S, Ferdová E, et al. The application of the prostatic specific membrane antigene ligand 68Ga‑PSMA-11 in imaging of prostatic tumors using PET/ CT and PET/MRI – initial experience with tolerance of the applied substance and imaging quality. Ces Radiol 2018; 72(1): 51–57 : 7.
7. Herlemann A, Wenter V, Kretschmer A, et al. 68Ga‑PSMA Positron Emission Tomography/Computed Tomography Provides Accurate Staging of Lymph Node Regions Prior to Lymph Node Dissection in Patients with Prostate Cancer. European Urology 2016; 70(4): 553–557.
8. Rowe SP, Pienta KJ, Pomper MG, Gorin MA. PSMA‑RADS Version 1.0: A Step Towards Standardizing the Interpretation and Reporting of PSMA–targeted PET Imaging Studies. European Urology 2018; 73(4): 485–487.
9. Rhee H, Thomas P, Shepherd B, et al. Prostate Specific Membrane Antigen Positron Emission Tomography May Improve the Diagnostic Accuracy of Multiparametric Magnetic Resonance Imaging in Localized Prostate Cancer. Journal of Urology 2016; 196(4): 1261–1267.
10. Perera M, Papa N, Roberts M, et al. Gallium-68 Prostate‑specific Membrane Antigen Positron Emission Tomography in Advanced Prostate Cancer – Updated Diagnostic Utility, Sensitivity, Specificity, and Distribution of Prostate‑specific Membrane Antigen‑avid Lesions: A Systematic Review and Meta‑analysis. European Urology 2020; 77(4): 403–417.
11. Ghosh A, Heston WDW. Tumor target prostate specific membrane antigen (PSMA) and its regulation in prostate cancer. Journal of Cellular Biochemistry 2004; 91(3): 528–539.
12. Eiber M, Fendler WP, Rowe SP, et al. Prostate‑Specific Membrane Antigen Ligands for Imaging and Therapy. Journal of Nuclear Medicine 2017; 58(Supplement 2): 67S–76S.
13. Afshar‑Oromieh A, Malcher A, Eder M, et al. PET imaging with a [68Ga]gallium‑labelled PSMA ligand for the diagnosis of prostate cancer: biodistribution in humans and first evaluation of tumour lesions. European Journal of Nuclear Medicine and Molecular Imaging 2013; 40(4): 486–495.
14. Eiber M, Herrmann K, Calais J, et al. Prostate Cancer Molecular Imaging Standardized Evaluation (PRO ‑ MISE): Proposed miTNM Classification for the Interpretation of PSMA‑Ligand PET/CT. Journal of Nuclear Medicine 2018; 59(3): 469–478.
15. Afshar‑Oromieh A, Avtzi E, Giesel FL, et al. The diagnostic value of PET/CT imaging with the 68Ga ‑ ‑labelled PSMA ligand HBED‑CC in the diagnosis of recurrent prostate cancer. European Journal of Nuclear Medicine and Molecular Imaging 2015; 42(2): 197–209.
16. Rauscher I, Düwel C, Haller B, et al. Efficacy, Predictive Factors, and Prediction Nomograms for 68Ga‑labeled Prostate‑specific Membrane Antigen‑ligand Positron‑emission Tomography/Computed Tomography in Early Biochemical Recurrent Prostate Cancer After Radical Prostatectomy. European Urology 2018; 73(5): 656–661.
17. Dietlein M, Kobe C, Kuhnert G, et al. Comparison of [18 F]DCFPyL and [68Ga]Ga‑PSMA‑HBED‑CC for PSMA‑PET Imaging in Patients with Relapsed Prostate Cancer. Molecular Imaging and Biology 2015; 17(4): 575–584.
18. De Visschere PJL, Standaert C, Fütterer JJ, et al. A Systematic Review on the Role of Imaging in Early Recurrent Prostate Cancer. European Urology Oncology 2019; 2(1): 47–76.
19. Eiber M, Weirich G, Holzapfel K, et al. Simultaneous 68Ga‑PSMA HBED‑CC PET/MRI Improves the Localization of Primary Prostate Cancer. European Urology 2016; 70(5): 829–836.
20. Giesel FL, Hadaschik B, Cardinale J, et al. F-18 labelled PSMA-1007: biodistribution, radiation dosimetry and histopathological validation of tumor lesions in prostate cancer patients. European Journal of Nuclear Medicine and Molecular Imaging 2017; 44(4): 678–688.
21. Maurer T, Gschwend JE, Rauscher I, et al. Diagnostic Efficacy of 68Gallium‑PSMA Positron Emission Tomography Compared to Conventional Imaging for Lymph Node Staging of 130 Consecutive Patients with Intermediate to High Risk Prostate Cancer. Journal of Urology 2016; 195(5): 1436–1443.
22. Uprimny C, Kroiss AS, Decristoforo C, et al. 68Ga‑PSMA-11 PET/CT in primary staging of prostate can ‑ cer: PSA and Gleason score predict the intensity of tracer accumulation in the primary tumour. European Journal of Nuclear Medicine and Molecular Imaging 2017; 44(6): 941–949.
23. Stejskal J, Jaskova V, Pavlicko A, et al. Diagnostika karcinomu prostaty pomocí fuzní biopsie. Ces Urol 2018; 22(2): 87–98.
24. Zalesky M, Stejskal J, Minarik I, et al. Porovnání detekce signifikantniho a nesignifikantniho karcinomu pomoci systematicke a cilene fuzní MRI/TRUS biopsie prostaty. Ces Urol 2018; 22(2): 115–121.
25. Kudlackova S, Kral M, Koranda P, Student V. 18-F cholin PET CT v primodiagnostice karcinomu pro ‑ staty. Ces Urol 2016; 20(1): 57–64.
26. Zettinig O, Shah A, Hennersperger C, et al. Multimodal image‑guided prostate fusion biopsy based on automatic deformable registration. International Journal of Computer Assisted Radiology and Surgery 2015; 10(12): 1997–2007.
27. Storz E, Shah A, Zettinig O, et al. 217 PSMA‑PET/MRI‑guided transrectal fusion biopsy for the detection of prostate cancer. European Urology Supplements 2015; 14: e217.
28. Krimphove M, Theissen L, Cole A, et al. Performance and Impact of Prostate Specific Membrane Antigen‑Based Diagnostics in the Management of Men with Biochemical Recurrence of Prostate Cancer and Its Role in Salvage Lymph Node Dissection. The World Journal of Men’s Health 2020; 38(1): 32–47.
29. Rauscher I, Düwel C, Wirtz M, et al. Value of 111In‑prostate‑specific membrane antigen (PSMA)-radio‑guided surgery for salvage lymphadenectomy in recurrent prostate cancer: correlation with histopathology and clinical follow‑up. BJU International 2017; 120(1): 40–47.
30. Maurer T, Robu S, Schottelius M, et al. 99mTechnetium‑based Prostate‑specific Membrane Antigen – radioguided Surgery in Recurrent Prostate Cancer. European Urology 2019; 75(4): 659–666.
31. Zhang Q, Helfand BT, Carneiro BA, et al. Efficacy Against Human Prostate Cancer by Prostate‑specific Membrane Antigen‑specific, Transforming Growth Factor‑β Insensitive Genetically Targeted CD8+ T‑cells Derived from Patients with Metastatic Castrate‑resistant Disease. European Urology 2018; 73(5): 648–652.
32. Lamb AD, Bryant RJ, Mills IG, Hamdy FC. First Report of Prostate‑specific Membrane Antigen–targeted Immunotherapy in Prostate Cancer: The Future is Bright. European Urology 2018; 73(5): 653–655.
33. Roach PJ, Francis R, Emmett L, et al. The Impact of 68Ga‑PSMA PET/CT on Management Intent in Prostate Cancer: Results of an Australian Prospective Multicenter Study. Journal of Nuclear Medicine 2018; 59(1): 82–88.
34. Han S, Woo S, Kim YJ, Suh CH. Impact of 68Ga‑PSMA PET on the Management of Patients with Prostate Cancer: A Systematic Review and Meta‑analysis. European Urology 2018; 74(2): 179–190.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2020 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Pravostranná robotická reimplantace močovodu s Boariho lalokovou plastikou
- Možnosti využití ligandů prostatického specifického membránového antigenu (PSMA) v diagnostice a léčbě karcinomu prostaty
- Úvod do problematiky urogenitálních píštělí: incidence, etiologie, klasifikace, symptomatologie a diagnostika
- Výskyt a výsledky operačního řešení lokálních recidiv zhoubných nádorů ledvin
- Atypická hladkosvalová neoplazie prostaty nejistého maligního potenciálu – leiomyom/leiomyosarkom prostaty
- Raritní případ gigantických kondylomat (Buschke-Löwenstein) v urologické prax
- Postradiační hemoragická cystitida – terapeutické možnosti se zaměřením na hyperbarickou oxygenoterapii
- Fraktura penisu – diagnostika a léčba
- Komentář k práci Schraml J, Broul M, Hlavička M, Bočan M. Šetření hrdla močového měchýře při RARP
- Vzpomínka na doc. MUDr. et MgA. Ivana Kawaciuka, CSc.
- Ohlédnutí za 66. výroční konferencí České urologickém společnosti
- Zpráva o proběhlé akci 8. český video‑seminář, Tipy a triky v urologické operativě 2020
- Výsledky soutěže ČUS o nejlepší vědeckou publikaci za rok 2019
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Fraktura penisu – diagnostika a léčba
- Úvod do problematiky urogenitálních píštělí: incidence, etiologie, klasifikace, symptomatologie a diagnostika
- Postradiační hemoragická cystitida – terapeutické možnosti se zaměřením na hyperbarickou oxygenoterapii
- Pravostranná robotická reimplantace močovodu s Boariho lalokovou plastikou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



