-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPeyronieho choroba
PEYRONIE´S DISEASE
Peyronie‘s disease (PD) is a chronic non‑fatal disease characterized by the occurrence of penile fibrous plaques in the tunica albuginea (TA). Clinical symptoms are pain, palpable induration, or penile deformity of the penis. Sometimes it may be present with erectile dysfunction associated with patient‘s mental deterioration. The most commonly affected are males between 40–60 years of age. The causes of PD are not entirely clear, probably multifactorial. Therapy is problematic. Therapeutic options are conservative and surgical.
KEY WORDS:
Peyronie‘s disease, fibrous plaque, curvature, deformity, conservative treatment, surgical treatment, penile prosthesis
Autoři: Aleš Horák
Působiště autorů: ANDROPHARM medical, s. r. o., Ostrava
Vyšlo v časopise: Ces Urol 2017; 21(1): 43-58
Kategorie: Přehledový článek
Souhrn
Peyronieho choroba (PD) je chronické nezhoubné onemocnění penisu charakterizované výskytem fibrózních plaků v oblasti tunika albuginea (TA). Klinické příznaky jsou bolest, hmatná indurace, kurvace nebo deformita penisu. Někdy může být přítomná i erektilní dysfunkce spojená s psychickou deteriorací pacienta. Nejčastěji jsou postiženi muži ve věku 40–60 let. Příčiny vzniku PD nejsou zcela jasné, patrně multifaktoriální. Terapie onemocnění je problematická. Možnosti terapie jsou konzervativní a chirurgické.
KLÍČOVÁ SLOVA:
Peyronieho choroba, fibrózní plak, kurvace, deformita, konzervativní léčba, chirurgická léčba, penilní protéza.ÚVOD
Nezhoubná deformita nebo kurvace penisu označovaná jako PD je onemocnění komplikující či úplně znemožňující pohlavní styk. Stigmatizuje určité procento mužské populace různého věku celá staletí. Přesto dosud nejsou přesně známy okolnosti vzniku PD, stejně tak optimální možnosti léčby a eventuální prevence manifestace onemocnění.
HISTORIE
První popis onemocnění podali již v 16. století italský lékař a anatom Gabriele Falloppio/Fallopius (1523–1562) (obr. 1) a holandský lékař a anatom Andries van Wesel Vesalius (1514–1564) (obr. 2). Blíže pak PD definoval v roce 1743 rodák z Montepellier François Gigot de la Peyronie (1678–1747) (Obr. 3), působící jako hlavní chirurg na dvoře Ludvíka XV. Na základě této skutečnosti získalo onemocnění jeho jméno (1).
Obr. 1. Gabriele Falloppio/Fallopius (1523–1562) Fig. 1 Gabriele Falloppio/Fallopius (1523–1562) 
(Staženo z https://en.wikipedia.org/wiki/Fran%C3%A7ois_Gigot_de_la_Peyronie) Obr. 2. Andries van Wesel Vesalius (1514–1564) Fig. 2 Andries van Wesel Vesalius (1514–1564) 
(Staženo z: https://en.wikipedia.org/wiki/Andreas_Vesalius) Obr. 3. François Gigot de la Peyronie (1678–1747) Fig. 3 François Gigot de la Peyronie (1678–1747) 
(Staženo z https://en.wikipedia.org/wiki/Fran%C3%A7ois_Gigot_de_la_Peyronie) EPIDEMIOLOGIE
Prevalence onemocnění se uvádí v rozmezí 0,39–3 %. Incidence PD je rozdílná dle věku, uvádí se 4,3 na 100 000 mužů ve věku 20–29 let, až 66 na 100 000 mužů ve věku 50–59 let. 2/3 onemocnění se vyskytují mezi 40–60 lety, i když jsou popisovány případy u 18 i 80letých pacientů. Je popisován vyšší výskyt PD u pacientů s hypertenzí a diabetem (1, 2, 3, 4, 5, 6, 7, 8, 9).
ETIOPATOGENEZE
Přesná podstata etiopatogeneze onemocnění není známá. Přičiny vzniku jsou patrně multifaktoriální s podílem genetické predispozice, traumatu a tkáňové ischemie.
Základem onemocnění je vznik fibrózních plaků s excesivní tvorbou kolagenu spolu s narušením struktury, fragmentací a úbytkem elastických vláken. V další fázi pak dochází k rozvoji dystrofických změn ve smyslu usazování depozit kalcia až osifikací. To vede ke ztrátě elasticity tuniky albuginei se vznikem kurvací a deformit při erekci. V důsledku toho dochází i k narušení venookluzivního mechanizmu s výskytem erektilní dysfunkce (ED). Iniciátorem tohoto procesu je patrně vznik drobných mikrotraumat a krvácení při pohlavním styku. PD je pak důsledkem abnormálního procesu hojení. Krvácení do tuniky albuginei, excesivní kumulace fibrinu, zánětlivých buněk, hyperexprese proteinů matrix, lokální deregulace cytokinů a růstových faktorů, jako je TGF-1, vede k tvorbě plaků (1, 2, 3, 4).
RIZIKOVÉ FAKTORY
Vzhledem k ne zcela jasné etiopatogenezi PD je snaha detekovat i možné příčiny a rizikové faktory jejího vzniku. Familiární výskyt samotné PD je uváděn asi ve 2 %, daleko větší výskyt 16–21 % je popisován současně s Dupuytrenovou kontrakturou. U obou onemocnění se nachází patrně stejná exprese genů pro degradaci kolagenu, osifikaci a diferenciaci myofibroblastů. Další studie uvádějí souvislost s expresí genů HLA‑B27, HLA‑A1, HLA‑DQw2, HLA‑DQ5. Souvislost s genitálním nebo perineálním traumatem, radikální prostatektomií, plantární fasciální kontrakturou, tympanosklerózou, uretrální instrumentací, Pagetovou chorobou, dnou, lipomatózou je však bezvýznamná. Uváděné rizikové faktory, jako hypertenze, kouření, hyperlipidémie, jsou spíše podstatné pro současně se vyskytující ED, vztah těchto rizikových faktorů k velikosti kurvatury nebo deformity penisu není prokázán. Stejně tak není jednoznačná souvislost s frakturou penisu a vznikem PD, protože k jejímu vzniku nemusí bezpodmíněčně předcházet, i když s delším časovým odstupem může mít následně stejný klinický obraz jako chronická fáze PD. Původní podezření na infekční etiologii onemocnění, stejně jako na následek instrumentálních vyšetření uretry, se nepotvrdilo. Je pozorována možná asociace PD s patologií malých cév, to může vysvětlovat její častější výskyt u pacientů s diabetem a hypertenzí. Známky vaskulitidy se nacházejí v časné fázi PD, stejně tak jako u aterosklerózy, čímž je vaskulární pojivová tkáň náchylnější k opakovaným malým traumatům (1, 2, 3, 4, 5, 11).
KLINICKÉ PROJEVY
Klinickými projevy PD je přitomnost indurací nebo typických plaků. Nejčastější lokalizace plaků je dorzálně, méně často se nacházejí ventrálně nebo laterálně.
Snížená elasticita tkáně vede ve svém důsledku k deviaci penisu na stranu přítomného plaku. V případě vícečetných a cirkulárně se vyskytujících plaků dochází ke vzniku deformit „bottlenecking“, kdy penis při erekci nabývá tvaru láhve s širokou bází a úzkým hrdlem a „hourglass deformity“, kdy penis při erekci připomíná tvar přesýpacích hodin (obr. 4, 5, 6, 7, 8).
Obr. 4. PD – ventrální kurvatura Fig. 4 PD – ventral curvature 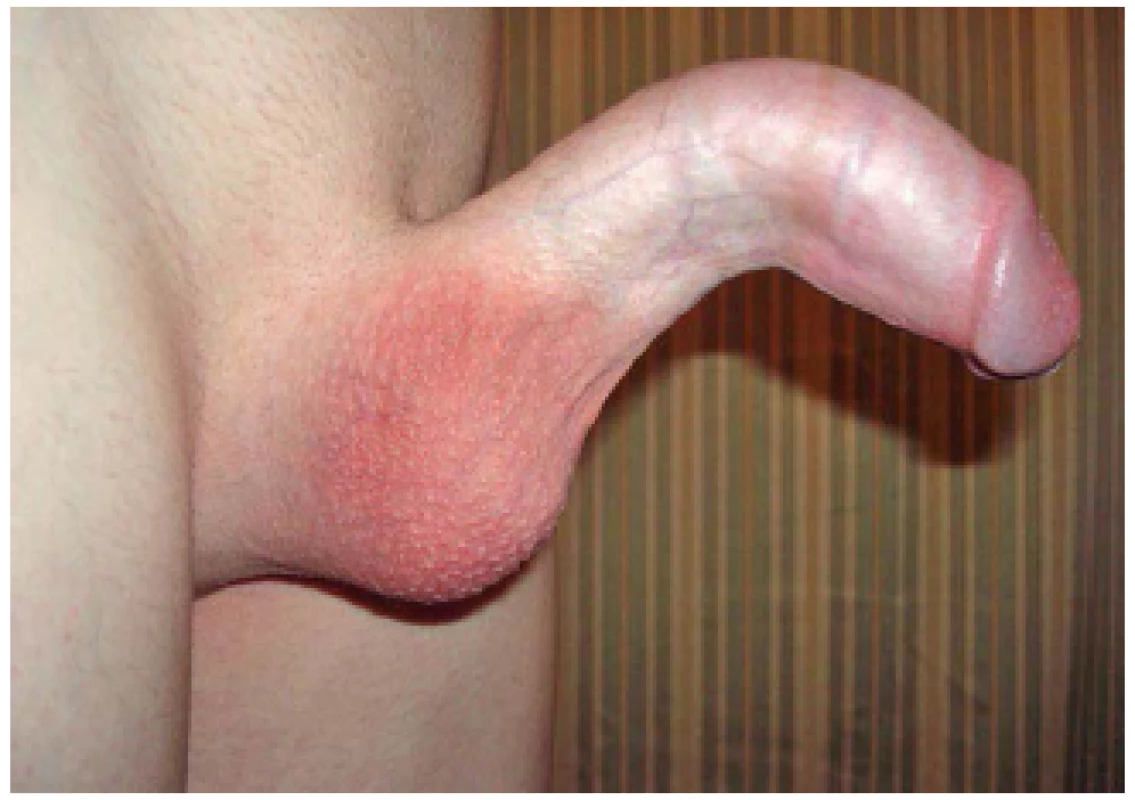
(Zdroj – vlastní databáze) Obr. 5. PD – dorzální kurvatura Fig. 5 PD – dorsal curvaturea 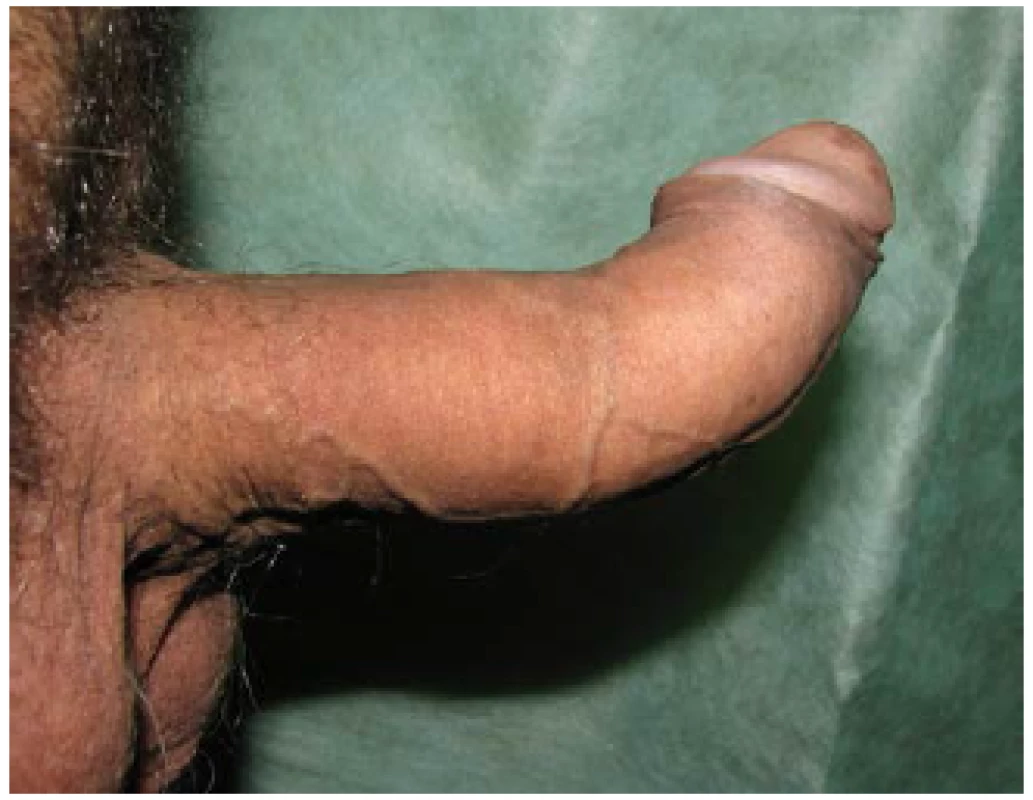
(Zdroj – vlastní databáze) Obr. 6. PD – deformita „hourglass“ Fig. 6 PD – „hourglass“ deformity 
(Zdroj – vlastní databáze) Obr. 7. PD – laterální deviace Fig. 7 PD – lateral curvature 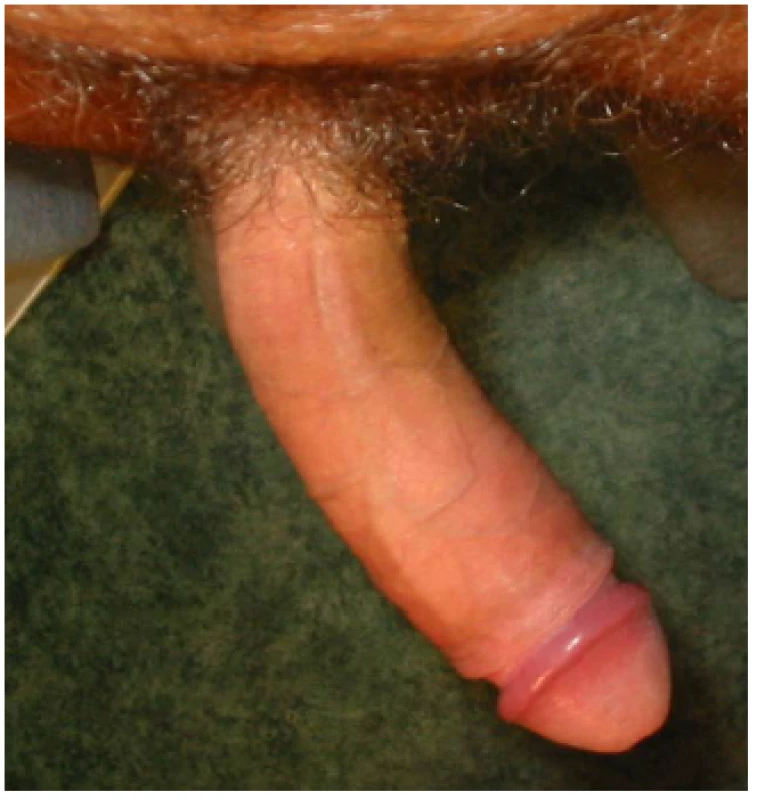
(Zdroj – vlastní databáze) Obr. 8. PD plak – řez penisem (3) Fig. 8 PD plaque – cut cross section of penis (3) 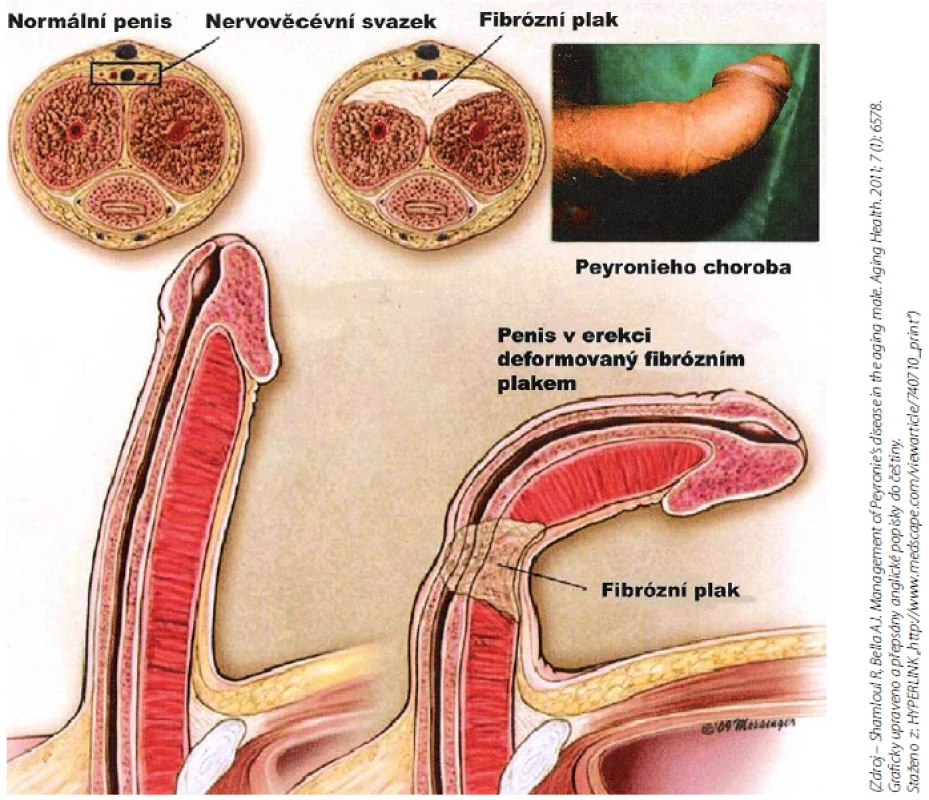
Bolest se projevuje v době erekce a bývá přítomna v akutní fázi onemocnění. Bolest nebývá výrazná, ale nepřijemně interferuje s pohlavním stykem, může také obtěžovat během nočních erekcí. Bolest spontánně ustupuje s ukončením akutní fáze onemocnění, a to je ve většíně případů do šesti měsíců od vzniku onemocnění.
Erektilní dysfunkce bývá přítomna až u 58 % pacientů s PD. Příčiny vzniku ED u PD jsou multifaktoriální. Psychologické faktory vyplývají jednak z obavy ze samotného onemocnění, tak i z neschopnosti uskutečnit vaginální penetraci. Zejména kurvatura penisu je komplikací penetrace. Z tohoto pohledu závisí na stupni a směru kurvatury penisu, kdy laterální a ventrální varianty jsou v tomto případě nepříznivější. U velmi rozsáhlých postižení penisu s infiltrací kavernózních těles se vyskytuje tzv. „Flail penis“, kdy chybí intumescence v oblasti plaku a penis je nestabilní. Zhoršení erekce jako takové souvisí s vaskulárním postižením jednak arteriálního, tak i venookluzivního systému. Významnější je venookluzivní porucha způsobená žilním únikem přes emissární žíly v oblasti plaku do v. dorsalis penis v důsledku ztráty elasticity a nedostatečné komprese těchto žil během tumescence (11).
Psychická deteriorace s anxiodepresivní symptomatologií je průvodním projevem onemocnění. Studie prokazují, že mnozí muži se vyhýbají sexu, pokud nejsou schopni vaginálního styku. Již v časné fázi nemocnění udávají muži menší chuť iniciovat koitus, následují pocity izolace, stigmatizace a projevuje se úzkost, obavy, deprese. Kvantitativní studie sledující depresi a sníženou kvalitu života u pacientů s PD uvádějí výskyt deprese různé závažnosti až ve 48 % (2, 4).
Průběh nemocnění lze rozdělit na akutní zánětlivou fázi, charakterizovanou vznikem indurací a plaků, bolestí, rozvojem kurvace nebo deformit. Doba trvání akutní fáze se uvádí 18–24 měsíců. Chronická fáze je spojena s ústupem bolestí a stabilizací kurvací a deformit, ukládání depozit kalcia do plaků a větším výskytem ED (1, 2, 3, 4, 5).
HISTOPATOLOGIE
V akutní fázi onemocnění nacházíme zánětlivou infiltraci T ‑lymfocyty, makrofágy a plazmatickými buňkami v okolí drobných cév v subtunikální pojivové tkáni. Tato infiltrace expanduje do TA a tkáně kavernózního tělesa. Zánětlivý infiltrát vede k aktivaci kaskády cytokinů s následnou aktivací fibroblastů. U pacientů s PD vykazují tyto fibroblasty až v 60 % abnormální chromozomální výbavu a vedou k excesivní neregulované tvorbě nepravidelné sítě elastických a kolagenních vláken s převahou kolagenu III. typu. V chronickém fázi onemocnění zánětlivá infiltrace již není patrná, naopak se v místě indurace mohou vyskytnout až ve 34 % projevy kalcifikace (1).
DIAGNOSTIKA
Základem diagnózy je anamnéza vzniku a klinického obrazu onemocnění, vyloučení eventuálního předchozího traumatu penisu, instrumentálního vyšetření nebo intrakavernózní aplikace vazoaktivních látek. Při výskytu erektilní dysfunkce se hodnotí její závažnost a odpověď na konzervativní léčbu. Významnou součástí diagnostiky je vizualizace vzhledu penisu během erekce, posouzení velikosti úhlu a směru kurvace nebo rozsahu deformity. Toho lze nejlépe dosáhnout vyšetřením penisu po intrakavernózní aplikaci vazoaktivní látky, použitím podtlakového erekčního přístroje, nejlépe však posouzením fotografie penisu v erekci zhotovené samotným pacientem. V případě nutnosti bližší vizualizace plaku, zejména před chirurgickým řešením, je možné využit klasické ultrazvukové vyšetření nebo magnetickou rezonanci. Zobrazení cévního řečiště s průkazem venózního úniku lze provést pomocí barevného Dopplerova ultrazvukového vyšetření a dynamické infuzní kavernózometrie (1, 2, 3, 4, 5).
TERAPIE
Terapie PD vyžaduje komplexní přístup a trpělivost jak lékaře, tak pacienta. Dosud žádná z dostupných terapeutických možností není optimální. Současná terapie by měla vycházet z doporučení odborných společností odvozených na základě „evidence based medicine“. Algoritmus léčby je stanoven z aktuálního klinického obrazu onemocnění (obr. 9) (2, 5, 18).
Obr. 9. Algoritmus léčby PD (5) Fig. 9 Algorithm of treatment PD (5) 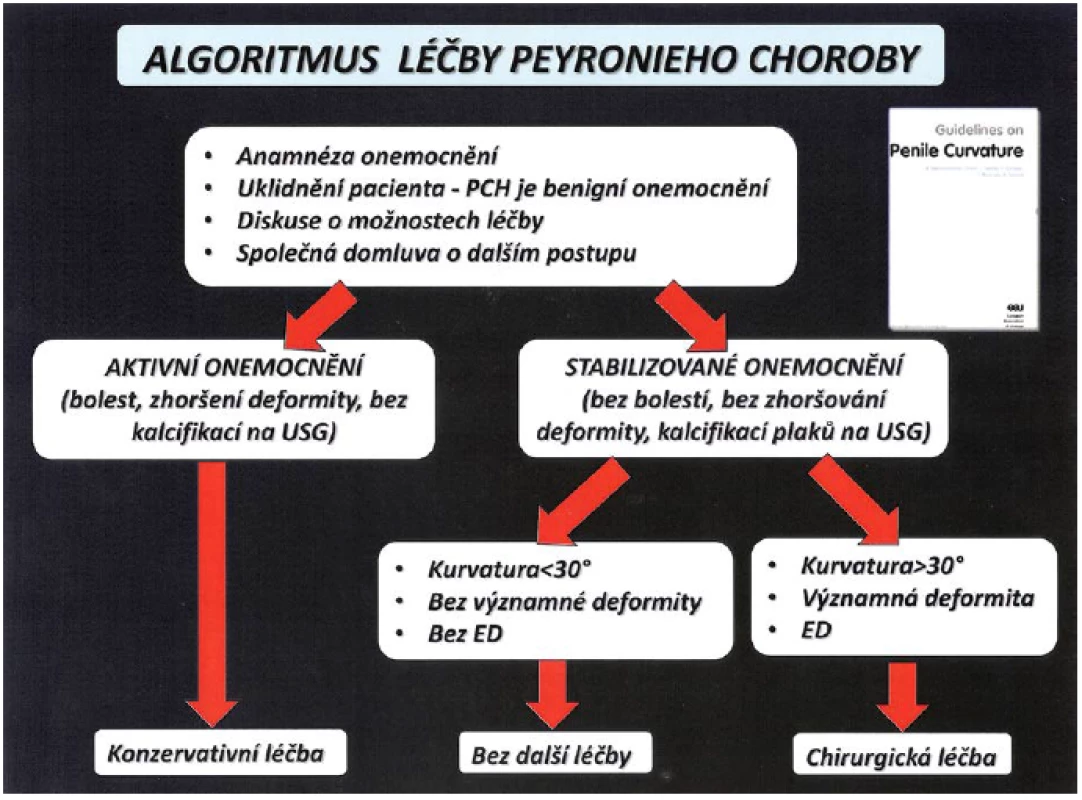
KONZERVATIVNÍ LÉČBA
Konzervativní léčba zahrnuje perorální, transdermálně nebo injekčně aplikované preparáty a využití různých fyzikálních metod. Přehled léčebných metod v průběhu staletí zahrnuje tabulka 1, mnohé z nich byly slepou uličkou, u celé řady dalších je efekt potvrzen pouze účinnostními studiemi bez průkazu účinku randomizovanými dvojitě placebem zaslepenými studiemi (DBPCT). Veškerá medikamentózní léčba, s vyjímkou klostridiové kolagenázy, není v souladu s SPC, tím je „off-label“ a probíhá jen na základě studií a doporučení odborných společností (tab. 1, 2), (1, 2, 3, 4, 5, 12, 13, 19).
Konzervativní léčba perorální
Vitamin E
Vitamin E je tradiční, levná, dostupná dosud používaná terapie, využivající antioxidační efekt vitaminu E, vedoucí k eliminaci kyslíkových radikálů uplatňujících se zejména v zánětlivé fázi onemocnění. Někteří autoři uvádějí pozitivní efekt vitaminu E na bolest při podávání 2x300 mg denně, nicméně toto nebylo v DBPCT prokázáno. V souvislosti s podáváním vitaminu E byly popisovány cerebrovaskulární příhody, bolesti hlavy, závratě (1, 2, 3, 4, 5, 13).
Kolchicin
Kolchicin vede k depolymerizaci tubulinu, a tím k inhibici buněčné mitózy, adhezi leukocytů a transportu kolagenu. Tyto mechanizmy by měly snížit tvorbu plaků u mikrotraumat tuniky albuginei. Pozitivní vliv na velikost plaku a kurvatury byl pozorován u podávání 0,5–2,5 mg denně po dobu čtyř měsíců. Nicméně další provedené studie toto nepotvrdily. Užívání colchicinu je však spojeno s výraznými gastrointestinálními vedlejšími příznaky a rizikem aplastické anémie (1, 2, 3, 4, 5, 11, 12, 13, 14, 15).
Tamoxifen
Předpokládaný efekt účinku tamoxifenu je v inhibici sekrece TGF‑beta fibroblasty, což vede k inhibici zánětlivých projevů onemocnění. Doporučené dávkování je 20 mg denně po dobu tři měsíců. DBPCT nepotvrdily pozitivní efekt na bolest, velikost plaku a kurvaci. V souvislosti s podáváním tamoxifenu se může vyskytnout elevace jaterních testů, alopecie, gastrointestinální vedlejší příznaky, ED, pancytopénie a návaly (1, 2, 3, 4, 5, 15, 16, 17, 18, 19).
Pentoxifyllin
Pentoxifyllin je nespecifický inhibitor fosfodiesterázy známý svým protizánětlivým a antifibrogenním účinkem. Vede ke snížení produkce kolagenu i elastinu produkovaného fibroblasty TA u PD stimulované TGF1-beta1. DBPCT z roku 2010, kdy byl podáván pentoxifyllin 2x400 mg denně po dobu šest měsíců, prokázala vzhledem k placebu pozitivní efekt na kurvaturu, objem plaku, erekci a progresi onemocnění. V souvislosti s podáváním pentoxifyllinu se mohu vyskytnut únava, gastrointestinální vedlejší příznaky, návaly, závratě a bolesbolesti hlavy. Nicméně pro rutinní použití pentoxifyllinu budou nutná další data z DBPCT, zatím tato léčba není EAU doporučena (1, 2, 3, 4, 5, 12, 13, 24).
Paraaminobenzoát sodný (POTABA®)
Paraaminobenzoát sodný má antifibrotický a protizánětlivý účinek využívaný v terapii dermatomyozitidy a sklerodermie. POTABA® snižuje hladiny serotoninu, zvyšuje aktivitu monoaminooxidázy, inhibuje sekreci glykosaminoglykanů fibroblasty a vede tím k redukci indurací u PD. Pozitivního efektu na redukci a stabilizaci indurací je dosaženo užíváním 4x3 g/den po dobu 12 měsíců. Kromě vyšší ceny a obtížné dostupnosti v ČR jsou nevýhodou gastrointestinální vedlejší příznaky a možná hepatopatie, hypoglykémie. Účinnost terapie PD preparátem POTABA® je potvrzena DBPCT (1, 2, 3, 4, 19, 47).
Karnitin
Karnitin působí jako inhibitor acetylkoenzymu A, a tím vede ke zlepšení mitochondriálních funkci a snížení množství kyslíkových radikálů v průběhu buněčného stresu. Nicméně DBPCT neprokázaly efekt karnitinu samotného nebo společně podávaného s vitaminem E na velikost plaku, kurvaci a bolest vzhledem k placebu. Navíc při podávání karnitinu se mohou vyskytovat gastrointestinální vedlejší příznaky a hypotenze (1, 2, 3, 4, 5, 12, 13, 22, 23).
Omega-3 mastné kyseliny
Vzhledem k určitému protizánětlivému efektu omega-3 mastných kyselin proběhly studie s jejich podáním u časné chronické fáze PD. To, že efekt vzhledem k placebu nebyl studiemi potvrzen a navíc popisovaný rybí odér, tuto léčbu PD eliminuje (2, 3, 4, 12, 13).
Prokarbazin
Prokarbazin je alkylující činidlo využívané v terapii lymfomů CNS, Hodgkinových lymfomů a high‑grade gliomů. Při jeho podávání byl zjištěn pozitivní efekt na Dupuytrenovu chorobu, a tím odvozen příznivý vliv na jiná fibroproliferativní onemocnění včetně PD. Pro výrazné nežádoucí účinky, především myelosupresi, nelze tuto léčbu PD doporučit (2, 3, 4, 12, 13, 25).
PDE-5 inhibitory
Inhibitory PDE-5 vedou ke zvýšení hladin cGMP inhibicí jeho degradace na GMP. Zvýšení koncentrace cGMP a NO způsobuje inhibici syntézy kolagenu a následného vzniku jeho depozit ovlivněním apoptózy fibroblastů a myelofibroblastů s možnou remodelací plaku. U retrospektivní studie s podáváním 2,5 mg tadalafilu denně po dobu šesti měsíců vykazovala skupina s tadalafilem zmenšení indurace na ultrazvukovém vyšetření oproti skupině s placebem. U sledovaných pacientů se však nevyskytovala kurvatura penisu. V další studii při denním podávání 50 mg sildenafilu oproti skupině pacientů, kterým bylo podáváno jen 400 IU vitaminu E po dobu tří měsíců, došlo ke zlepšení IIEF a ústupu bolestí pouze u pacientů se sildenafilem. K objektivnímu posouzení efektu PDE-5 v terapii PD bude nutné provedení DBPCT většího rozsahu (2, 3, 4, 5, 13).
Konzervativní léčba injekční (obr. 10)
Obr. 10. Intralesionální aplikace (3) Fig. 10 Intralesional therapy (3) 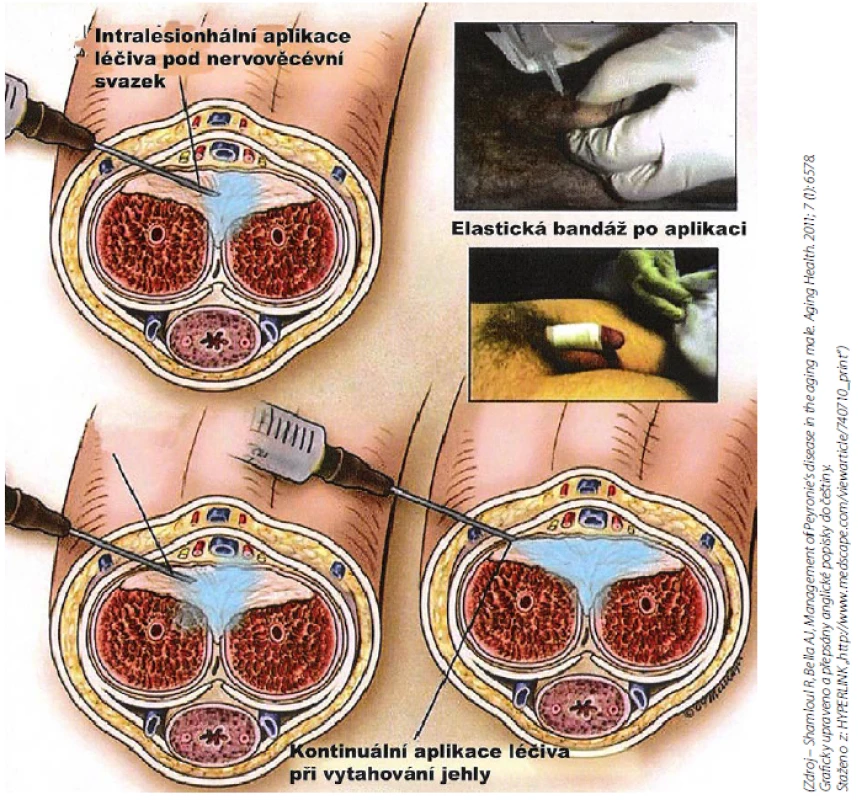
Verapamil
Kalciové blokátory jak in vitro, tak in vivo inhibují syntézu molekul extracelulární matrix zahrnující kolagen, glykosaminglykany, fibronectin a zároveň zvyšují aktivitu kolagenázy a TGF-β. Následkem toho pak dochází k remodelaci a degradaci extracelulární matrix ve tkáni. Aby byl tento účinek možný, je nezbytná co největší tkáňová koncentrace verapamilu, a to je možné jen injekční aplikací přímo do plaku. Schéma injekční aplikace verapamilu je dle různých autorů odlišné. Je možné aplikovat 1–2 ml/10–20 mg verapamilu do plaku 1x týdně po dobu tří měsíců, při dobré odezvě na terapii lze pokračovat do šesti měsíců. Aplikaci verapamilu lze provést z jednoho nebo více vpichů, ve druhém případě je pak vhodné provést penilní blokádu 2% Lidocainem®. Po aplikaci je vhodné krátkodobě komprimovat místo vpichu. V souvislosti s injekční aplikací verapamilu se může kromě dyskomfortu spojeného s aplikací vytvořit drobná přechodná ekchymóza v místě vpichu, žádné závažné lokální nebo systémové projevy toxicity nejsou popsány. DBPCT potvrdily pozitivní efekt na velikost plaku a kurvatury. Terapie je doporučena EAU (1, 2, 3, 4, 5, 26, 27, 28).
Interferon alfa-2 B
Aplikace interferonu alfa-2 B vede k inhibici proliferace fibroblastů a snížení produkce kolagenu v extracelulární matrix a zvýšení produkce kolagenázy v místě plaků PD.
Schéma aplikace interferonu se opět liší dle pracoviště. Aplikuje se injekčně do plaku 3 MIU 1x týdně nebo 6 MIU co druhý týden do celkové dávky 18 MIU. Samotná aplikace není spojena s větším dyskomfortem, nepříjemně vnímány pak mohou být následné celkové příznaky jako schvácenost, únava, bolesti hlavy a teplota související s „flu‑like“ syndromem. Tyto celkové příznaky jsou přechodné s maximálním trváním do 36 hodin od aplikace a dobře reagují na podání NSA, které je vhodné podat profylakticky již před samotnou aplikací. DBPCT potvrdily pozitivní efekt na velikost plaku, kurvatury a bolest, terapie je doporučena EAU (1, 2, 3, 4, 5, 29).
Klostridiová kolagenáza
Přípravek Xiapex® je směs kolagenázových enzymů, které byly společně exprimovány a získány z anearobní fermentace fenotypově vybraného kmene bakterie Clostridium histolyticum. Kolagenáza vede k degradaci depozit kolagenu PD s následným pozitivním efektem na kurvaci penisu. Aplikace klostridiové kolagenázy je indikována pouze u pacientů s hmatnou indurací a kurvací přesahující 30°. Doporučená dávka přípravku Xiapex® je 0,58 mg na jednu injekci podanou do plaku. Objem rekonstituovaného roztoku přípravku Xiapex®, který se injikuje striktně do plaku, je 0,25 ml. Léčebná kůra zahrnuje maximálně čtyři léčebné cykly. Každý léčebný cyklus zahrnuje dvě injekce přípravku Xiapex® a modelaci penisu. Druhá injekce přípravku Xiapex® se podává jeden až tři dny po první injekci. Modelace penisu se provádí jeden až tři dny po druhé injekci každého léčebného cyklu. Interval mezi léčebnými cykly je přibližně šest týdnů. Pokud se kurvace zmenší pod 15°, v další aplikaci se nepokračuje. Při léčbě kolagenázou se může vyskytnout ekchymóza, otok a bolestivost v místě aplikace. Vzácně se může vyskytnut alergická reakce různé závažnosti. Nejobávanější komplikací cca u 0,5 % pacientů je ruptura kavernózního tělesa s nutností urgentního chirurgického ošetření. Léčba klostridiovou kolagenázou je moderní konzervativní léčba PD, jediná korelující s SPC, jejíž účinek je potvrzen DBPCT. Tato léčba je možná v USA i Evropě jen na registrovaných pracovištích (2, 3, 4, 5, 30).
Kortikosteroidy
Injekční podání steroidů dexametazonu nebo triamcinolonu do plaku vyplývá z předpokladu jejich protizánětlivého účinku a snížení syntézy kolagenu. Bohužel pozitivní účinek na velikost indurace a kurvace nebyl ve studiích signifikantně lepší vzhledem k placebu. Navíc při jejich aplikaci dochází ke ztenčení a atrofii tkáně a také k imunosupresi (1, 2, 3, 4, 5, 31).
Další možnosti konzervativní léčby
Radiační léčba
U aplikace nízkodávkované radiační terapie v akutní fázi onemocnění byl popisován pouze pozitivní efekt na bolest. Nicméně účinek na kurvaci, deformitu a velikost plaku nebyl následně v DBPCT potvrzen. Vzhledem k negativnímu efektu radiace na tkáň penisu, včetně erektilní dysfunkce, nelze tuto terapii PD doporučit (2, 3, 4, 31, 32).
Topická léčba
Účinek topicky aplikovaného verapamilu ve formě gelu na indurace u PD na zmenšení velikosti plaku a kurvace byl popsán v některých studich. Stejně tak u aplikace verapamilu samotného nebo v kombinaci s dexametazonem pomocí iontoforézy (EMDA – Electromotive drug administration) byl popisován pozitivní efekt na velikost plaku a kurvace, data jsou ale nekonzistentní (2, 3, 4, 5, 33, 34).
Rázová vlna (ESWT)
Mechanizmus účinku ESWT na PD není zcela jasný. Jedna z teoríí vysvětluje účinek ESWT přímou destrukcí a remodelací plaků, druhá zvýšenou vaskularizací, vyvoláním zánětlivé reakce se zvýšenou aktivací makrofágů a následnou lýzou a resorbcí plaků. Mnohé učinnostní nekontrolované studie uvádějí pozitivní vliv na PD, nicméně DBPCT prokazují pouze efekt na bolest. Hatzichristodoulou dokonce v prospektivní placebem kontrolované jednou zaslepené studii uvádí zhoršení kurvace po aplikaci ESWT. Na základě těchto údajů nelze ESWT v terapii PD doporučit (2, 3, 4, 5, 36, 37, 38, 39, 40, 41).
Trakční aparáty
Penilní trakční terapie (PTT) je možností konzervativní terapie PD. Tato metoda vychází ze zkušeností při použití u jiných onemocnění kostí, svalů a vaziva. Účinek je vysvětlován tzv. mechanotransdukcí, kdy pozvolné napětí tkáně vede k celulární proliferaci a produkci kolagenu. U fibrózních plaků vede kontinuální trakce ke zvýšení aktivity kolagenáz a metaloproteináz s následným změkčením a prodloužením plaku. K dosažení požadovaného efektu je třeba nosit trakční aparát 2–9 hodin denně po dobu 3–6 měsíců (obr. 11). K dispozici jsou pouze placebem nekontrolované účinnostní studie s relativně malým počtem pacientů. K jednoznačnému potvrzení pozitivního efektu PTT u PD bude nutné provedení dalších lépe designovaných studií (2, 3, 4, 5, 42, 43).
Obr. 11. Trakční aparát Fig. 11 Traction device 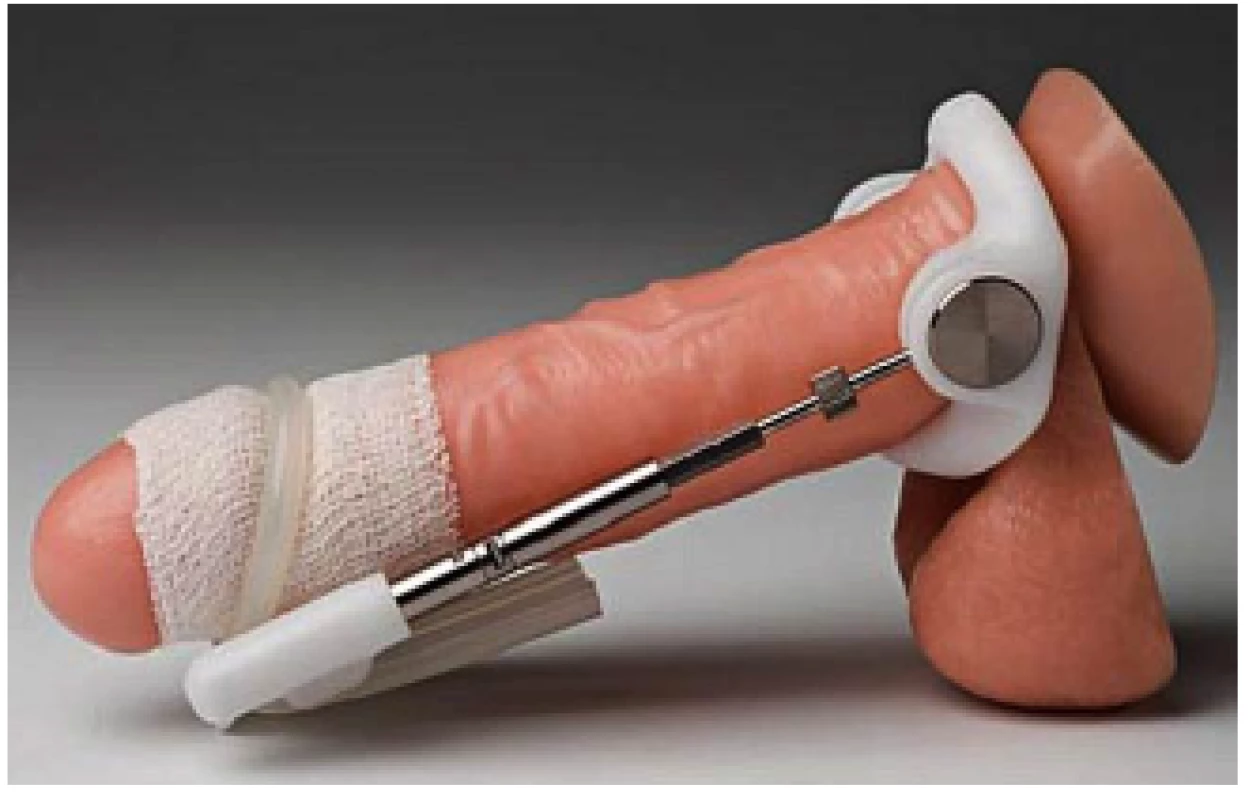
(Staženo z: http://mensexualcare.com/Platinum.html) Konzervativní léčba PD budoucnosti
Na základě dosavadních znalostí faktorů vzniku a rozvoje PD lze předpokládat pozitivní efekt βThymosinu, pirfenidonu, tkáňových metaloproteináz a protilátek inhibitoru metaloproteináz redukujících syntézu kolagenu, stejně tak decorinu, folistatinu a proteinu Smad7 s antifibrotickým efektem (44).
CHIRURGICKÁ LÉČBA
Chirurgické řešení přichází na řadu v případě neúspěchu konzervativní terapie u nejméně tři měsíce stabilizovaného onemocnění, většinou 6–12 měsíců od jeho vzniku, u pacienta se zájmem o aktivní sexuální život. Volba typu operace vyplývá z aktuálního klinického obrazu onemocnění, a to především dle stupně kurvace nebo rozsahu deformity, délky penisu a kvality erekce (obr. 12). Nezbytnou podmínkou je informovaný souhlas pacienta. Operační metody PD se rozdělují do tří základních skupin, a to na operace penis zkracující, operace penis prodlužující a implantace penilní protézy (1, 2, 3, 4, 5, 54).
Obr. 12. Algoritmus chirurgické léčby PD (5) Fig. 12 Algorithm of surgical treatment PD (5) 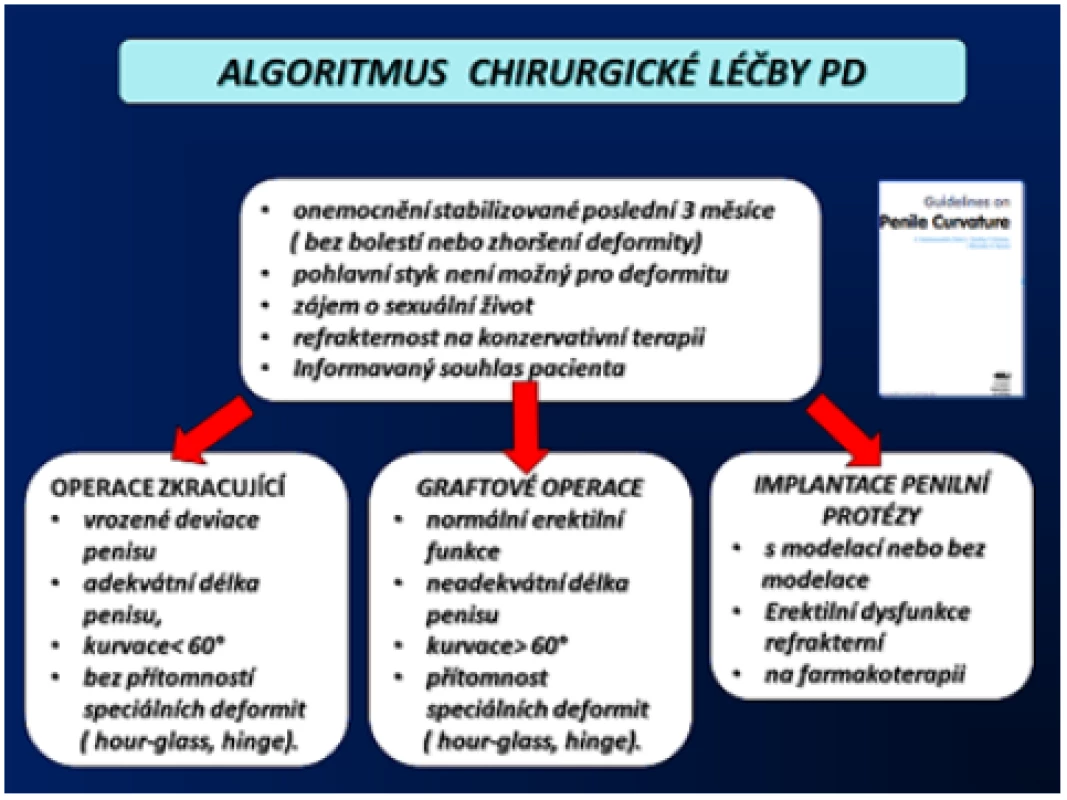
Operace zkracující penis
Operace zkracující penis se provádějí u pacientů s kurvací do 60° bez významné deformity s dostatečnou délkou penisu. Operace probíhá na kontralaterální straně penisu, než se nachází plak PD, který zůstává in situ. Provádí se zkrácení tuniky albuginei různými způsoby dle operační metody. Možné je vytvoření elipsovitých otvorů v TA a jejich následná sutura dle Nesbita včetně celé řady modifikací této metody (obr. 13). Yachia používá longitudinální nářezy TA, které uzavirá v horizontálním směru. Méně invazivní metodou je plikace např. podle Lua, kterou lze v případě dorzální nebo laterální lokalizace plaku provést i z přístupu z podélné incize v raphe penisu v lokální anestezii, čímž bývá chráněna předkožka na rozdíl od přístupu ze subkoronárního cirkulárního řezu a „deglovingu“ (obr. 14). Nevýhodou pouhé plikace je však sutura nevstřebatelným materiálem, který zůstává trvale hmatný, na rozdíl od incizí TA, kde lze použít vstřebatelný materiál (1, 2, 3, 4, 5, 45, 46).
Obr. 13. Operace zkracující penis – Nesbit (4) Fig. 13 Shortening procedures of penis – Nesbit (4) 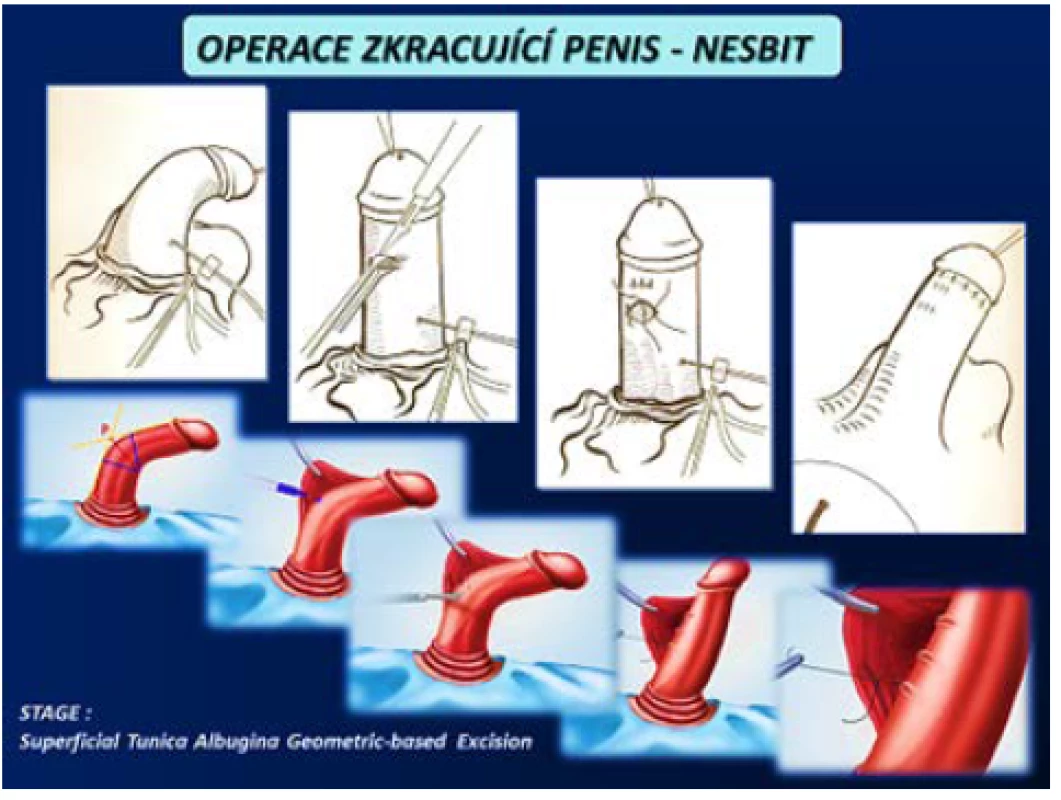
(Zdroj – 1.část – Smith JF, Walsh TJ, Lue TF. Peyronie‘s disease: a critical appraisal of current diagnosis and treatment, Int J Impot Res. 2008; 20(5): 445459. Staženo z: „http://www.medscape. com/viewarticle/584819_print“ 2. část – Staženo z: „http://www.acpct.com/#!stagetechniquecurvedpenis/ c1qiu“) Obr. 14. Operace zkracující penis – plikace (3, 4) Fig. 14 Shortening penis procedures – plication (3, 4) 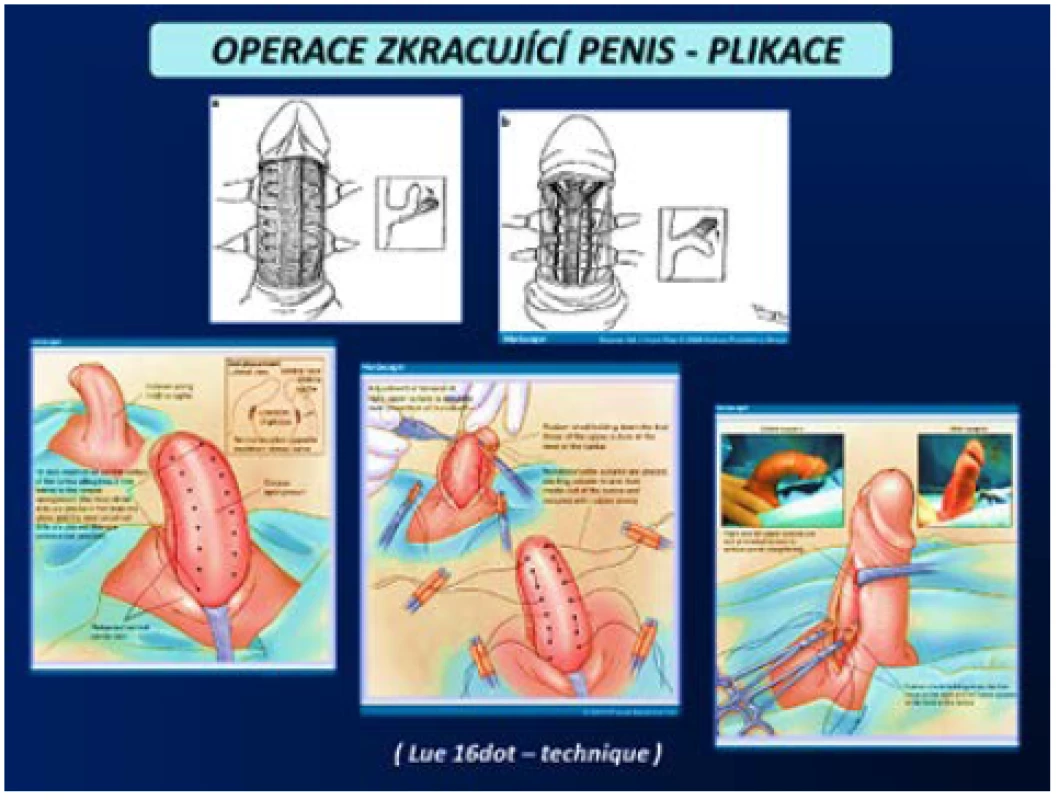
(Zdroj – 1. část – Smith JF, Walsh TJ; Lue TF. Peyronie‘s disease: a critical appraisal of current diagnosis and treatment. Int J Impot Res. 2008; 20(5): 445459. Staženo z: „http:// www.medscape.com/viewarticle/ 584819_print“ 2. část – Shamloul R, Bella AJ. Management of Peyronie‘s disease in the aging male, aging health. 2011; 7(1): 6578. Staženo z: „http://www. medscape.com/viewarticle/584819_ print“. Graficky upraveno a přepsány anglické popisky do češtiny) Operace prodlužující penis
Operace prodlužující penis jsou indikovány u pacientů s kurvací větší než 60°, výraznou deformitou a relativně krátkým penisem. U těchto pacientů je předpokladem operace dobrá erekce, nebo ED s dobrou odpovědí na konzervativní léčbu. Princip operace spočívá v úplné excizi nebo jen částečné incizi plaku tak, aby došlo k úpravě kurvatury či deformity a následným překrytím vzniklého defektu v TA štěpem. Pouhá incize plaku je doporučována vzhledem k menšímu riziku narušení venookluzivního mechanizmu s následnou ED, jizvením a recidivou kurvatury. Důležitý je následný výběr graftu. Požadavek na graft je, aby byl snadno dostupný, jednoduše suturovatelný, poddajný, přizpůsobivý, cenově dostupný, s nízkým rizikem infekce a antigenní aktivitou, dobře tolerovatelný s minimální tkáňovou reakcí. Jako autologní graft lze využit dermální graft, lalok tuniky vaginalis, fascii lata, temporální fascii, muskulární aponeurózu, bukální sliznici, TA a venózní tkáň. Dále je možné využit allografty a kadaverózní xenografty jako bovinní perikard, kadaverózní perikard, duru mater, intestinální submukózu a dermis. Ze syntetických materiálů lze použit Gore‑Tex ®, Dacron® a silastic. Nicméně syntetický materiál vede k výraznějšímu pooperačnímu zánětu, a to způsobuje následně větší riziko infekce a vzniku fibrózy v okolí graftu. U operací s využití graftu je vhodná pooperační rehabilitace, jako prevence recidivy kurvace v důsledku svrašťování v oblasti graftu pomocí PDE-5 inhibitorů, zahájená týden po výkonu po dobu šesti týdnů. Dle jiných autorů lze využit manuální trakce, trakčních nebo podtlakových přístrojů (obr. 15) (1, 2, 3, 4, 5, 47, 48, 54).
Obr. 15. Operace prodlužující penis – veńozní graft (3) Fig. 15 Lengthening penis procedures – vein graft (3) 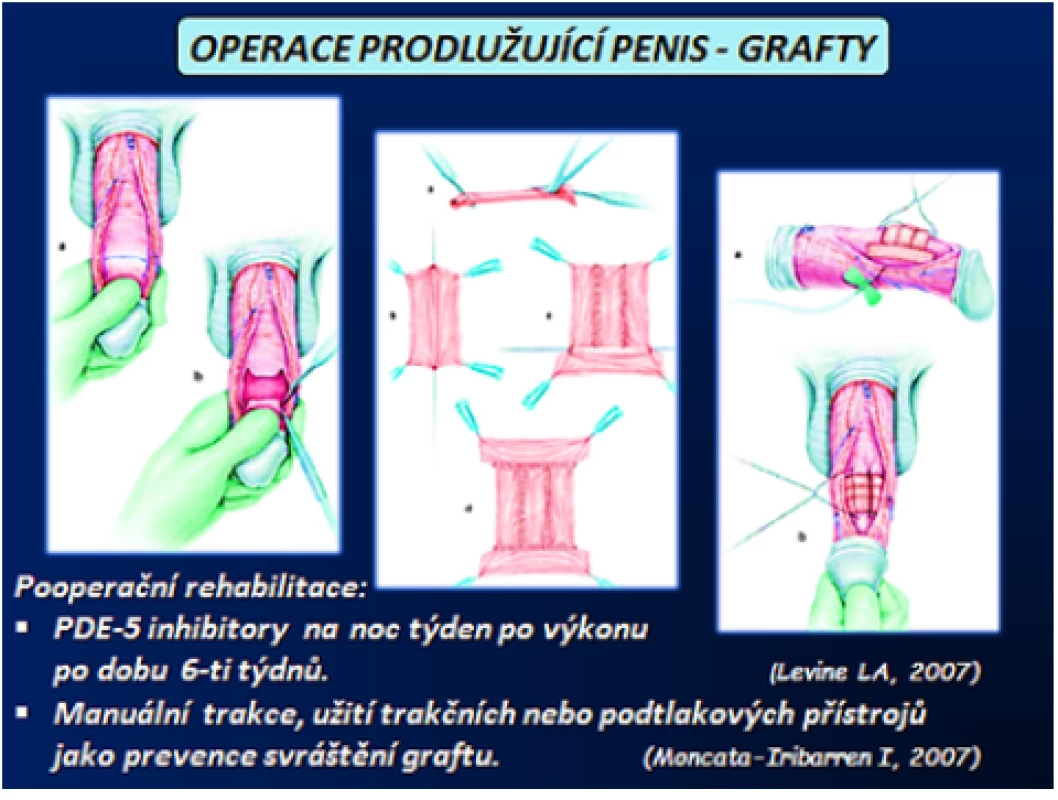
(Zdroj – Smith JF, Walsh TJ, Lue TF. Peyronie‘s disease: a critical appraisal of current diagnosis and treatment. Int J Impot Res. 2008; 20(5): 445459. Staženo z: „http://www.medscape. com/viewarticle/584819_print“) Implantace penilní protézy (PP)
Implantace (PP) přichází v úvahu u pacientů s PD a ED refrakterní na konzervativní terapii. V tomto případě se používají maleabilní nebo inflatabilní PP. Na základě hodnocení pacientů i jejich partnerek, lepší vizuální i funkční výsledek jednoznačně poskytují inflatabilní PP. Inflatabilní PP jsou nicméně bohužel pro pacienta finančně náročnější. V případě menší kurvatury stačí pouhá implantace PP, při přetrvávajícím zakřivení je pak nutná modelace, která vede k distenzi plaku s následným štěpením a vzniku jeho ruptur. Modelace se provádí s pomocí již implantované maximálně distendované PP. V případě, že modelace nestačí, je pak nutné provést dodatečné incize plaku bez nebo s použitím graftu (1, 2, 3, 4, 5, 48, 49, 50, 51, 52, 53, 54).
ZÁVĚR
Přestože je PD známa staletí, stále je „noční můrou“ jak pro pacienta, tak pro ošetřujícího lékaře. Jedná se o chronické onemocnění, které stigmatizuje pacienta nejen fyzicky, ale i psychicky. Stále nejsou známy všechny okolnosti vzniku a průběhu onemocnění, stejně tak jako optimální způsob terapie. Moderní terapie by měla být účinná, neinvazivní, dobře tolerovatelná a cenově dostupná. Součástí terapie je citlivý a trpělivý přístup k pacientovi, vysvětlení podstaty onemocnění a seznámení s dostupnými možnostmi terapie.
Střet zájmů: žádný
Prohlášení o podpoře: Autor prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Došlo: 30. 11. 2016
Přijato: 20. 2. 2017
Kontaktní adresa:
MUDr. Aleš Horák
ANDROPHARM medical, s. r. o.
Opavská 6192, 708 00 Ostrava ‑Poruba
e ‑mail: andropharm@seznam.cz
Zdroje
1. Ralph DJ, Pryor JP. Peyronie’s disease. In: Carson CC, Kirby RS, Goldstein I. (ed.). Textbook of erectie dysfunction. Isis Medical Media, Oxford, 1999 : 515–527. ISBN: 899066‑96‑9
2. Garaffa G, Trost LW, Serefoglu EC, Ralph D, Hellstrom WJG. Understanding the course of Peyronie’s disease. Int J Clin Pract. 2013; 67(8): 781–788.
3. Shamloul R; Bella AJ. Management of Peyronie’s disease in the aging male, aging health. 2011; 7(1): 6578. Dostupný také z: www.medscape.com/viewarticle/740710_print
4. Smith JF, Walsh TJ, Lue TF. Peyronie’s disease: a critical appraisal of current. Diagnosis and treatment. Int J Impot Res. 2008; 20(5): 445–459.
5. Hatzimouratidis K, Eardley I, Giuliano F, Moncada I, Salonia A. Guidelines on penile curvature. Eur Urol 2012 Sep; 62(3): 543–552.
6. Schwarzer U, Sommer F, Klotz T, Braun M, Reifenrath B, Engelmann U. The prevalence of Peyronie’s disease: results of a large survey. BJU Int 2001; 88 : 727.
7. Rhoden EL, Teloken C, Ting HY, Lucas ML, Teodosio da Ros C, Ary Vargas Souto C. Prevalence of Peyronie’s disease in men over 50yold from Southern Brazil. Int J Impot Res 2001; 13 : 291.
8. Mulhall JP, Creech SD, Boorjian SA, et al. Subjective and objective analysis of the prevalence of Peyronie’s disease in a population of men presenting for prostate cancer screening. J Urol 2004; 171 : 2350.
9. Lindsay MB, Schain DM, Grambsch P, Benson RC, Beard CM, Kurland LT. The incidence of Peyronie’s disease in Rochester. Minnesota, 1950 through 1984. J Urol 1991; 146 : 1007.
10. Kadioglu A, Oktar T, Kandirali E, Kendirci M, Sanli O, Ozsoy C. Incidentally diagnosed Peyronie’s disease in men presenting with erectile dysfunction. Int J Impot Res 2004; 16 : 540.
11. Kendirci M, Trost L, Sikka SC, Hellstrom WJ. Diabetes mellitus is associated with severe Peyronie’s disease. BJU Int 2007; 99 : 383.
12. Trost LW, Gur S, Hellstrom WJ. Pharmacological management of Peyronie’s disease. Drugs 2007; 67 : 527.
13. Barrett Harlow B, Wang R. Oral therapy for Peyronie’s disease, does it work? Transl Androl Urol. 2016; 5(3): 296–302.
14. Akkus E, Carrier S, Rehman J, Breza J, Kadioglu A, Lue TF. Is colchicine effective in Peyronie’s disease. A pilot study. Urology, 44, 1994; 2 : 291–295.
15. Safarinejad MR. Therapeutic effects of colchicine in the management of Peyronie’s disease: a randomized doubleblind, placebo controlled study. Int J Impot Res 2004; 16 : 238.
16. Teloken C, Rhoden EL, Grazziotin TM, Da Ros CT, Sogari PR, Souto CAV. Tamoxifenversus placebo in the treatment of Peyronie’s disease, J. Urol., 162, 1999; 15 : 2003–2005.
17. Ralph DJ, Brooks GF, Pryor JP. The treatment of Peyronie’s disease with tamoxifen. Brit. J. Urol., 70, 19 92; 648 .
18. Biagiotti G, Cavallini G. Acetyl Lcarnitine vs. tamoxifen in the oral therapy of Peyronie’s disease: a preliminary report. BJU Int 2001; 88 : 63.
19. Wagenknecht LV. Differential therapies in various stages of penile induration. Arch Esp Urol 1996; 49 : 285.
20. Kladenský J, Pacík D, Čermák A. Potaba – Glenwood – unsere Erfahrungen mit derkonservativen Behandlung der Induratio penis plastica. Uroscop., 1993; 9 : 29.
21. Carson CC. Potassium paraaminobenzoate for the treatment of Peyronie’s disease: is it effective? Tech Urol 1997; 3 : 135.
22. Bremer J. Carnitine‑metabolism and functions. Physiol Rev 1983; 63 : 1420.
23. Karlic H, Lohninger A. Supplementation of Lcarnitinein athletes: does it make sense? Nutrition 2004; 20 : 709 s.
24. Brant WO, Dean RC, Lue TF. Treatment of Peyronie’s disease with oral pentoxifylline. Nat Clin Pract Urol 2006; 3 : 111.
25. Morgan RJ, Pryor JP. Procarbazine (Natulan) in the treatment of Peyronie’s disease. Br J Urol 1978; 50 : 111.
26. Vrabec J, Mathernová V. Kalciové blokátory v liečbě induratio penis plastica. Slovenský lekár, 1997; 7 : 21–23.
27. Levine LA. Treatment of Peyronie’s disease with intralesional verapamil injection. J. Urol., 158, 1997; 10 : 1395 –139 9.
28. Levine LA, Merrick PL, Lee RC. Intralesional verapamil injection for the treatment of Peyronie’s disease. J. Urol., 151, 1994; 6 : 1522–1524.
29. Hellstrom WJ, Kendirci M, Matern R, et al. Singleblind, multicenter, placebo controlled, parallel study to assess the safety and efficacy of intralesional interferon alpha2B for minimally invasive treatment for Peyronie’s disease. J Urol 2006; 176 : 394.
30. Jordan GH. The use of intralesional clostridial collagenase injection therapy for Peyronie’s disease: a prospective, singlecenter, nonplacebo controlled study. J Sex Med 2008; 5 : 180.
31. De Sanctis PN, Furey CA Jr. Steroid injection for Peyronie’s disease: A 10‑year summary and review of 38 cases, J. Urol., 97, 1967; 114.
32. Carson CCIII, Coughlin PWF. Radiation therapy for Peyronie’s disease: is there a place?, J. Urol., 134, 1985; 684 .
33 Mulhall JP, Hall M, Broderick G A, Incrocci L. Radiation therapy in Peyronie’s disease J Sex Med.2012 May; 9(5): 1435–1441.
34. Greenfield JM, Shah SJ, Levine LA. Verapamil versus saline in electromotive drug administration for Peyronie’s disease: a doubleblind, placebo controlled trial. J Urol 2007; 177 : 972.
35. Montorsi F, Salonia A, Guazzoni G, et al. Transdermal electromotive multidrug administration for Peyronie’s disease: preliminary results. J Androl 2000; 21 : 85.
36. Knobloch K, Kuehn M, Vogt PM. Focused extracorporeal shockwave therapy in Dupuytren’s disease hypothesis. Med Hypotheses. 2011 May; 76(5): 6357.
37. Butz M, Teichert HM, Fuerth D. Treatment of Peyronie’s disease by extracorporal shockwawes. J. Urol., 1999; 159 : 118.
38. Hatzichristodoulou G, Meisner C, Gschwend JE, Stenzl A, Lahme S. Extracorporeal shock wave therapy in Peyronie’s disease: results of a placebocontrolled, prospective, randomized, singleblind study. J Sex Med. 2013 Nov; 10(11): 2815–2821.
39. Abdel Salam Y, Budair Z, Renner C, et al. Treatment of Peyronie’s disease by extracorporeal shockwave therapy: evaluation of our preliminary results. J Endourol 1999; 13 : 549.
40. Drlík P, Kočárek J. Sedmileté zkušenosti s aplikací rázových vln u mužů s induratio penis plastica (IPP). Ces Urol 2015; 19(4): 296–303.
41. Drlík P, Loško J, Křístek V, Kőhler O. Matematické modelování deformace penisu při induratio penis plastica po terapii rázovými vlnami (swt). Ces Urol, 2012; 16(1): 37–42.
42. Martínez Salamanca JI, Egui A, Moncada I, et al. Acute phase Peyronie’s disease management with traction device: a nonrandomized prospective controlled trial with ultrasound correlation. J Sex Med. 2014 Feb; 11(2): 506–515.
43. Yafi FA, Pinsky MR, Stewart C, et al. The effect of duration of penile traction therapy in patients under-going intralesional injection therapy for Peyronie’s disease. J Urol. 2015 Sep; 194(3): 754–758.
44. Gur S, Kadowitz PJ, Hellstrom WJ. Drugs of the future for Peyronie’s disease. Med Hypotheses; 2012 Feb; 78(2): 305–311.
45. Nesbit RM. Congenital curvature of the phallus: report of three cases with description of corrective operation. J Urol 1965; 93 : 230.
46. Gholami SS, Lue TF. Correction of penile curvature using the 16dot plication technique: a review of 132 patients. J Urol, 2002; 167 : 2066.
47. Montorsi F, Salonia A, Maga T, et al. Evidence based assessment of longterm results of plaque incision and vein grafting for Peyronie’s disease. J Urol 2000; 163 : 1704.
48. Hellstrom WJ, Usta MF. Surgical approaches for advanced Peyronie’s disease patients. Int J Impot Res 2003; 15(Suppl 5): S121.
49. Mulcahy JJ, Wilson SK. Management of Peyronie’s disease with penile prostheses. Int J Impot Res 2002; 14 : 384.
50. Wilson SK, Delk II JR. A new treatment for Peyronie’s disease: modeling the penis over an inflatable penile prosthesis. J Urol 1994; 152 : 1121.
51. Akin Olugbade O, Parker M, Guhring P, Mulhall J. Determinants of patient satisfaction following penile prosthesis surgery. J Sex Med 2006; 3 : 743.
52. Wilson SK, Delk II JR, Salem E. Longterm survival of inflatable penile prostheses: single surgical group experience with 2 384 first time implants spanning two decades. J Sex Med 2007; 4 : 1074.
53. Carson CC. Penile prosthesis implantation in the treatment of Peyronie’s disease and erectile dysfunction. Int J Impot Res 2000; 12(Suppl 4): 122. 54. Kadioglu A, Akman T, Sanli O, Gurkan L, Cakan M, Celtik M. Surgical treatment of Peyronie’s disease: a critical analysis. European Urology 2006; 50 : 235–248.
Štítky
Dětská urologie Nefrologie Urologie
Článek Editorial
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2017 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- RETROPERITONEOSKOPICKÁ RESEKCE TUMORU LEDVINY – VIDEO
- Varianty laparoskopické reimplantace močovodu
- Doporučení pro diagnostiku a léčbu symptomů dolních močových cest u pacientů s roztroušenou sklerózou v České republice - mezioborový konsenzus expertů dle metodiky DELPHI
- Komentář k článku Krhut, et al. Doporučené postupy včera, dnes a zítra
- Úloha psychosomatiky v urologii
- Peyronieho choroba
- LITOTRYPSE EXTRAKORPORÁLNÍ RÁZOVOU VLNOU – PRVNÍ ZKUŠENOSTI S ELEKTROMAGNETICKÝM LITOTRYPTOREM SIEMENS
- POUŽITÍ PROPLACHOVÉHO SYSTÉMU SUBY G U PACIENTŮ S NEUROGENNÍ DYSFUNKCÍ DOLNÍCH MOČOVÝCH CEST A DLOUHODOBĚ ZAVEDENÝM PERMANENTNÍM KATÉTREM
- VZÁCNÝ CYSTADENOKARCINOM PROSTATY, KLINICKÉ PROJEVY, DIAGNOSTIKA A LÉČBA
- SPONTÁNNÍ RUPTURA MOČOVÉHO MĚCHÝŘE: DVA PŘÍPADY Z NAŠEHO PRACOVIŠTĚ
- LÉČBA KARCINOMU PROSTATY V ČESKÉ REPUBLICE V ROCE 2016 – VÝSTUPY ZE SEMINÁŘŮ O METASTATICKÉM KASTRAČNĚ REFRAKTERNÍM KARCINOMU PROSTATY (MCRPC)
- THE AUTHORS REPORT ON THE 13,sup>TH WINTER UROLOGY SYMPOSIUM IN SPINDLERUV MLYN
- PROF. MUDR. MILAN HORA, PH.D., MBA
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Varianty laparoskopické reimplantace močovodu
- Peyronieho choroba
- Úloha psychosomatiky v urologii
- VZÁCNÝ CYSTADENOKARCINOM PROSTATY, KLINICKÉ PROJEVY, DIAGNOSTIKA A LÉČBA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



