-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vyšetření sentinelové uzliny u karcinomu prostaty – mapování primární lymfatické drenáže a zhodnocení přínosu pro staging onemocnění
Examination of the sentinel lymph node, mapping of the prostatic primary lymphatic drainage and assessment benefit of this diagnostic procedure for staging of the prostate cancer
Aim:
Sentinel lymph node (SLN) dissection replaces regional lymphadenectomy in early stages of many tumors. The objective of our study was to evaluate if the SLN dissection can improve staging of prostate cancer, define the regions of primary lymphatic drainage and correlate the staging accuracy of various templates of pelvic lymph node dissection (PLND).Material and methods:
Fifty patients with estimated risk of lymphadenopathy above 5%, based on Briganti nomogram, were included in the study. On the day of surgery Tc-99m-labeled nanocolloid was injected into prostate and then the planar lymphoscintigraphy and single-photon emission computer tomography (SPECT) fused with CT images were performed to detect SLN. Patients then underwent SLN dissection and backup PLND.Results:
We successfully detected the SLN in 96% of the patients. A total of 186 SLNs were localized by gamaprobe in course of the operation (mean value, 3,7 per patient). Lymph node (LN) metastases were found in 17 (34%) patients. Sensitivity of the procedure was 94.1% and it diagnosed additional micrometastases in 9/17 (53%) patients. Only 35.5% of primary LNs were found in obturator region. The extended PLND removeD 94.6% of primary LNs. SLN was identified in presacral and common iliac regions in only 3.2% and 2.2% respectively.Conclusion:
SLN dissection shown high sensitivity in identifying LN metastases. The procedure improves staging by detecting higher number of micrometastases and allows to guide the dissection in presacral and internal iliac regions. Lymphatic mapping showed that extended PLND covers 95% of SLNs. PLND limited to obturator region is inadequate procedure as it removes only one third of SLNs.Key words:
lymph node excision, prostatic neoplasms, sentinel lymph node biopsy.
Autoři: Michal Staník 1; Ivo Čapák 1; Daniel Macík 1; Karol Bolčák 2; Eva Lžičařová 3; Jiří Vašina 2; Martin Šustr 1; David Miklánek 1; Jan Doležel 1
Působiště autorů: Oddělení onkourologie, Masarykův onkologický ústav, Brno 1; Oddělení nukleární medicíny, Masarykův onkologický ústav, Brno 2; Oddělení onkologické a experimentální patologie, Masarykův onkologický ústav, Brno 3
Vyšlo v časopise: Ces Urol 2013; 17(1): 42-50
Kategorie: Původní práce
Souhrn
Cíl:
Vyšetření sentinelové uzliny (SU) přihlíží k individuální anatomii lymfatické drenáže, zlepšuje záchyt uzlinových mikrometastáz a u časných stadií řady nádorů nahrazuje regionální lymfadenektomii. Cílem studie je posoudit přínos vyšetření SU pro staging onemocnění u karcinomu prostaty, definovat oblasti primární lymfatické drenáže pomocí vyšetření SU a srovnat přesnost uzlinového stagingu při různém rozsahu pánevní lymfadenektomie (PLAE).Materiál a metody:
Do studie bylo zařazeno 50 pacientů s karcinomem prostaty, jejichž riziko uzlinového postižení bylo vyšší než 5 % podle Brigantiho nomogramu. V den operace byl pacientům intraprostaticky aplikován 99mTechneciem značený radiokoloid Nanocoll. SU byly zobrazeny pomocí planární lymfoscintigrafie a SPECT/CT. Do 6 hodin od aplikace pacienti podstoupili intraoperačně detekci SU gamasondou a poté „rozšířenou“ PLAE.Výsledky:
Detekce SU byla úspěšná u 96 % pacientů. Gama-sondou jsme během operace nalezli 186 SU, v průměru 3,7 na pacienta. Uzlinové metastázy byly zachyceny u 17 pacientů (34 %). Senzitivita vyšetření SU dosáhla 94,1 %, vyšetření vedlo k zvýšenému záchytu uzlinových mikrometastáz, které v našem souboru tvořily až 53 %. V obturatorní oblasti se nachází pouze 35,5 % primárních spádových uzlin, naopak „rozšířená“ PLAE jich zahrnula 94,6 %. Výskyt SU presakrálně a v oblasti společných ilických uzlin byl v naší studii méně častý (3,2 %, resp. 2,2 %).Závěr:
Vyšetření SU dosahuje vysoké senzitivity při detekci uzlinových metastáz. Zlepšuje staging vyšším záchytem mikrometastáz a upřesněním rozsahu PLAE v presakrální oblasti a podél větví vnitřních ilických cév. Mapování lymfatické drenáže prokázalo, že „rozšířená“ PLAE zahrnula 95 % SU. PLAE omezená pouze na obturatorní uzliny je nedostatečná, protože zahrnuje pouze třetinu primárních spádových uzlin.Klíčová slova:
karcinom prostaty, pánevní lymfadenektomie, sentinelová uzlina.ÚVOD
Uzlinové metastázy u karcinomu prostaty jsou nepříznivým prognostickým faktorem (1). Nejpřesnější stagingovou metodou k zhodnocení lymfatických uzlin zůstává PLAE i přes rozvoj zobrazovacích metod, které však mají nízkou senzitivitu při detekci metastáz pod 5 mm (2). Zavedení PSA vyšetření vedlo k posunu klinických stadií v čase diagnózy, a s tím i k poklesu incidence uzlinových metastáz, což mělo za následek ústup od provádění PLAE a omezení jejího rozsahu (3). Stagingová PLAE se často omezila na obturatorní skupinu, což vedlo k podhodnocení výskytu uzlinových metastáz v současných chirurgických souborech. V poslední době byl dosažen konsenzus, že rozsah PLAE musí zohledňovat výsledky studií mapujících lymfatický spád prostaty, které prokázaly komplexní drenáž do zevních ilických, vnitřních ilických, obturatorních a presakrálních uzlin (4), ale optimální rozsah PLAE není dosud vyřešen. „Rozšířená“ PLAE vede k zpřesnění stagingu, kdy vyšší počet odstraněných uzlin se promítá do vyšší detekce uzlinových metastáz. Na druhé straně může být časově náročná a zvyšuje riziko komplikací (5), i když někteří autoři to popírají (6). Výsledky retrospektivních studií navíc poukazují na skutečnost, že pečlivá PLAE může mít i terapeutický přínos u části pacientů s minimálním uzlinovým postižením (7).
Na tyto problémy reagoval koncept SU. Byl vyvíjen s cílem omezit rozsah lymfadenektomie na odstranění pouze primárních spádových uzlin drénujících lymfu z nádoru, a tak snížit morbiditu lymfadenektomie a zkrátit operační čas.
SU je první uzlinou, do které přitéká lymfa z nádoru a při lymfatickém metastazování spolu s ní i nádorové buňky. Vyšetření SU by mělo odrážet stav celého lymfatického spádu nádoru; pokud je SU nepostižená, tak lze předpokládat, že i ostatní uzliny ve spádovém řečišti jsou bez nádoru. U řady nádorů je již zavedenou stagingovou metodou. Upřesňuje staging vyšetřením spádových oblastí mimo běžný rozsah lymfadenektomie a detekuje mikrometastázy pečlivým vyšetřením menšího počtu lymfatických uzlin s využitím imunohistochemických (IMH) metod (8).
V pilotní studii jsme potvrdili schůdnost vyšetření SU u karcinomu prostaty (9). V nynější práci bylo naším záměrem posoudit přínos vyšetření SU pro staging onemocnění a vyvodit důsledky z mapovací studie pro rozsah PLAE.
METODA
Protokol vyšetření SU u karcinomu prostaty byl schválen ústavní Etickou komisí a každý pacient podepsal informovaný souhlas s účastí ve výzkumném projektu. Od října 2010 do února 2012 jsme zařadili do studie 50 pacientů s klinicky lokalizovaným nebo lokálně pokročilým karcinomem prostaty, kteří byli dle doporučení Evropské urologické společnosti indikováni k PLAE (2) a riziko lymfadenopatie bylo podle Brigantiho nomogramu vyšší než 5 % (10). Kontraindikací k vyšetření byla předchozí pánevní operace, endoskopická operace prostaty, radioterapie pánve, antiandrogenní léčba nebo pánevní lymfadenopatie.
Vyšetření SU jsme prováděli v jednodenním režimu. Ráno v den operace jsme pacientům intraprostaticky aplikovali 99mTechneciem značený radiokoloid Nanocoll (GE Healthcare, Miláno, Itálie) v objemu 0,8 ml s celkovou aktivitou 100 MBq. Aplikace proběhla pod ultrazvukovou kontrolou Chiba jehlou 21 G oboustranně do periferní a centrální zóny v horním a dolním kvadrantu prostaty. Karcinom prostaty je obvykle multifokální a pomocí transrektální sonografie obtížně lokalizovatelný, proto nelze aplikovat radiokoloid peri/intratumorózně. Snažili jsme se o co nejhomogennější rozptýlení radiofarmaka, a tím zobrazení primárního lymfatického spádu celé prostaty.
K orientačnímu zobrazení SU jsme využívali planární lymfoscintigrafii v intervalu 30 až 120 minut (obr. 1a), provedli jsme sérii 2–6 statických snímků s 5 minutovou délkou snímání. Snímky SPECT byly získány ze 72 projekcí během 15 minut s následnou rekonstrukcí dat se softwarovou korekcí atenuace. K přesnější anatomické lokalizaci SU byla provedena fúze SPECT a CT zobrazení (obr. 1b).
Obr. 1. Planární lymfoscintigrafie (1a) nás orientačně informuje o počtu a poloze sentinelových uzlin (šipka). Prostata s aplikovaným radiokoloidem je odstíněna olověnou gumou (hvězdička). Fúze SPECT a CT obrazu (1b) usnadňuje lokalizaci sentinelové uzliny ve vztahu k anatomickým strukturám, v tomto případě se jedná o zevní ilickou uzlinu (šipka). Fig. 1. Planar scintigraphy (1a) gives us basic overview of the location and the number of sentinel lymph nodes (arrow). The prostate with injected radiocolloid is shaded by lead plate (asterisk). Fusion of SPECT and CT images (1b) facilitates localization of sentinel lymph nodes. External iliac sentinel lymph node is depicted in this case (arrow). 
Pacienty jsme operovali s odstupem 3 až 6 hodin od aplikace radiofarmaka. Extraperitoneálně jsme zpřístupnili pánevní spádové oblasti, které jsme systematicky vyšetřili gama-sondou. SU jsme detekovali nejdříve in vivo (za SU jsme považovali uzliny s minimálně dvojnásobnou aktivitou pozadí) a pro kontrolu byla všechna odstraněna tukově-lymfatická tkáň přeměřená in vitro, abychom vyloučili přehlédnutou SU. Všechny uzliny s vyšší aktivitou radiofarmaka jsme považovali za primární spádové uzliny. Použili jsme gama-sondy dvou výrobců: Europrobe (Euromedical, Le Chesnay, Francie) a Di Surpro (Delong instruments, Brno, Česká republika). K posouzení senzitivity vyšetření jsme prováděli „rozšířenou“ PLAE, jejímiž hranicemi byla proximálně bifurkace společné ilické arterie, distálně vena iliaca circumflexa a ligamentum Cooperi. Laterální hranici tvořila laterální stěna zevní ilické arterie a pánevní stěna, mediálním ohraničením byl ureter a stěna měchýře, posteriorně jsme odstranili tukově-lymfatickou tkáň až na endopelvickou fascii, s disekcí kolem vnitřních ilických cév a jejich větví. Společné ilické a presakrální uzliny byly odstraněny jenom v případě výskytu SU v této oblasti (obr. 2). Následovala radikální retropubická prostatektomie.
Obr. 1. Levá pánevní strana po „rozšířené“ pánevní lymfadenektomii z extraperitoneálního přístupu s označenými regiony lymfatického spádu 1 – zevní ilická oblast, 2 – obturatorní oblast, 3 – vnitřní ilická oblast, 4 – presakrální oblast, 5 – společná ilická oblast Fig. 2. Left pelvic side after completion of extended pelvic lymphadenectomy. Lymphatic drainage regions are indicated. 1 – external iliac, 2 – obturator, 3 – internal iliac, 4 – presacral, 5 – common iliac 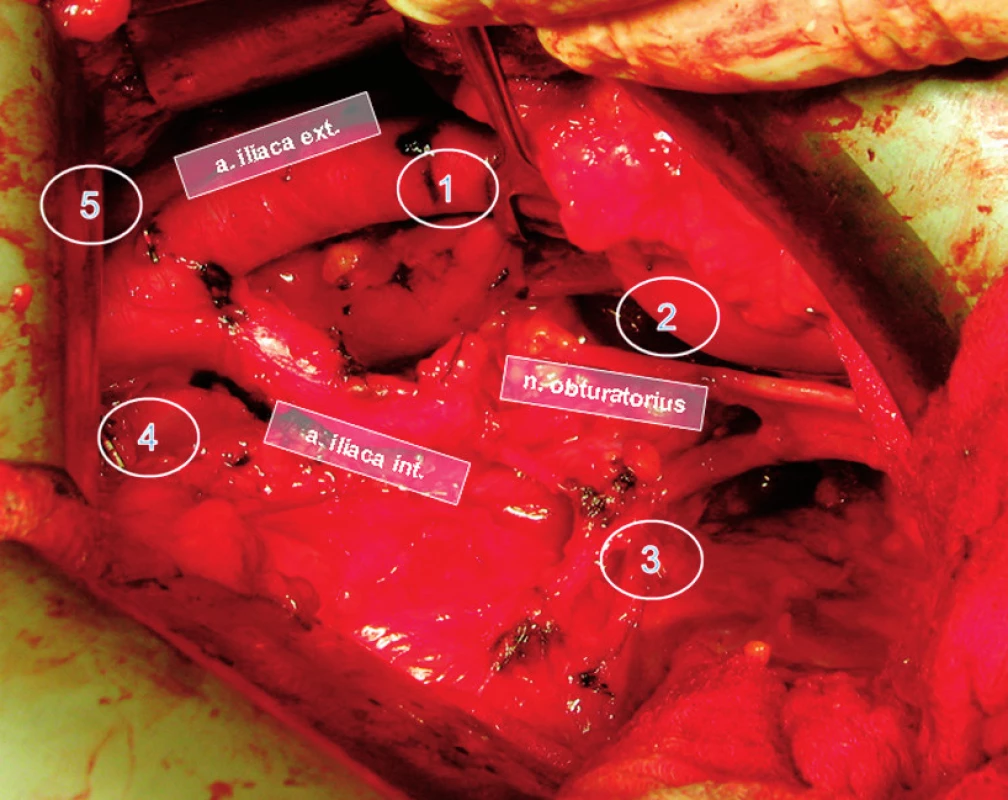
Po fixaci formalinem byly uzliny menší velikosti pouze podélně rozpůlené dle nejdelší osy, uzliny širší než 4 mm byly rozkrájeny na cca 2 mm silné plátky a zality do parafinových bloků. Z takto zpracované uzliny byly vyšetřeny tři základní, po sobě jdoucí řezy s odstupy 2–4 µm, barvené hematoxylin-eosinem. Byla-li uzlina v barvení hematoxylin-eosin negativní, následoval krok se stupňovitým prokrájením lymfatické uzliny formou dvou řezů s odstupem 150 µm, řezy byly barveny hematoxylin-eosinem, u řezu s odstupem 300 µm byla paralelně provedena i imunohistochemická reakce pomocí širokospektré anticytokeratinové protilátky (CK AE1/AE3, Biogenex).
VÝSLEDKY
U 50 vyšetřených pacientů byly klinické stadia cT1, cT2 a cT3 zastoupeny v 34 %, 60 %, resp. 6 %. Medián věku pacientů byl 63 let (rozsah 51–72). Předoperační údaje o souboru pacientů jsou uvedeny v tabulce 1 a pooperační histopatologické charakteristiky v tabulce 2.
Tab. 1. Předoperační údaje o souboru pacientů Table 1. Patients preoperative data 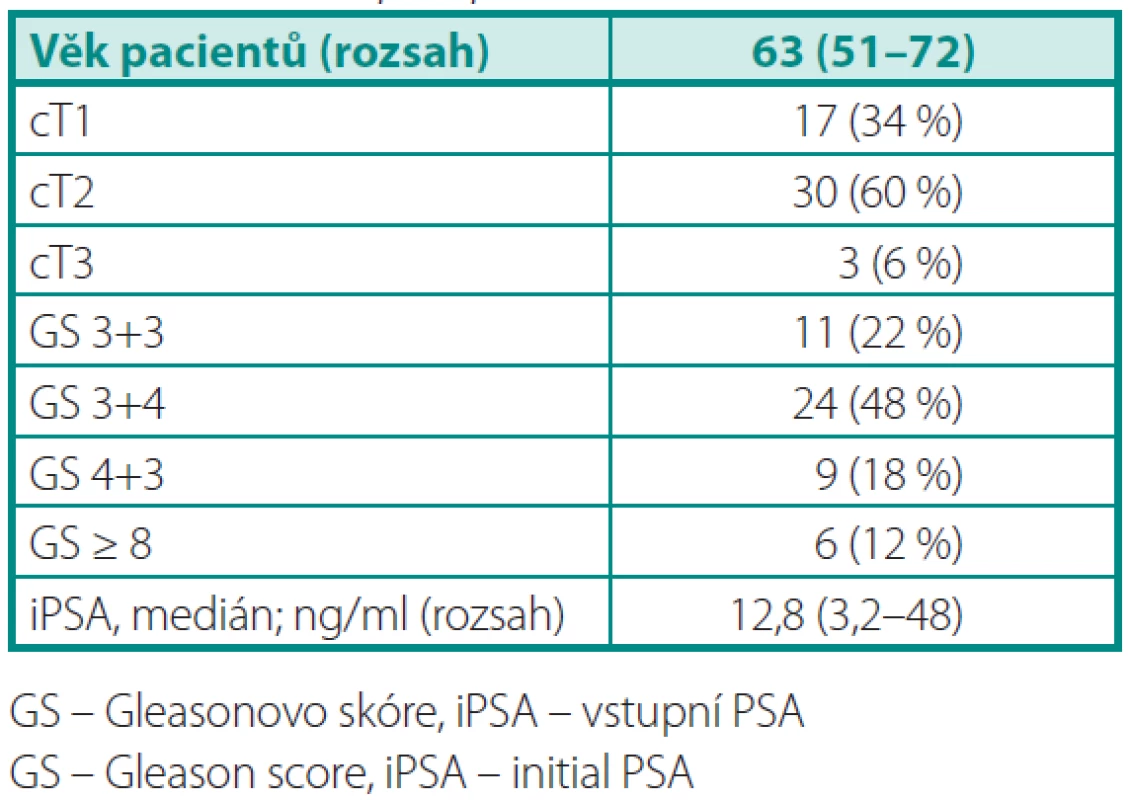
Tab. 2. Histopatologické údaje o souboru pacientů Table 2. Patients histopathological characteristics 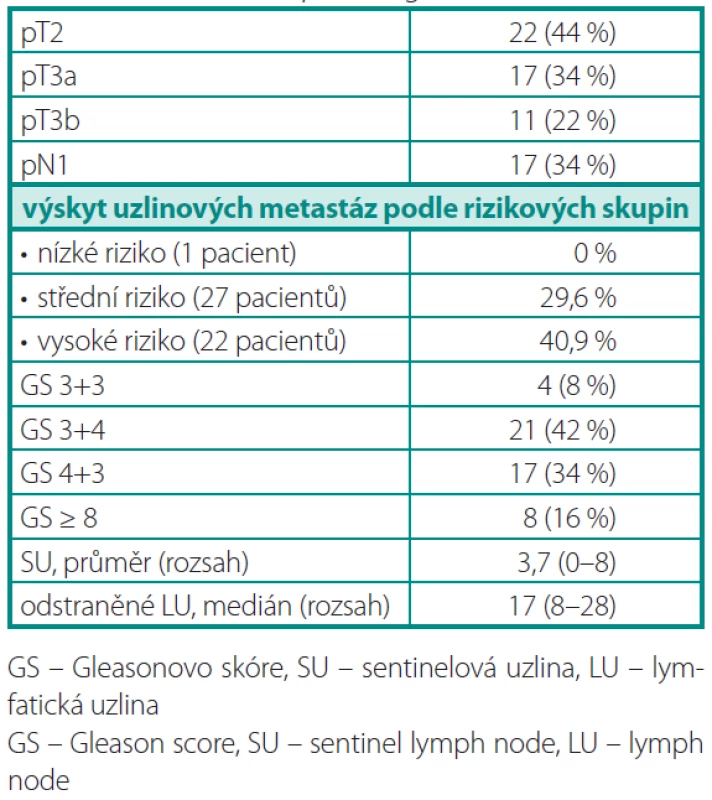
Detekce SU byla úspěšná u 96 % pacientů, v 80 % na obou stranách pánve a v 16 % jenom unilaterálně. U dvou pacientů (4 %) jsme SU nedetekovali. Při planární lymfoscintigrafii a SPECT vyšetření jsme zachytili 120 SU, gama-sondou jsme během operace nalezli 186 SU, v průměru 3,7 na pacienta (medián 4). Při následné „rozšířené“ PLAE byl medián odstraněných uzlin 17 (rozsah 8–28).
V tabulce 3 je uvedena lokalizace SU a uzlinových metastáz podle spádových oblastí. Odstraněním obturatorních uzlin bychom vyšetřili pouze 35,5 % primárních spádových uzlin, naopak při „rozšířené“ PLAE zahrnující i vnitřní a zevní ilické uzliny vyšetříme 94,6 %. Výskyt SU presakrálně a v oblasti společných ilických uzlin byl v naší studii méně častý (3,2 %, resp. 2,2 %).
Tab. 3. Výskyt SU a metastáz podle anatomických regionů Table 3. Occurrence of sentinel lymph node and metastases according to anatomical regions 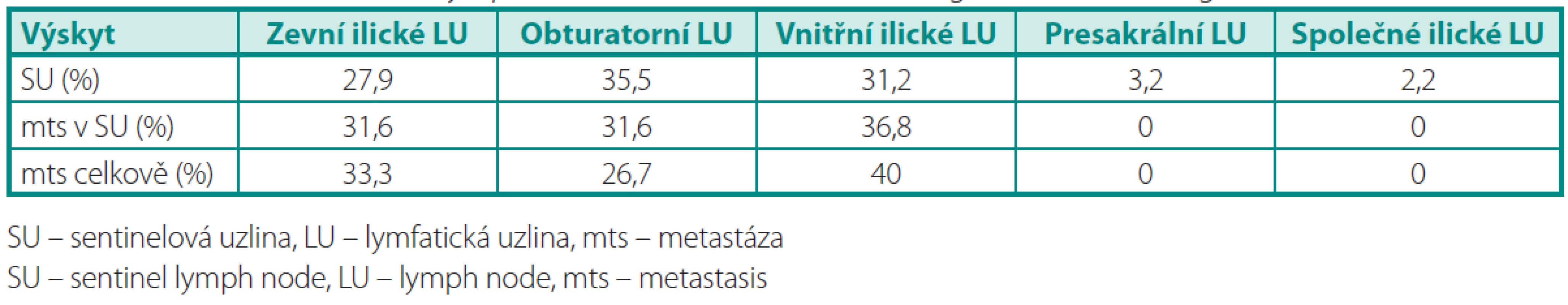
Uzlinové metastázy byly zachyceny u 17 pacientů (34 %). Přesné stadium onemocnění bychom určili u 7/17 (41,2 %) pacientů při omezení PLAE na obturatorní skupinu (tab. 4). Rozšířil-li by se rozsah výkonu o odstranění zevních ilických uzlin, stagingové přesnosti by bylo dosaženo u 13/17 (76,5 %) pacientů. S ohledem na potencionálně léčebnou roli PLAE je však tento rozsah v obou případech nedostatečný, jelikož všechny uzlinové metastázy bychom odstranili pouze ve 2/17 (11,8 %), resp. 7/17 (41,2 %) případů. Vnitřní ilické uzliny byly postiženy u 10/17 (58,8 %) pacientů.
Tab. 4. Vliv rozsahu pánevní lymfadenektomie na přesnost stagingu a potencionální léčebný přínos Table 4. Influence of the pelvic lymphadenectomy template on staging accuracy and its potential therapeutic benefi t 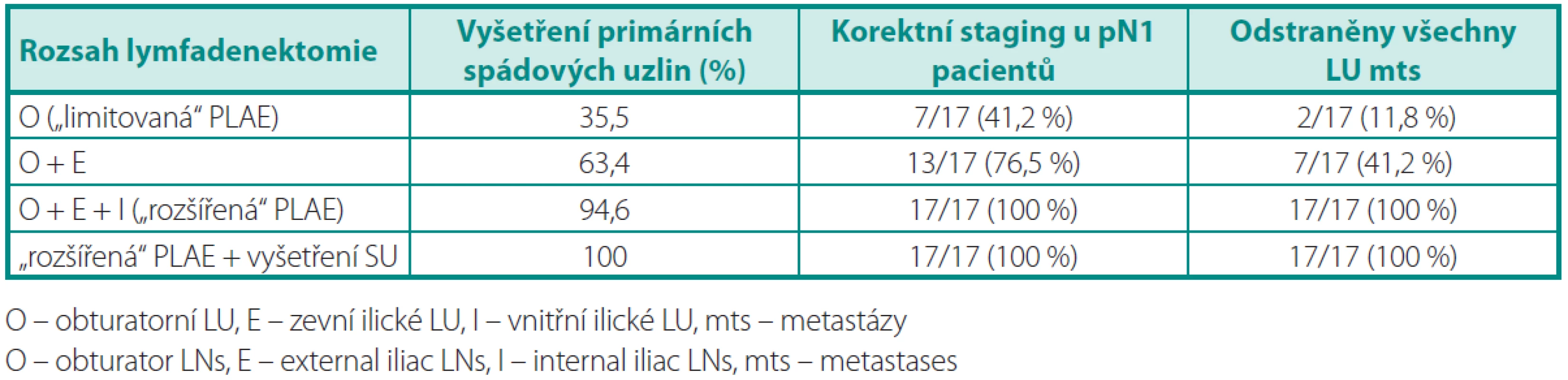
Senzitivita vyšetření SU ve vztahu k detekci uzlinových metastáz dosáhla 94,1 %, metastázy byly zachyceny v SU v 16 ze 17 případů, u jednoho pacienta byla nalezena uzlinová metastáza na pánevní straně, kde se nezobrazila SU. Výsledek vyšetření SU byl tedy falešně negativní u jednoho ze 17 pacientů (5,9 %) a negativní prediktivní hodnota vyšetření byla 97,1 %.
V osmi případech se jednalo o makrometastázy (> 2 mm), v sedmi případech o mikrometastázy (0,2–2 mm) a ve dvou případech byly nalezeny jenom izolované klustry nádorových buněk (< 0,2 mm). Medián velikosti metastáz byl 1,9 mm. V průměru bylo postiženo 1,8 uzliny na pacienta (medián 1, rozsah 1–5 uzlin). U deseti pacientů (58,8 %) byla postižena pouze jedna SU, u sedmi pacientů byly postiženy i non-sentinelové uzliny.
Komplikace v souvislosti s vyšetřením SU se nevyskytly. Po rozšířené pánevní lymfadenektomii byla nutná perkutánní drenáž lymfokély u 14 % pacientů, plicní embolii a flebotrombózu jsme zaznamenali u jednoho (2 %) pacienta.
DISKUSE
Vyšetření SU je jednou z nejrychleji se rozvíjejících diagnostických metod v onkochirurgii. Základy značení lymfatických cest radiokoloidem a metylénovou modří byly rozpracovány u nádoru prsu a melanomu již v devadesátých letech 20. století (11, 12). U karcinomu prostaty techniku lymfoscintigrafie a intraoperační detekce radiokoloidu v SU pomocí ruční gama-sondy standardizovala Augsburská skupina v roce 1999 (13). V České republice publikoval první zkušenosti doc. Jarolím se skupinou z FN Motol v roce 2004 (14).
Cílem vyšetření SU obecně je miniinvazivním způsobem odhalit okultní metastázy v primárních spádových uzlinách. V případě negativního nálezu se pacienti vyhnou rozsáhlejšímu výkonu a možným komplikacím při zachování onkologické bezpečnosti. Koncept SU se opírá o zásadní poznatek, že vyšetření SU spolehlivě určuje postižení dalších spádových uzlin (15).
Schůdnost vyšetření SU u karcinomu prostaty potvrdilo více autorů, přičemž úspěšnost detekce SU je popisována v 85–100 % a senzitivita 83–98 % ve vztahu k záchytu uzlinových metastáz (16–19). V naší studii jsme nalezli SU u 96 % pacientů, v 80 % případů na obou pánevních stranách. Senzitivita vyšetření byla 94,1 %; v jednom případě byla nalezena uzlinová metastáza u pacienta, u kterého se podařilo detekovat SU jenom na kontralaterální pánevní straně. Vyšetření lze považovat za kompletní, pouze zobrazí-li se SU bilaterálně, jinak hrozí riziko falešné negativity vyšetření. Vyšetření je navíc nevhodné provádět při klinické lymfadenopatii, kdy mohou být primární spádové uzliny obstruovány metastatickými buňkami a nedojde v nich k akumulaci radiokoloidu. Proto je u pokročilých nádorů udávaná nižší senzitivita vyšetření (20).
Odstraněním pouze SU bychom v naší studii dosáhli 94% přesnosti uzlinového stagingu. Pokud ale uznáme i léčebnou roli PLAE, tak je odstranění samotné SU nepostačující, jelikož 41 % pacientů mělo metastázy i v non-SU. Pravděpodobnost postižení non-SU stoupá hlavně u pacientů ve skupině s vysokým rizikem (20). Jedním z řešení je peroperační vyšetření SU, které však zatím nebylo u karcinomu prostaty podrobněji zkoumáno. I když je jeho přesnost při detekci mikrometastáz nízká, u karcinomu prsu kolem 40 % (21), tak v případě minimálního postižení SU je nízké i riziko metastáz v non-SU (17, 18) a odstranění SU může být v této situaci dostačující. V našem souboru se nevyskytly metastázy v non-SU, pokud byla v SU nalezena jenom mikrometastáza. Důležitými se proto do budoucna jeví inovace techniky, které by vedly ke spolehlivější a rychlejší detekci SU, jako je například duální využití radiofarmaka a barviva (22).
Mapovací studie prokázaly variabilitu lymfatické drenáže prostaty (4, 23) a na jejich podkladě je doporučeno provádět „rozšířenou“ PLAE v rozsahu zevních ilických, obturatorních a vnitřních ilických uzlin (2). Tzv. „limitovanou“ PLAE v rozsahu obturatorních uzlin vyšetříme méně než 40 % primárních spádových uzlin (4), což vede k podhodnocení výskytu uzlinových metastáz (3). Tuto skutečnost je nutné zohlednit i při předpovědi rizika postižení uzlin pomocí Partinových tabulek (24) nebo Kattanova nomogramu (25), které se opírají o výsledky „limitované“ PLAE; jenom Brigantiho nomogram vychází z dat s „rozšířenou“ PLAE (10). Naše studie potvrzuje poznatek, že v obturatorní oblasti se vyskytuje asi jenom třetina primárních spádových uzlin, jejichž vyšetřením dosáhneme správného stagingu ve 41,2 % případů, ale všechny uzlinové metastázy odstraníme jenom u 11,8 % pacientů (tab. 3). Důležitou součástí PLAE je pečlivá preparace kolem větví vnitřních ilických cév, kdy odstraníme nejenom minimálně další třetinu SU (4), ale je to i nejčastější místo uzlinového postižení (v našem souboru u 58,8 % pacientů s metastázemi).
Oblast „rozšířené“ PLAE zahrnula v našem případě 94,6 % SU. Zbylých 5,4 % SU jsme nalezli v oblasti společných ilických uzlin a presakrálně. Mattei et al. mapovali primární lymfatickou drenáž pomocí SPECT/CT vyšetření po intraprostatické aplikaci radiokoloidu a uvádí, že při „rozšířené“ PLAE nevyšetříme až 37 % primárních spádových uzlin (4). Nicméně ve své studii zaznamenali vysoký medián 10 SU a je otázkou, zda 16 % společných ilických a 12 % paraaortálních uzlin lze ve všech případech považovat za primární lymfatický spád. Doporučují rozšířit disekci kraniálně o společné ilické uzliny po křížení s ureterem, čímž se zvýší podíl odstraněných SU na 75 %.
Více autorů prokázalo, že podíl primární drenáže do presakrální oblasti (4), podobně jako výskyt metastáz (23), je nízký. Proto s ohledem na obtížnou přístupnost a riziko poškození autonomních sympatických nervů v této oblasti nejsou presakrální uzliny do „rozšířené“ PLAE standardně zahrnuty. Omezením naší práce je skutečnost, že presakrální uzliny nebyly odstraněny u všech pacientů, a proto se k výskytu metastáz v této oblasti nelze vyjádřit. Skupina z Leuvenu naopak udává až 9% záchyt metastáz v presakrální oblasti, jejichž odstranění by ovlivnilo léčebný výsledek u 12 % pacientů, a proto doporučují tuto oblast do PLAE zahrnout (26). Tyto výsledky musí být potvrzeny na větších souborech pacientů.
Zpřesnění stagingu a vyšší záchyt uzlinových metastáz souvisí nejen s rozsahem PLAE a počtem odstraněných uzlin (3), ale i způsobem jejich zpracování a vyšetření (27). V našem souboru jsme detekovali v průměru 4 SU na pacienta. SU jsou prokrájeny po 150 μm a navíc každý řez po 300 μm je vyšetřen na přítomnost cytokeratinů AE1/3. Tímto způsobem se podstatně zvyšuje záchyt uzlinových mikrometastáz, v našem souboru tvořil až 53 % pacientů s uzlinovým postižením. Výsledky naší práce můžou být ovlivněny faktem, že non-SU nebyly zpracovány stejným postupem. Nicméně skupina z Leuvenu udává, že prokrájením SU i non-SU po 300 μm se nezvýšilo riziko falešné negativity a nižší senzitivity vyšetření (28).
Častý výskyt uzlinových metastáz v našem souboru (34 %) odráží i spektrum operovaných pacientů. Jednalo se o selektované pacienty, u kterých byla indikována PLAE podle doporučení (2), a téměř všichni byli předoperačně ve skupině se středním nebo vysokým rizikem (tab. 2). Vysokou incidenci uzlinových metastáz jsme potvrdili u obou skupin (6), u středního rizika ve 29,6 % a u vysokého rizika ve 40,9 % případů.
Definitivně vyřešena není ani otázka indikace PLAE u pacientů s nízkým rizikem, jelikož tato skupina není zcela homogenní z hlediska rizika lymfadenopatie. Pravděpodobnost uzlinového postižení stoupá s procentem postižených bioptických vzorků a s pečlivostí patologického vyšetření. Augsburgská skupina při vyšetření SU prokázala výskyt uzlinových metastáz u 6,8 % pacientů s nízkým rizikem, pokud byl pozitivní bioptický vzorek na jedné straně prostaty, resp. 10,7 % při oboustranném postižení (29).
Vyšetření SU u karcinomu prostaty zůstává experimentální metodou, nenahrazuje PLAE, ale je k ní komplementární. Hlavním výsledkem je zpřesnění stagingu a posun ve stadiích onemocnění. Budoucnost metody závisí také na rozvoji neinvazivních alternativ, jako jsou moderní zobrazovací metody, předoperační nomogramy nebo nové prognostické parametry, které by pomohly vyselektovat pacienty profitující z PLAE. Určující bude i vyřešení otázky terapeutického prospěchu PLAE, která zůstává nadále otevřená.
ZÁVĚRY
Vyšetření SU je zavedenou diagnostickou metodou v onkochirurgii řady nádorů, kde nahrazuje lymfadenektomii a selektuje pacienty, kteří z ní mohou mít prospěch. U karcinomu prostaty byla prokázaná vysoká senzitivita vyšetření SU pro detekci uzlinových metastáz, avšak v současnosti je vyšetření SU pouze doplňkem PLAE, zpřesňuje staging odstraněním primárních uzlin mimo obvyklý rozsah PLAE a vyšším záchytem mikrometastáz vede k posunu ve stadiích onemocnění.
Pro rozvoj metodiky je nutné vyvinout rychlý a spolehlivý způsob intraoperační lokalizace SU a snížit riziko falešné negativity vyšetření. Výrazným klinickým přínosem by byla možnost rozhodnout o nutnosti PLAE na základě peroperačního histologického zhodnocení SU, překážkou však zůstává nízká senzitivita peroperační histologie při detekci mikrometastáz.
Je-li PLAE indikována, musí být „rozšířená“ v rozsahu zevních ilických, obturatorních a vnitřních ilických uzlin. Pokud bychom omezili PLAE jenom na obturatorní oblast, přesné uzlinové stadium bychom určili u 41 % pacientů a všechny uzlinové metastázy odstranili pouze u 12 %. V naši studii zahrnula „rozšířená“ PLAE 95% primárních spádových uzlin a stadium určila správně ve 100 % případů.
Došlo: 16. 8. 2012.
Přijato: 8. 2. 2013.
Kontaktní adresa
MUDr. Michal Staník
Oddělení onkourologie, Masarykův onkologický ústav
Žlutý Kopec 7, 656 53 Brno
e-mail: stanik@mou.cz
Práce byla financována z institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR v roce 2012.
Střet zájmů: žádný.
Zdroje
1. Fleischmann A, Schobinger S, Schumacher M, et al. Survival in surgically treated, nodal positive prostate cancer patients is predicted by histopathological characteristics of the primary tumor and its lymph node metastases. Prostate 2009; 69 : 352–362.
2. Heidenreich A, Bellmunt J, Bolla M, et al. EAU guidelines on prostate cancer. Part 1: screening, diagnosis, and treatment of clinically localized disease. Eur Urol 2011; 59 : 61–71.
3. Abdollah F, Sun M, Thuret R, et al. Decreasing rate and extent of lymph node staging in patients undergoing radical prostatectomy may undermine the rate of diagnosis of lymph node metastases in prostate cancer. Eur Urol 2010; 58 : 882–892.
4. Mattei A, Fuechsel FG, Bhatta Dhar N, et al. The template of the primary lymphatic landing sites of the prostate should be revisited: results of a multimodality mapping study. Eur Urol 2008; 53 : 118–125.
5. Briganti A, Blute ML, Eastham JH, et al. Pelvic lymph node dissection in prostate cancer. Eur Urol 2009; 55 : 1251–1265.
6. Heidenreich A, Ohlmann CH, Polyakov S. Anatomical extent of pelvic lymphadenectomy in patients undergoing radical prostatectomy. Eur Urol 2007; 52 : 29–37.
7. Schumacher MC, Burkhard FC, Thalmann GN, et al. Good outcome for patients with few lymph node metastases after radical retropubic prostatectomy. Eur Urol 2008; 54 : 344–352.
8. Fait V. Sentinelova biopsie a možnosti využiti v současne onkochirurgii. Klinická Onkologie 2008; 21 : 5–19.
9. Staník M, Čapák I, Macík D, et al. Vyšetření sentinelové uzliny u karcinomu prostaty. Ces Urol 2011; 15(Suppl 2): 39.
10. Briganti A, Karakiewicz PI, Chun FK, et al. Percentage of positive biopsy cores can improve the ability to predict lymph node invasion in patients undergoing radical prostatectomy and extended pelvic lymph node dissection. Eur Urol 2007; 51 : 1573–1581.
11. Krag DN, Weaver DL, Alex JC, Fairbank JT. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. Surg Oncol 1993; 2 : 335–339.
12. Morton DL, Wen DR, Wong JH, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992; 127 : 392–399.
13. Wawroschek F, Vogt H, Weckermann D, Wagner T, Harzmann R. The sentinel lymph node concept in prostate cancer: first results of gamma probe guided sentinel lymph node identification. Eur Urol 1999; 36 : 595–600.
14. Jarolím L, Verner P, Křížová H, et al. Lymfoscintigrafie sentinelových uzlin při radikální prostatektomii. Urológia 2004; 10 : 33.
15. Šimša J. a kol. Sentinelová uzlina. Lymfadenektomie u solidních nádorů. 1.vyd. Praha: Maxdorf Jessenius 2010; 10–11.
16. Holl G, Dorn R, Wengenmair H, Weckermann D, Sciuk J. Validation of sentinel lymph node dissection in prostate cancer: experience in more than 2,000 patients. Eur J Nucl Med Mol Imaging 2009; 36 : 1377–1382.
17. Fukuda M, Egawa M, Imao T, et al. Detection of sentinel node micrometastasis by step section and immunohistochemistry in patients with prostate cancer. J Urol 2007; 177 : 1313–1317.
18. Jeschke S, Beri A, Grüll M, et al. Laparoscopic radioisotope-guided sentinel lymph node dissection in staging of prostate cancer. Eur Urol 2008; 58 : 126–133.
19. Meinhardt W, Valdes Olmos RA, van der Poel HK, et al. Laparoscopic sentinel node dissection for prostate carcinoma: technical and anatomical observations. BJU 2008; 102 : 714–717.
20. Weckermann D, Dorn R, Holl G, Wagner T, Harzmann R. Limitation of radioguided surgery in high-risk prostate cancer. Eur Urol 2007; 51 : 1549–1558.
21. Liu LC, Lang JE, Lu Y, et al. Intraoperative frozen section analysis of sentinel lymph nodes in breast cancer patients. Cancer 2011; 117 : 250–258.
22. Van Der Poel H, Buckle T, Brouwer OR, et al. Intraoperative laparoscopic fluorescence guidance to the sentinel lymph node in prostate cancer patiens: clinical proof of concept of an integrated functional imaging approach using a multimodal tracer. Eur Urol 2011; 60 : 826–833.
23. Heidenreich A, Varga Z and Von Knobloch R. Extended pelvic lymphadenectomy in patients undergoing radical prostatectomy: high incidence of lymph node metastasis. J Urol 2002; 167 : 1681.
24. Makarov DV, Humphreys EB, Mangold LA, et al. Pathological outcomes and biochemical progression in men with T1c prostate cancer undergoing radical prostatectomy with prostate specific antigen 2.6 to 4.0 vs 4.1 to 6.0 ng/ml. J Urol 2006; 176 : 554–558.
25. Cagiannos I, Karakiewicz P, Eastham JA, et al. A preoperative nomogram identifying decreased risk of positive pelvic lymph nodes in patients with prostate cancer. J Urol 2003; 170 : 1798–1803.
26. Joniau S, Van Den Bergh L, Lerut E, et al. Mapping of pelvic lymph node metastases in prostate cancer. Eur Urol 2012, http://dx.doi.org/10.1016/j.eururo.2012.6.057.
27. Wawroschek F, Wagner T, Hamm M, et al. The influence of serial sections, immunohistochemistry and extension of pelvic lymph node dissection on the lymph node status in clinically localized prostate cancer. Eur Urol 2003; 43 : 132–137.
28. Van Den Bergh L, Lerut E, Deroose CM, et al. Sentinel node procedure for lymph node staging in prostate cancer. Eur Urol Suppl 2012; 11 : 1011.
29. Weckermann D, Wawroschek F, Harzmann R. Is there a need for pelvic lymph node dissection in low risk prostate cancer patients prior to definitive local therapy? Eur Urol 2005; 47 : 45–50.
Štítky
Dětská urologie Nefrologie Urologie
Článek EditorialČlánek Novinky 10. konference ESOU
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2013 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Role urologa u kastračně rezistentního karcinomu prostaty v České republice
- Diagnostika onemocnění nadledvin – nejvýznamnější klinické syndromy, biochemický průkaz a úloha zobrazovacích metod
- Cizí tělesa zavedená do urogenitálního traktu za účelem sexuální stimulace
- Testikulární aneuploidie spermií mužů s transverzální lézí míšní
- Vyšetření sentinelové uzliny u karcinomu prostaty – mapování primární lymfatické drenáže a zhodnocení přínosu pro staging onemocnění
- Život ohrožující krvácení do dutiny břišní na podkladě spontánní ruptury angio-myolipomu
- Morcelace ledviny po laparoskopické nefrektomii
- Komentář k článku Viktor Eret a kol. „Jednoportová laparoskopie v urologii (Laparoendoscopic single-site surgery, less) – Nová hranice miniinvazivity?“
- Novinky 10. konference ESOU
- Editorial
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostika onemocnění nadledvin – nejvýznamnější klinické syndromy, biochemický průkaz a úloha zobrazovacích metod
- Cizí tělesa zavedená do urogenitálního traktu za účelem sexuální stimulace
- Život ohrožující krvácení do dutiny břišní na podkladě spontánní ruptury angio-myolipomu
- Morcelace ledviny po laparoskopické nefrektomii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




