-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prognóza pacientů s T1G3 uroteliálním karcinomem močového měchýře léčených vakcínou BCG – retrospektivní analýza
Treatment outcomes of BCG vaccine in patients with T1G3 urothelial cancer – a retrospective analysis
Aim:
The aim of the study was to determine the natural history, recurrence and progression risk after intravesical adjuvant bacillus Calmette-Guérin (BCG) immunotherapy in patients with T1G3 urothelial bladder tumors.Methods:
Ninety-two patients diagnosed with a T1G3/high grade tumor between 1990 and 2008 were evaluated. All patients received a full induction course (i.e. 6 instillations) of BCG. A subgroup received maintenance BCG treatment following the full initial induction course. The outcomes for each group were compared.Results:
The median follow-up time was 4.8 (0.3–18.7) years. Recurrence was confirmed in 29 patients, and the recurrence free survival rate at 1, 3 and 5 years was 82, 72 and 66% respectively. There was a significantly higher risk of 3.3% recurrence in patients treated with the induction course of BCG only compared to those receiving maintenance BCG treatment. In the BCG induction plus maintenance group recurrence was detected in 16 patients. The progression free survival at 1, 3 and 5 year follow-ups was 95, 85 and 80%. There was no significant correlation between the risk of progression and concomitant tumor in situ (TIS). On the other hand, BCG maintenance treatment significantly increased the progression-free survival (p = 0.007). Patients without maintenance had 3-times higher risk of progression and 8-times higher risk of subsequent cystectomy. BCG maintenance treatment was the most significant and favorable independent factor for cystectomy-free survival rate, both disease specific and overall survival.Conclusion:
High-grade T1 (formerly T1G3) bladder cancer has a high propensity for recurrence and progression. Treatment with maintenance BCG was shown to be a significant, favorable, independent factor of recurrence-free, progression-free, cystectomy-free, disease-free and overall survival rate.Key words:
BCG, progression, recurrence, maintenance BCG treatment, urothelial T1G3 bladder cancer.
Autoři: Viktor Soukup 1; Otakar Čapoun 1; Tomáš Hanuš 1; Michael Pešl 1; Zuzana Vaľová 1; Zuzana Feherová 1; Libor Zámečník 1; Marko Babjuk 2
Působiště autorů: Urologická klinika 1. LF UK a VFN, Praha 1; Urologická klinika 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Ces Urol 2012; 16(4): 230-240
Kategorie: Původní práce
Souhrn
Cíl:
Cílem práce je prostřednictvím retrospektivní analýzy zhodnotit průběh onemocnění u pacientů s T1G3 uroteliálním karcinomem léčených vakcínou BCG.Materiál a metoda:
Do studie bylo zařazeno 92 pacientů léčených na Urologické klinice VFN v letech 1992–2008. Zařazeni byli pouze pacienti s T1G3 uroteliálním karcinomem, kteří byli léčeni vakcínou BCG a dokončili alespoň úvodní cyklus šesti instilací.Výsledky:
Medián délky sledování byl 4,8 (0,3–18,7) let. K recidivě došlo u 29 pacientů, přežití bez recidivy v 1, 3 a 5 letech bylo 82, 72 a 66 %. Nemocní s indukční léčbou měli 3,3 vyšší riziko recidivy ve srovnání se skupinou, kde byla aplikována i udržovací léčba, rozdíl byl statisticky významný. Progrese byla zaznamenána u 16 pacientů, přežití bez progrese v 1, 3 a 5 letech bylo 95, 85 a 80 %. Souvislost konkomitantního tumoru in situ (TIS) s rizikem progrese nebyla statisticky významná. Naopak aplikace udržovací léčby byla statisticky významným faktorem pro přežití bez progrese (p = 0,007); pokud nebyla podána, riziko progrese bylo 3krát vyšší a provedení cystektomie 8krát častější. Podání udržovací léčby bylo statisticky významným faktorem pro přežití bez cystektomie, nádorově specifické přežití a celkové přežití.Závěr:
Pacienti s T1G3 nádorem močového měchýře patří do skupiny s vysokým rizikem recidivy a progrese. Podání udržovací léčby vakcínou BCG bylo statisticky významným faktorem pro přežití bez recidivy, progrese, cystektomie, celkové i nádorově specifické přežití.Klíčová slova:
BCG, progrese, recidiva, udržovací léčba BCG, uroteliální T1G3 karcinom močového měchýře.ÚVOD
Uroteliální karcinom T1G3 patří mezi agresivní, svalovinu detrusoru neinfiltrující nádory močového měchýře (NMIBC). V souborech publikovaných před érou BCG došlo během pětiletého sledování až u 60 % pacientů k progresi do invazivního nádoru. Jedna třetina těchto pacientů v průběhu dlouhodobého sledování následně zemřela v důsledku nádorového onemocnění (1). EAU guidelines řadí nádor T1G3 do skupiny s vysokým rizikem recidivy a progrese, léčba vakcínou BCG je doporučována jako způsob první volby (2). Nicméně u T1G3 nádorů s nepříznivými prognostickými faktory může být primárně provedena časná cystektomie (2). Volba optimálního způsobu léčby pro T1G3 nádory zůstává nejednoznačná.
Jednotlivé studie zabývající se oběma způsoby léčby jsou ve většině případů retrospektivní a na relativně malém počtu pacientů (3). Malým počtem pacientů je zatíženo i několik publikovaných komparativních většinou nerandomizovaných studií (4). V rozsáhlé retrospektivní studii zahrnující více než 1000 pacientů s T1G3 tumorem léčených radikální cystektomií bez předcházející léčby vakcínou BCG 1/3 pacientů zemřela v důsledku progrese nádoru, u 51 % pacientů byl zachycen invazivní nádor, a to i přes to, že opakovaná transuretrální resekce (reTUR) byla provedena u 70 % pacientů (5). Randomizovaná prospektivní studie, která by u pacientů s T1G3 tumory srovnávala účinek léčby vakcínou BCG s radikální cystektomií, doposud nebyla provedena. BCG vakcína dokáže snížit riziko recidivy a progrese neinvazivních nádorů močového měchýře, nicméně informací o tom, zda je účinek na snížení rizika progrese dlouhodobý, je málo. Podle provedených studií má délka léčby vakcínou BCG zásadní význam a měla by být delší než jeden rok. Většina meta-analýz nicméně zahrnuje pacienty se středním rizikem. Naše retrospektivní studie je zaměřena pouze na pacienty s T1G3 nádory močového měchýře.
MATERIÁL A METODIKA
Do studie bylo zařazeno 92 pacientů léčených na Urologické klinice VFN v letech 1992 až 2008. Mezi kritéria pro zařazení do souboru byl jakýkoliv pacient s histologicky ověřeným T1G3 (dle WHO 1973) karcinomem močového měchýře či T1 high-grade (podle ISUP 1998/WHO 2004) karcinomem močového měchýře, kterému byl podán alespoň úvodní cyklus šesti instilací vakcíny BCG či pacient s recidivou ve formě T1 G3/HG tumoru, kdy původní nádor byl neinvazivní karcinom močového měchýře jiný než T1 G3/HG, a kterému nebyla pro tento nádor podána BCG vakcína. Důvod pro nezařazení byl nález invazivního nádoru (≥ T2), jiný histologický typ nádoru než uroteliální karcinom, pacienti s NMIBC, kteří byli již léčeni BCG vakcínou pro jiný nádor než T1G3/high-grade, pacienti s T1G3 nádorem, kteří byli iniciálně léčeni jinak než BCG vakcínou. Diagnóza TIS byla verifikována histologicky na základě biopsií, exofytické tumory byly před podáním BCG kompletně odstraněny transuretrální resekcí. V úvodním cyklu bylo pacientům podáno šest instilací v týdenním intervalu, udržovací léčba v sobě zahrnovala podání tří instilací v týdenním intervalu ve 3., 6. měsíci léčby a dále v půlročním intervalu se záměrem pokračování léčby do doby 3 let. Detailní popis samotného provedení instilace včetně použitého kmenu, ředění a dávky, způsobu sledování pacientů byl popsán v naší předchozí práci (6).
Za recidivu byl považován histologický průkaz Ta, T1 uroteliálního karcinomu, za progresi histologický průkaz nádoru infiltrujícího detrusor či průkaz metastatického onemocnění. Mezi hlavní hodnocené parametry patřil přežití bez recidivy, přežití bez progrese, přežití bez cystektomie, nádorově specifické přežití, celkové přežití. Dále byl hodnocen význam velikosti nádoru, mnohočetnosti nádoru, přítomnosti konkomitantního tumoru in situ (TIS), zda šlo o primární či recidivující nádor a význam počtu vykouřených cigaret během života (pack-years).
Statistické hodnocení
Veškerá statistická analýza byla vypracována pomocí systému SAS (Statistical Analysis Systém, SAS version 8.2, SAS Inc., Cary, NC, USA). Funkce přežití bez návratu choroby a časy do progrese byly porovnány pomocí Log-Rank testu a Wilcoxonova zobecněného testu. Metoda dle Kaplana-Meiera byla užita pro odhad funkcí přežití. Porovnání středních poloh dvou distribucí bylo provedeno pomocí ANOVA testu nebo dle Wilcoxonova nepárového testu. Souvislost mezi nominálními parametry byla testována chí-kvadrát testem. Všechny testované hypotézy byly oboustranné a předem byla zvolena hladina významnosti α = 0,05. Všechny testované hypotézy H0 vs. H1 byly formulovány před sběrem dat a nebyla užita žádná z metod adjustace pro mnohonásobná porovnávání.
VÝSLEDKY
Charakteristiky souboru jsou uvedeny v tabulce 1. Z celkového počtu 92 pacientů bylo 28 léčeno pouze úvodním cyklem šesti instilací vakcíny BCG, u 64 pacientů bylo po úvodním cyklu navázáno udržovací léčbou, jejíž délka byla u 53 pacientů kratší než jeden rok a u 11 pacientů delší než jeden rok. Medián sledování pacientů byl 4,8 let (0,31–18,7). K recidivě došlo u 29 z 92 pacientů (31,5 %). Přežití pacientů bez recidivy nádoru v závislosti na čase je patrné na obrázku 1. Ze sledovaných parametrů nebyla zaznamenána signifikantní souvislost mezi přežitím bez recidivy a počtem nádorů (p = 0,11), velikostí nádoru (p = 0,20), přítomností konkomitantního TIS (p = 0,29), počtem vykouřených cigaret během života (p = 0,72), či zda měl pacient primární či recidivující nádor (p = 0,56). Rozdíl v době do recidivy nádoru mezi skupinou s úvodním cyklem a další udržovací léčbou byl statisticky signifikantní (p = 0,0007, Log-Rank test, p < 0,0001 Wilcoxon test) (obr. 2). Podle Coxova modelu měli pacienti léčeni pouze úvodním cyklem šesti instilací 3,3krát vyšší riziko recidivy tumoru (HR 3,303, 1,588–6,869). Při podrobnější analýze byl signifikantní rozdíl v době do recidivy nádoru i mezi skupinami s udržovací léčbou v délce trvání kratší a delší než jeden rok (p = 0,0020, Log-Rank test, p = 0,0001 Wilcoxon test) (obr. 3).
Tab. 1. Charakteristika souboru Table 1. Patient characteristics 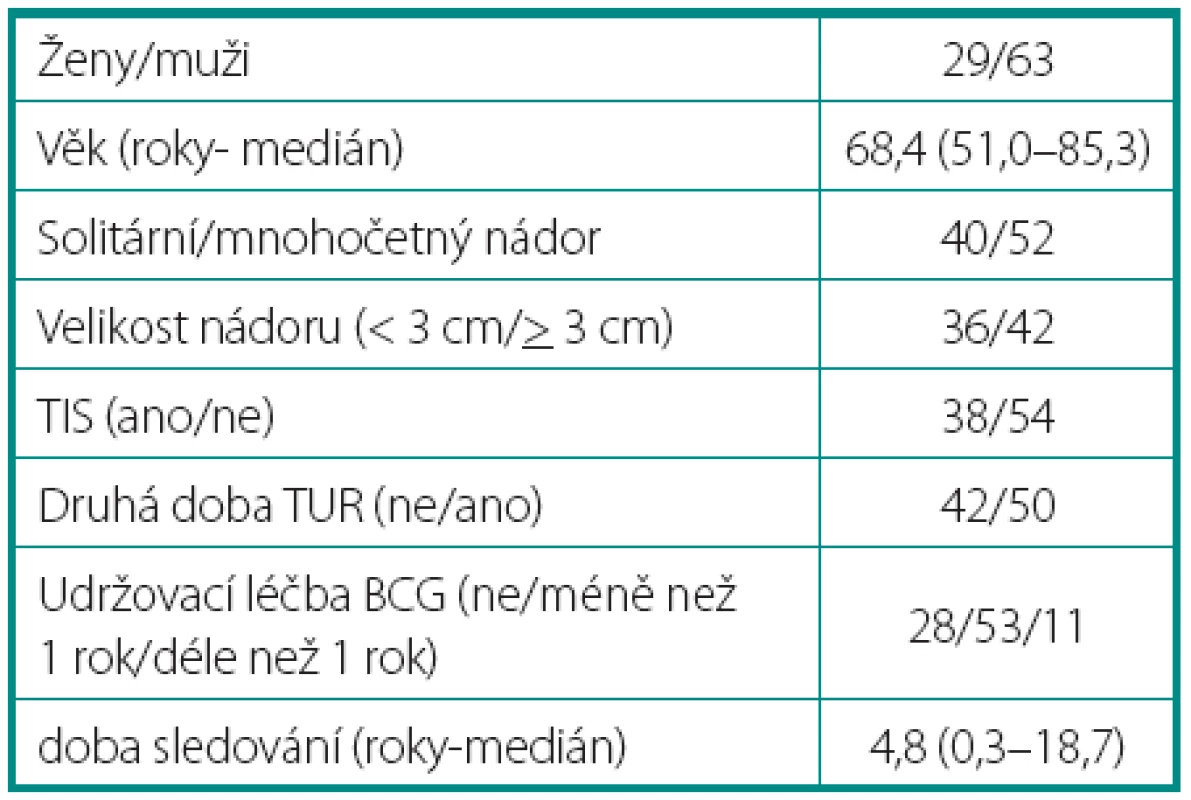
Obr. 1. Přežití bez recidivy v rámci celého souboru 92 pacientů Fig. 1. Recurrence free survival in the whole group of 92 patients 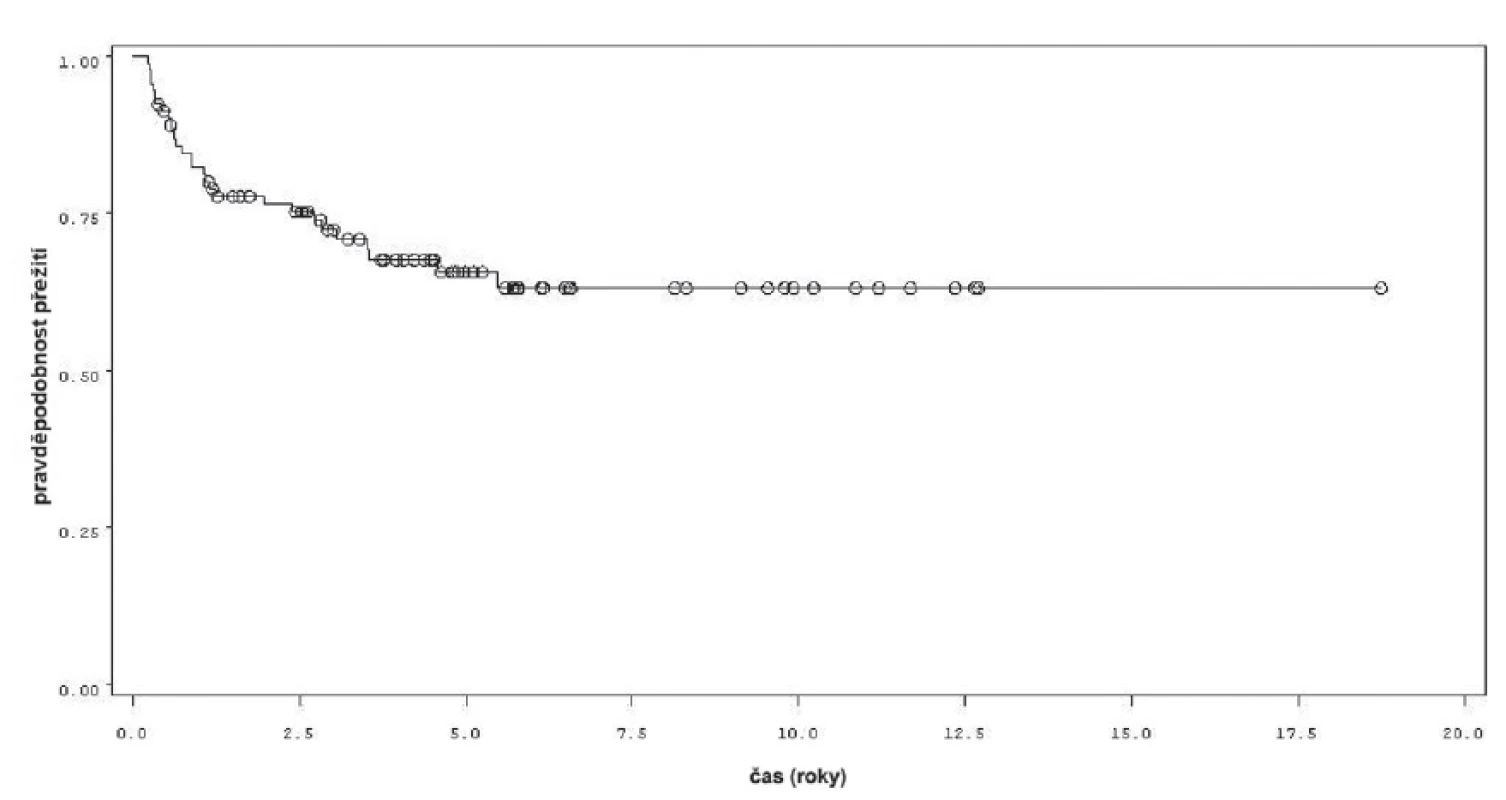
Obr. 2. Přežití bez recidivy nádoru u pacientů léčených pouze úvodním cyklem šesti instilací BCG (černá křivka) a u pacientů s následnou udržovací léčbou (červená křivka) Fig. 2. Recurrence free survival in patients treated with induction course BCG only (black line) and in patients treated with maintenance BCG (red line) 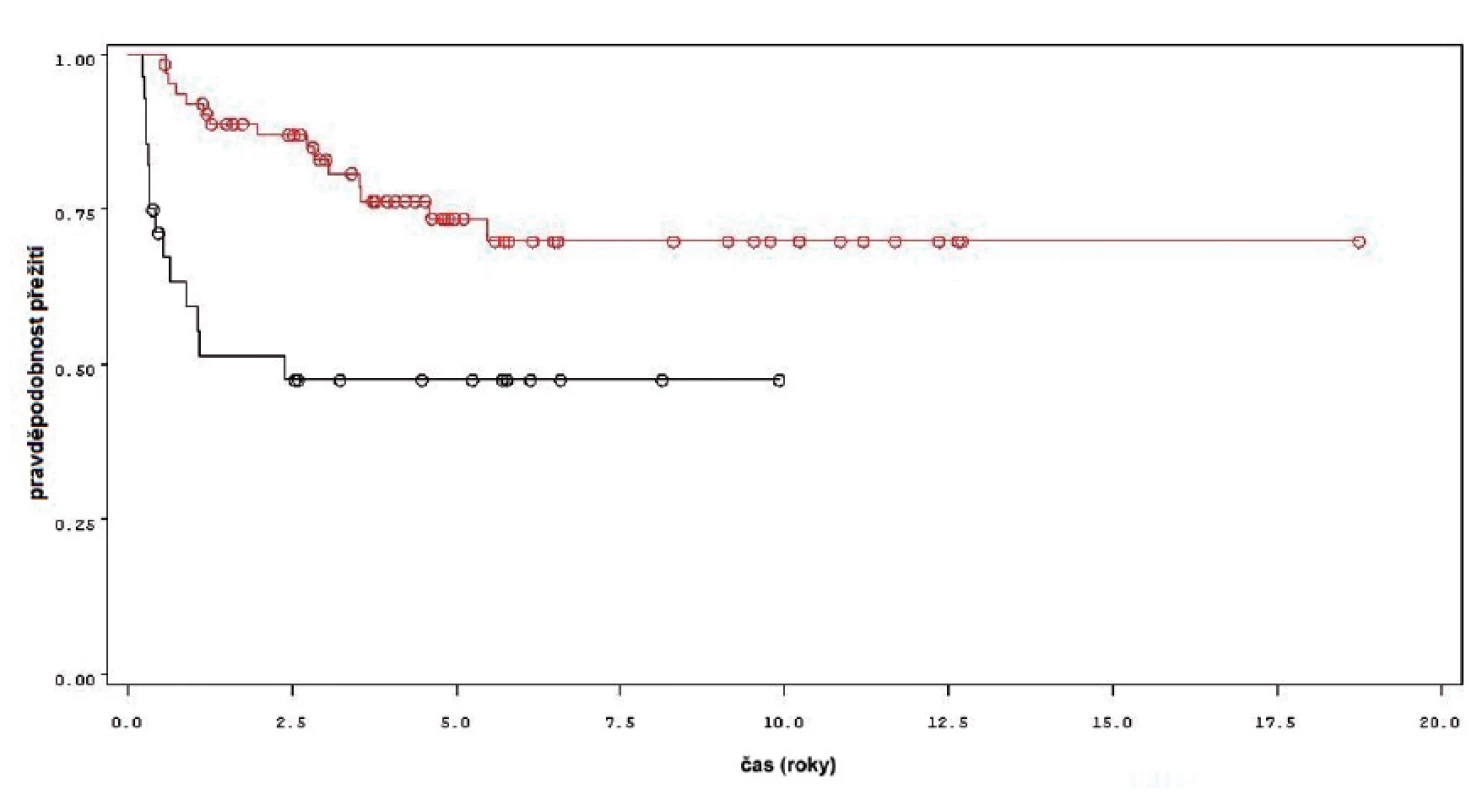
Obr. 3. Přežití bez recidivy nádoru u pacientů léčených pouze úvodním cyklem šesti instilací BCG (zelená křivka, 28 pacientů), u pacientů s udržovací léčbou kratší než 1 rok (černá křivka, 53 pacientů) a u pacientů s udržovací léčbou delší než jeden rok (červená křivka, 11 pacientů) Fig. 3. Recurrence free survival in patients treated with induction course BCG only (green line, 28 patients), in patients treated with maintenance BCG up to 1 year (black line, 53 patients) and in patients treated with maintenance BCG longer that 1 year (red line, 11 patients). 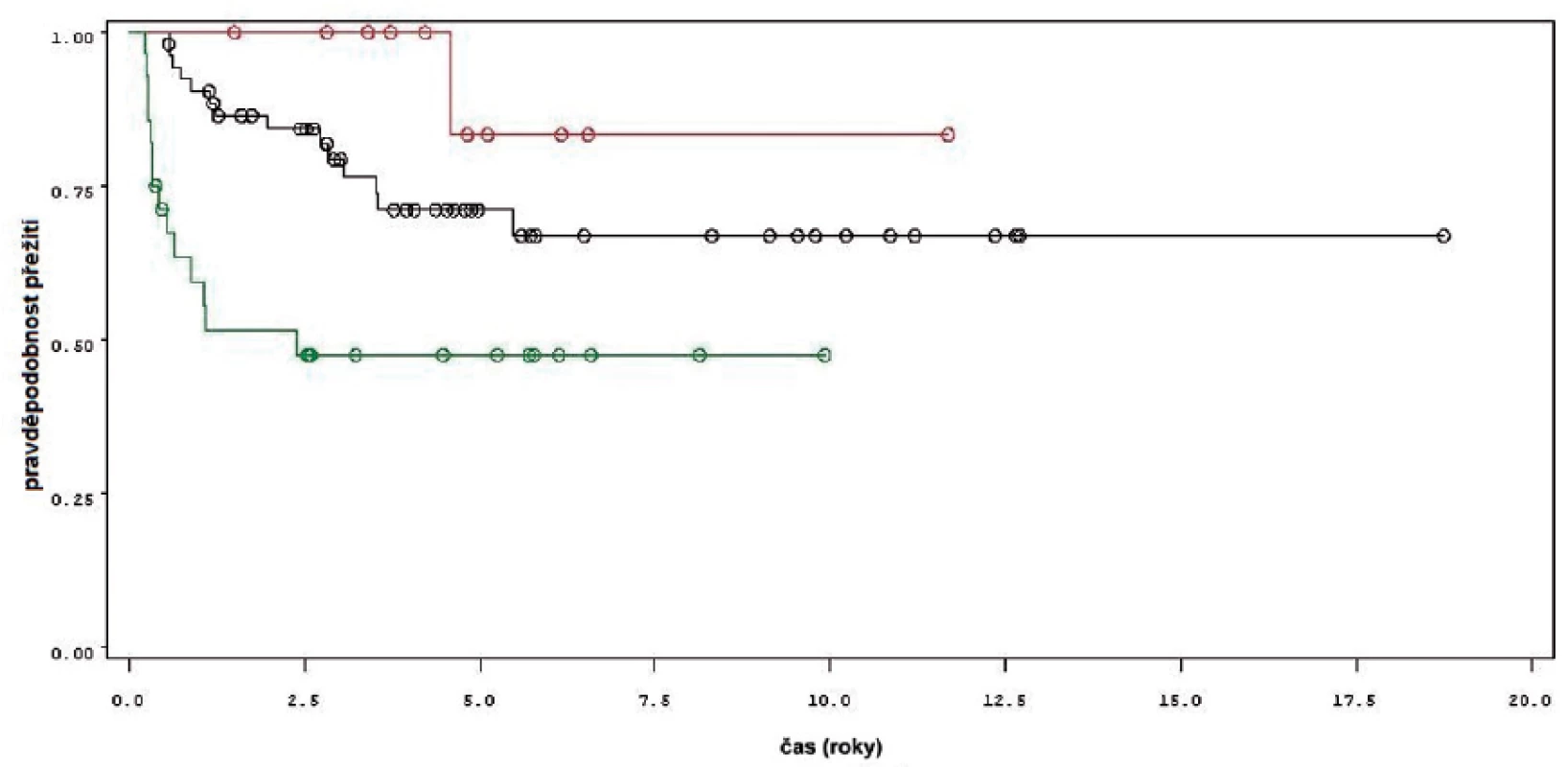
K progresi do invazivní formy nádoru došlo u 16 z 92 pacientů (obr. 4). Mezi přežitím bez progrese a sledovanými parametry mezi něž patřil počet nádorů (n =0,34), velikost nádorů (n = 0,54), počtem vykouřených cigaret během života (n = 0,98), či zda měl pacient primární či recidivující nádor (n = 0,82); nebyla prokázána statisticky významná souvislost. Souvislost s přítomností konkomitantního TIS byla patrná nicméně nedosahovala statistické významnosti (p = 0,09). Doba do progrese se významně lišila mezi skupinou pacientů léčených pouze úvodním cyklem intravesikální BCG a skupinou, která byla léčená navíc pokračující léčbou (p = 0,0226, Log-Rank test, p = 0,0071 Wilcoxon test) (obr. 5). Podle Coxova modelu měli pacienti léčeni pouze úvodním cyklem šesti instilací trojnásobně vyšší riziko progrese nádoru do invazivní formy (HR 2,968, 1,112–7,923). Rozdíl v době přežití do progrese mezi skupinou nemocných léčených jen úvodním cyklem šesti instilací, skupinou s udržovací léčbou v délce trvání do jednoho roku a udržovací léčbou delší než jeden rok byl statisticky signifikantní jen pro krátké sledování, do pěti let (p = 0,027 pro Wilcoxonův test, p = 0,685 pro Log-Rank test).
Obr. 4. Přežití bez progrese v rámci celého souboru 92 pacientů Fig. 4. Progression free survival in the whole group of 92 patients. 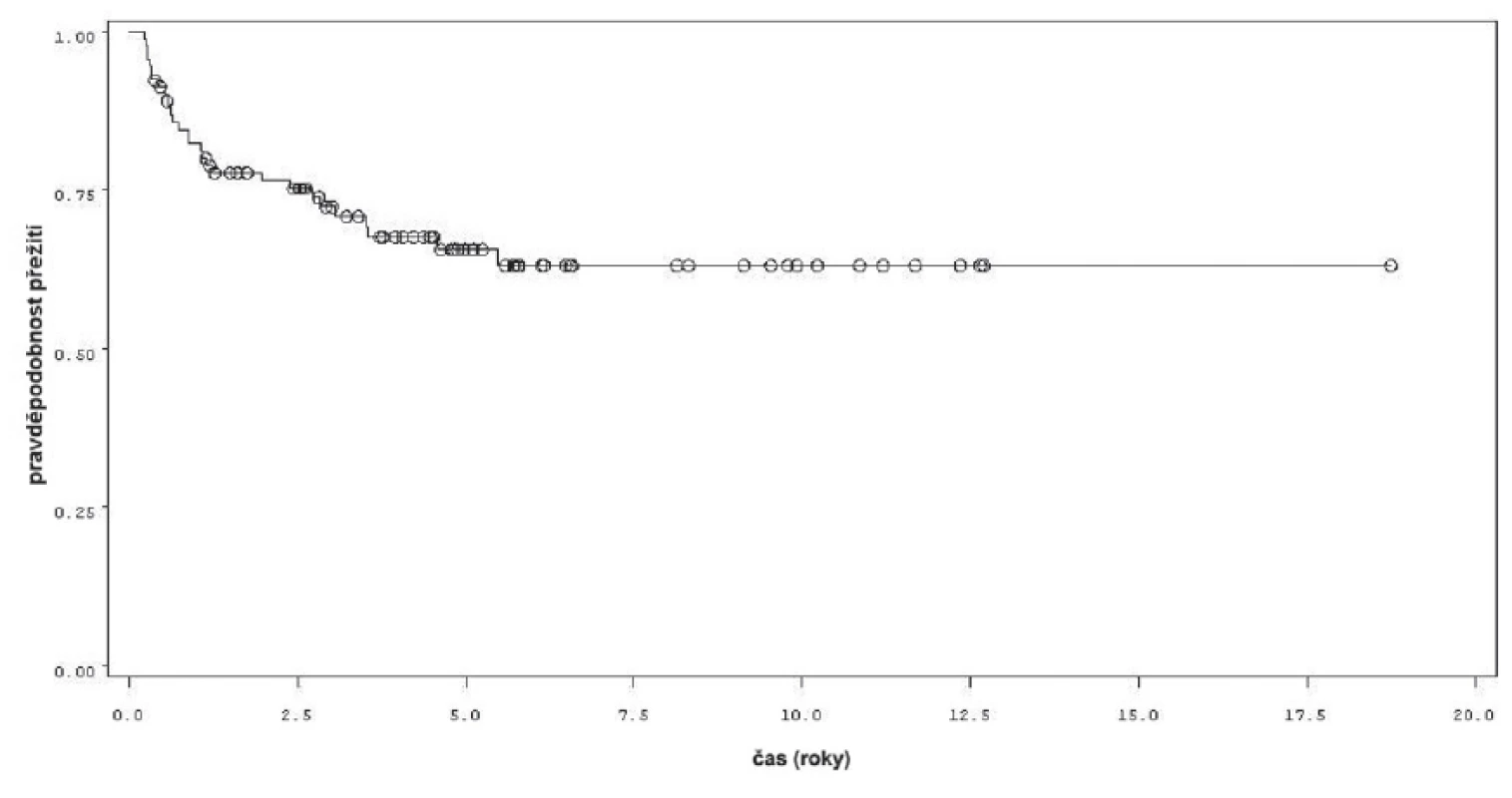
Obr. 5. Přežití bez progrese nádoru u pacientů léčených pouze úvodním cyklem šesti instilací BCG (černá křivka) a u pacientů s následnou udržovací léčbou (červená křivka) Fig. 5. Progression free survival in patients treated with induction course BCG only (black line) and in patients treated with maintenance BCG (red line). 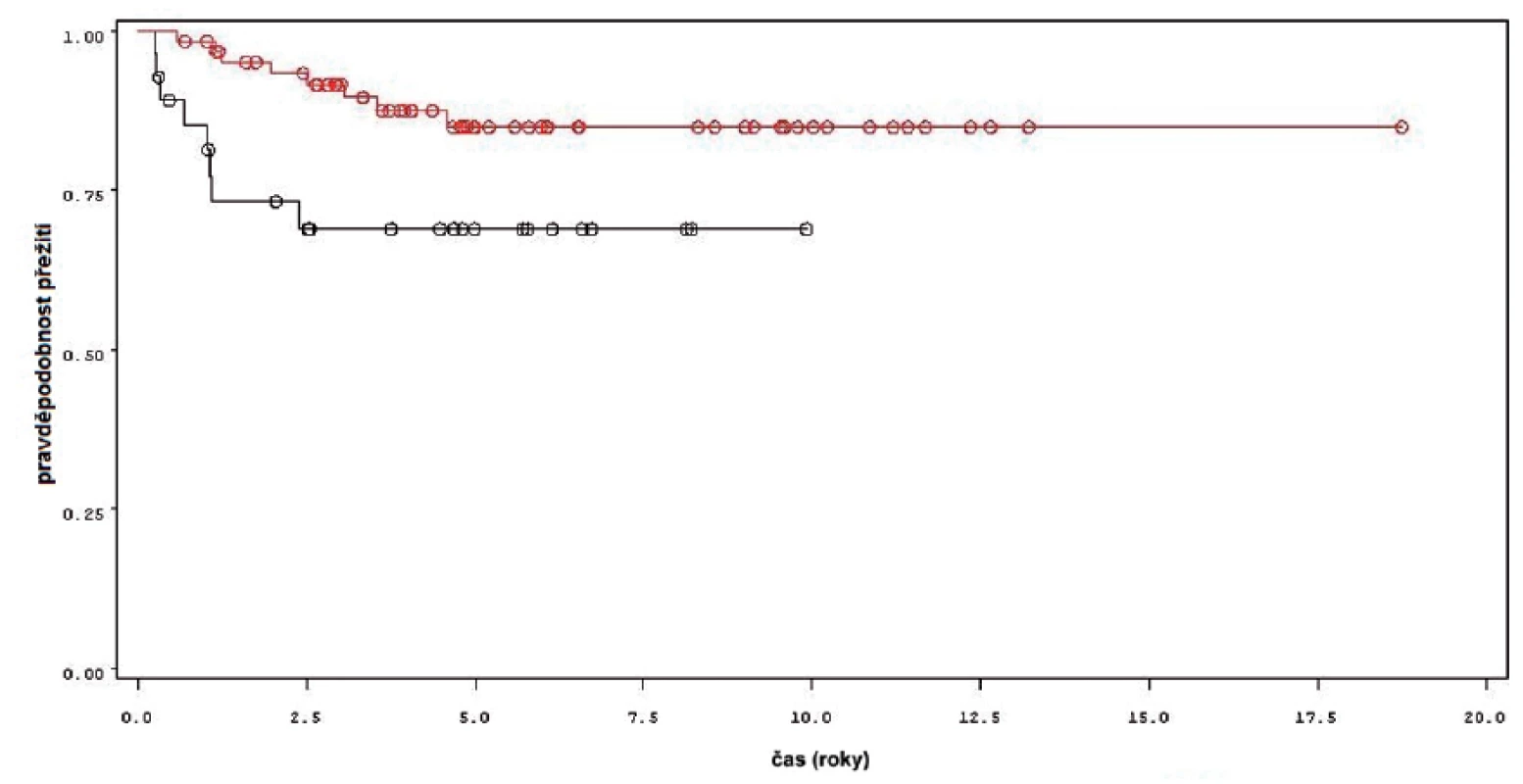
Během sledování osm pacientů z 92 sledovaných podstoupilo cystektomii, z toho ve dvou případech pro recidivu T1 tumoru a v šesti případech pro nález invazivního tumoru (T2 a více). Přežití bez cystektomie v rámci celého souboru je uvedeno na obrázku 6, rozdíl v přežití bez cystektomie mezi skupinou léčenou pouze úvodním cyklem a skupinou s udržovací léčbou byl statisticky významný (p = 0,0013 pro Wilcoxonův test, p = 0,0009 pro Log-Rank test) (obr. 7). Podle Coxova modelu měli pacienti léčeni pouze úvodním cyklem šesti instilací 8,8 vyšší riziko provedení cystektomie (HR 8,825, 1,777–43,844). Rozdíl v přežití bez cystektomie byl signifikantní při srovnání skupin pacientů léčených pouze úvodním cyklem instilací BCG, s pokračující léčbou kratší než 1 rok a delší než 1 rok (p = 0,0053 pro Wilcoxonův test, p = 0,0037 pro Log-Rank test).
Obr. 6. Přežití bez cystektomie Fig. 6. Cystectomy free survival 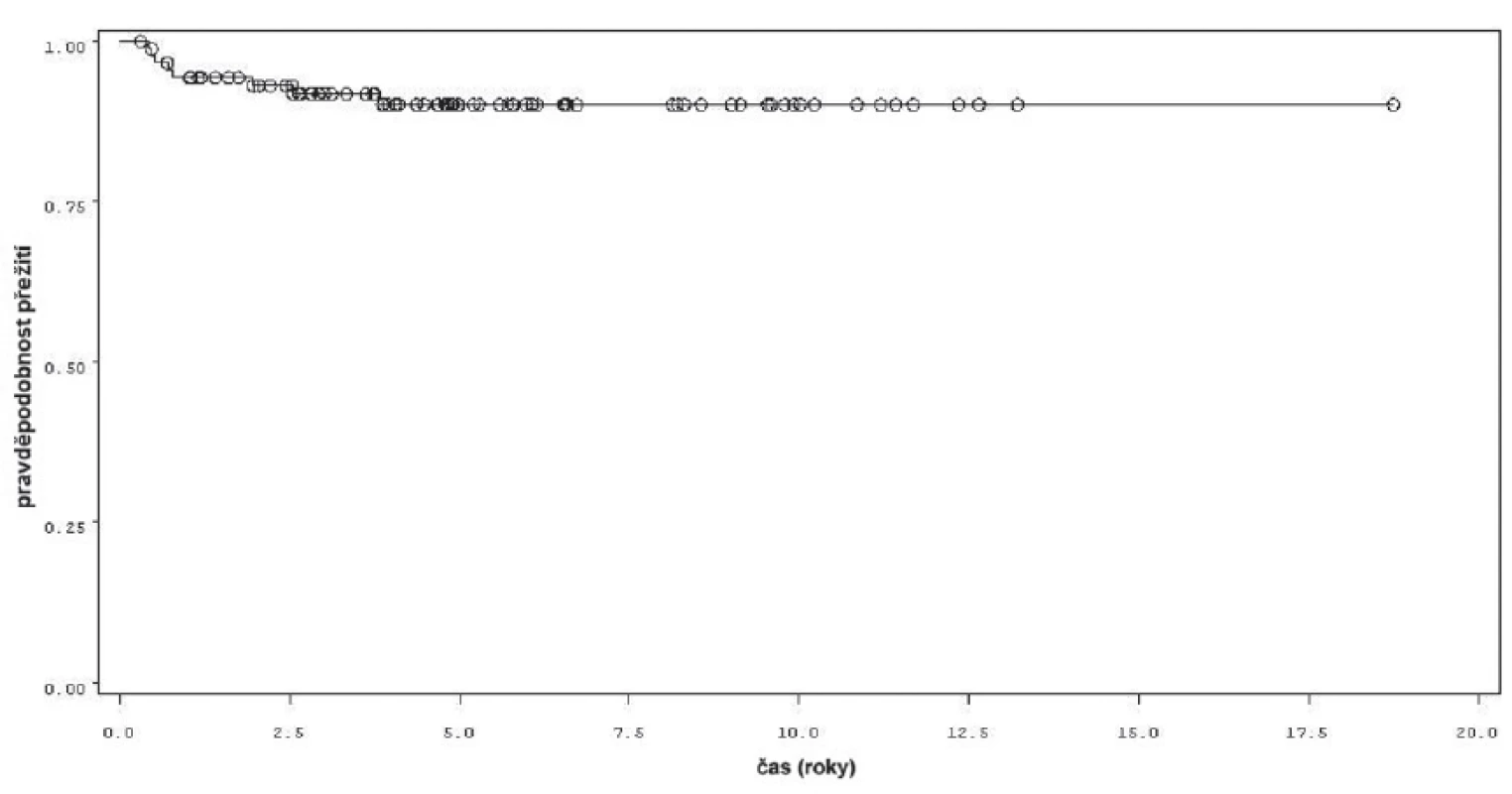
Obr. 7. Přežití bez cystektomie u pacientů léčených pouze úvodním cyklem šesti instilací BCG (černá křivka) a u pacientů s následnou udržovací léčbou (červená křivka) Fig. 7. Cystectomy free survival in patients treated with induction course BCG only (black line) and in patients treated with maintenance BCG (red line). 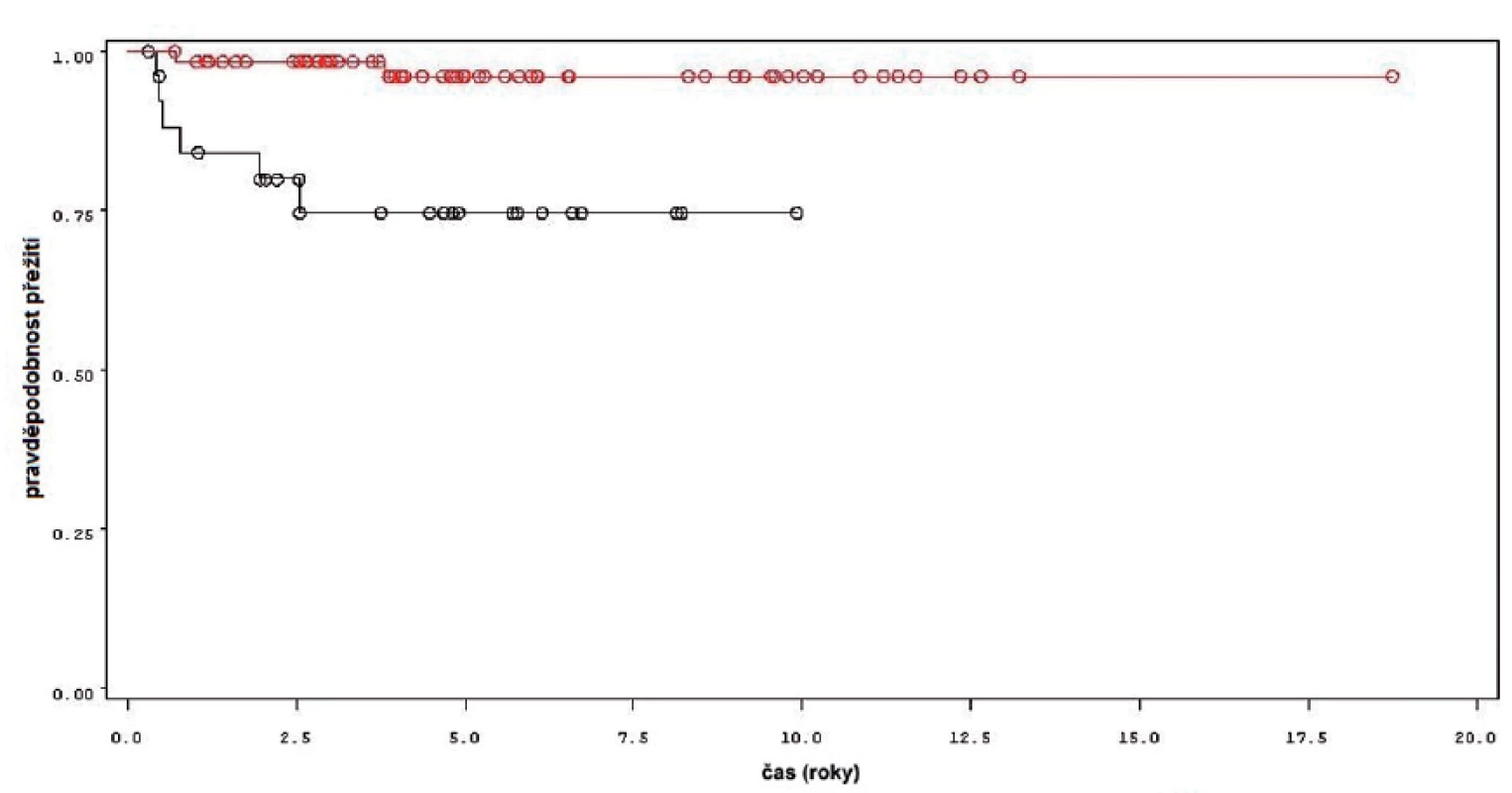
U nádorově specifického přežití pacientů byl opět zjištěn signifikantní rozdíl mezi skupinou pacientů léčených jen úvodním cyklem a pokračující léčbou instalacemi BCG (p = 0,0097 pro Wilcoxonův test, p = 0,0079 pro Log-Rank test) (obr. 8). Podle Coxova modelu měli pacienti léčeni pouze úvodním cyklem šesti instilací čtyřnásobné riziko úmrtí v důsledku progrese nádoru (HR 4,050, 1,284–12,775). Při podrobné analýze byl mezi skupinou nemocných léčených jen úvodním cyklem, udržovací léčbou v délce trvání do jednoho roku a udržovací léčbou delší než 1 rok rozdíl mezi jednotlivými skupinami statisticky významný (p = 0,0354 pro Wilcoxonův test, p = 0,0283 pro Log-Rank test).
Obr. 8. Pro nádor specifi cké přežití u pacientů léčených pouze úvodním cyklem šesti instilací BCG (černá křivka) a u pacientů s následnou udržovací léčbou (červená křivka) Fig. 8. Tumor free survival in patients treated with induction course BCG only (black line) and in patients treated with maintenance BCG (red line) 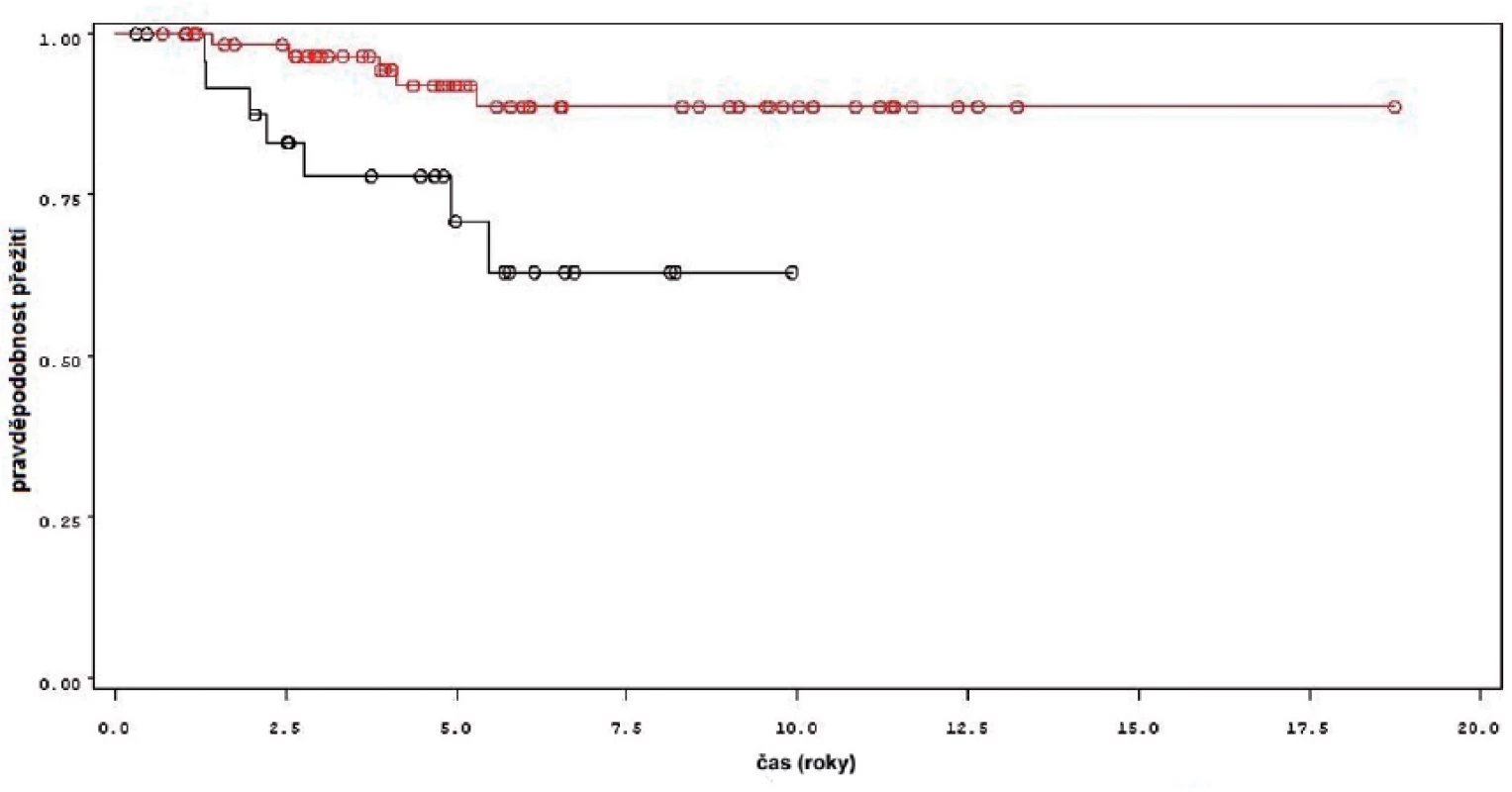
Obdobné výsledky byly získány i pro celkové přežití pacientů. Statisticky významný rozdíl byl mezi skupinou léčenou jen úvodním cyklem ve srovnání se skupinou s udržovací léčbou (p = 0,0013 pro Wilcoxonův test, p = 0,0013 pro Log-Rank test) (obr. 9). Během sledování měli pacienti léčení jen úvodním cyklem 3,9krát vyšší riziko úmrtí (HR 3,893, 1,599–9,475). I v rámci skupin pacientů léčených úvodním cyklem, udržovací léčbou kratší a delší než 1 rok byl rozdíl statisticky významný (p = 0,0055 pro Wilcoxonův test, p = 0,0056 pro Log-Rank test).
Obr. 9. Celkové přežití u pacientů léčených pouze úvodním cyklem šesti instilací BCG (černá křivka, n = 28) a u pacientů s následnou udržovací léčbou (červená křivka, n = 64) Fig. 9. Overall survival in patients treated with induction course BCG only (black line, n-28) and in patients treated with maintenance BCG (red line, n-64) 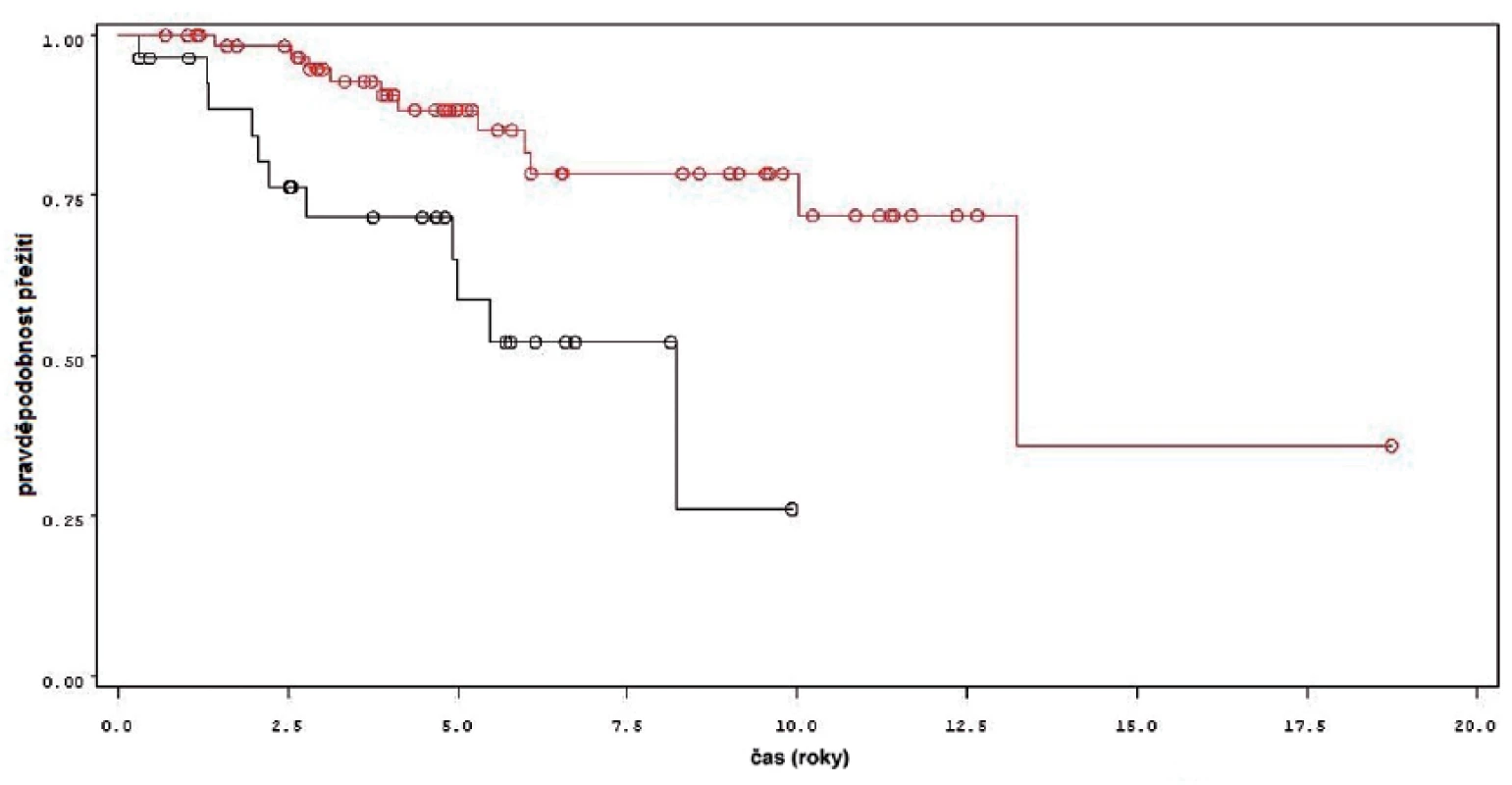
DISKUSE
Prostřednictvím několika metaanalýz bylo prokázáno, že léčba vakcínou BCG s udržovací fázi je ve srovnání se samotnou transuretrální resekcí či kombinací transuretrální resekce a adjuvantní intravesikální chemoterapie účinnější v prevenci recidiv NMIBC (7–9). Ačkoliv dvě metaanalýzy publikovaných prací srovnávajících BCG s léčbou mitomycinem C (MMC) či jinou intravesikální léčbou došly k závěru, že udržovací léčba vakcínou BCG dokáže zabránit či alespoň oddálit progresi nádoru (10, 11), tyto výsledky nebyly potvrzeny metaanalýzou individuálních dat pacientů srovnávající BCG a MMC (9).
V metaanalýze 24 studií s celkovým počtem 4863 pacientů došlo k progresi u 9,8 % léčených vakcínou BCG ve srovnání s progresí u 13,8 kontrol, což odpovídalo snížení relativního rizika progrese o 27 %. Doba sledování nicméně byla krátká - medián 2,5 roku a u pacientů s papilárními tumory byl počet progresí nízký (jen 6,4 %) (11). V metaanalýze Bohleho a Becka srovnávající účinnost instalační léčby MMC a BCG byl rozdíl v snížení rizika progrese u pacientů se středně a vysoce rizikovým NMIBC významný pokud byla aplikována i udržovací léčba vakcínou BCG. Hodnocení účinku vakcíny BCG separovaně pouze pro pacienty s vysoce rizikovým NMIBC nebylo provedeno pro nízký počet pacientů (10). V metaanalýze individuálních dat pacientů srovnávající účinek instilační léčby MMC a BCG byl zaznamenán významný rozdíl ve snížení rizika recidivy ve prospěch BCG, pokud byla podávána i v udržovacím režimu. V době do progrese a v rámci celkového přežití nebyl zjištěn signifikantní rozdíl. K progresi došlo jen u 12 % pacientů a subanalýza pro pacienty s vysokým rizikem nebyla pro to provedena (9). Problémem výše uvedených studií je krátká doba sledování pacientů. Aby bylo zřejmé, že léčba BCG vakcínou dokáže snížit riziko progrese nádoru do invazivní formy, je nutné provedení studií s délkou sledování 10–15 let a takové v současné době dostupné nejsou (1). Navíc, jak je zmíněno v úvodu, většina meta-analýz zahrnuje pacienty se středním rizikem progrese. Pro skupinu pacientů s T1G3 nádory močového měchýře ve vztahu k účinnosti konzervativní léčby vakcínou BCG je dostupných dat málo (12). Ve studii srovnávající účinek BCG vakcíny a epirubicinu v rámci 323 pacientů s vysoce rizikovým NMIBC a s mediánem sledování 9,4 let nebyla prokázána významně větší účinnost vakcíny BCG ve srovnání s chemoterapií ve vztahu k snížení rizika progrese (13).
V naší práci jsme se snažili zjistit, zda udržovací léčba vakcínou BCG zlepšit prognózu pacientů s T1G3 nádory močového měchýře - srovnávána byla skupina pacientů léčených pouze úvodním cyklem se skupinou léčenou i udržovací léčbou BCG. Význam udržovací léčby vakcínou BCG byl prokázán několika studiemi. V Lammově randomizované studii byl zaznamenán významný rozdíl v snížení rizika progrese (p = 0,04), nicméně studie čelí kritice pro metodologické nedostatky jako neurčitá definice progrese (jsou zahrnuti pacienti se zhoršením onemocnění), randomizace až po první cystoskopii ve 3 měsících a fakt, že nebyl uveden počet pacientů s invazivním nádorem a metastatickým onemocněním (14). V prospektivní studii se 111 pacienty s vysoce rizikovým NMIBC (32 % T1) byla prokázána významná souvislost mezi počtem udržovacích cyklů a přežitím bez recidivy nádoru. V době 12 měsíců po ukončení léčby bylo přežití bez recidivy 89 % u pacientů kteří dostali tři cykly, 67 % u těch, kteří dostali dva cykly a 41 % u pacientů, kterým byl podán jen jeden cyklus udržovací léčby (p 0,0003). Progresí v uvedeném souboru bylo jen devět ze 111 pacientů. Nedostatkem studie je, že pouze 77 % recidiv bylo potvrzeno histologicky (15). V naší práci jsme došli k obdobným výsledkům, prokázali jsme významnou souvislost mezi délkou udržovací léčby a přežitím bez recidivy a progrese nádoru, kdy významný rozdíl v prognóze byl mezi pacienty léčených jen úvodním cyklem, udržovací léčbou kratší a udržovací léčbou delší než 1 rok.
Na druhou stranu existují i práce, kde efekt udržovací léčby ve srovnání s indukční léčbou zaznamenán nebyl (16–-21). Skutečný význam udržovací léčby vakcínou BCG u vysoce rizikových NMIBC močového měchýře by měla určit multicentrická, randomizovaná, prospektivní studie.
V léčbě pacientů s T1G3 karcinomem močového měchýře existují dva koncepty, měchýř šetřící instilační léčba vakcínou BCG a radikální cystektomie. Konzervativní léčba je s určitou mírou zjednodušení úspěšná zhruba u jedné třetiny nemocných, třetina nemocných podstoupí odloženou cystektomii pro recidivu tumoru, u jedné třetiny dojde ke vzniku metastatického onemocnění (22).
Časná cystektomie pro T1G3 nádor vede k nádorově specifickému přežití 80–90 % (3). Výhodou je, že je účinným způsobem léčby i pro skupinu pacientů, kde je původní hloubka nádorové invaze podhodnocena; riziko podhodnocení u T1 nádorů je i v případě provedení druhé doby transuretrální resekce vyšší než 10 % (23). Další výhodou je současné provedení pánevní lymfadenektomie, riziko metastatického postižení pánevních uzlin je u pacientů s T1G3 nádory až 17 % (5). Časná cystektomie ve srovnání s odloženou cystektomií pro recidivu nádoru u pacientů léčených BCG vakcínou ve formě TIS, T1G3, či invazivního nádoru podle některých studií vede k významně lepšímu pro nádor specifickému přežití (4, 24). Obdobný výsledek byl ve studii srovnávající tříleté, pro nádor specifické přežití u pacientů s de novo T2 nádory a nádory progresí do stadia T2 ze svalovinu detruzoru neinfitrujícího nádoru, kdy rozdíl byl opět významný (67 % oproti 37 %) (25). Prospektivní randomizovaná studie srovnávající konzervativní léčbu vakcínou BCG s časnou cytektomií u T1G3 nádorů močového měchýře nebyla doposud provedena, nicméně platí, že častější indikace intravesikální léčby a prodloužení doby do radikální chirurgické léčby může mít souvislost s horším přežíváním u pacientů po cystektomii pro T1 tumory ve srovnání s dobou před érou léčby vakcínou BCG (26). Na druhou stranu nevýhodou cystektomie je peroperační mortalita, která se pohybuje i ve zkušených centrech mezi 2–3 %, významná morbidita výkonu, poruchy sexuálních funkcí a snížení kvality života v dalších aspektech v souvislosti s derivací moči.
Snahou do budoucna bude v rámci skupiny pacientů s T1G3 nádory najít takové prognostické faktory, které jednoznačně určí jedince s nepříznivým průběhem, u nichž by měla být provedena neodkladná cystektomie i za cenu zhoršení kvality života (3).
Pacienti refrakterní k léčbě vakcínou BCG či časnou recidivou do šesti měsíců od zahájení léčby by měli být indikováni k radikální cystektomii. U pacientů s iniciální kompletní odpovědí a pozdní recidivou je možné uvážit další indukční cyklus BCG vakcíny, nicméně studií zabývajících se účinností tohoto druhu léčby je málo. Ve studii s recidivou ve formě T1 tumoru byl zaznamenán významný rozdíl v riziku progrese nádoru mezi skupinou léčenou dalším úvodním cyklem vakcíny BCG a radikální cystektomií (27). Riziko progrese s každým dalším indukčním cyklem stoupá o 7 % (28). Pravděpodobnost účinku třetího cyklu je jen 6 % (29). Léčebné okno je v tomto případě malé, odkládání radikální cystektomie může mít pro pacienta závažné následky.
Naše práce, stejně jako většina výše uvedených studií, trpí nedostatky mezi které patří zejména její retrospektivní charakter, malý počet zařazených pacientů, malý počet pacientů s progresí tumoru, dlouhá doba, během níž byli pacienti do studie zařazováni. Během tohoto dlouhého období se pohled na léčbu pacientů s T1G3 tumory měnil. V současné době je druhá doba transuretrální resekce doporučována u všech pacientů s T1G3 nádory (2). V našem souboru byla provedena jen u 50 z 92 pacientů (54 %). Druhá doba TUR dokáže zlepšit prognózu tím, že sníží riziko podhodnocení hloubky nádorové invaze (a pacienti jsou včas radikálně léčeni) a dokáže odstranit případný reziduální nádor, a tím prodloužit beznádorové přežívání (30, 31). V našem souboru jsme však nezaznamenali významnou souvislost mezi provedením druhé doby TUR a přežitím bez recidivy (n = 0,66) či přežitím bez progrese (n = 0,14).
I přes výše uvedené nedostatky naše výsledky svědčí pro to, že konzervativní léčba vakcínou BCG u pacientů s T1G3 nádory má své místo a pokud je pacient tímto způsobem léčen, měla by po úvodním cyklu následovat i udržovací instilační léčba.
ZÁVĚR
Naše výsledky potvrzují, že intravesikální léčba vakcínou BCG představuje účinný způsob léčby pro T1G3 nádory močového měchýře s přijatelnou mírou zachování močového měchýře. Udržovací léčba vakcínou BCG dokáže snížit pravděpodobnost recidivy a progrese nádoru, zvýšit pravděpodobnost zachování močového měchýře a prodloužit celkové i beznádorové přežívání pacientů.
Došlo: 10. 9. 2012.
Přijato: 20. 11. 2012.
Kontaktní adresa
MUDr. Viktor Soukup, Ph.D.
Urologická klinika 1. LF UK a VFN
Ke Karlovu 6, 128 08 Praha 2
e-mail: viktor.soukup@lf1.cuni.cz
Střet zájmů: žádný.
Práce byla podpořena grantem TIP ČR FR-TI3/666 a IGA NT/12205-5.
Zdroje
1. Cookson MS, Herr HW, Zhang ZF, et al. The treated natural history of high risk superficial bladder cancer: 15-year outcome. J Urol 1997; 158(1): 62–67.
2. Babjuk M, Oosterlinck W, Sylvester R, et al. EAU Guidelines on non-muscle-invasive urothelial carcinoma of the bladder. Eur Urol 2011; 59 : 997–1008.
3. Kulkarni GS, Hakenberg OW, Gschwend JE, et al. An updated critical analysis of the treatment strategy for newly diagnosed high-grade T1 (previously T1G3) bladder cancer. Eur Urol. 2010; 57(1): 60–70.
4. Denzinger S, Fritsche HM, Otto W, et al. Early versus deferred cystectomy for initial high-risk pT1G3 urothelial carcinoma of the bladder: do risk factors define feasibility of bladder-sparing approach? Eur Urol 2008; 53(1): 146–152.
5. Fritsche HM, Burger M, Svatek RS, et al. Characteristics and outcomes of patients with clinical T1 grade 3 urothelial carcinoma treated with radical cystectomy: results from an international cohort. Eur Urol 2010; 57(2): 300–309.
6. Babjuk M. Intravezikální instilace BCG vakcíny v léčbě povrchových nádorů močového měchýře. Prak Lék 1997; 77 : 238–240.
7. Shelley MD, Kynaston H, Court J, et al. A systematic review of intravesical bacillus Calmette-Gue’ rin plus transurethral resection vs transurethral resection alone in Ta and T1 bladder cancer. BJU Int 2001; 88 : 209–216.
8. Bohle A, Jocham D, Bock PR. Intravesical bacillus Calmette-Gue’rin versus mitomycin C for superficial bladder cancer: a formal metaanalysis of comparative studies on recurrence and toxicity. J Urol 2003; 169 : 90–95.
9. Malmström P-U, Sylvester RJ, Crawford DE, et al. An individual patient data meta-analysis of the long-term outcome of randomised studies comparing intravesical mitomycin C versus bacillus Calmette-Gue’rin for non–muscle-invasive bladder cancer. Eur Urol 2009; 56 : 247–256.
10. Bohle A, Bock PR. Intravesical bacilli Calmette-Gue’rin versus mitomycin C in superficial bladder cancer: formal meta-analysis of comparative studies on tumor progression. Urology 2004; 63 : 682–686.
11. Sylvester RJ, van der Meijden AP, Lamm DL. Intravesical bacillus Calmette-Gue’ rin reduces the risk of progression in patients with superficial bladder cancer: a meta-analysis of the published results of randomized trials. J Urol 2002; 168 : 1964–1970.
12. Herr HW. Is maintenance Bacillus Calmette-Guérin really necessary? Eur Urol 2008; 54 : 971–973.
13. Sylvester RJ, Brausi MA, Kirkels WJ, et al. Long-term efficacy results of EORTC genito-urinary group randomized phase 3 study 30911 comparing intravesical instillations of epirubicin, bacillus Calmette-Guérin, and bacillus Calmette-Guérin plus isoniazid in patients with intermediate - and high-risk stage Ta T1 urothelial carcinoma of the bladder. Eur Urol 2010; 57(5): 766–773.
14. Lamm DL, Blumenstein BA, Crissman JD, et al. Maintenance bacillus Calmette-Guerin immunotherapy for recurrent TA, T1 and carcinoma in situ transitional cell carcinoma of the bladder: a randomized Southwest Oncology Group Study. J Urol 2000; 163 : 1124–1129.
15. Decobert M, LaRue H, Harel F, et al. Maintenance bacillus Calmette-Guerin in high-risk nonmuscleinvasive bladder cancer: how much is enough? Cancer 2008; 113 : 710–716.
16. Badalament RA, Herr HW, Wong GY, et al. A prospective randomized trial of maintenance versus nonmaintenance intravesical BCG therapy of superficial bladder cancer. J Clin Oncol 1987; 5 : 441–449.
17. Palou J, Laguna P, Millan-Rodriquez F, et al. Kontrol group and maintenance treatment with BCG for carcinoma in situ and/or high grade bladder tumors. J Urol 2001; 165 : 1488–1491.
18. Hudson MA, Ratliff TL, Gillen DP, et al. Single course versus maintenance BCG therapy for superficial bladder tumors: a prospective randomized trial. J Urol 1987; 138 : 295–298.
19. Tachibana M, Jitsukawa S, Iigaya T, et al. Komparative study on prophylactic intravesical instillation of BCG and adriamycin for superficial bladder cancers. Nippon Hinyokika Gakkai Zasshi 1989; 80 : 1459–1465.
20. Akaza H, Hinotsu S, Aso Y, et al. BCG treatment of existing papillary bladder cancer and carcinoma in situ of the bladder. Cancer 1995; 75 : 552–559.
21. Herr HW, Dalbagni G, Donat SM. Bacillus Calmette-Guérin without maintenance therapy for high-risk non-muscle-invasive bladder cancer. Eur Urol 2011; 60(1): 32–36.
22. Shahin O, Thalmann GN, Rentsch C, Mazzucchelli L, Studer UE. A retrospective analysis of 153 patients treated with or without intravesical bacillus Calmette-Guerin for primary stage T1 grade 3 bladder cancer: recurrence, progression and survival. J Urol 2003; 169 : 96–100.
23. Dalbagni G, Herr HW, Reuter VE. Impact of a second transurethral resection on the staging of T1 bladder cancer. Urology 2002; 60 : 822–824.
24. Herr HW, Sogani PC. Does early cystectomy improve the survival of patients with high risk superficial bladder tumors? J Urol 2001; 166 : 1296–1299.
25. Schrier BP, Hollander MP, van Rhijn BW, Kiemeney LA, Witjes JA. Prognosis of muscle-invasive bladder cancer: difference between primary and progressive tumours and implications for therapy. Eur Urol 2004; 45 : 292–296.
26. Lambert EH, Pierorazio PM, Olsson CA, et al. The increasing use of intravesical therapies for stage T1 bladder cancer coincides with decreasing survival after cystectomy. BJU Int 2007; 100 : 33–36.
27. Raj GV, Herr H, Serio AM, et al. Treatment paradigm shift may improve survival of patients with high risk superficial bladder cancer. J Urol 2007; 177 : 1283–1286.
28. Catalona WJ, Hudson MA, Gillen DP, Andriole GL, Ratliff TL. Risks and benefits of repeated courses of intravesical bacillus Calmette-Guerin therapy for superficial bladder cancer. J Urol 1987; 137 : 220–224.
29. Nieder AM, Brausi M, Lamm D, et al. Management of stage T1 tumors of the bladder: International Consensus Panel. Urology 2005; 66 : 108–125.
30. Dutta SC, Smith Jr JA, Shappell SB, et al. Clinical under staging of high risk nonmuscle invasive urothelial carcinoma treated with radical cystectomy. J Urol 2001; 166 : 490–493.
31. Divrik T, Yildirim U, Eroglu AS, Zorlu F, Ozen H. Is a sekond transurethral resection necessary for newly diagnosed pT1 bladder cancer? J Urol 2006; 175 : 1258–1261.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2012 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Zobrazení karcinomu prostaty metodami nukleární medicíny
- Využití molekulární genetiky v diferenciální diagnostice nádorů ledvin
- Srovnání laparoskopické a retropubické radikální prostatektomie – zkušenosti z jednoho centra
- Prognóza pacientů s T1G3 uroteliálním karcinomem močového měchýře léčených vakcínou BCG – retrospektivní analýza
- Využití extraanatomického stentu (EAS) u pacientů s pokročilým maligním onemocněním
- Liposarkom retroperitonea v lokalizaci dolního polu ledviny
- Myoglobinurie jako projev rabdomyolýzy po extrémní fyzické zátěži
- 12th Central European Meeting
- Ohlédnutí za 58. výroční konferencí ČUS v Ostravě
- Zpráva z kurzu endourologie v Amsterdamu
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Myoglobinurie jako projev rabdomyolýzy po extrémní fyzické zátěži
- Zobrazení karcinomu prostaty metodami nukleární medicíny
- Prognóza pacientů s T1G3 uroteliálním karcinomem močového měchýře léčených vakcínou BCG – retrospektivní analýza
- Liposarkom retroperitonea v lokalizaci dolního polu ledviny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



