-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ZMĚNY FOVEÁLNÍ AVASKULÁRNÍ ZÓNY A MAKULÁRNÍ MIKROVASKULATURY V RÁMCI VYŠETŘENÍ OCT ANGIOGRAFIE U MLADÝCH DIABETIKŮ 1. TYPU (PILOTNÍ STUDIE)
Autoři: L. Magera; J. Krásný; P. Pluhovský; L. Holubová
Působiště autorů: Oční klinika FN Královské Vinohrady, Praha
Vyšlo v časopise: Čes. a slov. Oftal., 76, 2020, No. 3, p. 111-117
Kategorie: Původní práce
doi: https://doi.org/10.31348/2020/19Souhrn
Cíl: Seznámit s vývojem změn foveální avaskulární zóny (FAZ) a vaskulatury sítnice v jejím okolí, a to v závislosti na době trvání diabetes mellitus 1. typu (T1DM).
Metodika: V rámci pravidelných kontrol mladých pacientů T1DM na Oční klinice FN Královské Vinohrady v Praze bylo v průběhu ledna až prosince 2019 provedeno vyšetření OCT angiografie pomocí přístroje Spectralis firmy Heidelberg Engineering. V posuzovaném souboru bylo 40 nemocných ve věku 18 až 30 let, medián 21 let. T1DM byl u nich diagnostikován v dětství a trval déle než 10 let. Současně byla vytvořena kontrolní skupina 40 jedinců obdobného věkového složení bez metabolického a jiného celkového onemocnění, při normální zrakové ostrosti a fyziologickém nálezu na očním pozadí. V obou skupinách byla měřena velikost FAZ, také byl posuzován její tvar, dále byl hodnocen pokles hustoty a změna charakteru vaskulatury sítnice.
Výsledky: V kontrolní skupině byla plocha FAZ v rozmezí 0,06 až 0,4 mm², v průměru 0,253 ± 0,092 mm² a medián 0,27 mm². Nebyla zastižena zásadní změna jejího okrouhlého tvaru a okolní kapilární síť byla pravidelná a přiměřeně hustá. U pacientů s T1DM byla plocha FAZ v širším rozmezí (zmenšení plochy či naopak její nárůst) a to v rozmezí 0,05 až 0,64 mm², v průměru 0,300 ± 0,132 mm² a medián 0,31 mm². Rozdíl plošného hodnocení FAZ mezi oběma vyšetřovanými skupinami byl statisticky významný (p = 0,009). Diabetická preretinopatie (DpR) byla definovaná nepravidelností kapilární hustoty až k projevům neperfuze, v 61 % při změně velikosti FAZ. U diabetické retinopatie (DR) byla vždy přítomná nepravidelnost tvaru FAZ s jejím zvětšením, dále projevy kapilární neperfuze nebo dilatace kapilár a ojedinělá mikroaneurysmata.
Závěr: Změny velikosti FAZ odpovídaly stadiu projevů T1DM na očním pozadí v závislosti na době trvání. Počátečný nárůst kapilár ve fovee, který způsobil snížení plochy FAZ, byl následován postupným úbytkem kapilár a zvětšováním FAZ, což odpovídalo projevům DpR. Periferněji byla pozorována změna kapilární hustoty, někdy až charakteru ložisek neperfuze. Naopak zvětšení plochy FAZ a její nepravidelnost, vždy přítomná ložiska neperfuze v kapilární síti makuly a mikroaneurysmata, již odpovídaly rozvoji DR.
Klíčová slova:
diabetická retinopatie – diabetická preretinopatie – FAZ – OCT-A – T1DM
Úvod
Angiografie prostřednictvím optické koherenční tomografie (OCT-A) představuje neinvazivní metodu sloužící ke znázornění cévního systému sítnice a cévnatky. OCT-A je postavena na principu snímání pohybových rozdílů v jinak statickém terénu sítnice. Principem vyšetření je opakované snímání zvoleného regionu sítnice a cévnatky a vzájemného porovnávání získaných snímků. Jediné rozdíly jsou podmíněné proměnlivou reflektivitou na membránách proudících krevních elementů – červených krvinek. Tyto rozdíly jsou softwarově zpracovány do obrazu cévní kresby. Výhodou metody je, že jednotlivé vrstvy sítnice i cévnatky lze opticky separovat a tím zobrazit různé segmenty vaskulární sítě. Superficiální vaskulární segment sítnice znázorňuje větší a střední arteriální i venózní cévní kmeny a zároveň kapiláry ve vrstvě gangliových buněk. Hluboký vaskulární segment sítnice znázorňuje kapilární kresbu na úrovni vnitřní nukleární vrstvy. Promítají se sem artefakty cévních kmenů ze superficiálních vrstev. Jinak se kapilární síť charakterem kresby a tortuozitou výrazně liší od povrchové. Zásadní je posouzení foveální avaskulární zóny (FAZ), za fyziologických poměrů ostře ohraničené od foveální arkády kapilár. V avaskulárním segmentu zdravého oka se nedetekuje žádná reflektivita odpovídající pohybu krevních elementů. Segment choriokapilaris je OCT-A zobrazen jako hustá síť střídajících se hyper a hyporeflexních bodů, bez odhalení lineárního průběhu cév. Segment chorioidey se projevuje hrubou difúzní kresbou cévních kmenů [1]. OCT-A lze uplatnit při posuzování některých diagnóz, mezi které patří především VPMD (věkem podmíněná makulární degenerace), a to u suché i vlhké formy, dále RVO (venózní okluze) a také u diabetické retinopatie a makulopatie [1]. Rozhodli jsme se zařadit metodu OCT-A k posouzení postupného vývoje patofyziologických změn diabetického oka. Jedná se o další diagnostický postup navazující již na používané funkční vyšetření pomocí kontrastní citlivosti (CS) spolu s hodnocením strukturálních změn sítnice pomocí spektrální optické koherenční tomografie (SD-OCT).
Metodika
Z pravidelně a dlouhodobě (tzn. přes deset let) sledovaných mladých pacientů T1DM na Oftalmologické klinice Fakultní nemocnice Královské Vinohrady v Praze, kteří absolvovali vyšetření v období od ledna do prosince 2019, jsme vytvořili soubor 40 pacientů, z toho bylo 20 žen a 20 mužů, ve věku 18 až 30 let (průměr 22 ± 3,5 let, medián 21 let). Onemocnění T1DM vzniklo v dětství, převážně v předškolním věku (v průměru od 5 let), s dobou trvání T1DM 11 až 25 let (průměr 16,6 ± 3,7 let, medián 15,5 let). Metabolické parametry a kompenzace diabetu nebyly ve studii posuzovány. Kontrolní soubor byl složen z 20 mužů a 20 žen od 18 do 29 let (průměr 23,8 ± 3,2 let, medián 24 let). Jednalo se o 40 zdravých jedinců, tzn. bez jakéhokoliv metabolického, či jiného celkového onemocnění. Z očních diagnóz mohly být přítomné refrakční vady nebo strabismy s podmínkou zrakové ostrosti (ZO) 4/4 na ETDRS optotypech, či lepší, a to naturálně nebo s korekcí. Na očním pozadí byl vždy detekován zcela fyziologický nález.
V rámci sledování T1DM pacientů bylo vždy provedeno komplexní oftalmologické vyšetření obou očí. Zraková ostrost byla měřena na ETDRS optotypu ze 4 metrů, dále následovalo vyšetření předního segmentu oka na štěrbinové lampě a vyšetření zadního segmentu oka nepřímou oftalmoskopií v cykloplegii, k posouzení případných diabetických změn na očním pozadí (konkrétně přítomnost tvrdých exsudátů, mikroaneurysmat, či dalších cévních abnormalit nebo hemoragií). Současně bylo u všech pacientů provedeno SD-OCT a CS. Obě tyto metody byly zařazeny z hlediska dlouhodobého sledování a nebyly obsahem celkového hodnocení. Základní a hlavní vyšetřovací metodou studie představovalo zobrazení mikrovaskulatury sítnice pomocí OCT-A na přístroji Spectralis firmy Heidelberg Engineering. K měření jsme použili vlastní specifické nastavení, kdy přístroj provedl v režimu vysokého rozlišení 7 snímku ve stejném řezu sítnice. Tímto způsobem jsme zobrazili plochu 15 x 15 stupňů, což odpovídá přibližně 4,4 x 4,4 mm výřezu sítnice a cévnatky. Segmentace vrstev sítnice proběhla automaticky. Z důvodu nejdokonalejšího a nejkontrastnějšího zobrazení FAZ jsme vybrali složený obraz ze všech vaskulárních komplexů sítnice, tedy superficiálního vaskulárního komplexu (SVC), intermediálního kapilárního plexu (ICP) a hlubokého kapilárního plexu (DCP). Použitím vestavěné funkce „Draw Region“ bylo možné manuálně vyznačit oblast FAZ a spočítat její plochu. Měření plochy FAZ bylo vždy provedeno jedním specialistou. Statistické zpracování měření bylo provedeno pomocí T-testu. K hodnocení dalších vaskulárních změn bylo pak použito zobrazení zvlášť povrchového (SVC) nebo hlubokého (DVC) vaskulárního komplexu. Posouzení choriokapilaris a chorioidey nebylo náplní studie.
Výsledky
U všech nemocných ze souboru T1DM byly hodnoty ZO na úrovni 4/4 ETDRS a lepší, naturálně nebo s korekcí. Na očním pozadí jsme vždy detekovali změny kresby makulární krajiny ve smyslu roztříštění až vymizení foveolárního reflexu a nepravidelnosti průběhu a kalibru kapilár s nárůstem jejich tortuosity. Tento nález jsme označili jako diabetická preretinopatie (DpR). Celkově jsme na 16 očích (20 %) navíc zastihli i ojedinělé mikroaneurysmata (MA) či hemoragie (HE) a občasně zde byly přítomné i tvrdé exsudáty (TE). V těchto případech se již jednalo o počínající neproliferativní diabetickou retinopatii (NPDR). Změny DpR převažovaly v 80 % nad NPDR.
Hlavním srovnávaným parametrem byla plocha FAZ. V kontrolní skupině byla průměrná hodnota FAZ 0,253 ± 0,092 mm² (medián 0,27 mm², rozptyl 0,06 až 0,4 mm²). Průměrná hodnota diabetických očí byla vyšší, a to 0,300 ± 0,132 mm² (medián 0,31 mm², rozptyl 0,05 až 0,64 mm²). Rozdíl velikosti plochy FAZ mezi diabetiky a kontrolní skupinou, který vyjadřuje krabicový graf (Graf 1), byl statisticky signifikantní (p = 0,009).
Graf 1. Rozdíl velikosti plochy foveální avaskulární zóny (FAZ) mezi zdravou populací a diabetiky 1. typu (T1DM) 
V kontrolním souboru jsme pozorovali nevýznamný mírný nárůst velikosti FAZ s věkem (Graf 2). Ve srovnání s kontrolní skupinou byly u diabetiků naměřené hodnoty více rozptýlené kolem průměru a v závislosti na době trvání diabetu se úměrně zvětšovala plocha FAZ (Graf 3).
Graf 2. Hodnocení plochy foveální avaskulární zóny (FAZ) u zdravé populace z hlediska věku 
Graf 3. Hodnocení plochy foveální avaskulární zóny (FAZ) u diabetiků 1. typu (T1DM) z hlediska jejího trvání 
Vyšetření kontrolní skupiny potvrdilo, že obraz OCT-A se vyznačoval v SVC vykreslenými arteriálními i venózními kmeny a kapilární kresbou s vysokou mírou reflektivity. Vlastní FAZ byla pravidelně okrouhlá (Obrázek 1a). DVC se vyznačoval hustší kapilární sítí bez návaznosti na cévní kmeny, FAZ byla také okrouhlá, ohraničena foveální arkádou kapilár (Obrázek 1b). Na složeném obraze tří vaskulárních segmentů (SVC, ICP, DCP) lze vidět ostře ohraničenou a okrouhlou FAZ (Obrázek 1c).
Obr. 1. OCT-A vyšetření zdravé 24leté ženy
A. Povrchový vaskulární komplex (SVC) s pravidelnou kapilární sítí
B. Hluboký vaskulární komplex (DVC) s hustou kapilární sítí a pravidelnou foveální avaskulární zónou (FAZ)
C. Pravidelná, ohraničená a okrouhlá FAZ (vyznačená modře) velikosti 0,28 mm²
Výsledek OCT-A u DpR měl dvojí podobu. Zpočátku byla FAZ užší (v rozmezí 0,05 až 0,26 mm²), doprovázena nepravidelností kapilární sítě v parafoveální zóně v SVC s jinak pravidelnou širší kapilární síti, ale možnost neperfuze nebyla vždy vyloučena (Obrázek 2a). V husté kapilární síti v DVC byla patrná lokální nepravidelnost kresby (Obrázek 2b).
Obr. 2. OCT-A vyšetření 20letého diabetika (13 let trvání diabetu) s diabetickou preretinopatií (DpR)
A. Povrchový vaskulární komplex s nepravidelností parafoveálních kapilár se zónami neperfuze (šipka)
B. V hlubokém vaskulárním komplexu je hustá kapilární síť vcelku pravidelná, ale místy se nález vyznačuje prořídnutím (šipky), plocha foveální avaskulární zóny je užší - 0,16 mm²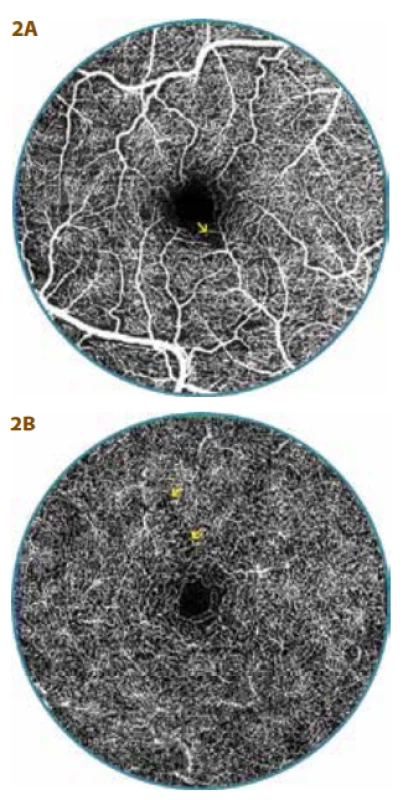
Druhý obraz OCT-A u DpR s širší FAZ (od 0,19 mm² až 0,47 mm²) představoval v SVC již mnohočetné menší zóny neperfuze a ojedinělý přesah kapilárně cévních kmenů do FAZ (Obrázek 3a). DVC měl kapilární síť ještě vcelku pravidelnou, ale v celé parafoveální oblasti byla řídká (Obrázek 3b). Celkově jsme ložiska neperfuze zaznamenali u 38 očí (59 %) s DpR v SVC.
Obr. 3. OCT-A vyšetření 20leté diabetičky (16 let trvání diabetu) s diabetickou preretinopatií (DpR)
A. V povrchovém vaskulárním komplexu jsou patrné mnohočetné menší zóny neperfuze (šipky), náznak přesahu cévně kapilárních svazků do foveální avaskulární zóny (FAZ)
B. V hlubokém vaskulárním komplexu je kapilární síť pravidelná, ale lehce řidší kolem FAZ (šipky), FAZ plocha je širší - 0,37 mm²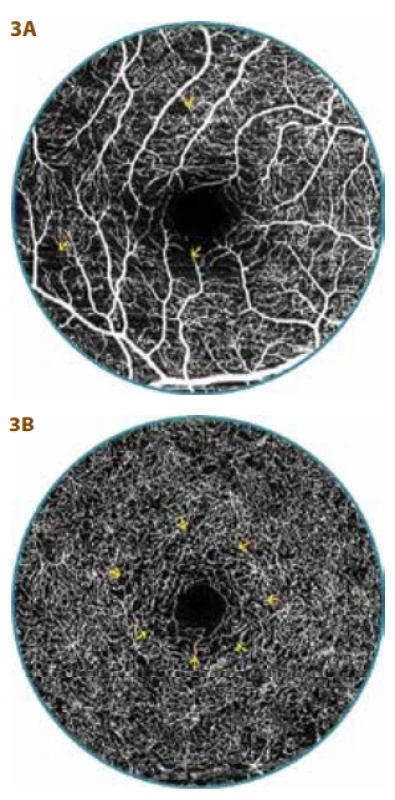
U všech pacientů s NPDR byly již závažné změny, FAZ byla rozšířená (od 0,34 mm² až 0,64 mm²) a nepravidelného tvaru. V SVC i DVC byly vždy mnohočetné zóny neperfuze. V SVC zasahovaly cévně kapilární kmeny hlouběji do FAZ, navíc byly přítomné MA (Obrázek 4a) a v DVC se kromě výrazného prořídnutí objevily i ložiska dilatované kapilární sítě (Obrázek 4b).
Obr. 4. OCT-A vyšetření 29letého diabetika (26 let trvání diabetu) s mírnou neproliferativní diabetickou retinopatií (NPDR)
A. Foveální avaskulární zóna (FAZ) je značně rozšířená a nepravidelná, povrchový vaskulární komplex s mnohočetnými zónami neperfuze, mikroaneurysmaty (v kroužku) a výrazným přesahem cévně kapilárních svazků do FAZ
B. Plocha FAZ - 0,58 mm², hluboký vaskulární komplex s četnými zónami neperfuze a prořídnutí kapilární sítě s ložisky její dilatace (šipky)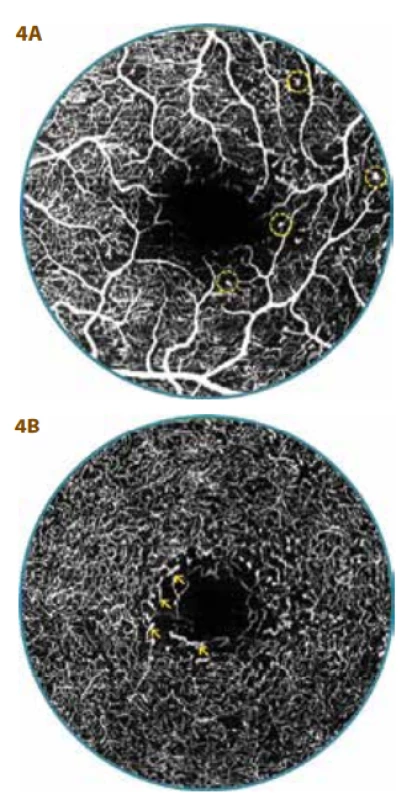
Nárůst plochy FAZ, který byl dán dobou trvání T1DM spolu s progredujícími změnami ve smyslu neperfuze byl ve shodě s přechodem DpR do NPDR. Pro rozdílný počet nemocných v obou skupinách očních projevů T1DM nebylo možné statisticky srovnat dobu trvání. Přesto i zde byl patrný rozdíl, u DpR se pohybovala doba trvání T1DM mezi 11 až 21 lety s průměrem 15,3 roku, zatímco u NPDR to bylo mezi 16 až 25 lety s průměrem 21,3 roku. Zatímco u DpR ve věkovém rozmezí převažoval spíš nižší věk, tak naopak u DR převažoval vyšší věk v příslušném rozmezí.
Diskuse
Skupina vyšetřených v této pilotní studii byla vytvořena na základě stejného vzorce jako u dvou našich předchozích studií na téma CS [2] a SD-OCT vyšetření [3] u počínajících očních změn u T1DM. Hranicí pro vyšetření v této studii bylo 30 let věku sledovaných, což bylo i náplní práce o CS výzkumného projektu IGA NR/7952 -3 [2]. Pro sledování jsme zařadili počátek T1DM v průměru do 5 let věku jako v předchozí pilotní studii vztahu SD-OCT a CS [3] z důvodu budoucí možnosti porovnání vývoje očích změn u T1DM. Doba sledování nad 10 let trvání T1DM byla také stanovena v předchozích dvou studiích [2,3], neboť se odhalili počínající funkčně strukturální změny v očním nálezu ještě před vznikem vlastní NPDR. Ta je již jasně definovaná svými příznaky, mezi které patří MA, hemoragie, flebopatie, intraretinální abnormality a vatovitá ložiska a dělí se na několik stupňů [4,5]. Přesto mezi tímto stavem a fyziologickým nálezem leží určitý mezistupeň.
Objasňování patogeneze a patofyziologie DR je spojeno s Cunha-Vazovým objevem fluorofotometrie na konci 70. let minulého století [6,7]. Metoda umožnila popsat zhroucení hematookulární bariéry, vedla k zavedení termínu preretinopatie [5]. I českoslovenští autoři popisují preretinopatii ve spojení s fluorescenčními cévními změnami: dilatací a segmentální okluzi kapilár [8] a při přímé chromatooftalmoskopii zeleným světlem zjistitelné cévní atypie: nepravidelnost kapilár a jejich dilataci, kterou označili jako suspektní nález DR [9]. Další známky jako mikroangiopatické abnormality [10] a funkční mikroangiopatie a kapilaropatie patří do těchto změn preretinopatie [11]. Obdobu těchto nálezů jsme rovněž zaznamenali v obrazu makulárních změn při poklesu CS při fyziologických hodnotách ZO [2]. Studie EURODIAB se problematikou DpR nezabývá a ani podrobný rozbor diagnosticko-léčebného řešení komplikací diabetu ji neuvádí [4].
Doporučené postupy pro DR v roce 2016 zahrnovaly základní čtyři diagnostické postupy: vyšetření na štěrbinové lampě, stereoskopickou fotografii či digitální stereofotografii, FAG a OCT na principu nízkokoherenční interferometrie. Tehdy se ještě o zařazení OCT-A neuvažovalo [4]. V současnosti je známo, že tato metoda určitým způsobem a v určitých indikacích může pro svoji neinvazivnost nahradit FAG, neboť umožňuje libovolný počet opakovaných vyšetření, což nelze tak často indikovat u FAG [1]. Velikost FAZ naměřená FAG a OCT-A je srovnatelná [12]. Opakovatelnost a přesnost jednotlivých OCT-A měření je také srovnatelná, nezáleží ani na použitém přístroji [13] či na zvoleném protokolu (6 x 6 nebo 3 x 3 mm) [14,15] nebo na tom, jestli se měření provedlo manuálně nebo automaticky [16,17].
V naši studii jsme analyzovali výsledky OCT-A při vyšetření 40 pacientů s T1DM konkrétního věkového složení (18 až 30 let) s minimální dobou trvání diabetu 10 let.
V našem souboru převažovaly nálezy DpR nad mírnou formou NPDR. Proti kontrolní skupině byla plocha FAZ u T1DM v průměru větší, její naměřené hodnoty byly víc rozptýlené a zvětšovaly se úměrně době trvání diabetu. Některé studie ukazují, že i u zdravých mladých lidí je FAZ signifikantně rozmanitá z pohledu rasy [18], věku a pohlaví [19] nebo přítomnosti myopické vady u dětí [20]. Vliv může mít i anatomická hloubka foveoly, která je u pacientů s trváním T1DM nad 10 let proměnlivá [3]. Kvůli rozmanitosti fyziologických hodnot plochy FAZ není možné použit tuto hodnotu jako screeningovou [21,22]. Polská studie u 130 dětí a mladistvých naopak prokázala nezávislost plochy FAZ na věku [23], což potvrdilo hodnocení naši kontrolní skupiny ze stejného evropského regionu ve věku od 18 do 29 let provázené mírným nesignifikantním nárůstem. Rozšíření FAZ u DR bylo prokázané již před 15 lety pomocí FAG [24]. Později publikovala řada autorů, že to lze prokázat bez použití kontrastní látky pomocí neinvazivní OCT-A. Plocha FAZ byla u pacientů s DR větší proti zdravé kontrolní skupině a její velikost byla přímo úměrná pokročilosti nálezu [16,25–29], jejichž výsledky ovlivňuje úroveň stadia DR. Další práce potvrdily korelaci mezi poklesem ZO a zvětšující se plochou FAZ u DR [27,30–32], kterou jsme pro minimální nálezy patologického postižení makulární krajiny při počínající NPDR nezaznamenali. V jiných studiích nebyl při srovnání diabetiků bez klinických příznaků DR s kontrolní skupinou rozdíl plochy FAZ signifikantní [21,23,33–35]. Současně u nich byl pozorován velký rozptyl velikosti FAZ u kontrolní skupiny [21], nebo byla doba trvání T1DM kratší než 10 let [23]. V naší skupině, s dobou trvání T1DM nad 10 let, byl rozdíl dán zařazením 1/5 pacientů s NPDR, což odpovídalo japonské práci popisující větší plochu FAZ u diabetiků bez DR a ještě větší u diabetiků s DR při srovnání s kontrolní skupinou [36]. U pacientů s normální velikostí FAZ a s průměrnou délkou trvání T1DM přes deset let nastal určitý pokles denzity kapilární sítě [33,35], což bylo shodné i s naším pozorováním. Zvýšení hustoty kapilární sítě bylo shledáno při nezměněné FAZ u diabetiků bez známek DR [34]. Sami jsme pozorovali zúžení FAZ, což pravděpodobně reprezentuje autoregulační odezvu na zvýšenou metabolickou poptávku [34].
Právě abnormality kapilární sítě byly zachyceny nejprve přímou oftalmoskopií [9,11], prokázané i fluoroangioskopicky [8,10], což vedlo k názvu preretinopatie. OCT-A vyšetření tu skutečnost potvrdilo, neboť detekuje časné mikrovaskulární změny na očích bez i s příznaky DR [37,38]. Rozhodující pro obraz OCT-A za použití Dopplerovy techniky je posouzení kvantitativního průtoku krve v sítnici [39]. U zdravé populace je rychlost průtoku v artériích zhruba 4,5 mms-1 a u vén 3,2 mms-1 a obdobné hodnoty jsou u diabetiků bez prokázané DR. Naopak u mírných forem NPDR je průtok v artériích nevýrazně pomalejší, ale ve vénách je již signifikantně snížen [25]. Na zpomalení průtoku v kapilárách se může podílet i angiograficky prokázaná okluze [8]. Zpomalení průtoku v MA způsobí jen 40% znázornitelnost na OCT-A vyšetření na rozdíl od FAG [40]. OCT-A ukazuje u pacientů bez DR snížení celkové denzity kapilár [41] a časné mikrovaskulární změny [38], a to bez rozdílu použitého přístroje [42], především v parafoveální oblasti DCP [43,44]. Tyto nálezy jsme také pozorovali. Analýza povrchového kapilárního plexu (SCP) odhalila útlum kapilární sítě ve srovnání s kontrolní skupinou v obou parafoveální i perifoveální oblasti [28], což jsme zaznamenali u DpR s již rozšířenou FAZ. Další prořídnutí a ztráta kapilární sítě pokračuje s progresí očních změn až do obrazu NPDR [34], což jsme prokázali u několika našich pacientů s NPDR, kde byly již jasné známky neperfuze [33,35], přestože nedisponujeme programem na měření tohoto parametru, kde se například vyhodnocuje počet bifurkací kapilár [42]. Právě progrese změn v DCP provází zhoršení DR [29], jehož příkladem byla námi pozorovaná dilatace kapilár.
Vývoj změn FAZ a jejího okolí může být velmi důležitým screeningem před vznikem DR u dětí s T1DM [45], ale kratší doba sledování dětských diabetiků (okolo 5 let) tyto změny neprokázala [23]. Přítomnost mikrocirkulačních změn je zásadním rozdílem od zdravé populace a určuje prvotní projevy T1DM ještě před biomikroskopickým nálezem DR [28,33].
Závěr
Změny velikosti FAZ odpovídaly stadiu projevů T1DM na očním pozadí. Nárůstem vinutosti kapilár v rámci mikrocirkulace se snížila její plocha, což bylo prvním klinickým symptomem DpR. Naopak zvětšení plochy FAZ a její nepravidelnost s perfuzním poklesem hustoty kapilární sítě v jejím okolí odpovídalo již rozvoji NPDR. Přesnější vyhodnocení patofyziologie diabetického postižení na očním pozadí lze předpokládat z kombinace hodnocení mikrocirkulačních změn (OCT-A) a strukturálních změn sítnice (SD-OCT) spolu s jejím funkčním postižením (CS).
Autoři práce prohlašují, že vznik a téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou. Tato práce nebyla zadána ani otištěna v jiném časopise.
Předneseno na XXVI. sjezdu ČOS v září 2018 (Praha) a na 20. sympoziu Diabetes mellitus – oční komplikace v říjnu 2019 (Olomouc)
Do redakce doručeno dne: 22. 2. 2020
Přijato k publikaci dne: 25. 3. 2020
MUDr. Lukáš Magera
Fakultní nemocnice Královské Vinohrady
Šrobárova 1150/50
100 34 Praha 10
Zdroje
1. Němec P. Trendy soudobé oftalmologie. Svazek 10. Praha: Galén; 2017. OCT angiografie; s. 33–50.
2. Krásný J, Anděl M, Brunnerová R, et al. The contrast sensitivity test in early detection of ocular changes in the relation to the type 1 diabetes mellitus compensation in children, teenegers, and young adults. Recent Pat Inflamm Alergy Drug Discov. 1; 2007; 232–236.
3. Krásný J, Vosáhlo J, Čeledová J, et al. Preretinopatie u mladistvých s diabetem I. typu z pohledu citlivosti na kontrast a koherentní tomografie (Pilotní studie). Ces Slov Oftal. 2014;70 : 123–130.
4. Kalvodová B, Sosna T, Ernest J, et al. Doporučené postupy pro diagnostiku a léčbu diabetické retinopatie. Ces Slov Oftal. 2016;72 : 226–233.
5. Sosna T, Bouček T, Fišer I. Diabetická retinopatie. Praha: Jiří Cendelín; 2001. 255.
6. Cunha-Vaz JG. Pathophysiology of diabetic retinopathy. British Journal of Ophthalmology. 1978;62(6):351–5.
7. Cunha-Vaz JG, Goldberg MF, Vygantas C, Noth J. Early detection of retinal involvement in diabetes by vitreous fluorophotometry. Ophthalmology. 1979;86(2):264–75.
8. Tomčíková D, Gerinec A. Osobitosti diabetické retinopatie u dětí. Ces Slov Oftal. 2001;57 : 266–276.
9. Filouš A, Rychnová J, Vavřinec J. Rozšířená klasifikace diabetické retinopatie u dětí a mladistvých. Cs Pediatr. 1992;47 : 453–455.
10. Verougstraete C, Toussaint D, De Schepper J, Haentjens M, Dorchy H. First microangiographic abnormalities in childhood diabetes - types of lesions. Graefe’s archive for clinical and experimental ophthalmology. 1991;229(1):24–32.
11. Klement UM, Freyler H. Diabetische Präretinopathie. Klin Mbl Augenheilk. 1980;176 : 313–316. German.
12. Enders C, Baeuerle F, Lang GE, Dreyhaupt J, Lang GK, Loidl M, et al. Comparison between Findings in Optical Coherence Tomography Angiography and in Fluorescein Angiography in Patients with Diabetic Retinopathy. Ophthalmologica. 2019 May 28;1–6.
13. Mihailovic N, Eter N, Alnawaiseh M. Foveal avascular zone and OCT angiography. An overview of current knowledge. Ophthalmologe. 2019 Jul;116(7):610–6.
14. Vujosevic S, Toma C, Villani E, Gatti V, Brambilla M, Muraca A, et al. Early Detection of Microvascular Changes in Patients with Diabetes Mellitus without and with Diabetic Retinopathy: Comparison between Different Swept-Source. J Diabetes Res. 2019;2019 : 2547216.
15. Xiao H, Liu X, Liao L, Tan K, Ling Y, Zhong Y. Reproducibility of Foveal Avascular Zone and Superficial Macular Retinal Vasculature Measurements in Healthy Eyes Determined by Two Different Scanning Protocols of Optical Coherence Tomography Angiography. Ophthalmic Res. 2019 Oct 16;1–8.
16. Ashraf M, Nesper PL, Jampol LM, Yu F, Fawzi AA. Statistical Model of Optical Coherence Tomography Angiography Parameters That Correlate With Severity of Diabetic Retinopathy. Invest Ophthalmol Vis Sci. 2018 Aug 1;59(10):4292–8.
17. Ishii H, Shoji T, Yoshikawa Y, Kanno J, Ibuki H, Shinoda K. Automated Measurement of the Foveal Avascular Zone in Swept-Source Optical Coherence Tomography Angiography Images. Transl Vis Sci Technol. 2019 May;8(3):28.
18. Hsu ST, Ngo HT, Stinnett SS, Cheung NL, House RJ, Kelly MP, et al. Assessment of Macular Microvasculature in Healthy Eyes of Infants and Children Using OCT Angiography. Ophthalmology. 2019 Jul 15;
19. Gomez-Ulla F, Cutrin P, Santos P, Fernandez M, Abraldes M, Abalo-Lojo JM, et al. Age and gender influence on foveal avascular zone in healthy eyes. Exp Eye Res. 2019 Oct 22;189 : 107856.
20. Gołębiewska J, Biała-Gosek K, Czeszyk A, Hautz W. Optical coherence tomography angiography of superficial retinal vessel density and foveal avascular zone in myopic children. PLoS ONE. 2019;14(7):e0219785.
21. Lynch G, Romo JSA, Linderman R, Krawitz BD, Mo S, Zakik A, et al. Within-subject assessment of foveal avascular zone enlargement in different stages of diabetic retinopathy using en face OCT reflectance and OCT angiography. Biomed Opt Express. 2018 Dec 1;9(12):5982–96.
22. Wang B, Camino A, Pi S, Guo Y, Wang J, Huang D, et al. Three-dimensional structural and angiographic evaluation of foveal ischemia in diabetic retinopathy: method and validation. Biomed Opt Express. 2019 Jul 1;10(7):3522–32.
23. Vujosevic S, Muraca A, Alkabes M, Villani E, Cavarzeran F, Rossetti L, et al. Early microvascular and neural changes in patients with type 1 and type 2 diabetes mellitus without clinical signs of diabetic retinopathy. Retina. 2019 Mar;39(3):435–45.
24. Conrath J, Giorgi R, Raccah D, Ridings B. Foveal avascular zone in diabetic retinopathy: quantitative vs qualitative assessment. Eye (Lond). 2005 Mar;19(3):322–6.
25. Bates NM, Tian J, Smiddy WE, Lee W-H, Somfai GM, Feuer WJ, et al. Relationship between the morphology of the foveal avascular zone, retinal structure, and macular circulation in patients with diabetes mellitus. Sci Rep. 2018 Mar 29;8(1):5355.
26. Lavia C, Feldman-Billard S, Erginay A, Guerin O, Virgili G, Gaudric A, et al. Rapid macular capillary loss in patients with uncontrolled type 1 diabetes. Retina. 2019 May 8;
27. Lu Y, Simonett JM, Wang J, Zhang M, Hwang T, Hagag AM, et al. Evaluation of Automatically Quantified Foveal Avascular Zone Metrics for Diagnosis of Diabetic Retinopathy Using Optical Coherence Tomography Angiography. Invest Ophthalmol Vis Sci. 2018 May 1;59(6):2212–21.
28. Sousa DC, Leal I, Moreira S, do Vale S, Silva-Herdade AR, Dionisio P, et al. Optical coherence tomography angiography study of the retinal vascular plexuses in type 1 diabetes without retinopathy. Eye (Lond). 2019 Jul 4;
29. Sun Z, Tang F, Wong R, Lok J, Szeto SKH, Chan JCK, et al. OCT Angiography Metrics Predict Progression of Diabetic Retinopathy and Development of Diabetic Macular Edema: A Prospective Study. Ophthalmology. 2019 Jun 26;
30. AttaAllah HR, Mohamed AAM, Ali MA. Macular vessels density in diabetic retinopathy: quantitative assessment using optical coherence tomography angiography. Int Ophthalmol. 2019 Aug;39(8):1845–59.
31. Balaratnasingam C, Inoue M, Ahn S, McCann J, Dhrami-Gavazi E, Yannuzzi LA, et al. Visual Acuity Is Correlated with the Area of the Foveal Avascular Zone in Diabetic Retinopathy and Retinal Vein Occlusion. Ophthalmology. 2016 Nov;123(11):2352–67.
32. Moein H-R, Novais EA, Rebhun CB, Cole ED, Louzada RN, Witkin AJ, et al. Optical coherence tomography angiography to detect macular capillary ischemia in patients with inner retinal changes after resolved diabetic macular edema. Retina. 2018 Dec;38(12):2277–84.
33. Kapsala Z, Pallikaris A, Mamoulakis D, Moschandreas J, Bontzos G, Tsilimbaris M. Perifoveal capillary network quantification in young diabetic patients with subclinical or no retinopathy. Can J Ophthalmol. 2018 Jun;53(3):199–206.
34. Rosen RB, Andrade Romo JS, Krawitz BD, Mo S, Fawzi AA, Linderman RE, et al. Earliest Evidence of Preclinical Diabetic Retinopathy Revealed Using Optical Coherence Tomography Angiography Perfused Capillary Density. Am J Ophthalmol. 2019 Jul;203 : 103–15.
35. Sacconi R, Casaluci M, Borrelli E, Mulinacci G, Lamanna F, Gelormini F, et al. Multimodal Imaging Assessment of Vascular and Neurodegenerative Retinal Alterations in Type 1 Diabetic Patients without Fundoscopic Signs of Diabetic Retinopathy. J Clin Med. 2019 Sep 8;8(9).
36. Takase N, Nozaki M, Kato A, Ozeki H, Yoshida M, Ogura Y. Enlargement of foveal avascular zone in diabetic eyes evaluated by en face optical coherence tomography angiography. Retina. 2015 Nov;35(11):2377–83.
37. de Carlo TE, Chin AT, Bonini Filho MA, Adhi M, Branchini L, Salz DA, et al. Detection of microvascular changes in eyes of patients with diabetes but not clinical diabetic retinopathy using optical coherence tomography angiography. Retina. 2015 Nov;35(11):2364–70.
38. Gildea D. The diagnostic value of optical coherence tomography angiography in diabetic retinopathy: a systematic review. Int Ophthalmol. 2019 Oct;39(10):2413–33.
39. Ruminski D, Sikorski BL, Bukowska D, Szkulmowski M, Krawiec K, Malukiewicz G, et al. OCT angiography by absolute intensity difference applied to normal and diseased human retinas. Biomedical optics express. 2015;6(8):2738–54.
40. Miwa Y, Murakami T, Suzuma K, Uji A, Yoshitake S, Fujimoto M, et al. Relationship between functional and structural changes in diabetic vessels in optical coherence tomography angiography. Scientific reports. 2016;6 : 29064.
41. Xu X, Chen C, Ding W, Yang P, Lu H, Xu F, et al. Automated quantification of superficial retinal capillaries and large vessels for diabetic retinopathy on optical coherence tomographic angiography. J Biophotonics. 2019 Nov;12(11):e201900103.
42. Munk MR, Giannakaki-Zimmermann H, Berger L, Huf W, Ebneter A, Wolf S, et al. OCT-angiography: A qualitative and quantitative comparison of 4 OCT-A devices. PloS one. 2017;12(5):e0177059.
43. Inanc M, Tekin K, Kiziltoprak H, Ozalkak S, Doguizi S, Aycan Z. Changes in Retinal Microcirculation Precede the Clinical Onset of Diabetic Retinopathy in Children with Type 1 Diabetes Mellitus. Am J Ophthalmol. 2019 Apr 19;
44. Simonett JM, Scarinci F, Picconi F, Giorno P, De Geronimo D, Di Renzo A, et al. Early microvascular retinal changes in optical coherence tomography angiography in patients with type 1 diabetes mellitus. Acta Ophthalmol. 2017 Dec;95(8):751–5.
45. Niestrata-Ortiz M, Fichna P, Stankiewicz W, Stopa M. Enlargement of the foveal avascular zone detected by optical coherence tomography angiography in diabetic children without diabetic retinopathy. Graefes Arch Clin Exp Ophthalmol. 2019 Apr;257(4):689–97.
Štítky
Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2020 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Kontaktní dermatitida očních víček
-
Všechny články tohoto čísla
- TRAUMATOLOGIE V OKULOPLASTICKÉ CHIRURGII PŘEHLEDOVÝ ČLÁNEK
- ZMĚNY FOVEÁLNÍ AVASKULÁRNÍ ZÓNY A MAKULÁRNÍ MIKROVASKULATURY V RÁMCI VYŠETŘENÍ OCT ANGIOGRAFIE U MLADÝCH DIABETIKŮ 1. TYPU (PILOTNÍ STUDIE)
- OCT ANGIOGRAFIE A DOPPLEROVSKÁ SONOGRAFIE U NORMOTENZNÍHO GLAUKOMU
- ŠÍŘE CHIASMATU U NORMOTENZNÍCH A HYPERTENZNÍCH GLAUKOMŮ
- ZEVNÍ OFTALMOMYIÁZA ZPŮSOBENÁ LARVOU STŘEČKA OESTRUS OVIS
- PRES SYNDRÓM
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- PRES SYNDRÓM
- ZEVNÍ OFTALMOMYIÁZA ZPŮSOBENÁ LARVOU STŘEČKA OESTRUS OVIS
- TRAUMATOLOGIE V OKULOPLASTICKÉ CHIRURGII PŘEHLEDOVÝ ČLÁNEK
- ZMĚNY FOVEÁLNÍ AVASKULÁRNÍ ZÓNY A MAKULÁRNÍ MIKROVASKULATURY V RÁMCI VYŠETŘENÍ OCT ANGIOGRAFIE U MLADÝCH DIABETIKŮ 1. TYPU (PILOTNÍ STUDIE)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



