-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Roční výsledky terapie vlhké formy věkem podmíněnéR makulární degenerace preparátem aflibercept
Autoři: Y. M. Klimešová; M. Penčák; Z. Straňák; L. Lalinská; M. Veith
Působiště autorů: Oftalmologická klinika FNKV a 3. LF UK, Praha, přednosta doc. MUDr. Pavel Studený, Ph. D., MHA
Vyšlo v časopise: Čes. a slov. Oftal., 74, 2018, No. 2, p. 47-52
Kategorie: Původní práce
doi: https://doi.org/10.31348/2018/1/1-2-2018Souhrn
Cíl:
Zhodnotit výsledky roční terapie preparátem aflibercept u pacientů s nově diagnostikovanou vlhkou formou věkem podmíněné makulární degenerace (VPMD).
Metodika:
Retrospektivní vyhodnocení léčby 28 očí 28 pacientů průměrného věku 74,2 let, kteří byli léčeni preparátem aflibercept na Oftalmologické klinice Fakultní nemocnice Královské Vinohrady. Všichni pacienti byli léčeni dle souhrnu údajů o přípravku (SPC), tj. úvodními 3 injekcemi po měsíčních intervalech, následovaný 4 injekcemi každé 2 měsíce. Hodnotili jsme změnu nejlépe korigované zrakové ostrosti (BCVA) na Early Treatment of Diabetic Retinopathy Study (ETDRS) optotypech a změnu centrální retinální tloušťky (CRT) pomocí optické koherenční tomografie (OCT).
Výsledky:
Průměrná vstupní hodnota BCVA byla 61,5 písmen ETDRS optotypu. Po úvodních 3 injekcích se zlepšila BCVA na 70,5 písmen, po roce léčby pak došlo k lehkému poklesu na 68,1 písmen. Lepší nebo stejnou zrakovou ostrost mělo 25 očí (89,3 %), ke zhoršení došlo u 3 očí (10,7 %). CRT se snížila ze vstupní průměrné hodnoty 360,9 µm na 253,3 µm po úvodní fázi a na 233,8 µm po roce léčby. Bez známek aktivity onemocnění bylo na konci sledovacího období 25 očí (89,3 %). Nebyly zaznamenány žádné komplikace léčby.
Závěr:
V našem souboru potvrzujeme účinnost a bezpečnost preparátu aflibercept u pacientů s nově diagnostikovanou vlhkou formou VPMD. Dodržením fixního léčebného režimu lze i v reálné klinické praxi dosáhnout podobně vynikajících výsledků léčby jako v klinických studiích.
Klíčová slova:
aflibercept, anti-VEGF terapie, optická koherenční tomografie (OCT), vlhká forma VPMD
ÚVOD
Věkem podmíněná makulární degenerace (VPMD) patří mezi degenerativní a progresivní onemocnění, postihující centrální část sítnice. Je nejčastější příčinou praktické slepoty osob starších 65 let v rozvinutých zemích [10]. Jedná se o multifaktoriální onemocnění a její prevalence stoupá hlavně s věkem. Dalším rizikovým faktorem je v současné době považováno kouření, nedostatečný příjem antioxidantů, bílá rasa, UV záření, nemoci kardiovaskulárního systému včetně hypertenze, diabetes mellitus a obezita. Z očních faktorů se jedná o světlou barvu duhovky a operace katarakty [15,3]. Z důvodu stárnoucí populace lze předpokládat, že se prevalence i incidence tohoto onemocnění bude zvyšovat [9].
Rozlišujeme dvě formy VPMD, suchou a vlhkou. V 85-90 % se jedná o pomalu rozvíjející se suchou (atrofickou, nonexudativní) formu VPMD a asi v 10-15 % se vyvine rychle progredující vlhká (neovaskulární, exsudativní) forma se vznikem choroidální neovaskularizace (CNV), která vede až v 85 % k praktické slepotě. Onemocnění se může projevovat kombinací obou forem [19,9]. Manifestuje se zpravidla jednostranně, druhé oko je postiženo po 5 letech trvání u 50 % pacientů, po 10 letech u každého nemocného. Klinicky jsou pro obě formy typické metamorfopsie, různý stupeň centrálního skotomu a snížení centrální zrakové ostrosti, zejména na blízko. Samotná VPMD nevede k úplné slepotě, nicméně nemocní s velmi těžkou formou se zrakovou ostrostí pod 0,05, udávají zhoršení kvality života o 63 % [6].
Klíčovou roli v patogenezi vzniku CNV hrají angiogenní faktory – především vaskulární endoteliální faktor (VEGF) [13], dále destičkový růstový faktor (PDGF) [18], transformující růstový faktor (TGF-β1), fibroblastový růstový faktor (FGF), angiogenin, placentární růstový faktor (PIGF) [22]. Ke správné funkci sítnice je nutná rovnováha mezi produkcí a potřebou VEGF. Postupem věku vlivem snížené propustnosti Bruchovy membrány (BM) nastává nadprodukce VEGF, čímž se stimuluje tvorba neovaskularizací. VEGF růstový faktor, specifický pro cévní endotelové buňky, je tvořen v důsledku hypoxie buňkami retinálního pigmentového epitelu (RPE). Působením zánětlivých mediátorů a angiogenních cytokinů vzniká choroidální neovaskularizace a následná exsudace [1,21].
Cílem léčby VPMD je zpomalit, případně zcela zastavit postup tohoto onemocnění a zabránit tak praktické slepotě. V současné době je nejúčinnější léčbou vlhké formy VPMD intravitreální aplikace léků s blokátorem vaskulárního endoteliálního růstového faktoru (anti-VEGF), které potlačují růst novotvořených cév [24]. U většiny pacientů dokážou nález stabilizovat, u některých zrakovou ostrost i zlepšit [12,14, 23].
Prvním účinným preparátem proti vlhké formě VPMD byl pegaptanib sodný (Macugen, Pfizer), modifikovaný RNA oligonukleotid, který se vysokou afinitou váže specificky pouze na izoformu VEGF-A165 a blokuje její vazbu na receptor [12,27]. Pro nižší účinnost ve srovnání s jinými anti-VEGF preparáty se v České republice již nepoužívá.
Preparát ranibizumab (Lucentis, Novartis) představuje fragment humanizované protilátky proti cévnímu růstovému faktoru. Základními studiemi pro zjištění účinnosti a bezpečnosti ranibizumabu jsou studie MARINA a ANCHOR, které prokázaly jednoznačně pozitivní efekt této léčby [7,23].
Zatím posledním registrovaným preparátem je aflibercept (Eylea, Bayer). Jedná se o rekombinantní fúzní protein, složený z vazebných částí VEGFR-1, VEGFR-2 a Fc části protilátky IgG1 [8,26]. Stejně jako ranibizumab váže všechny izoformy VEGF-A. Její afinita k molekule VEGF-A je však 10 –100 × vyšší. Působí jako falešný receptor, který váže VEGF-A, B a PIGF.
Cílem této práce je retrospektivní zhodnocení roční léčby skupiny pacientů s nově diagnostikovanou vlhkou formou VPMD, léčených preparátem aflibercept, a porovnání našich výsledků s výsledky klinických studií.
METODIKA A SOUBOR
Vlastní soubor tvořilo 28 očí 28 pacientů, z toho 11 mužů a 17 žen. Ve všech případech se jednalo o pacienty s nově diagnostikovanou vlhkou formou VPMD (tedy bez předchozí léčby). Léčba probíhala na Oftalmologické klinice Fakultní nemocnice Královské Vinohrady v období od ledna 2014 do listopadu 2016. Průměrný věk pacientů byl 74,2 let (rozmezí 54 – 88 let). U všech pacientů bylo léčeno pouze jedno oko. 17 očí (39,3 %) bylo fakických, 11 očí (60,7 %) artefakických. U 15 očí (53,6 %) se jednalo o léčbu lepšího oka.
Všichni pacienti z našeho souboru byli léčeni dle souhrnu údajů o přípravku (SPC), tedy úvodními 3 injekcemi 2 mg afliberceptu po jednom měsíci a dále 4 injekcemi po dvou měsících. Sledovací doba je 12 měsíců.
U 10 pacientů, kde nebyl jasný biomikroskopický či OCT nález, byla k verifikaci přítomnosti a typu CNV doplněna fluorescenční angiografie (FAG). V souboru bylo zařazeno 9 očí (32,1 %) s klasickou CNV, 2 oči (7,2 %) s minimálně klasickou CNV a 17 očí (60,7 %) s okultní CNV.
Podmínkou zahájení léčby afliberceptem bylo splnění všech v té době platných indikačních omezení úhrady pro léčbu vlhké formy VPMD, tj. prokázaná CNV při vlhké formě VPMD, vstupní zraková ostrost 4/8 – 4/40, velikost léze maximálně 8 PD (průměr papily zrakového nervu), případná hemoragie maximálně do 25 % léze. U okultních a minimálně klasických membrán byla nutná přítomnost tvrdých exsudátů či hemoragie, nebo zhoršení zrakové ostrosti alespoň o dva řádky ETDRS optotypů během dvou měsíců. Léčba byla ukončena při ztrátě 15 a více písmen ETDRS optotypů během 12 měsíců.
Sledovali jsme změnu nejlépe korigované zrakové ostrosti (BCVA) na ETDRS optotypech a změnu centrální retinální tloušťky (CRT) na přístroji Cirrus 4000 HD-OCT (Carl Zeiss Meditec, Dublin, CA). Uvedené parametry byly hodnoceny po 3,5 a 7 aplikaci a porovnány proti vstupním hodnotám.
Graf 1. Průměrná BCVA jednotlivých kontrol 
Graf 2. Průměrný zisk písmen u jednotlivých kontrol 
Graf 3. Průměrná hodnota CRT u jednotlivých kontrol 
Graf 4. Průměrný pokles CRT u jednotlivých kontrol 
VÝSLEDKY
Průměrná vstupní BCVA byla 61,5 písmen ETDRS optotypu (rozmezí 40–70). Po třech úvodních dávkách 2 mg afliberceptu se zlepšila BCVA na 70,5 písmen ETDRS (rozmezí 50–85), průměrný zisk byl tedy +9,0 písmen ETDRS. K výraznému zlepšení o >15 písmen došlo u 9 očí (32,1 %), 6 očí (21,4 %) se zlepšilo o 10 - 14 písmen, 4 oči (14,3 %) o 5-9 písmen, 8 očí (28,6 %) o 0–4 písmena. U jednoho oka (3,6 %) došlo ke ztrátě 6 písmen.
Po 5. aplikaci (tedy bezprostředně před 6. injekcí) jsme zaznamenali mírný pokles zrakové ostrosti na 68,4 písmen ETDRS (rozmezí 40–83) a průměrný zisk oproti vstupu odpovídal +8,4 písmen. Tento mírný pokles BCVA lze vysvětlit tím, že byl aplikační interval v této fázi již 2 měsíce. Zlepšení o >15 písmen bylo prokázáno u 2 očí (11,8 %). 8 očí (47,0 %) mělo zisk 10–14 písmen a 2 oči (11,8 %) 5–9 písmen. U 4 očí (23,5 %) bylo prokázáno minimální zlepšení 0–4 písmen a pouze u jednoho oka (5,9 %) byla zjištěna ztráta 2 písmen.
Výsledná průměrná nejlépe korigovaná zraková ostrost po 7. aplikaci byla 68,1 písmen ETDRS, kde stejné či lepší zrakové ostrosti dosáhlo 25 očí (89,3 %) (graf 1). Průměrný zisk písmen oproti vstupnímu vyšetření byl po 7. aplikaci +7,1 písmen (graf 2). 7 očí (25,0 %) se zlepšilo o >15 písmen. U 6 očí (21,4 %) se zlepšila zraková ostrost o 10–14 písmen, u 5 očí (17,9 %) o 5–9 písmen a u 7 očí (25,0 %) o 0–4 písmena. Zhoršení zrakové ostrosti jsme zaznamenali u 3 očí (10,7 %), přičemž u 2 očí se jednalo o ztrátu méně než 5 písmen a u jednoho pacienta byla po 7. aplikaci ztráta >15 písmen v důsledku rozvoje rozsáhlé atrofie RPE. Jednalo se o stejného pacienta, který měl již po třech úvodních aplikacích ztrátu písmen.
Průměrná vstupní centrální tloušťka makuly (CRT) byla 360,9 µm (rozmezí 218-640). Po třech aplikacích afliberceptu poklesla CRT o 107,6 µm na hodnotu 253,3 µm (rozmezí 181–495). U 23 očí (82,1 %) se edém v makule kompletně vstřebal, u zbylých 5 očí (17,9 %) byla na OCT stále patrná aktivita CNV. V dalších kontrolních vyšetřeních nebyl pokles CRT již tak výrazný. Po 5. aplikaci byla hodnota CRT 250,2 µm (rozmezí 183–349). Měsíc po poslední 7. aplikaci dosáhla CRT výsledné hodnoty 233,8 µm (rozmezí 186–470). Bez známek aktivity CNV bylo 25 očí (89,3 %). Průměrnou hodnotu CRT oproti vstupní hodnotě ukazuje graf 3, zatímco graf 4 sleduje průměrnou změnu absolutních hodnot CRT.
Zánětlivé reakce, odchlípení sítnice ani další jiné komplikace jsme v tomto sledovaném souboru nezaznamenali.
Obr. 1. Vstupní foto fundu: pacient – muž, 75 let, vstupní BCVA 63 písmen ETDRS optotypu, CRT 348 μm, FAG - minimálně klasická CNV. 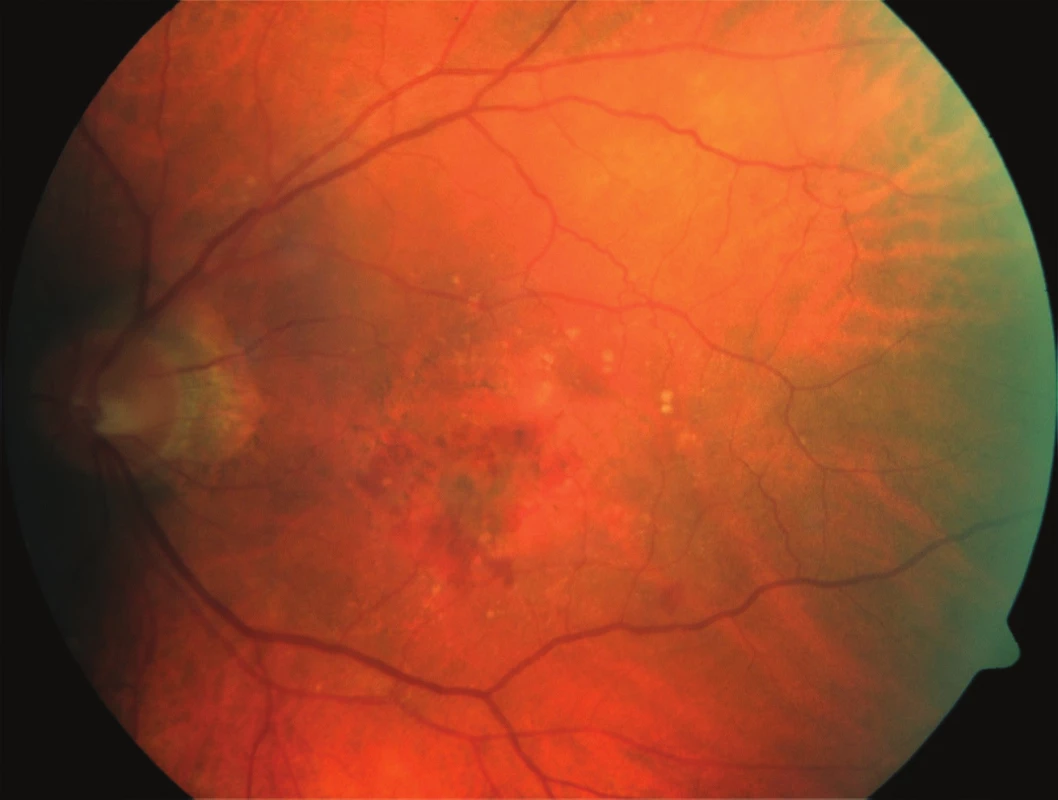
Obr. 2. Vstupní OCT – přítomnost exsudace 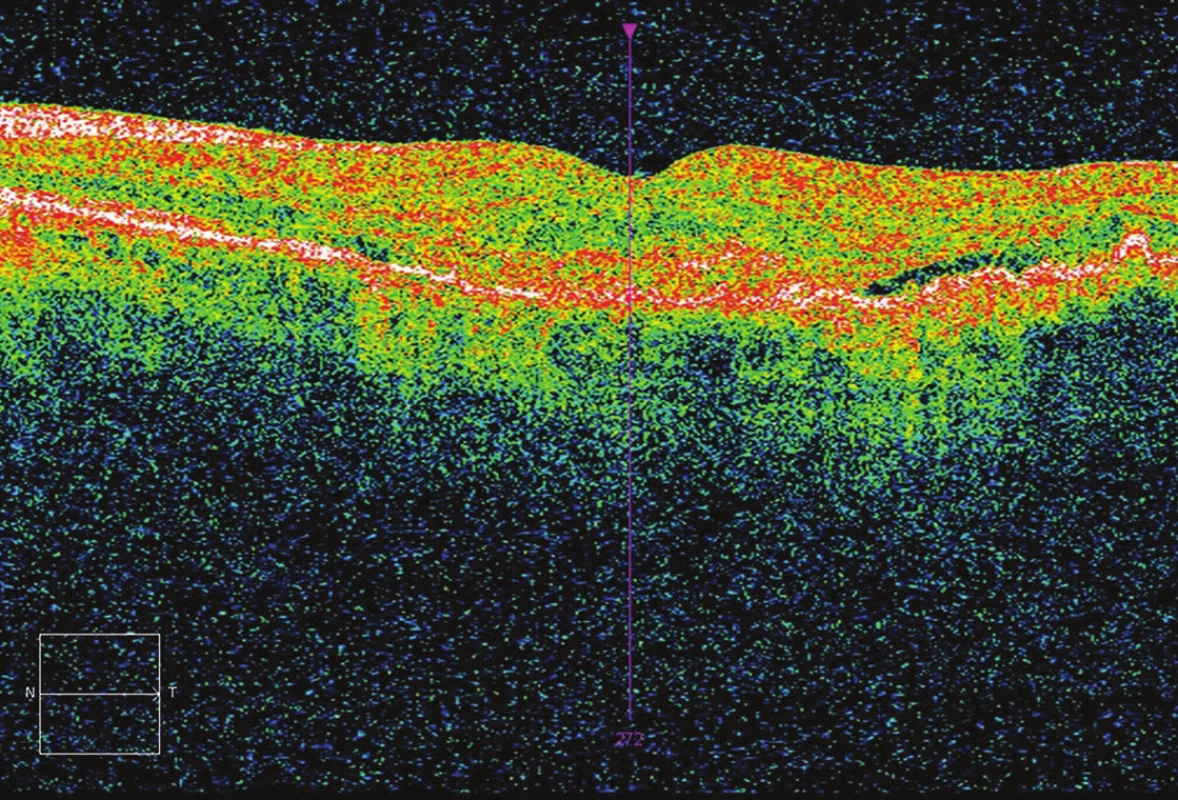
Obr. 3. OCT po 3 aplikacích - CRT 233 μm, bez edému, BCVA 70 písmen ETDRS optotypu (zisk 7 písmen oproti vstupu). 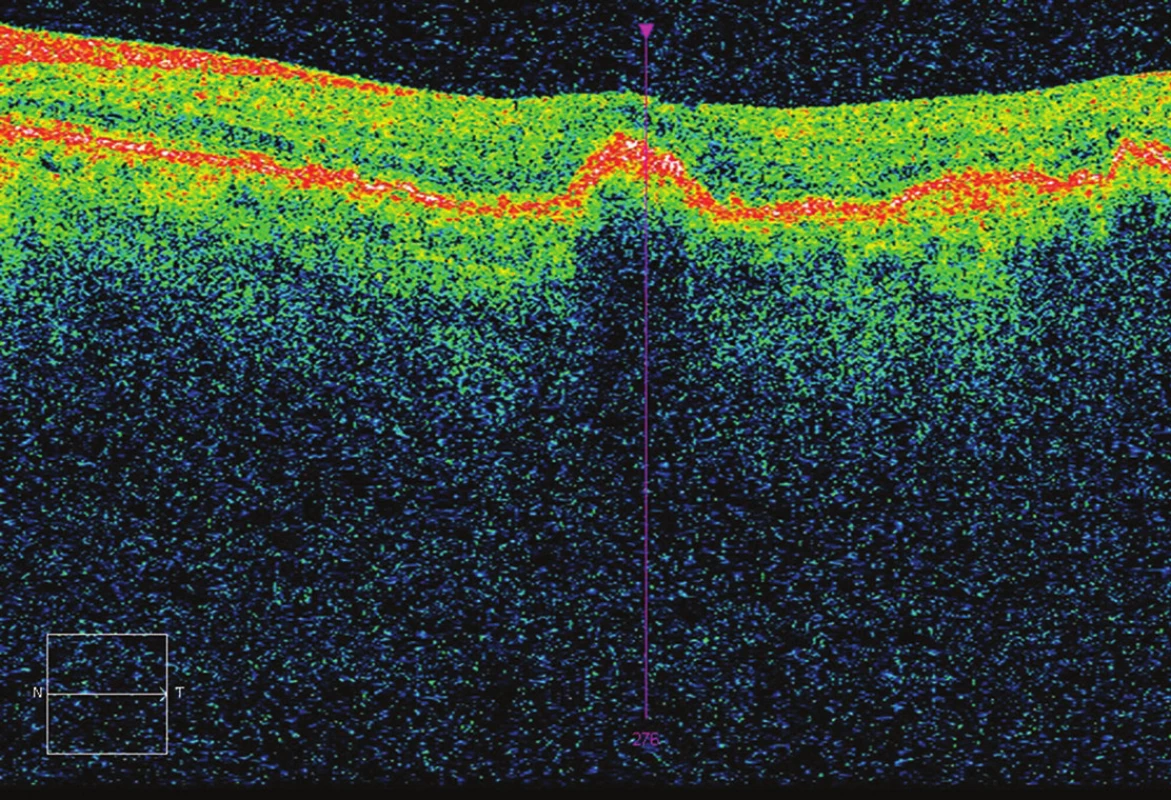
Obr. 4. OCT po 5 aplikacích – CRT 248 μm, opětovný edém, BCVA 73 písmen ETDRS optotypu (zisk o 10 písmen oproti vstupu) 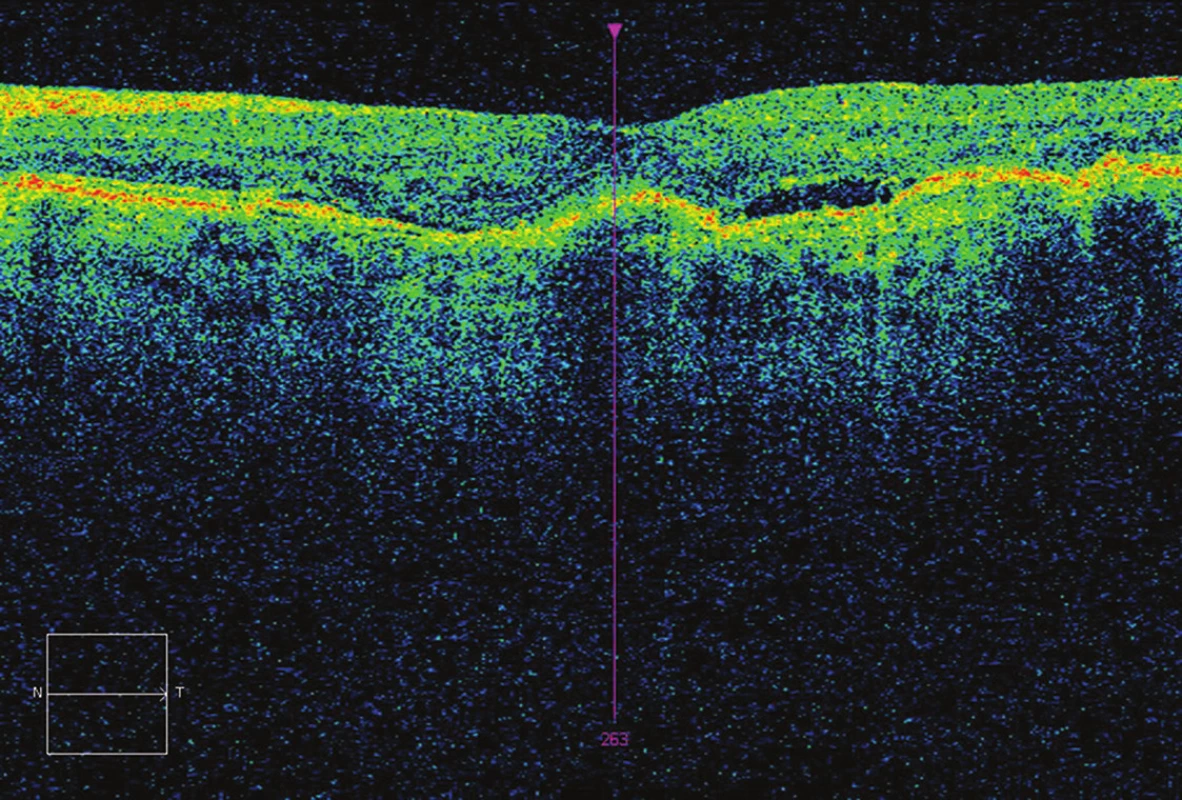
Obr. 5. OCT po 7 aplikacích – CRT 221 μm, bez edému, BCVA 75 písmen ETDRS optotypu (zisk o 12 písmen oproti vstupu) 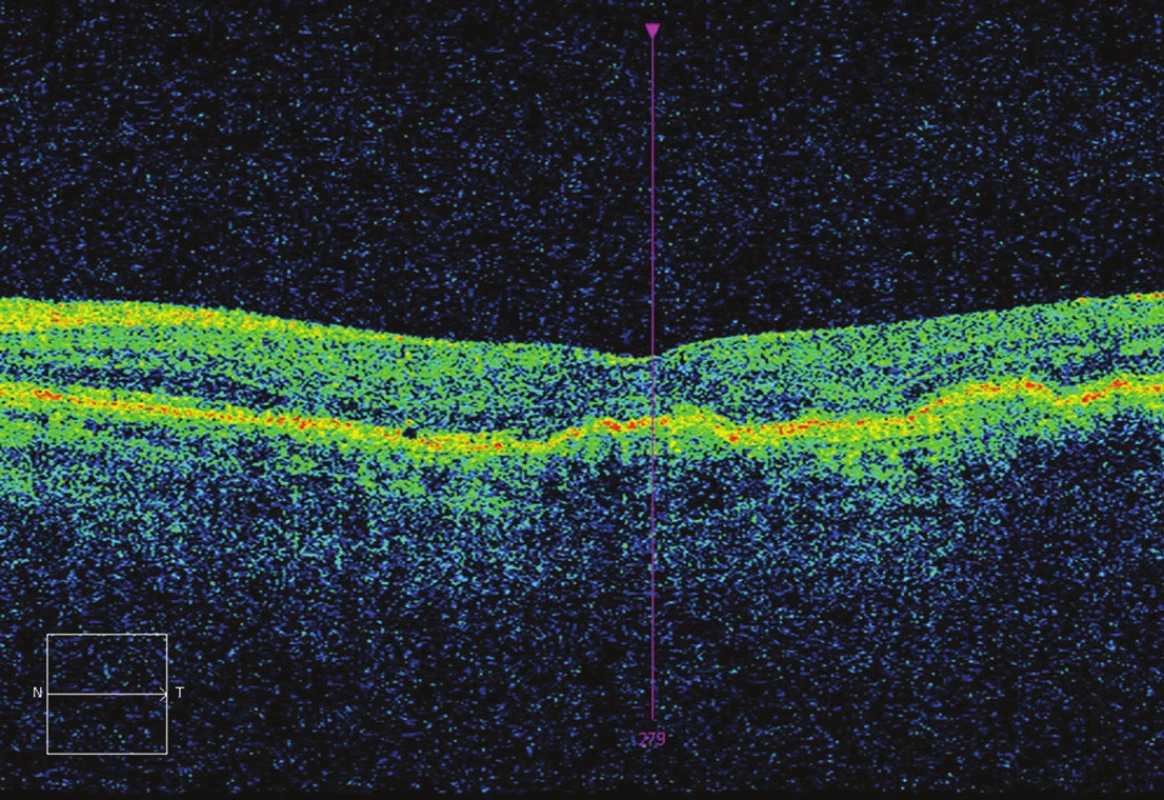
DISKUSE
Anti-VEGF terapie je současné době metodou první volby u pacientů s vlhkou formou VPMD. Jako zatím poslední anti-VEGF preparát obdržel registraci a úhradu aflibercept.
Účinnost a bezpečnost afliberceptu u léčby vlhké formy VPMD ověřily klinické studie VIEW 1 a VIEW 2. Jednalo se o multicentrickou studii ve fázi III, dvojitě zaslepenou, prospektivní, randomizovanou studii, která aktivně kontrolovala klinickou účinnost afliberceptu v porovnání s ranibizumabem. Byly to největší kontrolované studie léčby vlhké formy VPMD anti-VEGF preparátem (VIEW 1 n=1,217, VIEW 2 n=1,240) [14,25].
Obě studie měly velmi podobnou charakteristiku souboru. Mezi zařazovací kritéria byl věk nad 50 let, aktivní subfoveolární léze na podkladě VPMD, juxtafoveolární léze s prosakováním ve fovey do celkové velikosti léze do 12 PD, CNV zahrnující minimálně 50 % velikosti léze, BCVA mezi 73 a 22 písmen ETDRS optotypu. Mezi vyřazovací kritéria patřila jakákoliv předchozí systémová léčba VPMD (výjimkou byly potravinové doplňky), nitrooční zánět či glaukom i v anamnéze.
Pacienti v těchto studiích byli rozděleni do 4 skupin: 3 různé dávkovací režimy afliberceptu – 0,5 mg á měsíc, 2 mg á měsíc, 2 mg á 2 měsíce po 3 úvodních měsíčních dávkách (tedy jako v našem souboru dle SPC), ve čtvrté skupině byli pacienti léčeni ranibizumabem (2 mg á měsíc). Podle typu CNV soubor tvořil ve studii VIEW 1 klasickou CNV ve 23,6 %, minimálně klasickou 36,5 %, okultní 39,2 % a ve studii VIEW 2 ve stejném pořadí 28,8 %, 34,6 % a 35,9 %.
V našem souboru bylo ve sledování 28 očí. Průměrná vstupní BCVA byla v našem souboru o něco lepší - 61,5 písmen ETDRS (VIEW 1 55,7 a VIEW 2 51,6), vstupní hodnota CRT byla naopak horší - 360,9 µm (VIEW 1 324,4um a VIEW 2 342,6um). Důvodem mohlo být jiné zastoupení typu CNV, kdy u nás převažoval okultní typ - 60,7 %.
Průměrný zisk písmen po 12 měsících léčby byl ve studii VIEW 1 zisk +7,9 písmen, resp. +8,9 písmen ve studii VIEW 2. Zisk ≥15 písmen dosáhlo ve studii VIEW 1 30,6 % pacientů a ve studii VIEW 2 31,4 % pacientů. Náš soubor měl o něco menší průměrný zisk písmen +7,1 písmen a i zisk ≥15 písmen dosáhlo méně pacientů - 25 %. Tento fakt lze přičíst lepší vstupní hodně BCVA v našem souboru, kde tak byl menší prostor pro výraznější zlepšení v průběhu léčby.
Pokles CRT byl po 12 měsících léčby 128,5 µm ve studii VIEW 1, resp. 149,2 µm ve studii VIEW 2. V našem souboru byl pokles CRT obdobný - 127,1 µm. Bez známek aktivity onemocnění na OCT bylo ve studii VIEW 1 63,4 % a ve studii VIEW 2 71,9 % pacientů, v našem souboru 89,3 %. Tento rozdíl mohl být způsoben rozdílným zastoupením typů CNV a také chybou malých čísel.
Kromě těchto dvou velkých klinických studií existují různé publikace, hodnotící efekt afliberceptu v běžné klinické praxi. Převážně se jedná o publikace, porovnávající účinnost léčby afliberceptu s jinými anti-VEGF preparáty, případně hodnotí jeho efekt u pacientů po přechozí léčbě jiným preparátem [2,4,11,20,31]. K dohledání je méně prací publikujících výsledky léčby tzv. naivních pacientů, tj. pacientů bez žádné předchozí léčby [5, 29, 30]. Jako příklad lze uvést publikaci Warwick et al - roční výsledky fixní léčby preparátem aflibercept u naivních pacientů [30]. Ve svém souboru hodnotí 58 očí 51 pacientů průměrného věku 82,8 let. Průměrná vstupní hodnota BCVA byla 54,1 písmen ETDRS a CRT 284,2 um. Po 12 měsících léčby 7 dávkami dosáhli zisku +4,67 písmen ETDRS a CRT poklesla pouze o 35,36 µm. Lepší anatomické a funkční výsledky v našem souboru lze vysvětlit rozdílným zastoupením typu CNV a vyšším věkovým zastoupením pacientů ve Warwickově studii. Vyšší věk pacientů mohl vyvolat primárně již atrofické změny sítnice.
Hodnocením efektu anti-VEGF léčby v reálné klinické praxi se zabýval také český národní registr AMADEUS. V registru jsou zaznamenány výsledky léčby více než 8000 pacientů z ČR. Z jejich analýz je také patrné, jaký význam má dostatečná frekvence kontrol a zejména aplikací. Pokud jsou pacienti léčeni dostatečně intenzivně, lze se i v reálné klinické praxi přiblížit vynikajícím výsledkům léčby v klinických studiích [16,17,28].
ZÁVĚR
Naše dosažené výsledky léčby vlhké formy VPMD preparátem aflibercept jsou srovnatelné s výsledky klinických studií. Dodržením fixního dávkovacího režimu byla zajištěna dostatečná intenzita léčby, která ve většině pacientů umožnila zachovat stabilní zrakovou ostrost.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
Do redakce doručeno dne: 17. 1. 2018
Do tisku přijato dne: 18. 5. 2018
MUDr. Klimešová
Oftalmologická klinika FNKV a 3. LF UK, Praha
Zdroje
1. Ambati, J., Fowler, BJ.: Mechanisms of age-related macular degeneration. Neuron, 75; 2012 : 26-39.
2. Arcinue, CA., Ma, F., Barteselli, G. et al.: One-year outcomes of aflibercept in recurrent or persistent neovascular age-related macular degeneration. Am J Ophthalmol, 159; 2015 : 426 – 436.
3. AREDS Research Group: Risk factors associated with age-related macular degeneration. A case-control study in the age-related eye disease study: Age-Related Eye Disease Study Report Numer 3. Ophthalmology, 107; 2000 : 2224–2232.
4. Bakall, B., Folk, JC., Boldt, HC. et al.: Aflibercept therapy for exudative age-related macular degeneration resistant to bevacizumab and ranibizumab. Am J Ophthalmol, 156; 2013 : 15–22.
5. Balaratnasingam, C., Dhrami-Gavazi, E., McCann, JT. et al.: Aflibercept: a review of its use in the treatment of choroidal neovascularization due to age-related macular degeneration. Clin Ophthalmol, 19; 2015 : 2355 – 71.
6. Brown, MM., Brown, GC., Stein, JD. et al.: Age-related macular degeneration: economic burden and value-based medicine analysis. Can J Ophthalmol, 40; 2005 : 277 - 87.
7. Brown, DM., Michels, M., Kaiser, PK. et al.: Ranibizumab versus verteporfin photodynamic therapy for neovascular age-related macular degeneration: Two-year results of the ANCHOR study. Ophthalmology, 116; 2009 : 57–65.
8. Dixon, JA., Olivek, S. C., Olson, JL. et al.: VEGF trap-eye for the treatment of neovascular age-related macular degeneration. Expert Opin Investig Drugs. 18; 2009 : 1573–1580.
9. Ernest, J.: Makulární degenerace: Trendy v léčbě věkem podmíněné makulární degenerace. Praha: Mladá fronta, 2010. (ISBN 978-80-204-2363-4) 249s.
10. Friedman, DS., O’Colmain, BJ., Munoz, B. et al.: Eye Diseases Prevalence Research Group. Prevalence of age-related macular degeneration in the United States. Arch Ophthalmol, 122;2004 : 564–572.
11. Gharbiya, M., Iannetti, L., Parisi, F. et al.: Visual and anatomical outcomes of intravitreal aflibercept for treatment-resistant neovascular age-related macular degeneration. Biomed Res Int, 2014;2014 : 273754.
12. Gragoudas, ES., Adami, AP., Cunningham, ET. et al.: VEGF Inhibition Study in Ocular Neovascular Clinical Trial Group. Pegaptanib for neovascular age-related macular degeneration. N Engl J Med, 351; 2004 : 2805–16.
13. Grisanti, S., Tatar, O.: The role of vascular endothelial growth factor and other endogenous interplayers in age-related macular degeneration. Prog Retin Eye Res, 27; 2008 : 372–390.
14. Heier, JS., Brown, DM., Chiny, V. et al.: Intravitreal Aflibercept (VEGF Trap-Eye) in Wet Age-related Macular Degeneration. Ophthalmology, 119;2012 : 2537–2548.
15. Hyman, L., HE, O., Grimson, E. et al. Risk factors for age related maculopathy. Incest Ophthalmol Vis Sci, 33; 1992 : 801.
16. Chrapek, O., Jarkovský, J., Studnička, J. et al.: The efficacy of ranibizumab treatment in clinical practice in patients with the wet form of age-related macular degeneration. The results of the Czech National Registry. Biomedical Papers – Olomouc 2015; 159(3): 407-412.
17. Chrapek, O., Pitrová, Š., Dušek, L. et al.: Výsledky léčby vlhké formy věkem podmíněné makulární degenerace u pacientů evidovaných v celonárodním registru AMADEUS. Česká a slovenská oftalmologie 2010, 66(3):110-118.
18. Jo, N., Mailhos, C., Ju, M. et al.: Inhibition of platelet-derived growth factor B signaling enhances the efficacy of anti-vascular endothelial growth factor therapy in multiple models of ocular neovascularization. Am J Pathol, 168; 2006 : 2036–2053.
19. Kolář, P.: Věkem podmíněná makulární degenerace. Praha: Grada Publishing, a.s., 2008. (ISBN 978-80-247-6760-4) 148s.
20. Messenger, WB., Campbell, JP., Faridi, A., et al.: Injection frequency and anatomic outcomes 1 year following conversion to aflibercept in patients with neovascular age-related macular degeneration. Br J Ophthalmol, 98; 2014 : 1205–1207.
21. Neufeld, G., Cohen, T., Gengrinovitch S. et al.: Vascular endothelial growth factor (VEGF) and its receptors. FASEB J., 13; 1999 : 9–22.
22. Rakic, JM., Lambert, V., Devy, L. et al. Placental growth factor, a member of the VEGF family, contributes to the development of choroidal neovascularization. Incest Ophthalmol Vis Sci, 44; 2003 : 3186 – 3193.
23. Rosenfeld, PJ., Brown, DM., Heier, JS. et al.: Ranibizumab for neovascular age-related macular degeneration. N Engl J Med, 355; 2006 : 1419 – 1431.
24. Salomon, SD., Lindsley, K., Vedula, SS. et al.: Anti-vascular endothelial growth factor for neovascular age-related macular degeneration. Cochrane Database Syst Rev 2014; 8: CD005139
25. Schmidt-Erfurth, U., Kaiser, PK., Korobelnik, J-F. et al.: Intravitreal Aflibercept Injection for Neovascular Age-related Macular Degeneration. Ophthalmology, 121; 2014 : 193–201.
26. Semeraro, F., Morescalchi, F., Duse, S. et al.: Aflibercept in wet AMD: specific role and optima use. Drug Des Devel Ther, 7; 2013 : 711–722.
27. Singerman, LJ., Masonson, H., Patel, M. et al.: Pegaptanib sodium for neovascular age-related macular degeneration: third-year safety results of the VEGF Inhibition Study in Ocular Neovascularisation (VISION) trial. Br J Ophthalmol, 92; 2008 : 1606–1611.
28. Studnička, J., Říhová, B., Rencová, E. et al.: Cost and effectiveness of therapy for wet age-related macular degeneration in routine clinical practice. Ophthalmologica 2013; 230(1): 34-42.
29. Udaondo, P., Salom, D., García-Delpech, S. et al.: Aflibercept as First-Line Therapy in Patients with Treatment-Naïve Neovascular Age-Related Macular Degeneration: Prospective Case Series Analysis in Real-Life Clinical Practice., 236; 2016 : 29-35.
30. Warwick, AN., Leaver, HH., Lotery, AJ.: Fixed bimonthly aflibercept in naïve and switched neovascular age-related macular degeneration patients: one year outcomes. Int J Ophthalmol, 9; 2016 : 1156–1162.
31. Wykoff, CC., Brown, DM., Maldonado, ME. et al.: Aflibercept treatment for patients with exudative age-related macular degeneration who were incomplete responders to multiple ranibizumab injections (TURF trial) Br J Ophthalmol, 98; 2014 : 951–955.
Štítky
Oftalmologie
Článek Zemřela Jaroslava Vladyková
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2018 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Možnosti využití přípravku Desodrop v terapii a prevenci oftalmologických onemocnění
-
Všechny články tohoto čísla
- Roční výsledky terapie vlhké formy věkem podmíněnéR makulární degenerace preparátem aflibercept
- Použití mikropulzního laseru u pacientů s diabetickým makulárním edémem na Oční klinice FNHK
- Výsledky prvních 12 měsíců léčby makulárního edému komplikujicího BRVO u pacientů léčených ranibizumabem
- Akutní myopie s elevací nitrooční tenze jako nežádoucí efekt antidepresivní medikace
- Zmena centrálného a perieferneho videnia u pacientky so symptomatickou cystou rathkeho púzdra po transsfenoidálnej resekcii
- Patnáct let Lionského oftalmologického edukačního centra oční kliniky Fakultní nemocnice Královské Vinohrady v Praze
- 19. Vejdovského olomoucký vědecký den
- Zemřela Jaroslava Vladyková
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zmena centrálného a perieferneho videnia u pacientky so symptomatickou cystou rathkeho púzdra po transsfenoidálnej resekcii
- Použití mikropulzního laseru u pacientů s diabetickým makulárním edémem na Oční klinice FNHK
- Výsledky prvních 12 měsíců léčby makulárního edému komplikujicího BRVO u pacientů léčených ranibizumabem
- Akutní myopie s elevací nitrooční tenze jako nežádoucí efekt antidepresivní medikace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



