-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučené postupy pro diagnostiku a léčbu pacientů s venózní okluzí sítnice
Vyšlo v časopise: Čes. a slov. Oftal., 68, 2012, No. 6, p. 244-256
Autorský kolektiv: Jiří Řehák, Jan Studnička
Oponenti:Pavel Rozsíval, MUDr. Šárka Pitrová, Jan Ernest, Pavel Němec, Petr Kolář, Štěpán Rusňák, Zora Dubská, Miroslav Veith, Martina Závorková
1. Úvod
Okluze sítnicové vény (RVO) je definována jako sítnicová vaskulární porucha, která se typicky projevuje překrvením, dilatací a tortuozitou sítnicových vén, převážně intraretinálními hemoragiemi a intraretinálním edémem, retinální ischémií včetně vatovitých ložisek, tvrdých exsudátů a makulárního edému [1-8]. Jakmile je postižena oblast fovey makulárním edémem, dojde k poklesu centrální zrakové ostrosti (ZO), což vede k progresivní a někdy akutní, bezbolestné ztrátě zraku.
RVO je v průmyslově vyspělých zemích poměrně častou příčinou ztráty zraku. Představuje druhou nejčastější příčinu zhoršení zraku v souvislosti s vaskulárním onemocněním sítnice, hned za diabetickou retinopatií [9, 10], přičemž okluze větve centrální retinální vény (BRVO) se vyskytuje 2–3krát častěji než okluze kmene centrální retinální vény (CRVO) [11, 12]. Incidence okluze vény udávaná pro věkovou skupinu 49 až 60 let je 0,7 %, a dále 4,6 % pro osoby starší 80 let. V současné době se odhaduje, že se vyskytuje přibližně 520 nových případů RVO na milión osob [13], z čehož ve 442 případech jde o BRVO a v 80 případech o CRVO. RVO se typicky vyskytuje ve středním věku a u starších osob (starších 50 let) a výskyt u obou pohlaví je stejný.
Etiologie RVO dosud nebyla plně objasněna. Uvažuje se o externí kompresi vény, v případě kmenové okluze sítnicové vény (SV) na úrovni lamina cribrosa, v případě okluze větve SV na úrovni arteriovenózního křížení. Může se vyskytovat řada dalších faktorů, mezi něž se řadí částečná obstrukce retinálního venózního systému vznikem trombu [14, 15, 16].
RVO se podle lokalizace dělí na: (1) CRVO, jestliže je postižen celý venózní sítnicový systém a předpokládané místo zvýšené rezistence vůči venóznímu odtoku se nachází v oblasti lamina cribrosa nebo za ním, a dále (2) BRVO, jestliže venózní překrvení postihuje pouze větve sítnicové venózní sítě. Může se omezovat na malé, periferní arteriovenózní křížení nebo postihovat celý kvadrant, nachází-li se na okraji zrakového nervu (ZN). Je-li postižena horní nebo dolní hemisféra sítnice, je předpokládaným místem okluze jeden ze dvou kmenů intraneurální centrální retinální vény, existuje-li tato vrozená abnormalita. Tato entita (hemicentrální RVO) se považuje za variantu kmenové okluze SV [9, 14, 15].
Do klinického obrazu CRVO patří edém terče ZN, dilatace a tortuozita všech sítnicových vén, hluboké a povrchové hemoragie sítnice, vatovitá ložiska jako výraz ischémie, edém sítnice a oblasti kapilární neperfúze. Podle angiografického nálezu je dělíme na neischemickou a ischemickou okluzi kmene SV. Ischemická okluze kmene SV je definována na fluorescenční angiografii (FAG) nálezem zón kapilární neperfúze v rozsahu 10ti a více ploch terče zrakového nervu [17]. Okluze větve SV vykazuje podobné charakteristiky, které jsou ovšem omezené pouze na část sítnice [18].
Cílem tohoto dokumentu je poskytnout aktualizovaná doporučení ohledně vedení léčby RVO ve světle nejnovějšího pokroku v oblasti diagnostiky a léčby BRVO i CRVO. Měl by sloužit očním specialistům i praktickým lékařům. Shrnuje také rizikové faktory RVO a doporučení týkající se RVO.
2. Metody
Skupinu pro zpracování pravidel léčby venózní okluze sítnice v ČR tvoří dvoučlenný autorský kolektiv (Doc. MUDr. Jiří Řehák, CSc., FEBO, MUDr. Jan Studnička, PhD.) a 9členná skupina oponentů (prof. MUDr. Pavel Rozsíval, CSc., FEBO, Doc. MUDr. Šárka Pitrová, CSc., FEBO, prim. MUDr. Jan Ernest, PhD., MUDr. Pavel Němec, MUDr. Petr Kolář, PhD, MUDr. Štěpán Rusňák, MUDr. Zora Dubská, CSc., MUDr. Miroslav Veith, MUDr. Martina Závorková). Pro účely tohoto posouzení byly prováděny rešerše literatury v databázích MEDLINE / PubMed a Cochrane Library, jako podklady byly využity britské a evropské standardy (Management of Retinal Vein Occlusion – Consensus Document a Interim Guidelines for Management of Retinal Vein Occlusion).
3. Patofyziologie a rizikové faktory
Všeobecně panuje názor, že etiopatogeneze venózních sítnicových okluzí je multifaktoriální [19, 20]. Okluze sítnicové vény je způsobena trombózou uvnitř sítnicových žil (centrální, hemicentrální nebo větve) [17, 19, 20], ačkoli zůstává nejasné, zda se jedná o primární nebo sekundární efekt. Kardiovaskulární rizikové faktory jsou nejčastějšími zdravotními obtížemi, které jsou s okluzí centrální sítnicové vény spojeny. V patogenezi okluze větve a hlavního kmene SV však existují určité rozdíly, které z nich činí samostatné klinické jednotky.
3.1 Okluze větve centrální sítnicové vény
Ve většině případů dochází k rozvoji BRVO v místech retinálního arteriovenózního křížení, která sdílejí společnou adventicii [9]. Téměř ve všech případech se tepna nachází nad vénou, která se tím pádem stává zranitelnou vůči kompresi tepnou, což vyvolává určitý stupeň stázy a turbulentní tok, jenž může vést k predispozici k endoteliálnímu poškození a oba faktory jsou náchylné k tvorbě trombu [10, 11]. Za přítomnosti arterosklerózy dochází k exacerbaci tohoto procesu [9, 10, 12, 21]. Turbulentní tok v místech arteriovenózního křížení byl prokázán pomocí FAG [5].
3.2 Okluze kmene centrální sítnicové vény
Ohledně patogeneze CRVO existuje několik hypotéz. Může dojít ke kompresi centrální sítnicové vény působením centrální sítnicové artérie, jelikož se obě nacházejí ve společném fibrózním pouzdře [21]. Roli může hrát také degenerativní nebo zánětlivé onemocnění stěny centrální sítnicové vény a také hemodynamické faktory, jako je hypotenze a krevní dyskrazie [16, 21–23]. Konečným důsledkem všech těchto mechanismů je stagnace toku žilní krve. Na základě histopatologických studií bylo prokázáno, že ve všech nebo většině případů CRVO dochází k tvorbě trombu v místě lamina cribrosa nebo těsně za tímto útvarem [14]. Předpokládá se, že neischemický typ CRVO se vyskytuje více posteriorně vůči lamina cribrosa, kde zvýšená dostupnost kolaterál vede k méně kompletní okluzi [22].
4. Rizikové faktory
4.1 Systémové rizikové faktory
Nejčastěji jsou do souvislosti s okluzemi centrální sítnicové vény nebo jejích větví kladeny zavedené kardiovaskulární rizikové faktory [22, 24, 25]. Kardiovaskulární trombogenní rizikové faktory venózního poškození, stázy a hyperkoagulability stanovila Virchowova triáda [26]. U pacientů starších 50 let je obvykle některý z kardiovaskulárních rizikových faktorů přítomen. U pacientů mladších 50 let chybí zřejmý rizikový faktor v 60 % případů [27, 28]. Více než 90 % případů RVO se objevuje ve věkové skupině nad 50 let [26].
4.1.1 Hypertenze a kardiovaskulární onemocnění
Častým nálezem je nedávno diagnostikovaná nebo špatně léčená hypertenze. Tento závažný rizikový faktor vykazuje vyšší prevalenci u pacientů s BRVO než u pacientů s CRVO. Více než 64 % pacientů s RVO ve věkové skupině nad 50 let trpí hypertenzí, která je rovněž převažujícím nálezem v případě recidivující RVO (88 %) [29, 30]. A podobně, u pacientů se stávající RVO jsou častěji pozorovány vaskulární (kardiovaskulární, cerebrální) příhody [30].
4.1.2 Hyperlipidémie a hypercholesterolémie
Jedná se o převažující rizikový faktor RVO u pacientů mladších 50 let. Vyskytuje se do 50 % i u starších pacientů [31]. Bylo zjištěno, že 71,4 % všech hodnocených pacientů s RVO trpí hypercholesterolémií [32].
4.1.3 Diabetes mellitus
Existuje významná souvislost mezi cukrovkou a CRVO [33]. Toto onemocnění nebylo ovšem ověřeno jako nezávislý rizikový faktor BRVO [32, 34–40], snad z důvodu zvýšené přítomnosti matoucích koexistujících kardiovaskulárních rizikových faktorů u těchto pacientů [29, 32, 42].
4.1.4 Jiné vaskulární rizikové faktory
Byla zjištěna také spojitost RVO s vysokým indexem tělesné hmotnosti a kouřením, tyto vztahy ovšem vykazují nižší konzistenci [31, 36, 43].
4.1.5 Trombofilie
Kauzální souvislost mezi poruchami koagulační kaskády a okluzí SV je diskutována již několik desetiletí. Mezi nejčastěji zmiňované poruchy patří deficit Proteinu C a S, antitrombinu, hyperprotrombinémie a nejvíce pozornosti bylo věnováno roli Leidenské mutace [20].
Vydat obecné klinické doporučení, zda-li je nutno u pacientů s okluzí SV rutinně provádět screening trombofilních poruch není na základě protichůdných výsledků dostupných studií jednoduché. V podstatě se lze řídit pouze závěry publikovaných metaanalýz, které statisticky hodnotily veškeré dostupné studie o roli jednotlivých trombofilních poruch [20, 26]. Za validní výsledky lze považovat výsledky metaanalýz, které prokázaly kauzální souvislost mezi RVO a hyperhomocysteinémií, antifosfolipidovým syndromem a Leidenskou mutací [20]. Rozdíl výskytu těchto hematologických poruch proti zdravé populaci však není tak vysoký, aby nás opravňoval provádět skríning hematologických poruch u všech pacientů s RVO.
Vzhledem k tomu, že trombofilické vady jsou hlavně genetického původu (s výjimkou hyperhomocysteinémie, která ze své podstaty souvisí se stravou), může určité světlo často vnést rodinná anamnéza trombotických příhod (trombóza hlubokých žil, plicní embolie nebo vícečetné spontánní potraty). Lepší šanci na identifikaci rizikových pacientů nabízí skrínink podle pozitivní osobní či rodinné anamnézy.
4.1.6 Vzácnější souvislosti
U mladších pacientů (ve věku mladších 50 let) více vystupují do popředí nálezy, jako je perorální antikoncepce a vaskulitida terče zrakového nervu [27, 28]. Chybí shoda o tom, jakou roli tyto faktory hrají, přičemž někteří autoři uvádí, že se nejedná o významné rizikové faktory [54, 55].
4.1.7 Další pozorování
U 1 % pacientů, u nichž se prezentuje RVO, jsou přítomné myeloproliferativní poruchy (jako je lymfom a leukémie) [33]. Dalšími vzácnými souvislostmi s RVO jsou zánětlivá onemocnění, která způsobují retinální vaskulitidu nebo s ní souvisejí. Při těchto procesech vzniká RVO často v místě retinální granulomatózní infiltrace nebo v periferní distribuci s postižením četných drobných cév. I zde je tendence k postižení u mladších osob. Mezi choroby, které je potřeba vzít v úvahu, patří sarkoidóza, toxoplazmóza, tuberkulóza, Behćetova nemoc, systémový lupus erythematosus, polyarteritis nodóza, Wegenerova granulomatóza a Goodpasturův syndrom [26]. V poslední době byla hlášena spojitost se spánkovou apnoe [56].
4.1.8 Souhrn
Prokázaná souvislost RVO se systémovými vaskulárními chorobami zdůrazňuje potřebu skríninku nových pacientů z hlediska vaskulárních rizikových faktorů, jako je arteriální hypertenze, dyslipidémie a diabetes mellitus. Léčba těchto základních příčin má zásadní význam z hlediska prevence značné morbidity. Není-li přítomna žádná jiná zřejmá etiologie, je vhodné zvážit vyšetření na trombofilii [26].
4.2 Oční rizikové faktory: Glaukom
Nejčastějším očním faktorem, který u pacientů způsobuje predispozici vůči RVO, je glaukom s otevřeným úhlem. Předpokládá se, že zvýšený nitrooční tlak narušuje tok retinální vénou a vyvolává stázu [29, 32, 44].
5. Přirozený průběh a prognóza výsledné zrakové ostrosti u okluze centrální sítnicové vény
Obecně platí, že prognóza kmenové okluze centrální sítnicové vény je mnohem horší ve srovnání s okluzí větve centrální sítnicové vény.
5.1. Okluze kmene centrální sítnicové vény
Pro CRVO existují dva hlavní prediktory výsledku zrakové ostrosti: FAG a vstupní ZO [57].
5.1.1 Fluorescenční angiografie
5.1.1.1. Ischemická CRVO
Quinlenová uvádí, že 36 % CRVO bylo ischemických už na vstupu. Všechny oči v ischemické skupině měly vstupní ZO 6/30 a horší. Konečnou ZO 6/60 a horší mělo 93 % očí. Pouze 3 % očí se zlepšilo na ZO 6/24 a lepší. Tyto výsledky ukazují, že ischemická CRVO je téměř vždy spojena se špatnou vstupní ZO a že úprava ZO je v případě ischemické okluze velmi málo pravděpodobná [57].
Neischemická CRVO
Quinlenová uvádí, že 64 % CRVO bylo na vstupu neischemických. Vstupní ZO je velmi variabilní: v rozmezí 6/9 – počítání prstů mělo 50 % očí finální ZO 6/60 a horší, podobný výsledek uvádí Glacet-Bernard – 48 % očí. Pokud se podíváme na prevalenci finální ZO 6/60 a horší s ohledem na vstupní ZO, tak zjistíme, že výrazně horší prognózu mají oči se špatnou vstupní ZO – tam, kde byla vstupní ZO 6/60 a horší, tak stejně špatná finální ZO byla v 88 %, zatímco u očí s dobrou vstupní ZO to je mnohem méně – pouze 21 % očí s finální ZO 6/60 a horší. Všeobecně platí, že čím je u neischemické okluze horší vstupní ZO, tím je horší prognóza úrovně výsledného vidění. [57].
5.1.2. Zraková ostrost
Nejreprezentativnější soubor o přirozeném vývoji CRVO (N = 728) podala výzkumná skupina Central Vein Occlusion Study Group (CVO SG): 65% očí s iniciálně dobrou ZO (6/12 a lepší) si udrželo stejně dobrou ZO na konci studie. Pacienti s intermediární vstupní ZO (6/15-6/60) vykazovali variabilní výsledek: 19% se zlepšilo na 6/12 a lepší, 44% zůstalo v intermediární skupině a 37% mělo finální ZO horší než 6/60. Pacient, který měl špatnou ZO na první návštěvě horší než 6/60 měl 80% šanci ZO horší než 6/60 na konečné vizitě, a to bez ohledu na skutečnost, zda na počátku šlo o ischemickou či neischemickou CRVO. Autoři konstatují, že vstupní ZO je silný prediktor ZO v tříletém sledování u očí s dobrou a špatnou ZO, avšak špatný prediktor u očí s intermediární ZO na počátku onemocnění. Je konstatováno, že zraková ostrost je při stanovení prognózy a určení dalšího léčebného postupu významnějším faktorem než FAG. Jestliže ZO poklesne kdykoliv během sledování vývoje okluze na úroveň horší než 6/60, pak je velmi pravděpodobné, že na takovém oku dojde k rozvoji rozsáhlé kapilární neperfúze. [8, 17].
Na základě studie Standard Care vs. Corticosteroid for Retinal Vein Occlusion (SCORE) bylo reportováno, že nejméně u 75 % očí (s ischemickou i neischemickou CRVO) sledované skupiny byla hodnota ZO po 12 měsících 6/12 nebo horší [59]. Na základě studie OZURDEX ® GENEVA bylo zjištěno, že pouze 7,5 % pacientů (s ischemickou i neischemickou CRVO) pozorované skupiny vykázalo zlepšení zraku nejméně o 15 písmen 30 dnů od zahájení sledování, přičemž toto procento po 180 dnech vzrostlo na 17,6 % [60]. V metaanalýze autorů McIntosh et al. [58] se udává, že střední pokles ZO byl v případě ischemické CRVO 35 písmen ve sledovací době 12 měsíců nebo více, v porovnání s poklesem v průměru o 3 písmena během sledování nejméně 12 měsíců v případě neischemické CRVO.
5.1.3. Konverze neischemické CRVO do ischemické formy
Quinlenová uvádí poměrně nízké procento – 9 % – avšak současně upozorňuje, že skutečná prevalence konverzí může být vyšší, protože mnoho jejích pacientů bylo nejdříve vyšetřováno ve spádu a nelze vyloučit, že mnoho neischemických okluzí konvertovalo do ischemické formy ještě před tím, než byli vyšetřeni ve Wilmer Eye Institute. To je ve shodě s výsledky Chena a kol., který publikoval 15% konvertovaných očí. [57,61].
Nejvíce reprezentativní data publikuje CVO Study Group (N = 547 neischemických CRVO), která zjistila, že během prvních 4 měsíců po začátku okluze 15 % neischemických CRVO konvertuje do ischemické formy. Avšak během dalších 32 měsíců sledování, dalších 19 % očí konvertovalo do ischemické formy. Celkový počet konverzí v průběhu 3 let je pak 34 %. Vývoj ke ztrátě perfúze nebo k ischémii byl nejrychlejší během prvních čtyř měsíců a po celou dobu sledování spojitě progredoval. Autoři dále konstatují, že jakmile okluze jednou přejde do ischemické formy, pak tyto oči vykazují stejné charakteristiky jako ischemické okluze včetně stejně špatné prognózy vidění a incidence komplikací. Také platí, že jestliže neischemická okluze jednou konvertuje do ischemické formy, tak už se nikdy nevrátí zpět do neischemické formy [17].
Zatímco změny ve smyslu kapilární neperfúze jsou ireverzibilní, ischémie pozorovaná zpočátku může být pouze relativní: opožděná cirkulace, která je následkem vaskulární stázy, i zánět cévy jsou reverzibilní při vývoji kolaterál.
5.1.4 Neovaskularizace
Bylo zjištěno, že incidence sekundární neovaskularizace při (počáteční) neischemické CRVO kolísá od 0 do 33 % v průběhu 12–15 měsíců [58]. V jedné studii [62], v níž nebyl subtyp CRVO klasifikován, byla po šesti měsících od vzniku centrální sítnicové žilní okluze hlášena incidence dokonce 50 %. Nejsilnějšími prediktory neovaskularizace předního segmentu (duhovka nebo komorový úhel) byla ZO a rozsah neperfundované oblasti zjištěné FAG. Podle CVO SG v případě očí, které byly zpočátku klasifikovány jako ischemické nebo nezařaditelné (pro rozsáhlé sítnicové hemoragie), došlo u 35 % očí k rozvoji neovaskularizace duhovky nebo komorového úhlu v porovnání s 10 % očí, které byly zpočátku klasifikovány jako neischemické [17].
Ischemická CRVO je spojována s vyšším rizikem neovaskulárního glaukomu, jehož rozvoj byl uváděn nejméně ve 23 % případů během 15 měsíců [58]. Neovaskularizace se v časné fázi rozvoje detekuje pomocí gonioskopie jako jemná vaskulární síť přiléhající k trabekulární síťovině. Dále může být zjištěna na pupilárním okraji, kde jemná vaskulární síť způsobuje ektropium duhovky. Následkem rozvoje neovaskularizací dochází k uzavření komorového úhlu a rozvoji neovaskulárního glaukomu. Po devíti měsících byla dokumentována incidence krvácení do sklivce u CRVO ve výši 10 % [63].
5.1.5 Makulární edém
Makulární edém patří mezi hlavní komplikace ischemické i neischemické CRVO. Ve většině studií se udává přítomnost makulárního edému již na počátku onemocnění. Existuje příliš málo hlášených případů rozvoje makulárního edému po RVO ke stanovení jeho incidence. Patří mezi ně údaj o 0–73 % resorpce v případě ischemického typu a zhruba 30 % v případě neischemického typu za dobu 2–15 měsíců [58].
Chronický makulární edém je spojen se špatnou prognózou vývoje ZO, je nicméně potřeba jej léčit. Ve prospěch časné intervence hovoří zjištění, že čím je doba trvání edému delší, tím větší je pravděpodobnost strukturního poškození fovey [58]. Na základě studie GENEVA s přípravkem Ozurdex bylo prokázáno, že i když bylo zlepšení v kontrolní neléčené skupině při kratším trvání makulárního edému větší, reakce na léčbu nezávisela na čase [60].
5.1.6 Postižení druhého oka
Vzhledem k přítomnosti systémových rizikových faktorů je riziko postižení druhého oka podobné. U zhruba 5–10 % případů CRVO byl hlášen rozvoj RVO u druhého oka během jednoho roku [58, 64–67].
5.2 Okluze větve centrální sítnicové vény
5.2.1 Přirozený průběh okluze větve centrální SV
Okluze větve centrální SV má vcelku dobrou prognózu – asi u 50–60 % nemocných je výsledná ZO 6/12 a lepší i bez laserové léčby [2, 73, 101]. Tento příznivý průběh závisí zejména na třech anatomických faktorech: 1. lokalizace okluze, 2. kalibr okludované vény a 3. stupeň venózní obstrukce [102]. U zbývajících 40 % očí je výsledná ZO 6/18 a horší. Asi polovina z těchto očí má však výslednou ZO velmi špatnou – 6/60 a horší, což reprezentuje asi 20 % očí z celkového počtu okluzí větve centrální SV [101]. V chronické fázi se na poklesu vidění podílí především chronický ME a neovaskularizace. ME nacházíme v 57 % u okluzí větve centrální SV [101]. (Prevalence finální ZO 6/60 a horší je u neléčených souborů uváděna ve 23–30% [70, 101, 103].
5.2.2 Prognóza zrakové ostrosti
Přirozený průběh okluze větve centrální SV a její prognóza je dána zejména místem a stupněm okluze, dále pak také integritou arteriální perfúze postiženého sektoru sítnice a hemodynamickou významností kolaterální cirkulace [73]. Chronický ME a krvácení do sklivce z neovaskularizací jsou nejčastější příčinou špatné výsledné ZO. Sítnicové neovaskularizace a chronický, perzistující ME jsou v literatuře popisovány v 25%, resp. 60% [2, 104]. Schilling pozoroval horší prognózu vidění u okluzí s ischemickým ME oproti neischemickému ME [75]. Avšak Finkelstein udává, že u 91 % očí z celkového počtu 23 okluzí s ischémií makuly se ZO během 1 roku zlepšila na 6/12 a lepší [105]. Tyto rozdílné zprávy a malý počet subjektů v těchto studiích nedovolují učinit konečné závěry stran zrakové prognózy u nemocných s okluzí větve centrální SV [106]. Někteří autoři jsou však přesvědčeni, že průběh okluze nemůže být vůbec predikován [70, 103, 107].
V posledních letech došlo k významnému posunu v této problematice. Vůbec nejčastější příčinou neuspokojivé finální ZO je chronický ME, který se rozvíjí na podkladě komplexních intracelulárních a extracelulárních změn v hypoxické sítnici [108]. Dokonce i když makula není postižena přímo, tak ostatní extracelulární faktory (jako jsou např. VEGF, interleukiny) se podílejí na rozvoji ME [109]. Celá řada prognostických faktorů je brána v úvahu u nemocných s okluzí větve centrální SV. Řada studií ukazuje na nepřímý vztah mezi tloušťkou makulární sítnice měřenou pomocí OCT a ZO u nemocných s diabetickým ME [110, 111]. U nemocných s okluzí větve centrální SV byla v nedávné době publikována SCORE studie a ta ukázala statisticky významnou korelaci mezi tloušťkou centrální části sítnice makuly (měřenou pomocí OCT) a ZO [112]. Regresní model ukázal pokles o 1,9 písmen od vstupní ZO měřené na ETDRS optotypech na každých 100 μm ztlušťění centrální části sítnice makuly. Možnou korelaci mezi ZO a integritou spojů mezi vnitřní a zevní vrstvou fotoreceptorů jakožto nejvýznamnější známkou integrity zevní vrstvy fotoreceptorů detekovanou pomocí OCT studoval Ota [113]. Zachovalá integrita foveální vrstvy fotoreceptorů před léčbou byla těsně spjata s dobrou zrakovou funkcí po resorpci ME u nemocných se sítnicovou venózní okluzí.
V roce 2011 byla publikována práce, která na podkladě multivariační analýzy na velkém souboru očí prokázala, že pouze vstupní ZO a věk nad 70 let jsou zcela nezávislým prediktorem výsledné ZO. U ostatních potenciálních predikčních faktorů nebyla prokázána dostatečná signifikance – ischemická okluze (definovaná jako přítomnost zón kapilární neperfúze na FAG větší než oblast 5 papilárních diametrů, resp. pokud není možnost vyhodnotit FAG pro rozsáhlé sítnicové hemoragie je kritériem ischemické okluze přítomnost vatovitých ložisek), pohlaví, okluze hlavní větve/okluze makulární větve. Na základě těchto výsledků je definována tzv. prognosticky nepříznivá okluze větve centrální SV, která je definována jako okluze větve s iniciální ZO 6/24 a horší [68].
5.2.3 Neovaskularizace
Incidence neovaskularizace je v případě BRVO relativně nízká s výjimkou případů s rozsáhlou ischémií (zasažení více než jedné třetiny fundu). Na téma incidence neovaskularizace u pacientů s BRVO není nicméně k dispozici dostatek významnějších studií [69].
5.2.4 Makulární edém
ME nacházíme v 57 % u okluzí větve SV [101]. Podle přirozeného průběhu jej Gutman rozděluje do 3 skupin:
- persistující či chronický ME (ME trvající déle než 3 měsíce) v 65 %,
- přechodný ME, který se spontánně resorbuje – nacházíme v 26 %,
- edém makuly, který se objeví v pozdní fázi onemocnění – nacházíme v 9 %.
Poslední dvě skupiny – přechodný ME a edém makuly s pozdním nástupem – mají dobrou prognózu; výsledná ZO byla u všech očí 6/12 a lepší. Na druhé straně ve skupině pacientů s chronickým ME si pouze 14 % očí uchovalo ZO 6/12 a lepší, zbývajících 86 % očí skončilo s výslednou ZO 6/18 a horší [101]. Tedy chronický edém makuly má špatnou prognózu co do výsledné ZO. Chronický ME – pokud trvá příliš dlouho - zpravidla vyústí v ireverzibilní strukturální poškození sítnice jako jsou: foveální cysty, degenerace RPE a preretinální membrány [20].
5.2.5 Postižení druhého oka
Bilaterální postižení v době náboru do studií bylo hlášeno u 4,5–6,5 % pacientů [2, 72]. Zpráva na základě BVO SG udává 9 % bilaterální postižení, i když není zřejmé, zda byly postiženy obě oči nebo zda došlo k rozvoji bilaterálního postižení postupem času [70, 71]. Michels a Gass [73] udávají 10% rozvoj BRVO u druhého oka v čase. Na základě průřezových populačních dat lze usuzovat na 5% bilaterální postižení [43, 64–67].
6. Léčba venózních okluzí sítnice
Vedení léčby RVO se soustředí na dva hlavní cíle: (1) identifikace rizikových faktorů a jejich léčebné zvládnutí a (2) rozpoznání a zvládnutí komplikací, které ohrožují zrak.
6.1 Medikamentózní léčba
6.1.1 Systémové rizikové faktory
Při léčbě RVO je potřeba řešit několik cílů, mezi něž patří identifikace a zvládnutí systémových rizikových faktorů (konkrétně arteriální hypertenze, kardiovaskulární onemocnění, diabetes mellitus, hyperlipidémie a trombofilie). Léčba základních zdravotních problémů je nutná za účelem prevence jiných než zrak postihujících příhod, například infarktu myokardu a cerebrovaskulárních příhod [74, 75] a také za účelem snížení rizika venózní okluze u druhého oka [76].
V případě tzv. pretrombózy (počínající RVO), která je charakterizována přítomností dilatovaných retinálních vén a malého počtu roztroušených hemoragií, bez makulárního edému, u asymptomatických pacientů nebo u pacientů s přechodnými epizodami rozostření vidění, u nichž může být na FAG patrný mírný nárůst retinálního cirkulačního času, se doporučuje lékařské vyšetření základních systémových rizikových faktorů. Rychlé zvládnutí systémových rizikových faktorů může odvrátit progresi nebo vést k úpravě stávající okluze [77]. Výše uvedená systémová onemocnění spadají do kompetence internisty nebo praktického lékaře.
Vzhledem k tomu, že výše zmiňované studie podle populace i multicentrické prospektivní studie, jako je CVO SG, prokázaly spojitost mezi RVO a glaukomem nebo arteriální hypertenzí [7, 17, 29, 32, 40, 43], je potřeba tyto stavy vyloučit, nebo jsou-li přítomny, příslušně léčit.
6.1.2 Antikoagulancia, fibrinolytická léčba a léky proti srážlivosti
Mohlo by se zdát, že se jedná o logické možnosti léčby, nicméně výsledky z klinických hodnocení s heparinem, streptokinázou a warfarinem byly zklamáním a poskytly omezené důkazy o případném užitku vzhledem k nežádoucím účinkům jako je krvácení do sklivce. Aspirin se nedoporučuje jako primární prevence kardiovaskulárních příhod. Vzhledem k tomu, že se nepodařilo prokázat, že by RVO mohla být rizikovým faktorem mortality z důvodu cerebrovaskulární příhody nebo vaskulární mortality, zůstává úloha aspirinu při RVO neurčitá.
Je k dispozici zpráva, která referuje o signifikantním efektu warfarinu u neischemické CRVO, ovšem za předpokladu, že léčba je dostatečně razantní (INR 3-3,5) a dostatečně dlouhá (1 rok). Konverzi do ischemické formy CRVO autoři uvádějí v 5 %, což je na dolní hranici publikovaných údajů. V případě ischemické CRVO tato léčba neovlivní signifikantně finální ZO, významně však redukuje incidenci neovaskulárního glaukomu z 50 % na 3 %. [78, 79]. Evidence zprávy je však omezená.
6.2.1 Vedení léčby kmenové okluze sítnicové vény
6.2.1.1 Klasifikace subtypů CRVO
Prvním krokem v léčbě CRVO je diferenciální diagnóza mezi neischemickou a ischemickou CRVO, s posouzením neperfundovaných kapilárních oblastí zadního pólu oka a přítomnosti/rozsahu neperfundovaných zón periferie podle FAG. Indikace pro léčbu komplikací ohrožujících zrak pomocí systémové i oční léčby CRVO vycházejí z této diferenciace.
U neischemické CRVO představují hlavní zrak ohrožující komplikace makulární edém a konverze k ischémii. U ischemické CRVO je hlavní takovou komplikací rozvoj oční neovaskularizace, zejména v předním segmentu oka (duhovka a komorový úhel, až po neovaskulární glaukom). Makulární edém se může vyskytnout u všech forem CRVO.
Přestože diferenciace mezi ischemickým a neischemickým typem může být obtížná, alespoň zpočátku nebo v raných stadiích, vodítkem ke stanovení diagnózy může být řada klinických a funkčních charakteristik, které jsou typické pro ischemickou CRVO [3, 8, 13, 17, 80]. Mezi tyto nálezy patří: špatná ZO, relativní aferentní pupilární defekt; přítomnost četných tmavých, hlubokých intraretinálních hemoragií, přítomnost vatovitých ložisek, přítomnost rozsáhlé retinální kapilární nonperfúze (větší oblast bez perfúze než desetinásobek velikosti terče) zjištěné pomocí FAG, nejen na periferii, ale také v oblasti makuly [8].
Přítomnost makulární ischémie (hodnocené podle zvětšení foveální avaskulární zóny na FAG) je prognosticky významná, jelikož indikuje nižší pravděpodobnost obnovy ZO. I když FAG může být užitečná k určení stupně vaskulární perfúze, významným nástrojem při vedení léčby u pacientů s venózní okluzí sítnice je spektrální optická koherentní tomografie (SD-OCT), jelikož je objektivní a pomáhá kvantifikovat objem cystoidního makulárního edému, a také poskytuje doplňující informace například o tom, zda se nahromaděná tekutina nachází převážně uvnitř sítnicových vrstev nebo také v subretinálním prostoru [81]. Po resorpci této tekutiny vyvolává závažná ischémie výrazné zmenšování tloušťky makulární oblasti a její atrofii.
Konečná prognóza vývoje zraku závisí na přítomnosti a integritě externí limitující membrány a také vnitřních a vnějších segmentů fotoreceptorů (rozhraní mezi vnitřním / vnějším segmentem fotoreceptorů). Hyperreflexní body na SD-OCT, hlavně ve vnějších vrstvách, ukazují na zánětlivou reakci a mohou být markerem aktivity nemoci [82].
V případě preokluzivní choroby (pretrombózy) s počátečními intraretinálními hemoragiemi a tortuozitou retinálních cév může SD-OCT ukazovat normální vzhled. V případě hrozící okluze vény jsou na úrovni vnitřní plexiformní vrstvy přítomná ložiska zvýšené reflektivity se stínovým efektem. Je-li přítomna ischemická komponenta, nastává brzy zřejmé zeslabování vrstvy nervových vláken.
Bylo dobře prokázáno, že raná léčba může být z léčebného hlediska prospěšná. To je důležité zejména v protikladu s dříve běžnou představou, že před zahájením léčby okluze vény je nutno počkat nejméně tři měsíce [60, 80].
6.2.1.2 Vedení léčby neischemické CRVO
6.2.1.2.1 Neischemická CRVO a dobrá ZO
U pacientů s neischemickou (dobře perfundovanou) CRVO a dobrou ZO (6/9 a lepší) je prognóza příznivá a je možné sledování. Primárním cílem je skrínink rizikových faktorů. Léčba základních příčin okluze sítnicové vény má význam při prevenci komplikací. Vyšetření na jiné rizikové faktory je vhodné zvážit pouze tehdy, ukazuje-li klinická anamnéza na jejich přítomnost, za nepřítomnosti jiné zřejmé etiologie [26]. Lokální faktory, které znamenají predispozici nebo souvisejí s CRVO, jako je glaukom s otevřeným úhlem, je potřeba vyloučit a vhodně léčit tak, aby bylo zmírněno riziko konverze do ischemické CRVO [43, 83].
Cílem monitoringu během sledování je identifikovat makulární edém anebo konverzi na ischemickou CRVO. Mezi hlavní prvky klinického vyšetření patří posouzení ZO, biomikroskopie a OCT. FAG je vhodné provést vždy, je-li pochybnost ohledně progrese nebo za účelem posouzení stupně ischémie.
Pacienty je vhodné monitorovat jednou měsíčně během prvních tří měsíců, poté během prvního roku každé dva měsíce. Během této doby monitorování je potřeba pacienty instruovat v tom smyslu, aby se ihned dostavili, jestliže si povšimnou zhoršeného vidění, které může ukazovat na makulární edém nebo konverzi do ischemické CRVO.
Je k dispozici zpráva, která doporučuje antikoagulační léčbu warfarinem (N = 50 neischemických CRVO, resp. N = 24 prétrombóz). U prétrombózy je uvedena 96% úspěšnost. Léčbu je možno vysadit za 2 měsíce po vymizení sítnicové symptomatologie. Autoři poukazují na skutečnost, že v okamžiku, kdy prétrombóza přejde do floridní neischemické CRVO je vyhlídka na dobrý výsledek nejistá, pokud okluze přejde do ischemické formy, je šance na dobrý výsledek minimální. Evidence této zprávy je však omezená [78, 79].
6.2.1.2.2 Neischemická CRVO a ZO horší než 6/9
V případě neischemické CRVO a ZO 6/12 nebo nižší je na místě pátrat po makulárním edému. Je-li přítomen, je třeba zahájit léčbu, nikoliv provádět pouze sledování.
6.2.1.2.3 Vedení léčby makulárního edému u neischemické CRVO
6.2.1.2.3.1 Laserová fotokoagulace
Podle CVO SG mřížková laserová fotokoagulace vede k redukci makulárního edému, nepřinesla ovšem žádný statisticky významný užitek z hlediska ZO, kromě skupiny mladších pacientů [88]. V současné době tudíž mřížková laserová fotokoagulace není indikována.
Současné možnosti léčby zahrnují přístupy využívající kortikosteroidy a preparáty proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF). U očí postižených makulárním edémem při CRVO je nutno zvážit léčbu vždy, je-li ZO nižší než 6/9 [88].
6.2.1.2.3.2 Přístup využívající kortikosteroidy
Existuje několik preparátů kortikosteroidů, nicméně ne všechny steroidy mají stejnou potenci a vedlejší účinky. Důvody pro využití steroidů při léčbě makulárního edému souvisejí s jejich schopností snižovat kapilární permeabilitu a inhibovat expresi genu VEGF a metabolickou cestu VEGF. Léčba kortikosteroidy by se měla opírat o randomizovaná klinická hodnocení.
6.2.1.2.3.2.1 Dexametazon
Dexametazon se používá již dlouho jako silný kortikosteroid, který snižuje zánětlivé mediátory, jež se u makulárního edému předpokládají. Na základě dosavadních dat lze usuzovat na méně vedlejších účinků než v případě jiných kortikosteroidů.
Dexametazon je vysoce rozpustný a po intravitreální injekci má krátký poločas rozpadu. Za účelem zajištění dlouhodobé hladiny dexametazonu byl vyvinut biologicky odbouratelný implantát (Ozurdex; Allergan) s pomalým uvolňováním, který léčivo uvolňuje k zadnímu pólu oka až šest měsíců od implantace do sklivcového prostoru. Jeho léčebné účinky na makulární edém spojený s RVO byly zkoumány v rámci šestiměsíčního, randomizovaného, kontrolovaného klinického hodnocení (studie GENEVA s přípravkem Ozurdex) [60]. Lék je možné podat pomocí jednorázového aplikátoru, který obsahuje 0,7 mg dexametazonu ve formě implantátu z polyglykolát acetátu s pomalým uvolňováním.
Studie GENEVA s přípravkem Ozurdex prokázala, že biologicky odbouratelný implantát s obsahem 0,7 mg dexametazonu (Ozurdex) vedl ke zlepšení ZO, přičemž vrchol účinku byl zjištěn po dvou měsících a jeho progresivní pokles na počáteční hodnoty po šesti měsících. V průměru bylo u pacientů po 60 dnech od implantace dosaženo zlepšení o 10 písmen. Zlepšení ZO lze účinně v průběhu jednoročního sledování dosáhnout po druhé injekci podané v 6. měsíci [60]. Z anatomického hlediska bylo zlepšení makulárního edému doloženo pomocí OCT.
Data o bezpečnosti ukázala nízký výskyt šedého zákalu a nízkou míru zvýšení nitroočního tlaku. Středně zvýšený nitrooční tlak byl zjištěn přibližně v 15 % případů, přičemž vrchol jeho výskytu nastal ve 2. měsíci, během sledování ovšem vykazoval klesající tendenci, zejména byl-li léčen pomocí kapek proti glaukomu, jejichž užívání mohla většina pacientů ukončit do šesti měsíců po implantaci. S injekcí nebyly spojeny žádné nežádoucí příhody.
V rámci studie se rovněž podařilo prokázat, že časná léčba makulárního edému je z hlediska obnovy ZO přínosnější než opožděná léčba. Na základě post hoc analýzy byla vyslovena úvaha, že u očí léčených do 90 dnů od nástupu cystoidního makulárního edému je vyšší pravděpodobnost zlepšení než u očí, u nichž byla léčba nasazena až po uplynutí zmíněné doby. Je pravděpodobné, že implantát dexametazonu by se měl podávat častěji, podle individuální reakce každého pacienta během sledování.
6.2.1.2.3.2.2 Triamcinolon acetonid
Preparát triamcinolonu acetonidu obsahující benzylalkohol se již řadu let používá při léčbě pacientů mimo rámec indikací (Kenalog®, Squibb). Pokud jde o prospěšné účinky tohoto preparátu při léčbě makulárního edému spojeného s neischemickou CRVO, byla publikována řada malých sérií případů [18]. Kenalog má ovšem řadu vedlejších účinků, mezi něž patří vývoj šedého zákalu a zvýšený nitrooční tlak. Přítomnost benzylalkoholu také vede ke zvýšenému riziku sterilní endoftalmitidy. Přípravek je sice indikován pro intraartikulární použití v kloubech, jeho použití v oblasti očí je ovšem v režimu off label léčby.
6.2.1.2.3.3 Přístup anti-VEGF
Bylo zkoumáno intravitreální podávání anti-VEGF látek, jako jsou ranibizumab, bevacizumab a pegaptanib.
6.2.1.2.3.3.1 Ranibizumab
Ranibizumab je neselektivní blokátor VEGF (Lucentis®, Novartis), jehož účinnost byla prokázána na základě klinického hodnocení CRUISE [84]. Ranibizumab byl podáván ve formě injekce jednou měsíčně ve dvou dávkách (0,3 a 0,5 mg) během prvních šesti měsíců, což vedlo ke střednímu zvýšení ZO o 12,7, resp. 14,9 písmen v porovnání s podáním falešné injekce v 6. měsíci. Po prvních šesti měsících absolvovali všichni pacienti otevřenou rozšiřující fázi se sledováním po dobu dalších šesti měsíců, s léčbou pro re nata (dle potřeby).
Publikované výsledky potvrdily účinnost léčby ranibizumabem po 1 roce léčby.
6.2.1.2.3.3.2 Bevacizumab
Bevacizumab je neselektivní blokátor VEGF (Avastin®, Roche). Žádné randomizované klinické hodnocení s bevacizumabem při RVO sice nebylo provedeno, nicméně řada nekontrolovaných kazuistických sérií uvádí, že jeho intravitreální podávání může vést ke zlepšení ZO a k úpravě makulárního edému [85, 86]. Nicméně vzhledem k odchylkám v dávkování a v léčebných režimech u těchto studií zůstávají dlouhodobé výstupy i data o bezpečnosti nejasná.
6.2.1.2.3.3.3 Pegaptanib
Pegaptanib je selektivní blokátor anti-VEGF165 – Macugen®, Pfizer, pro který nebyla udělena licence pro použití v indikaci okluze sítnicové vény (off label léčba). Klinické hodnocení fáze II ukázalo na možnost, že intraviterální dávka 0,3 mg pegaptanibu podávaná každých šest týdnů po dobu šestiměsíčního sledování vedla v 6. měsíci ke zlepšení ZO přibližně o 7 písmen [87].
6.2.1.2.3.4 Doporučení pro další sledování
Sledování je v průběhu prvního roku měsíčně, po stabilizaci stavu v dalším roce 1x za 3 měsíce.
Indikační kritéria pro opakovanou léčbu
Indikační kritéria pro opakovanou léčbu odpovídají SPC jednotlivých léčebných prostředků.
Léčba je vysazena na základě rozhodnutí lékaře (viz níže).
6.2.1.2.3.6 Přerušení léčby
Kritéria pro přerušení léčby jsou:
a. Důkaz, že z léčby není prospěch, např. trvalé zhoršení/nedosažení stabilizace zraku i přes příslušnou léčbu. Zpravidla platí, že pokud se 3 měsíce po zahájení léčby nedostaví pozitivní terapeutická odpověď, tak je prognóza špatná i přes nadále vedenou léčbu.
b. Vzestup nitroočního tlaku v souvislosti s léčebným preparátem.
6.2.1.3 Vedení léčby ischemické CRVO
U pacientů s ischemickou CRVO by mělo primární hodnocení vycházet z posouzení přítomnosti makulární perfúze a také z přítomnosti neovaskularizace.
6.2.1.3.1 Makulární perfúze
V případech s makulárním edémem a stále perfundovanou makulou je vhodné zahájit stejnou léčbu, jaká je nastíněna výše pro případy neischemické CRVO.
V případě neperfundované makuly je potřeba léčbu zahájit i tehdy, zůstává-li očekávání zlepšení zraku. ZO 6/60 a horší je však vždy spojena s vysokým stupněm makulární ischémie. Pokud tento stav trvá déle jak 2 měsíce, je předpoklad úpravy ZO velmi malý a léčba není tedy indikována.
6.2.1.3.2 Periferní nonperfúze
Pro ischemickou CRVO je obvykle charakteristická periferní retinální neperfúze vyšší než desetinásobek průměru terče ZN. Rozvoj oční neovaskularizace je přímo úměrný rozsahu neperfúze.
Případy s rozsáhlou retinální neperfúzí nebo s omezenou compliance lze považovat za kandidáty pro časnou panretinální fotokoagulaci (PRP) ve snaze zablokovat rozvoj oční neovaskularizace. V méně závažných případech může být postačující laserová léčba (scatter fotokoagulace) zaměřená na oblasti bez perfúze.
Kromě případné léčby makulárního edému je potřeba pacienty s ischemickou CRVO bez neovaskularizace sledovat nejméně jednou měsíčně a provádět vyšetření ZO, biomikroskopii, OCT a FAG (bude-li potřeba). Ve snaze detekovat rané známky neovaskularizace je rovněž vhodné posoudit rohovkový úhel a duhovku [95].
6.2.1.3.3 Vedení léčby neovaskularizace
6.2.1.3.3.1 Neovaskularizace předního segmentu
Vždy, je-li zjištěna neovaskularizace předního segmentu (neovaskularizace komorového úhlu anebo duhovky), přiklání se evidence-based medicína k provedení PRP. Především rozsah neovaskularizace předního segmentu (která si explicitně vyžaduje PRP) byl definován jako jakákoliv neovaskularizace úhlu anebo neovaskularizace duhovky odpovídající dvěma hodinám [8].
Dosud sice nebylo provedeno žádné randomizované klinické hodnocení kombinované léčby, je nicméně přiměřené podávat spolu s PRP intravitreální látku anti-VEGF, protože tento přístup může vést k rychlejší regresi neovaskularizace předního segmentu [96, 97]. Pokud jde o léčbu neovaskularizace předního segmentu pomocí monoterapie anti-VEGF, jsou prozatím k dispozici omezené zkušenosti [98].
6.2.1.3.3.2 Neovaskularizace zadního segmentu
Neovaskularizace zadního segmentu (neovaskularizace sítnice anebo terče zrakového nervu) se může vyvinout samostatně nebo ve spojení s neovaskularizací předního segmentu. Neovaskularizaci zadního segmentu lze nicméně léčit pomocí PRP, v souladu s výše uvedenými návrhy.
Jak je uvedeno výše, může se kombinovaná léčba pomocí anti-VEGF a PRP osvědčit jako užitečná při efektivní kontrole růstu neovaskularizace. Monoterapie ve formě intravitreální injekce látek anti-VEGF, jako je ranibizumab a bevacizumab, může vést k přechodné regresi oční neovaskularizace [90, 91].
Pacienty s pokročilou oční neovaskularizací je potřeba léčit pomocí PRP co nejdříve. Zejména u očí s krvácením do sklivcové dutiny se může kombinovaná léčba s látkami anti-VEGF osvědčit jako účinná při zástavě růstu oční neovaskularizace, což by zároveň umožnilo okamžitou aplikaci PRP během pár individuálních léčebných aplikací (pokud vitreální hemoragie není příliš hutná, což by si vyžadovalo vitrektomii a endolaserovou léčbu).
6.2.1.3.3.3 Neovaskulární glaukom
V případě zjištění neovaskulárního glaukomu bylo prokázáno, že intravitreálně podávaný neselektivní anti-VEGF preparát způsobuje regresi nových cév duhovky a pokles obstrukce úhlu. Z komparativních sérií případů vyplývá, že nové cévy duhovky mohou vykazovat rychlejší regresi po intravitreálním podání neselektivního anti-VEGF preparátu spolu s PRP než při samotné léčbě PRP. V těchto zprávách se rovněž udává možnost, že neselektivní anti-VEGF preparát může snižovat potřebu chirurgického zákroku, a že může sloužit jako užitečný doplněk filtrační chirurgické léčby. Alternativou je kombinovaná kryochirugická léčba (cyklokryokoagulace a panretinální kryokoagulace sítnice) [93].
6.2.1.4 Juvenilní CRVO
Juvenilní CRVO, která se vyskytuje u osob mladších 50 let, představuje podle všeho odlišnou entitu, pokud jde o patogenezi a klinický průběh, a je potřeba ji odlišit od CRVO, která se rozvíjí po dosažení věku 50 let. V některých případech, je-li onemocnění spojeno se závažnou systémovou chorobou, je potřeba stav pacienta řešit na základě kompletního systémového vyšetření a prognóza může být zhoršená.
Juvenilní CRVO je často neischemického typu, bez jakýchkoliv jasně identifikovatelných rizikových faktorů, a někdy souvisí se zánětlivou patogenezí, jak bylo prokázáno na základě detekce buněk sklivce [27]. Prognóza vývoje zraku je obecně lepší v porovnání s běžnou CRVO, i když možné komplikace zahrnují oční neovaskularizaci a rozvoj makulárního edému.
Existují určité průkazné materiály o tom, že k rychlejší úpravě nemoci mohou vést systémové steroidy. Není sice k dispozici žádné randomizované klinické hodnocení, je nicméně přijatelné předpokládat, že intraokulárně podávané steroidy, zejména intravitreální implantát dexametazonu s pomalým uvolňováním, nebo ranibizumabu se mohou osvědčit při léčbě makulárního edému při juvenilní CRVO.
Algoritmus léčby CRVO (tab. 1.)
Tab. 1. 
V případě intravitreálních injekcí je třeba provádět sledování nitroočního tlaku, šedého zákalu atd. 6.2.2 Vedení léčby okluze větve centrální sítnicové vény (BRVO)
6.2.2.1 Systémové rizikové faktory a klasifikace subtypů BRVO
Vedení léčby BRVO je v mnoha ohledech podobné léčbě CRVO, pokud jde o systémové rizikové faktory, zároveň ale vykazuje určité významné rozdíly, jelikož tento typ RVO představuje nižší riziko progresivního zhoršování ZO a konverze k ischémii a také nižší riziko neovaskularizace.
Léčba BRVO by se tudíž měla zaměřovat na několik aspektů, mezi něž patří: identifikace a zvládnutí systémových rizikových faktorů (konkrétně arteriální hypertenze, kardiovaskulárních chorob a diabetes mellitus); přesná klasifikace oblasti okluze pro určení, zda se jedná o okluzi hlavní větve nebo vedlejší větve (zejména makulární BRVO) obecně platí, že čím je místo okluze distálněji od terče, tím je lepší prognóza; posouzení stupně periferní perfuze a stupně makulární ischémie a dále zavedení léčby podle komplikací, které ohrožují zrak (hlavně perzistentní makulární edém a neovaskularizace).
Jak bylo popsáno výše, diagnóza BRVO je klinická. Ve sporných případech, zejména při malé okluzi může být pro potvrzení diagnózy provedena ještě FAG. FAG je zvlášť užitečná při stanovení rozsahu makulárního edému a ischémie. Ve studiích okluze větve centrální SV si přibližně 50 % neléčených očí s BRVO podrželo vidění 6/12 nebo lepší, zatímco u 25 % subjektů byl výsledek ≥ 6/60. Mezi dvě hlavní komplikace, které mohou vyžadovat léčbu, patří makulární edém a neovaskularizace sítnice nebo terče. Jak bylo prokázáno ve dvou nezávislých studiích, neovaskularizace sítnice se vyskytuje u 36 % očí s > 5 papilárních diametrů (DD) a u 62 % s > 4DD oblastí neperfúze [71,74].
6.2.2.2. Léčba neovaskularizace
Neovaskularizace terče nebo sítnice je indikací pro fotokoagulaci ischemické sítnice (sektorová fotokoagulace), ačkoli dostupné důkazy svědčí o tom, že čekání s laserovým zákrokem lze odložit do chvíle, než se objeví vitreální krvácení, které nemá na prognózu vidění nepříznivý vliv [71, 74]. Nové cévy se objevují pouze tehdy, když existuje alespoň kvadrant kapilárního uzávěru a obvykle se tak děje po šesti měsících od okluze. U pacientů s jedním nebo více kvadranty sítnicové ischémie jsou doporučeny kontrolní návštěvy v intervalu 3-4 měsíců. Nicméně panuje všeobecný názor, že při výskytu neovaskularizace sítnice nebo optického terče je vhodné provést sektorovou laserovou fotokoagulaci. Před laserovým zákrokem není vždy nutná fluorescenční angiografie, protože zóna ischémie je viditelná klinicky (obliterované cévy). Při horší compliance nebo nemožnosti monitorovat pacienta lze doporučit fotokoagulaci laserem v zónách kapilární neperfuze.
6.2.2.3 Léčba makulárního edému
6.2.2.3.1 BRVO s perfundovanou periferií a normální ZO
V případě BRVO s perfundovanou periferií a normální ZO je prognóza příznivá a je možné pouze monitorovat. V tomto případě není nutno doporučovat žádnou léčbu.
Při vyšetření během sledování je třeba hledat případný makulární edém a sice pomocí vyšetření ZO, biomikroskopie a OCT. V případě pochybností je vhodné provést FAG.
Během prvních tří měsíců je třeba pacienty sledovat jednou měsíčně, poté během prvního roku jednou za dva měsíce. Během tohoto období monitorace je třeba pacienty instruovat tak, aby se v případě zhoršení ZO rychle ohlásili.
V klinické praxi se setkáváme s případy, kdy přes přítomnost ME je dlouhodobě uchována dobrá ZO. Každý edém je však sám o sobě spojen s určitým stupně ischémie, resp. hypoxie. Makula je schopna nedostatek kyslíku tolerovat po určitou dobu a pak se zpravidla náhle dekompenzuje, což je provázeno dalším poklesem ZO, často již trvalého charakteru. To, jak dlouho bude makula schopna odolávat hypoxii, je velmi individuální – závisí to na mnoha faktorech: čím je ME vyšší, tím je zpravidla spojen s vyšším stupněm hypoxie a makula bude takovémuto stavu schopna odolávat kratší dobu, zvláště pokud není tendence k resorpci ME nebo ME se dokonce prohlubuje. Tam, kde jsou přítomny výkonné autoregulační mechanismy, tam může makula hypoxii odolávat velmi dlouho. S rostoucím věkem klesá výkonnost autoregulace jako projev přirozeného procesu stárnutí. Dekompenzace makuly je anatomicky provázena přechodem mikrocystických změn v makrocystické. Tyto změny lze detekovat pečlivou biomikroskopií, dnes jsou suverénně detekovatelné pomocí OCT vyšetření. Jde o zřetelný nástup strukturálních, ireverzibilních změn v makule. Někdy lze i biomikroskopicky dobře pozorovat hladinku krve na dně makrocysty. Jde o urgentní stav – pokud se nám nepodaří v krátké době dosáhnout resorpce cystoidního ME, tak se pokles ZO bude prohlubovat a zejména pokles ZO bude trvalý [20].
Shrnutí: u okluze větve centrální SV se ZO 6/12 a lepší je možno s terapií vyčkat, je nutno však stav na sítnici pečlivě monitorovat.
6.2.2.3.2 BRVO a symptomatický pokles VA
V případech BRVO a symptomatického poklesu VA je třeba provést vyšetření se zaměřením na možnou přítomnost makulárního edému. Jestliže OCT ukáže na přítomnost makulárního edému, je potřeba zvážit léčbu podle následujícího stručného popisu.
V roce 2011 byla publikována práce, která prokazuje, že vstupní ZO je zcela nezávislým prediktorem výsledné ZO [68]. Čím horší je ZO, tím horší je prognóza větvové okluze. Souvisí to se skutečností, že úroveň centrální ZO je velmi citlivým indikátorem kyslíkových poměrů v centrální krajině sítnice [20]. Stupeň hypoxie makuly pak koreluje s urgentností jakékoliv efektivní léčby. Na základě těchto znalostí existují 2 základní indikace léčby BRVO: (1) Časná léčba u prognosticky nepříznivé okluze, tj. při vstupní ZO 6/24 a horší. Čím dříve zahájíme léčbu, tím lépe – makula je stižena vysokým stupněm hypoxie, kdy rozvoj strukturálních změn v centrální krajině sítnice spojený s trvalou poruchou ZO často nastupuje dosti rychle. Lze připustit okamžitou léčbu u okluze s inciální ZO 6/18. (2) Mikrocystické změny v makule přecházejí do makrocystických. Jde o zřetelný nástup strukturálních, ireverzibilních změn v makule. Tato indikace platí i pro ZO 6/6 [20].
6.2.2.3.3 Terapeutické přístupy v léčbě makulárního edému u BRVO
6.2.2.3.3.1.Techniky laserová fotokoagulace
V současné době se používají 2 techniky laserové fotokoagulace – všeobecně rozšířená mřížková (grid) fotokogulace, která je všeobecně uznávaných standardem a všechny ostatní nové léčebné přístupy by měly být s tímto standardem srovnány s jasným závěrem zda nový přístup přináší lepší výsledky či nikoliv. Druhou technikou laserové fotokogulace je arteriolární konstrikce.
6.2.2.3.3.1.1 Mřížková (grid) laserová fotokoagulace
Mřížková laserová fotokoagulace je již řadu let standardem péče a doporučuje se u pacientů s makulárním edémem souvisejícím s okluzí větve centrální vény, kteří splňují kritéria způsobilosti BVO SG (ZO 6/12 nebo nižší, perzistentní makulární edém trvající čtyři měsíce nebo déle a dále resorpce makulární hemoragie). Jednalo se o multicentrické, randomizované, kontrolované klinické hodnocení, které bylo navrženo tak, aby umožňovalo řešit otázky ohledně vedení léčby komplikací při okluzi větve centrální vény [70, 71]. Mřížkovou fotokopagulaci je možno opakovat 1x za 4 měsíce. Pacienti se závažnou ztrátou zrakové ostrosti (méně než 6/60) a pacienti, u nichž se symptomy vyskytovaly více než jeden rok, nebudou mít pravděpodobně z fotokoaguace prospěch [75].
Mřížková fotokoagulace však není vhodnou technikou pro hemodynamicky závažné, hemoragické okluze, které jsou téměř vždy spojeny s nízkou úrovní ZO, a tedy vysokým stupněm makulární ischémie. Fotokogulace hemoragické sítnice je všeobecně považována za kontraindikovanou pro vznik hyperkoagulačních lézí a vysokým rizikem vzniku epiretinální membrány a následnou trakcí do makuly [20].
6.2.2.3.3.1.2 Arteriolární konstrikce (tzv. crimping technique)
Tuto techniku popsal poprvé v roce 1975 L’Esperance (tzv. crimping technique). Autor předpokládá, že fungování této techniky je založeno na poklesu arteriálního tlaku v okludovaném regionu a následném zlepšení drenáže ME v důsledku redukce přítoku do místa okluze [114]. V roce 1984 použil Jalkh vlastní modifikaci arteriolární kontsrikce (AKo) v léčbě chronického ME u 41 očí. Jeho modifikace spočívá v aplikaci splývajících koagulačních lézí podél arterioly, která zásobuje oblast sítnice s ME [115]. V roce 1993 byla Řehákem popsána modifikace AKo, která spočívá v aplikaci splývajících koagulačních bodů přímo přes přívodní arteriolu [116]. Rozsah výkonu na arteriole závisí na závažnosti okluze a na druhé straně je limitován možností nalézt úsek arterioly, který není překryt hemoragií, resp. kde není v těsné blízkosti hemoragie. Konstrikci je možné provést i mimo oblast okluze, musí však jít o arteriolu, která zásobuje okludovanou oblast. Další zprávy o použití této techniky v zahraniční literatuře jsou ojedinělé: Erdol and Akyol v roce 2000 dosáhli lepších výsledků ve skupině, kdy kombinovali mřížkovou fotokoagulaci a AKo oproti prosté mřížkové fotokoagulaci, avšak rozdíl nebyl statisticky významný [117].
AKo je vhodnou technikou pro léčbu hemodynamicky závažných okluzí s rozsáhlými retinálními hemoragiemi a vysokou makulární ischémií (špatná vstupní ZO). Není však doposud k dispozici práce s dostatečnou evidencí efektivity tohoto přístupu.
6.2.2.3.3.2. Intravitreálně aplikovaná léčiva
6.2.2.3.3.2.1 Intravitreální steroidy
6.2.2.3.3.2.1.1 Triamcinolon acetonid (TRIVARIS)
Klinická studie SCORE dokumentovala, že u pacientů s BRVO má laserový zákrok příznivější poměr prospěchu a rizika než triamcinolon acetonid (TRIVARIS).
6.2.2.3.3.2.1.2 Biologicky odbouratelné implantáty s dexametazonem
V klinické studii GENEVA s biologicky odbouratelným implantátem dlouhodobě uvolňujícím dexamethazon (Ozurdex) prokázala dvě identická, randomizovaná, prospektivní, multicentrická, maskovaná klinická hodnocení fáze III, s falešnou kontrolou a paralelními skupinami, statisticky významný účinek a rychlé působení, kdy maximální efekt byl dosažen k 60. dni a jeho pokles začínal v 90. den, přesto ale přetrvával ještě k 180. dni. Druhá injekce byla dokonce mírně účinnější než první. S podáním injekce nebyly spojeny žádné nežádoucí příhody, výskyt šedého zákalu byl velmi nízký a stejně tak byl velmi nízký výskyt perzistentního nárůstu nitroočního tlaku.
Podíl pacientů, kteří dosáhli zlepšení ZO alespoň o 15 písmen nebo 10 písmen od počátku, byl významně vyšší ve skupině s dexametazonem 700 mg než ve skupině s falešnou léčbou, a sice od 30. do 90. dne. Nejvyšší reakce byla pozorována v 60. den.
Na základě novější analýzy výsledků studie GENEVA [60] bylo zjištěno, že léčba makulárního edému při BRVO krátkého trvání má lepší efekt než oddálení léčby. Procento snížené naděje na zlepšení o 15 písmen při léčbě v 180. den bylo 54 %, jestliže edém trval 6 měsíců, 32 % jestliže trval 3 měsíce, a konečně 12 %, jestliže trval 1 měsíc. Ozurdex je považován za efektivní léčbu BRVO.
6.2.2.3.3.2.2 Anti-VEGF preparáty
Ranibizumab
je neselektivní blokátor VEGF (Lucentis), jehož účinnost byla prokázána na základě klinického hodnocení BRAVO.
Ve studii BRAVO [94] došlo v 6. měsíci u 55 % pacientů, kteří dostávali Lucentis v dávce 0,3 mg, a dále u 61 % pacientů, kteří dostávali Lucentis v dávce 0,5 mg, ke zlepšení zraku o 15 písmen nebo více, v porovnání s 29 % pacientů, kteří dostávali falešné injekce a u nichž bylo provedeno laserové ošetření mřížkovou fotokoagulací.
V 6. měsíci, při průměru 5,7 injekcí během prvních šesti měsíců, činilo střední zlepšení zraku 16,6 a 18,3 písmen (0,3 a 0,5 mg), v porovnání se 7,3 písmeny ve skupině s falešnou léčbou. Od 3. do 5. měsíce byla ovšem ve všech studijních ramenech povolena jednorázová aplikace laserové fotokoagulace jako záchranné léčby.
Od 6. do 12. měsíce byli pacienti léčeni otevřeným způsobem pro re nata. Prospěšný účinek na zrak byl zachován při středním počtu 2,7 dalších injekcí během druhých šesti měsíců. Přínos byl zjištěn také u pacientů ve skupině s falešnou léčbou, i když míra zlepšení zraku nedosáhla hodnot jako u pacientů, kteří léčbu dostávali od počátku. Více než polovina pacientů v klinickém hodnocení BRAVO měla makulární edém krátkého trvání (51,5-53,8 %).
Ranibizumab je považován za efektivní léčbu BRVO.
6.2.2.3.3.2.2.2 Bevacizumab
V současné době stále více údajů z krátkodobých studií podporuje fakt, že opakované intravitreální injekce bevacizumabu snižují makulární edém, který se vyskytuje jako projev okluze sítnicové žíly, a to i u pacientů, u kterých selhala předchozí léčba laserem [95–99]. Nejběžnější dávkovací režim je dvě až tři injekce v průběhu prvních 5–6 měsíců.
K hodnocení dlouhodobé účinnosti a bezpečnosti intravitreálně podávaného bevacizumabu jsou ovšem potřeba další randomizované kontrolované studie. V současnosti nemůže být vydáno žádné doporučení ohledně intravitreálního podání bevacizumabu.
Pegaptanib
První multicentrická randomizovaná studie zabývající se účinkem léčby anti-VEGF při léčbě RVO byla navržena tak, aby umožňovala posoudit účinnost sodné soli pegaptanibu.
Ve skupině léčené sodnou solí pegaptanibu v dávce 1 mg byl zjištěn vyšší výskyt zlepšení o 5 písmen nebo více a nižší výskyt zhoršení o 15 písmen nebo více než v kontrolní skupině (p<0,05, resp. p<0,01) [100].
Pegaptanib je selektivní blokátor anti-VEGF165 - Macugen®, Pfizer, pro který nebyla udělena licence pro použití v indikaci okluze sítnicové vény (off label léčba).
6.2.2.3.3.3 Kritéria pro opakovanou léčbu
- 1. Indikační kritéria pro opakovanou léčbu odpovídají SPC jednotlivých léčebných prostředků.
Léčba je vysazena na základě rozhodnutí lékaře (viz níže)
- 2. Měla by být zvážena opakovaná léčba modifikovanou mřížkovou laserovou fotokoagulací v intervalech jednou za 4 měsíce
6.2.2.3.3.4 Přerušení léčby
- Léčbu je možné přerušit při trvalém poškození zraku nebo morfologie makuly.
- Kritéria pro přerušení léčby jsou:
- a. Důkaz, že z léčby není prospěch, např. trvalé zhoršení/nedosažení stabilizace zraku i přes dvě po sobě následující návštěvy.
- Vzestup nitroočního tlaku, který nedostatečně reaguje na léčbu účinným lékem na snížení nitroočního tlaku.
Algoritmus léčby BRVO (tab. 2.)
Tab. 2. 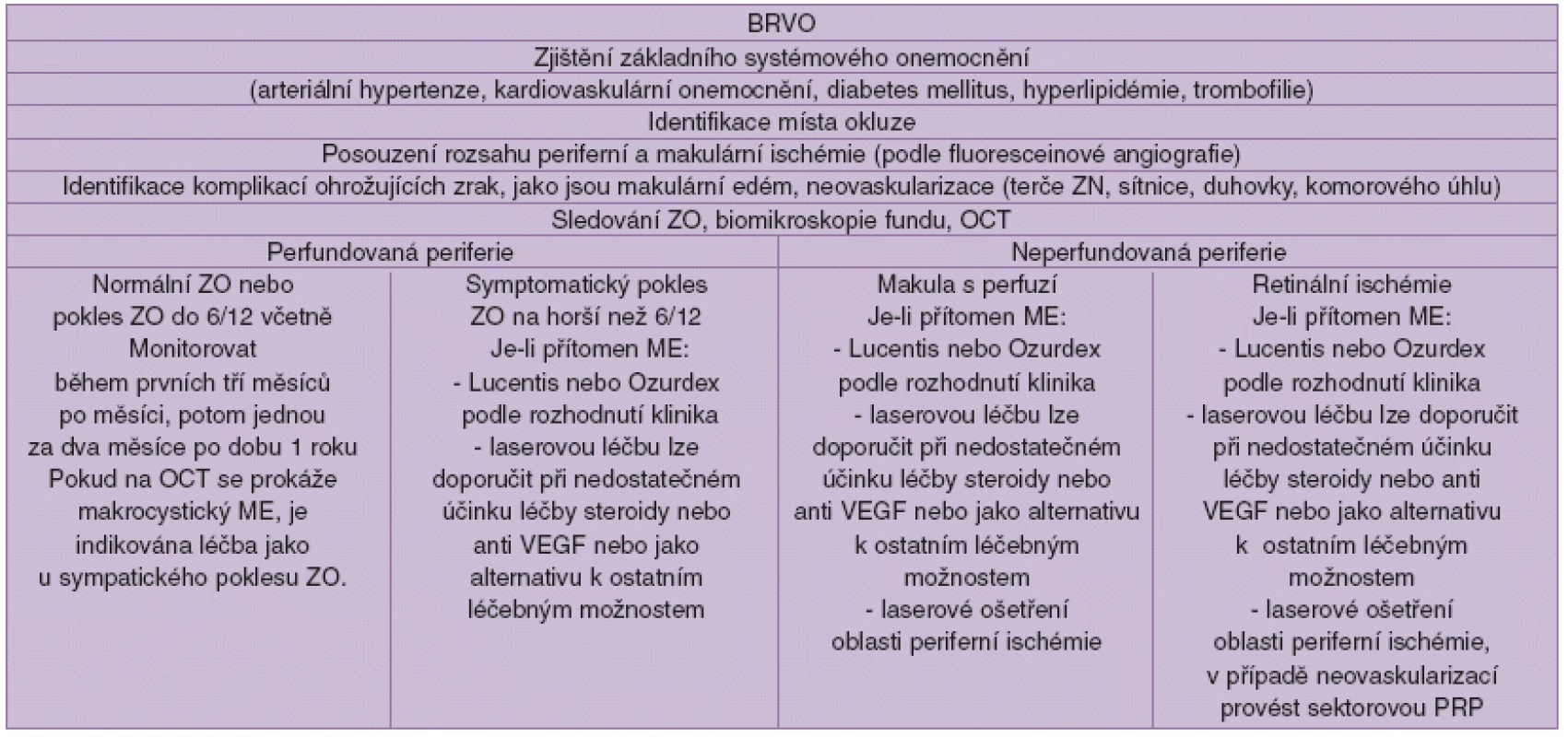
V případě intravitreálních injekcí je třeba provádět sledování nitroočního tlaku, šedého zákalu atd. 6.2.3. Algoritmus při okluzi hemisférické žíly
- Léčba okluze hemisférické žíly je podobná jako léčba okluze větve sítnicové žíly. Zejména makulární edém v důsledku okluze hemisférické žíly je léčený podobně jako BRVO.
- Riziko rubeózy u ischemické okluze hemicentrální žíly je větší než u BRVO, ale menší než u CRVO. Je tedy indikováno vyšetření na neovaskularizaci předního segmentu, včetně gonioskopie. Léčba neovaskularizace duhovky nebo komorového úhlu je stejná jako u CRVO.
7. Závěr
Doporučené postupy pro diagnostiku a léčbu pacientů s venózní okluzí sítnice obsahují postupy péče o nemocné s uzávěrem sítnicových žil, které jsou doporučené Českou vitreoretinální společností a schválené Českou oftalmologickou společností.
Zdroje
1. Hayreh SS: Occlusion of the central retinal vessels. Br J Ophthalmol 1965; 49 : 626–645.
2. Hayreh SS, Rojas P, Podhajsky P, Montague P, Woolson RF: Ocular neovascularization with retinal vascular occlusion. 3. Incidence of ocular neovascularization with retinal vein occlusion. Ophthalmology 1983; 90 : 488–506.
3. Hayreh SS, Klugman MR, Beri M, Kimura AE, Podhajsky P: Differentiation of ischemic from non-ischemic central retinal vein occlusion during the early acute phase. Graefes Arch Clin Exp Ophthalmol 1990; 228 : 201–217.
4. Hayreh SS: Retinal vein occlusion. Indian J Ophthalmol 1994; 42 : 109–132.
5. Coscas G, Dhermy P: Occlusions veineuses rétiniennes. Paris, Masson, 1978, pp 283–346.
6. Coscas G, Gaudric A: Natural course of nonaphakic cystoid macular edema. Surv Ophthalmol 1984; 28(suppl):471 –484.
7. Central Vein Occlusion Study Group: Baseline and early natural history report: the Central Vein Occlusion Study. Arch Ophthalmol 1993; 111 : 1087–1095.
8. Central Vein Occlusion Study Group: A randomized clinical trial of early panretinal photocoagulation for ischemic central vein occlusion: the Central Vein Occlusion Study Group N Report. Ophthalmology 1995; 102 : 1434–1444.
9. Frangieh GT, Green WR, Barraquer-Somers E, Finkelstein D: Histopathologic study of nine branch retinal vein occlusions. Arch Ophthalmol 1982; 100 : 1132 – 1140.
10. Duker JS, Brown GC: Anterior location of the crossing artery in branch retinal vein obstruction. Arch Ophthalmol 1989; 107 : 998–1000.
11. Zhao J, Sastry SM, Sperduto RD, Chew EY, Remaley NA: Arteriovenous crossing patterns in branch retinal vein occlusion. Ophthalmology 1993; 100 : 423 – 428.
12. Christoffersen NL, Larsen M: Pathophysiology and hemodynamics of branch retinal vein occlusion. Ophthalmology 1999; 106 : 2054–2062.
13. Rogers S, McIntosh RL, Cheung N, Lim L, Wang JJ, Mitchell P, Kowalski JW, Nguyen H, Wong TY, International Eye Disease consortium: The prevalence of retinal vein occlusion: pooled data from population studies from the United States, Europe, Asia, and Australia. Ophthalmology 2010; 117 : 313–319.
14. Green WR, Chan CC, Hutchins GM, Terry JM: Central retinal vein occlusion: a prospective histopathologic study of 29 eyes in 28 cases. Trans Am Ophthalmol Soc 1981; 79 : 371–422.
15. Green WR: Retina; in Spencer WH (ed): Ophthalmic Pathology. An Atlas and Textbook, ed 3. Philadelphia, WB Saunders, 1985, p 589.
16. Janssen MC, den Heijer M, Cruysberg JR, Wollersheim H, Bredie SJ: Retinal vein occlusion: a form of venous thrombosis or a complication of atherosclerosis? A metaanalysis of thrombophilic factors. Thromb Haemost 2005; 93 : 1021–1026.
17. Central Retinal Vein Occlusion Study Group: Natural history and clinical management of central retinal vein occlusion. Arch Ophthalmol 1997; 115 : 486 – 491.
18. Jonas J, Paques M, Monés J, Glacet-Bernard A, Coscas G: Retinal vein occlusions. Dev Ophthalmol 2010; 47 : 111–135.
19. Fejfar, Z., Přerovský, I.: Patofyziologie krevního oběhu. Avicenum, Praha, 1980 : 359-386.
20. Řehák J, Rehák M et al.: Venózní okluze sítnice, Grada publishing, 2011.
21. Haymore JG, Mejico LJ: Retinal vascular occlusion syndromes. Int Ophthalmol Clin 2009; 49 : 63–79.
22. Hayreh SS, Zimmerman M, Podhajsky P: Incidence of various types of retinal vein occlusion and their recurrence and demographic characteristics. Am J Ophthalmol 1994; 117 : 429–441.
23. Williamson TH: Central retinal vein occlusion: what’s the story? Br J Ophthalmol 1977;81 : 698–704.
24. Hayreh SS, Zimmerman B, McCarthy MJ, Podhajsky P: Systemic diseases associated with various types of retinal vein occlusion. Am J Ophthalmol 2001; 131 : 61–77.
25. Recchia FM, Brown GC: Systemic disorders associated with retinal vascular occlusion. Curr Opin Ophthalmol 2000; 11 : 462–467.
26. Yau JW, Lee P, Wong TY, Best J, Jenkins A: Retinal vein occlusion: an approach to diagnosis, systemic risk factors and management. Intern Med J 2008; 38 : 904–910.
27. Dodson PM, Kritzinger EE: Underlying medical conditions in young patients and ethnic differences in retinal vein occlusion. Trans Ophthalmol Soc UK 1985; 104 : 114–119.
28. Dodson PM, Kritzinger EE: Medical cardiovascular treatment trials: relevant to medical ophthalmology in 1997 ? Eye (Lond) 1997; 11(pt 1):3–11.
29. Eye Disease Case-Control Study Group: Risk factors for central retinal vein occlusion. Arch Ophthalmol 1996; 114 : 545–554.
30. di Capua M, Coppola A, Albisinni R, Tufano A, Guida A, di Minno MN, Cirillo F, Loffredo M, Cerbone AM: Cardiovascular risk factors and outcome in patients with retinal vein occlusion. J Thromb Thrombolysis 2010; 30 : 16–22.
31. Dodson PM, Galton DJ, Hamilton AM, Blach RK: Retinal vein occlusion and the prevalence of lipoprotein abnormalities. Br J Ophthalmol 1982; 66 : 161–164.
32. Eye Disease Case-Control Study Group: Risk factors for branch retinal vein occlusion. Am J Ophthalmol 1993; 116 : 286–296.
33. Dodson PM, Kritzinger EE, Clough CG: Diabetes mellitus and retinal vein occlusion in patients of Asian, West Indian and White European origin. Eye (Lond) 1992; 6 : 66–68.
34. Lim LL, Cheung N, Wang JJ, Islam FM, Mitchell P, Saw SM, Aung T, Wong TY: Prevalence and risk factors of retinal vein occlusion in an Asian population. Br J Ophthalmol 2008; 92 : 1316–1319.
35. O’Mahoney PR, Wong DT, Ray JG: Retinal vein occlusion and traditional risk factors for atherosclerosis. Arch Ophthalmol 2008; 126 : 692–699.
36. Prisco D, Marcucci R, Bertini L, Gori AM: Cardiovascular and thrombophilic risk factors for central retinal vein occlusion. Eur J Intern Med 2002; 13 : 163–169.
37. Salaun N, Delyfer MN, Rougier MB, Korobelnik JF: Evaluation du bilan étiologique des occlusions veineuses rétiniennes du sujet Čgé de moins de 60 ans. J Fr Ophthalmol 2007; 20 : 918–923.
38. Shrestha RK, Shrestha JK, Koirala S, Shah DN: Association of systemic diseases with retinal vein occlusive disease. JNMA J Nepal Med Assoc 2006; 45 : 244–248.
39. Sodi A, Giambene B, Marcucci R, Sofi F, Fedi S, Abbate R, Prisco D, Menchini U: Atherosclerotic and thrombophilic risk factors in patients with ischemic central retinal vein occlusion. Retina 2010, E-pub ahead of print.
40. Wang S, Xu L, Jonas JB, Wong TY, Cui T, Li Y, Wang YX, You QS, Yang H, Sun C: Major eye diseases and risk factors associated with systemic hypertension in an adult Chinese population: the Beijing Eye Study. Ophthalmology 2009; 116 : 2373–2380.
41. Yasuda M, Kiyohara Y, Arakawa S, Hata Y, Yonemoto K, Doi Y, Iida M, Ishibashi T: Prevalence and systemic risk factors for retinal vein occlusion in a general Japanese population: the Hisayama study. Invest Ophthalmol Vis Sci 2010; 51 : 3205–3209.
42. Elman MJ, Bhatt AK, Quinlan PM, Enger C: The risk for systemic vascular diseases and mortality in patients with central retinal vein occlusion. Ophthalmology 1990; 97 : 1543-1548.
43. Mitchell P, Smith W, Chang A: Prevalence and associations of retinal vein occlusion in Australia: the Blue Mountains Eye Study. Arch Ophthalmol 1996; 114 : 1243–1247.
44. Rath EZ, Frank RN, Shin DH, Kim C: Risk factors for retinal vein occlusions: a case-control study. Ophthalmology 1992; 99 : 509-514.
45. Sofi F, Marcucci R, Fedi S, Giambene B, Sodi A, Menchini U, Gensini GF, Abbate R, Prisco D: High lipoprotein(a) levels are associated with an increased risk of retinal vein occlusion. Atherosclerosis 2010; 210 : 278–281.
46. Stojakovic T, Scharnagl H, März W, Winkelmann BR, Boehm BO, Schmut O: Low density lipoprotein triglycerides and lipoprotein (a) are risk factors for retinal vascular occlusion. Clin Chim Acta 2007; 382 : 77–81.
47. Turello M, Pasca S, Daminato R, dello Russo P, Giacomello R, Venturelli U, Barillari G: Retinal vein occlusion: evaluation of ‘classic’ and ‘emerging’ risk factors and treatment. J Thromb Thrombolysis 2010; 29 : 459–464.
48. Rehak M, Krcova V, Slavik L, Fric E, Langova K, Ulehlova J, Rehak J: The role of thrombophilia in patients with retinal vein occlusion and no systemic risk factors. Can J Ophthalmol 2010; 45 : 171–175.
49. Kuhli-Hattenbach C, Scharrer I, Lüchtenberg M, Hattenbach LO: Coagulation disorders and the risk of retinal vein occlusion. Thromb Haemost 2010; 103 : 299–305.
50. Lahey JM, Tunć M, Kearney J, Modlinski B, Koo H, Johnson RN, Tanaka S: Laboratory evaluation of hypercoagulable states in patients with central retinal vein occlusion who are less than 56 years of age. Ophthalmology 2002; 109 : 126–131.
51. Larsson J, Hillarp A, Ólafsdóttir E, Bauer B: Activated protein C resistance and anticoagulant proteins in young adults with central retinal vein occlusion. Acta Ophthalmol Scand 1999; 77 : 634–637.
52. Fegan CD: Central retinal vein occlusion and thrombophilia. Eye (Lond) 2002; 16 : 98–106.
53. Bertram B, Remky A, Arend O, Wolf S, Reim M: Protein C, protein S, and antithrombin III in acute ocular occlusive diseases. Ger J Ophthalmol 1995; 4 : 332–335.
54. Ciardella AP, Yannuzzi LA, Freund KB, DiMichele D, Nejat M, de Rosa JT, Daly JR, Sisco L: Factor V Leiden, activated protein C resistance, and retinal vein occlusion. Retina 1998; 18 : 308–315.
55. Cruciani F, Moramarco A, Curto T, Labate A, Recupero V, Conti L, Gandolfo GM, Balacco Gabrieli C: MTHFR C677T mutation, factor II G20210A mutation and factor V Leiden as risk factors for youth retinal vein occlusion. Clin Ter 2003; 154 : 299–303.
56. Glacet-Bernard A, les Jardins GL, Lasry S, Coscas G, Soubrane G, Souied E, Housset B: Obstructive sleep apnea among patients with retinal vein occlusion. Arch Ophthalmol 2010; 128 : 1533 –1538.
57. Quinlan PM, Elman MJ, Bhatt AK, Mardesich P, Enger C: The natural course of central retinal vein occlusion. Am J Ophthalmol. 1990; 100 : 118-123.
58. McIntosh RL, Rogers SL, Lim L, Cheung N, Wang JJ, Mitchell P, Kowalski JW, Nguyen HP, Wong TY: Natural history of central retinal vein occlusion: an evidence-based systematic review. Ophthalmology 2010; 117 : 1094–1123.
59. Scott IU, VanVeldhuisen PC, Oden NL, Ip MS, Blodi BA, Jumper JM, Figueroa M, SCORE Study Investigator Group: SCORE Study report 1: baseline associations between central retinal thickness and visual acuity in patients with retinal vein occlusion. Ophthalmology 2009; 116 : 504-512.
60. Haller JA, Bandello F, Belfort R Jr, Blumenkranz MS, Gillies M, Heier J, Loewenstein A, Yoon YH, Jacques ML, Jiao J, Li XY, Whitcup SM: OZURDEX GENEVA Study Group: randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with macular edema due to retinal vein occlusion. Ophthalmology 2010; 117 : 1134 –1146.
61. Chen JC, Klein ML, Watzke RC et al.: Natural course of perfused CRVO. Can. J. Opthalmol. 1995, 30, 2124.
62. Ramezani A, Entezari M, Moradian S, Tabatabaei H, Kadkhodaei S: Intravitreal triamcinolone for acute central retinal vein occlusion: a randomized clinical trial. Graefes Arch Clin Exp Ophthlamol 2006; 244 : 1601–1606.
63. Tewari HK, Lemtor MT, Azad RV, Verma L: Argon laser photocoagulation in acute central retinal vein occlusion. Afro-Asian J Ophthalmol 1995; 13 : 88–91.
64. Cugati S, Wang JJ, Rochtchina E, Mitchell P: Ten-year incidence of retinal vein occlusion in an older population: the Blue Mountains Eye Study. Arch Ophthalmol 2006; 124 : 726–732.
65. Fong ACO, Shatz H: Central retinal vein occlusion in young adults. Surv Ophthalmol 1993; 37 : 393–417.
66. Orth DH, Patz A: Retinal branch vein occlusion. Surv Ophthalmol 1978; 22 : 357–376.
67. Walters RF, Spalton DJ: Central retinal vein occlusion in people aged 40 years or less: a review of 17 patients. Br J Ophthalmol 1990; 74 : 30–35.
68. Rehak J, Dusek L, Chrapek O, Fric E, Rehak M: Initial visual acuity is an important prognostic factor in patients with branch retinal vein occlusion. Opthalmic Res. 2011;45 : 204-209.
69. Rogers SL, McIntosh RL, Lim L, Mitchell P, Cheung N, Kowalski JW, Nguyen HP, Wang JJ, Wong TY: Natural history of branch retinal vein occlusion: an evidence-based systematic review. Ophthalmology 2010; 117 : 1094–1101e5.
70. Branch Vein Occlusion Study Group: Argon laser photocoagulation for macular edema in branch vein occlusion. Am J Ophthalmol 1984; 98 : 271–282.
71. Branch Vein Occlusion Study Group: Argon laser scatter photocoagulation for prevention of neovascularization and vitreous hemorrhage in branch vein occlusion: a randomized clinical trial. Arch Ophthalmol 1986; 104 : 34–41.
72. Clemett RS, Kohner EM, Hamilton AM: The visual prognosis in retinal branch vein occlusion. Trans Ophthalmol Soc UK 1973; 93 : 523–535.
73. Michels RG, Gass JD: The natural course of retinal branch vein obstruction. Trans Am Acad Ophthalmol Otolaryngol 1974; 78 : 166–177.
74. Shilling JS, Kohner EM: New vessel formation in retinal branch vein occlusion. Br J Ophthalmol 1976; 60 : 810–815.
75. Shilling JS, Jones CA: Retinal branch vein occlusion: a study of argon laser photocoagulation in the treatment of macular oedema. Br J Ophthalmol 1984; 68 : 196–198.
76. Murakami T, Takagi H, Ohashi H, Kita M, Nishiwaki H, Miyamoto K, Watanabe D, Sakamoto A, Yamaike N, Yoshimura N: Role of posterior vitreous detachment induced by intravitreal tissue plasminogen activator in macular edema with central retinal vein occlusion. Retina 2007; 27 : 1031–1037.
77. Royal College of Ophthalmologists: Interim guidelines for management of retinal vein occlusion: December 2010. 2010.
78. Řehák J, Chrapek O: Venózní okluze sítnice in Rozsíval P: Trendy soudobé oftalmologie sv. 2, Galén 2005 : 73-98
79. Rehák M, Řehák J, Fric E, Bábková B, Prachařová Z: Warfarin v léčbě kmenové okluze centrální sítnicové vény. 9. Vejdovského olomoucký vědecký den, sborník abstrakt
80. Hayreh SS: Management of central retinal vein occlusion. Ophthalmologica 2003; 217 : 167–188.
81. Shroff D, Mehta DK, Arora R, Narula R, Chauhan D: Natural history of macular status in recent-onset branch retinal vein occlusion: an optical coherence tomography study. Int Ophthalmol 2008; 28 : 261–268.
82. Coscas G, Coscas F, Vismara S, Zourdani A, Li Calzi C: Bright hyper-reflective spots and dense zones; in Coscas G (ed): Optical Coherence Tomography in Age-Related Macular Degeneration. Heidelberg, Springer, 2009, chapt 7, pp 159–167.
83. Hirota A, Mishima HK, Kiuchi Y: Incidence of retinal vein occlusion at the Glaucoma Clinic of Hiroshima University. Ophthalmologica 1997; 211 : 288–291.
84. Brown DM, Campochiaro PA, Singh RP, Li Z, Gray S, Saroj N, Rundle AC, Rubio RG, Murahashi WY, CRUISE Investigators: Ranibizumab for macular edema following central retinal vein occlusion: six-month primary end point results of a phase III study. Ophthalmology 2010; 117 : 1124–1133e1.
85. Ferrara DC, Koizumi H, Spaide RF: Early bevacizumab treatment of central retinal vein occlusion. Am J Ophthalmol 2007; 144 : 864–871.
86. Figueroa MS, Contreras I, Noval S, Arruabarrena C: Results of bevacizumab as the primary treatment for retinal vein occlusion. Br J Ophthalmol 2010; 94 : 1052–1056.
87. Wroblewski JJ, Wells JA 3rd, Adamis AP, Buggage RR, Cunningham ET Jr, Goldbaum M, Guyer DR, Katz B, Altaweel MM: Pegaptanib in Central Retinal Vein Occlusion Study Group: pegaptanib sodium for macular edema secondary to central retinal vein occlusion. Arch Ophthalmol 2009; 127 : 374–380.
88. Kinge B, Stordahl PB, Forsaa V, Fossen K, Haugstad M, Helgesen OH, Seland J, Stene-Johansen I: Efficacy of ranibizumab in patients with macular edema secondary to central retinal vein occlusion: results from the sham-controlled ROCC study. Am J Ophthalmol 2010; 150 : 310-314.
89. Browning DJ, Scott AQ, Peterson CB, Warnock J, Zhang Z: The risk of missing angle neovascularization by omitting screening gonioscopy in acute central retinal vein occlusion. Ophthalmology 1998; 105 : 776–784.
90. Beutel J, Peters S, Lüke M, Aisenbrey S, Szurman P, Spitzer MS, Yoeruek E, Bevacizumab Study Group, Grisanti S: Bevacizumab as adjuvant for neovascular glaucoma. Acta Ophthalmol 2010; 88 : 103–109.
91. Moraczewski AL, Lee RK, Palmberg PF, Rosenfeld PJ, Feuer WJ: Outcomes of treatment of neovascular glaucoma with intravitreal bevacizumab. Br J Ophthalmol 2009; 93 : 589–593.
92. Parodi MB, Friberg TR, Pedio M, Fiotti N, di Stefano G, Ravalico G: Panretinal photocoagulation and photodynamic therapy for anterior segment neovascularization secondary to ischemic central retinal vein occlusion. Ophthalmic Surg Lasers Imaging 2007; 38 : 94–99.
93. Řehák J, Vymazal M: Kryotherapie zur Behandlung der neovascularen Glaukome mit verschlossenem Kamerwinkel. Klin. Mbl. Augenheilkd. 1994; 204 : 20-23.
94. Campochiaro PA, Heier JS, Feiner L, Gray S, Saroj N, Rundle AC, Murahashi WY, Rubio RG, BRAVO Investigators: Ranibizumab for macular edema following branch retinal vein occlusion: six-month primary end point results of a phase III study. Ophthalmology 2010; 117 : 1102–1112.
95. Prager F, Michels S, Kriechbaum K, Georgopoulos M, Funk M, Geitzenauer W, Polak K, Schmidt-Erfurth UM: Intravitreal bevacizumab (Avastin(R)) for macular edema secondary to retinal vein occlusion – twelvemonth results of a prospective clinical trial. Br J Ophthalmol 2009; 93 : 452-456.
96. Hoeh AE, Ach T, Schaal KB, Scheuerle AF, Dithmar S: Long-term follow up of OCT guided bevacizumab treatment of macular edema due to retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol 2009; 47 : 1635-1641.
97. Rensch F, Jonas JB, Spandau UH: Early Intravitreal Bevacizumab for Non-Ischaemic Branch Retinal Vein Occlusion. Ophthalmologica 2008; 223(2):124-127.
98. Russo V, Barone A, Conte E, Prascina F, Stella A, Delle Noci N: Bevacizumab compared with macular laser grid photocoagulation for cystoid macular edema in branch retinal vein occlusion. Retina 2009;29 : 511-515.
99. Kriechbaum K, Michels S, Prager F et al.: Intravitreal Avastin for macular oedema secondary to retinal vein occlusion: a prospective study. Br J Ophthalmology 2008; 92(4):518-522.
100. Wroblewski JJ, John JA, Gonzales CR: Pegaptanib sodium for macular edema secondary to branch retinal vein occlusion. Am J Ophthalmol 2010; 149 : 147-154
101. Gutman FA, Zegarra H, Zakov ZN: The natural course of temporal retinal vein.
102. Trans. Amer Acad Opthalmol Otolaryngol 1974; 78 : 178-192.
103. Demeler U: Management of retinal venous occlusion. Opthalmologica (Basel) 1980; 180 : 61-67.
104. Magargal LE, Sanborn GE, Kimmel AS, Annesley WH: Temporal branch retinal vein obstruction: A review. Opthal Surg 1986; 17 : 240-246.
105. Finkelstein D: Argon laser photocoagulation for macular edema in branch retinal vein occlusion. Ophthalmology 1986; 93 : 975-977.
106. Finkelstein D: Ischemic macular edema: Recognition and favorable natural history in branch vein occlusion. Arch Ophthalmol 1992; 110 : 1427–1434.
107. Rehak J, Rehak M: Branch retinal vein occlusion: pathogenesis, visual prognosis, and treatment modalities. Curr Eye Res 2008; 33 : 111–131.
108. Morse PH: Prospective rationale for and results of argon laser treatment of patients with branch retinal vein occlusion. Annals Ophthalmol 1985; 17 : 565-571
109. Noma H, Funatsu H, Yamasaki M. et al: Pathogenesis of macular edema with branch retinal vein occlusion and intraocular levels of vascular endothelial growth factor and interleukin-6. Am J Ophthalmol 2005; 140 : 256-261.
110. Rehák M, Hollborn M, Iandiev I, et al: Retinal gene expression and Müller cell responses after branch retinal vein occlusion in the rat. Invest Ophthalmol Vis Sci 2009; 50 : 2359-2367.
111. Goebel W, Kretzchmar-Gross T: Retinal thickness in diabetic retinopathy: a study using optical coherence tomography (OCT). Retina 2002; 22 : 759–767.
112. Diabetic Retinopathy Clinical Research Network: Relationship between optical coherence tomography-measured central retinal thickness and visual acuity in diabetic macular edema. Ophthalmology 2007; 114 : 525–536.
113. Scott IU, Van Veldhuisen PC, Oden NL, Ip, MS, Blodi BA, Jumper JM, Figueroa M, SCORE Study Investigator Group: SCORE study report 1: baseline associations between central retinal thickness and visual acuity in patients with retinal vein occlusion. Ophthalmology 2009; 116 : 504–512.
114. Ota M, Tsujikawa A, Kita M, Miyamoto K, Sakamoto A, Yamaike N, Kotera Y, Yoshimura N: Integrity of foveal photoreceptor layer in central retinal vein occlusion. Retina 2008; 28 : 1502–1508.
115. L’Esperance FA: Ocular photocoagulation. A stereoscopic atlas. St.Louis, CV Mosby Company 1975;215-222.
116. Jalkh AE, Avila PM, Zakka KA, Trempe CL, Schepens CL: Chronic macular edema in retinal branch vein occlusion: Role of laser photocoagulation. Annals Ophthalmol 1984; 16 : 526-533.
117. Řehák J: Venózní okluze sítnice: III. Perspektiva arteriolární konstrikce. Čs
Oftalmol 1993; 49 : 151-154.
118. Erdöl H, Akyol N: Arterial crimping in branch retinal vein occlusion with macular edema. Acta Ophthalmol Scand 2000; 78 : 456–459.
Štítky
Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2012 Číslo 6- Stillova choroba: vzácné a závažné systémové onemocnění
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Familiární středomořská horečka
- Kontaktní dermatitida očních víček
-
Všechny články tohoto čísla
- Standardy odborné oftalmologické zdravotní péče v ČR
- Standard pro diagnostiku a léčbu: Katarakta dospělých
- Doporučené postupy pro diagnostiku a léčbu diabetické retinopatie
- Doporučené postupy pro diagnostiku a léčbu pacientů s venózní okluzí sítnice
- Standard akutní vitreoretinální péče
- Rejstřík ročníku 2012
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučené postupy pro diagnostiku a léčbu pacientů s venózní okluzí sítnice
- Standard pro diagnostiku a léčbu: Katarakta dospělých
- Standard akutní vitreoretinální péče
- Doporučené postupy pro diagnostiku a léčbu diabetické retinopatie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



