-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPřehled difuzních gliomů dle WHO klasifikace 2021 1. část – difuzní gliomy dospělého typu
Autoři: M. Hendrych 1; M. Barák 2; H. Valeková 2; T. Kazda 3; P. Pospíšil 3
; R. Lakomý 4; J. Šána 4,5; R. Jančálek 2; M. Hermanová 1
Působiště autorů: I. ústav patologie, LF MU a FN u sv. Anny v Brně 1; Neurochirurgická klinika LF MU a FN U sv. Anny v Brně 2; Klinika radiační onkologie LF MU a Masarykův onkologický ústav, Brno 3; Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav, Brno 4; CEITECH – Středoevropský technologický institut, MU, Brno 5
Vyšlo v časopise: Cesk Slov Neurol N 2023; 86(6): 359-368
Kategorie: Přehledný referát
doi: https://doi.org/10.48095/cccsnn2023359Souhrn
Recentní poznatky na poli molekulárně genetických změn difuzních gliomů u dospělých a dětských pacientů iniciovaly významné změny v jejich klasifikaci a diagnostice. Tyto změny předkládá 5. edice klasifikace WHO nádorů centrálního nervového systému zdůrazňující odsun od tradiční kategorizace tumorů na podkladu morfologie k integrované diagnostice inkorporující charakteristické molekulárně-genetické a epigenetické změny s tradičními morfologickými znaky. Tato první část přehledové práce předkládá souhrn jednotek, které jsou zařazeny do skupiny difuzních gliomů dospělého typu, s důrazem na diagnostická kritéria a grading dle 5. edice klasifikace WHO nádorů centrálního nervového systému z roku 2021.
Klíčová slova:
astrocytom – glioblastom – oligodendrogliom – difuzní gliom – WHO CNS 2021 – integrovaná diagnostika
Úvod
Gliomy představují vysoce heterogenní skupinu nejčastěji se vyskytujících primárních nádorů mozku dospělých i dětí [1]. Jejich aktuální klasifikace dle 5. edice klasifikace WHO nádorů centrálního nervového systému z roku 2021 [2,3] inkorporuje pravidla integrované diagnostiky zavedené již v předchozí přepracované 4. edici klasifikace WHO nádorů centrálního nervového systému z roku 2016 (shrnuto v přehledové práci [4]) a doplněné o nejnovější poznatky vydávané formou doporučení Consortium to Inform Molecular and Practical Approaches to CNS Tumor Taxonomy (cIMPACT-NOW) [5–10].
Tradiční dělení gliomů na difuzní a ohraničené je nově rozšířeno o rozdělení difuzních gliomů do dvou skupin – na gliomy dětského a dospělého typu. Dětský typ difuzních gliomů je dále rozdělen na nádory nízkého stupně (low-grade) a vysokého stupně malignity (high-grade) (tab. 1). Toto nové rozdělení difuzních gliomů na dospělý a dětský typ je podmíněno jejich výrazně odlišným biologickým chováním i molekulárně genetickými alteracemi, přestože morfologicky jsou mnohdy prakticky nerozlišitelné. Současně rozdělení na dospělý a dětský typ difuzních gliomů odpovídá dominantnímu výskytu nádorových jednotek, nevylučuje však výskyt dětského typu difuzního gliomu u dospělých pacientů, nebo naopak vzácné zachycení dospělého typu difuzního gliomu u dětských pacientů [2]. První část této přehledové práce bude věnována difuzním gliomům dospělého typu, zatímco druhá část se bude zabývat high-grade a low-grade difuzními gliomy dětského typu.
Nutno konstatovat, že diagnostika a klasifikace gliomů v současnosti dalece předbíhá terapeutické možnosti. Aktualizace léčebných doporučení se dlouho týkaly spíše pouze různých modifikací známé pooperační radioterapie a chemoterapie [11] (především alkylačním cytostatikem temozolomidem). Teprve v poslední době se objevují studie poukazující na možný efekt dalších léčebných postupů, jako je terapie pomocí tumor treating fields u glioblastomů [12] nebo pomocí vorasidenibu u IDH-mutovaných low-grade gliomů [13].
Tab. 1. Přehled difuzních gliomů dle WHO 2021 vč. WHO CNS gradu přiřazeného k jednotlivým diagnostickým jednotkám a diagnostických genetických alterací. 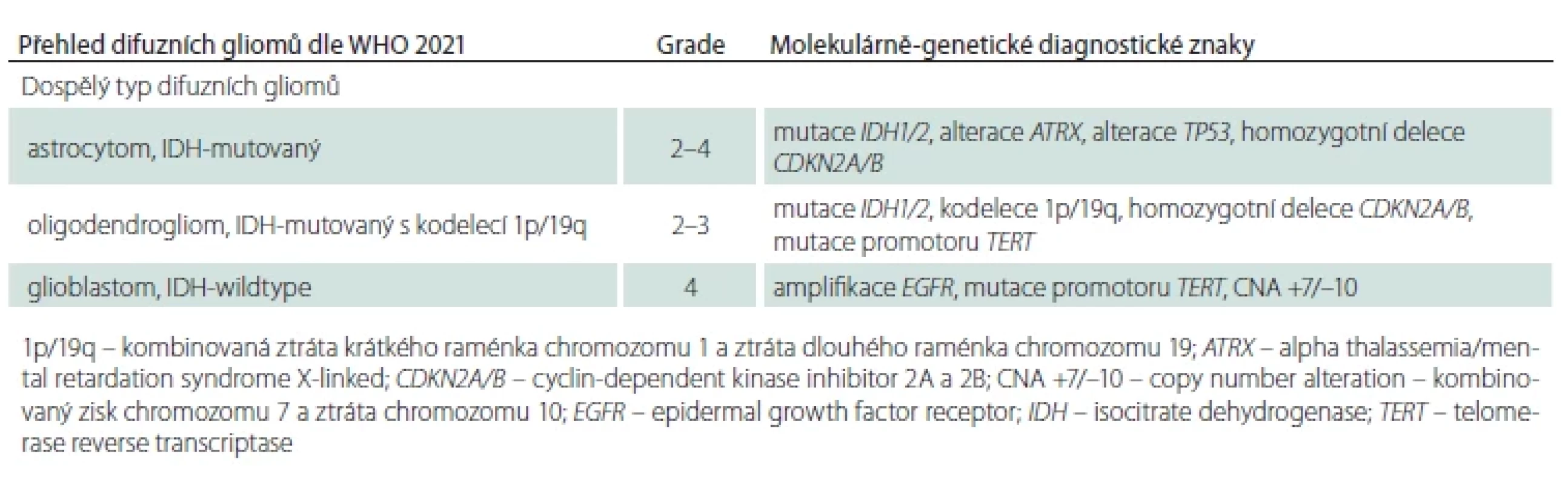
Obr. 1. Imunohistochemické vyšetření neurofi lament využité pro diskriminaci difuzního a ohraničeného gliomu. (A) Glioblastom IDH-wildtype tvořený difuzně infi ltrujícími nádorovými buňkami (modrá jádra) disekující mezi axony infi ltrované mozkové tkáně (hnědě). (B) Pilocytární astrocytom (modrá jádra) odtlačující okolní nenádorovou mozkovou tkáň (hnědě). Originální zvětšení 100×. 
Fig. 1. Immunohistochemical examination of neurofi laments used for the discrimination of diff use and circumscribed glioma. (A) Glioblastoma IDH-wildtype formed by diff usely infi ltrating tumor cells (blue nuclei) dissecting between axons of infi ltrated brain tissue (brown). (B) Pilocytic astrocytoma (blue nuclei) crowding out the surrounding non-neoplastic brain tissue (brown). Original magnifi cation 100×. IDH – isocitrate dehydrogenase Typy růstu gliomu
Odlišení typu růstu gliálně diferencované neoplazie je iniciálním a zároveň esenciálním krokem diagnostiky. Pro difuzně rostoucí gliomy je charakteristický neohraničený infiltrativní růst tkání CNS predominantně preformovanými prostory okolo cév, pod pia mater či okolo/podél axonů bílých mozkových drah. Charakteristickými morfologickými známkami difuzního růstu je postupný pokles denzity nádorových buněk od centra do periferie tumoru, kde jsou patrné tzv. sekundární znaky difuzně rostoucího gliomu – perineuronální satelitóza a perivaskulární či subpiální šíření. Imunohistochemicky (IHC) lze difuzní růst vizualizovat vyšetřením neurofilament zobrazujících fragmentované reziduální axony perzistující v difuzně rostoucí nádorové mase gliomu (obr. 1A). Ohraničené gliomy naopak rostou expanzivně a okolní tkáň CNS spíše odtlačují, což lze verifikovat IHC vyšetřením neurofilament (obr. 1B) [4]. Následný diagnostický proces zahrnuje sekvenci molekulárně genetických vyšetření, která jsou spolu s morfologií nutná pro správnou klasifikaci tumoru dle integrované diagnostiky. Diagnostický postup je zjednodušeně shrnut v obr. 2.
Obr. 2. Zjednodušený diagnostický algoritmus upravený dle doporučení EANO 2021 [14]. Fig. 2. Simplifi ed diagnostic algorithm adapted based on the EANO guidelines 2021 [14]. ![Zjednodušený diagnostický algoritmus upravený dle doporučení EANO 2021 [14]. </br> Fig. 2. Simplifi ed diagnostic algorithm adapted based on the EANO guidelines 2021 [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ff64484022f5f862c3fe1040adaf5121.png)
*U všech středočarových gliomů s průkaznou ztrátou nukleární exprese H3 K27me3 je nutné došetřit genetickou alteraci, která ztrátu exprese způsobuje a je geneticky defi nující pro difuzní středočarový gliom H3 K27-alterovaný – mutace H3 K27, alterace EGFR, nebo overexprese EZHIP. **IDH-wildtype low-grade difuzní gliomy zahrnují heterogenní skupinu tumorů, do které patří jednotky skupiny low-grade difuzních gliomů dětského typu s charakteristickými molekulárně-genetickými změnami a také tumory, které nelze zařadit do žádné z defi novaných jednotek dle klasifi kace WHO označované popisně morfologicky s přívlastkem NEC (not elsewhere classifi ed). 1p/19q – kombinovaná ztráta krátkého raménka chromozomu 1 a ztráta dlouhého raménka chromozomu 19; ATRX – alpha thalassemia/mental retardation syndrome X-linked; CDKN2A/B – cyclin-dependent kinase inhibitor 2A a 2B; CNA +7/–10 – copy number alteration – kombinovaný zisk chromozomu 7 a ztráta chromozomu 10; EANO – European Association of Neuro-Oncology; EGFR – epidermal growth factor receptor; IDH – isocitrate dehydrogenase; TERT – telomerase reverse transcriptase*In every single case of midline glioma with a loss of nuclear expression of H3 K27me3, it is necessary to assess the genetic alterations which are genetically defi ning for the diff use midline glioma, H3 K27-altered and cause the loss of nuclear expression of H3 K27me3 – mutation of H3 K27, EGFR alteration, or EZHIP overexpression. **IDH-wildtype low-grade diff use gliomas include a heterogenous tumor group, which includes tumor types of the low-grade pediatric- -type diff use gliomas with characteristic molecular-genetic alterations, as well as tumors that cannot be classifi ed into any of the defi ned tumor type according to the WHO classifi cation, denoted descriptively morphologically with the attribute NEC (not elsewhere classifi ed). 1p/19q – combined loss of the short arm of chromosome 1 and loss of the long arm of chromosome 19; ATRX – alpha thalassemia/mental retardation syndrome X-linked; CDKN2A/B – cyclin-dependent kinase inhibitor 2A a 2B; CNA +7/–10 – copy number alteration – combined gain of chromosome 7 and loss of chromosome 10; EANO – European Association of Neuro-Oncology; EGFR – epidermal growth factor receptor; IDH – isocitrate dehydrogenase; TERT – telomerase reverse transcriptase Tab. 2. Diagnostická kritéria pro astrocytom IDH-mutovaný dle WHO. 
Obr. 3. Astrocytom IDH-mutovaný. Hematoxylin-eozin, původní zvětšení 200×. Fig. 3. Astrocytoma IDH-mutant. Hematoxylin-eosin, original magnifi cation 200×. 
(A) Astrocytom grade 2 tvořený středně celulární proliferací atypických fi brilárních astrocytů. (B) Astrocytom grade 3 tvořený hypercelulární proliferací astrocytárně diferencovaných buněk se signifi kantní mitotickou aktivitou. (C) Astrocytom grade 4 s četnými vaskulárními proliferáty tvořenými patologicky formovanými cévami s mnohovrstevným endotelem. (D) Astrocytom grade 3 gemistocytární varianta tvořená buňkami s abundantní eozinofilní cytoplazmou. (A) Grade 2 astrocytoma formed by medium cellular proliferation of atypical fi brillar astrocytes.(B) Grade 3 astrocytoma formed by hypercellular proliferation of astrocytic diff erentiated cells with signifi cant mitotic activity. (C) Grade 4 astrocytoma with numerous vascular proliferates formed by pathologically formed vessels with a multilayered endothelium.(D) Astrocytoma grade 3 gemistocytic variant consisting of cells with abundant eosinophilic cytoplasm. IDH – isocitrate dehydrogenase Obr. 4. Astrocytom IDH-mutovaný grade 3. Původní zvětšení 200×.Fig. 4. Astrocytoma IDH-mutant grade 3. Original magnifi cation 200×. 
(A) Imunohistochemické vyšetření IDH1 mutačně specifi ckou protilátkou IDH1 R132H s pozitivní reakcí verifi kující mutaci R132H genu IDH1.U IDH1 R132H negativních tumorů je nutné doplnění mutační analýzy genů IDH1/2 k identifi kaci vzácnějších mutací genů IDH v kodonu 132 genu IDH1 a kodonu 172 genu IDH2.(B) Imunohistochemické vyšetření kyselého gliálního fi brilárního proteinu (GFAP).(C) Imunohistochemickým vyšetřením ATRX byla v nádorových buňkách prokázána ztráta nukleární exprese ATRX asociovaná z alterací genu ATRX.(D) Imunohistochemickým vyšetřením p53 byla v signifi kantním množství nádorových buněk prokázána silná nukleární exprese proteinu p53 asociovaná s tzv. missence mutací genu TP53. (A) Immunohistochemical examination of IDH1 with the IDH1 R132H mutation-specifi c antibody with a positive reaction verifying the R132H mutation of the IDH1 gene. In IDH1 R132H negative tumors, mutation analysis of the IDH1/2 genes is required to identify rarer IDH gene mutations in codon 132 in the IDH1 gene and codon 172 in the IDH2 gene.(B) Immunohistochemical examination of glial fi brillary acidic protein (GFAP).(C) Immunohistochemical examination of ATRX showed a loss of nuclear expression of ATRX associated with ATRX gene alterations in tumor cells.(D) Immunohistochemical examination of p53 demonstrated a strong nuclear expression of the p53 protein associated with so-called missense mutations of the TP53 gene in a significant number of tumor cells.ATRX – alpha thalassemia/mental retardation syndrome X-linked; IDH – isocitrate dehydrogenase Dospělý typ difuzních gliomů
Astrocytom IDH-mutovaný (WHO G2–4)
Astrocytomy jsou difuzně rostoucí gliomy geneticky definované mutací v genu IDH1/2 současnou IHC průkaznou ztrátou exprese ATRX a/nebo mutací genu TP53 při absenci kodelece 1p/19q (tab. 2). Astrocytomy mohou být lokalizované v rozsahu celé kraniospinální osy, typicky se ale vyskytují supratentoriálně, především v oblasti frontálních a temporálních laloků. Nejvyšší incidence astrocytomu je mezi 30.–34. rokem věku [14].
Morfologicky jsou astrocytomy typicky tvořené difuzně rostoucími atypickými fibrilárními astrocyty či méně četně gemistocytárními elementy (obr. 3). Geneticky definovaný astrocytom nicméně zahrnuje i nádory s oligoastrocytární či čistě oligodendrogliální diferenciací [3,4]. Pouze vzácně byly popsány případy kompozitních IDH-mutovaných difuzních gliomů s duálním oligoastrocytárním genotypem – ztrátou exprese ATRX, mutací TP53, bez kodelece 1p/19q v astrocytární komponentně a kodelecí 1p/19q bez alterací v genech ATRX i TP53 v oligodendrogliální komponentě [15]. Status ATRX a TP53 musí být vyšetřen, pokud nebylo provedeno vyšetření kodelece 1p/19q (obr. 4). Inaktivační mutaci ATRX má však pouze 70–80 % astrocytomů, tedy absence ztráty exprese ATRX při IHC vyšetření tuto diagnózu nevylučuje. Ztráta ATRX však není pro astrocytom specifická a vyskytuje se také u všech difuzních hemisferických gliomů, H3 G34-mutovaných, části difuzních středočarových gliomů, H3 K27-alterovaných a je nesčetněkrát popsána i u glioblastomu IDH-wildtype (GBM) [16].
Astrocytom může být klasifikován jako grade 2, 3 nebo 4 dle diagnostických kritérií shrnutých v tab. 3 [7]. Prognostický význam stratifikace grade 2 a 3 astrocytomů dle mitotické aktivity je některými pracemi negován [3,7,17], nicméně jeho význam byl u IDH-mutovaných astrocytomů bez homozygotní kodelece CDKN2A/B, mimo jiné, podpořen v recentní studii Kros et al. [18]. V této studii byl mitotický index (s hranicí dvě mitózy na 10 zorných polí velkého zvětšení) u astrocytomů bez homozygotní kodelece CDKN2A/B identifikován jako nezávislý prognostický faktor pro přežití bez progrese onemocnění a je relevantní pro odlišení grade 2 (s méně než dvěma mitózami) a grade 3 astrocytomů (s dvěma a více mitózami) [18]. Nově je v rámci gradingu implementováno i vyšetření homozygotní delece genů CDKN2A/B, které představují nezávislý prediktor špatné prognózy [19,20], a dle recentních doporučení by mělo být jejich vyšetření rutinně provedeno u IDH-mutovaných astrocytomů [16]. Homozygotní delece CDKN2A/B se u primárních, terapeuticky neovlivněných IDH-mutovaných gliomů vyskytuje relativně vzácně. Dostupná literární data uvádějí u primárních IDH-mutovaných astrocytomů četnost homozygotní delece pro morfologicky definovaný grade 2 u 1,8–3,5 %, grade 3 u 3,2–6,7 % a grade 4 u 18,8–27 % [19,21]. Daleko častěji je zjištěna v recidivujících tumorech po předchozí radioterapii, což vysvětluje nutnost opakovaného testování homozygotní delece CDKN2A/B i v recidivujících IDH-mutovaných gliomech, kde je k dispozici materiál po eventuální reoperaci [19,22]. Po ozáření získaná homozygotní delece CDKN2A/B zároveň představuje potenciální biomarker predikující rezistenci k radioterapii u recidivujících IDH-mutovaných gliomů [22]. Naopak u IDH-wildtype gliomů se delece CDKN2A/B vyskytuje často i u nově diagnostikovaných, terapeuticky dosud neovlivněných tumorů [22]. Recentně byl však také popsán případ astrocytomu a oligodendrogliomu s delecí CDKN2A/B, u kterých již delece CKDN2A/B nebyla v recidivě tumoru prokázána [23].
Tab. 3. Kritéria gradingu pro astrocytom IDH-mutovaný. 
Tab. 4. Diagnostická kritéria pro oligodendrogliom IDH-mutovaný s kodelecí 1p/19q dle WHO. 
Oligodendrogliom IDH-mutovaný s kodelecí 1p/19q (WHO G2–3)
Oligodendrogliomy jsou geneticky definovány mutací v genu IDH1/2 a současnou kompletní kodelecí 1p/19q (tab. 4). Charakteristická je supratentoriální lokalizace, přičemž až polovina případů postihuje frontální laloky. Pouze vzácně se oligodendrogliom vyskytuje infratentoriálně. Obdobně jako všechny difuzní gliomy dospělého typu i oligodendrogliom může infiltrovat více mozkových laloků, a to i oboustranně (dříve označováno jako gliomatosis cerebri), či se leptomeningeálně šířit [3,14]. V porovnání s astrocytomy se oligodendrogliomy spíše vyskytují u starších pacientů, přičemž nejvyšší incidence je u pacientů ve věku mezi 40.–44. rokem [14]. Geneticky se od astrocytomů také odlišují přítomností mutace promotoru TERT, která se vyskytuje u většiny oligodendrogliomů a její testování lze využít pro podpoření diagnózy oligodendrogliomu [16].
Charakteristický histologický obraz zahrnuje difuzně rostoucí nádorové gliální buňky oligodendrogliální diferenciace s drobnými kulatými jádry a perinukleárním projasněním (připomínající volské oko) v síti bohatě se větvících kapilár (obr. 5). V rámci tumoru jsou často zastiženy i kalcifikace. Nicméně morfologické spektrum geneticky definovaného oligodendrogliomu zahrnuje i nádory s oligoastrocytární či čistě astrocytární diferenciací [3,4].
Grading oligodendrogliomů, obdobně jako u astrocytomu, kombinuje histologické znaky – signifikantní mitotickou aktivitu, přítomnost nekróz a vaskulárních proliferátů – a genetickou alteraci – homozygotní deleci CDKN2A/B (tab. 5) [3]. Obdobně jako u astrocytomu je i u oligodendrogliomu považována přítomnost homozygotní delece CDKN2A/B za marker špatné prognózy. Prognóza pacientů s G3 oligodendrogliomem klasifikovaným na podkladě průkazu homozygotní delece CDKN2A/B je celkově horší než u pacientů s G3 oligodendrogliomem klasifikovaným pouze na podkladě histologických znaků bez průkazné homozygotní delece CDKN2A/B, nicméně tato alterace se vyskytuje u méně než 10 % případů [20]. Medián celkového přežití G2 oligodendrogliomu je 16,6 roku, což je nejvíc ze všech difuzních gliomů dospělého typu [1].
Obr. 5. Oligodendrogliom IDH-mutovaný s kodelecí 1p/19q. Hematoxylin-eozin, původní zvětšení 200×. Fig. 5. Oligodendroglioma, IDH-mutant with 1p/19q co-deletion. Hematoxylin-eosin, original magnifi cation 200×. 
(A) Oligodendrogliom grade 2 tvořený středně celulární difúzní proliferací neoplastických buněk s klasickou oligodendrogliální diferenciací – buňky s kulatým jádrem s perinukleárním projasněním rostoucí v síti větvících se kapilár.(B) Oligodendrogliom grade 3 rostoucí v podobě hypercelulární proliferace se signifi kantní mitotickou aktivitou.(C) Imunohistochemické vyšetření IDH1 mutačně specifi ckou protilátkou IDH1 R132H s pozitivní reakcí verifi kující mutaci R132H genu IDH1. U IDH1 R132H negativních tumorů je nutné doplnění mutační analýzy genů IDH1/2 k identifi kaci vzácnějších mutací genů IDH v kodonu 132 genu IDH1 a kodonu 172 genu IDH2.(D) Imunohistochemické vyšetření ARTX se zachovanou wildtype expresí ARTX. (A) Oligodendroglioma grade 2 formed by medium cellular diff use proliferation of neoplastic glia with classic oligodendroglial diff erentiation – cells with a round nucleus with perinuclear halo growing in a network of branching capillaries.(B) Oligodendroglioma grade 3 growing in the form of hypercellular proliferation with signifi cant mitotic activity.(C) Immunohistochemical examination of IDH1 with the IDH1 R132H mutation-specifi c antibody with a positive reaction verifying the R132H mutation of the IDH1 gene. In IDH1 R132H negative tumors, mutation analysis of the IDH1/2 genes is required to identify rarer IDH gene mutations in codon 132 in the IDH1 gene and codon 172 in the IDH2 gene.(D) Immunohistochemical examination of ARTX with preserved wildtype expression of ARTX. ATRX – alpha thalassemia/mental retardation syndrome X-linked; IDH – isocitrate dehydrogenase Tab. 5. Kritéria gradingu pro oligodendrogliom IDH-mutovaný s kodelecí 1p/19q. 
Obr. 6. Glioblastom IDH-wildtype.Fig. 6. Glioblastoma, IDH-wildtype. 
(A) Přehledové barvení hematoxylin-eozin zobrazující palisádující nekrózy glioblastomu tvořené centrální nekrotickou oblastí ohraničenou nádorovými buňkami migrujícími z nekrotické oblasti. Originální zvětšení 100×.(B) Glioblastom s mnohočetnými vaskulární proliferáty tvořenými patologicky formovanými cévami s mnohovrstevným endotelem. Originální zvětšení 100×.(C) V imunohistochemickém vyšetření mutačně specifi ckou protilátkou IDH1 R132H nebyla prokázána mutace R132H genu IDH1. U pacientů mladších 55 let je nutné doplnění mutační analýzy genů IDH1/2 k vyloučení vzácnějších mutací genů IDH v kodonu 132 genu IDH1 a kodonu 172 genu IDH2. U pacientů starších 55 let s nestředočarovým, histomorfologicky klasickým glioblastomem, není mutační analýza genů IDH1/2 indikovaná, jelikož v těchto případech je pravděpodobnost záchytu IDH mutovaného tumoru zanedbatelná. Zvětšení 200×.(D) Imunohistochemické vyšetření proliferačního indexu Ki-67 detekující proliferující buňky (hnědá jádra) – buňky mimo G0 fázi buněčnéhocyklu. Zvětšení 200×. (A) Hematoxylin-eosin staining showing palisade necroses in glioblastoma formed by a central necrotic area bordered by tumor cells migrating away from the necrotic center. Original magnifi cation 100×.(B) Glioblastoma with multiple vascular proliferates formed by pathologically formed vessels with multilayered endothelium. Original magnification 100×.(C) The R132H mutation of the IDH1 gene was not demonstrated in the immunohistochemical examination with the IDH1 R132H mutation-specific antibody. In patients younger than 55 years of age, a mutation analysis of the IDH1/2 genes is necessary to exclude rarer IDH gene mutations in codon 132 in the IDH1 gene and codon 172 in the IDH2 gene. The mutation analysis of the IDH1/2 genes is not indicated in patients older than 55 years of age with, non-midline tumor and classic glioblastoma histomorphology. In these cases, the probability of detecting an IDH mutant tumor is negligible. Magnifi cation 200×.(D) Immunohistochemical examination of the proliferative index Ki-67 detecting proliferating cells (brown nuclei) – cells beyond the G0 phase of the cell cycle. Magnification 200×.IDH – isocitrate dehydrogenase Glioblastom IDH-wildtype (WHO G4)
Glioblastom (GBM) představuje nejčastější primární nádor CNS dospělých, tvoří necelých 60 % všech gliomů. Charakteristická je supratentoriální lokalizace, přičemž nejčastěji se vyskytuje v oblasti frontálních mozkových laloků. GBM je nádor pouze dospělého věku a nejvyšší incidence dosahuje ve věkové skupině 75–84 let [1]. Pro GBM je charakteristický rychlý infiltrativní růst v CNS podmiňující klinickou symptomatologii vyjádřenou často symptomy intrakraniální hypertenze. Naopak vzdálené metastázy GBM jsou klinicky diagnostikovány velmi vzácně a bývají častěji zjištěny až postmortálně [24,25]. Medián přežití pacientů se pohybuje okolo 16 měsíců, a to i přes komplexní chirurgickou a následnou onkologickou terapii [26,27].
Diagnostická kritéria GBM byla recentně rozšířena dle doporučení cIMPACT NOW update 3 a 6 o genetické znaky definující GBM i v případě absence klasických morfologických rysů, tj. nekróz a mikrovaskulárních proliferátů (obr. 6) [5,10]. Dle platných doporučení musí být tedy u všech histologicky G2/3 IDH-wildtype difuzních gliomů vyšetřeny genetické znaky GBM – mutace promotoru TERT, amplifikace EGFR, kombinovaný zisk chromozomu 7 a ztráta chromozomu 10 (tab. 6) [16]. Na základě shodné klinické prezentace, průběhu onemocnění i shodně špatné prognózy jsou nově difuzní gliomy IDH-wildtype s genetickými znaky GBM klasifikovány jako GBM [28,29].
Právě GBM definované genetickými alteracemi jsou dle autorů Zhang et al. [30] jednak nedostatečně vyšetřené nebo časně zastižené/vyvíjející se GBM. U první skupiny nedostatečně vyšetřených GBM je nezastižení klasických morfologických znaků dáno vyšetřením okraje nádoru, a to mimo oblasti s typickými nekrózami a vaskulárními proliferáty. Druhá skupina časně zastižených/vyvíjejících se GBM zahrnuje pacienty, u kterých byl nádor resekován ještě před jeho „vyzráním“ do charakteristického morfologického obrazu GBM jak na zobrazovacích vyšetřeních, tak mikroskopicky. V průběhu onemocnění však u těchto pacientů dochází k rozvoji recidiv s již vyjádřeným charakteristickým obrazem na zobrazovacích metodách i s typickým mikroskopickým nálezem. Klasifikace GBM na podkladě genetických znaků vedla v prospektivní studii Zhang et al. [30] k agresivnějšímu terapeutickému přístupu a signifikantnímu prodloužení přežívání pacientů (medián přežití 23,8 měsíce) v porovnání s retrospektivní kontrolní kohortou klasifikovanou dle CNS WHO 2016 jako WHO G2 nebo G3 tumory, u nichž medián přežití dosahoval pouze 16,2 měsíce.
Metylace promotoru MGMT by měla být, na rozdíl od IDH-mutovaných gliomů, testovaná u všech GBM. Monoterapie temozolomidem je efektivní pouze u pacientů s metylací promotoru MGMT [16]. Pacienti s GBM s metylací promotoru MGMT mají delší medián přežití (24 měsíců) v porovnání s pacienty bez metylace promotoru MGMT (14 měsíců) [31–33], jedná se tedy jak o významný prognostický, tak i prediktivní marker. V případě IDH-mutovaných gliomů rutinní testování není doporučováno. Některé práce uvádí, že až 98 % IDH-mutovaných gliomů má metylaci promotoru MGMT [16]. Nicméně retrospektivní analýza metylačního stavu MGMT u IDH-mutovaných gliomů z roku 2022 udává četnost metylace jen 62,3 %. Význam metylace MGMT pro IDH-mutované gliomy též není zcela jasný. Zmíněná práce uvádí, že přítomnost metylace promotoru MGMT je spojena s lepšími výsledky přežití pro IDH-mutované gliomy vyššího gradu [34].
Tab. 6. Diagnostická kritéria pro glioblastom IDH-wildtype dle WHO. 
Tab. 7. Příklad bioptického závěru integrované diagnostiky. 
Závěr integrované diagnostiky
Doporučení pro formulaci závěru bioptického vyšetření dle WHO CNS 5 a cIMPACT-NOW vychází z konsenzuálního doporučení Mezinárodní společnosti pro neuroonkologii z roku 2014 preferující strukturovanou formu, která obsahuje výslednou diagnózu dle integrované diagnostiky, histologickou diagnózu, grading a seznam provedených molekulárně genetických vyšetření vč. jejich interpretace a použité metody (tab. 7) [2,3,5,35].
V případě, že molekulárně genetická vyšetření není možné provést či jejich výsledek není interpretovatelný, je doporučeno tumor klasifikovat na základě morfologické diagnózy s přívlastkem NOS (not otherwise specified) – např. high-grade difuzní astrocytární gliom NOS. Naopak pokud ani komplexní molekulárně genetické vyšetření neumožnuje zařazení tumoru do definované jednotky dospělého nebo dětského typu difuzního gliomu dle WHO CNS 5, je daný tumor označen přívlastkem NEC (not elsewhere classified) – např. difuzní astrocytom IDH-wildtype, H3-wildtype, NEC [6].
Závěr
Diagnostika difuzních gliomů je konstantně se vyvíjející proces, který v současné době prochází významnými změnami podmíněnými rychlým rozvojem a adopcí nových metod umožňujícími studium molekulárně genetického i epigenetického pozadí nádorů [36]. Právě studium těchto změn vedlo k stratifikaci tumorů do skupin s homogennější prognózou či terapeutickou odpovědí a tyto poznatky jsou reflektovány i v klasifikaci gliomů dle WHO CNS 2021.
Grantová podpora
Tato práce byla podpořena Grantovou agenturou Masarykovy univerzity (MUNI/A/1379/2022) a Agenturou pro zdravotnický výzkum Ministerstva zdravotnictví (NU23-03-00100).
Prohlášení o konfliktu zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Zdroje
1. Ostrom QT, Price M, Neff C et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2015–2019. Neuro Oncol 2022; 24 (Suppl 5): v1–v95. doi: 10.1093/neuonc/noac202.
2. Louis DN, Perry A, Wesseling P et al. The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro Oncol 2021; 23 (8): 1231–1251. doi: 10.1093/neuonc/noab106.
3. WHO Classification of Tumours Editorial Board. Central nervous system tumours. Lyon: International Agency for Research on Cancer 2021.
4. Hendrych M, Valeková H, Kazda T et al. Integrated diag - nostics of diffuse gliomas. Klin Onkol 2020; 33 (4): 248–259. doi: 10.14735/amko2020248.
5. Louis DN, Wesseling P, Aldape K et al. cIMPACT-NOW update 6: new entity and diagnostic principle recommendations of the cIMPACT-Utrecht meeting on future CNS tumor classification and grading. Brain Pathol 2020; 30 (4): 844–856. doi: 10.1111/bpa.12832.
6. Louis DN, Wesseling P, Paulus W et al. cIMPACT-NOW update 1: not otherwise specified (NOS) and not elsewhere classified (NEC). Acta Neuropathol 2018; 135 (3): 481–484. doi: 10.1007/s00401-018-1808-0.
7. Brat DJ, Aldape K, Colman H et al. cIMPACT-NOW update 5: recommended grading criteria and terminologies for IDH-mutant astrocytomas. Acta Neuropathol 2020; 139 (3): 603–608. doi: 10.1007/s00401-020-02127-9.
8. Ellison DW, Hawkins C, Jones DTW et al. cIMPACT-NOW update 4: diffuse gliomas characterized by MYB, MYBL1, or FGFR1 alterations or BRAF V600E mutation. Acta Neuropathol 2019; 137 (4): 683–687. doi: 10.1007/s00401-019-01987-0.
9. Louis DN, Giannini C, Capper D et al. cIMPACT-NOW update 2: diagnostic clarifications for diffuse midline glioma, H3 K27M-mutant and diffuse astrocytoma/anaplastic astrocytoma, IDH-mutant. Acta Neuropathol 2018; 135 (4): 639–642. doi: 10.1007/s00401-018-1826-y.
10. Brat DJ, Aldape K, Colman H et al. cIMPACT-NOW update 3: recommended diagnostic criteria for „Diffuse astrocytic glioma, IDH-wildtype, with molecular features of glioblastoma, WHO grade IV“. Acta Neuropathol 2018; 136 (5): 805–810. doi: 10.1007/s00401-018-1913-0.
11. Stupp R, Mason WP, van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352 (10): 987–996. doi: 10.1056/NEJMoa043330.
12. Stupp R, Taillibert S, Kanner AA et al. Maintenance therapy with tumor-treating fields plus temozolomide vs temozolomide alone for glioblastoma a randomized clinical trial. JAMA 2015; 314 (23): 2535–2543. doi: 10.1001/jama.2015.16669.
13. Mellinghoff IK, van den Bent MJ, Blumenthal DT et al. Vorasidenib in IDH1 - or IDH2-mutant low-grade glioma. N Engl J Med 2023; 389 (7): 589–601. doi: 10.1056/NEJMoa2304194.
14. Weller M, van den Bent M, Preusser M et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol 2021; 18 (3): 170–186. doi: 10.1038/s41571-020-00447-z.
15. Miller JJ, Castro LNG, Mcbrayer S et al. Isocitrate dehydrogenase (IDH) mutant gliomas: a Society for Neuro-Oncology (SNO) consensus review on diagnosis, management, and future directions. Neuro Oncol 2023; 25 (1): 4–25. doi: 10.1093/neuonc/noac207.
16. Huse JT, Diamond EL, Wang L et al. Mixed glioma with molecular features of composite oligodendroglioma and astrocytoma: a true „oligoastrocytoma“? Acta Neuropathol 2015; 129 (1): 151–153. doi: 10.1007/s00401-014-1359-y.
17. Brat DJ, Aldape K, Bridge JA et al. Molecular biomarker testing for the diagnosis of diffuse gliomas. Arch Pathol Lab Med 2022; 146 (5): 547–574. doi: 10.5858/arpa.2021-0295-CP.
18. Carstam L, Corell A, Smits A et al. WHO grade loses its prognostic value in molecularly defined diffuse lower-grade gliomas. Front Oncol 2022; 11 : 803975. doi: 10.3389/fonc.2021.803975.
19. Kros JM, Rushing E, Uwimana AL et al. Mitotic count is prognostic in IDH mutant astrocytoma without homozygous deletion of CDKN2A/B. Results of consensus panel review of EORTC trial 26053 (CATNON) and EORTC trial 22033-26033. Neuro Oncol 2023; 25 (8): 1443–1449. doi: 10.1093/neuonc/noac282.
20. Marker DF, Pearce TM. Homozygous deletion of CDKN2A by fluorescence in situ hybridization is prognostic in grade 4, but not grade 2 or 3, IDH-mutant astrocytomas. Acta Neuropathol Commun 2020; 8 (1): 169. doi: 10.1186/s40478-020-01044-y.
21. Appay R, Dehais C, Maurage CA et al. CDKN2A homozygous deletion is a strong adverse prognosis factor in diffuse malignant IDH-mutant gliomas. Neuro Oncol 2019; 21 (12): 1519–1528. doi: 10.1093/neuonc/noz 124.
22. Ceccarelli M, Barthel FP, Malta TM et al. Molecular profiling reveals biologically discrete subsets and pathways of progression in diffuse glioma. Cell 2016; 164 (3): 550–563. doi: 10.1016/j.cell.2015.12.028.
23. Kocakavuk E, Anderson KJ, Varn FS et al. Radiotherapy is associated with a deletion signature that contributes to poor outcomes in patients with cancer. Nat Genet 2021; 53 (7): 1088–1096. doi: 10.1038/s41588-021-00874-3.
24. Lee K, Kim SI, Kim EE et al. Genomic profiles of IDH-mutant gliomas: MYCN-amplified IDH-mutant astrocytoma had the worst prognosis. Sci Rep 2023; 13 (1): 6761. doi: 10.1038/s41598-023-32153-y.
25. Onda K, Tanaka R, Takahashi H et al. Cerebral glioblastoma with cerebrospinal fluid dissemination: a clinicopathological study of 14 cases examined by complete autopsy. Neurosurgery 1989; 25 (4): 533–540. doi: 10.1227/00006123-198910000-00005.
26. Hendrych M, Solar P, Hermanova M et al. Spinal metastasis in a patient with supratentorial glioblastoma with primitive neuronal component: a case report with clinical and molecular evaluation. Diagnostics 2023; 13 (2): 181. doi: 10.3390/diagnostics13020181.
27. Lakomy R, Kazda T, Selingerova I et al. Real-world evidence in glioblastoma: Stupp’s regimen after a decade. Front Oncol 2020; 10 : 840. doi: 10.3389/fonc.2020.00840.
28. Tan AC, Ashley DM, López GY et al. Management of glioblastoma: state of the art and future directions. CA Cancer J Clin 2020; 70 (4): 299–312. doi: 10.3322/caac. 21613.
29. Tesileanu CMS, Dirven L, Wijnenga MMJ et al. Survival of diffuse astrocytic glioma, IDH1/2 wildtype, with molecular features of glioblastoma, WHO grade IV: a confirmation of the cIMPACT-NOW criteria. Neuro Oncol 2020; 22 (4): 515–523. doi: 10.1093/neuonc/noz200.
30. Wijnenga MMJ, Maas SLN, van Dis V et al. Glioblastoma lacking necrosis or vascular proliferations: different clinical presentation but similar outcome, regardless of histology or isolated TERT promoter mutation. Neurooncol Adv 2023; 5 (1): vdad075. doi: 10.1093/noajnl/vdad 075.
31. Zhang Y, Lucas CHG, Young JS et al. Prospective genomically guided identification of „early/evolving“ and „undersampled“ IDH-wildtype glioblastoma leads to improved clinical outcomes. Neuro Oncol 2022; 24 (10): 1749–1762. doi: 10.1093/neuonc/noac089.
32. Hegi ME, Diserens A-C, Gorlia T et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med 2005; 352 (10): 997–1003. doi: 10.1056/NEJMoa043331.
33. Higa N, Akahane T, Yokoyama S et al. Prognostic impact of PDGFRA gain/amplification and MGMT promoter methylation status in patients with IDH wild-type glioblastoma. Neurooncol Adv 2022; 4 (1): vdac097. doi: 10.1093/noajnl/vdac097.
34. Alnahhas I, Alsawas M, Rayi A et al. Characterizing benefit from temozolomide in MGMT promoter unmethylated and methylated glioblastoma: a systematic review and meta-analysis. Neurooncol Adv 2020; 2 (1): vdaa082. doi: 10.1093/noajnl/vdaa082.
35. Lam K, Eldred BSC, Kevan B et al. Prognostic value of O6-methylguanine-DNA methyltransferase methylation in isocitrate dehydrogenase mutant gliomas. Neurooncol Adv 2022; 4 (1): vdac030. doi: 10.1093/noajnl/vdac 030.
36. Louis DN, Perry A, Burger P et al. International Society of Neuropathology – Haarlem consensus guidelines for nervous system tumor classification and grading. Brain Pathol 2014; 24 (5): 429–435. doi: 10.1111/bpa.12171.
37. Sahm F, Brandner S, Bertero L et al. Molecular diagnostic tools for the World Health Organization (WHO) 2021 classification of gliomas, glioneuronal and neuronal tumors; an EANO guideline. Neuro Oncol 2023; 25 (10): 1731–1749. doi: 10.1093/neuonc/noad100.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2023 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Magnosolv a jeho využití v neurologii
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Chirurgická léčba recidivy intrakraniálních aneuryzmat po ošetření klipem
- Přehled difuzních gliomů dle WHO klasifikace 2021 1. část – difuzní gliomy dospělého typu
- Vliv chemoterapeutické léčby na kognitivní funkce dětí s leukemií
- Repetitivní transkraniální magnetická stimulace v léčbě poruch spánku
- Efekt psychoedukačního programu u pacientů s CMP v postakutní péči
- Paměťová rezerva a údržba paměti u superúspěšně stárnoucích osmdesátníků
- Polysomnografické nálezy mužů s narkolepsií typu 1 ve věku nad 55 let
- Atypické případy cycloplegie způsobené durmanem obecným
- Nečekaně abnormální test POBAV a SPECT mozku dokonce u vnuka pacientky s demencí
- Z. Adam et al. Monoklonální gamapatie klinického významu a další nemoci
- Zpráva o výročním sjezdu České neurochirurgické společnosti ČLS JEP v Hradci Králové
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přehled difuzních gliomů dle WHO klasifikace 2021 1. část – difuzní gliomy dospělého typu
- Repetitivní transkraniální magnetická stimulace v léčbě poruch spánku
- Efekt psychoedukačního programu u pacientů s CMP v postakutní péči
- Chirurgická léčba recidivy intrakraniálních aneuryzmat po ošetření klipem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



