-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chirurgická léčba recidivy intrakraniálních aneuryzmat po ošetření klipem
Autoři: A. Hejčl 1-3; M. Stratilová 1; A. Sejkorová 1; R. Bartoš 1; F. Cihlář 4; M. Sameš 1
Působiště autorů: Neurochirurgická klinika Univerzity J. E. Purkyně, Masarykova nemocnice, Ústí nad Labem 1; Mezinárodní centrum klinického výzkumu (ICRC), FN u sv. Anny v Brně 2; Ústav experimentální medicíny Akademie věd ČR, v. v. i., Praha 3; Radiologická klinika Univerzity J. E. Purkyně, Masarykova nemocnice, Ústí nad Labem 4
Vyšlo v časopise: Cesk Slov Neurol N 2023; 86(6): 351-358
Kategorie: Přehledný referát
doi: https://doi.org/10.48095/cccsnn2023351Souhrn
Recidiva intrakraniálního aneuryzmatu (IA) po chirurgickém ošetření (klip aneuryzmatu) je v klinické praxi relativně raritní. Pro řešení takové recidivy je nutné individuální rozhodnutí na základě precizní radiodiagnostiky a zkušeností daného týmu. Chirurgická léčba recidiv aneuryzmat je technicky náročnější v porovnání s primární operací vzhledem k postoperačním změnám. Cílem naší práce je shrnout současné znalosti o problematice a managementu recidiv IA po klipu a prezentovat naše zkušenosti s jejich chirurgickou léčbou.
Klíčová slova:
radiodiagnostika – intrakraniální aneuryzma – klip – mozková angiografie
Úvod
Poprvé bylo mozkové aneuryzma chirurgicky ošetřeno v roce 1931 Normanem Dot - tem v Edinburghu, který obalil svalem (wrapping) prasklé aneuryzma levé střední mozkové tepny ze subfrontálního přístupu u Colina Blacka, u kterého operaci předcházely tři ruptury této výdutě. První klip aneuryzmatu pak provedl Walter Dandy v roce 1937 u prasklé výdutě zadní komunikující tepny. K dalšímu vývoji významně přispělo zavedení mikroskopu do neurochirurgické operativy v 60. letech. Pokračující vývoj chirurgické léčby znamenal rozvoj stále menších a delikátnějších nástrojů, dočasných klipů, zlepšení diagnostiky, perioperačních diagnostických metod, jako je perioperační videoangiografie (VAG) s využitím indocyaninové zeleně (indocyanine green; ICG), nebo omezení využívání peroperačních lopatek s cílem zmenšení manipulace s mozkovou tkání a zvýšení bezpečnosti chirurgie.
Nicméně po publikaci studie International Subarachnoid Aneurysm Trial (ISAT) došlo ve světě k částečnému odklonu v léčbě intrakraniálních aneuryzmat (IA) od chirurgie k endovaskulární terapii [1]. Na druhou stranu střednědobé a dlouhodobé výsledky mezinárodních studií v následujících letech prokázaly zvýšené množství recidiv endovaskulárně ošetřených IA v porovnání s těmi ošetřenými chirurgicky [2,3]. Výhodou chirurgie je tedy, mimo jiné, dlouhodobá stabilita takto ošetřených výdutí. Proto současná doporučení preferují, mimo jiné, chirurgickou léčbu např. u mladých pacientů (< 40 let) vzhledem k očekávané délce dožití [4,5]. Na druhou stranu je třeba konstatovat, že i v těch nejzkušenějších rukách má klip aneuryzmatu 7% riziko, že aneuryzma nebude po 10 letech kompletně vyřešeno [3]. Proto se v praxi nutně musíme setkat s pacientem s recidivou IA po klipu. V této práci se zabýváme péčí o pacienty po chirurgické léčbě IA.
Historický vývoj
První zdokumentovaný případ recidivy aneuryzmatu byl nejspíše popsán v roce 1965 [6]. Pacientka zemřela na rupturu aneuryzmatu levé střední mozkové tepny po předchozím ošetření ruptury aneuryzmatu tantalovým klipem pravé střední mozkové tepny před 11 lety. Při pitvě pak byla potvrzena multilobulární recidiva aneuryzmatu střední mozkové tepny o velikost 14 × 11 mm. V 80. letech existoval názor, že riziko ruptury u pacienta s reziduem aneuryzmatu je velmi nízké, a proto dle Feuerberga et al. nebyl důvod k reoperaci takového pacienta [7]. Na druhou stranu v roce 1984 popsali Drake et al. sérii 115 reoperovaných recidiv IA [8]. Popsali také několik důvodů pro jejich nekompletní ošetření a vytvořili první jednoduchou klasifikaci (obr. 1). U 36 % (41/115) pacientů došlo ke vzniku nového neurologického deficitu, buď na podkladě krvácení, nebo na vrub expanzivního chování vaku.
Další studie převážně z 90. let prokázaly, že roční riziko krvácení z rezidua aneuryzmatu je 1,9 %, což je vyšší než u většiny aneuryzmat neprasklých [9]. Studie The Cerebral Aneurysm Rerupture After Treatment (CARAT) potvrdila, že riziko krvácení je přímo úměrné velikosti rezidua vaku [10]. V souboru chirurgicky či endovaskulárně ošetřených prasklých IA ve studii CARAT bylo 4leté riziko reruptury u primárně kompletně obliterovaných aneuryzmat 1,1 %, zatímco u aneuryzmat s reziduem přesahujícím 70 % to bylo 17,6 %. Podle jiné studie u 3,5–15 % zbytků aneuryzmat dochází k růstu a u 28 % z nich pak dojde k reruptuře [11].
Obr. 1. Vybrané klasifi kace recidiv IA po ošetření klipem. Nejstarší a zároveň nejjednoduší dle Drakea z roku 1967, asi nejznámější z roku 1998 dle Sindoua a klasifi kace dle Kobayashiho z roku 2017, která řeší vztah mezi stávajícím postavením klipu a možností nasazení nového klipu na recidivu vaku. 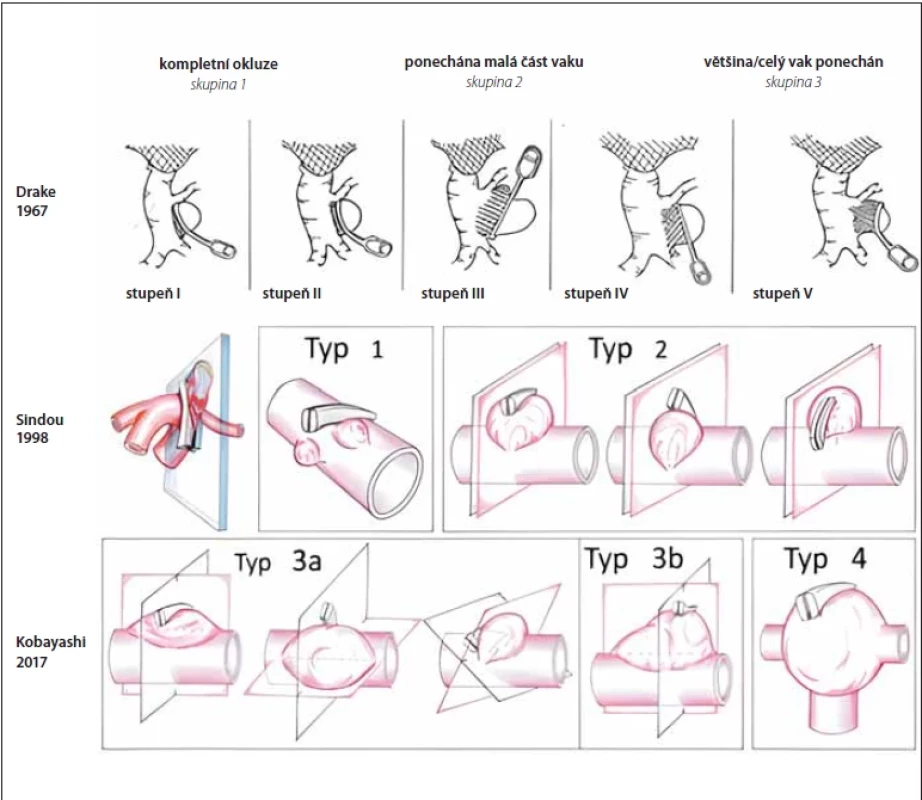
Fig. 1. Selected classifi cations of intracranial aneurysm recurrencies after clipping. The oldest and the most simple classifi cation developed by Drake in 1967; the most common classifi cation by Sindou from 1998 and a classifi cation by Kobayashi from 2017 with special focus on the relationship between current clip position and possibilities of new clip placement on the sac recurrence. Obr. 2. 3D CT rekonstrukce 1 rok po klipu prasklého aneuryzmatu arteria cerebri media vpravo (2010). Ponechán „nájezd“ pro odstup M2 větví, které odstupovaly z báze vaku. Pacientka byla sledována, kontrolní CTA po 6 (2015) a 11 letech (2020) demonstrovala postupnou progresi vaku. V roce 2020 jsme provedli operaci a progredující recidivu vaku uzavřeli 2 okénkovými klipy přes klipy původní z roku 2010, jak je patrno na kontrolní 3D CTA 2 roky po operaci recidivy. 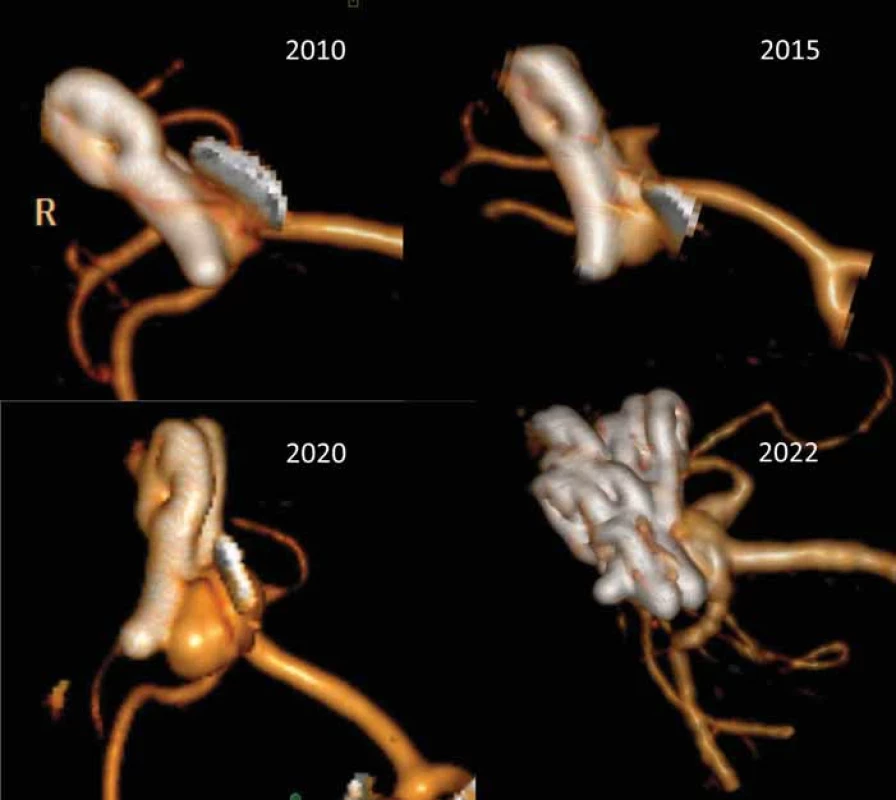
Fig. 2. 3D CT reconstruction 1 year after clipping a ruptured middle cerebral artery aneurysm (2010). A remnant of the aneurysm sac was left outside the clip to preserve the fl ow in M2 branches originating from the base of the sac. The patient was followed, check-up CTA performed 6 years (2015) and 11 years (2020) after surgery demonstrated a gradual progression of the aneurysm sac remnant. In 2020, we performed surgery and occluded the aneurysm with 2 fenestrated clips applied over the original clips from 2010 as may be seen on 3D CTA performed 2 years after the revision surgery. Obr. 3. CTA provedené 1. den po elektivním klipu intrakraniálního aneuryzmatu přední komunikující tepny. (A) Je patrné významné residuum vaku aneuryzmatu. (B) Následující den byla provedena revize ze stejného přístupu s doplněním paralelního klipu distálně od původního. Příčinou plnění zbytku byla slabá síla distálních částí branží. Na CTA po revizní operaci je již patrná kompletní obliterace vaku aneuryzmatu. 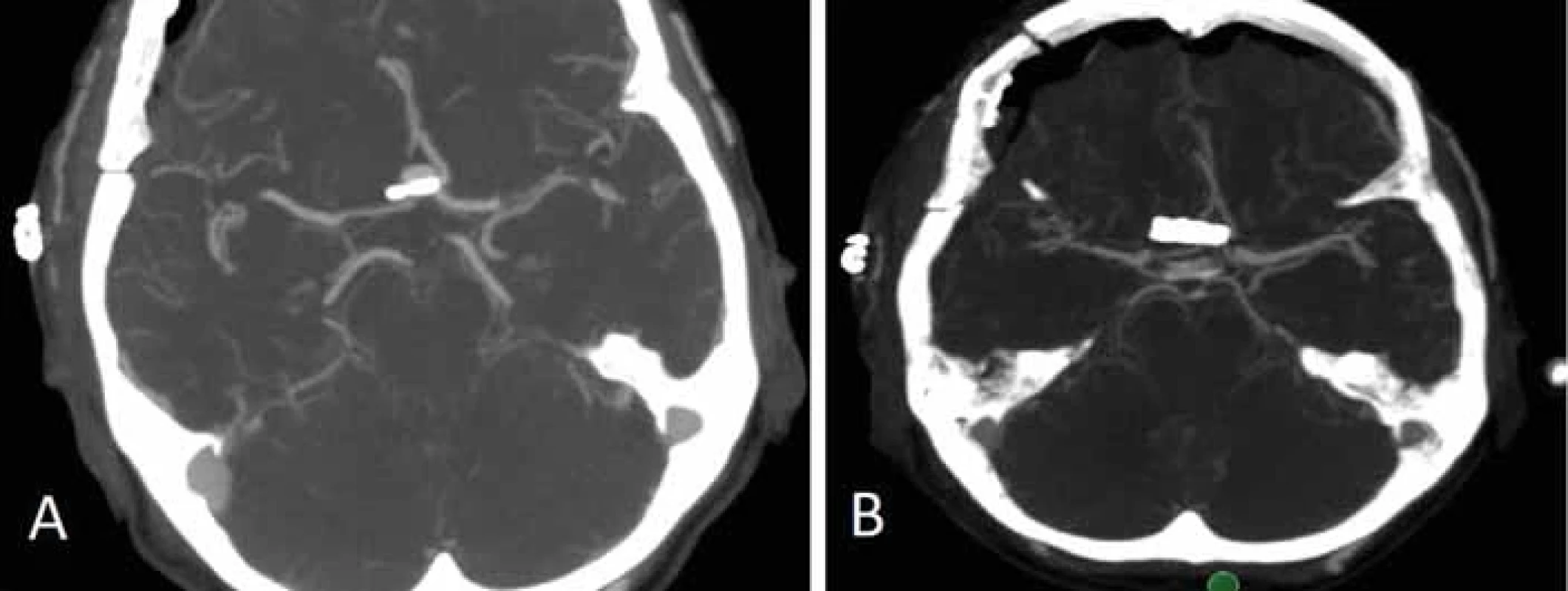
Fig. 3. CTA performed on Day 1 after elective clipping of the intracranial aneurysm of the anterior communicating artery. (A) A signifi - cant aneurysm sac residuum is apparent. (B) On the following day, a revision surgery was performed and a parallel clip was applied distally to the original one. The aneurysm sac remnant resulted from a weak closing force of the distal portion of the blades. CTA after the revision surgery shows complete obliteration of the aneurysm sac. Reziduum aneuryzmatu po klipu
Ponechání rezidua aneuryzmatu může být výsledkem technické chyby či nedokonalosti při klipu aneuryzmatu nebo se může jednat o cílený krok operatéra daný anatomickými poměry v okolí vaku. Důvodem pro ponechání rezidua aneuryzmatu je nejčastěji odstup jedné či více větví z krčku či vaku aneuryzmatu (obr. 2). Snaha o kompletní uzavření vaku IA by jinak vedla k obliteraci tepenné větve s možným rozvojem ischemického neurologického deficitu. Zbytek vaku lze poté zmenšit koagulací a obalit např. fascií či Gore-Texem (wrapping), event. provést zajištění wrappu klipem [12]. Na druhou stranu může být reziduum vaku ponecháno neúmyslně. Častou příčinou je nepřehledná situace u pacientů s prasklým aneuryzmatem při masivním subarachnoidálním krvácení v kombinaci např. s otokem mozku. Další příčinou mohou být složité anatomické poměry např. u aneuryzmat přední komunikující tepny či bazilárního apexu, které neumožní zhlédnutí vaku a jeho krčku po celém obvodu čili kontrolu v rozsahu 360°. Dokonce ani nasazení klipu s okulometricky kompletním vyřazením vaku nemusí znamenat 100% vyřešení výdutě, neboť menší síla v distální části klipu např. při ateroskleróze či kalcifikaci krčku může způsobit nedokonalé uzavření vaku s přetrvávajícím tokem krve do aneuryzmatu (obr. 3). Proto je také po naložení klipu třeba zkontrolovat kompletní uzavření vaku aneuryzmatu pomocí adjuvantních metod, jako je perioperační VAG či perioperační přímá dopplerometrie. Pokud je technicky možné, doporučujeme vak perioperačně prostřihnout a tím okluzi verifikovat. Stejně tak ověříme, že nedošlo klipem ke stenotizaci toku, či dokonce okluzi některé z tepenných větví. K tomu lze navíc k uvedeným metodám využít flowmetrie pomocí Charbelových sond. Optimálním řešením je pak využití intraoperační DSA, kdy před vrácením kostní ploténky lze během 15 min provést plnohodnotné radiologické vyhodnocení ošetřeného aneuryzmatu.
Již v roce 1967 popsal Drake riziko recidivy krvácení u tří skupin pacientů dle své klasifikace; těch s kompletní okluzí vaku (45 pacientů), s malým zbytkem (12 pacientů) a s ponechanou většinou či celým vakem (13 pacientů). U pacientů s kompletní okluzí vaku autoři nezaznamenali žádnou recidivu krvácení (0 %), u pacientů s menším zbytkem vaku pak zaznamenali dvě časná a dvě pozdní krvácení z vaku (33 %), což rezultovalo ve smrt tří pacientů. Nejhorší výsledky byly pochopitelně ve 3. skupině, kde autoři zaznamenali čtyři časná a tři pozdní krvácení (54 %) s výslednými šesti úmrtími.
Několik recentnějších studií ukázalo, že při využití postoperační DSA je možno nalézt zbytek vaku ve 2,3–16 % případů [13–15]. Např. studie klipovaných aneuryzmat z Helsinek, jednoho z nejrespektovanějších center chirurgie mozkových aneuryzmat na světě, z let 1998–2001 ukázala, že reziduum po klipu bylo diagnostikováno u 12 % pacientů. Při analýze rizik pak autoři zjistili, že vyšší riziko ponechání rezidua bylo u pacientů s prasklými aneuryzmaty (14 vs. 9 %), u aneuryzmat zadního povodí a dále u velkých či gigantických výdutí.
Ito et al. vyhodnotili 244 klipovaných pacientů a u šesti z nich (2,5 %) diagnostikovali nekompletní ošetření výdutě klipem. U dvou přitom došlo k časné reruptuře do 30 dnů, naštěstí jen u jednoho pacienta vedla reruptura ke zhoršení klinického stavu. Čtyři pacienti (1,6 %) podstoupili reoperaci. U pěti pacientů šlo přitom o aneuryzmata komplexu přední komunikující tepny a v jednom případě o aneuryzma arteria basilaris. Autoři vyhodnotili příčiny nedostatečně zaklipovaných výdutí a ve čtyřech případech šlo o nedostatečné ozřejmení aneuryzmatu během operace, v jednom případě o nedostatečnou schopnost klipu uzavřít silnou stěnu krčku výdutě a v jednom případě šlo o zbytek mezi branžemi aneuryzmatických klipů.
Radiologické hodnocení po primárním chirurgickém ošetření aneuryzmatu
Reziduum aneuryzmatu definujeme jako nekompletně ošetřené IA s ponechaným zbytkem vaku či krčku. Dříve bývalo zvykem, že se operatéři při hodnocení kompletnosti ošetření IA spoléhali na perioperační nález bez nutnosti pooperačního radiologického zobrazení. Také na našem pracovišti jsme přibližně do roku 2007 standardně indikovali 1. pooperační den pouze nativní CT mozku k vyloučení komplikací (ischemie, hemoragie, kontuze). Stále více se však klade důraz na objektivizaci kompletnosti ošetření mozkové výdutě, tedy provedení zobrazení po chirurgickém ošetření aneuryzmatu, a to buď pomocí CTA, či DSA. Proto od roku 2007 standardně provádíme u všech aneuryzmat CT vč. CTA mozkových tepen (obr. 3). A to i v případě, že vak aneuryzmatu prostřihneme či se přesvědčíme o kompletnosti klipu kombinací perioperačního transkraniálního dopplera a ICG. Dle našich zkušeností jsme 1× zaznamenali neočekávané reziduum, které souviselo s nedostatečnou silou klipu v distální části (což je nejslabší část klipu). I přes náš dojem z operace bylo aneuryzma ošetřeno nedostatečně, což jsme následující den vyřešili nasazením paralelního klipu distálně od původního aneuryzmatu s kompletním vyřešením výdutě.
Z literatury plyne, že v případě, že bylo kompletní ošetření aneuryzmatu potvrzeno ihned po výkonu 3D angiografií, blíží se riziko recidivy 0 % [16]. Na druhou stranu riziko recidivy inkompletně vyřešených aneuryzmat bylo po necelých 4 letech od primární operace 11,8 %. Kompletní ošetření vaku výdutě je tak zcela zásadním ovlivnitelným faktorem v prevenci vzniku recidivy IA.
Recidiva aneuryzmatu po klipu
Účinnost chirurgické léčby aneuryzmatu je vysoká, s ročním rizikem recidivy 0,26–0,53 % [9,17–19]. Mezi významné rizikové faktory recidivy IA patří kompletnost primárního ošetření výdutě. Pravděpodobnost recidivy aneuryzmatu po kompletním uzavření klipem v horizontu 10 let je udávána 0,7 %, zatímco riziko recidivy u aneuryzmatu s ponechaným zbytkem je 13,9 % [20]. Mezi rizikové faktory recidivy autoři výše uvedené studie z Jižní Koreje identifikovali jednak ponechaný zbytek aneuryzmat a také zvýšenou konzumaci alkoholu. Mezi další popisované rizikové faktory recidivy patří nízký věk pacienta či přítomnost vícečetných výdutí.
Přibližně po 6 letech od kompletního ošetření klipem 699 aneuryzmat byla diagnostikována jen jedna recidiva aneuryzmatu (0,14 %) [21]. Na druhou stranu u 59 aneuryzmat s reziduem při časném angiografickém vyšetření bylo zachyceno osm (13,6 %), u kterých došlo z dlouhodobého hlediska k růstu. Všech těchto osm aneuryzmat vyžadovalo ošetření. V této kohortě pacientů pak bylo diagnostikováno dalších osm (0,97 %) nových aneuryzmat. Výsledky přirozeně korelují s problematikou inkompletně endovaskulárně ošetřených IA, kde jsou však čísla recidiv mnohem vyšší [22]. Všichni tito pacienti měli primárně diagnostikována vícečetná aneuryzmata. Z toho plyne několik závěrů. Jednak že bychom se měli snažit vždy ošetřit aneuryzma kompletně. Dále je nutné provést časnou angiografickou (CTA, DSA) kontrolu a při řešitelném reziduu toto ošetřit. Pokud se pak týká dlouhodobého sledování, toto bychom měli obzvláště akcentovat u pacientů s primárně nekompletně ošetřenými aneuryzmaty, u mladých jedinců a též u pacientů s primárně diagnostikovanými mnohočetnými aneuryzmaty.
Snad pro zajímavost stojí za to připomenout dnes již překonaný problém související s recidivou klipovaných aneuryzmat, který se objevil na konci 70. let 20. století. Tehdy bylo publikováno vícero kazuistik týkajících se napětím indukované koroze některých typů aneuryzmatických klipů [23]. Pokud se týká materiálů používaných pro výrobu klipů, tak se původně začínalo stříbrnými klipy, neboť stříbro bylo považováno za inertní [24]. Nicméně stříbrné klipy měly tendenci časem korodovat a jejich užití vedlo k významné reakci okolní tkáně. V dalším období byly vyráběny klipy ze slitiny nerezové oceli (první Drakeovy a Yasargilovy klipy). Rozvoj MR v medicíně, a zvláště v neurochirurgii, následně vedl k potřebě používat klipy kompatibilní s MR. Byly tak vyvinuty klipy ze speciálních slitin, např. MP 35 N (Sundtovy klipy), či ze slitin kobaltu Phynox (Yasargilovy klipy) nebo Eligiloy (Sugita Standard). Nicméně ani tyto klipy neumožňují pooperační sledování pomocí MR, neboť jsou zdrojem významných artefaktů. Proto je snaha vyvinout klipy negenerující artefakty, jako např. klipy keramické či vlákny zpevněné plastové klipy [25,26]. Tým autorů z Detroitu zjistil, že dříve používané klipy Heifetz, Pivot, a Vari-Angle měly větší tendenci k selhání než jiné (např. známé klipy Yasargilovy). Dočasné klipy Yasargil a Sugita mají zavírací tlak mezi 0,88 a 1,08 N (90–110 g) a 0,69 N (70 g). Permanentní klipy pak mají zavírací tlak 1,27–1,47 N (130–150 g, Sugita) a 1,47–1,96 N (150–180 g, Yasargil). Přitom zavírací tlak není rovnoměrný po celé délce branží, nýbrž je nejnižší ve špičce a nejsilnější v proximální části branží.
Klasifikace recidivy aneuryzmatického vaku po klipu
Recidiva aneuryzmatu je definována jako růst vaku de novo po kompletně ošetřené výduti či jako zvětšení zbytku vaku po nekompletním ošetření. Existuje několik klasifikací reziduí či recidiv po klipu IA. První klasifikace byla dle Drakea z roku 1967, který rozdělil aneuryzmata na tři stupně: 1. kompletní obliterace; 2. ponechána menší část vaku; 3. ponechána velká část vaku či vak celý [27]. Asi nejznámější je klasifikace dle Sindoua, který dělí rezidua aneuryzmatu na pět stupňů: 1. ponecháno pod 50 % krčku aneuryzmatu; 2. ponechán krček aneuryzmatu; 3. ponechána část vaku (lobulus) u multilobulárního aneuryzmatu; 4. ponechána část vaku, méně než 75 %; 5. ponecháno více než 75 % vaku aneuryzmatu [28]. První dvě skupiny přitom autoři doporučují ponechat ke sledování, zatímco typ 3–5 primárně indikují k revizi.
Další klasifikace z Japonska pak posouvá problematiku chirurgických řešení recidiv aneuryzmat ještě o další krok dále [29]. Kobayashi et al. definovali vztah mezi stávající rovinou okluze vaku danou branžemi původního klipu a novou rovinou, která je definována optimální pozicí branží nového klipu. Tato klasifikace tak pomáhá s indikací následného chirurgického řešení recidivy aneuryzmatu. Autoři dělí recidivy na čtyři typy s návrhem chirurgického řešení, kdy pro typy I, II a IIIb autoři navrhují nasazení nového klipu aneuryzmatu s následným sejmutím původního klipu. U typu IIIa pak autoři doporučují nejdříve odstranění původního klipu, který umožní nasazení nového klipu a kompletní řešení recidivy. U recidivy typu IV, kdy je vztah vaku k mateřským cévám komplexní, pak autoři navrhují chirurgickou léčbu v podobě trappingu a bypassu, neboť přímý klip vzhledem ke komplexnosti vaku neumožňuje řešení recidivy. Přitom u všech pacientů autoři primárně zvažují endovaskulární řešení recidivy. Nicméně vzhledem k tomu, že většina recidiv IA nemá úzký krček a je spíše komplexní, autoři uvádějí, že endovaskulární řešení lze použít u menšiny recidiv klipem řešených IA. S tímto máme na našem pracovišti obdobnou zkušenost.
Existují ještě další dvě klasifikace IA dle Spiotta a el-Beltagy, které dělí recidivy obdobně dle vztahu původního klipu k recidivě do tří kategorií. Varianta el-Beltagy je jakousi velmi zjednodušenou verzí Kobayashiho klasifikace řešící možnost nasazení nového klipu bez konfliktu s původním, klasifikace dle Spiotta vztah mezi chirurgickou léčbou a typem recidivy přímo neřeší. Spiotta et al. popsali tři typy recidiv IA. U typu I je recidiva v oblasti proximální části klipu, typu II v distální části klipu a typu III pak laterálně od branží klipu [30].
Endovaskulární léčba pro recidivu IA po klipu
Vzhledem k relativně malému množství případů neexistují žádné rozsáhlé randomizované studie, které by hodnotily efektivitu endovaskulární či chirurgické léčby u pacientů s recidivou chirurgicky ošetřených IA. Byla publikována brazilská retrospektivní observační multicentrická studie u 70 pacientů s inkompletně klipem ošetřeným aneuryzmatem či recidivou aneuryzmatu po klipu, kteří byli endovaskulárně ošetřeni [31]. Studie ukázala, že okamžitá úplná obliterace aneuryzmatu byla pozorována u 73,1 % aneuryzmat (s vyloučením aneuryzmat ošetřených flow-diverterem). Kompletní okluze po 1 roce pak byla pozorována u 75,3 %, avšak např. u aneuryzmat ošetřených prostým coilingem to bylo pouze u 68,4 % z nich. Je tedy zřejmé, že i když se při endovaskulární léčbě vyhneme manipulaci v jizevnatém terénu, výsledky léčby nejsou z hlediska technické úspěšnosti zcela uspokojivé. Rozhodnutí o řešení recidivy chirurgicky ošetřené výdutě provádíme vždy v týmu spolu s intervenční radiologem a zvažujeme obě možnosti řešení (obr. 4).
Obr. 4. (A) Vstupní 3D CTA mozkových tepen u 59letého kuřáka s arteriální hypertenzí provedené pro kolapsový stav s nálezem incidentálního aneuryzmatu M1 vlevo 7 mm. (B) 3D DSA verifi kující aneuryzma úseku M1 vlevo a fusiformní dilataci jedné z větví M2 vlevo. (C) 3D CTA po klipu aneuryzmatu (rok 2016). Perioperačně se ukázalo, že se jedná o sakulární aneuryzma se širokým krčkem nežli o fuziformní cévní výduť. (D) Kontrolní CTA po 4 letech (2020) prokázala recidivu aneuryzmatu o velikosti 10 mm, což verifi kovala i následná DSA (E). (F) Angiografi e na konci endovaskulární embolizace recidivy aneuryzmatu pomocí spirálek a stentu (jehož spirálky jsou patrné v M1 segmentu). 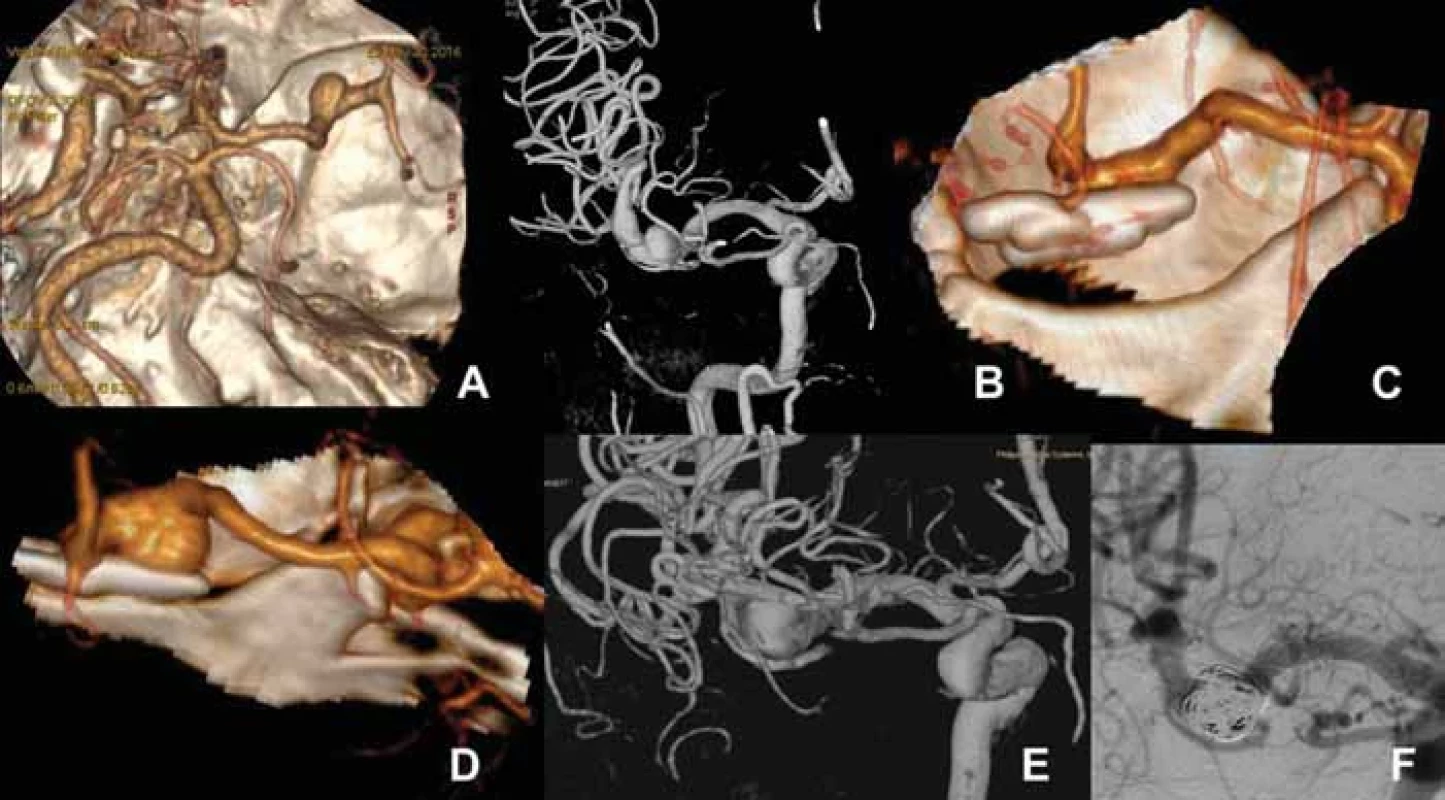
Fig. 4. (A) A 59-year-old male smoker with arterial hypertension underwent 3D CTA performed after a collapse. An incidental 7-mm M1 aneurysm on the left was detected. (B) 3D DSA verifi ed an aneurysm of the left M1 segment and a fusiform dilation of one of the M2 branches on the left. (C) 3D CTA after aneurysm clipping (year 2016). During surgery, the aneurysm was found to be a saccular one with a wide neck rather than a fusiform sac type. (D) CTA 4 years later (2020) demonstrated aneurysm recurrence with a size of 10 mm, which was then verifi ed by DSA (E). (F) Angiography at the end of endovascular embolization of the aneurysm recurrence using coils and a stent (its helical structure is visible in the M1 segment). Dispensarizace pacientů po chirurgickém ošetření IA
Sledování těchto pacientů je stejně jako u endovaskulárního ošetření založeno na klinickém vyšetření a opakovaných radiologických kontrolách. Pokud se týká radiodiagnostiky, tak zlatým standardem je hodnocení pomocí DSA, optimálně 3D DSA. Nevýhodou je invazivita s nutností kanylace femorální tepny, tedy hospitalizace. Rizika spojená s vlastním výkonem jsou pak relativně malá, jako např. cca 0,4% riziko hematomu v místě vpichu či přibližně 0,3% riziko vzniku dočasného neurologického deficitu [32]. Vzhledem k invazivitě je však tato metoda nevhodná k pravidelnému sledování. Neinvazivní a zcela bez RTG záření je MRA, nicméně artefakty po klipu neumožňují hodnocení oblasti kolem klipu. V současnosti tedy využíváme dominantně sledování pacientů pomocí CTA, která umožňuje s určitým omezením hodnotit významná rezidua či recidivy vaku aneuryzmatu a přitom umožňuje ambulantní sledování. Nevýhodou je však rentgenové záření. Na druhou stranu recentně byla představena nová sekvence s ultrakrátkým echo časem na 3T MR (GE Healthcare Life Sciences, Altrincham, Velká Británie), která eliminuje vliv kovových artefaktů na obraz a umožňuje relativně přesné hodnocení ošetřeného vaku a okolních cév a nabízí slibnou možnost v blízké budoucnosti [33]. Lze očekávat, že další vývoj a rozšíření této a podobných sekvencí povede k tomu, že i pacienty po klipu aneuryzmatu budeme nejspíše radiologicky sledovat pomocí MR, a tím se vyhneme radiačnímu záření. Na druhou stranu před vlastním rozhodnutím a plánováním ošetření recidivy výdutě preferujeme kvalitní 3D CTA, a pokud není k dispozici, doporučujeme provedení 3D DSA, což např. u primárně řešených výdutí dnes již využíváme zcela výjimečně.
Otázkou je, jak dlouho či zdali celoživotně sledovat pacienty po ošetření aneuryzmatu klipem [9,18,34–36]. Nedávná metaanalýza ukázala, že záchyt recidiv po ošetření klipem a také de novo aneuryzmat roste časem víceméně lineárně [35]. I výsledky výše zmíněné metaanalýzy potvrzují nutnost dlouhodobého sledování s tím, že termíny kontrol autoři doporučují v intervalech 5, 10 a 20 let po ošetření. Druhým přínosem může být záchyt neprasklé výdutě, kterou autoři výše zmíněné metaanalýzy udávají po 20 letech kolem 7 %. Souhlasíme proto s aktivním a dlouhodobým/celoživotním sledováním pacientů po ošetření mozkové výdutě [35,37].
Naše zkušenosti s chirurgickou léčbou recidiv intrakraniálních aneuryzmat
Mezi lety 2010–2021 jsme ošetřili celkem 812 intrakraniálních aneuryzmat, z toho 198 (24 %) endovaskulárně a 614 (76 %) chirurgicky. Recidivu jsme přitom léčili u 9 (4,5 %) z nich ze skupiny endovaskulární a jen 1 (0,16 %) ze skupiny léčených chirurgicky. V posledních 15 letech jsme pak provedli chirurgické ošetření recidiv klipem ošetřených aneuryzmat u 4 pacientů. Jednalo se o 3 ženy a 1 muže, kdy operace recidivy byla provedena mezi 11 a 18 lety po původním klipu. U 3 pacientů byla indikací k operaci významná progrese recidivy IA (obr. 1) a u 1 pacientky se pak jednalo o symptomatické krvácení z recidivy IA (obr. 5). Tato pacientka byla přijata pro náhle vzniklou fatickou poruchu na okresní pracoviště. CT prokázalo drobný SAK fronto-temporálně vlevo s drobným intracerebrálním hematomem temporálně vlevo distálně od původního klipu. Kontrolní DSA ukázalo 5 mm recidivu aneuryzmatu ACM vlevo a spasmy v povodí ACM vlevo. Po léčbě vasospasmů cestou opatrné titrace hypertenzní terapie byla symptomatická recidiva aneuryzmatu následně ošetřena klipem.
Terén byl u všech 3 aneuryzmat již od dury je velmi zjizvený, kortex k duře v místě přístupu nepříjemně adheroval. Předpokládáme, že se jednalo o kombinaci zánětlivých a reparativních změn po původním subarachnoidálním krvácení v kombinaci s chirurgickou intervencí. Zatímco například u neprasklých aneuryzmat střední mozkové tepny mnozí neurochirurgové preferují přímý přístup k vaku bez nutnosti preparace optochiasmatické a dalších bazálních cisteren, v případě recidivy je s výhodou, dle našeho názoru, preparace bazálních cisteren v okolí optiku a karotidy, která umožní lepší opadnutí mozku a tím aspoň částečně pomůže k lepší manipulaci v okolí aneuryzmatu a okolních cév v jinak při nepříjemně zjizveném terénu. V některých případech lze po často náročné preparaci okolních tepen po přístupu k aneuryzmatu původní klip zcela beztrestně sundat (Kobayashiho klasifikace, obr. 1)) [26], v některých situacích toto vede ke krvácení a je lepší klip spíše ponechat. Zatímco u většiny primárně řešených aneuryzmat, ať již prasklých či neprasklých, považujeme za dostatečné provedení standardního CTA s 3D rekonstrukcemi, v případě recidivy považujeme za zásadní provedení standardní 3D DSA, pokud se nepodaří provést velmi kvalitní 3D rekonstrukci pomocí CTA. Předoperační plánování je v případě recidivy náročnější, neboť manipulační prostor je významně omezen hlavně kombinaci jizevnatých změn a přítomností původního klipu. V případě recidiv aneuryzmat je tak přesná představa o 3D anatomii aneuryzmatu, jeho recidivě, pozici klipů, mateřské tepně či dceřiných tepnách zcela zásadní, neboť jizevnatý terén neumožňuje jednoduše celý prostor rozpreparovat a situaci si standardně ozřejmit tak jako u primooperace. Po operaci recidivy AN preferujeme 3D DSA, abychom jasně a přesně posoudili možný zbytek výdutě, neboť toto je opět často obtížné 100 % hodnotit při operaci. Zároveň nám to umožní získat výchozí obraz pro další sledování, které však již realizujeme cestou CTA a jen v případě změny zvažujeme opakovat 3D DSA.
Závěr a doporučení
Chirurgická léčba IA je v porovnání s léčbou endovaskulární dlouhodobě stabilnější. Na druhou stranu je riziko rezidua či recidivy i v těch nejlepších rukách 7 % v průběhu 10 let. Vyšší riziko recidivy vč. krvácení je u neúplně ošetřených výdutí. Při primárním ošetření je proto nutná snaha o kompletní vyřešení výdutě, pokud je to bezpečné. Úplnost ošetření IA je nutno ověřit pomocí CTA či DSA časně po operaci. Nutné je také dlouhodobé sledování všech ošetřených pacientů, neboť riziko recidivy v čase roste. Toto je zvláště třeba zdůraznit u aneuryzmat s ponechaným zbytkem. U pacientů s recidivou není možno říci, který typ léčby (ať již endovaskulární, nebo chirurgický) je lepší, a je třeba toto zvážit zcela individuálně na základě anatomických poměrů, věku pacienta, jeho stavu apod. Před takovým rozhodnutím je nutná detailní radiologická diagnostika, optimálně cestou 3D DSA, pokud by byla po provedení CTA jakákoliv nejistota. Chirurgická léčba pak vyžaduje pečlivou preparaci výdutě a mateřských tepen v jizevnatém terénu a připravenost na nutnost improvizace při chirurgickém ošetření výdutě, neboť pooperační změny a již nasazený klip často neumožní jednoduché, přímočaré řešení.
Finanční podpora
Práce byla podpořena vnitřním grantem Krajské zdravotní, a. s., IGA-KZ-2020-1-15, IGA-KZ-2023-1-13 a grantem Agentury zdravotnického výzkumu MZČR NU22-08-00124.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Zdroje
1. Molyneux A, Kerr R, Stratton I et al. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet 2002; 360 (9342): 1267–1274. doi: 10.1016/s0140-6736 (02) 11314-6.
2. Molyneux AJ, Birks J, Clarke A et al. The durability of endovascular coiling versus neurosurgical clipping of ruptured cerebral aneurysms: 18 year follow-up of the UK cohort of the International Subarachnoid Aneurysm Trial (ISAT). Lancet 2015; 385 (9969): 691–697. doi: 10.1016/S0140-6736 (14) 60975-2.
3. Spetzler RF, McDougall CG, Zabramski JM et al. Ten - -year analysis of saccular aneurysms in the Barrow Ruptured Aneurysm Trial. J Neurosurg 2019; 132 (3): 771–776. doi: 10.3171/2018.8.JNS181846.
4. Molyneux AJ, Kerr RS, Birks J et al. Risk of recurrent subarachnoid haemorrhage, death, or dependence and standardised mortality ratios after clipping or coiling of an intracranial aneurysm in the International Subarachnoid Aneurysm Trial (ISAT): long-term follow-up. Lancet Neurol 2009; 8 (5): 427–433. doi: 10.1016/S1474-4422 (09) 70080-8.
5. Mitchell P, Kerr R, Mendelow AD et al. Could late rebleeding overturn the superiority of cranial aneurysm coil embolization over clip ligation seen in the International Subarachnoid Aneurysm Trial? J Neurosurg 2008; 108 (3): 437–442. doi: 10.3171/JNS/2008/108/3/ 0437.
6. McKissock W. Recurrence of an intracranial aneurysm after excision. J Neurosurg 1965; 23 (5): 547–548. doi: 10.3171/jns.1965.23.5.0547.
7. Feuerberg I, Lindquist C, Lindqvist M et al. Natural history of postoperative aneurysm rests. J Neurosurg 1987; 66 (1): 30–34. doi: 10.3171/jns.1987.66.1.0030.
8. Drake CG, Friedman AH, Peerless SJ. Failed aneurysm surgery. Reoperation in 115 cases. J Neurosurg 1984; 61 (5): 848–856. doi: 10.3171/jns.1984.61.5.0848.
9. David CA, Vishteh AG, Spetzler RF et al. Late angiographic follow-up review of surgically treated aneurysms. J Neurosurg 1999; 91 (3): 396–401. doi: 10.3171/jns.1999.91.3.0396.
10. Johnston SC, Dowd CF, Higashida RT et al. Predictors of rehemorrhage after treatment of ruptured intracranial aneurysms: the Cerebral Aneurysm Rerupture After Treatment (CARAT) study. Stroke 2008; 39 (1): 120–125. doi: 10.1161/STROKEAHA.107.495747.
11. Ihm EH, Hong CK, Shim YS et al. Characteristics and management of residual or slowly recurred intracranial aneurysms. J Korean Neurosurg Soc 2010; 48 (4): 330–334. doi: 10.3340/jkns.2010.48.4.330.
12. Safavi-Abbasi S, Moron F, Sun H et al. Techniques and outcomes of gore-tex clip-wrapping of ruptured and unruptured cerebral aneurysms. World Neurosurg 2016; 90 : 281–290. doi: 10.1016/j.wneu.2016.02.109.
13. Jabbarli R, Pierscianek D, Wrede K et al. Aneurysm remnant after clipping: the risks and consequences. J Neurosurg 2016; 125 (5): 1249–1255. doi: 10.3171/2015.10.JNS151536.
14. Kivisaari RP, Porras M, Ohman J et al. Routine cerebral angiography after surgery for saccular aneurysms: is it worth it? Neurosurgery 2004; 55 (5): 1015–1024. doi: 10.1227/01.neu.0000141043.07303.60.
15. Proust F, Toussaint P, Hannequin D et al. Outcome in 43 patients with distal anterior cerebral artery aneurysms. Stroke 1997; 28 (12): 2405–2409. doi: 10.1161/01.str.28.12.2405.
16. Marbacher S, Gruter BE, Wanderer S et al. Risk of intracranial aneurysm recurrence after microsurgical clipping based on 3D digital subtraction angiography. J Neurosurg 2022; 138 (3): 717–723. doi: 10.3171/2022.5.JNS22 424.
17. Matheus MG, Castillo M. Development of de novo intracranial aneurysm in three months: case report and literature review. AJNR Am J Neuroradiol 2003; 24 (4): 709–710.
18. Tsutsumi K, Ueki K, Morita A et al. Risk of aneurysm recurrence in patients with clipped cerebral aneurysms: results of long-term follow-up angiography. Stroke 2001; 32 (5): 1191–1194. doi: 10.1161/01.str.32.5.1191.
19. Wermer MJ, Greebe P, Algra A et al. Incidence of recurrent subarachnoid hemorrhage after clipping for ruptured intracranial aneurysms. Stroke 2005; 36 (11): 2394–2399. doi: 10.1161/01.STR.0000185686.28035.d2.
20. Han HJ, Lee W, Kim J et al. Incidence rate and predictors of recurrent aneurysms after clipping: long - -term follow-up study of survivors of subarachnoid hemorrhage. Neurosurg Rev 2022; 45 (5): 3209–3217. doi: 10.1007/s10143-022-01828-x.
21. Brown MA, Parish J, Guandique CF et al. A long-term study of durability and risk factors for aneurysm recurrence after microsurgical clip ligation. J Neurosurg 2017; 126 (3): 819–824. doi: 10.3171/2016.2.JNS152059.
22. Raymond J, Guilbert F, Weill A et al. Long-term angiographic recurrences after selective endovascular treatment of aneurysms with detachable coils. Stroke 2003; 34 (6): 1398–1403. doi: 10.1161/01.STR.0000073841.885 63.E9.
23. Dujovny M, Kossovsky N, Kossowsky R et al. Intracranial clips: an examination of the devices used for aneurysm surgery. Neurosurgery 1984; 14 (3): 257–267. doi: 10.1227/00006123-198403000-00001.
24. Sasidharan GM, Sastri SB, Pandey P. Aneurysm clips: what every resident should know. Neurol India 2015; 63 (1): 96–100. doi: 10.4103/0028-3886.152666.
25. Sutherland GR, Kelly JJ, Boehm DW et al. Ceramic aneurysm clips. Neurosurgery 2008; 62 (5 Suppl 2): ONS 400–ONS405. doi: 10.1227/01.neu.0000326025.93724.5f.
26. Brack A, Fischer G, Janssen G et al. Development of an artifact-free aneurysm clip. Curr Direct Biomed Eng 2016; 2 (1): 543–546. doi: 10.1515/cdbme-2016-0120.
27. Drake CG, Vanderlinden RG. The late consequences of incomplete surgical treatment of cerebral aneurysms. J Neurosurg 1967; 27 (3): 226–238. doi: 10.3171/jns.1967.27.3.0226.
28. Sindou M, Acevedo JC, Turjman F. Aneurysmal remnants after microsurgical clipping: classification and results from a prospective angiographic study (in a consecutive series of 305 operated intracranial aneurysms). Acta Neurochir (Wien) 1998; 140 (11): 1153–1159. doi: 10.1007/s007010050230.
29. Kobayashi S, Moroi J, Hikichi K et al. Treatment of recurrent intracranial aneurysms after neck clipping: novel classification scheme and management strategies. Oper Neurosurg (Hagerstown) 2017; 13 (6): 670–678. doi: 10.1093/ons/opx033.
30. Spiotta AM, Hui F, Schuette A et al. Patterns of aneurysm recurrence after microsurgical clip obliteration. Neurosurgery 2013; 72 (1): 65–69. doi: 10.1227/NEU.0b013e 318276b46b.
31. da Silva Junior NR, Trivelato FP, Nakiri GS et al. Endovascular treatment of residual or recurrent intracranial aneurysms after surgical clipping. J Cerebrovasc Endovasc Neurosurg 2021; 23 (3): 221–232. doi: 10.7461/jcen. 2021.E2021.03.001.
32. Dawkins AA, Evans AL, Wattam J et al. Complications of cerebral angiography: a prospective analysis of 2,924 consecutive procedures. Neuroradiology 2007; 49 (9): 753–759. doi: 10.1007/s00234-007-02 52-y.
33. Katsuki M, Narita N, Ishida N et al. Usefulness of 3 Tesla ultrashort echo time magnetic resonance angiography (UTE-MRA, SILENT-MRA) for evaluation of the mother vessel after cerebral aneurysm clipping: case series of 19 patients. Neurol Med Chir (Tokyo) 2021; 61 (3): 193–203. doi: 10.2176/nmc.oa.2020-0336.
34. Kemp WJ 3rd, Fulkerson DH, Payner TD et al. Risk of hemorrhage from de novo cerebral aneurysms. J Neurosurg 2013; 118 (1): 58–62. doi: 10.3171/2012.9.JNS111512.
35. Spiessberger A, Vogt DR, Fandino J et al. Formation of intracranial de novo aneurysms and recurrence after neck clipping: a systematic review and meta-analysis. J Neurosurg 2019; 132 (2): 456–464. doi: 10.3171/2018.10.JNS181281.
36. Zali A, Khoshnood RJ, Zarghi A. De novo aneurysms in long-term follow-up computed tomographic angiography of patients with clipped intracranial aneurysms. World Neurosurg 2014; 82 (5): 722–725. doi: 10.1016/ j.wneu.2013.06.008.
37. Rotim K, Raguz M, Rotim A et al. Late aneurysm relapse after microsurgical treatment of middle cerebral artery aneurysm: a case report and literature review of treatment options. Acta Clin Croat 2020; 59 (3): 532–538.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2023 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Chirurgická léčba recidivy intrakraniálních aneuryzmat po ošetření klipem
- Přehled difuzních gliomů dle WHO klasifikace 2021 1. část – difuzní gliomy dospělého typu
- Vliv chemoterapeutické léčby na kognitivní funkce dětí s leukemií
- Repetitivní transkraniální magnetická stimulace v léčbě poruch spánku
- Efekt psychoedukačního programu u pacientů s CMP v postakutní péči
- Paměťová rezerva a údržba paměti u superúspěšně stárnoucích osmdesátníků
- Polysomnografické nálezy mužů s narkolepsií typu 1 ve věku nad 55 let
- Atypické případy cycloplegie způsobené durmanem obecným
- Nečekaně abnormální test POBAV a SPECT mozku dokonce u vnuka pacientky s demencí
- Z. Adam et al. Monoklonální gamapatie klinického významu a další nemoci
- Zpráva o výročním sjezdu České neurochirurgické společnosti ČLS JEP v Hradci Králové
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přehled difuzních gliomů dle WHO klasifikace 2021 1. část – difuzní gliomy dospělého typu
- Repetitivní transkraniální magnetická stimulace v léčbě poruch spánku
- Efekt psychoedukačního programu u pacientů s CMP v postakutní péči
- Chirurgická léčba recidivy intrakraniálních aneuryzmat po ošetření klipem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



