-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Práh pro somatosenzorickou časovou diskriminaci nediferencuje mezi pacienty s esenciálním a dystonickým třesem hlavy
Somatosensory temporal discrimination threshold does not discriminate between patients with essential and dystonic head tremor
Aim: The aim of this study was to evaluate the utility of the somatosensory temporal discrimination threshold (STDT) examination in patients with head tremor to differentiate between patients with essential tremor (ET) and dystonic head tremor in cervical dystonia (CD). Patients and methods: 42 patients with head tremor (21 ET and 21 CD patients) and 20 healthy controls (HC) were examined. Patient examination consisted of medical history (onset of symptoms, family history, and effect of alcohol) and scales that objectively assessed head and upper limb tremor, severity of CD and severity of ataxia. All subjects were examined by STDT. This is a method based on determining the shortest interval in which an individual recognizes two tactile stimuli as temporally separated. Results: No significant differences were found between ET and CD patients in medical history data. On rating scales, the two groups of patients differed significantly, with ET patients having a higher severity of upper limb tremor and CD patients having a higher degree of dystonia (P < 0.0001). Both groups of patients had a higher degree of ataxia, significantly more in patients with ET (P = 0.0008). STDT values were significantly higher in patients with ET vs. HC (P = 0.0067). We did not find major differences when comparing groups of patients with ET and CD. Conclusion: In patients with head tremor, abnormally elevated STDT values were observed in patients with ET but not in CD, probably due to impaired somatosensory stimulus processing mechanisms and time perception attributed to cerebellar involvement. However, we did not find a significant difference in the STDT values when comparing the examined groups of patients.
Keywords:
essential tremor – Cerebellum – somatosensory temporal discrimination threshold – dystonic tremor – head tremor
Autoři: P. Hollý 1; T. Duspivová 1,2; D. Kemlink 1; O. Ulmanová 1; J. Rusz 1,3; R. Krupička 2; R. Jech 1; E. Růžička 1
Působiště autorů: Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze 1; Katedra biomedicínské informatiky, Fakulta biomedicínského inženýrství, ČVUT v Praze 2; Katedra teorie obvodů, Fakulta elektrotechnická, ČVUT v Praze 3
Vyšlo v časopise: Cesk Slov Neurol N 2022; 85(2): 163-167
Kategorie: Původní práce
doi: https://doi.org/10.48095/cccsnn2022163Souhrn
Cíl: Cílem práce bylo ozřejmit využitelnost vyšetření prahu pro somatosenzorickou časovou diskriminaci (somatosensory temporal discrimination threshold; STDT) u pacientů s třesem hlavy k rozlišení pacientů s esenciálním (ET) a dystonickým třesem hlavy při cervikální dystonii (CD). Soubor a metodika: Bylo vyšetřeno 42 pacientů s třesem hlavy (21 ET a 21 CD) a 20 zdravých kontrol (healthy controls; HC). Byla odebrána anamnéza (začátek příznaků, rodinná anamnéza, efekt alkoholu) a byly hodnoceny škály tíže třesu hlavy a horních končetin, tíže CD a tíže ataxie. Poté byl vyšetřen STDT. Jde o metodu založenou na stanovení nejkratšího intervalu, v němž jedinec rozpozná dva taktilní podněty jako časově oddělené. Výsledky: V anamnestických datech nebyly mezi pacienty s ET a CD nalezeny významné rozdíly. Ve škálách se obě skupiny pacientů signifikantně lišily – pacienti s ET měli vyšší tíži třesu horních končetin, pacienti s CD zase vyšší míru dystonie (p < 0,0001). Obě skupiny měly vyšší míru ataxie, více pacienti s ET (p = 0,0008). Hodnoty STDT byly vyšší u pacientů s ET vs. u HC (p = 0,0067). Nenašli jsme významnější rozdíly při srovnání skupin pacientů s ET vs. CD. Závěr: U pacientů s třesem hlavy byly pozorovány abnormálně zvýšené hodnoty STDT u ET, ale ne u CD, pravděpodobně v důsledku narušených mechanizmů zpracování somatosenzorických podnětů a vnímání času, které se připisují postižení mozečku. Nicméně při srovnání vyšetřovaných skupin pacientů jsme nenašli signifikantní rozdíl v hodnotě STDT.
Klíčová slova:
esenciální třes – práh pro somatosenzorickou časovou diskriminaci – dystonický třes – třes hlavy – mozeček
Úvod
Esenciální třes (ET) je nejčastější extrapyramidovou poruchou u dospělých [1], přičemž prevalence podle jedné metaanalýzy činí od 0,4 do 3,9 % [2] a incidence se zvyšuje s věkem až na 20 % u populace starší 95 let [3]. Současná klasifikační kritéria definují ET jako syndrom, který se vyznačuje izolovaným akčním třesem horních končetin s trváním nejméně 3 roky, třes však může být přítomen v jiných tělesných lokalitách, jako jsou hlava, hlasivky a dolní končetiny. Dále je nutná absence dalších neurologických příznaků, jako jsou dystonie, ataxie nebo známky parkinsonského syndromu [4].
Zatímco podle definice jsou horní končetiny postiženy u všech pacientů s ET, třes hlavy je druhou nejčastější lokalizací a postihuje přibližně jednu třetinu pacientů s ET [5], přičemž jeho výskyt se zvyšuje s věkem [6,7] a je častější u žen než u mužů [8,9].
Diagnostika je komplikovaná zejména u pacientů s převažujícím nebo izolovaným třesem hlavy, který nesplňuje současná diagnostická kritéria ET [4]. V diferenciální diagnostice pak připadá v úvahu dystonický třes při cervikální dystonii (CD), který je charakterizován třesem hlavy v kombinaci s dystonickým držením hlavy a/ nebo krku, tj. třes části těla postižené dystonií [4]. Třes je běžným příznakem dystonie [10,11], je obvykle asymetrický [12], posturální nebo kinetický, má vysokou tendenci měnit se při různých polohách nebo úkonech [13], obvykle se zhoršuje, když pacient vědomě vykonává pohyb jdoucí proti dystonickému stočení, a může být zmírněn senzorickými manévry (tzv. geste antagoniste), např. dotykem vlastní tváře nebo brady [14]. Klinické odlišení ET a dystonického třesu hlavy komplikuje skutečnost, že mírnou dystonii lze snadno přehlédnout. Kromě toho se u některých pacientů s třesem hlavy může CD vyvinout až několik let po začátku třesu [15].
V několika klinických studiích byl zkoumán práh pro somatosenzorickou časovou diskriminaci (somatosensory temporal discrimination threshold; STDT) u pacientů s ET, CD a Parkinsonovou nemocí (PN) [16–18]. Jedná se o metodu založenou na stanovení nejkratšího intervalu, v němž jedinec rozpozná dva taktilní podněty jako časově oddělené [19]. K tomuto stanovení se používá dvojic impulzů dodávaných přístrojem EMG. Prodloužení STDT bylo zaznamenáno u pacientů s CD [17] a u pacientů s CD a dystonickým třesem ve srovnání s pacienty s ET a zdravými kontrolami [16,17]. Jedna studie však popsala prodloužení STDT u pacientů s izolovaným třesem hlavy nebo hlasu [20]. Jiná studie uváděla abnormální STDT u pacientů s PN a u pacientů s CD, přičemž u pacientů s třesem hlavy byly zjištěny vyšší hodnoty STDT než u těch bez něj [21].
Cílem této studie tedy bylo změřit STDT u pacientů s třesem hlavy a zjistit, zda může přispět k diferenciální diagnostice jeho příčin čili k odlišení pacientů s ET a třesem hlavy a pacientů s CD a třesem hlavy.
Metodika a popis souboru
Subjekty
Pacienti s třesem hlavy byli rekrutováni v Centru pro léčbu extrapyramidových poruch Neurologické kliniky 1. LF UK a VFN v Praze. Účast ve studii byla nabídnuta pacientům s diagnózou ET a třesem hlavy a pacientům s CD a třesem hlavy. Pacienti byli diagnostikováni podle příslušných diagnostických kritérií [4,22]. Do studie nebyli zařazeni pacienti se známým genetickým nebo sekundárním původem dystonie a pacienti s komorbiditou ovlivňující polohu a pohyb krkem, fonaci, pohyby horních končetin, stabilitu nebo chůzi. V případě léčby opakovanými injekcemi botulotoxinu do hyperaktivních krčních svalů byl minimální interval po předchozí dávce stanoven na 12 týdnů.
Celkem bylo zařazeno 42 pacientů s třesem hlavy (27 žen a 15 mužů, průměrný věk 65,5 ± 11,6 let). Dvacet jedna pacientů splňovalo diagnostická kritéria pro ET (12 žen a 9 mužů, průměrný věk 67,1 ± 12,8 let) a 21 pacientů mělo CD s třesem hlavy (15 žen a 6 mužů, průměrný věk 63,9 ± 10,3 let). Dále bylo vyšetřeno 20 osob bez neurologických příznaků (zdravé kontroly [healthy controls; HC]: 11 žen a 9 mužů, průměrný věk 60,3 ± 8,4 let).
Klinické vyšetření
Každý pacient byl vyšetřen neurologem pomocí strukturovaného dotazníku, který zahrnoval rodinnou anamnézu třesu nebo dystonie, příznaky onemocnění a jejich vývoj, komorbidity a vliv alkoholu a léků na projevy onemocnění. Klinické vyšetření zahrnovalo hodnocení klidového třesu horních končetin podle stupnice Movement Disorder Society – Unified Parkinson‘s Disease Rating Scale (MDS-UPDRS, část III, položka 17 a 18) [23] a přelévání 250 ml vody z jedné odměrky do druhé (celkem 3x tam a zpět). Poté byl stav pacienta hodnocen podle škály The Essential Tremor Rating Assessment Scale (TETRAS) [24] zahrnující dílčí škály Activities of Daily Living (ADL) a Performance Subscale (PS). Navíc bylo vypočteno skóre akčního třesu horních končetin součtem dílčích hodnot třesu horních končetin (TETRAS PS položka 4) na pravé a levé horní končetině (statický třes s nataženými končetinami, s končetinami v poloze křídel a intenční třes). Dále byla u pacientů stanovena míra CD podle škály Toronto Western Spasmodic Torticollis Rating Scale (TWSTRS) [25], z této škály byla zvlášť hodnocena část 1A, která byla založena na objektivním hodnocení. Nakonec byla hodnocena škála pro posuzování mozečkového postižení Scale for the Assessment and Rating of Ataxia (SARA) [26].
Vyšetření prahu pro somatosenzorickou časovou diskriminaci
STDT byl testován po klinickém vyšetření (tj. nejméně po 20 min při pokojové teplotě). Teplota kůže byla měřena na každé z testovaných rukou a u všech subjektů byla kožní teplota nad 30 °C. Vyšetření probíhalo v klidné místnosti vsedě.
Použili jsme elektromyografický přístroj Medelec Synergy (Surrey, Velká Británie), impulzy dodával zesilovací přístroj CED 1902 Quad-system (Cambridge, Velká Británie).
Na začátku byl na obou rukách pomocí povrchových adhezivních elektrod pořízen záznam senzitivního neurogramu mediálního nervu, abychom předešli vyšetřování pacientů s neuropatií tohoto nervu. Jako práh pro neuropatii byla stanovena rychlost vedení pod 50 m/s. Poté jsme stanovili práh citlivosti. Užity byly prsténkové elektrody umístěné na ukazováčku, přičemž anoda byla umístěna 5 mm distálně od katody. Užili jsme elektrické stimuly, které začínaly na 2 mA a zvyšovaly se o 0,2 mA s náhodně se měnící mezistimulovou pauzou 5 s ± 25 %. Metoda STDT byla realizována podle práce Tinazziho et al [27] s několika modifikacemi popsanými níže.
STDT byl stanoven dodáním dvojic impulzů o dvojnásobné hodnotě elektrického proudu, než byla hodnota prahu citlivosti. Mezistimulové intervaly (interstimulus interval; ISI) začínaly na 20 ms a zvyšovaly se vždy o 10 ms až na 400 ms. Kromě toho byly do celého protokolu pseudonáhodně rozmístěny stimuly s ISI 20 ms (celkem cca 20 % protokolu). Tyto stimuly měly zabránit předvídatelnosti dalšího vjemu. Subjekt byl instruován, aby po každém ze stimulů nahlásil, zda vnímal JEDEN nebo DVA impulzy. STDT byl určen jako ISI prvního ze tří po sobě jdoucích stimulů, které subjekt rozpoznal jako DVA. Stejné vyšetření bylo provedeno 4x pro každou ruku, u každého subjektu počínaje levou stranou. Celkový STDT byl vypočten jako průměr těchto osmi měření.
Statistické analýzy
Normalita výsledků hodnotících škál a výsledků STDT byla testována Shapir-Wilkovým testem. Průměry a směrodatné odchylky jsou uvedeny pro věk pacientů, věk nástupu obtíží a hodnoty STDT. Pro popis doby mezi nástupem třesu hlavy a nástupem CD a dále pro hodnoty jednotlivých škál a množství vylité vody byly použity mediány a interkvartilové rozptyly. Ke stanovení hladiny významnosti (p) meziskupinových srovnání pro parametrické hodnoty byl použit t-test pro 2 nezávislé hodnoty a pro neparametrické hodnoty Mann-Whitneyův U test. Pro srovnání pozitivní rodinné anamnézy a efektu alkoholu byl použit chí-kvadrát test. U meziskupinového srovnání hodnot STDT byla navíc spočítána analýza kovariace s věkem (ANCOVA). Pro vícenásobná srovnání byla hladina významnosti stanovena na 0,01. Výpočty byly provedeny pomocí softwaru STATISTICA 12.0 (StatSoft, Praha, ČR).
Výsledky
Klinické vyšetření a anamnestická data
Mezi pacienty s ET a CD nebyly zjištěny žádné významné rozdíly v rodinné anamnéze třesu, symptomech onemocnění pacienta a jejich progresi, komorbiditách a vlivu alkoholu (do hodnocení vlivu alkoholu na třes nebyli začleněni pacienti, kteří udali minimální či žádný příjem alkoholu, a tudíž jim tato informace nebyla známa). Věk nástupu prvního příznaku byl v obou skupinách podobný (tab. 1). V hodnotících škálách však byly mezi skupinami významné rozdíly. Škála TETRAS prokázala vyšší hodnocení třesu ve skupině ET ve srovnání se skupinou CD, a to jak v dílčím skóre aktivit denního života a objektivním hodnocení, tak v celkovém skóre TETRAS. Také dílčí skóre akčního třesu horních končetin bylo u pacientů s ET ve srovnání s pacienty s CD významně vyšší. Naopak podskupina s CD měla vyšší hodnoty v celkovém skóre TWSTRS i v podskóre závažnosti dystonie Ia. Podle škály SARA byly příznaky mozečkového postižení přítomny jak u pacientů s ET, tak u pacientů s CD, přičemž u podskupiny ET bylo postižení signifikantně vyšší. Další podrobnosti jsou uvedeny v tab. 1. V našem souboru se u pacientů s dystonickým třesem hlavy vyskytl třes hlavy jako první příznak onemocnění u 8 pacientů, abnormální postavení hlavy jako první příznak pouze u 3 pacientů a 10 pacientů referovalo nástup CD a třesu hlavy ve stejném věku. U prve zmíněných pacientů se abnormní stočení hlavy objevilo v mediánu 10,5 roku po nástupu třesu hlavy (mezikvartilové rozpětí 25 let).
Tab. 1. Výsledky anamnestických dat, hodnotících škál a STDT. Procenta vyjadřují zastoupení pozitivních hodnot, u škál a objemu vylité vody je uveden medián (interkvartilový rozptyl) a u věku začátku obtíží a STDT je uveden průměr ± směrodatná odchylka. 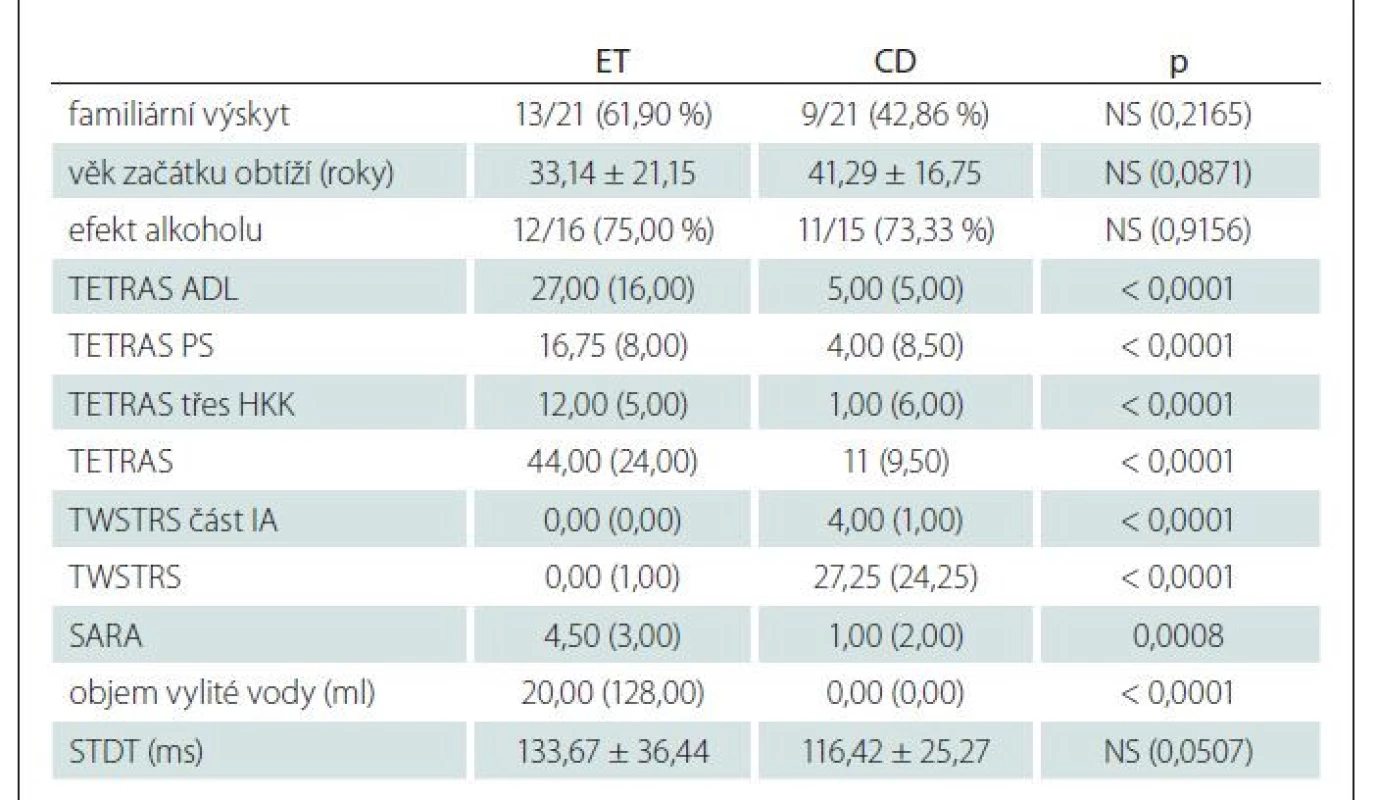
ADL – Activities of Daily Living; CD – pacienti s cervikální dystonií a dystonickým tremorem hlavy; ET – pacienti s esenciálním tremorem a tremorem hlavy; HKK – horní končetiny; NS – nesignifikantní; PS – Performance Subscale; SARA – Scale for the Assessment and Rating of Ataxia; STDT – práh pro somatosenzorickou časovou diskriminaci; TETRAS – The Essential Tremor Rating Assessment Scale; TWSTRS – Toronto Western Spasmodic Torticollis Rating Scale Práh pro somatosenzorickou časovou diskriminaci
Vyšetření STDT trvalo přibližně 20–40 min v závislosti na tíži nálezu. Hodnoty STDT byly u pacientů s třesem hlavy ve srovnání s HC nevýznamně vyšší (průměrná hodnota STDT 125,32 ± 32,69 oproti 98,75 ± 35,30 ms; p = 0,2366). Při porovnání jednotlivých podskupin (obr. 1) byl STDT významně vyšší u pacientů s ET ve srovnání s HC (133,67 ± 36,44 oproti 98,75 ± 35,30 ms; p = 0,0067). Vzhledem k nižšímu věku HC, než byl věk pacientů s ET (p = 0,01928), byly skupiny porovnány pomocí ANCOVA. V tomto porovnání se významně nelišily (p = 0,1160).
Obr. 1. Hodnoty prahů pro STDT u pacientů s ET, u pacientů s třesem hlavy při CD a u HC.
CD – cervikální dystonie; ET – esenciální třes a třes hlavy; HC – zdravé kontroly; SmCh – směrodatná chyba; SmOdch – směrodatná odchylka; STDT – práh pro somatosenzorickou časovou diskriminaci
Fig. 1. STDT in patients with ET, in patients with head tremor in CD and in HC.
CD – cervical dystonia; ET – essential tremor and head tremor; HC – healthy controls; SmCh – standard error; SmOdch – standard deviation; STDT – somatosensory temporal discrimination threshold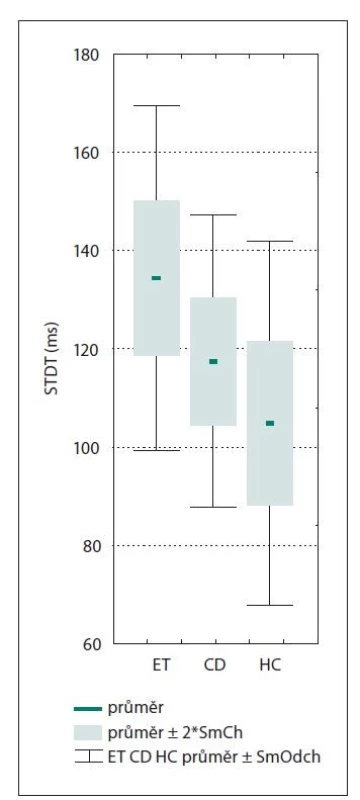
Diskuze
Cílem této studie bylo zjistit, zda pacienti s třesem hlavy mají abnormální STDT a zda toto hodnocení může podpořit rozlišení mezi pacienty s ET a dystonickým třesem hlavy. Nezjistili jsme signifikantní rozdíly v hodnotě STDT při porovnávání pacientů s třesem hlavy a zdravých kontrol. Na rozdíl od předchozích studií, které prokázaly abnormální prodloužení STDT u CD, nebyly zjištěny žádné rozdíly mezi pacienty s dystonickým třesem hlavy a HC. Naopak zvýšený STDT se objevil u našich pacientů s ET ve srovnání se HC. Toto zjištění není v souladu se studiemi, které uváděly zvýšené STDT u pacientů s CD ve srovnání s ET [16,17].
Jsou zde ovšem i studie, které pozorovaly normální hodnoty STDT u pacientů s CD [28,29], takže lze o současných výsledcích diskutovat i z hlediska rozdílů mezi testovacími protokoly. Bylo prokázáno, že hodnoty STDT se mohou lišit v závislosti na testovacím protokolu a individuálních proměnných, jako je věk [30]. Kromě modifikací původního vyšetřovacího protokolu [27] v důsledku odlišného technického vybavení mohl výsledky ovlivnit i nižší věk HC než pacientů s ET, proto byla provedena korekce s ohledem na věk a ta signifikanci nepotvrdila.
Je třeba hledat další vysvětlení, proč byl STDT u pacientů s ET s třesem hlavy významně zvýšen. STDT je měřítkem přesnosti časového zpracování smyslových informací na subkortikální i korové úrovni mozku [31]. Předchozí nálezy zvýšených hodnot STDT u dystonie byly přičítány narušení komunikace mezi kortikálními oblastmi, bazálními ganglii a mozečkem [31,32]. Předpokládala se zejména snížená aktivita inhibičních okruhů v rámci primární somatosenzorické kůry [17], pravděpodobně jako důsledek narušeného spojení subkortikálních oblastí a bazálních ganglií [33]. Studie [34], která zkoumala STDT v různých částech těla pacientů s fokální dystonií, ukázala, že STDT je zvýšený i v částech těla bez dystonie, a tedy že abnormality STDT jsou spíše obecným rysem u fokálních dystonií, než že by byly specifické pro postiženou oblast těla. Zajímavé je, že jedna dřívější studie uvádí abnormálně zvýšený STDT u pacientů s izolovaným třesem hlavy, ale nikoli u pacientů s ET se samotným třesem horních končetin nebo s třesem horních končetin plus hlavy [20]. Současné výsledky navíc naznačují, že výskyt třesu hlavy je spojen se zvýšeným STDT i u pacientů, kteří splňují současná klasifikační kritéria ET [4]. Zajímavé je, že u CD byly popsány vyšší hodnoty STDT u pacientů s třesem hlavy ve srovnání s pacienty bez třesu hlavy [21]. Lze tedy předpokládat, že pacienti s třesem hlavy představují specifickou podskupinu, a to jak mezi pacienty s ET, tak s CD. Tato myšlenka je zvláště zajímavá u pacientů s třesem hlavy, kde se až později rozvinou další příznaky umožňující jejich klasifikaci podle diagnostických kritérií CD nebo ET. Podobně jako v dřívější studii [15] byl třes hlavy počátečním znakem u podstatné části našich pacientů a předcházel vzniku dystonie až o několik let.
Postižení mozečku může představovat spojovací článek mezi abnormalitami STDT a třesem hlavy, a to jak u ET, tak u CD. Cerebelární okruhy se podílejí na rozvoji dystonie [35] a úloha mozečku, zejména oscilační smyčky mozeček-mozkový kmen, je dobře známa i v patogenezi ET [36,37]. U pacientů s ET byly navíc prokázány poruchy motorického a senzorického časování [38] a u pacientů s atrofií mozečku byl pozorován zvýšený STDT [39]. Narušené mozečkové mechanizmy vnímání času postihují zejména subsekundové intervaly, tj. ty, které se podílejí na STDT [40].
Závěry
Závěrem lze říct, že u pacientů s třesem hlavy byly pozorovány abnormálně zvýšené hodnoty STDT u pacientů s ET, ale ne u pacientů s CD a dystonickým třesem hlavy, pravděpodobně v důsledku narušených mechanizmů zpracování somatosenzorických podnětů a vnímání času, které se připisují postižení mozečku. Nicméně při srovnání vyšetřovaných skupin pacientů jsme nenašli signifikantní rozdíl v hodnotě STDT. Další výzkum by měl vysvětlit, proč jsou změny STDT zvláště výrazné u pacientů s třesem hlavy. Pozornost by měla být věnována hlavně porovnání STDT ještě u třetí skupiny pacientů, což jsou pacienti s ET bez třesu hlavy.
Etické aspekty
Studii schválila etická komise Všeobecné fakultní nemocnice v Praze (19.10.2017, č.j. 104/ 17) a každý účastník si přečetl a podepsal informovaný souhlas. Autoři prohlašují, že studie na lidských subjektech byla provedena v souladu s etickými standardy příslušné institucionární komise odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v roce 2000.
Finanční podpora
Tato studie byla podpořena Grantovou agenturou Univerzity Karlovy, grant č. 580218.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 2. 2. 2022
Přijato do tisku: 16. 3. 2022
MUDr. Petr Hollý
Neurologická klinika
1. LF UK a VFN v Praze
Kateřinská 30
120 00 Praha
e-mail: petr.holly@vfn.cz
Zdroje
1. Louis ED, Ottman R, Hauser WA. How common is the most common adult movement disorder? estimates of the prevalence of essential tremor throughout the world. Mov Disord 1998; 13(1): 5–10. doi: 10.1002/ mds.870130 105.
2. Louis ED, Ferreira JJ. How common is the most common adult movement disorder? Update on the worldwide prevalence of essential tremor. Mov Disord 2010; 25(5): 534–541. doi: 10.1002/ mds.22838.
3. Louis ED, Thawani SP, Andrews HF. Prevalence of essential tremor in a multiethnic, community-based study in northern Manhattan, New York. N.Y. Neuroepidemiology 2009; 32(3): 208–214. doi: 10.1159/ 000195691.
4. Bhatia KP, Bain P, Bajaj N et al. Consensus statement on the classification of tremors. from the task force on tremor of the International Parkinson and Movement Disorder Society. Mov Disord 2018; 33(1): 75–87. doi: 10.1002/ mds.27121.
5. Elble RJ. Diagnostic criteria for essential tremor and differential diagnosis. Neurology 2000; 54 (11 Suppl 4): S2–S6.
6. Louis ED. When do essential tremor patients develop head tremor? Influences of age and duration and evidence of a biological clock. Neuroepidemiology 2013; 41(2): 110–115. doi: 10.1159/ 000351698.
7. Lenka A, Bhalsing KS, Jhunjhunwala KR et al. Are patients with limb and head tremor a clinically distinct subtype of essential tremor? Can J Neurol Sci 2015; 42(3): 181–186. doi: 10.1017/ cjn.2015.23.
8. Hardesty DE, Maraganore DM, Matsumoto JY. Increased risk of head tremor in women with essential tremor: longitudinal data from the Rochester Epidemiology Project. Mov Disord 2004; 19(5): 529–533. doi: 10.1002/ mds.20096.
9. Louis ED, Ford B, Frucht S. Factors associated with increased risk of head tremor in essential tremor: a community - based study in northern Manhattan. Mov Disord 2003; 18(4): 432–436. doi: 10.1002/ mds.10395.
10. Defazio G, Gigante AF, Abbruzzese G et al. Tremor in primary adult-onset dystonia: prevalence and associated clinical features. J Neurol Neurosurg Psychiatry 2013; 84(4): 404–408. doi: 10.1136/ jnnp-2012-303782.
11. Albanese A, Bhatia KP, Bressman SB et al. Phenomenology and classification of dystonia: a consensus update. Mov Disord 2013; 28(7): 863–873. doi: 10.1002/ mds.25475.
12. Erro R, Rubio - Agusti I, Saifee TA et al. Rest and other types of tremor in adult-onset primary dystonia. J Neurol Neurosurg Psychiatry 2014; 85(9): 965–968. doi: 10.1136/ jnnp-2013-305876.
13. Jedynak CP, Bonnet AM, Agid Y. Tremor and idiopathic dystonia. Mov Disord 1991; 6(3): 230–236. doi: 10.1002/ mds.870060307.
14. Albanese A, Sorbo FD. Dystonia and tremor: The clinical syndromes with isolated tremor. Tremor Other Hyperkinet Mov (N Y) 2016; 6 : 319. doi: 10.7916/ D8X34XBM.
15. Rivest J, Marsden CD. Trunk and head tremor as isolated manifestations of dystonia. Mov Disord 1990; 5(1): 60–65. doi: 10.1002/ mds.870050115.
16. Tinazzi M, Fasano A, Di Matteo A et al. Temporal discrimination in patients with dystonia and tremor and patients with essential tremor. Neurology 2013; 80(1): 76 – 84. doi: 10.1212/ WNL.0b013e31827b1a54.
17. Antelmi E, Erro R, Rocchi L et al. Neurophysiological correlates of abnormal somatosensory temporal discrimination in dystonia. Mov Disord 2017; 32(1): 141–148. doi: 10.1002/ mds.26804.
18. Lee MS, Lee MJ, Conte A et al. Abnormal somatosensory temporal discrimination in Parkinson‘s disease: Pathophysiological correlates and role in motor control deficits. Clin Neurophysiol 2018; 129(2): 442–447. doi: 10.1016/ j.clinph.2017.11.022.
19. Tinazzi M, Fiorio M, Fiaschi A et al. Sensory functions in dystonia: insights from behavioral studies. Mov Disord 2009; 24(10): 1427–1436. doi: 10.1002/ mds.22490.
20. Conte A, Ferrazzano G, Manzo N et al. Somatosensory temporal discrimination in essential tremor and isolated head and voice tremors. Mov Disord 2015; 30(6): 822–827. doi: 10.1002/ mds.26163.
21. Conte A, Ferrazzano G, Belvisi D et al. Somatosensory temporal discrimination in Parkinson‘s disease, dystonia and essential tremor: Pathophysiological and clinical implications. Clin Neurophysiol 2018; 129(9): 1849–1853. doi: 10.1016/ j.clinph.2018.05.024.
22. Albanese A, Asmus F, Bhatia KP et al. EFNS guidelines on diagnosis and treatment of primary dystonias. Eur J Neurol 2011; 18(1): 5–18. doi: 10.1111/ j.1468 - 1331.2010.03042.x.
23. Goetz CG, Tilley BC, Shaftman SR et al. Movement Disorder Society-sponsored revision of the Unified Parkinson‘s Disease Rating Scale (MDS-UPDRS): scale presentation and clinimetric testing results. Mov Disord 2008; 23(15): 2129–2170. doi: 10.1002/ mds.22 340.
24. Elble R, Comella C, Fahn S et al. Reliability of a new scale for essential tremor. Mov Disord 2012; 27(12): 1567 – 1569. doi: 10.1002/ mds.25162.
25. Gayraud D, Viallet F. Evaluation of cervical dystonia. Usefulness of rating scales: the TWSTRS scale. Rev Neurol (Paris) 2008; 164 (12 Suppl): F263–F274. doi: 10.1016/ S0035-3787(08)75127-0.
26. Schmitz-Hubsch T, du Montcel ST, Baliko L et al. Scale for the assessment and rating of ataxia: development of a new clinical scale. Neurology 2006; 66(11): 1717–1720. doi: 10.1212/ 01.wnl.0000219042.60538.92.
27. Tinazzi M, Frasson E, Bertolasi L. Temporal discrimination of somesthetic stimuli is impaired in dystonic patients. Neuroreport 1999; 10(7): 1547–1550. doi: 10.1097/ 00001756-199905140-00028.
28. Ganos C, Ferre ER, Marotta A et al. Cortical inhibitory function in cervical dystonia. Clin Neurophysiol 2018; 129(2): 466–472. doi: 10.1016/ j.clinph.2017.11.020.
29. Sadnicka A, Daum C, Cordivari C et al. Mind the gap: temporal discrimination and dystonia. Eur J Neurol 2017; 24(6): 796–806. doi: 10.1111/ ene.13293.
30. Bradley D, Whelan R, Kimmich O et al. Temporal discrimination thresholds in adult-onset primary torsion dystonia: an analysis by task type and by dystonia phenotype. J Neurol 2012; 259(1): 77–82. doi: 10.1007/ s00415 - 011-6125-7.
31. Conte A, Defazio G, Hallett M et al. The role of sensory information in the pathophysiology of focal dystonias. Nat Rev Neurol 2019; 15(4): 224–233. doi: 10.1038/ s41582 - 019-0137-9.
32. Quartarone A, Hallett M. Emerging concepts in the physiological basis of dystonia. Mov Disord 2013; 28(7): 958–967. doi: 10.1002/ mds.25532.
33. Hutchinson M, Kimmich O, Molloy A et al. The endophenotype and the phenotype: temporal discrimination and adult-onset dystonia. Mov Disord 2013; 28(13): 1766 – 1774. doi: 10.1002/ mds.25676.
34. Scontrini A, Conte A, Defazio G et al. Somatosensory temporal discrimination in patients with primary focal dystonia. J Neurol Neurosurg Psychiatry 2009; 80(12): 1315–1319. doi: 10.1136/ jnnp.2009.178236.
35. Kaji R, Bhatia KP, Graybiel AM. Pathogenesis of dystonia: is it of cerebellar or basal ganglia origin? J Neurol Neurosurg Psychiatry 2018; 89(5): 488–492. doi: 10.1136/ jnnp-2017-316250.
36. Deuschl G, Wenzelburger R, Loffler K et al. Essential tremor and cerebellar dysfunction clinical and kinematic analysis of intention tremor. Brain 2000; 123(Pt 8): 1568 – 1580. doi: 10.1093/ brain/ 123.8.1568.
37. Benito-Leon J, Labiano-Fontcuberta A. Linking essential tremor to the cerebellum: clinical evidence. Cerebellum 2016; 15(3): 253–262. doi: 10.1007/ s12311-015-0741-1.
38. Bares M, Husarova I, Lungu OV. Essential tremor, the cerebellum, and motor timing: towards integrating them into one complex entity. Tremor Other Hyperkinet Mov (N Y) 2012; 2: tre-02-93-653-1.
39. Manganelli F, Dubbioso R, Pisciotta C et al. Somatosensory temporal discrimination threshold is increased in patients with cerebellar atrophy. Cerebellum 2013; 12(4): 456–459. doi: 10.1007/ s12311-012-0435-x.
40. Bares M, Apps R, Avanzino L et al. Consensus paper: decoding the contributions of the cerebellum as a time machine. from neurons to clinical applications. Cerebellum 2019; 18(2): 266–286. doi: 10.1007/ s12311-018-0979-5.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2022 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Poruchy rovnováhy u osob s roztroušenou sklerózou a možnosti rehabilitační terapie – aktuální poznatky kontrolovaných klinických studií
- Historický vývoj posturálnych stratégií a prehltacích manévrov v behaviorálnej liečbe orofaryngeálnej dysfágie
- Muzikoterapia pri poruchách hlasu a reči u pacientov s Parkinsonovou chorobou
- Efekt počítačového kognitivního tréninku na zlepšení kognitivních funkcí u seniorů bez kognitivní poruchy
- Cílená chirurgická léčba obstrukční spánkové apnoe
- Práh pro somatosenzorickou časovou diskriminaci nediferencuje mezi pacienty s esenciálním a dystonickým třesem hlavy
- Role adhezních molekul (ICAM-1 a VCAM-1) při akutní ischemické cévní mozkové příhodě
- Úspešná mechanická trombektómia ľavej hornej cerebelárnej artérie
- Úspěšná konzervativní terapie radikulopatie v terénu objemné hernie disku s nestabilitou u low back pain syndromu
- Intraventrikulární subependymom s intratumorálním prokrvácením imitující hemocefalus při aneuryzmatickém subarachnoidálním krvácení
- Myozitida s protilátkami proti NXP2
- Bilaterální amauróza jako vzácná komplikace obstrukčního hydrocefalu
- Zkušenosti s léčbou kryptokokové meningitidy
- Infiltrace zrakového nervu velkobuněčným B-lymfomem
- Z histórie Slovenskej neurologickej spoločnosti Slovenskej lekárskej spoločnosti
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cílená chirurgická léčba obstrukční spánkové apnoe
- Poruchy rovnováhy u osob s roztroušenou sklerózou a možnosti rehabilitační terapie – aktuální poznatky kontrolovaných klinických studií
- Úspěšná konzervativní terapie radikulopatie v terénu objemné hernie disku s nestabilitou u low back pain syndromu
- Muzikoterapia pri poruchách hlasu a reči u pacientov s Parkinsonovou chorobou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



