-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Tichý akútny a subakútny mozgový infarkt u pacientov pred koronárnou intervenciou
Acute and subacute silent cerebral infarction in patients before elective coronary intervention
Introduction:
The presence of silent cerebral infarction (SCI) might cause cognitive dysfunction, psychiatric disorders, stroke and earlier mortality. Exact incidence and prevalence of SCI is still not known, the results of previously published clinical trials vary. The aims of our study were to detect acute and subacute SCI using MRI in patients before elective coronary intervention, measure the volume of SCI and investigate the risk factors associated with SCI.Materials and methods:
Patients indicated for elective coronary angiography, angioplasty or stenting were enrolled in this study. Brain MRI was performed before cardiac intervention. The presence of acute and subacute SCI was evaluated, SCI volume was measured and risk factors associated with SCI were investigated. Cognitive functions were tested and correlated with SCI.Results:
Between November 2015 and July 2017, 144 patients were enrolled in the study (103 men, 41 women). At least one acute/ subacute SCI was detected on MRI in 9 out of 144 (6.3%) patients before cardiac intervention. History of stroke or transient ischemic attack (TIA) was associated with a higher risk of SCI (p = 0.05). Ipsilateral internal carotid artery stenosis > 50% was diagnosed in one patient. Patients with a history of stroke/ TIA had a larger volume of SCI (p = 0.008). We did not find stastistically significant differences in cognitive function tests between patients with SCI and without SCI (p > 0.05).Conclusion:
Acute/ subacute SCI was detected in 6.3% of patients indicated for elective coronary intervention. History of stroke or TIA was a predictor of the presence of SCI and also its volume. No correlation was found between SCI and cognitive dysfunction.Key words:
silent cerebral infarction – magnetic resonance imaging – stroke – coronary angiography – cognitive deficitThe authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
选择性冠状动脉介入治疗前患者急性和亚急性无症状脑梗死
介绍:
无症状脑梗塞(SCI)的存在可能导致认知功能障碍,精神疾病,中风和早期死亡。 SCI的确切发病率和患病率尚不清楚,以前发表的临床试验结果各不相同。 我们的研究目的是在选择性冠状动脉介入治疗前使用MRI检测急性和亚急性脊髓损伤,测量脊髓损伤的体积并调查与SCI相关的危险因素。
材料和方法:
选择性冠状动脉造影,血管成形术或支架置入术的患者参加了本研究。 在心脏介入前进行脑MRI检查。评估急性和亚急性SCI的存在,测量SCI体积并研究与SCI相关的风险因素。 测试认知功能并与SCI相关联。
结果:
2015年11月至2017年7月期间,共有144名患者参加了该研究(103名男性,41名女性)。在心脏介入治疗前144例患者中有9例(6.3%)在MRI上检测到至少一例急性/亚急性SCI。中风或短暂性脑缺血发作(TIA)的病史与SCI的高风险相关(p = 0.05)。 一名患者诊断出同侧颈内动脉狭窄> 50%。有卒中/TIA病史的患者脊髓损伤量较大(p = 0.008)。我们没有发现SCI患者和没有SCI患者的认知功能测试存在显著差异(p> 0.05)。
结论:
在选择性冠状动脉介入治疗的6.3%患者中检测到急性/亚急性SCI。 中风或TIA的病史是SCI存在及其体积的预测因子。 SCI与认知功能障碍之间未发现相关性。
关键词:
无症状脑梗塞 - 磁共振成像 - 中风 - 冠状动脉造影 - 认知缺陷
Autoři: D. Viszlayová 1,2,3; D. Školoudík 4,5; M. Brozman 1; K. Langová 5,6
; R. Herzig 7; L. Pátrovič 8; S. Királová 9
Působiště autorů: Neurologická klinika FSVaZ UKF a FN Nitra 1; Neurologická klinika LF UP, Olomouc 2; Neurologická klinika LF UK, Hradec Králové 3; Neurologická klinika 1. LF UK a VFN v Praze 4; Centrum vědy a výzkumu, FZV UP, Olomouc 5; Ústav lekářské biofyziky, LF UP, Olomouc 6; Komplexní cerebrovaskulární centrum, Neurologická klinika LF UK a FN Hradec Králové 7; Jessenius – diagnostické centrum a. s., Nitra 8; Ústav klinickej psychológie, FN Nitra 9
Vyšlo v časopise: Cesk Slov Neurol N 2018; 81(5): 563-569
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2018563Souhrn
Úvod:
Tichý mozgový infarkt (silent cerebral infarction; SCI) sa považuje za rizikový faktor postupného rozvoja kognitívnej dysfunkcie, psychiatrických ochorení, vzniku CMP a skoršej mortality. Presná incidencia a prevalencia SCI nie je známa a líši sa na základe výsledkov publikovaných klinických štúdií. Cieľom našej práce bolo zistiť výskyt incidentálnych akútnych a subakútnych SCI na MR mozgu a ich objem u pacientov pred plánovanou koronárnou intervenciou, ako aj posúdiť rizikové faktory vzniku SCI.Materiál a metodika:
Do štúdie boli zaradení pacienti pred elektívnou koronárnou angiografiou, angioplastikou alebo stentingom. Pred intervenciou absolvovali MR mozgu, na ktorom sa hodnotila prítomnosť akútneho a subakútneho SCI, jeho objem a vzťah jednotlivých rizikových faktorov k výskytu SCI. Zároveň sa hodnotil kognitívny deficit vo vzťahu k SCI.Výsledky:
Do štúdie bolo od novembra 2015 do júla 2017 zaradených 144 pacientov (103 mužov a 41 žien). Zo 144 pacientov malo prítomný minimálne jeden akútny/ subakútny SCI na MR pred koronárnou intervenciou 9 (6,3 %) pacientov. Jediným štatisticky významným rizikovým faktorom prítomnosti SCI bol vyšší výskyt prekonanej CMP/tranzitórneho ischemického ataku (TIA) v minulosti (p = 0,05). U jednej pacientky bola diagnostikovaná ipsilaterálna stenóza arteria carotis interna > 50 %. Objem mozgových ischemických ložísk bol väčší u pacientov s prekonanou CMP/ TIA v anamnéze (p = 0,008). Vyšetrenie kognitívnych testov nepotvrdilo štatisticky významné rozdiely medzi pacientami s SCI a pacientami bez SCI (p > 0,05).Záver:
U pacientov indikovaných k elektívnej koronárnej intervencii sa vyskytoval akútny/subakútny SCI v 6,3 %. Ako rizikový faktor prítomnosti a zároveň väčšieho objemu ischemických ložísk sa preukázala anamnéza prekonanej CMP/ TIA. Štúdia nepotvrdila štatisticky významný kognitívny deficit u pacientov s SCI oproti pacientom bez SCI.Kľúčové slová:
tichý mozgový infarkt – magnetická rezonancia – cievna mozgová príhoda – koronárna angiografia – kognitívny deficitÚvod
V roku 1965 bola publikovaná C. M. Fisherom prvá práca o výskyte mozgového infarktu bez sprievodných klinických príznakov [1]. Tichý mozgový infarkt (silent cerebral infarction; SCI) je definovaný ako mozgová lézia zistená zobrazovacím alebo neuropatologickým vyšetrením, ktorá nie je sprevádzaná príznakmi CMP alebo tranzitórneho ischemického ataku (TIA) [2]. SCI sa v súčasnosti nepovažuje za benígnu mozgovú ischémiu. Bol potvrdený vzťah SCI k postupnému rozvoju neurologických ťažkostí, kognitívnej dysfunkcie, psychiatrických ochorení, vzniku CMP a skoršej mortality [3–16]. Údaje o prevalencii SCI sa uvádzajú 5–62 %, prevaha dát však udáva rozpätie 10–20 % [16].
Tichý mozgový infarkt je najčastejším patologickým incidentálnym nálezom na CT alebo MR mozgu [17]. MR mozgu má väčšiu senzitivitu a špecificitu ako CT. Dokáže lepšie zobraziť a diferencovať malé kortikálne a subkortikálne infarkty, lakunárne infarkty, hyperintenzity v bielej hmote, perivaskulárne priestory, mozgovú atrofiu a iné štrukturálne lézie. Parametre zobrazenia SCI na MR uvádzajú detailne odporúčania American Heart Association/ American Stroke Association Statement 2017 a American College of Radiologists 2015 [17,18]. MR protokol má obsahovať nasledovné sekvencie: T1 váženie, difúziou vážený obraz (diffusion weighted imaging; DWI), aparentný difúzny koeficient (apparent diffusion coefficient; ADC), T2 váženie, fluid-attenuated inversion recovery (FLAIR), T2* váženie alebo susceptibility weighted imaging (SWI) prípadne gradient echo imaging (GRE). Má sa realizovať na MR prístroji so silou 1,5–3,0 T [17,18]. Akútne a subakútne SCI sú definované ako hyperintenzitné lézie na DWI korešpondujúce s hypointenzitnou oblasťou v ADC mape. Predpokladá sa, že trvanie („vek“) akútnych a subakútnych SCI predstavuje niekoľko hodín až týždňov [17–25]. SCI sa zobrazujú prevažne ako drobné subkortikálne lézie v non-elokventných zónach.
Kardioembolizácia patrí medzi najčastejšie príčiny akútnej ischemickej CMP. Významne rizikovú skupinu predstavujú pacienti s koronárnym ochorením srdca. Môžeme predpokladať, že kardioembolizácia bude tiež častou príčinou SCI u pacientov s koronárnym ochorením. Štúdia „Sonolysis in Risk Reduction of Symptomatic and Silent Brain Infarctions During Coronary Stenting (SONOREDUCE)“ sa zaoberala rizikom vzniku SCI počas koronárnych intervencií [26].
Primárnym cieľom predkladanej štúdie bolo zistiť výskyt incidentálnych akútnych a subakútnych SCI na MR mozgu u pacientov s koronárnym ochorením srdca pred elektívnou koronárnou angiografiou, angioplastikou alebo stentingom. Sekundárnym cieľom bolo identifikovať rizikové faktory prítomnosti a veľkosti (objemu) SCI a zhodnotiť kognitívne funkcie pred plánovanou koronárnou intervenciou a ich vzťah k SCI. Pilotná štúdia bola zrealizovaná ako podštúdia štúdie SONOREDUCE.
Etické schválenie protokolu štúdie
Štúdia bola realizovaná v súlade s Helsinskou deklaráciou z roku 1975 (a jej zmenami z rokov 2004 a 2008). Bola schválená lokálnou etickou komisiou FN Nitra (29. 4. 2014). Všetci pacienti pred zaradením do štúdie podpísali informovaný súhlas. Štúdia bola registrovaná v medzinárodnom registri Clinical Trials (NCT02351050).
Metodika práce
Pacienti
Do štúdie boli zaradení všetci pacienti, ktorí boli indikovaní na plánovanú koronárnu angiografiu, angioplastiku alebo stenting v období od novembra 2015 do januára 2017 a boli zaradení do štúdie SONOREDUCE. Vstupné kritériá boli: 1. indikácia na plánovanú koronárnu angiografiu, angioplastiku alebo stenting; 2. vek 35–90 rokov; 3. funkčná nezávislosť hodnotená modifikovanou Rankinovej škálou (mRS) v rozpätí 0–2 body. Vylučovacie kritériá boli: 1. kontraindikácia pre realizáciu MR mozgu (pacemaker, implantovaný kovový materiál, klaustrofóbia), 2. akútna koronárna intervencia; 3. akútny infarkt myokardu.
Magnetická rezonancia
Magnetická rezonancia sa realizovala na prístroji 1,5 T Avanto (Siemens, Erlangen, Nemecko). Protokol tvorili tri sekvencie: 1. transverzálne T2 vážené obrazy; 2. FLAIR; 3. DWI zobrazenie a ADC – parametrická mapa. Impedancia difúzie molekúl vody bola kvantitatívne hodnotená s pomocou troch rozličných hodnôt b faktora a následnej kalkulácie ADC parametrickej mapy. Sekvencie boli použité vždy na rovnakej úrovni, s rovnakou hrúbkou rezov a rovnakým počtom snímkov (rezov). Šírku rezu tvorila vlastná hrúbka rezu (5 mm) + vzdialenostný faktor (10 %). Štandardný počet rezov bol 25. Štandardná úroveň rezov bola považovaná za modifikovanú úroveň bázy lebky v dôsledku minimalizácie vzdialenostných artefaktov echo-planárnej zobrazovacej sekvencie.
Hodnotili sme výskyt akútneho a subakútneho SCI na MR mozgu pred plánovanou koronárnou intervenciou. Za akútny/ subakútny mozgový infarkt sme považovali hypersignálnu léziu na DWI. Táto lézia mala korelát zníženej hodnoty signálu na ADC mape. Staršie vaskulárne lézie charakteru chronických SCI boli hodnotené ako hyperintenzitné lézie v sekvenciách T2 a FLAIR [17–20]. Zároveň bol počítaný objem SCI.
Vyšetrenie vyhodnocoval rádiológ a neurológ. Nezrovnalosti sa riešili vzájomnou dohodou. Objem sa počítal manuálnou volumometrickou metódou ako celková plocha hyperintenzity DWI v každom jednotlivom reze vynásobená efektívnou hrúbkou rezu.
Klinické vyšetrenie
U všetkých pacientov boli zaznamenané vek, pohlavie, sledované ochorenia (arteriálna hypertenzia, ischemická choroba srdca, fibrilácia predsiení, prekonaný infarkt myokardu, diabetes mellitus, hyperlipidémia, prekonaná TIA alebo CMP, onkologické ochorenie, ischemická choroba dolných končatín, prekonaná embólia do pľúcnice, anamnéza koronárnej angioplastiky/ stentingu, aortokoronáreho bypassu), lieková anamnéza (typ a dávka antiagregačnej liečby, antikoagulanciá, hypolipidemiká), fajčenie, požívanie alkoholu, stenóza arteria carotis interna (ACI) ≥ 50 %, indikácia koronárnej intervencie (infarkt myokardu, ischemická choroba srdca, instabilná angina pectoris, srdcové zlyhávanie, embólia do arteria pulmonalis) a čas od vzniku srdcového ochorenia po katetrizačný výkon.
Pacienti absolvovali fyzikálne a neurologické vyšetrenie. Hodnotili sa výška, hmotnosť, body mass index, merali sa hodnoty krvného tlaku a pulzovej frekvencie. Neurologický nález sa hodnotil škálou National Institutes of Health Stroke Scale (NIHSS), funkčná nezávislosť pomocou mRS.
Vyšetrenie kognitívnych funkcií, ktoré podstúpili pacienti pred výkonom, tvorili Addenbrookský kognitívny test (ACE-R), Mini-Mental State Examination (MMSE), test hodín a test verbálnej fluencie.
Štatistická analýza
Porovnanie skupín v kategoriálnych znakoch bolo realizované pomocou Fisherovho presného testu. Údaje s normálnou distribúciou boli porovnávané dvojvýberovým t-testom. V ostatných kvantitatívnych a ordinálnych veličinách boli skupiny porovnávané neparametrickým Mann-Whitneyho U testom. Na výpočet korelácie medzi kvantitatívnymi a ordinálnymi veličinami bol použitý Spearmanov korelačný koeficient. Závislosť objemu na kvalitatívnych dátach bol overovaný Mann-Whitneyho U testom pre dichotomické dáta a pomocou Kruskal-Wallisovho testu pre dáta s viacerými kategóriami.
Štatistická analýza bola urobená pomocou programu SPSS verzia 23 (IBM Corp., Armonk, NY, USA). Všetky testy boli hodnotené na úrovni štatistickej významnosti p = 0,05.
Výsledky
V období od novembra 2015 do júla 2017 sme do štúdie zaradili 144 pacientov (103 mužov a 41 žien), ktorí mali plánovaný koronárny zákrok. Základná charakteristika súboru je uvedená v tab. 1.
Tab. 1. Základná charakteristika súboru pacientov. 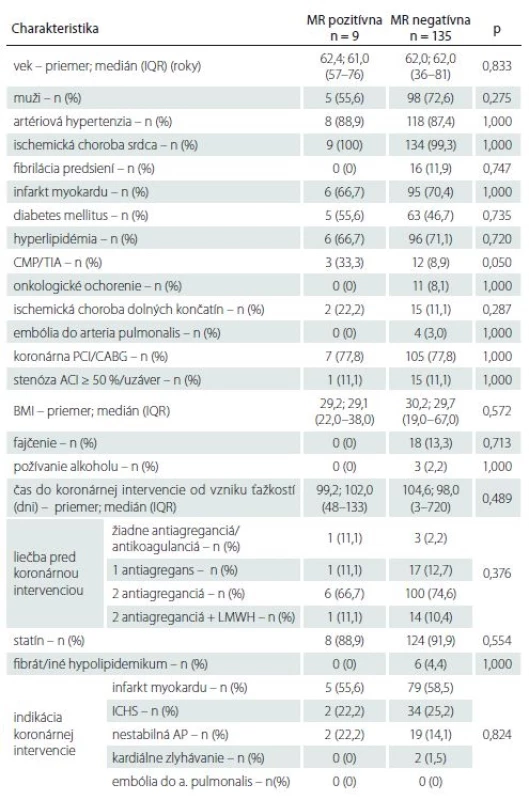
ACI – arteria carotis interna; AP – angina pectoris; BMI – body mass index; CABG – aortokoronárny bypass; ICHS – ischemická choroba srdca; IQR – interkvartilové rozpätie; LMWH – nízkomolekulový heparín; PCI – perkutánna koronárna intervencia; TIA –tranzitórny ischemický atak Zo 144 pacientov malo prítomný akútny/ subakútny SCI na MR pred koronárnou intervenciou 9 pacientov (6,3 %) a staršie vaskulárne lézie charakteru chronických SCI 111 (77,1 %) pacientov (obr. 1A–C). Vplyv rizikových faktorov na prítomnosť a objem SCI je uvedený v tab. 1–3. Jediným štatisticky významným rizikovým faktorom prítomnosti SCI bola prekonaná CMP/ TIA v minulosti (p = 0,05). Traja z deviatich (33,3 %) pacientov s SCI mali v anamnéze údaj o prekonanej CMP/ TIA v minulosti, ale len 12 zo 135 (8,9 %) pacientov bolo bez nálezu SCI. U jednej pacientky s SCI sme následne diagnostikovali ipsilaterálnu stenózu ACI > 50 %, ktorá bola plánovane ošetrená karotickou angioplastikou s implantáciou stentu. Táto pacientka v minulosti CMP neprekonala.
Analýza objemu mozgových ischémií preukázala, že väčší objem ischémie bol prítomný u pacientov s prekonanou CMP/ TIA v anamnéze (p = 0,008) (tab. 2 – 4).
Obr. 1. MR mozgu u pacienta s akútnym/subakútnym SCI parietálne vpravo. A – DWI; B – ADC obraz; C – FLAIR; D – T2 váženie. ADC – aparentný difúzny koeficient; DWI – difúziou vážený obraz; FLAIR – fluid-attenuated inversion recovery; SCI – tichý mozgový infarkt
Fig. 1. MRI in a patient with acute/subacute SCI in the right parietal region. A – DWI; B – ADC image; C – FLAIR; D – T2-weighted. ADC – apparent diffusion coefficient; DWI – diffusion weighted imaging; FLAIR – fluid-attenuated inversion recovery; SCI – silent cerebral infarction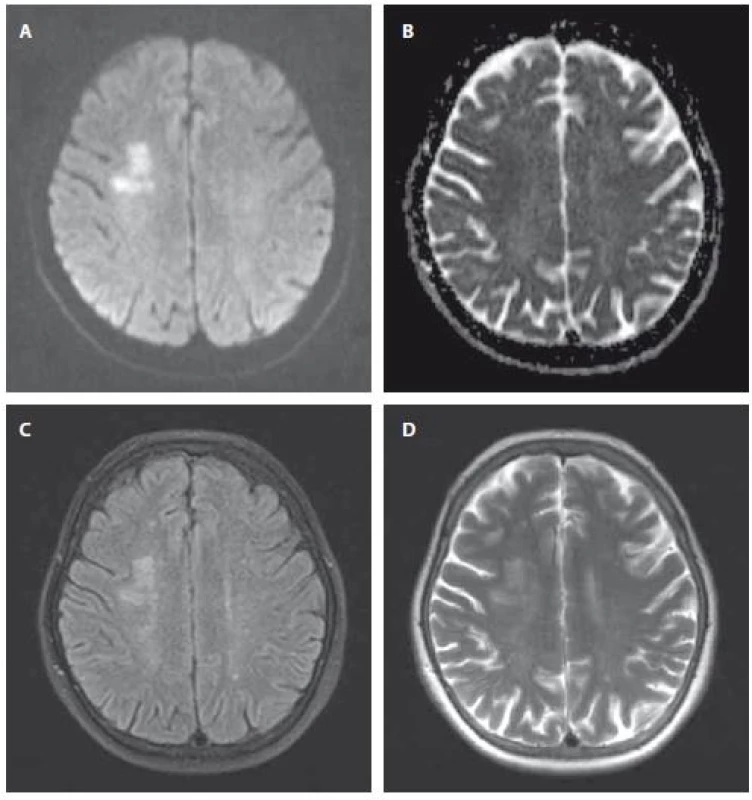
Tab. 2. Korelácia medzi kvantitatívnymi alebo ordinálnymi faktormi a objemom ischemického ložiska. 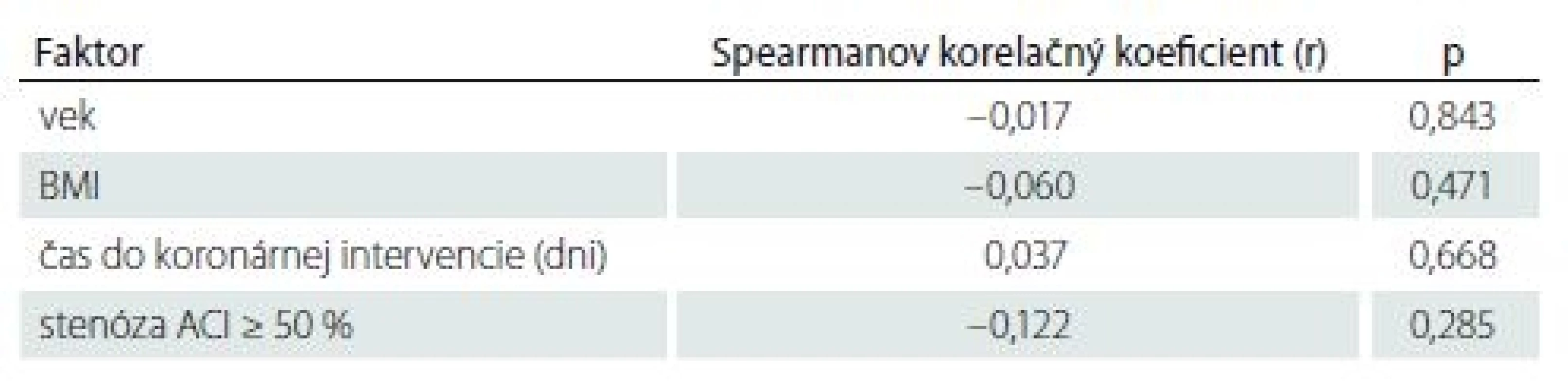
ACI – arteria carotis interna; BMI – body mass index Tab. 3. Vplyv kvalitatívnych faktorov na objem ischemického ložiska. 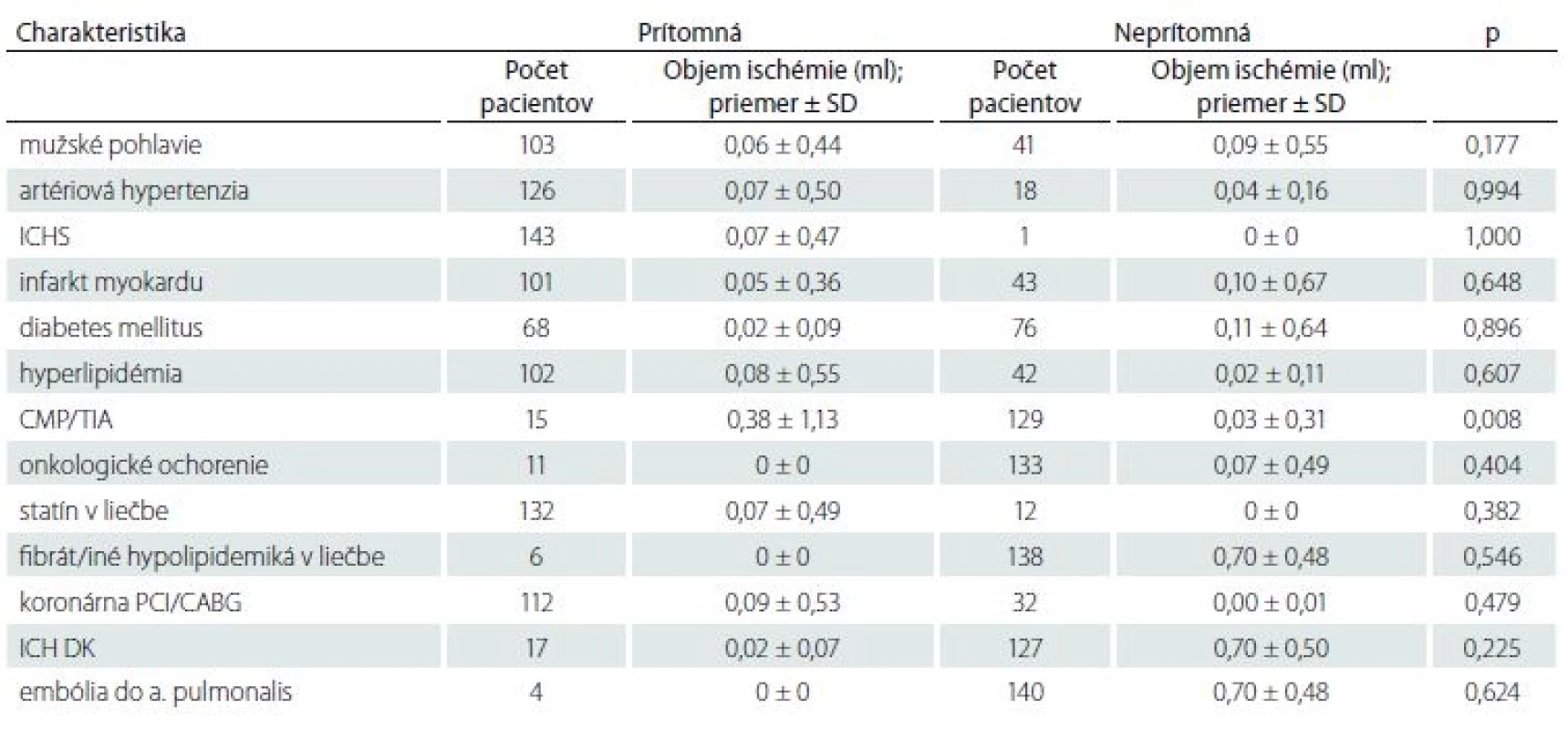
CABG – aortokoronárny bypass; ICH DK – ischemická choroba dolných končatín; ICHS – ischemická choroba srdca; PCI – perkutánna koronárna intervencia; SD – standard deviation; TIA – tranzitórny ischemický atak Tab. 4. Vplyv viacrozmerných kvalitatívnych faktorov na objem ischemického ložiska. 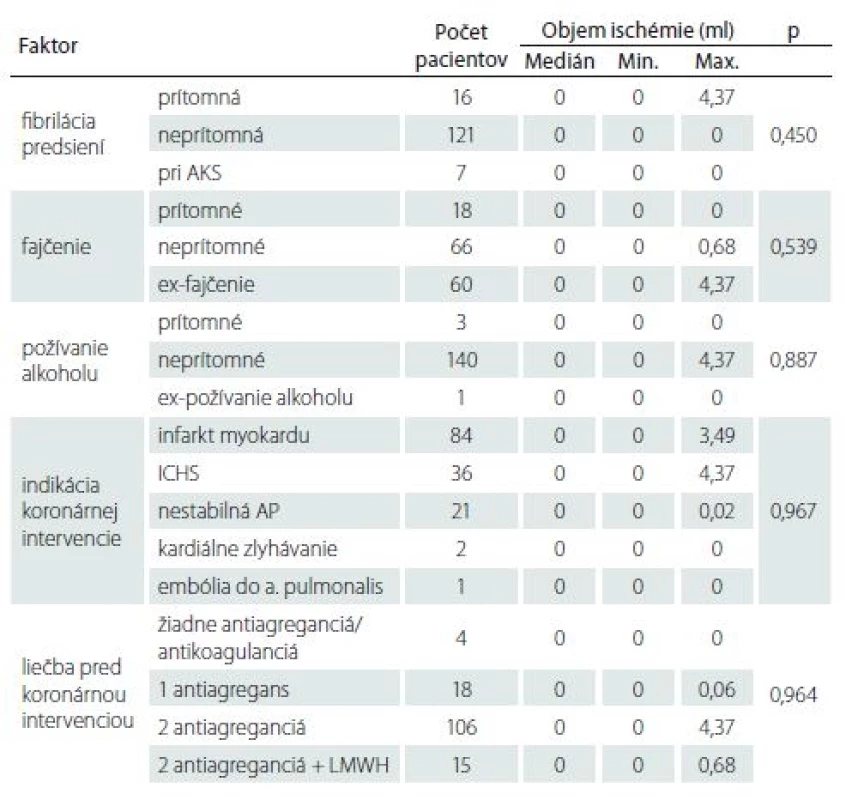
AKS – akútny koronárny syndróm; AP – angina pectoris; ICHS – ischemická choroba srdca; LMWH – nízkomolekulový heparín I keď pacienti s SCI mali horšie výsledky vo všetkých štyroch kognitívnych testoch ako pacienti bez SCI, žiadny z týchto rozdielov nedosiahol štatisticky významnú hodnotu (p > 0,05 vo všetkých prípadoch) (tab. 5). Nezistila sa štatisticky významná korelácia medzi výsledkami kognitívnych testov a objemom mozgovej ischémie (p > 0,05 vo všetkých prípadoch) (tab. 6).
Tab. 5. Výsledky kognitívnych testov. 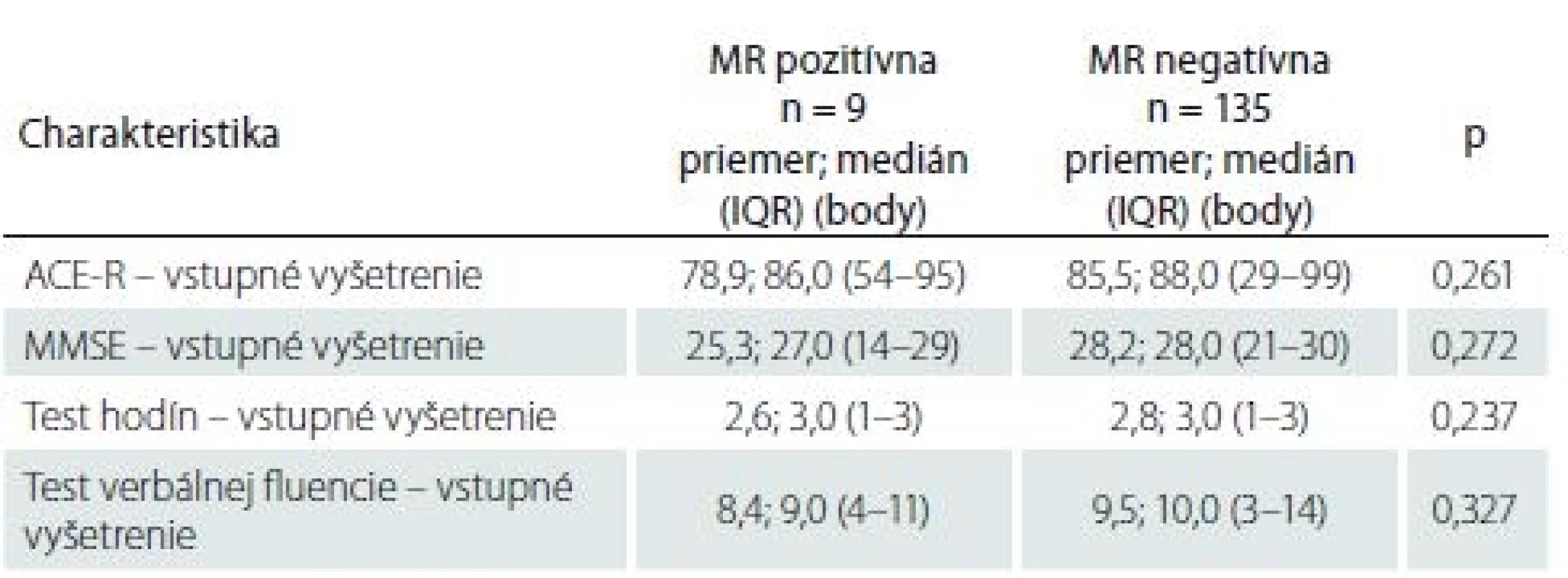
ACE-R – Adenbrookský kognitívny test; IQR – medzikvartilové rozpetie; MMSE – Mini-Mental State Examination Tab. 6. Korelácia medzi výsledkami kognitívnych testov a objemom ischemického ložiska. 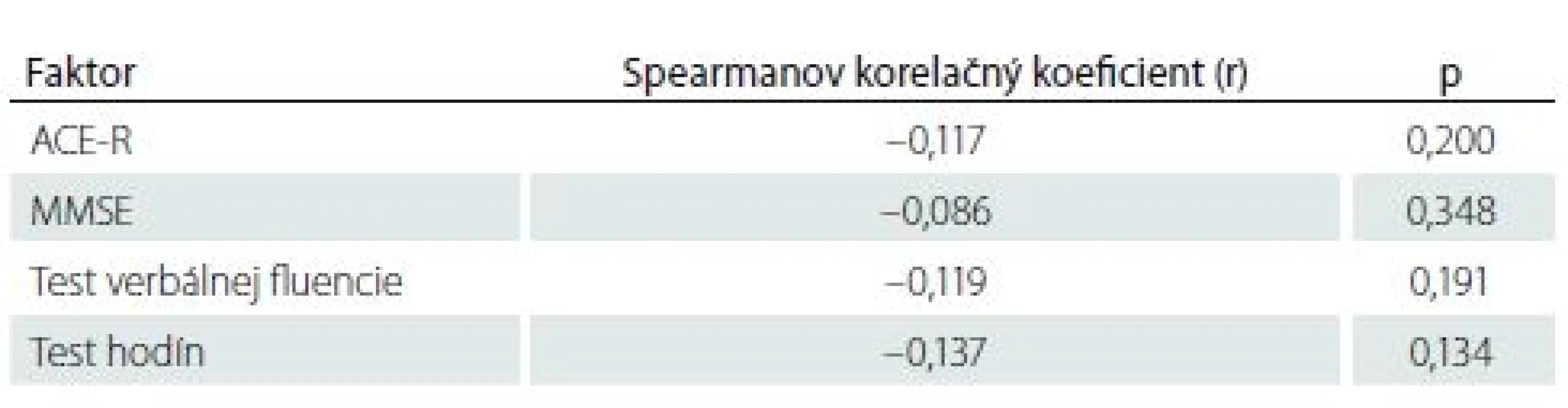
ACE-R – Adenbrookský kognitívny test; MMSE – Mini-Mental State Examination Diskusia
Tichý mozgový infarkt sa odlišuje od CMP tým, že v čase jeho vzniku nemá klinické prejavy, a preto ho nie je možné v akútnej fáze liečiť. Jeho klinický význam spočíva v tom, že sa považuje za možný „marker“ rizika vzniku CMP a kognitívnej dysfunkcie [3–16]. Údaje o reálnej prevalencii SCI sú v súčasnosti veľmi rôznorodé [16]. Publikované práce sa významne odlišujú z dôvodu rozdielnej definície SCI, rozdielnych sledovaných rizikových faktorov a zobrazovacej diagnostike – CT resp. MR [16]. Parametre MR vyšetrenia sa odlišujú v štúdiách podľa použitej magnetickej sily (0,02 – 15 T) a hrúbky rezov (4 mm, 6 mm a viac), ako aj použitých sekvencií.
Čas vzniku SCI nie je známy. Odlíšenie akútnych, subakútnych a chronických SCI je možné prostredníctvom MR mozgu. MR nám umožňuje rozdeliť mozgové ischémie na včasné hyperakútne (0–6 hodín), neskoré hyperakútne (6–24 hodín), akútne (1–7 dní), subakútne (1–3 týždne) a chronické (viac ako 3 týždne). Akútna ischémia je detekovateľná na DWI sekvencii najskôr 30 min od vzniku CMP. V akútnej fáze mozgového infarktu pretrváva na DWI signál vysokej intenzity (obr. 1A). Na ADC mape dochádza postupne k poklesu signálu, max. pokles nastáva medzi 1.–5. dňom (obr. 1B). V subakútnej fáze infarktu (7.–15. deň) dochádza k „pseudonormalizácii“ hodnôt ADC. Tieto stúpajú oproti akútnej fáze, kedy poklesli na minimum. Po 2. týždni ischémie pokračuje zvyšovanie intenzity na ADC mape a ischemické lézie sa stávajú hypersignálne. Sekvencie T2 a FLAIR sú vo včasnom hyperakútnom štádiu v norme. V subakútnej a chronickej fáze sa ischémia zobrazuje v T2 a FLAIR hypersignálne (obr. 1C, D). Dôležitou sekvenciou pre detekciu chronických SCI je T1 sekvencia. V nej dokážeme odlíšiť lakunárne zmeny od rozšírených perivaskulárnych priestorov, bielu a šedú hmotu, ako aj hodnotiť mozgovú atrofiu [19–25].
Prevaha realizovaných štúdií bola zameraná na detekciu chronických SCI [27]. Za najvýznamnejší rizikový faktor vzniku chronických SCI sa považuje vek. Faning publikoval metaanalýzu, v ktorej odds ratio prevalencie SCI stúpal každý rok z 1,03 (95% CI 0,98–1,08) na 1,13 (95% CI 1,09–1,18) a každú dekádu z 2,44 (95% CI 1,84–3,23) na 3,21 (95% CI 2,17–4,74) [16]. Približne 25 % ľudí starších ako 80 rokov má prítomný viac ako jeden SCI na zobrazovacom vyšetrení mozgu [17].
Za silné rizikové faktory vzniku SCI sa považujú vek, artériová hypertenzia, chronické obličkové ochorenia, metabolický syndróm a zúženie karotických tepien. Ďalšími rizikovými faktormi sú srdcové zlyhávanie, ischemická choroba srdca, hyperhomocysteinémia a syndróm obštrukčného spánkového apnoe [16]. Srdcové ochorenia, najmä fibrilácia predsiení, kardiomyopatie, otvorené foramen ovale, katetrizačné a operačné výkony na srdci predstavujú tiež riziko vzniku SCI [28–32].
Informácií o výskyte akútnych a subakútnych SCI je v súčasnosti dostupných málo. Naša štúdia preukázala výskyt incidentálneho akútneho a subakútneho SCI v populácii pacientov pred plánovanou koronárnou intervenciou 6,3 %. Yamada et al publikovali prácu, v ktorej absolvovalo MR mozgu z rôznej indikácie 16 206 pacientov. Celkom 72 % z nich bolo vo veku nad 65 rokov. Výskyt akútnych SCI zaznamenali u 60 (0,37 %) pacientov. Indikácia MR mozgu bola veľmi variabilná, najčastejšími indikáciami boli kontrolné MR mozgu po prekonanej CMP v minulosti a poruchy pamäti. Až 92 % pacientov malo prítomný min. jeden rizikový vaskulárny faktor – 58 % artériovú hypertenziu, 30 % hyperlipidémiu a 12 % fibriláciu predsiení [33]. Ďaľšia štúdia, ktorá sa venovala MR detekcii akútnych SCI, potvrdila výskyt u 6 zo 649 pacientov (0,92 %). Jednalo sa o skupinu pacientov, ktorí boli zaradení do výskumu demencie. Priemerný vek pacientov bol 79,3 ± 4,6 roka, každý pacient mal aspoň jeden rizikový vaskulárny faktor a v anamnéze nikdy neprekonal CMP. Päť pacientov malo signifikantný kognitívny deficit. U troch pacientov bol v priebehu 4 dní po realizácii MR zaznamenaný prechodný neurologický deficit (u dvoch poruchy pamäti a u jedného ataxia) [34].
V našej práci mali pacienti s pozitívnou MR vo vzťahu k SCI priemerný vek 62,4 rokov. Zastúpenie rizikových vaskulárnych faktorov bolo vysoké. Všetci pacienti s nálezom SCI mali ischemickú chorobu srdca (100 %), 88,9 % artériovú hypertenziu, 66,7 % hyperlipidémiu, 66,7 % pacientov prekonalo infarkt myokardu. Množstvo štúdií potvrdilo riziko vzniku SCI u pacientov s fibriláciou predsiení [27–29]. Na základe ich výsledkov sa udáva prevalencia SCI 15–50 % a asociované riziko so vznikom klinicky manifestného mozgového infarktu v 3-ročnom sledovaní po akútnom SCI 7 %. V našom súbore fibriláciu predsiení nemal zdokumentovanú žiadny pacient, ktorý mal nález SCI.
V našej štúdii sa ako hlavný rizikový faktor vzniku SCI preukázala prekonaná CMP/ TIA v minulosti. Vznik akútnych SCI bol popísaný u pacientov po symptomatickom mozgovom infarkte [35–43]. Akútny SCI, detekovaný na MR do 7 dní od vzniku symptomatickej ischémie, sa vyskytoval u 24,2–34,3 % pacientov. Táto skupina pacientov mala vyššie zastúpenie aterosklerózy veľkých mozgových tepien a častejšie im bola podaná intravenózna trombolýza. Incidencia SCI, ktoré vznikli v neskoršej fáze po ikte – počas nasledujúcich 30–90 dní, sa uvádza v rozmedzí 22,1–26,3 % [35,36].
Tichý mozgový infarkt sa súčasne považuje za rizikový faktor vzniku symptomatického mozgového infarktu [3]. Dve japonské práce potvrdili tento vzťah u pacientov, ktorí mali nález SCI na MR mozgu a neprekonali v minulosti CMP [11,12]. Symptomatickú CMP zaznamenali u 7,3 % pacientov s SCI v porovnaní s 3,8 % bez výskytu SCI (hazard ratio 1,5) počas 4-ročného sledovania v Cardiovascular Health Study [15]. Rotterdam Scan Study z roku 2003 preukázala 3,4-násobne vyšší výskyt CMP u pacientov po SCI v sledovanom priemernom intervale 3,4 roka (adjusted hazard ratio 3,9) [14].
Výsledky štúdie PRoFESS z roku 2012 preukázali, že súčasný výskyt CMP a SCI významne zvyšoval riziko recidívy CMP (13,0 vs. 9,2 %) v horizonte 2,5 roka. Zároveň bol potvrdený vyšší výskyt iných vaskulárnych príhod a zaznamenaná vyššia mortalita u pacientov, u ktorých bol SCI detekovaný [36].
Predpokladá sa, že etiológia SCI sa nemusí zhodovať s etiológiou CMP. Prevažná väčšina SCI na MR by mala byť asociovaná s ochorením malých mozgových tepien (small vessel disease), a to v 85–90 %. Zvyšných 10–15 % SCI by mali tvoriť kortikálne infarkty alebo väčšie subkortikálne infarkty (> 15 mm), ktoré sú spôsobené ochorením veľkých tepien, kardioembolizmom alebo inou príčinou ako ochorenie malých tepien [17]. V štúdii českých autorov sa u akútne prijatých pacientov do komplexného cerebrovaskulárneho centra pre ischemickú CMP potvrdila ako potenciálna príčina iktu srdcová patológia u 46,1 % pacientov. Použité boli klasifikácie etiológie CMP ASCOD (A – atherosclerosis; S – small-vessel disease; C – cardiac pathology; O – other causes; D – dissection) a TOAST (trial of ORG 10172 in acute stroke treatment) [21].
Klinický význam SCI sa považuje za dôležitý predovšetkým z dôvodu zvýšeného rizika vzniku symptomatickej CMP, ale aj možného rozvoja zmiešanej a vaskulárnej demencie. U týchto pacientov je potrebná dôkladná diferenciálna diagnostika etiológie SCI a zároveň preventívna medikamentózna liečba. Problematika si vyžaduje ďalšie klinické štúdie, ktoré by mali mať jednotnú definíciu SCI a jednotný zobrazovací protokol. Tiež je potrebné realizovať opakované MR vyšetrenia v definovaných časových intervaloch. Prevaha štúdií bola doposiaľ zameraná na analýzu chronických SCI, preto je potrebné doplniť výskum so zameraním na akútne SCI. Okrem sledovania MR bude určite prínosné sledovanie kognitívneho stavu pacientov v dlhšom časovom období. V našej štúdii sme zistili horšie výsledky kognitívnych testov u pacientov s SCI, ale rozdiel nedosiahol štatistickú významnosť oproti pacientom bez SCI. Kontrolné kognitívne testy po 2 rokoch sú plánované. Zároveň realizujeme komplexné klinické kontrolné vyšetrenia po 2 rokoch od katetrizácie, ktoré odhalia, koľko pacientov prekonalo v tomto období klinicky manifestnú CMP.
Za limitácie našej štúdie považujeme nízky počet zaradených pacientov, nehomogenitu z hľadiska pohlavia (prevaha mužov) a chýbajúce kontrolné vyšetrenia kognitívnych funkcií s odstupom času.
Záver
Výsledky našej štúdie preukázali, že výskyt incidentálneho akútneho a subakútneho SCI na MR mozgu u pacientov pred plánovanou koronárnou intervenciou bol 6,3 %. Štatisticky významným rizikovým faktorom pre vznik SCI bola prekonaná CMP alebo TIA v minulosti. Anamnéza prekonanej CMP/ TIA bola zároveň asociovaná s väčším objemom SCI. Štatisticky významné rozdiely v kognitívnom deficite sme u pacientov s SCI nezistili.
Štúdia bola podporená grantom Internej grantovej agentúry LF UP v Olomouci (IGA_LF_2017_025) a čiastočne grantom MŠMT ČR (PROGRES Q40).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Daša Viszlayová
Neurologická klinika FN a FSVaZ UKF
Špitálska 6
950 01 Nitra
e-mail: d.viszlayova@gmail.com
Přijato k recenzi: 12. 1. 2018
Přijato do tisku: 19. 7. 2018
Zdroje
1. Fisher CM. Lacunes: small, deep cerebral infarcts. Neurology 1965; 15(8): 774–784. doi: 10.1212/ WNL.15.8.774.
2. Sacco RL, Kasner SE, Broderick JP et al. An updated definition of stroke for the 21st century: a statement for healthcare professional from the American Heart Association/ American Stroke Association. Stroke 2013; 44(7): 2064–2089. doi: 10.1161/ STR.0b013e318296aeca.
3. Avdibegovic E, Becirovic E, Salimbasic Z et al. Cerebral cortical atrophy and silent brain infarcts in psychiatric patients. Psychiatr Danub 2007; 19(1–2): 49–55.
4. Price TR, Manolio TA, Kronnal RA et al. Silent brain infarction on magnetic resonance imaging and neurological abnormalities in community-dwelling older adults. The cardiovascular health study. CHS Collaborative Research Group. Stroke 1997; 28(6): 1158–1164. doi: 10.1161/ 01.STR.28.6.1158.
5. Liebetrau M, Steen B, Hamann GF et al. Silent and symptomatic infarcts on cranial computerized tomography in relation to dementia and mortality: a population-based study in 85-year-old subjects. Stroke 2004; 35(8): 1816–1820. doi: 10.1161/ 01.STR.0000131928.47478.44.
6. Song IU, Kim JS, Kim YI et al. Clinical signifikance of silent cerebral infarctions in patiens with Alzheimer disease. Cogn Behav Neurol 2007; 20(2): 93–98. doi: 10.1097/ WNN.0b013e31805d859e.
7. Wright CB, Festa JR, Paik MC et al. White matter hyperintensities and subclinical infarction: associations with psychomotor speed and cognitive flexibility. Stroke 2008; 39(3): 800–805. doi: 10.1161/ STROKEAHA.107.484147.
8. Fujikawa T, Yamawaki S, Touhouda Y. Silent cerebral infarctions in patiens with late-onset mania. Stroke 1995; 26(6): 946–949. doi: 10.1161/ 01.STR.26.6.946.
9. Hamada T, Murata T, Omori M et al. Abnormal nocturnal blood pressure fall in senile-onset depression with subcortical silent cerebral infarction. Neuropsycho-biology 2003; 47(4): 187–191. doi: 10.1159/ 000071213.
10. Yamashita H, Fujikawa T, Yanai I et al. Cognitive dysfunction in recovered depressive patiens with silent cerebral infarction. Neuropsychobiology 2002; 45(1): 12–18. doi: 10.1159/ 000048667.
11. Bokura H, Kobayashi S, Yamaguchi S et al. Silent brain infarction and subcortical white matter lesions increase the risk of stroke and mortality: a prospective cohort study. J Stroke Cerebrovasc Dis 2006; 15(2): 57–63. doi: 10.1016/ j.jstrokecerebrovasdis.2005.11.001.
12. Kobayashi S, Okada K, Koide H et al. Subcortical silent brain infarction as a risk factor for clinical stroke. Stroke 1997; 28(10): 1932–1939. doi: 10.1161/ 01.STR.28.10.1932.
13. Putaala J, Haapaniemi E, Kurkinen M et al. Silent brain infarcts, leukoaraiosis, and long-term prognosis in young ischemic stroke patients. Neurology 2011; 76(20): 1742–1749. doi: 10.1212/ WNL.0b013e31821a44ad.
14. Vermeer SE, Hollander M, van Dijk EJ et al. Silent brain infarcts and white matter lesions increase strokerisk in the general population: the Rotterdam scan study. Stroke 2003; 34(5): 1126–1129. doi: 10.1161/ 01.STR.0000068408.82115.D2.
15. Longstreth WT, Dulberg C, Manolio TA et al. Incidence, manifestations, and predictors of brain infarcts defined by serial cranial magnetic resonance imaging in the elderly: the cardiovascular health study. Stroke 2002; 33 : 2376–2382. doi: 10.1161/ 01.STR.0000032241.58727.49.
16. Faning JP, Wong AA, Fraser JF. The epidemiology of silent brain infraction: a systematic review of population-based cohorts. BMC Med 2014; 12 : 119. doi: 10.1186/ s12916-014-0119-0.
17. Smith E, Saposnik G, Biessels GJ et al. Prevention of stroke in patients with silent cerebrovascular disease. a scientific statement for healthcare prof-fesionals from the American Heart Association/ American Stroke Association. Stroke 2017; 48(2): e44–e71. doi: 10.1161/ STR.0000000000000116.
18. American College of Radiology. ACR-ASNR-SPRpractice parameter for the performance and interpretation of magnetic resonance imaging of the brain. [online]. Available from URL: https:/ / www.acr.org/ -/ media/ ACR/ Files/ Practice-Parameters/ MR-Brain.pdf.
19. Zhu YC, Dufouil C, Tzourio C et al. Silent brain infarcts: a review of MRI diagnostic criteria. Stroke 2011; 42(4): 1140–1145. doi: 10.1161/ STROKEAHA.110.600114.
20. Marks MP, de Crespigny A, Lentz D et al. Acute and chronic stroke: navigated spin-echo diffusion-weighted MR imaging. Radiology 1996; 199(2): 403–408. doi: 10.1148/ radiology.199.2.8668785.
21. Bokura H, Kobayashi S, Yamaguchi S et al. Distinguishing silent lacunar infarction from enlarged Virchow-Robin spaces: a magnetic resonance imaging and pathological study. J Neurol 1998; 245 : 116–122.
22. Inoue M, Mlynash M, Christensen S et al. Early diffusion-weighted imaging reversal after endovascular reperfusion is typically transient in patients imaged 3 to 6 hours after onset. Stroke 2014; 45(4): 1024–1028. doi: 10.1161/ STROKEAHA.113.002135.
23. Campbell B, Purushotham A, Christensen S et al. For the epithet–defuse investigators. The infarct core is well represented by the acute diffusion lesion: sustained reversal is infrequent. J Cereb Blood Flow Metab 2012; 32(1): 50–56. doi: 10.1038/ jcbfm.2011.102.
24. Allen L, Hasso AN, Handwerker J et al. Sequence-specific MR imaging findings that are useful in dating ischemic stroke. Radiographics 2012; 32(5): 1285–1297. doi: 10.1148/ rg.325115760.
25. Srinivasan A, Goyal M, Al Azri F et al. State-of-the-art imaging of acute stroke. Radiographics 2006; 26 (Suppl 1): S75–S95. doi: 10.1148/ rg.26si065501.
26. Viszlayová D, Brozman M, Langová K et al. Sonolysis in risk reduction of symptomatic and silent brain infarctions during coronary stenting (SONOREDUCE): randomized, controlled trial. Int J Cardiol 2018; 267 : 62–67. doi: 10.1016/ j.ijcard.2018.05.101.
27. Vermeer SE, Longstreth WT Jr, Koudstall PJ. Silent brain infarcts: a systematic review. Lancet Neurol 2007; 6(7): 611–619. doi: 10.1016/ S1474-4422(07)70170-9.
28. Sato H, Koretsune Y, Fukunami M et al. Aspirin attenuates the incidence of silent brain lesions in patiens with nonvalvular atrial fibrillation. Circ J 2004; 68(5): 410–416.
29. EAFT Study Group. Silent brain infarction in nonrheumatic atrial fibrillation: European atrial fibrillation trial. Neurolog 1996; 46(1): 159–165.
30. Ezekowitz MD, James KE, Nazarian SM et al. Silent cerebral infarction in patiens with nonrheumatic atrial fibrillation. Circulation 1995; 92(8): 2178–2182.
31. Siachos T, Vanbakel A, Feldman DS et al. Silent strokes in patiens with heart failure. J Card Fail 2005; 11(7): 485–489. doi: 10.1016/ j.cardfail.2005.04.004.
32. Kozdag G, Ciftci E, Ural D et al. Silent cerebral infarction in chronic heart failure: ischemic and nonischemic dilated cardiomyopathy. Vasc Health Risk Manag 2008; 4(2): 463–469.
33. Yamada K, Nagakane Y, Sasajima H et al. Incidental acute infarcts identified on diffusionweighted images: a university hospital-based study. AJNR Am J Neuroradiol 2008; 29(5): 937–940. doi: 10.3174/ ajnr.A1028.
34. Saini M, Ikram K, Hilal S et al. Silent stroke not listened to rather than silent. Stroke 2012; 43(11): 3102–3104. doi: 10.1161/ STROKEAHA.112.666461.
35. ClinicalTrials.gov. Effects of TIVA with propofol versus inhalational anaesthesia on postoperative pain after hepatectomy. [online]. Available from: http:/ / clinicaltrials.gov/ ct2/ show/ .
36. Bernick C, Kuller L, Dulberg C et al. Silent MRI infarcts and the risk of future stroke: the cardiovascular health study. Cardiovascular health study collaborative reseach group. Neurology 2001; 57(7): 1222–1229.
37. Weber R, Weimar C, Wanke I et al. Risk of recurrent stroke in patiens with silent brain infarction in the PRoFESS imaging substudy. Stroke 2012; 43(2): 350–355. doi:10.1161/ STROKEAHA.111.631739.
38. Lee EJ, Kank DW, Warach S. Silent new brain lesions: innocent bystander or guilty party? J Stroke 2016; 18(1): 38–49. doi: 10.5853/ jos.2015.01410.
39. Kang DW, Latour LL, Chalela JA et al. Early ischemic lesion recurrence within a week after acute ischemic stroke. Ann Neurol 2003; 54(1): 66–74. doi: 10.1002/ ana.10592.
40. Kang DW, Latour LL, Chalela JA et al. Early and late recurrence of ischemic lesion on MRI: evidence for a prolonged stroke-pronestate? Neurology 2004; 63(12): 2261–2265.
41. Kang DW, Lattimore SU, Latour LL et al. Silent ischemic lesion recurrence on magnetic resonance paging predicts subsequent clinical vascular events. Arch Neurol 2006; 63(12): 1730–1733. doi: 10.1001/ archneur.63.12.1730.
42. Nolte CH, Albach FN, Heuschmann PU et al. Silent new DWI lesions with in the first week after stroke. Cerebrovasc Dis 2012; 33(3): 248–254. doi: 10.1159/ 000334665.
43. Král M, Šaňák D, Školoudík D et al. Kardioembolizace je nejčastější příčinou akutní ischemické cévní mozkové příhody u pacientů přijatých do Komplexního cerebrovaskulárního centra do 12 hodin od začátku příznaků –výsledky studie HISTORY. Cesk Slov Neurol N 2016, 79/ 112(1): 61–67. doi: 10.14735/ amcsnn201661.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Nejlepší postup v terapii motoricky pokročilé Parkinsonovy nemoci je INTRADUODENÁLNÍ LEVODOPAČlánek Najlepší postup v terapii motoricky pokročilej Parkinsonovej nemoci je HLBOKÁ MOZGOVÁ STIMULÁCIAČlánek Vztah mezi epidemiologií a subjektivním vnímáním bolesti u pacientů se syndromem karpálního tuneluČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2018 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Anestezie a nervosvalová onemocnění
- Nejlepší postup v terapii motoricky pokročilé Parkinsonovy nemoci je INTRADUODENÁLNÍ LEVODOPA
- Nejlepší postup v terapii motoricky pokročilé Parkinsonovy nemoci je APOMORFINOVÁ INFUZE
- Najlepší postup v terapii motoricky pokročilej Parkinsonovej nemoci je HLBOKÁ MOZGOVÁ STIMULÁCIA
- Nejlepší postup v terapii motoricky pokročilé Parkinsonovy nemoci je intraduodenální levodopa, apomorfi nová infuze nebo DBS?
- Cervikální vertigo – fikce či realita?
-
Cervikální vertigo – fikce či realita?
Komentář k článku Z. Kadaňky Jr. et al - Péče o pacienty s dysfagií po cévní mozkové příhodě v České republice
- Matematické modelování hemodynamiky mozkových aneuryzmat a možný přínos v klinické praxi z pohledu neurochirurga
- Přehled onemocnění s obrazem restrikce difuze na magnetické rezonanci mozku
- Nové poznatky v diagnostice a léčbě amyotrofické laterální sklerózy
- Léčba recidivy či rezidua multiformního glioblastomu pomocí stereotaktické radiochirurgie gama nožem – společně hodnocený soubor dvou neurochirurgických pracovišť
- Tichý akútny a subakútny mozgový infarkt u pacientov pred koronárnou intervenciou
- Vztah mezi epidemiologií a subjektivním vnímáním bolesti u pacientů se syndromem karpálního tunelu
- Umístění bifurkace bazilární tepny ve vztahu k dorsu sellae
- Validace dotazníku pro pacienty s myotonií – česká verze Myotonia Behaviour Scale
- Zrozumiteľnosť reči a klinické parametre u pacientov s Parkinsonovou chorobou
- První dokumentovaný případ japonské encefalitidy importované do České republiky
- Spinální schwannom v oblasti hrudní páteře s masivním intratumorálním krvácením
- Časná komplikace ošetření disekujícího intrakraniálního aneuryzmatu ve vertebrobazilárním povodí flow-diverterem
- Svalová dystopie ve Fallopiově kanálu
- Harvey Cushing jako kandidát Nobelovy ceny
- Stanovisko Výboru Cerebrovaskulární sekce České neurologické společnosti ČLS JEP k dlouhodobému holterovskému EKG monitoringu u pacientů s ischemickou cévní mozkovou příhodou
- Analýza dat v neurologii LXXI.<br>Pearsonův korelační koeficient
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nové poznatky v diagnostice a léčbě amyotrofické laterální sklerózy
- Přehled onemocnění s obrazem restrikce difuze na magnetické rezonanci mozku
- Cervikální vertigo – fikce či realita?
- Anestezie a nervosvalová onemocnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



