-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Esenciální tremor – vzniká nový nozologický koncept?
Essential Tremor – Is There a New Nosological Concept?
Essential tremor (ET), the most common form of pathological tremor, affects up to 4% of the population. According to the traditional concept, ET is a monosymptomatic benign clinical entity where tremor is associated with longevity and positive family history. Despite the high prevalence and suspected genetic component, research failed so far to find a causative gene mutation for ET. The main reason is probably related to an imperfectly bounded nosological concept. There are still uncertainties around clinical definition of ET, which does not include isolated head tremor, voice tremor or task-specific tremors that often overlap with dystonic tremor. Moreover, numerous studies have shown the incidence of parkinsonism, cerebellar signs and cognitive disorders in ET. Age of onset turns out as a key factor, characterized by two peaks in the adolescence and in the old age. The classical concept of ET corresponds to early onset disease characterized by a positive family history, more benign progression, and relief after alcohol. Conversely, so called aging-related tremor is usually characterized by late-onset, sporadic occurrence, rapid progression, and also by cognitive dysfunction and other symptoms and signs suggestive of neurodegenerative disorder. Thus, rather than a monosymptomatic nosological entity, ET appears as a group of diseases featuring action tremor. Besides unclear etiology, the possible contribution of neurodegenerative processes remains an open question in the pathogenesis of ET. Thereafter, a thorough description of the individual phenotype along with the methods of genome-wide association studies can contribute to finding causal gene polymorphisms in ET and to elucidate the pathogenesis of various forms of the disease.
Key words:
essential tremor – dystonic tremor – aging-related tremor – genetics – cerebellum
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: P. Hollý; E. Růžička
Působiště autorů: Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze
Vyšlo v časopise: Cesk Slov Neurol N 2017; 80/113(5): 527-533
Kategorie: Přehledný referát
doi: https://doi.org/10.14735/amcsnn2017527Souhrn
Esenciální tremor (ET), nejobvyklejší chorobná forma třesu, postihuje až 4 % populace. Podle tradiční koncepce je ET benigní monosymptomatická klinická jednotka spojená vedle třesu s dlouhověkostí a s rodinným výskytem. Navzdory vysoké prevalenci a suspektní dědičné složce se však dosud nepodařilo najít kauzální genovou mutaci pro ET. Hlavním důvodem je zřejmě nedokonale ohraničený nozologický koncept. Trvají nejasnosti kolem klinické definice ET, která nezahrnuje izolovaný třes hlavy, hlasu či třes vázaný na specifickou činnost, jež se překrývají s dystonickým třesem. Navíc četné práce u ET dokládají výskyt parkinsonských a mozečkových příznaků a kognitivních poruch. Jako klíčový faktor se ukazuje věk vzniku příznaků ET, který vykazuje dva populační vrcholy: v adolescenci a ve stáří. Klasické představě o ET odpovídá onemocnění s časným začátkem charakterizované rodinným výskytem, příznivějším průběhem a úlevou po alkoholu, zatímco tzv. věkově vázaný třes se vyznačuje sporadickým výskytem, rychlejší progresí třesu, ale i kognitivní dysfunkcí a dalšími projevy připomínajícími neurodegenerativní onemocnění. ET se tedy spíše než jako monosymptomatická nozologická jednotka jeví jako skupina onemocnění vyznačujících se akčním třesem. Vedle nejasné etiologie zůstává otevřenou otázkou i možný podíl neurodegenerativních dějů v patogenezi ET. Kvalitní popis fenotypu jednotlivých pacientů spolu s metodikou celogenomových asociačních studií by proto mohly přispět k nalezení kauzálních genových polymorfizmů a k objasnění patogeneze různých forem onemocnění.
Klíčová slova:
esenciální tremor – dystonický třes – věkově vázaný třes – genetika – mozečekÚvod
Třes (tremor) je nejčastější abnormální pohyb, jenž se objevuje jako samostatný příznak nebo v kombinaci s dalšími poruchami hybnosti. Je definován jako mimovolní rytmický oscilační pohyb části těla [1].
Můžeme ho rozdělit do skupin podle různých kritérií:
1. podle aktivity a polohy postižené části těla:
- klidový třes, např. u Parkinsonovy nemoci (Parkinson‘s disease; PD);
- akční posturální (statický) třes, např. fyziologický, akcentovaný fyziologický či esenciální tremor (ET);
- akční kinetický třes (při cílených i necílených pohybech), spolu s posturálním třesem u ET nebo akční intenční třes (při cílených pohybech) zejména při mozečkových poruchách.
2. podle stranové převahy:
- symetrický, např. fyziologický či obvykle i ET;
- asymetrický, např. u PD či při jednostranném postižení mozečkové hemisféry a jejích výstupních drah.
3. podle topografické distribuce: izolovaný třes (hlavy, hlasu, měkkého patra, brady…), třes horních končetin, třes dolních končetin, třes trupu.
Etiologie třesu
Klidový třes je nejčastěji způsoben PD [1–3]. Třes o frekvenci 4–6 Hz typicky začíná jednostranně na ruce, případně i na noze, a později se šíří na druhou stranu. Nemusí být přítomen pouze na končetinách, může postihnout i obličej (rty, dolní čelist), ale jen výjimečně u PD nacházíme třes hlavy a hlasu, který pak spíše svědčí pro koincidentní ET [3]. Někteří pacienti na počátku onemocnění vyvinou pouze klidový třes bez dalších klinických známek PD. Tato forma se nazývá monosymptomatický klidový třes [1,2]. Vzácněji je klidový třes součástí postižení u atypických parkinsonských syndromů, jako je multisystémová atrofie, progresivní supranukleární paréza, kortikobazální degenerace či u polékového parkinsonského syndromu [1]. Klidový třes může dále být součástí postižení u pacientů s ET nebo s dystonickým třesem (DT), kde jinak dominuje třes akční.
Nejčastější klinickou jednotkou akčního třesu je ET, který podrobně rozebereme dále. Poměrně častý je také akcentovaný fyziologický třes, který je vyvolán nadměrnou aktivací sympatiku v určitých stavech a situacích (stres, hypertyreóza, intoxikace nebo vliv některých léků) [4]. Dystonický třes se definuje jako třes na tělesné části postižené dystonií a považuje se za součást klinického syndromu dystonie. Mívá trhavý ráz a typicky bývá polohově závislý, případně vázaný na určitou aktivitu [1,2]. Ortostatický třes se prezentuje posturální instabilitou při delším stání, promptně ustupující při chůzi. Až elektromyografií svalů dolních končetin se ve stoji prokáže vysokofrekvenční třes 13 – 18 Hz [1,2].
Zatímco prostý kinetický třes může být součástí postižení u ET nebo u akcentovaného fyziologického třesu, intenční třes (charakteristicky akcentovaný před cílem pohybu) svědčí pro postižení mozečku, bývá pomalé frekvence pod 5 Hz, jedno - nebo oboustranný, podle lokalizace příčinné léze [1].
Rubrální (Holmesův) třes při lézi výstupních mozečkových drah v horním mozečkovém stonku nebo v mozkovém kmeni mívá složku klidovou, statickou i kinetickou [1,2]. Také funkční (psychogenní) třes může mít složku klidovou, posturální i kinetickou u téhož pacienta [2].
V navazujícím krátkém přehledu se zaměříme zejména na ET. Uvádíme klinické, epidemiologické a laboratorní poznatky, na jejichž základě v poslední době dochází ke změnám pojetí ET jako samostatné klinické jednotky.
Esenciální tremor
Podle klasických prací je pro ET charakteristický izolovaný třes horních končetin a případně hlavy bez dalších příznaků, onemocnění má často rodinný výskyt a pacienti s ET se dožívají vyššího průměrného věku než ostatní populace [5–7]. Tento koncept však doznává v poslední době podstatných změn na základě řady novějších prací, které alespoň v části případů ET naznačují neurodegenerativní proces.
Definice, epidemiologie, formy onemocnění
V současné době spočívá diagnóza ET na klinickém vyšetření dle kritérií Consensus Statement of the Movement Disorder Society on Tremor z roku 1998 [1]. Tato kritéria definují ET jako klinický syndrom vyznačující se viditelným a trvalým symetrickým posturálním nebo kinetickým třesem horních končetin. Současně může být přítomen třes hlavy, ale bez abnormálního držení. Podle jednoho přehledu jsou horní končetiny postiženy třesem u 95 %, dolní končetiny u 20 %, hlava u 34 %, hlas u 12 %, obličej u 5 % a trup u 5 % postižených [8].
ET je nejčastější extrapyramidové onemocnění v dospělém věku [9]. Metaanalýza epidemiologických studií uvádí prevalenci ET mezi 0,4 a 3,9 %, bez podstatných rozdílů mezi pohlavími [10]. Výskyt ET stoupá se vzrůstajícím věkem, takže v populaci osob starších 95 let je to už přes 20 % [11]. Většina nemocných uvádí zhoršování příznaků ET v čase [12].
Klasická literatura i běžná klinická zkušenost ukazují, že v rodinách pacientů s ET se často vyskytuje podobný třes. Dle recentní studie se nález ET alespoň u jednoho člena rodiny potvrdil u 30 % pacientů s ET na rozdíl od 3 % kontrol [13]. Vzorce výskytu naznačují dědičnost autozomálně dominantního typu [14]. U příbuzných prvního stupně je 5× vyšší riziko rozvoje ET než u kontrol a toto riziko stoupá až na desetinásobné, pokud se ET rozvinul do 50 let věku [15]. Další studie prokázala pozitivní rodinnou anamnézu u více než 80 % pacientů se začátkem potíží před 40. rokem věku [16]. Také v jiné studii, která dělila pacienty podle věku začátku příznaků, se pozitivní rodinná anamnéza třesu ukázala až u 75 % pacientů se začátkem do 24 let a u 59 % pacientů s pozdním začátkem ET [17].
Izolovaný třes hlavy
V diferenciální diagnostice izolovaného třesu hlavy přichází v úvahu především DT při cervikální dystonii nebo ET.
DT je třes části těla postižené dystonií. Je zpravidla asymetrický [18], posturální či kinetický, má velkou tendenci k variabilním projevům při různých polohách nebo vykonávaných úkolech [19]. Může se mírnit vlivem senzorických manévrů „geste antagoniste“ (např. dotekem ruky na bradě) a naopak horšit při volním pohybu hlavy proti směru dystonického stočení [20]. Prevalence třesu u pacientů postižených dystonií se různí (11–87 %) [21]. Nejčastější forma DT je třes hlavy, následovaný třesem horní končetiny. Méně častý je pak třes hlasu a třes dolní končetiny [21]. Kromě DT se ještě popisuje třes u dystonie, tj. třes části těla nepostižené dystonií při dystonii v jiné svalové skupině [1,22].
Klinické rozpoznání DT (a odlišení od jiných příčin, zejména od ET) je ztíženo tím, že příznaky dystonie mohou být velmi mírné a snadno se mohou přehlédnout. Zřetelné projevy dystonie se navíc u pacienta postiženého třesem mohou vyvinout až několik let po začátku třesu [23]. Ke složitosti diferenciální diagnostiky přispívá i to, že u některých pacientů s cervikální dystonií (a případně s DT hlavy) se v průběhu onemocnění objeví třes horních končetin, které dystonií postiženy nejsou [24]. Třes horních končetin provázející cervikální dystonii se i podle neurofyziologických analýz liší od ET [25]. Přesto značná část pacientů s DT nebo s třesem u dystonie dostává v běžné praxi diagnózu ET [26]. Na druhé straně jsou popisovány případy pacientů se začátkem ET v mladém věku, u kterých byl třes hlavy po dlouhou dobu jediným příznakem onemocnění [27]. Až po manifestaci třesu na horních končetinách však u nich mohla být formálně stanovena diagnóza ET podle platných kritérií [1].
Pro klinické rozlišení třesu hlavy při cervikální dystonii a u ET byla navržena zkouška porovnání třesu hlavy vsedě a vleže. Práce tvrdí, že zatímco u ET třes hlavy vleže vymizí, při cervikální dystonii třes hlavy přetrvává i vleže [28]. Dále se pro rozlišení ET a DT hlavy nabízí polyelektromyografie v kombinaci s akcelerometrií, kde se popisuje pokles výkonu třesu při geste antagoniste u DT, ale ne u ET [29]. Validita těchto zkoušek nebo jiných klinických diferenciálně diagnostických postupů pro odlišení třesu hlavy u DT a ET však dosud nebyla ověřena.
Izolovaný třes hlasu
Třes hlasu se popisuje u 10–25 % pacientů v pozdním stadiu ET [30]. Izolovaný třes hlasu se však běžně za ET nepovažuje [31], ačkoli se pro tento projev ojediněle objevil termín ET hlasu [32]. Někteří autoři soudí, že izolovaný třes hlasu a izolovaný třes hlavy jsou zvláštní jednotky patofyziologicky odlišné od ET [20].
Třes vázaný na činnost
Do kategorie „task-specific tremor“ patří skupina klinických jednotek, které se projevují akčním třesem při vykonávání určitých aktivit, ale třes se v příslušné svalové skupině nevyskytuje při jiných aktivitách [33]. Typickou formou je zde primární písařský třes (Primary Writing Tremor; PWT), který se projevuje třesem ruky objevujícím se buď pouze při psaní (typ A), nebo i když jen ruka zaujme pozici jako při psaní (typ B) [1]. V diferenciální diagnostice je tu především písařská křeč, tj. fokální dystonie zápěstí a ruky vázaná na psaní [34 – 36].
Názory na etiologii PWT se různí. Dle jedné teorie je tento druh třesu variantou ET. Podle druhé se vždy jedná o dystonický třes při písařské křeči, případně někteří jedinci trpí variantou ET a jiní variantou DT. Konečně existuje i názor, že se PWT liší od obou [33]. Přibližně u jedné třetiny pacientů je pozitivní rodinná anamnéza [37] a u přibližně 20 % postižených tomuto postižení předchází úraz ruky s velmi variabilní dobou následného vzniku PWT mezi 18 měsíci a 12 lety [37].
Četná další kazuistická sdělení popsala různé případy tzv. profesionálních třesů horní končetiny nebo hlavy vázaných spíše na určitou polohu než na činnost, jako např. třes ruky u štukatérů při práci se zednickou lžící, třes hlavy u střelců z pušky, třes ruky u hráčů šipek či třes ruky u studenta zubního lékařství při práci s vrtačkou [38]. I v těchto případech pokračuje debata o tom, zda se jedná o formy ET nebo spíše o varianty DT.
ET a věk
Výskyt ET má dva populační vrcholy, podle kterých lze rozlišit ET s časným (od dětství do cca 25 let) a s pozdním začátkem (po 50. roce, s maximem mezi 60. a 70. rokem věku). Druhý populační vrchol přispívá ke strmému vzestupu prevalence ET s věkem [11]. Ukazuje se však navíc, že pozdní forma progreduje podstatně rychleji než ET s časným začátkem [17]. Naopak u pacientů s časným začátkem ET je vyšší rodinný výskyt třesu a reakce třesu (zlepšení) na podání alkoholu [17]. Zdá se tedy, že klasickému konceptu ET odpovídá spíše onemocnění s časným začátkem, zatímco onemocnění, pro něž bylo recentně navrženo označení věkově vázaný třes (Aging-related Tremor; ART), se vyznačuje pozdním začátkem, rychlejší progresí třesu, ale ve zvýšené míře i kognitivní dysfunkcí a dalšími projevy akcelerovaného patologického stárnutí [39].
Zbývá otázka dlouhověkosti u ET. Ke klasických pracím přibyla novější studie, která nalezla delší přežití i u příbuzných pacientů s ET [40]. Další práce však dlouhověkost u ET nepotvrdily a objevila se dokonce studie popisující zvýšenou mortalitu pacientů s ET ve srovnání s ostatní populací [41]. Ukázalo se ovšem, že vyšší mortalita se spojuje s vyšším věkem začátku onemocnění, týká se tedy hlavně pacientů s ART [39].
Genetika ET
Navzdory vysokému procentu rodinného výskytu se dosud nepodařilo určit žádný kauzální gen ET. Ačkoli vazebná analýza v rodinách s ET prokázala nejméně tři kandidátní genové lokusy (ETM1, ETM2, lokus na 6p23) a asociační analýzou byla prokázána susceptibilní varianta genu pro dopaminový receptor D3 a genu pro HS1-binding protein 3. Přímou souvislost žádného z těchto kandidátních genů se vznikem ET se nepodařilo potvrdit [42].
Nedávno bylo popsáno větší riziko vzniku ET u jedinců nesoucích určité jednonukleotidové polymorfizmy (SNP) v genu Leucine rich repeat and Immunoglobin-like domain-containing protein 1 (LINGO1) [43] a v genu Solute carrier family 1 member 2 (SLC1A2) [44]. Další dva SNP asociované s ET byly nalezeny v genu Serine/Threonine Kinase 32B (STK32B) a v genu pro Peroxisome proliferator-activated receptor gamma coactivator 1-alpha (PPARGC1A) [45]. Ani u těchto polymorfizmů však nebyl prokázán jasný patogenetický účinek.
Výskyt dalších chorobných příznaků u ET
Ačkoli se ET klasicky uvádí jako benigní onemocnění projevující se pouze třesem bez dalších příznaků a s minimální progresí, některé novější práce ukázaly u ET kromě třesu i další motorické a non-motorické poruchy [43]. Jsou to zejména poruchy stability stoje a chůze [47–50], ale také poruchy časování a koordinace pohybů [51], zvláště u pacientů s třesem hlavy [52]. Kromě toho se popisují i poruchy kognitivních funkcí od mírné kognitivní dysfunkce až po demenci [53–55], změny osobnosti, nálady a poruchy spánku [46].
Parkinsonské příznaky u ET
Již běžná klinická zkušenost naznačuje častější komorbidní výskyt ET a PD, než by odpovídalo prosté náhodné koincidenci. Dle jedné ze starších prací byly příznaky parkinsonského syndromu přítomny až u 20 % pacientů s ET [56]. Novější populační studie ukázala asi 4× vyšší riziko rozvoje PD u pacientů s ET ve srovnání se zbytkem populace [57]. Koincidence ET a PD může mít genetický podklad. Ukázalo se, že některé SNP, např. pozitivita v LINGO1 genu, zvyšují riziko onemocnění jak pro ET, tak pro PD [58].
Mozečkové příznaky u ET
Intenční komponenta třesu je takřka pravidelnou součástí obrazu ET [59]. Řada prací prokázala poruchy koordinace, časování pohybů, stability a chůze s charakteristickými rysy pro postižení mozečku [49,51,52]. Výraznější postižení chůze se prokázalo u nemocných s intenčním třesem [59]. Horší stabilita chůze souvisela s tíží středočárového třesu (hlavy, hlasu) [50].
V souvislosti s klinickými projevy postižení mozečku je třeba zmínit se také o funkční studii MR, jež u ET prokázaly zvýšenou aktivitu mozečku a sníženou konektivitu v cerebello-thalamo-kortikální síti [60]. Funkční změny mozečku prokazují dále i některé elektrofyziologické studie [61].
Kognitivní dysfunkce u ET
Přibývá prací ukazujících, že pacienti s ET trpí kognitivními poruchami, zejména mírným kognitivním deficitem s převážným postižením exekutivních funkcí a paměti [53,56]. Tyto příznaky se mohou objevit ještě před klinickým rozvojem třesu [62] a vyznačují se rychlejší progresí než kognitivní deficit u stejně starých kontrol [54]. Kognitivní deficit nepostihuje pouze pacienty s pozdním začátkem ET, ale byl popsán i u nemocných s časným začátkem ET [63].
Zobrazovací a neuropatologické nálezy u ET
Několik studií prokázalo s využitím voxel-based morfometrie strukturální změny, zejména atrofii mozečku, u pacientů s ET v porovnání s kontrolami (tab. 1) [64,65]. Další studie prokázaly i úbytek šedé hmoty v mozkové kůře [66,67]. Existují však práce, které žádnou atrofii u ET nenalezly [68]. Studie MR spektroskopie ukázaly změny svědčící pro ztrátu neuronů nebo poruchy jejich funkce především v kůře hemisfér mozečku [69,70]. Studie MR difuze prokázaly u ET poklesy frakční anisotropie svědčící pro postižení bílé hmoty mozečku a mozkového kmene [71,72], ale jiné práce takové změny nepotvrdily [73]. Studie SPECT a PET prokázaly vyšší hodnoty regionálního mozkového průtoku v mozečku pacientů s ET [74]. V četných studiích SPECT s ligandy pro dopaminový receptor se u ET jen výjimečně prokázal pokles vazby ve striátu [74]. Studie PET s benzodiazepinovým ligandem 11C-flumazenilem dokládají funkční dysregulaci GABAA receptorů v mozečku pacientů s ET [75,76].
Ojedinělé post-mortem analýzy cíleně sbíraných mozků pacientů s diagnózou ET ukázaly strukturální změny ve srovnání s kontrolními mozky zemřelých osob odpovídajícího věku. Většina změn se týkala Purkyňových buněk mozečku, v nichž byly popsány morfologické a imunohistochemické změny, postižení dendritů a axonů, až k buněčnému zániku [77]. Sporný je nález zvýšeného výskytu Lewyho tělísek v mozkovém kmeni u ET [77,78].
Terapie ET
Léky první volby u pacientů s ET jsou i dle posledního dostupného léčebného doporučení stále nejstarší neselektivní beta-blokátor propranolol a barbiturátové antiepileptikum primidon [79]. Jak tomu u starších generik bývá, jejich používání nemá silnou oporu v klinických studiích. Dle jedné práce přímo srovnávající propranolol a primidon mají oba léky účinek asi ve 2/3 případů, ale liší se ve výskytu a rázu nežádoucích účinků [80]. Žádný z novějších preparátů zejména ze skupiny antiepileptik (pregabalin, gabapentin, topiramát, levetiracetam, zonisamid aj.) a z dalších skupin (clozapin, olanzapin aj.) neprokázal dosud u ET uspokojivou účinnost ani dle klinické zkušenosti, ani v klinických studiích odpovídajících standardům medicíny založené na důkazech [79]. Nedávné studie in vitro a na zvířecím modelu ukázaly, že by u ET (a u PD) mohla mít efekt monoklonální protilátka proti výše zmíněnému LINGO-1 [81]. Ta je však tč. ve fázi klinického testování z neurologických onemocnění pouze u roztroušené sklerózy.
Ačkoli ani pro intervenční léčbu třesu nejsou k dispozici kontrolované studie účinnosti, z již více než 30leté klinické zkušenosti vyplývá, že hluboká mozková stimulace nucleus ventralis intermedius (DBS VIM) thalamu je ověřená, bezpečná a účinná metoda pro léčbu refrakterních případů ET [82]. Další intervenční metody, jako stereotaktická radiofrekvenční thalamotomie nebo VIM thalamotomie pomocí gama nože [83], mají dle dosavadní zkušenosti účinnost srovnatelnou s DBS, ale je u nich vyšší riziko nežádoucích účinků. Podobný problém je i u nejnovější metody, založené na vytvoření cílené léze, ultrazvukové thalamotomie[84].
To, že konzumace alkoholu u části pacientů s ET zmírňuje třes, je známo již déle než 100 let [6]. Recentní studie toto tvrzení podporují [85,86]. Pravděpodobným vysvětlením působení etanolu na ET je snížení koncentrace glutamátu na dysregulovaných NMDA receptorech [87]. Nevysvětlenými skutečnostmi zůstává, proč efekt alkoholu na třes pozoruje jen zhruba 50 % nemocných s ET a proč se u nich častěji nevyskytuje škodlivé užívání alkoholu [88]. Efektu alkoholu na ET využívá i terapie alkoholem s delším řetězcem, 1-oktanolem, jehož potenciál k ovlivnění třesu je značný, nicméně jeho potřebná dávka k ovlivnění třesu je vysoká (cca 100 mg/kg) [89].
Diskuze
ET jako skupina klinických jednotek
Všechny výše uvedené nálezy spolu s dosavadní neúspěšností genetických studií ET vedou k otázce, zda je udržitelná koncepce ET jako jediného onemocnění (klinické nozologické jednotky s jednotnou etiologií a patogenezí) nebo zda se spíše jedná o skupinu etiopatogeneticky odlišných nemocí s podobnými klinickými projevy. Dostupné informace svědčí pro druhou možnost, a to zejména z těchto důvodů:
Zůstává problém s klinickým diagnostickým zařazením některých pacientů, jejichž příznaky neodpovídají diagnostickým kritériím ET – např. izolovaný třes hlavy, hlasu, třes vázaný na specifickou činnost. Zdá se, že v řadě případů diagnostikovaných jako ET se ve skutečnosti jedná o třes dystonický.
Pro heterogenní skupinu nemocí s polymorfními projevy dále svědčí nejednotný rodinný výskyt a věk nástupu onemocnění. Onemocnění s časným začátkem a rodinným výskytem více odpovídá tradiční představě o ET (Minorův „status macrobioticus multiparus“) [7]. Druhá forma, sporadický věkově vázaný třes, má rysy neurodegenerativního onemocnění s rychlejší progresí a vyšším výskytem kognitivní dysfunkce a dalších projevů. Stojí za zmínku, že i tato forma onemocnění byla známa klasikům oboru jako „senilní tremor“ [5,6].
Tím, že se ET jeví jako heterogenní onemocnění či spíše skupina onemocnění, je ztíženo hledání kauzálního genu či genů. Je ovšem otázka, zda by rozdělení na menší diagnostické podjednotky (např. pacienti s izolovaným třesem hlavy atd.) mohlo zvýšit naději na identifikaci genů. Díky novým metodám celogenomových asociačních studií by měl v každém případě k nalezení odpovídajících změn v genotypu přispět kvalitní popis fenotypu jednotlivých pacientů s ET. Systematické klinické a laboratorní vyšetřování pacientů s klinickou diagnózou ET tak poslouží jako zdroj dat pro analýzu vztahů mezi fenotypem a genotypem onemocnění.
ET a neurodegenerace
Pro ET jako neurodegenerativní onemocnění svědčí přinejmenším v části případů prokázané motorické a non-motorické projevy postižení mozečku a kognitivních funkcí. V souladu s tím jsou některé nálezy morfologických a funkčních zobrazovacích metod (tab. 1). Dále jsou zde ne zcela ověřené neuropatologické nálezy, které naznačují degenerativní změny zejména v mozečku pacientů s ET.
Tab. 1. Zobrazovací a neuropatologické studie u esenciálního třesu. 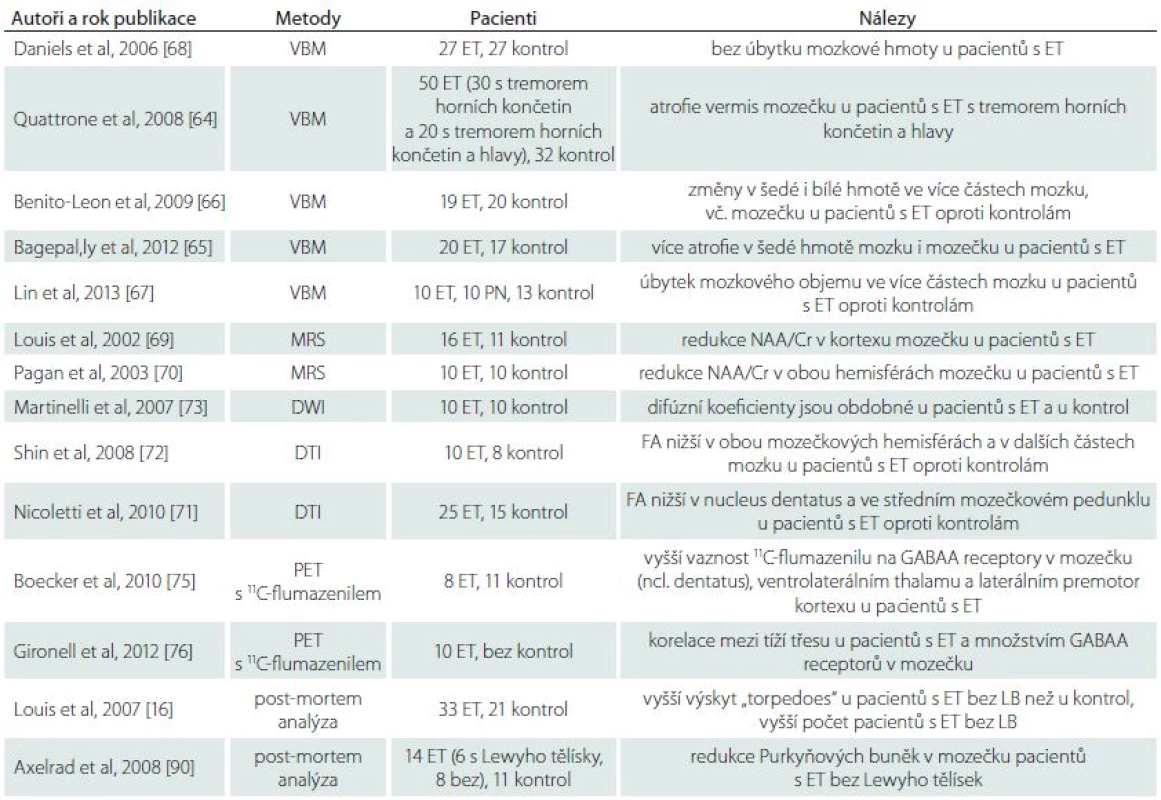
VBM – Voxel-Based Morphometry; MRS – Magnetic Resonance Spectroscopy; NAA/Cr – N-acetyl aspartate/creatine; DWI – Diffusion Weighted Imaging; DTI – Diffusion Tensor Imaging; FA – Fractional Anisotropy; PET – Positron Emission Tomography; GABA – Gamma-Aminobutyric Acid. Otázkou zůstává, proč některé jiné studie u pacientů s ET známky neurodegenerace nepotvrdily. Odpovědí může být, že ET je heterogenní skupina klinických jednotek a že ne všechny formy onemocnění vykazují rysy neurodegenerace. Skutečností však je, že práce představující ET jako neurodegenerativní onemocnění dosud vycházejí z malého okruhu pracovišť a vyžadují další ověření.
Závěr
ET je nejčastější chorobná příčina třesu. Heterogenní klinické obrazy však svědčí pro to, že spíše než o unitární klinickou jednotku jde o skupinu etiopatogeneticky odlišných nemocí s podobnými klinickými projevy. Tím se dá vysvětlit dosavadní neúspěšnost snah o průkaz genetického podkladu onemocnění navzdory vysokému familiárnímu výskytu ET. Nálezy dalších klinických příznaků vedle třesu lze spolu se zobrazovacími a jinými laboratorními známkami postižení cerebella a dalších oblastí mozku brát jako důkazy pro možný podíl neurodegenerativních mechanizmů v patogenezi ET. Pečlivý popis klinického fenotypu onemocnění a další rozsáhlé analýzy selektovaných subpopulací pacientů budou nezbytné k upřesnění genetických podkladů a patogenetických mechanizmů ET.
Tato práce byla podpořena AZV 16-28119A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Evžen Růžička, DrSc.
Neurologická klinika 1. LF UK a VFN v Praze
Kateřinská 30
120 00 Praha 2
e-mail: eruzi@lf1.cuni.cz
Přijato k recenzi: 9. 4. 2017
Přijato do tisku: 29. 8. 2017
Zdroje
1. Deuschl G, Bain P, Brin M. Consensus statement of the Movement Disorder Society on Tremor. Ad HocScientific Committee. Mov Disord 1998;13 (Suppl 3):2 – 23.
2. Edwards MJ, Deuschl G. Tremor syndromes. Continuum (Minneap Minn) 2013;19 : 1213 – 4.
3. Jankovic J. Parkinson‘s disease: clinical features and diagnosis. J Neurol Neurosurg Psychiatry 2008;79 : 368 – 76.
4. Bain PG. Tremor. Parkinsonism & related disorders 2007;13 (Suppl 3):S369 – 74.
5. Critchley M. Observations on essential (heredofamial) tremor. Brain: a journal of neurology 1949;72 : 113 – 139.
6. Pelnář J. Das Zittern. Berlin: Springer 1913.
7. Minor LS. Neue Beobachtungen über das erbliche Zittern. Russk Klin 1929;12 : 713 – 725.
8. Elble RJ. Diagnostic criteria for essential tremor and differential diagnosis. Neurology 2000;54:S2 – 6.
9. Louis ED, Ottman R, Hauser WA. How common is the most common adult movement disorder? estimates of the prevalence of essential tremor throughout the world. Mov Disord 1998;13 : 5 – 10.
10. Louis ED, Ferreira JJ. How common is the most common adult movement disorder? Update on the worldwide prevalence of essential tremor. Mov Disord 2010;25 : 534 – 41.
11. Louis ED, Thawani SP, Andrews HF. Prevalence of essential tremor in a multiethnic, community-based study in northern Manhattan, New York, N.Y. Neuroepidemiology 2009;32 : 208 – 14.
12. Gutierrez J, Park J, Badejo O, Louis ED. Worse and Worse and Worse: Essential Tremor Patients‘ Longitudinal Perspectives on Their Condition. Front Neurol 2016;7 : 175.
13. Louis ED, Clark L, Ottman R. Familial Aggregation and Co-Aggregation of Essential Tremor and Parkinson‘s Disease. Neuroepidemiology 2016;46 : 31 – 6.
14. Bain PG, Findley LJ, Thompson PD, et al. A study of hereditary essential tremor. Brain 1994;117(Pt 4):805 – 24.
15. Louis ED, Ford B, Frucht S, et al. Risk of tremor and impairment from tremor in relatives of patients with essential tremor: a community-based family study. Ann Neurol 2001;49 : 761 – 69.
16. Louis ED, Dogu O. Does age of onset in essential tremor have a bimodal distribution? Data from a tertiary referral setting and a population-based study. Neuroepidemiology 2007;29 : 208 – 12.
17. Hopfner F, Ahlf A, Lorenz D, et al. Early - and late-onset essential tremor patients represent clinically distinct subgroups. Mov Disord 2016;31 : 1560 – 66.
18. Erro R, Rubio-Agusti I, Saifee TA, et al. Rest and other types of tremor in adult-onset primary dystonia. J Neurol Neurosurg Psychiatry 2014;85 : 965 – 68.
19. Jedynak CP, Bonnet AM, Agid Y. Tremor and idiopathic dystonia. Mov Disord 1991;6 : 230–6.
20. Albanese A, Sorbo FD. Dystonia and Tremor: The Clinical Syndromes with Isolated Tremor. Tremor Other Hyperkinet Mov (N Y) 2016;6 : 319. doi: 10.7916/ D8X34XBM.
21. Defazio G, Conte A, Gigante AF, et al. Is tremor in dystonia a phenotypic feature of dystonia? Neurology 2015;84 : 1053 – 59. doi: 10.1212/ WNL.0000000000001341.
22. Elble RJ. Defining dystonic tremor. Curr Neuropharmacol 2013;11 : 48 – 52. doi: 10.2174/ 157015913804999478.
23. Rivest J, Marsden CD. Trunk and head tremor as isolated manifestations of dystonia. Mov Disord 1990;5 : 60 – 65.
24. Pal PK, Samii A, Schulzer M, et al. Head tremor in cervical dystonia. Can J Neurol Sci 2000;27 : 137 – 42.
25. Munchau A, Schrag A, Chuang C, et al. Arm tremor in cervical dystonia differs from essential tremor and can be classified by onset age and spread of symptoms. Brain: a journal of neurology 2001;124 : 1765 – 76.
26. Lalli S, Albanese A. The diagnostic challenge of primary dystonia: evidence from misdiagnosis. Mov Disord 2010;25 : 1619 – 26.
27. Louis ED. When do essential tremor patients develop head tremor? Influences of age and duration and evidence of a biological clock. Neuroepidemiology 2013;41 : 110 – 15.
28. Agnew A, Frucht SJ, Louis ED. Supine head tremor: a clinical comparison of essential tremor and spasmodic torticollis patients. Journal of neurology, neurosurgery, and psychiatry 2012;83 : 179 – 81.
29. Masuhr F, Wissel J, Muller J, et al. Quantification of sensory trick impact on tremor amplitude and frequency in 60 patients with head tremor. Mov Disord 2000;15 : 960 – 4.
30. Louis ED, Ford B, Barnes LF. Clinical subtypes of essential tremor. Arch Neurol 2000;57 : 1194 – 8.
31. Jankovic J. Essential tremor: clinical characteristics. Neurology 2000;54:S21 – 25.
32. Sulica L, Louis ED. Clinical characteristics of essential voice tremor: a study of 34 cases. Laryngoscope 2010;120 : 516 – 28.
33. Bain PG. Task-specific tremor. Handb Clin Neurol 2011;100 : 711 – 8.
34. Sheehy MP, Marsden CD. Writers‘ cramp-a focal dystonia. Brain 1982;105 (Pt 3):461 – 80.
35. Sheehy MP, Rothwell JC, Marsden CD. Writer‘s cramp. Adv Neurol 1988;50 : 457 – 72.
36. Waddy HM, Fletcher NA, Harding AE, et al. A genetic study of idiopathic focal dystonias. Ann Neurol 1991;29 : 320 – 4.
37. Bain PG, Findley LJ, Britton TC, et al. Primary writing tremor. Brain 1995;118 (Pt 6):1461 – 72.
38. Soland VL, Bhatia KP, Volonte MA, et al. Focal task-specific tremors. Mov Disord 1996;11 : 665 – 70.
39. Deuschl G, Petersen I, Lorenz D, et al. Tremor in the elderly: Essential and aging-related tremor. Mov Disord 2015;30 : 1327-1334.
40. Jankovic J, Beach J, Schwartz K, et al. Tremor and longevity in relatives of patients with Parkinson‘s disease, essential tremor, and control subjects. Neurology 1995;45 : 645 – 8.
41. Louis ED, Benito-Leon J, Ottman R et al. Neurological Disorders in Central Spain Study G. A population-based study of mortality in essential tremor. Neurology 2007;69 : 1982 – 9.
42. Jasinska-Myga B, Wider C. Genetics of essential tremor. Parkinsonism Relat Disord 2012;18 (Suppl 1):S138 – 9. doi: 10.1016/ S1353-8020(11)70043-8.
43. Jimenez-Jimenez FJ, Garcia-Martin E, Lorenzo-Betancor O, et al. LINGO1 and risk for essential tremor: results of a meta-analysis of rs9652490 and rs11856808. J Neurol Sci 2012;317 : 52 – 7. doi: 10.1016/ j.jns.2012.02.030.
44. Thier S, Lorenz D, Nothnagel M, et al. Polymorphisms in the glial glutamate transporter SLC1A2 are associated with essential tremor. Neurology 2012;79 : 243 – 8.
45. Muller SH, Girard SL, Hopfner F, et al. Genome-wide association study in essential tremor identifies three new loci. Brain 2016;139 : 3163 – 9. doi: 10.1093/ brain/ aww242.
46. Louis ED. Non-motor symptoms in essential tremor: A review of the current data and state of the field. Parkinsonism Relat Disord 2016;22 (Suppl 1):S115 – 8.
47. Louis ED, Galecki M, Rao AK. Four Essential Tremor Cases with Moderately Impaired Gait: How Impaired can Gait be in this Disease? Tremor Other Hyperkinet Mov (N Y). 2013;4;3. doi: 10.7916/ D8QV3K7G.
48. Louis ED, Rao AK, Gerbin M. Functional correlates of gait and balance difficulty in essential tremor: balance confidence, near misses and falls. Gait Posture 2012;35 : 43 – 7. doi: 10.1016/ j.gaitpost.2011.08.002.
49. Louis ED, Rios E, Rao AK. Tandem gait performance in essential tremor: clinical correlates and association with midline tremors. Mov Disord 2010;25 : 1633 – 8. doi: 10.1002/ mds.23144.
50. Hoskovcova M, Ulmanova O, Sprdlik O, et al. Disorders of balance and gait in essential tremor are associated with midline tremor and age. Cerebellum 2013;12 : 27 – 34. doi: 10.1007/ s12311-012-0384-4.
51. Bares M, Husarova I, Lungu OV. Essential tremor, the cerebellum, and motor timing: towards integrating them into one complex entity. Tremor Other Hyperkinet Mov (N Y). 2012;2. doi: 10.7916/ D8CN72N0.
52. Bares M, Lungu OV, Husarova I, et al. Predictive motor timing performance dissociates between early diseases of the cerebellum and Parkinson‘s disease. Cerebellum 2010;9 : 124 – 35. doi:10.1007/ s12311-009-0133-5.
53. Lombardi WJ, Woolston DJ, Roberts JW, et al. Cognitive deficits in patients with essential tremor. Neurology 2001;57 : 785 – 90.
54. Louis ED, Benito-Leon J, Vega-Quiroga S, et al. Neurological Disorders in Central Spain Study G. Faster rate of cognitive decline in essential tremor cases than controls: a prospective study. European journal of neurology : the official journal of the European Federation of Neurological Societies 2010;17 : 1291 – 7.
55. Janicki SC, Cosentino S, Louis ED. The cognitive side of essential tremor: what are the therapeutic implications? Ther Adv Neurol Disord 2013;6 : 353 – 68. doi: 10.1177/ 1756285613489591.
56. Lou JS, Jankovic J. Essential tremor: clinical correlates in 350 patients. Neurology 1991;41 : 234 – 8.
57. Benito-Leon J, Louis ED, Bermejo-Pareja F. Risk of incident Parkinson‘s disease and parkinsonism in essential tremor: a population based study. J Neurol Neurosurg Psychiatry. 2009;80(4):423 – 5. doi: 10.1136/ jnnp.2008.147223.
58. Vilarino-Guell C, Ross OA, Wider C, et al. LINGO1 rs9652490 is associated with essential tremor and Parkinson disease. Parkinsonism Relat Disord 2010;16 : 109 – 11.
59. Deuschl G, Wenzelburger R, Loffler K, et al. Essential tremor and cerebellar dysfunction clinical and kinematic analysis of intention tremor. Brain 2000;123(Pt 8):1568 – 80.
60. Cerasa A, Quattrone A. Linking Essential Tremor to the Cerebellum-Neuroimaging Evidence. Cerebellum 2016;15 : 263 – 75. doi: 10.1007/ s12311-015-0739-8.
61. Filip P, Lungu OV, Manto MU, et al. Linking Essential Tremor to the Cerebellum: Physiological Evidence. Cerebellum 2016;15 : 774 – 80.
62. Benito-Leon J, Louis ED, Sanchez-Ferro A, et al. Rate of cognitive decline during the premotor phase of essential tremor: a prospective study. Neurology 2013;81 : 60 – 6. doi: 10.1212/ WNL.0b013e318297ef2b.
63. Sengul Y, Sengul HS, Yucekaya SK, et al. Cognitive functions, fatigue, depression, anxiety, and sleep disturbances: assessment of nonmotor features in young patients with essential tremor. Acta Neurol Belg 2015;115 : 281 – 7. doi: 10.1007/ s13760-014-0396-6.
64. Quattrone A, Cerasa A, Messina D, et al. Essential head tremor is associated with cerebellar vermis atrophy: a volumetric and voxel-based morphometry MR imaging study. AJNR Am J Neuroradiol 2008;29 : 1692 – 7. doi: 10.3174/ ajnr.A1190.
65. Bagepally BS, Bhatt MD, Chandran V, et al. Decrease in cerebral and cerebellar gray matter in essential tremor: a voxel-based morphometric analysis under 3T MRI. J Neuroimaging 2012;22 : 275 – 8. doi: 10.1111/ j.15526569.2011.00598.x.
66. Benito-Leon J, Alvarez-Linera J, Hernandez-Tamames JA, et al. Brain structural changes in essential tremor: voxel-based morphometry at 3-Tesla. J Neurol Sci 2009;287 : 138 – 42. doi: 10.1016/ j.jns.2009.08.037.
67. Lin CH, Chen CM, Lu MK, et al. VBM Reveals Brain Vol-ume Differences between Parkinson‘s Disease and Essential Tremor Patients. Front Hum Neurosci 2013;7 : 247. doi: 10.3389/ fnhum.2013.00247.
68. Daniels C, Peller M, Wolff S, et al. Voxel-based morphometry shows no decreases in cerebellar gray matter volume in essential tremor. Neurology 2006;67 : 1452 – 6.
69. Louis ED, Shungu DC, Chan S, et al. Metabolic abnormality in the cerebellum in patients with essential tremor: a proton magnetic resonance spectroscopic imaging study. Neurosci Lett 2002;333 : 17 – 20.
70. Pagan FL, Butman JA, Dambrosia JM, et al. Evaluation of essential tremor with multi-voxel magnetic resonance spectroscopy. Neurology 2003;60 : 1344 – 7.
71. Nicoletti G, Manners D, Novellino F, et al. Diffusion tensor MRI changes in cerebellar structures of patients with familial essential tremor. Neurology 2010;74 : 988 – 94. doi: 10.1212/ WNL.0b013e3181d5a460.
72. Shin DH, Han BS, Kim HS, et al. Diffusion tensor imaging in patients with essential tremor. AJNR Am J Neuroradiol 2008;29 : 151 – 3. doi: 10.3174/ ajnr.A0744.
73. Martinelli P, Rizzo G, Manners D, et al. Diffusion-weight-ed imaging study of patients with essential tremor. Mov Disord 2007;22 : 1182 – 5. doi: 10.1002/ mds.21287.
74. Sharifi S, Nederveen AJ, Booij J, et al. Neuroimaging essentials in essential tremor: a systematic review. Neuroimage Clin 2014;5 : 217 – 31. doi: 10.1016/ j.nicl.2014.05.003.
75. Boecker H, Weindl A, Brooks DJ, et al. GABAergic dysfunction in essential tremor: an 11C-flumazenil PET study. J Nucl Med 2010;51 : 1030 – 5. doi: 10.2967/ jnumed.109.074120.
76. Gironell A, Figueiras FP, Pagonabarraga J, et al.Gaba and serotonin molecular neuroimaging in essential tremor: a clinical correlation study. Parkinsonism RelatDisord 2012;18 : 876 – 80. doi: 10.1016/ j.parkreldis.2012.04.024.
77. Louis ED, Vonsattel JP. The emerging neuropathology of essential tremor. Mov Disord 2008;23 : 174 – 82. doi: 10.1002/ mds.21731.
78. Shill HA, Adler CH, Beach TG. Lewy bodies in essential tremor are no different than in controls. Parkinsonism Relat Disord 2016;23 : 106 – 7. doi: 10.1016/ j.parkreldis.2015.11.025. 79. Zesiewicz TA, Elble RJ, Louis ED, et al. Evidence-based guideline update: treatment of essential tremor: report of the Quality Standards subcommittee of the American Academy of Neurology. Neurology 2011;77 : 1752 – 5. doi: 10.1212/ WNL.0b013e318236f0fd.
80. Koller WC, Vetere-Overfield B. Acute and chronic effects of propranolol and primidone in essential tremor. Neurology 1989;39 : 1587 – 8.
81. Agundez JA, Jimenez-Jimenez FJ, Alonso-Navarro H,et al. The potential of LINGO-1 as a therapeutic targetfor essential tremor. Expert Opin Ther Targets 2015;19 : 1139 – 48. doi: 10.1517/ 14728222.2015.1028360.
82. Flora ED, Perera CL, Cameron AL, et al. Deep brain stimulation for essential tremor: a systematic review. Mov Disord. 2010;25(11):1550 – 9. doi: 10.1002/ mds.23195.
83. Young RF, Li F, Vermeulen S, et al. Gamma Knife thalamotomy for treatment of essential tremor: long-term results. J Neurosurg 2010;112 : 1311 – 7.
84. Elias WJ, Lipsman N, Ondo WG, et al. A Randomized Trial of Focused Ultrasound Thalamotomy for Essential Tremor. N Engl J Med 2016;375 : 730-739. doi: 10.3171/ 2009.10.JNS09332.
85. Mostile G, Jankovic J. Alcohol in essential tremor and other movement disorders. Mov Disord 2010;25 : 2274 – 84. doi: 10.1002/ mds.23240.
86. Hopfner F, Erhart T, Knudsen K, et al. Testing for alcohol sensitivity of tremor amplitude in a large cohort with essential tremor. Parkinsonism Relat Disord 2015;21 : 848 – 51. doi: 10.1016/ j.parkreldis.2015.05.005.
87. Manto M, Laute MA. A possible mechanism for the beneficial effect of ethanol in essential tremor. Eur J Neurol 2008;15 : 697 – 705. doi: 10.1111/ j.1468-1331.2008.02150.x.
88. Ulmanova O, Vinopalova M, Zima T, et al. Biomarkers demonstrate increased consumption, but not abuse, of ethanol in essential tremor. J Neurol 2012;259 : 1177 – 80. doi: 10.1007/ s00415-011-6323-3.
89. Haubenberger D, Nahab FB, Voller B, et al. Treatment of essential tremor with long-chain alcohols: still experimental or ready for prime time? Tremor Other Hyperkinet Mov (N Y). 2014;4. doi: 10.7916/ D8RX991R.
90. Axelrad JE, Louis ED, Honig LS, et al. Reduced Purkinje cell number in essential tremor: a postmortem study. Arch Neurol 2008;65 : 101–7. doi: 10.1001/archneurol.2007.8.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Dopis redakci
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2017 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Terapia pokročilých štádií Parkinsonovej choroby invazívnymi postupmi
- Je nutné diferenciálně diagnosticky odlišovat fenomenologii abnormálních pohybů
- Není nutné diferenciálně diagnosticky odlišovat fenomenologii abnormálních pohybů
- Je nutné diferenciálne diagnosticky odlišovať fenomenológiu abnormálnych pohybov?
- Neurorehabilitace chůze po cévní mozkové příhodě
- Esenciální tremor – vzniká nový nozologický koncept?
- Leberova hereditární neuropatie optiku
- Funkce lícního nervu po mikrochirurgické léčbě vestibulárního schwannomu
- Teplotní management u pacientů podstupujících plánovaný spondylochirurgický výkon v pronační poloze – prospektivní randomizovaná studie
-
Comment of Article
Perioperative Thermal Management – součást kvalitní perioperační péče - Prevalence kouření u středoevropských pacientů s narkolepsií s kataplexií, narkolepsií bez kataplexie a idiopatickou hypersomnií
- Zhodnocení dlouhodobého prospívání pacientů po operaci intramedulárního kavernomu
- Statiny indukovaná nekrotizující autoimunitní myopatie
- Elektrostimulace suprahyoidních svalů u pacientů po cévní mozkové příhodě s dysfagií
- Aminoguanidin podávaný subchronicky intrahipokampálně zlepšuje u diabetických potkanů plnění úkolů pasivního vyhýbání a expresi genů z rodiny Bcl-2
- Intraventrikulární meningiomy – retrospektivní studie 19 případů
- Varianta p.Val66Met v genu pro mozkový neurotrofní faktor (BDNF) v české populaci
- Kazuistika meningitidy dospělých způsobená bakterií Escherichia coli
- Dva případy atypického teratoidního rhabdoidního tumoru CNS a přehled literatury
-
Analýza dat v neurologii
LXV. Přínosy a rizika klinických studií s jedním zařazeným pacientem („N of 1 trials“) - Odešla doc. MU Dr. Jaroslava Nebudová, CSc. (1927– 2017)
- Prof. Franz Gerstenbrand – in memoriam
- Osobní vzpomínky na prof. Franze Gerstenbranda
- Dopis redakci
- XII. konference neurogenní poruchy komunikace u dospělých
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Esenciální tremor – vzniká nový nozologický koncept?
- Leberova hereditární neuropatie optiku
- Statiny indukovaná nekrotizující autoimunitní myopatie
- Terapia pokročilých štádií Parkinsonovej choroby invazívnymi postupmi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



