-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
Cerebrospinal Fluid Triplet in the Diagnosis of Alzheimer-Fischer disease
Introduction:
Clinical suspicion of a disease with dementia first described by Alzheimer and Fischer can be supported by changes in concentrations of three proteins in the cerebrospinal fluid: an increase in total tau and phosphorylated tau proteins and a decrease in beta-amyloid (so-called cerebrospinal fluid triplet). The aim of this research was to determine normal concentrations and compare them with levels in patients with Alzheimer-Fischer disease and other dementias.Patients and methods:
We measured concentrations of cerebrospinal fluid triplet in the laboratory of the AD Center using Enzyme-Linked ImmunoSorbent Assay in 65 neurological patients without cognitive deficit (controls) [Mini-Mental State Examination, median and interquartile range: 29 (28–29) points] and 34 patients with Alzheimer-Fischer disease according to NINCDS-ADRDA criteria [Mini-Mental State Examination 21 (18–23) points]. Cut-off concentrations were determined using an analysis of receiver operating characteristic curves to achieve maximum sensitivity as well as specificity.Results:
Patients with Alzheimer-Fischer disease significantly differed from control subjects in the cerebrospinal fluid concentrations of these analytes [median (interquartile range) pg/ml] of these analytes: total tau [Alzheimer-Fischer disease: 575 (273–1168)] vs [NC: 209 (158–276)], phosphorylated tau [Alzheimer-Fischer disease: 65 (42–90)] vs [NC: 33 (26–40)] and beta-amyloid [Alzheimer-Fischer disease: 560 (370–815)] vs [NC: 748 (580–885)]. Cut-off concentrations established by the receiver operating characteristic analyses were associated with these sensitivities/specificities of total tau 334 pg/ml (72 %/85 %), p181-tau 57 pg/ml (62%/95 %) and beta-amyloid 448 pg/ml (38 %/92 %). Ratios of the analytes, with the exception of beta-amyloid/total tau, or normalization of all three analytes relative to the total protein in the CSF were not better than the concentrations alone in the differentiation of both groups.Conclusion:
Total tau and the ratio of beta-amyloid/total tau showed the greatest diagnostic value. Results of cerebrospinal fluid triplet testing can support a diagnosis of Alzheimer-Fischer disease but limitations of this investigation have to be considered.Key words:
Alzheimer’s disease – dementia – diagnosis – cerebrospinal fluid – tau protein – beta amyloid
Autoři: A. Bartoš 1,2; L. Čechová 3; J. Švarcová 1; J. Říčný 1; D. Řípová 1
Působiště autorů: AD Centrum, Psychiatrické centrum Praha 1; UK v Praze, 3. LF a FN Královské Vinohrady, Neurologická klinika, Praha 2; Neurologické oddělení, Nemocnice Rudolfa a Stefanie Benešov, a. s. 3
Vyšlo v časopise: Cesk Slov Neurol N 2012; 75/108(5): 587-594
Kategorie: Původní práce
Souhrn
Úvod:
Klinické podezření na nemoc s demencí poprvé popsanou Alzheimerem a Fischerem lze podpořit změnami koncentrací tří bílkovin v mozkomíšním moku: zvýšení celkového a fosforylovaného tau proteinu a snížení beta-amyloidu (tzv. likvorový triplet). Cílem práce bylo určit jejich normální koncentrace a porovnat je s hladinami u pacientů s Alzheimerovou-Fischerovou nemocí a dalšími demencemi.Soubor a metodika:
U 65 neurologických pacientů bez kognitivního deficitu (kontroly) [Mini-Mental State Examination, medián a interkvartilové rozmezí: 29 (28-29) bodů] a 34 pacientů s Alzheimerovou-Fischerovou nemocí podle NINCDS-ADRDA kritérií [Mini-Mental State Examination 21 (18–23) bodů] jsme v laboratoři AD Centra změřili metodou Enzyme-Linked ImmunoSorbent Assay koncentrace likvorového tripletu. Hraniční hodnoty jsme určili podle metody založené na křivkách receiver operating characteristic k dosažení maximální senzitivity a současně specificity.Výsledky:
Pacienti s Alzheimerovou-Fischerovou nemocí se od kontrolních osob významně lišili v mozkomíšních koncentracích těchto analytů [medián (interkvartilové rozmezí) pg/ml] těchto analytů: celkový tau [Alzheimerova-Fischerova nemoc: 575 (273–1 168)] vs [kontroly: 209 (158–276)], fosforylovaný tau [Alzheimerova-Fischerova nemoc: 65 (42–90)] vs [kontroly: 33 (26–40)] a beta-amyloidu [Alzheimerova-Fischerova nemoc: 560 (370–815)] vs [kontroly: 748 (580–885)]. Hraniční koncentrace stanovené podle receiver operating characteristic analýz byly asociovány s těmito senzitivitami/specificitami: celkový tau 334 pg/ml (72 %/85 %), fosforylovaný tau 57 pg/ml (62 %/95 %) a beta-amyloid 448 pg/ml (38 %/92 %). S výjimkou poměru beta--amyloid/celkový tau nebyly poměry analytů či normalizace na celkovou bílkovinu v likvoru lepší než samotné koncentrace v rozlišení obou skupin.Závěr:
Největší diagnostickou výtěžnost měl celkový tau a poměr beta-amyloid/celkový tau. Výsledky likvorového tripletu mohou podpořit diagnózu Alzheimerovy-Fischerovy nemoci, i když i tato pomocná metoda má různá omezení.Klíčová slova:
Alzheimerova nemoc – demence – diagnostika – likvor – mozkomíšní mok – tau protein – beta amyloid – tripletÚvod
O první klinické popisy a histopatologické nálezy Alzheimerovy nemoci se významně zasloužil český psychiatr a neuropatolog Oskar Fischer [1,2]. Proto jsme se v tomto článku rozhodli rozšířit obvyklý název onemocnění na Alzheimerovu-Fischerovu nemoc (AFN). Správné a časné rozpoznání AFN je někdy svízelné, protože klinické příznaky mohou být minimální nebo být součástí jiného neurodegenerativního onemocnění mozku [3–5].
V klinické praxi se opíráme především o celkovou výkonnost a profil kognitivních funkcí, které můžeme zjišťovat krátkými testy pro lékaře nebo komplexními neuropsychologickými bateriemi [3,6–10]. K potvrzení syndromu demence se vyžaduje nejen kognitivní deficit, ale také zhoršení běžných, pracovních a společenských činností [11]. V českém prostředí je můžeme kromě rozhovoru zjišťovat strukturovanými dotazníky speciálně vyvinutými pro tyto účely [12–15].
Klinickou diagnózu AFN lze upřesnit pomocnými metodami. Pomocí CT nebo lépe MR mozku chceme nejen vyloučit strukturální podklad demencí (nádor, normotenzní hydrocefalus, subdurální hematom, vaskulární léze apod.), ale snažíme se také o pozitivní podporu diagnózy průkazem mediotemporální atrofie [5,16,17]. Z funkčního zobrazení mozku se v ČR používá prakticky pouze SPECT mozku, pomocí něhož lze detekovat mediotemporální hypoperfuzi [18,19]. Skoro vůbec se nepoužívá PET mozku (údaj z hlasování během tří přednášek na kurzu Kognitivní poruchy a demence v r. 2009, o projektu Dny paměti v r. 2010 a na Českém a slovenském neurologickém sjezdu v r. 2011).
Diagnózu AFN podporují také nálezy typických biochemických ukazatelů v likvoru. Vycházejí z peptidů a bílkovin patologicky ukládaných do agregátů, které lze pozorovat při histologických vyšetřeních mozků od pacientů s AFN. Mezi ně patří celkový tau protein (t-tau), fosforylovaný tau protein a peptid beta-amyloid o délce 42 aminokyselin (beta-amyloid) [20–23]. Přestože se běžně používá výraz hyperfosforylovaný tau protein, domníváme se, že se jedná o zavádějící název. Obě formy tau proteinu (celkový i tzv. fosforylovaný) obsahují fosforylace. Rozdíl je v tom, že tzv. fosforylovaný tau protein ji má na specifické pozici, např. 199 (fosforylovaný serin), 181 (threonin) nebo 231 (threonin). Protože používáme ELISA soupravu detekující tau protein fosforylovaný na 181. aminokyselině (threoninu), budeme dále používat jednoznačnou zkratku p181-tau. Pro celou trojici bílkovin navrhujeme stručné označení biochemický či likvorový triplet, což běžně používáme v našem AD Centru (Centrum pro výzkum, diagnostiku a léčbu Alzheimerovy demence), třebaže takový termín ve světovém písemnictví nikde nenajdeme.
Kromě tripletu se hledají nové ukazatele AFN, protože vzhledem k heterogenitě onemocnění zřejmě ideální jediný biochemický ukazatel neexistuje [24]. Například jsme v tomto směru studovali kalciovou homeostázu v krevních destičkách [25]. Nyní se zabýváme detekcí komplexů beta-amyloidu s multifunkčním mitochondriálním enzymem 17-beta-hydroxysteroiddehydrogenázou v mozkomíšním moku nebo vlivem magnetických nanočástic na fluorescenci likvoru barveného thioflavinem [26,27].
V naší zemi se využívá likvorového tripletu v diagnostice demencí relativně vzácně [19,28]. Důvodem je především chybění finančního krytí tohoto výkonu pojišťovnami a poměrně složitý proces od pacienta k výsledku (souhlas s lumbální punkcí, samotný výkon, archivace zmrazeného vzorku, předání do příslušné laboratoře, shromažďování většího množství vzorků, správné biochemické stanovení).
Cílem sdělení je obohacení poznatků o vlastní praktické zkušenosti v našem AD Centru (www.pcp.lf3.cuni.cz/adcentrum) na základě využívání likvorového tripletu v diagnostice demencí po delší dobu. Soustředili jsme se na určení hranic normálních koncentrací naší laboratoře. Zjišťovali jsme různé ukazatele jejich diagnostické užitečnosti. Vedle hlavního tématu, a to rozdílu mezi pacienty s AFN a kontrolními osobami, nás zajímala ojedinělá pozorování i u dalších forem demencí.
Pacienti a metodika
Dva neurologové (AB a LČ) roztřídili formou konsenzuální diskuze 123 pacientů s vyšetřeným likvorovým tripletem do několika skupin na základě veškerých dostupných klinických údajů a zároveň bez znalosti likvorového tripletu. Všechny vhodné kandidáty jsme rozčlenili do tří základních skupin, v nichž jsme vytvořili vždy dvě podskupiny:
- 1. Ústřední skupinu tvořilo 35 pacientů s pravděpodobnou a čtyři pacienti s definitivní AFN podle kritérií NINCDS-ADRDA [29]. Na FLAIR vážených snímcích MR mozku jsme hodnotili pomocí čtyřstupňové škály přítomnost hyperintenzit [30]. Podle nich jsme rozdělili pacienty s AFN na dvě podskupiny – s přítomností hyperintenzit (skór 3 a 4) a bez nich (skór 1 a 2). Zbývajících šest osob bez MR mozku kvůli kontraindikacím nebo jiným důvodům jsme přiřadili podle výsledku jejich CT mozku. Celkem 26 pacientů s AFN mělo změny bílé hmoty (AFNh+) a menšina nikoli (n = 13) (AFNh–).
- 2. Vzorky od 65 normálních osob starších 55 let do kontrolní skupiny (normální kontroly, NK) vznikaly přirozeným způsobem z běžné klinické praxe. Jednalo se o pacienty, u nichž byla indikována lumbální punkce (LP) za jiným diagnostickým účelem než v rámci diferenciální diagnostiky kognitivní poruchy (např. polyneuropatie, vyloučení neuroinfekce, subarachnoidálního krvácení). Podmínkou zařazení byly normální kognitivní funkce. První podskupinu tvořilo 52 pacientů s různými méně závažnými diagnózami nebo příznaky a hlavně s normálním základním likvorovým nálezem (NKz–). Další podskupinu tvořilo 13 kontrolních pacientů s potvrzeným patologickým likvorovým nálezem, především pleocytózou a hyperproteinorachií (zapříčiněné nejčastěji zánětlivou afekcí nervového systému) (NKz+). Zobrazení mozku pomocí MR mělo 41 osob a pomocí CT 10 jedinců, u zbývajících osob se je nepodařilo doplnit.
Kognitivní funkce osob z obou předchozích hlavních skupin jsme zhodnotili vždy pomocí MMSE [31], dále podrobněji zpočátku podle Mattis Dementia Rating Scale (MDRS) [32], později pomocí ACE-CZ [6–8].
- 3. Pro zajímavost jsme analyzovali i pacienty s různými demencemi, od nichž jsme měli k dispozici mozkomíšní mok. Do první podskupiny jsme sdružili sedm pacientů s vaskulární demencí (VD). Diagnóza byla stanovena po pečlivé klinické úvaze vyžadující demenci s odlišným klinickým profilem oproti AFN a současně přítomnost vaskulárních změn na CT nebo MR mozku. Jeden z nich má geneticky prokázanou angiopatii tepen mozku typu CADASIL. Druhá heterogenní podskupina se skládá z 11 pacientů s různými formami vzácnějších ostatních demencí (OD) (3× frontotemporální demence, z toho 1× patologicky verifikovaná, 3× progresivní supranukleární obrna, z toho 1× patologicky verifikovaná, 1× kortikobazální degenerace, 2× histopatologicky verifikovaná Creutzfeldtova--Jakobova nemoc, 1× normotenzní hydrocefalus s příznivým efektem zkratové operace, 1× histopatologicky verifikovaná Wernickeova encefalopatie).
Koncentrace všech tří bílkovin v duplikátech jsme změřili komerčně dostupnou ELISA soupravou firmy Innogenetics podle návodu. Vzorky jsme měřili v duplikátech. Pro každou ELISA destičku jsme použili vždy dva vnitřní standardy (mozkomíšní moky s nízkým a vysokým obsahem analytu). Pro stanovení beta-amyloidu a t-tau bylo použito 25 µl likvoru//jamku, pro stanovení p181-tau 75 µl likvoru/jamku. Souprava pro celkový tau má limit detekce 60 pg/ml, rozsah standardní křivky 75–1 200 pg/ml a dosahuje variačního koeficientu méně než 10 % pro obsah 125–1 000 pg/ml. Souprava pro měření p181-tau má limit detekce 15 pg/ml, rozsah standardní křivky 15,6–500 pg/ml a dosahuje variačního koeficientu méně než 10 % pro obsah 28–300 pg/ml. Souprava pro měření beta-amyloidu má limit detekce 50 pg/ml, rozsah standardní křivky 125–2 000 pg/ml a dosahuje variačního koeficientu méně než 10 % pro obsah 125–2 000 pg/ml. Kvalitu našeho měření verifikujeme v rámci mezinárodního mezilaboratorního porovnávání systémem externí kontroly kvality řízené ze Švédska.
Kromě absolutních koncentrací jsme vypočítali všechny tři poměry mezi dvěma analyty (p181-tau/t-tau, beta-amyloid//t-tau, beta-amyloid/p-tau). Dále jsme vztáhli absolutní koncentrace t-tau, p181-tau a beta-amyloid ke koncentraci celkové bílkoviny v mozkomíšním moku, tzv. normalizované poměry t-tau, p181-tau a beta-amyloidu.
Výzkumné osoby podepsaly informovaný souhlas s účastí ve studii, která byla schválena etickými komisemi Psychiatrického centra Praha a FN Královské Vinohrady.
Vzhledem k přítomnosti normálního i nenormálního rozložení sledovaných ukazatelů podle histogramů a podle testů Kolmogorova-Smirnova a Sharpirova-Wilkova jsme se rozhodli pro neparametrické statistické přístupy (Kruskallův-Wallisův test, Mann-Whitneyův test, Spearmanův korelační koeficient). Hranice normálních hodnot jsme určili pomocí analýz ROC (Receiver Operating Curve) křivek k dosažení nejvyšší senzitivity a současně specificity. Diskriminační potenciál mezi pacienty s AFN a kontrolami jsme porovnávali podle plochy pod křivkou ROC, senzitivity, specifity, věrohodnostních poměrů a diagnostického poměru šancí [33].
Výsledky
Klinické charakteristiky a laboratorní výsledky likvorového tripletu a poměrů shrnují tab. 1 a 2. Pacienti s AFN měli převážně lehký stupeň demence podle MMSE a ACE. Kognitivní funkce normálních kontrol byly v pásmu předpokládané normy.
Tab. 1. Sociodemografické charakteristiky a kognitivní funkce u normálních kontrolních jedinců a pacientů s Alzheimerovou-Fischerovou nemocí. 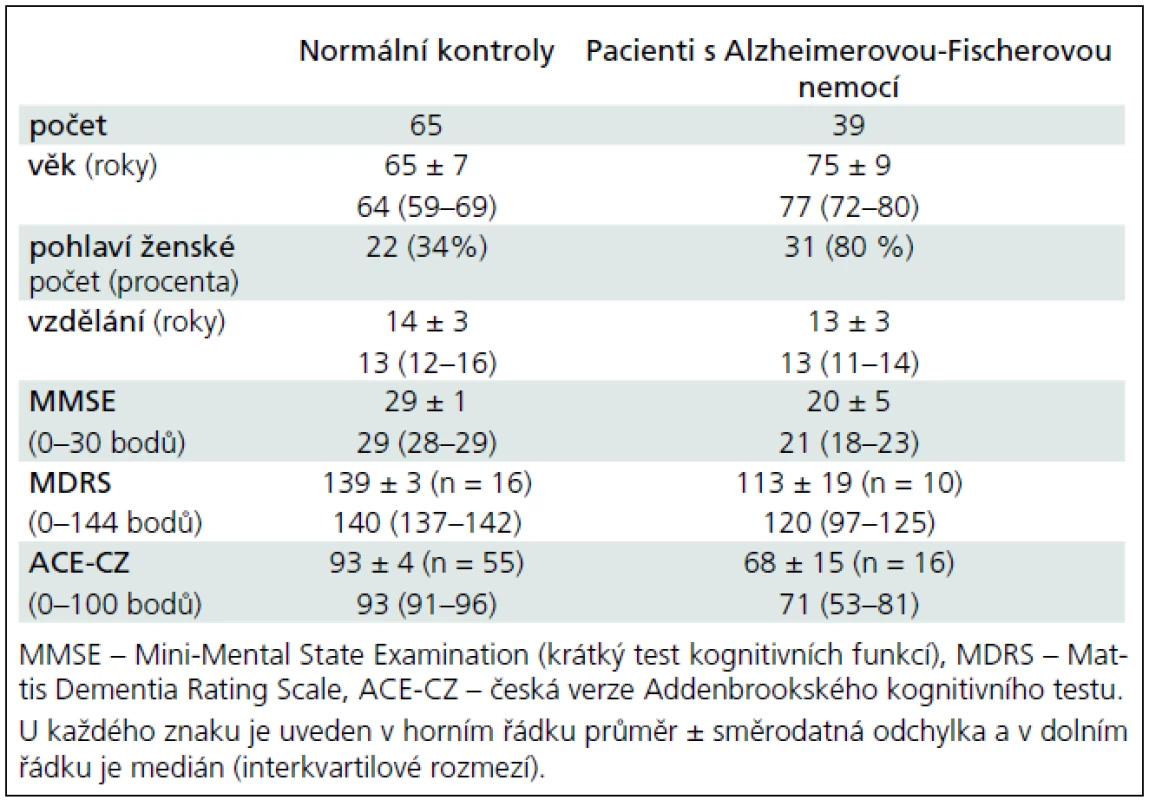
Tab. 2. Koncentrace a poměry celkového tau proteinu, tau proteinu fosforylovaného na 181 a beta-amyloidu v mozkomíšním moku u normálních kontrolních jedinců (n = 65) a pacientů s Alzheimerovou-Fischerovou nemocí (n = 35). 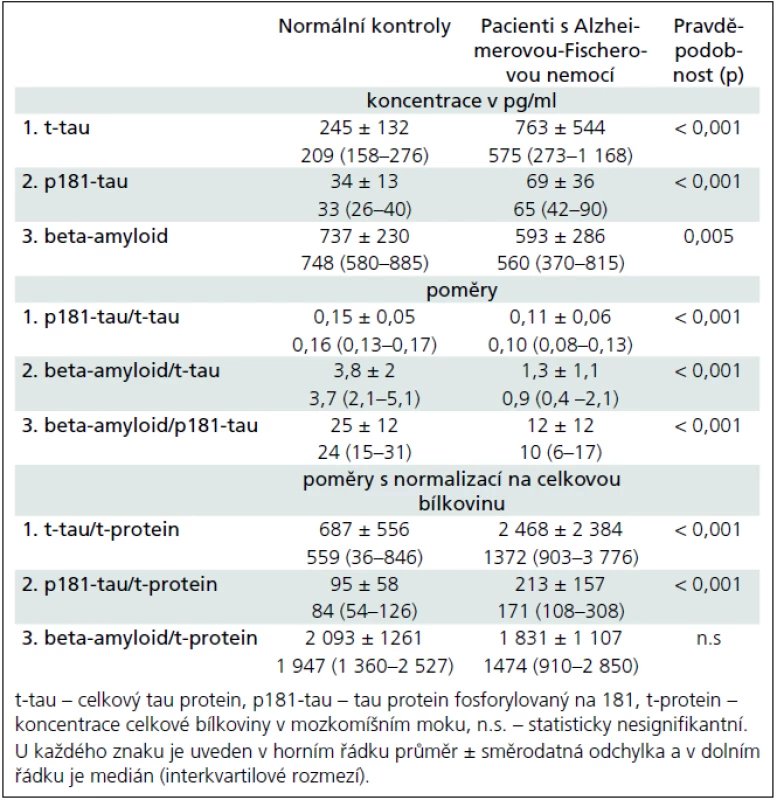
Obr. 1a–c ukazují koncentrace tau, p181-tau a beta-amyloidu v mozkomíšním moku pro jednotlivé podskupiny v hlavních kategoriích. Mozkomíšní koncentrace t-tau a p181-tau proteinů byly významně vyšší a beta-amyloidu významně nižší u pacientů s AFN než u kontrolních jedinců. Pacienti s AFN se neliší v koncentracích t-tau a beta-amyloidu od pacientů s VD či OD, zatímco p181-tau vykazuje významně vyšší koncentrace u AFN vs VD: p = 0,005, AFN vs OD: p = 0,001. Všechny tři analyty se nelišily mezi kontrolními jedinci s a bez abnormálního likvorového nálezu, mezi pacienty s AFN s a beze změn bílé hmoty a mezi VD a OD s jedinou výjimkou. Koncentrace beta-amyloidu v podskupině NKz+ byly významně snížené oproti těm v podskupině NKz – (p = 0,02) a nelišily se od koncentrací v podskupině AFNh – či AFNh+. Za povšimnutí na obr. 1b stojí tři vysoké hodnoty p181-tau u kontrolních osob. Hraniční koncentrace nebo poměry mezi skupinou pacientů s AFN a normálními kontrolami a ukazatele diagnostické výtěžnosti jsou v tab. 3. Konkrétní koncentrace pro různé diagnózy ve skupině OD je možné vidět v tab. 4.
Obr. 1a. Mozkomíšní koncentrace celkového tau proteinu u kontrolních jedinců, pacientů s AFN, VD a OD. NK z– (n = 52) – normální senioři s normálním likvorovým nálezem, NK z+ (n = 13) – normální kontroly s patologickým likvorovým nálezem, AFN h– (n = 13) – pacienti s A lzheimerovou-Fischerovou nemocí a bez významných změn bílé hmoty na zobrazení mozku, AN h+ (n = 26) – pacienti s A lzheimerovou-Fischerovou nemocí a se změnami bílé hmoty na zobrazení mozku, VD (n = 7) – pacienti s vaskulární demencí, OD (n = 12) – pacienti s ostatními, různými typy demencí. Hraniční čára přes celý obrázek ukazuje hodnotu, při které je podle ROC křivky dosaženo nejvyšší senzitivity a zároveň specificity pro odlišení pacientů s AFN od kontrolní populace. Krabice zobrazuje intekvartilové rozmezí, vodorovná čára uvnitř krabice značí medián vyjádřený číslem nad čárou a svislé svorky ukazují rozsah neodlehlých hodnot (± 1,5 výšky krabice od horního, resp. dolního kvartilu). Odlehlé body (kolečka a čtverečky) se nachází mezi 1,5 a 3 výškami krabice od horního, resp. dolního kvartilu. K dobrému znázornění koncentrací celkového tau proteinu byly vynechány extrémní hodnoty dvou pacientů s C rutzfeldovou-Jakobovou nemocí (3 947 a 9 192 pg/ml) (více než 3 výšky krabice od horního kvartilu). 
Obr. 1b. Mozkomíšní koncentrace tau proteinu fosforylovaného na pozici 181 (threonin) u kontrolních jedinců a pacientů s AFN, VD a OD. Vysvětlivky shodné s obr. 1a. 
Obr. 1c. Mozkomíšní koncentrace beta-amyloidu 42 u kontrolních jedinců a pacientů s AFN, VD a OD. Vysvětlivky shodné s obr. 1a. 
Tab. 3. Hraniční koncentrace a poměry likvorových ukazatelů mezi pacienty s Alzheimerovou-Fischerovou nemocí (n = 39) a kontrolními jedinci (n = 65). 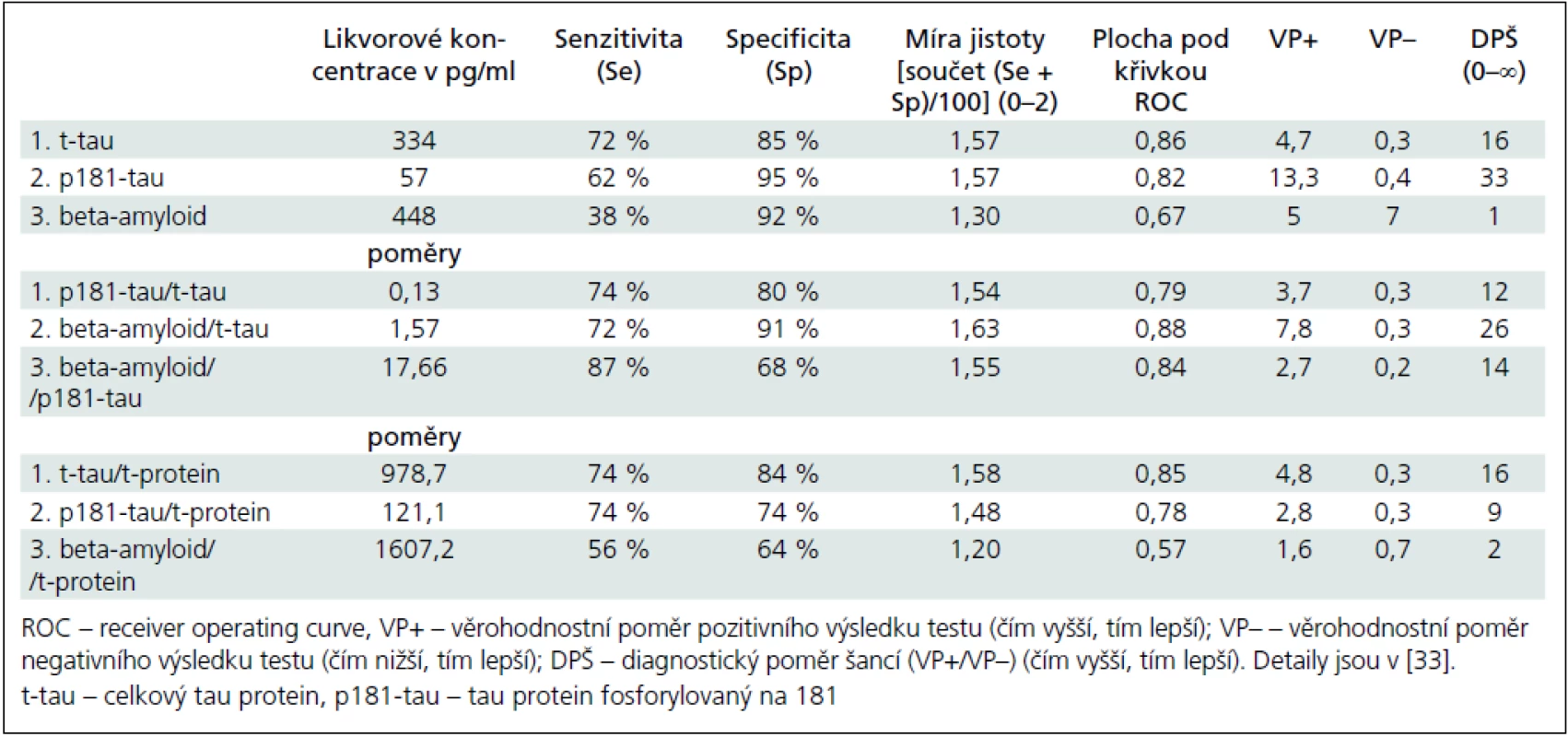
Tab. 4. Konkrétní koncentrace t-tau, p181-tau a beta-amyloidu v mozkomíšním moku u skupiny různých forem demencí. Tučně jsou zvýrazněny patologické hodnoty koncentrací podle námi vypočtených hraničních koncentrací pro jednotlivé analyty. Nápadné je zejména extrémní zvýšení t-tau u Creutzfeldtovy-Jakobovy nemoci odpovídající masivnímu rozpadu neuronů v krátkém časovém úseku. 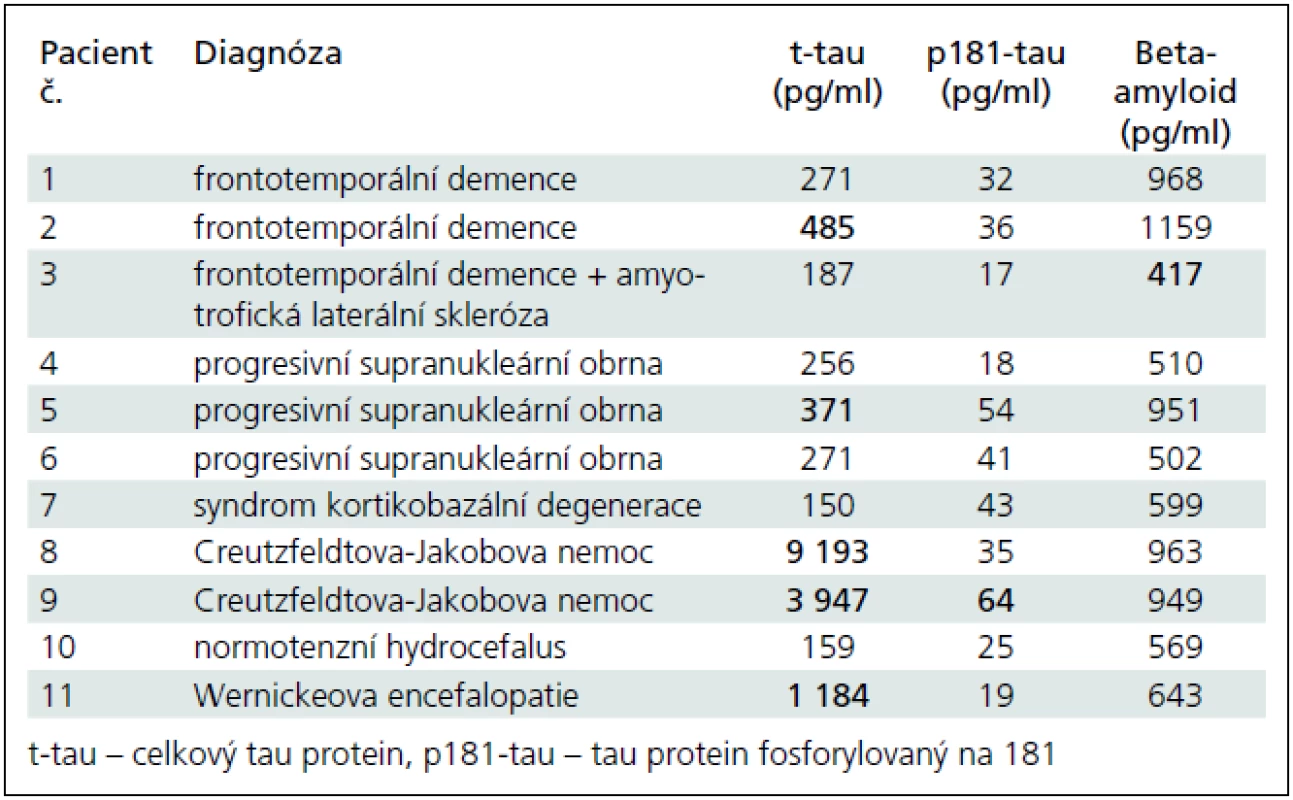
V celé skupině seniorů s normálními kognitivními funkcemi se koncentrace jak t-tau, tak p181-tau zvyšuje s věkem (obě r = 0,3; p < 0,01). Pro beta-amyloid tato věková souvislost neplatí (p > 0,05). U skupiny pacientů s AFN jsme neprokázali korelaci mezi kognitivním stavem, věkem, počtem leukocytů nebo celkovou bílkovinou v likvoru na jedné straně a koncentracemi ani jednoho z tripletu na druhé straně.
Diskuze
Na základě analýz našeho dlouhodobého používání tripletu v diagnostice demencí předkládáme několik zjištění. Pacienti s AFN měli významně odlišné mozkomíšní koncentrace tripletu oproti kontrolám (ať už s demencí jiného typu nebo bez ní). Oproti normálním kontrolám bez demence byly u pacientů s AFN mediánové koncentrace t-tau zhruba 3krát a p181--tau zhruba 2krát vyšší a koncentrace beta-amyloidu snížené asi o 1/4. Významné rozdíly mezi pacienty s AFN a kontrolami jsme našli i pro všechny tři možné poměry vždy dvou analytů z tripletu (p181-tau/t-tau, beta-amyloid/t-tau, beta-amyloid/p-tau) nebo pro každý poměr analytu vztažený na koncentraci celkové bílkoviny v likvoru (s výjimkou beta-amyloid//celková bílkovina v likvoru) (tab. 2). Nejlepšími ukazateli AFN byly: t-tau, p181--tau a poměr beta-amyloidu/t-tau. Ostatní poměry nepřinášely zřetelnější výhodu oproti samotným koncentracím analytů, naopak vyžadují vyšetření dvou bílkovin. Pokus o normalizaci analytů tripletu na celkovou bílkovinu v mozkomíšním moku nepřinesl žádné zlepšení oproti absolutním koncentracím, takže tento přístup není možné využít ve snaze o jednotné a případně mezinárodní normy. Nízkou výpovědní hodnotu normalizace tripletu na celkovou bílkovinu dobře demonstruje i tab. 2 velkými hodnotami směrodatných odchylek a interkvartilového rozmezí u těchto poměrů.
Z bližšího posouzení podskupin vyplývají dva poznatky. První pozorování vypovídá o tom, že přítomnost změn v bílé hmotě mozkové u pacientů s AFN se neprojevila v likvorovém tripletu. Podle naší studie je tedy možné výsledky tripletu interpretovat bez ohledu na cévní stav mozku u pacientů s AFN. Druhé zjištění ukazuje, že u skupiny normálních kontrol nebyly koncentrace tau ani p181-tau proteinů ovlivněny změnami celkové bílkoviny a leukocytů v likvoru. Naproti tomu při hyperproteinorhachii či pleocytóze v likvoru (tedy vesměs zánětlivé afekci, tzv. podskupina NKz+) byla koncentrace beta-amyloidu snížená. Tento pokles dosáhl pásma obvyklého pro AFN (obr. 1c). Znamená to, že beta-amyloid se snižuje také při zánětech nervového systému, a může tak být jejich nepřímým ukazatelem. Proto při interpretaci beta-amyloidu je třeba přihlížet k základnímu rozboru likvoru. Koncentrace beta-amyloidu však přímo nesouvisí s intenzitou zánětu podle celkové bílkoviny či počtu leukocytů v likvoru podle korelací.
U demencí s předpokládanou hlavní vaskulární složkou (skupina VD) jsou významně zvýšené koncentrace pouze celkového tau proteinu, zatímco p181-tau a beta-amyloid se nemění. Přesto zvýšení t-tau je jen mírné a nedosahuje úrovně AFN. Přitom by se dalo očekávat, že t-tau jako nespecifický ukazatel rozpadu neuronů by mohl být zvýšen na úroveň AFN či dokonce více. Podle koncentrací jak ve skupině VD, tak v podskupině AFNh+ soudíme, že vliv vaskulární složky na hladiny t-tau bude malý. Tento závěr je třeba brát s rezervou vzhledem k nízkému počtu pacientů s VD.
Významné rozdíly v tripletu, poměrech a v normalizovaných hodnotách mezi skupinami byl očekávaný výsledek odpovídající všeobecně známým nálezům [20]. V klinické praxi si při používání tripletu však klademe jinou otázku, a to jaká je hraniční koncentrace.
V evropských zemích existuje obrovská variace v hraničních hodnotách pro t-tau (medián 367 pg/ml, interkvartilové rozmezí 195–450 pg/ml), pro p181-tau (medián 60; 40–85) a pro beta-amyloid (medián 500, 300–849). Každá laboratoř by si proto měla vytvořit své vlastní normy, protože se nedají převzít odjinud [20]. Určit správné meze normálních hodnot pro triplet, poměry i normalizované hodnoty je náročný úkol. Nejdříve musí být k dispozici dostatečný počet pečlivě roztříděných osob s kvalitními diagnózami. Velmi důležitá je kontrolní skupina, které ne vždy bývá věnována stejná pozornost jako pacientům s demencemi. Problémem u nich bývá nedostatečná znalost jejich kognitivních funkcí nebo nevhodné složení diagnóz u kontrol, jindy věkový rozdíl proti skupině pacientů s demencí [20,23,34]. Hodnoty ovlivňuje také jistota diagnózy AFN (pravděpodobná vs definitivní). U histopatologicky verifikovaných pacientů s AFN jsou koncentrace beta-amyloidu nižší než u pacientů s klinickou diagnózou AFN (170 pg/ml vs 187 pg/ml) a t-tau vyšší (667 pg/ml vs 559 pg/ml) [35]. Důležitá je dále preanalytická fáze (odběr, zpracování a skladování likvoru). Laboratorní část také závisí na mnoha okolnostech: kvalita standardu dodávaného k soupravě [36], používání souprav od různých výrobců [37], variace mezi šaržemi stejné soupravy od stejného výrobce (inter-assay variabilita) [38], různé zvyklosti laboratoří [39] aj.
Dále chybí jednotný metodický přístup, jak stanovit hraniční hodnoty. Většina prací využívá ROC křivek. Při nich se pracuje s oběma porovnávanými skupinami současně k dosažení nejvyšší senzitivity a specificity [21,23,40]. Při porovnání s jinými přístupy se i nám tento způsob osvědčil.
Naše lokálně zjištěná hraniční koncentrace celkového tau touto metodou 334 pg/ml odpovídá výsledkům různě koncipovaných ostatních domácích i zahraničních unicentrických i multicentrických studií v poslední době (vždy pg/ml): 355 [21], 323 [40], 367 [20], 252 [41], 450 pro věkovou skupinu 51–70 let a 500 pro věkovou skupinu 71–93 let [42], nikoli mezinárodně ustanoveným normám doporučovaných i firmou Innogenetics 450 pro skupinu 51–70 let a 600 pro skupinu nad 70 let [43].
Naše výsledky senzitivity a specificity mezi pacienty s AFN a kontrolami jsou také s nimi srovnatelné. Nálezy mezi studiemi jsou různé. Vyšší specificita byla dosažena v původním českém sdělení (97 %) [21] nebo je uvedena v přehledném článku (průměrně 90 %) [44]. Hraniční hodnoty je třeba hledat v kvalitně provedených studiích na velkých počtech osob, nejlépe s histopatologickou verifikací AFN [35,41] a vždy ve vazbě na konkrétní laboratoř.
Naše hraniční koncentrace pro p181-tau optimalizovaná podle ROC křivky na 57 pg/ml je podobná jako v dalších studiích (vždy pg/ml): 55 [21], 60 [20] a 60 jako mezinárodně ustanovena norma [43].
Nejhorší výsledky a variace platí pro beta-amyloid 42. Rozdíly mezi pacienty s AFN a kontrolami byly ve srovnání s oběma tau proteiny nejmenší. Hraniční koncentrace 448 pg/ml zhruba odpovídá i jiným zjištěním (pg/ml): 458 [21], 500 [20], 643 [41], 500 [42] a 500 jako mezinárodně ustanovená norma a doporučovaná i firmou Innogenetics [43].
Tento trend většího rozptylu u beta-amyloidu než u tau proteinů se projevuje v téměř trojnásobném rozdílu hraniční hodnoty mezi evropskými státy [20], v multicentrické studii [45] nebo ve zprávě ze společného vyšetřování tripletu současně 14 skupinami [39]. Z těchto poznatků vyplývá, že beta-amyloid je nejvíce náchylný k variabilním výsledkům. S tím je potřeba počítat v klinické praxi, při stanovování norem i při výzkumu.
Závěrem je možné konstatovat, že výsledky likvorového tripletu poskytují nový pohled na diagnostiku pacientů s kognitivními poruchami. Jejich hlavní přínos lze pozorovat při složitějších diferenciálnědiagnostických úvahách nebo v detekci časných stadií. Je třeba mít však na zřeteli, že mají také omezenou výpovědní hodnotu. Proto se hledají nové ukazatelé různými skupinami včetně nás [46,47].
Poděkování
Práce byla podpořena grantem IGA MZ ČR NS 10369-3. Děkujeme prof. Koženému za pomoc při statistických analýzách. Vážíme si dlouhodobé a vstřícné spolupráce s MUDr. Radoslavem Matějem, Ph.D., při histopatologických verifikacích klinických diagnóz neurodegenerativních demencí. Tento článek věnujeme zapomenuté památce významného českého psychiatra a neuropatologa Pickovy německé psychiatrické kliniky Oskara Fischera (1876–1942), který zpracoval rozsáhlejší neuropatologické soubory než v podobné době Alois Alzheimer.
doc. MUDr. Aleš Bartoš, Ph.D.
AD Centrum, Psychiatrické centrum Praha
Ústavní 91
181 03 Praha 8-Bohnice
e-mail: bartos@pcp.lf3.cuni.cz
Přijato k recenzi: 19. 1. 2012
Přijato do tisku: 2. 4. 2012
Zdroje
1. Goedert M. Oskar Fischer and the study of dementia. Brain 2009; 132(Pt 4): 1102–1111.
2. Kalvach P, Kalvach Z. Demence na prahu 20. století: Praha vs Frankfurt vs Mnichov. Psychiatrie 2010; 14(3): 135–140.
3. Bartoš A, Hasalíková M. Poznejte demenci správně a včas – příručka pro klinickou praxi. Praha: Mladá fronta 2010.
4. Rektorová I. Neurodegenerativní demence. Cesk Slov Neurol N 2009; 72/105(2): 97–109.
5. Ressner P, Hort J, Rektorová I, Bartoš A, Rusina R, Línek V et al. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Cesk Slov Neurol N 2008; 71/104(4): 494–501.
6. Bartoš A. Raisová M. Kopeček M. Důvody a průběh novelizace české verze Addenbrookského kognitivního testu (ACE-CZ). Cesk Slov Neurol N 2011; 74/106(6): e1–e5.
7. Bartoš A, Raisová M, Kopeček M. Novelizace české verze Addenbrookského kognitivního testu (ACE-CZ). Cesk Slov Neurol N 2011; 74/107(6): 681–684.
8. Hummelová-Fanfrdlová Z, Rektorová I, Sheardová K, Bartoš A, Línek V, Ressner P et al. Česká adaptace Addenbrookského kognitivního testu (Addenbrooke’s Cognitive Examination). Československá psychologie 2009; 53(4): 376–388.
9. Hort J, Rusina R et al. Paměť a její poruchy. Paměť z hlediska neurovědního a klinického. Praha: Maxdorf 2007.
10. Topinková E, Jirák R, Kožený J. Krátká neurokognitivní baterie pro screening demence v klinické praxi: Sedmiminutový screeningový test. Interní Med 2002; 4(8): 386–391.
11. Martínek P, Bartoš A. Použití dotazníků aktivit denního života u pacientů s Alzheimerovou nemocí. Cesk Slov Neurol N 2011; 74/107(6): 632–640.
12. Bartoš A, Martínek P, Řípová D. Dotazník Bristolská škála aktivit denního života BADLS-CZ pro hodnocení pacientů s demencí. Cesk Slov Neurol N 2010; 73/106(6): 673–677.
13. Bartoš A, Martínek P, Buček A, Řípová D. Dotazník soběstačnosti DAD-CZ – česká verze pro hodnocení každodenních aktivit pacientů s Alzheimerovou nemocí. Neurol prax 2009; 10(5): 320–323.
14. Bartoš A, Martínek P, Bezdíček O, Buček A, Řípová D. Dotazník funkčního stavu FAQ-CZ – česká verze pro zhodnocení každodenních aktivit pacientů s Alzheimerovou nemocí. Psychiat Prax 2008; 9(1): 31–34.
15. Martínek P, Bartoš A. Aktivity denního života pacientů s Alzheimerovou nemocí očima jejich pečovatelů. Čes Ger Rev 2008; 6(3): 186–192.
16. Bartoš A, Zach P, Diblíková F, Tintěra J, Řípová D, Brunovský M. Vizuální kategorizace mediotemporální atrofie na MR mozku u Alzheimerovy nemoci. Psychiatrie 2007; 11 (Suppl 3): 49–52.
17. Hort J, O’Brien JT, Gainotti G, Pirttila T, Popescu BO, Rektorova I et al. EFNS guidelines for the diagnosis and management of Alzheimer’s disease. Eur J Neurol 2010; 17(10): 1236–1248.
18. Bartoš A, Píchová R, Trojanová H, Lang O, Řípová D. SPECT mozku v diagnostice Alzheimerovy nemoci. Psychiatrie 2008; 12 (Suppl 3): 8–11.
19. Sheardová K, Hort J, Rektorova I, Rusina R, Línek V, Bartoš A. Dementia diagnosis and treatment in Czech neurological and psychiatric practices. Cesk Slov Neurol N 2012; 75/108(2): 208–211.
20. Hort J, Bartos A, Pirttilä T, Scheltens P. Use of cerebrospinal fluid biomarkers in diagnosis of dementia across Europe. Eur J Neurol 2010; 17(1): 90–96.
21. Hort J, Glosová L, Vyhnálek M, Bojar M, Škoda D, Hladíková M. Tau protein a beta amyloid v likvoru u Alzheimerovy choroby. Cesk Slov Neurol N 2007; 70/103(1): 30–36.
22. Mareš J, Herzig R, Pirman V, Urbánek K, Bekárek V, Schneiderka P et al. Tau protein a beta-amyloid jako diagnostické markery Alzheimerovy demence. Čes a slov Psychiat 2004; 100(1): 31–35.
23. Vališ M, Taláb R, Andrýs C, Štourač P, Masopust J, Kalnická D, Waberžinek G. Tau-protein, fosforylovaný tau-protein a beta-amyloid42 v likvoru u demencí a roztroušené sklerózy. Cesk Slov Neurol N 2008; 71/104(3): 329–335
24. Řípová D, Strunecká A. An ideal biological marker of Alzheimer’s disease. Physiol Res 2001; 50(2): 119–129.
25. Řípová D, Platilová V, Strunecká A, Jirák R, Höschl C. Cytosolic calcium alterations in platelets of patients with early stages of Alzheimer‘s disease. Neurobiol Aging 2000; 21(5): 729–734.
36. Kristofiková Z, Bockova M, Hegnerova K, Bartos A, Klaschka J, Ricny J et al. Enhanced levels of mitochondrial enzyme 17beta-hydroxysteroid dehydrogenase type 10 in patients with Alzheimer disease and multiple sclerosis. Mol Biosyst 2009; 5(10): 1174–1179.
27. Gažová Z, Antošová A, Krištofiková Z, Bartoš A, Říčný J, Čechová L et al. Attenuated antiaggregation effects of magnetite nanoparticles in cerebrospinal fluid of people with Alzheimer’s disease. Molecular Biosystems 2010; 6(11): 2200–2205.
28. Vyhnálek M, Bartoš A, Dostál V, Franková V, Holmerová I, Laczó J et al. Diagnostikujeme a léčíme demenci správně a včas? Výsledky průzkumu ve světle nových doporučení. Neurol Prax 2011; 12(5): 352–358.
29. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984; 34(7): 939–944.
30. Bartoš A, Zach P, Tintěra J, Ibrahim I, Řípová D. Jednoduchá klasifikace změn bílé hmoty na MR mozku ve stáří. Psychiatrie 2010; 14 (Suppl 2): 44–47.
31. Folstein MF, Folstein SE, McHugh PR. “Mini-Mental State”. A practical method for grading the cognitive state of patients for the clinician. J Psychiat Res 1975; 12(3): 189–198.
32. Mattis S. Mental status examination for organic mental syndrome in the elderly patient. In: Bellak L, Karasu TB (eds). Geriatric Psychiatry. New York, Grune & Stratton 1976 : 77–121.
33. Dušek L, Pavlík T, Jarkovský J, Koptíková J. Analýza dat v neurologi. XXVI. Hodnocení diagnostických testů – věrohodnostní poměr a diagnsotický poměr šancí. Cesk Slov Neurol N 2011; 74/107(2): 221–225.
34. Pidrman V, Látalová K, Mareš J, Urbánek K, Herzig R, Bekárek V et al. Stanovení tau proteinu a beta-amyloidu jako možných diagnostických markerů a demencí. Cesk Slov Neurol N 2004; 67/100(5): 330–334.
35. Sunderland T, Linker G, Mirza N, Putnam KT, Friedman DL, Kimmel LH et al. Decreased beta-amyloid 1–42 and increased tau levels in cerebrospinal fluid of patients with Alzheimer disease. JAMA 2003; 289(16): 2094–2103.
36. Petzold A, Altintas A, Andreoni L, Bartos A, Berthele A, Blankenstein MA et al. Neurofilament ELISA validation. J Immunol Methods 2010; 352(1–2): 23–31.
37. Fialová L, Bartoš A, Švarcová J, Doležil D, Malbohan I. Stanovení tau proteinu v mozkomíšním moku pacientů s roztroušenou sklerózou dvěma soupravami ELISA. Klinická biochemie a metabolismus 2011; 19/40(2): 113–118.
38. Mattsson N, Andreasson U, Persson S, Arai H, Batist SD, Bernardini S et al. The Alzheimer’s Association external quality control program for cerebrospinal fluid biomarkers. Alzheimers Dement 2011; 7(4): 386–395.
39. Teunissen CE, Verwey NA, Kester MI, van Uffelen K, Blankenstein MA. Standardization of Assay Procedures for Analysis of the CSF Biomarkers Amyloid β (1–42), Tau, and Phosphorylated Tau in Alzheimer‘s Disease: Report of an International Workshop. Int J Alzheimers Dis 2010; pii: 635053.
40. Petzold A, Chapman MD, Schraen S, Verwey NA, Pasquier F, Bombois S et al. An unbiased, staged, multicentre, validation strategy for Alzheimer’s disease CSF tau levels. Exp Neurol 2010; 223(2): 432–438.
41. Hulstaert F, Blennow K, Ivanoiu A, Schoonderwaldt HC, Riemenschneider M, De Deyn PP et al. Improved discrimination of AD patients using beta--amyloid (1–42) and tau levels in CSF. Neurology 1999; 52(8): 1555–1562.
42. Sjogren M, Davidsson P, Tullberg M, Minthon L, Wallin A, Wikkelso C et al. Both total and phosphorylated tau are increased in Alzheimer’s disease. J Neurol Neurosurg Psychiatry 2001; 70(5): 624–30.
43. Humpel Ch. Identifying and validating biomarkers for Alzheimer’s disease. Trends in Biotechnology 2011; 29(1): 26–32.
44. Blennow K, Hampel H. CSF markers for incipient Alzheimer’s disease. Lancet Neurol 2003; 2(10): 605–613.
45. Vewey NA, van der Flier WM, Blennow K, Clark C, Sokolow S, De Deyn PP. A worldwide multicentre comparison of assays for cerebrospinal fluid biomarkers in Alzheimer‘s disease. Ann Clin Biochem 2009; 46(Pt 3): 235–240.
46. Bartos A, Fialova L, Svarcova J, Ripova D. Patients with Alzheimer disease have elevated intrathecal synthesis of antibodies against tau protein and heavy neurofilament. J Neuroimmunol. In press 2012. http://dx.doi.org/10.1016/j.jneuroim.2012.08.001
47. Kristofikova Z, Ripova D, Bartos A, Bockova M, Hegnerova K, Ricny J et al. Neuroinflammation and complexes of 17ß-hydroxysteroid dehydrogenase type 10 – amyloid ß in Alzheimer´s Disease. Curr Alzheimer Res. In press 2012.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2012 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Vliv malých dávek vína či jiných alkoholických nápojů na lidské zdraví a délku života
- Emoční paměť – patofyziologie a klinické souvislosti
- Endovaskulární léčba intrakraniálních aneuryzmat – metodika, indikace, komplikace
- Validita a prediktivní hodnota skríningových testů u prediabetické a časné diabetické polyneuropatie
- Komentář k práci Š. Buršové et al
- Incidence a rizikové faktory pooperačního deliria
- Bezpečnost a účinnost intravenózní trombolytické terapie mozkového infarktu u pacientů nad 80 let věku
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
- Zhoršení kognitivních funkcí a snížení perfuze v kontralaterálním frontálním laloku u pacientů s lézí mozečku
- Baha jako řešení jednostranné hluchoty po operaci vestibulárního schwannomu
- Sekvestrace MBNL1 proteinu mutovaným ZNF9 mRNA v lymfocytech pacientů s myotonickou dystrofií 2. typu
- Lze detekovat intrakraniální venózní reflux z transkondylárního přístupu? Výsledky studie s Fusion Imaging
- Náhrada defektu kalvy u dítěte po úrazu CNS biokompatibilním materiálem na míru – kazuistika
- Motorické stereotypie v dětském věku – kazuistiky
- Léčba spinálních paragangliomů – kazuistiky
- Amyotrofická laterální skleróza v zařízení paliativní hospicové péče – kazuistika
- Idiopatická stenóza akveduktu a porucha vývoje řeči u dětí s neurofibromatosis von Recklinghausen typ 1 – dvě kazuistiky
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXXV. Rozlišujme poměr šancí a relativní riziko -
8. olomoucké neuroimunologické sympozium s mezinárodní účastí
Olomouc, 20.–21. 9. 2012
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Motorické stereotypie v dětském věku – kazuistiky
- Emoční paměť – patofyziologie a klinické souvislosti
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



