-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Asociace polymorfizmů v genu pro matrix metalloproteinázu-2 a tkáňový inhibitor metalloproteinázy-2 s roztroušenou sklerózou
An Association between Matrix Metalloproteinase-2 and TIMP-2 +853G/A Gene Polymorphisms and Multiple Sclerosis
Background:
Matrix metalloproteinases (MMPs) play an important role in the immunopathogenesis of multiple sclerosis (MS). They are notable contributors to the progression of inflammatory process, blood-brain barrier disruption, formation of MS lesions and demyelination. The matrix metalloproteinase-9 (MMP-9) and matrix metalloproteinase-2 (MMP-2) are the most important. They are expressed by T-lymphocytes and monocytes, the predominant group of inflammatory cells in active demyelinating plaques. In our previous study, we demonstrated a borderline association of MMP-2-1575G/A gene polymorphism with MS susceptibility. To date, no other genetic association study involving MMP-2 and (tissue inhibitor of metalloproteinases-2 (TIMP-2) genes variability and MS have been carried out.Objective:
The aim of this study was to investigate the possible association of MMP-2 (–168G/T, –735C/T) and TIMP-2 (+853G/A) gene polymorphisms with MS susceptibility; to find potential gender differences; and to investigate whether these polymorphisms influence disability.Materials and methods:
A study group consisted of 240 patients fulfilling McDonald’s criteria of MS, a control group consisted of 135 healthy volunteers. Clinical status was evaluated with the Expanded Disability Status Scale (EDSS) and the disease severity was calculated using the MS Severity Score (MSSS). Polymerase chain reaction (PCR) methods and restriction analysis were used for genotyping in MMPs genes.Results:
We demonstrated a borderline association between TIMP-2 +853G/A gene polymorphism and a risk of developing relapsing-remitting MS (Pg = 0.04), odds ratio (OR), 1.46; 95% confidence interval (CI): 0.91–2.36). Other polymorphisms were associated neither with MS susceptibility nor with the disease phenotype. No association with disability was found.Conclusion:
MMP-2 and TIMP-2 gene polymorphisms are not a risk factor for MS susceptibility in the Czech population.Key words:
gene polymorphism – matrix metalloproteinases – multiple sclerosis
Autoři: Y. Benešová 1; A. Vašků 2; P. Štouračihash2 1,3 1,3
Působiště autorů: Neurologická klinika LF MU a FN Brno 1; Ústav patologické fyziologie, LF MU, Brno 2; CEITEC – Středoevropský technologický institut, MU, Brno 3
Vyšlo v časopise: Cesk Slov Neurol N 2012; 75/108(3): 314-319
Kategorie: Původní práce
Souhrn
Úvod:
Matrix metalloproteinázy (MMPs) hrají důležitou roli v imunopatogenezi roztroušené sklerózy (RS). Významně se podílejí na progresi zánětlivého procesu, porušení hemato-encefalické bariéry, formování zánětlivých RS lézí a demyelinizaci. Jedná se zejména o metalloproteinázu-9 (MMP-9) a metalloproteinázu-2 (MMP-2), exprimované T lymfocyty a monocyty, které jsou převažující populací zánětlivých buněk v aktivních demyelinizačních plakách. V naší předchozí studii jsme prokázali hraniční asociaci polymorfizmu MMP-2-1575G/A s RS. Jiné studie zabývající se vztahem genetických polymorfizmů lokalizovaných v genech pro MMP-2 a tkáňový inhibitor metalloproteinázy-2 (TIMP-2) s RS dosud nebyly provedeny.Cíl:
Cílem práce bylo určit asociační vztah genetických polymorfizmů (–168G/T, –735C/T) lokalizovaných v genu pro MMP-2 a polymorfizmu +853 G/A v genu pro TIMP-2 s vnímavostí k RS; nalézt možné rozdíly mezi pohlavími a zjistit, zda ovlivňují tíži onemocnění a stupeň postižení.Soubor a metodika:
Do studie bylo zařazeno 240 pacientů s RS, diagnostikovanou dle McDonaldových kritérií, kontrolní soubor byl tvořen 135 zdravými jedinci. Klinický stav byl hodnocen pomocí Expanded Disability Status Scale (EDSS), stupeň postižení byl kvantifikován pomocí Multiple Sclerosis Severity Score (MSSS). Genotypizace byla provedena metodou polymerázové řetězové reakce a restrikční analýzou.Výsledky:
Byla prokázána hraniční asociace v distribuci TIMP-2 +853G/A genetického polymorfizmu s rizikem rozvoje relabující-remitentní RS (Pg = 0,04), odds ratio (OR) 1,46; 95% Confidence Interval (CI): 0,91–2,36). V distribuci ostatních vyšetřených polymorfizmů asociace nalezena nebyla. Nebyl zjištěn rozdíl mezi pohlavími ani asociace s tíží onemocnění.Závěr:
Vyšetřené polymorfizmy nejsou rizikovým faktorem vnímavosti k RS v české populaciKlíčová slova:
genetické polymorfizmy – matrix metalloproteinázy – roztroušená sklerózaÚvod
Roztroušená skleróza mozkomíšní (RS) je chronické, zánětlivé, autoimunitní onemocnění centrálního nervového systému (CNS), vedoucí ke ztrátě myelinu v zánětlivých ložiscích bílé hmoty a postižení axonů [1].
Jedná se o komplexní onemocnění, jehož rozvoj a progresi ovlivňuje několik patofyziologických procesů, které nejsou rovnoměrně zastoupeny u jednotlivých pacientů a podmiňují různý klinický průběh, prognózu a efekt léčby [2]. Migrace aktivovaných lymfocytů, makrofágů, zánětlivých buněk, autoprotilátek a komplementu přes hemato-encefalickou bariéru (HEB) do CNS je považováno za klíčové pro aktivitu onemocnění a formování zánětlivých RS lézí [3,4]. Důležitou roli v tomto procesu hrají adhezivní molekuly, chemokiny a matrix metalloproteinázy (MMPs).
MMPs jsou enzymy, které se podílejí na remodelaci tkání za normálních i patologických stavů a jsou schopné degradovat většinu proteinových složek základní mezibuněčné hmoty [5–7]. Je známo nejméně 26 MMPs [8,9], jejichž exprese byla zjištěna v různých buněčných populacích, zejména v T lymfocytech, monocytech a B lymfocytech [5,6]. Matrix metalloproteináza-2 (MMP-2), nazývaná také jako gelatináza A, hraje důležitou roli v patofyziologii RS. Dosavadní studie prokazují, že se spolu s matrix metalloproteinázou-9 (MMP-9) významně podílí na porušení HEB a štěpení myelinového bazického proteinu [5,10–12] u RS a experimentální autoimunitní encefalomyelitidy [13–16].
MMP-9 hraje významnou roli také v patogenezi mnoha dalších, zejména autoimunitních onemocnění – např. u systémového lupusu, revmatoidní artritidy, systémové sklerózy, arteriosklerózy a kardiovaskulárních onemocnění [17]. Byla zjištěna zvýšená exprese MMP-9 v nestabilních plakách ve studii 41 pacientů po endarterektomii [18]. Další experimentální studie na zvířecím modelu prokázala signifikantně zvýšenou expresi MMP-9 v kortexu ischemického ložiska po podání intravenózní trombolýzy s užitím tkáňového aktivátoru plazminogenu [19].
Gelatináza A je exprimována nejen periferními leukocyty, ale také astrocyty, neurony a endoteliálními buňkami v CNS [20–23]. Byla prokázána zvýšená exprese MMP-2, tkáňového inhibitoru metalloproteináz-2 (TIMP-2) a MMP-14 monocyty u RS pacientů ve srovnání se zdravými jedinci [6]. Vzhledem k tomu, že monocyty se v CNS transformují na makrofágy a mikroglii, které tvoří hlavní populaci zánětlivých buněk v aktivních demyelinizačních plakách [6], MMP-2 se pravděpodobně významně podílí na progresi zánětlivého procesu a vlastního onemocnění.
Byla nalezena zvýšená hladina MMP-2 v séru [24,25] u primárně progresivní RS, zvýšená exprese mRNA v periferních mononukleárech (PBMC) u RS pacientů [14] a v chronických demyelinizačních lézích [15,26,27]. Autoři Fainardi et al (2009) prokázali zvýšenou hladinu aktivní MMP-2 intratékálně a zvýšený poměr MMP-2/TIMP-2 v mozkomíšním moku a séru u RS pacientů ve srovnání s nezánětlivými a jinými zánětlivými stavy [28].
Exprese a aktivita MMPs je regulována na několika úrovních: genové exprese; transkripce, zahrnující cytokiny a růstové faktory [5,6,8,29,30]; aktivace proenzymu; sekrece enzymu [31,32]; je inhibována specificky tkáňovými inhibitory (TIMPs), které se váží na proformy nebo aktivované MMPs a nespecificky alfa-2 makroglobulinem. Dochází k modifikované expresi genů kódujících tyto proteiny. Mutace těchto genů pravděpodobně ovlivňuje stupeň exprese, stabilitu mRNA a vlastnosti daných proteinů, což může ovlivnit etiopatogenezi procesu.
V naší předchozí studii jsme prokázali hraniční asociaci polymorfizmu MMP-2 –1575G/A s RS [33]. Jiné studie zabývající se vztahem genetických polymorfizmů lokalizovaných v genech pro MMP-2 a TIMP-2 s RS dosud nebyly provedeny. Z tohoto důvodu jsme vyšetřili další funkční polymorfizmy lokalizované v těchto kandidátních genech.
Cílem práce je analýza genetických polymorfizmů (–168G/T, –735C/T) lokalizovaných v genu pro MMP-2 a polymorfizmu +853 G/A v genu pro TIMP-2, stanovení frekvence alel a genotypové distribuce ve studovaném souboru. Určit asociační vztah s vnímavostí k RS; nalézt možné rozdíly mezi pohlavími a zjistit, zda ovlivňují tíži onemocnění a stupeň postižení.
Materiál a metodika
Charakteristika souboru
Demografická data jsou shrnuta v tab. 1.
Jedná se o studii typu case-control. Bylo do ní zařazeno 375 jedinců, 240 pacientů s RS, diagnostikovanou dle revidovaných McDonaldových kritérií [34], průměrný věk 38 ± 10,2 let (x ± SD), 181 žen a 59 mužů. Průměrná délka onemocnění činila 7,5 ± 6,3 let (x ± SD). Kontrolní soubor byl tvořen 135 zdravými jedinci, průměrný věk 36 ± 11,9 let (x ± SD), 85 žen a 50 mužů. Klinický stav byl hodnocen pomocí Expanded Disability Status Scale (EDSS) mimo ataku [35]. Stupeň postižení byl spočítán podle Multiple Sclerosis Severity Score (MSSS) (graf 1) [36]. Nemocní byli rozděleni podle formy onemocnění do skupin následovně: 182 pacientů s relabující remitentní RS (RRRS), 32 nemocných s sekundárně chronicko-progresivní RS (SPRS) a 26 nemocných s primárně progresivní RS (PPRS) formou onemocnění.
Graf 1. Multiple Sclerosis Severity Score vygenerované v souboru 9 892 evropských RS pacientů. 
Všichni pacienti byli vyšetřeni ve specializovaném centru pro RS stejným lékařem (YB). Studie byla schválena etickou komisí FN Brno a všichni jedinci podepsali informovaný souhlas před vstupem do studie.
Genetická analýza
Genotypizace byla provedena metodou polymerázové řetězové reakce (PCR) a restrikční analýzou. DNA byla izolována z leukocytů periferní krve pomocí metody s využitím proteinázy K. Izolace DNA spočívala v lýze buněk v roztoku, který obsahuje 10 mM Tris-HCl (pH = 8,5); 0,1% SDS; 0,1 mg/ml proteinázy K. Proteináza K byla odstraněna extrakcí fenolem a po etanolové precipitaci a vysušení byl vzorek DNA rozpuštěn v TE pufru (10 mM Tris-Cl pH = 8,1 mM EDTA pH = 8).
Detekce polymorfizmů (–168G/T, –735C/T) v genu pro MMP-2 a polymorfizmu +853G/A v genu pro TIMP-2 byla provedena pomocí PCR se specifickými primery navrženými původními autory [37,38] a následné restrikční analýzy specifickými endonukleázami. Popis metodiky je uveden v tab. 2 a 3.
Tab. 2. Sekvence primerů, teplota pro připojení primerů. 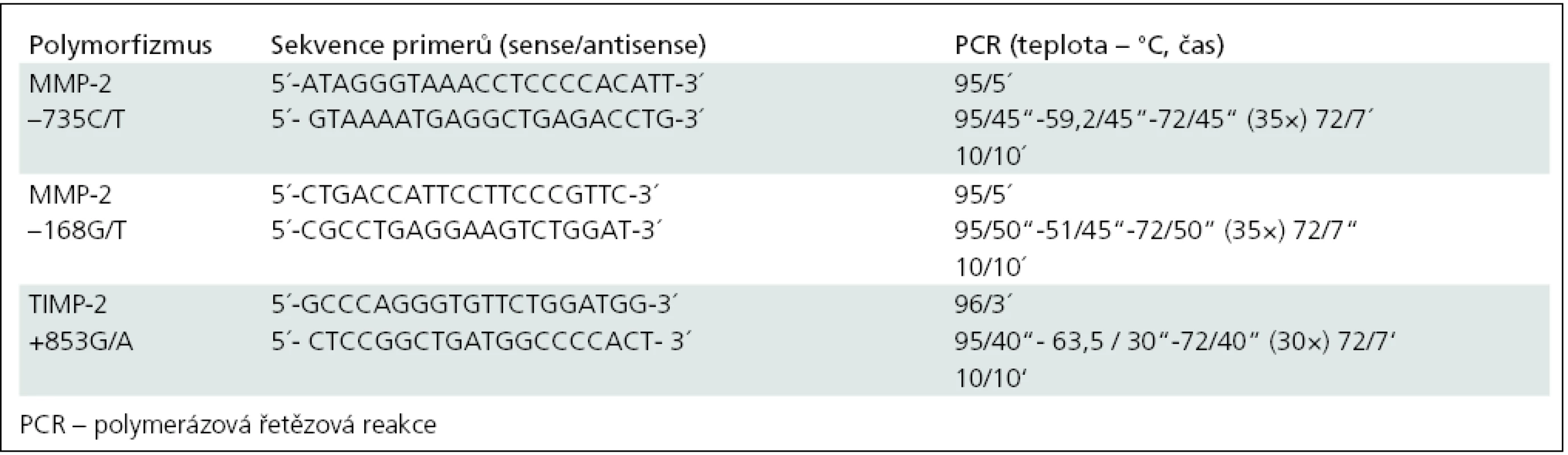
Tab. 3. Restrikční enzymy, podmínky a délka PCR produktů pro analýzu genů MMP-2 a TIMP-2. 
Statistické hodnocení
K testování rozdílů mezi vybranými skupinami nemocných nebo asociacemi mezi sledovanými parametry byly použity tyto statistické techniky: Normální rozložení bylo testováno Kolmogorov-Smirnovovým testem normality. Normální rozložení dat bylo prezentováno jako průměr ± směrodatná odchylka (x ± SD).
Vzhledem k tomu, že distribuce většiny získaných hodnot se lišila od normálního rozložení, byly dále použity neparametrické testy. V case-control studii bylo provedeno srovnání mezi genovou distribucí a alelovou frekvencí ve skupině nemocných a kontrolní skupině. K testování rozdílů mezi vybranými podskupinami nemocných byla použita Hardyho-Weinbergova rovnováha, rozdíly v genové distribuci byly testovány chí-kvadrát (χ2) testem a v alelové frekvenci polymorfizmů jednotlivých nukleotidů Fisherovým exaktním testem. Pro ordinární kategorické proměnné byl použit nepárový test ANOVA. Odds Ratio (OR), 95% Confidence Interval (CI) a signifikance hodnot byla spočítána běžnými metodikami.
Pro mnohočetné srovnání byla spočítána Bonferroniho korelace (Pcorr). Pro zjištění korelačního vztahu mezi genotypy a tíží onemocnění vyjádřenou EDSS a stupněm postižení vyjádřenou MSSS byl použit Kruskal-Wallisův ANOVA test. Pro všechny analýzy byla považována za statisticky signifikantní hodnota p ≤ 0,05. Ke zpracování výsledků byl použit program STATISTICA (StatSoft, Inc., Tulsa, OK, USA), verze 8.
Výsledky
Genetická studie
Genotypová distribuce a alelová frekvence polymorfizmů (–168G/T, –735C/T) v genu pro MMP-2 a polymorfizmu +853G/A v genu pro TIMP-2 v celé RS skupině a kontrolní skupině je shrnuta v tab. 4.
Tab. 4. Srovnání genotypové distribuce a alelové frekvence u skupiny RS a kontrol. 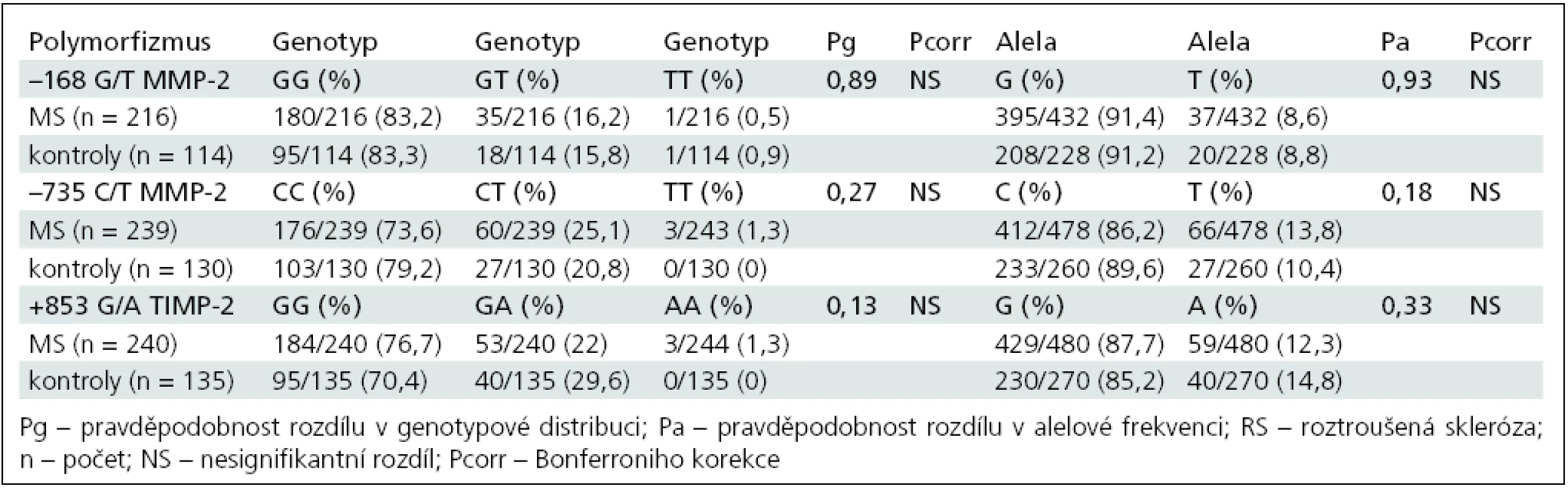
Genotypová distribuce a alelová frekvence polymorfizmu +853G/A v genu pro TIMP-2 ve skupině RRRS a kontrolní skupině je shrnuta v tab. 5.
Tab. 5. Srovnání genotypové distribuce a alelové frekvence TIMP-2 +853G/A polymorfizmu skupin RS a kontrol. 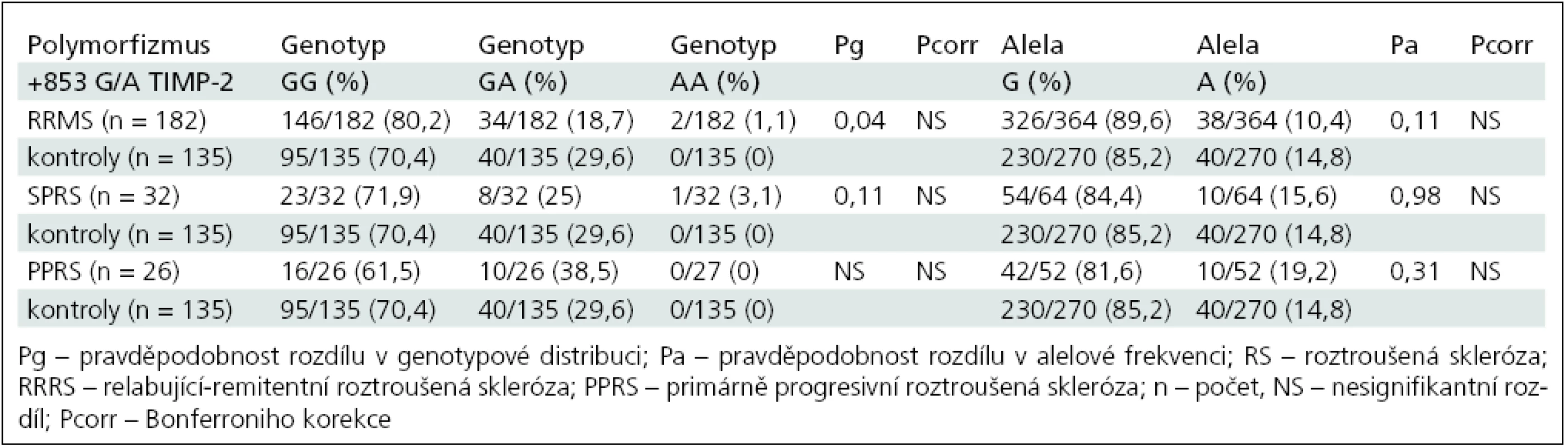
Genotypová distribuce se nelišila v Hardyho-Weinbergově rovnováze v žádném polymorfizmu v žádné skupině (p > 0,05).
Nebyla prokázána signifikantní asociace vyšetřených polymorfizmů s vnímavostí k RS a nebyl prokázán rozdíl mezi pohlavími.
Po rozdělení nemocných na skupiny podle průběhu onemocnění na RRRS, SPRS a PPRS jsme prokázali v distribuci polymorfizmu TIMP-2 +853G/A signifikantní rozdíl genové distribuce (Pg = 0,04) mezi skupinou RRRS a kontrolní skupinou. Homozygoti GG a heterozygoti GA se vyskytovali frekventněji u pacientů s RRRS (OR 1,46; 95% CI: 0,91–2,36). Tento rozdíl však nezůstal signifikantní po mnohonásobném srovnání.
Nebyl prokázán signifikantní rozdíl vyšetřených polymorfizmů mezi skupinami RRRS, SPRS PPRS.
Korelace genotypů s tíží onemocnění a stupněm postižení
Nebyla nalezena signifikantní korelace mezi genotypy a tíží onemocnění vyjádřenou EDSS ani stupněm postižení vyjádřenou MSSS podle Roxburgha. EDSS skóre v celé RS skupině činilo 3,5 ± 1,8 (x ± SD), MSSS skóre v celé RS skupině činilo 5,6 ± 2,3 (x ± SD).
Diskuze
RS je multifaktoriální choroba, vnímavost k tomuto onemocnění je podmíněna genetickou predispozicí. Mezi kandidátní geny řadíme geny pro MMP-2, -9 a jejich inhibitory, neboť hrají důležitou roli v migraci zánětlivých buněk přes HEB, což je jedním z nejdůležitějších faktorů podmiňujících rozvoj a progresi RS.
V prezentované asociační studii byl poprvé testován vztah genetických polymorfizmů (–735C/T, –168G/T) lokalizovaných v kandidátním genu pro MMP-2 a TIMP-2 +853G/A genetického polymorfizmu s rizikem rozvoje RS. Naše předchozí studie prokázala četnější zastoupení homozygotů GG a heterozygotů GA MMP-2 –1575G/A genetického polymorfizmu ve skupině RS pacientů ve srovnání s kontrolním souborem [33]. Alela –1575G zvyšuje promotorovou aktivitu MMP-2 ovlivněním vazby estrogenního receptoru [39].
Alela T MMP-2-735C/T genetického polymorfizmu je také funkční, snižuje promotorovou aktivitu následkem přerušení Sp1-vazebného místa (CCACC box) ve studii in vitro [40]. Buněčný transkripční faktor Sp1 se váže na kritické regulační prvky v různých buněčných a virových promotorech. Chybějící Sp1-vazebná sekvence MMP-2 –735T alely může vést ke snížení produkce proteinu MMP-2 u jedinců nesoucích CT nebo TT genotyp ve srovnání s jedinci nesoucími CC genotyp [37]. Tato alela je funkčně spojena s alelou T –1306C/T genetického polymorfizmu, která také silně snižuje promotorovou aktivitu přerušením Sp1-vazebného místa in vitro [37] a bylo prokázáno synergní ovlivnění exprese mRNA MMP-2 [41]. Byla zjištěna asociace haplotypu CC se zvýšeným rizikem karcinomu jícnu [40] a plicního karcinomu [41,42]. U revmatoidní artritidy byla zjištěna zvýšená frekvence alely T u nemocných mužů [43] ve srovnání se zdravými kontrolami. V našem souboru nebyl nalezen signifikantní rozdíl mezi RS pacienty a kontrolní skupinou u tohoto genetického polymorfizmu.
Asociační studie zabývající se vztahem genetických polymorfizmů lokalizovaných v genu pro TIMP-2 s RS nebyly dosud provedeny. Studovali jsme TIMP-2 +853 G/A polymorfizmus, který je lokalizován na chromozomu X17q23–q25 a nachází se na 3. exonu. V našem souboru nebyl nalezen signifikantní rozdíl mezi RS pacienty a kontrolní skupinou. Po rozdělení souboru na skupiny podle průběhu onemocnění bylo prokázáno četnější zastoupení homozygotů GG a heterozygotů GA ve skupině RRRS pacientů ve srovnání s kontrolním souborem. Byla zjištěna také zvýšená frekvence alely G u pacientů s těžkou chronickou obstrukční chorobou bronchopulmonální [44] a u nemocných s aneuryzmaty břišní aorty [45] ve srovnání s kontrolami. Ačkoli substitucí +853 G/A nukleotidu nedochází ke změně aminové kyseliny, je pravděpodobné snížení aktivity TIMP-2. Další možností je sekundární ovlivnění struktury mRNA, což vede k inhibici míry translace a/nebo snížení stability mRNA [44]. Tento enzym inhibuje specificky MMP-2, která se významně podílí na porušení HEB, remodelaci extracelulární matrix, poškození neuronů, axonů a reparaci tkání [46]. Při nedostatečné inhibici dochází ke zvýšené aktivitě MMP-2, což může vést k progresi onemocnění.
Naše nálezy neprokazují asociační vztah vyšetřených polymorfizmů v genu pro MMP-2 a TIMP-2 s vnímavostí k RS. Nenalezli jsme ani asociaci genotypů s tíží onemocnění nebo stupněm postižení vyjádřené EDSS a MSSS skóre. Jedná se však o první asociační studii uvedených SNPs v genech pro MMP-2 a TIMP-2 s RS. Vzhledem k významu MMP-2 a TIMP-2 v patofyziologii RS je potřeba provést další nezávislé studie ve větším souboru pacientů a ověřit získané výsledky.
RS je multifaktoriální onemocnění, vnímavost k rozvoji a progresi choroby je geneticky determinována. Na spuštění autoimunitního procesu se pravděpodobně podílí velké množství malých genů, které podmiňují vysokou interindividuální variabilitu choroby [47–49]. Zjištění rizikových genetických polymorfizmů v regulačních oblastech kandidátních genů, které modifikují expresi metaloproteináz a jejich tkáňových inhibitorů, může poskytnout důležité informace o patogenezi onemocnění a nalézt jednotlivce se zvýšeným rizikem. Mimoto, zjištění rizikových alel pro dané onemocnění může napomoci ve vývoji specifické terapie a přispět ke zjištění individuální odpovědi pacientů na terapii.
MMPs jsou slibný biologický marker, jejich význam v patofyziologii RS a využití v klinické praxi však ještě musí být ověřen v dalších studiích.
Práce byla vypracována s podporou grantu IGA MZ ČR č. NR 8832-4/2006: „Matrix metalloproteinázy v imunopatogenezi roztroušené sklerózy“ a díky projektu „CEITEC – Středoevropský technologický institut“ (CZ.1.05/1.1.00/02.0068) z Evropského fondu regionálního rozvoje.
MUDr. Yvonne Benešová, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
email: benes@fnbrno.cz
Přijato k recenzi: 8. 8. 2011
Přijato do tisku: 22. 12. 2011
Zdroje
1. Hartung HP, Bar-Or A, Zoukos Y. What do we know about the mechanism of action of disease-modifying treatments in MS? J Neurol 2004; 251 (Suppl 5): v12–v29.
2. Hauser SL, Oksenberg JR. The neurobiology of multiple sclerosis: genes, inflammation, and neurodegeneration. Neuron 2006; 52(1): 61–76.
3. Martin R, Bielekova B, Gran B, McFarland HF. Lessons from studies of antigenspecific T cell responses in multiple sclerosis. J Neural Transm Suppl 2000; 60 : 361–373.
4. Hafler DA. Multiple sclerosis. J Clin Incest 2004; 113(6): 788–794.
5. Chandler S, Coates R, Gearing A, Lury J, Wells G, Bone E. Matrix metalloproteinases degrade myelin basic protein. Neurosci Lett 1995; 201(3): 223–226.
6. Bar-Or A, Nuttall RK, Duddy M, Alter A, Kim HJ, Ifergan I et al. Analyses of all matrix metalloproteinase members in leukocytes emphasize monocytes as a major inflammatory mediators in multiple sclerosis. Brain 2003; 126(12): 2738–2749.
7. de Souza AP, Trevilatto PC, Scarel-Caminaga RM, Brito RB, Bartoš SP, Line SP. Analysis of the MMP-9 (C-1562T) and TIMP-2 (G-418C) gene promoter polymorphisms in patients with chronic periodontitis. J Clin Periodontol 2005; 32(2): 207–211.
8. Birkedal-Hansen H, Moore WG, Bodden MK, Windsor LJ, Birkedal-Hansen B, DeCarlo A et al. Matrix metalloproteinases: a review. Crit Rev Oral Biol Med 1993; 4(2): 197–250.
9. Yong VW. Metalloproteinases: mediators of pathology and regeneration in the CNS. Nat Rev Neurosci 2005; 6(12): 931–944.
10. Proost P, Van Damme J, Opdenakker G. Leukocyte gelatinase B cleavage releases encephalitogens from human myelin basic protein. Biochem Biophys Res Commun 1993; 192(3): 1175–1181.
11. Leppert D, Ford J, Stabler G, Grygar C, Lienert C, Huber S et al. Matrix metalloproteinase-9 (gelatinase B) is selectively elevated in CSF during relapses and stable phases of multiple sclerosis. Brain 1998; 121(12): 2327–2334.
12. Ram M, Sherer Y, Shoenfeld Y. Matrix metalloproteinase-9 and autoimmune diseases. J Clin Immunol 2006; 26(4): 299–307.
13. Kieseier BC, Kiefer R, Clements JM, Miller K, Wells GM, Schweitzer T et al. Matrix metalloproteinase-9 and -7 are regulated in experimental autoimmune encephalomyelitis. Brain 1998; 121(1): 159–166.
14. Galboiz Y, Shapiro S, Lahat N, Rawashden R, Miller A. Matrix metalloproteinases and their tissue inhibitors as markers of disease subtype and response to interferon-beta therapy in relapsing and secondary progressive multiple sclerosis patients. Ann Neurol 2001; 50(4): 443–451.
15. Lindberg RL, De Groot CJ, Montagne L, Freitag P, Valk P, Kappos L et al. The expression profile of matrix metalloproteinases (MMPs) and thein inhibitors (TIMPs) in lesions and normal appearing white matter of multiple sclerosis. Brain 2001; 124(9): 1743–1753.
16. Abraham M, Shapiro S, Karni A, Weiner HL, Miller A. Gelatinases (MMP-2 and MMP-9) are preferentially expressed by Th1 vs. Th2 cells. J Neuroimmunol 2005; 163(1–2): 157–164.
17. Ram M, Sherer Y, Shoenfeld Y. Matrix metalloproteinase-9 and autoimmune diseases. J Clin Immunol 2006; 26(4): 299–307.
18. Sherer Y, Shoenfeld Y. Immunomodulation for treatment and prevention of atherosclerosis. Autoimmun Rev 2002; 1(1–2): 21–27.
19. Aoki T, Sumii T, Mori T, Wang X, Lo EH. Blood-brain barrier disruption and matrix metalloproteinase-9 expression during reperfusion injury: mechanical versus embolic focal ischemia in spontaneously hypertensive rats. Stroke 2002; 33(11): 2711–2717.
20. Welgus HG, Campbell EJ, Cury JD, Eisen AZ, Senior RM, Wilhelm SM et al. Neutral metalloproteinases produced by human mononuclear phagocytes. Enzyme profile, regulation, and expression during cellular development. J Clin Incest 1990; 86(5): 1496–1502.
21. Leppert D, Waubant E, Galardy R, Bunnett NW, Hauser SL. T cell gelatinases mediate basement membrane transmigration in vitro. J Immunol 1995; 154(9): 4379–4389.
22. Montgomery AM, Sabzevari H, Reisfeld RA. Production and regulation of gelatinase B by human T-cells. Biochim Biophys Acta 1993; 1176(3): 265–268.
23. Maeda A, Sobel RA. Matrix metalloproteinases in the normal human central nervous system, microglial nodules, and multiple sclerosis lesions. J Neuropathol Exp Neurol 1996; 55(3): 300–309.
24. Avolio C, Ruggieri M, Giuliani F, Liuzzi GM, Leante R, Riccio P. Serum MMP-2 and MMP-9 are elevated in different multiple sclerosis subtypes. J Neuroimmunol 2003; 136(1–2): 46–53.
25. Benesová Y, Vasku A, Novotná H, Litzman J, Stourač P, Beránek M et al. Matrix metalloproteinase-9 and matrix metalloproteinase-2 as biomarkers of various courses in multiple sclerosis. Mult Scler 2009; 15(3): 316–322.
26. Anthony DC, Ferguson B, Matyzak MK, Miller KM, Esiri MM, Perry VH. Differential matrix metalloproteinase expression in cases of multiple sclerosis and stroke. Neuropathol Appl Neurobiol 1997; 23(5): 406–415.
27. Diaz-Sanchez M, Williams K, DeLuca GC, Esiri MM. Protein co-expression with axonal injury in multiple sclerosis plaques. Acta Neuropathol 2006; 111(4): 289–299.
28. Fainardi E, Castellazzi M, Tamborino C, Trentini A, Manfrinato MC, Tola MR et al. Potential relevance of cerebrospinal fluid and serum levels and intrathecal synthesis of active matrix metalloproteinase-2 (MMP-2) as markers of disease remission in patients with multiple sclerosis. Mult Scler 2009; 15(5): 547–554.
29. Borden P, Keller RA. Transcriptional control of matrix metalloproteinases and the tissue inhibitors of matrix metalloproteinases. Crit Rev Eukaryot Gene Expr 1997; 7(1–2): 159–178.
30. Yushchenko M, Mäder M, Elitok E, Bitsch A, Dressel A, Tumani H et al. Interferon-beta-1b decreased matrixmetalloproteinase-9 serum levels in primary progressive multiple sclerosis. J Neurol 2003; 250(10): 1224–1228.
31. Nagase H, Enghild JJ, Suzuki K, Salvesen G. Stepwise activation of the precursor of matrix metalloproteinase 3 (stromelysin) by proteinases and (4-aminophenyl) mercuric acetate. Biochemistry 1990; 29(24): 5783–5789.
32. Bernardo MM, Fridman R. TIMP-2 (tissue inhibitor of metalloproteinase-2) regulates MMP-2 (matrix metalloproteinase-2) activity in the extracellular environment after pro-MMP-2 activation by MT1 (membrane type 1)-MMP. Biochem J 2003; 347(3): 739–745
33. Benesová Y, Vasků A, Stourač P, Hladíková M, Beránek M, Kadanka Z et al. Matrix metalloproteinase-9 and matrix metalloproteinase-2 gene polymorphisms in multiple sclerosis. J Neuroimmunol 2008; 205(1–2): 105–109.
34. Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the “McDonald Criteria”. Ann Neurol 2005; 58(6): 840–846.
35. Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an Expanded Disability Status Scale (EDSS). Neurology 1983; 33(11): 1444–1452.
36. Roxburgh RH, Seman SR, Masterman T, Hensiek AE, Sawcer SJ, Vukusic S et al. Multiple Sclerosis Severity Score: using disability and disease duration to rate disease severity. Neurology 2005; 64(7): 1144–1151.
37. Price SJ, Greaves DR, Watkins H. Identification of novel, functional genetic variants in the human matrix metalloproteinase-2 gene: role of Sp1 in allele specific transcriptional regulation. J Biol Chem 2001; 276(10): 7549–7558.
38. Vasků A, Goldbergová M, Izakovicová Hollá L, Sisková L, Groch L, Beránek M et al. A haplotype constituted of four MMP-2 promoter polymorphisms (–1575G/A, –1306C/T, –790 T/G and –735C/T) is associated with coronary triple-vessel disease. Matrix Biol 2004; 22(7): 585–591.
39. Xu E, Xia X, Lü B, Xing X, Huang Q, Ma Y et al. Association of matrix metalloproteinase-2 and -9 promoter polymorphisms with colorectal cancer in Chinese. Mol Carcinog 2007; 46(11): 924–929.
40. Yu C, Zhou Y, Miao X, Xiong P, Tan W, Lin D. Functional haplotypes in the promoter of matrix metalloproteinase-2 predict risk of the occurrence and metastasis of esophageal cancer. Cancer Res 2004; 64(20): 7622–7628.
41. Zhou Y, Yu C, Miao X, Wang Y, Tan W, Tong S et al. Functional haplotypes in the promoter of matrix metalloproteinase-2 and lung cancer susceptibility. Carcinogenesis 2005; 26(6): 1117–1121.
42. Rollin J, Régina S, Vourc’h P, Iochmann S, Bléchet C, Reverdiau P et al. Influence of MMP-2 and MMP-9 promoter polymorphisms on gene expression and clinical outcome of non-small cell lung cancer. Lung Cancer 2007; 56(2): 273–280.
43. Nemec P, Goldbergová M, Svobodnik T, Polásková D, Soucek M, Vasků A. Polymorphism of gene promotor region for MMP-2 in rheumatoid arthritis. Vnitr Lek 2006; 52(4): 348–354.
44. Hirano K, Sakamoto T, Uchida Y, Morishima Y, Masuyama K, Ishii Y et al. Tissue inhibitor of metalloproteinases-2 gene polymorphisms in chronic obstructive pulmonary disease. Eur Respir J 2001; 18(5): 748–752.
45. Wang X, Tromp G, Cole CW, Verloes A, Sakalihasan N, Yoon S et al. Analysis of coding sequences for tissue inhibitor of metalloproteinases 1 (TIMP1) and (TIMP2) in patients with aneurysms. Matrix Biol 1999; 18(2): 121–124.
46. Newman TA, Woolley ST, Hughes PM, Sibson NR, Anthony DC, Perry VH. T-cell and macrophage mediated axon damage in the absence of a CNS-specific immune response: involvement of metalloproteinases. Brain 2001; 124(11): 2203–2214.
47. Ebers G. Genetic factors in multiple sclerosis. MS Forum; Modern Management Workshop Boston 1995.
48. Brynedal B, Duvefelt K, Jonasdottir G, Roos IM, Akesson E, Palmgren J. HLA-A confers an HLA-DRB1 independent influence on the risk of multiple sclerosis. PloS One 2007; 2(7): e664.
49. Gregory SG, Schmidt S, Seth P, Oksenberg JR, Hart J, Prokop A et al. Multiple Sclerosis Genetics Group. Interleukin 7 receptor alpha chain (IL7R) shows allelic and functional association with multiple sclerosis. Nat Genet 2007; 39(9): 1083–1091.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2012 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Chirurgická léčba revmatického postižení kraniocervikálního přechodu
- Konformačně specifické protilátky a diagnostika prionových chorob
- Low back pain a deprese – vzájemný vztah
- Neurosyfilis
- Diagnostika a možnosti léčby Niemann-Pickovy choroby typ C
- Tau protein a anti-tau protilátky u pacientů s roztroušenou sklerózou
- Asociace polymorfizmů v genu pro matrix metalloproteinázu-2 a tkáňový inhibitor metalloproteinázy-2 s roztroušenou sklerózou
- Neurofyziologická diagnostika poškození loketního nervu v oblasti lokte
- Rozšířený transnazální endoskopický přístup k nádorům lebeční spodiny a očnice
- Stanovení mozečkové dominance podle asymetrie svalového tonu končetin
- Vzorec posturálnych zmien v súvislosti so symetrickou vibráciou krčných svalov
- Operační léčba syndromu tarzálního tunelu
- Zadní interhemisférický prekuneální/transspleniální přístup k intrinsickým mozkovým lézím
- Atypický paraneoplastický neurologický syndrom – kazuistika
- Neurenterická cysta kraniocervikální junkce – kazuistika
- Oboustranná léze n. phrenicus manifestující se jako ortopnoe – kazuistiky tří případů
- Alzheimerova nemoc probíhající pod obrazem kortikobazální degenerace – kazuistika
- Rozsáhlý epidurální absces cervikotorakální páteře řešený kombinovaným přístupem – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXXIII. Bayesovská statistika v klinických a neurovědních aplikacích - Stanislav Kratochvíl – Experimentální hypnóza. 3. aktualizované a rozšířené vydání. Praha: Grada 2011, 363 stran.
- Adherence k léčbě u pacientů se schizofrenií
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neurosyfilis
- Operační léčba syndromu tarzálního tunelu
- Oboustranná léze n. phrenicus manifestující se jako ortopnoe – kazuistiky tří případů
- Diagnostika a možnosti léčby Niemann-Pickovy choroby typ C
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání