-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ektopický pankreas jako zdroj krvácení do horní etáže trávicího traktu
Ectopic pancreas as a cause of upper gastrointestinal bleeding
Differentiated ectopic pancreatic tissue can develop anywhere in the gastrointestinal tract (GIT) and is most frequently found in the gastric or duodenal wall. Nowadays a development of ectopic pancreas stay unclear. The incidence of an ectopic pancreas is 0.55–13.70%, and such tissue is found more frequently in males than in females. Most ectopic pancreases are histologically categorized as type 1 according to Heinrich’s classification and contain all pancreatic components (acini, ducts, and endocrine cells). The majority of cases are asymptomatic; however, a large ectopic pancreas can cause various symptoms. Ectopic pancreatic tissue rarely causes bleeding. Here, we present two case reports. The first case was a middle-aged woman who developed anemia due to ectopic pancreatic tissue in the gastric wall. The second case exhibited acute bleeding due to a subpapillary lesion in the duodenum. Differential diagnosis can be difficult. Surgery and histological examination of the resected GIT led to a definitive diagnosis in both cases.
Conflict of Interest: Authors declare that the article/manuscript complies with ethical standards, patient anonymity has been respected, and states that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: The article/manuscript has not been published or is currently being submitted to another review.
The authors agree to publish their name and e-mail in the published article/manuscript.
Dedication: Supported by Ministry of Health, Czech Republic – conceptual development of research organization 64165, General University Hospital in Prague, Czech Republic.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Keywords:
endoscopy – surgery – Pancreas – choristoma – ectopic tissue – bleeding – Gastrointestinal tract
Autoři: Vacík M.; Shon F.; Řežábek M.
Působiště autorů: Gastroenterologické oddělení, Nemocnice České Budějovice, a. s.
Vyšlo v časopise: Gastroent Hepatol 2019; 73(2): 132-137
Kategorie: IBD: přehledová práce
doi: https://doi.org/10.14735/amgh2019132Souhrn
Diferencovanou pankreatickou tkáň mimo běžnou lokalizaci – ektopický pankreas (EP) – můžeme nalézt v celém průběhu trávicího traktu, nejčastěji pak ve stěně žaludku, duodena a jejuna. Vývoj ektopického pankreatu není v současné době plně objasněn. Jeho incidence se pohybuje mezi 0,55 a 13,70 % a vyskytuje se častěji u mužů. Z histologického hlediska dominuje typ 1 dle Heinrichovy klasifikace – tedy s aciny, dukty i endokrinní složkou pankreatu. Většina případů je asymptomatických. K prezentaci symptomů vedou až větší ložiska. Je-li léze symptomatická, krvácení jako příznak ektopického pankreatu nebývá časté. V první ze zmíněných kazuistik byl EP žaludku důvodem anemického syndromu u pacientky středního věku. V druhém případě pak popisujeme akutní krvácení z léze lokalizované subpapilárně v oblasti D2 duodena. Diferenciální diagnostika nebývá jednoduchá a v obou našich případech až chirurgická resekce s následným histologickým vyšetřením stanovila definitivní diagnózu.
Klíčová slova:
pankreas – choristom – ektopická tkáň – krvácení – endoskopie – chirurgie – gastrointestinální trakt
Úvod
Podezření na krvácení do trávicí trubice, ať už se jedná o krvácení akutní či o chronickou anemizaci, bývá častým důvodem vyšetřování našich pacientů. Mimo diagnosticky jasné zdroje musíme v rámci diferenciální rozvahy pamatovat i na možnosti vzácnější, a to zejména tam, kde je endoskopický obraz atypický. Takovými příklady jsou i následující dvě kazuistická sdělení.
Kazuistika 1
Pacientka, 74 let, s anamnézou diabetes mellitus 2. typu, s ischemickou chorobou dolních končetin, asymptomatickým subdiafragmatickým aneuryzmatem abdominální aorty, s hyperlipidemií a hyperurikemií, po panhysterektomii v roce 1980, byla přijata k vyšetření prekolapsového stavu na kardiologické oddělení naší nemocnice. Vstupní hladina erytrocytů byla 2,88 × 1012/l, hodnota hemoglobinu 91 g/l, střední objem erytrocytu činil 95,2 fl, základní biochemie byla bez nápadností, jen troponin I (TnI) dosahoval vstupně 0,94 µg/l. Pacientka byla hypotenzní, 80/50 mm Hg, v klidu bez tachykardie, fyzikální nález byl v normě, per rectum melena objektivizována nebyla. Udávané potíže ve smyslu námahové dušnosti, slabosti a bolesti v epigastriu po hemosubstituci ustoupily. Hladina TnI se normalizovala. Kardiologická příčina potíží nebyla zjištěna a pacientka byla přeložena na gastroenterologii k dalšímu vyšetření anémie.
Indikovaná gastroskopie (Olympus H 180) popsala v antru při zadní stěně uložený polokulovitý útvar s velikostí základny cca 25 mm s centrální drobnou erozí krytou fibrinem (obr. 1A,B). Dále byly přítomny známky antrální gastritidy a bulbitidy. Kultivace na Helicobacter pylori byla negativní, histologie ze vzorků získaných klešťovou biopsií z výše uvedeného útvaru antra žaludku popsala žaludeční sliznici antrálního typu s jizvením a mírným chronickým lymfoplazmocelulárním zánětem. Doplněno bylo rovněž CT vyšetření břicha s perorální i intravenózně podanou kontrastní látkou, kde žaludeční stěna ani okolí nevykazovaly žádné známky expanze. Popsány byly pouze zmnožené lymfatické uzliny retroperitoneálně. Vzhledem k nadále stabilní hodnotě krevního obrazu po hemosubstituci a dobrému klinickému stavu probíhala další vyšetření pacientky ambulantně (obr. 2).
Obr. 1. A,B. Gastroskopický obraz a – v normálním světle a b – pod NBI (Narrow Band Imaging).
Fig. A,B. Antral intramural tumor in normal and NBI (Narrow Band Imaging).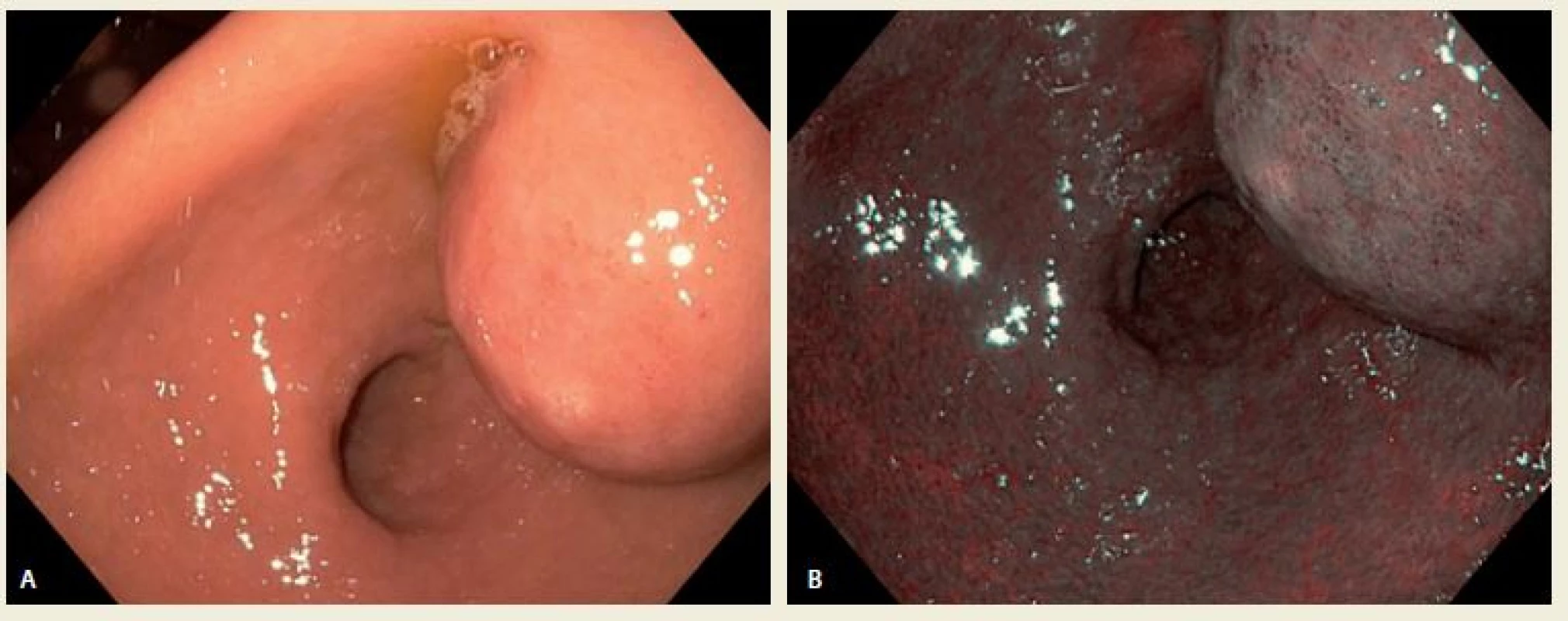
Obr. 2. Endosonografický obraz antrálního útvaru žaludku.
Fig. 2. Submucosal antral tumor in endosonographic imaging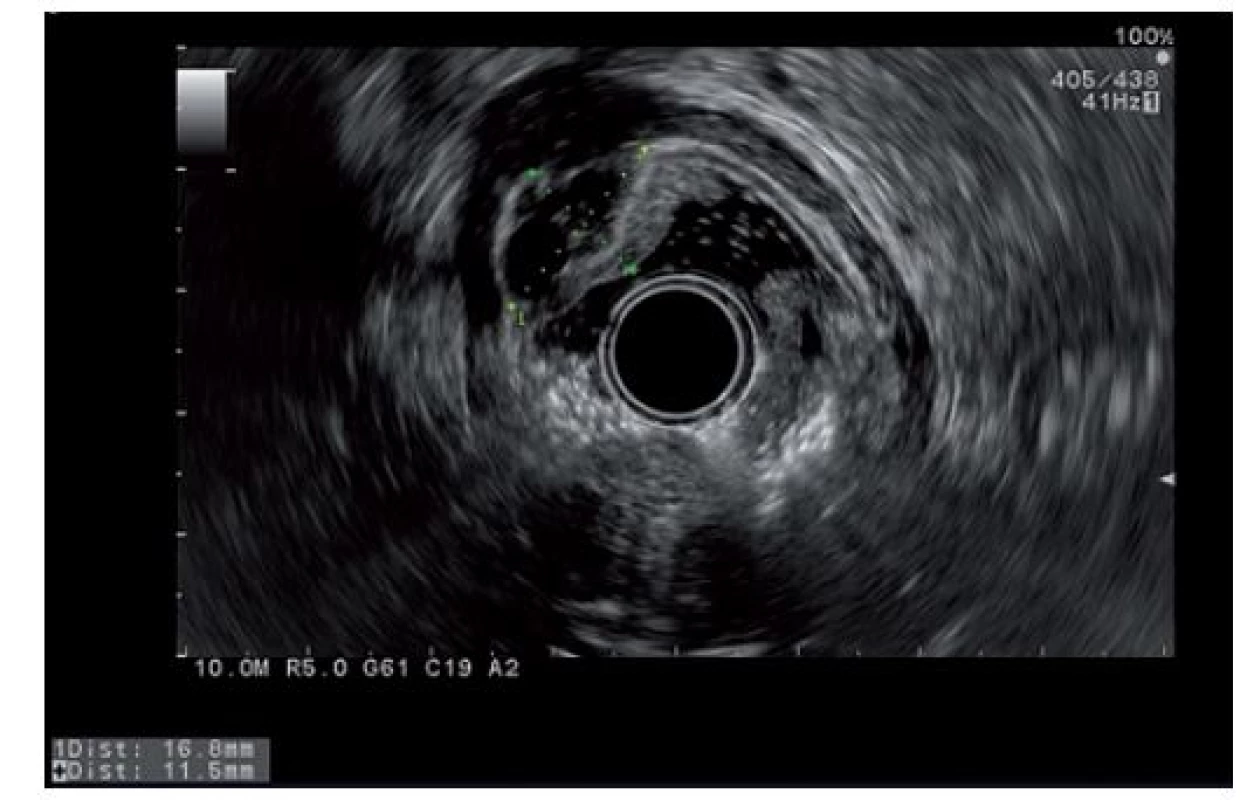
Endoskopická ultrasonografie (EUS) radiální sondou a poté i lineární s tenkojehlovou biopsií (FNB – fine needle biopsy) (Olympus UCT 180) provedené v odstupu popisují heteroechogenní ložisko s hypoechogenními oblastmi velikosti cca 17 × 12 mm uložené v antru v submukóze (obr. 2). Pomocí tenké jehly 19G však nebyl získán reprezentativní materiál.
Během koloskopie (Olympus HQ 190), v rámci doplnění vyšetřování mož-ného zdroje anémie, byl odstraněn tubulární stopkatý adenom (0-Ip dle Pařížské klasifikace) s low grade dysplazií v colon descendens velikosti 13 × 7 × 4 mm pomocí metody endoskopické polypektomie, další dva hyperplastické polypy sigmatu byly odstraněny metodou studené kličky. Vzhledem k panhysterektomii v anamnéze byla gynekologická etiologie anemizace vyloučena.
V odstupu dalších 3 měsíců jsme opakovali EUS, sonografický obraz léze ve stěně žaludku neměnil svůj vzhled ani velikost. Pro získání vzorků byla zvolena metoda biopsie „klíčovou dírkou“. Po precutu a odběru vzorku ze spodiny však došlo k většímu krvácení, které bylo stavěno oplachem ledovou vodou a nasazením jednorázového Boston Resolution klipu. Histologie z biopsie získané během tohoto sezení však rovněž neozřejmila povahu léze. Byl získán jen vzorek jizevnatého vaziva. Po konzultaci s vyšším pracovištěm nebyly další odběry biopsie provedeny. Případ jsme prezentovali na interoborovém týmu, kde byla za pravděpodobný zdroj anemizace pacientky označena nalezená submukózní léze s centrální erozí v žaludečním antru – nejspíše gastrointestinální stromální tumor (GIST). Pacientka byla indikována k resekčnímu výkonu na žaludku. Výkon byl proveden ze střední laparotomie prodloužené pod pupek. Dutina břišní byla bez výpotku, játra bez hmatných metastáz, před pylorem byl objektivizován intramurální tumor cca 20 mm. V omentu byla odebrána jedna z přítomných velkých lymfatických uzlin k peroperační histologii, která neobsahovala neoplastické buňky. Dále byla provedena resekce žaludku typu Billroth I. Pacientka se hojila per primam. Histologické vyšetření intramurálního tumoru žaludku popsalo multicystické ložisko tvořené heterotopickou tkání pankreatu s dilatací četných duktů a s nevelkou přítomností acinů (obr. 3). Při následné klinické kontrole byla pacientka bez větších zažívacích potíží.
Obr. 3. Svalová vrstva žaludeční stěny, pankreatické acini, malé a dilatované vývody. Barvení hematoxylin-eozinem, zvětšení 10×.
Fig. 3. Musculous layer of gastric wall, pancreatic acini, small dilated ducts. Haematoxylin and eosin staining, magnification 10×.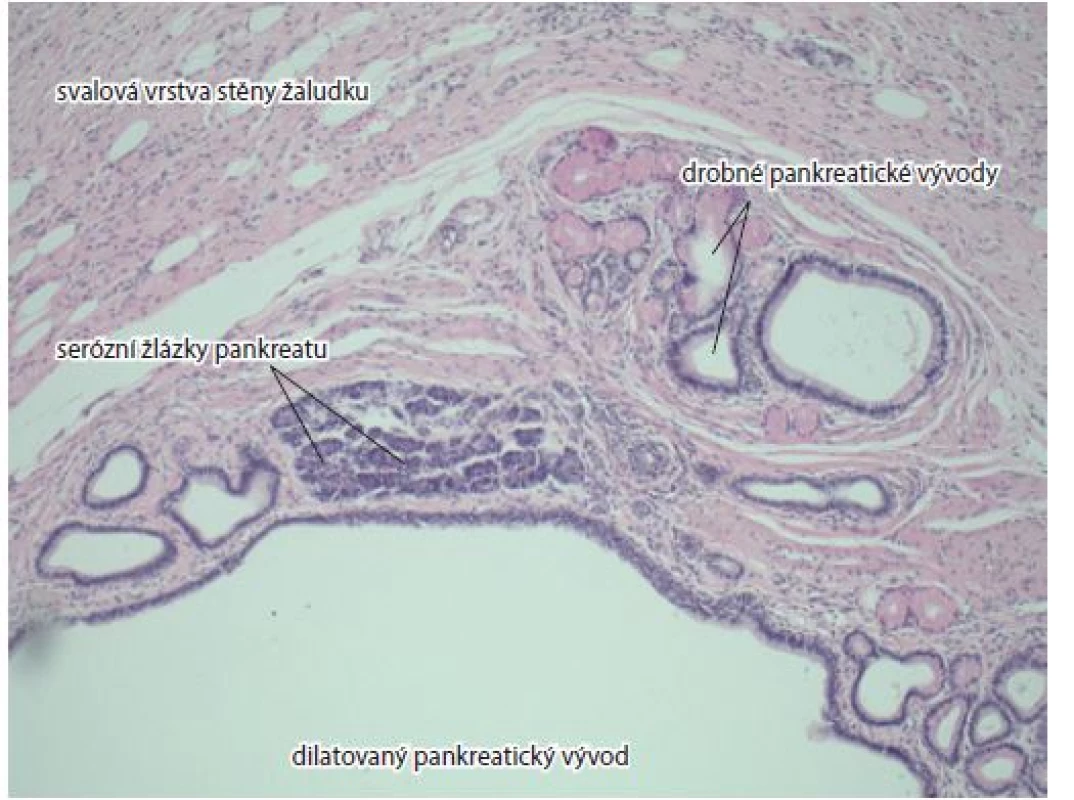
Kazuistika 2
Pacient, 58 let, kuřák, astenického habitu, s recentně diagnostikovanou paroxysmální fibrilací síní, na medikaci antiarytmikem I. třídy a kyselinou acetylsalicylovou bez dalších komorbidit v osobní anamnéze, byl přijat akutně na naše pracoviště pro hematochezii bez bolesti břicha. Při přijetí byl pacient bez tachykardie, normotenzní (krevní tlak 130/90 mm Hg), při fyzikálním vyšetření bez nápadnosti, jen v ampule rekta objektivizována tmavě červená krev smísená se stolicí. Hladina hemoglobinu ve vstupním laboratorním vyšetření činila 131 g/l. Pacient zajištěn kontinuální infuzí 160 mg inhibitorů protonové pumpy (IPP) na 24 hod, hydratován, v úvodu podána hemostyptika. Po přijetí na lůžko byla provedena urgentní gastroskopie (Olympus HQ 190), při které byly patrny tři malé slizniční povrchové defekty pod gastroezofageální junkcí, největší 6 mm s lehce ronící krví. Tyto léze, které nejspíše vznikly po počátečním zadávení při inkompetenci kardie, byly ošetřeny opichem roztoku adrenalinu 1 : 10 000. Velká křivina žaludku zůstala nepřehledná pro zbytky stravy s malou příměsí hematinu. Další čerstvá krev pak byla patrna v oblasti D2 duodena, kde bylo popsáno ložiskové oploštění klků. Nově však zde krev nikde nepřitékala.
Gastroskopická kontrola (Olympus HQ 190) provedená 2 dny od prvního vyšetření popisovala červenou jizvu 6 mm na č. 12 ciferníku při Z-linii. Další nález v žaludku až do bulbu duodena byl fyziologický. V D2 partii byl popsán v prográdním pohledu erytém a deformace subpapilárně. Přístroj byl vyměněn za lateroskop (Olympus JF 160), zde byla patrna málo prominující polyploidní křehká zarudlá tkáň velikosti cca 30 mm. Proveden odběr biopsie. V diferenciálně diagnostické rozvaze jsme na prvním místě pomýšleli na neoplazii pankreatu s infiltrací stěny duodena, dále na lymfom či neuroendokrinní tumor. Doplněný ultrazvuk břicha byl s nálezem mírně lipomatózního pankreatu a zvětšené prostaty, jinak bez odchylek. Tumorózní markery, karcinoembryonální antigen a karbohydrátový antigen 19-9, nebyly zvýšeny. Histologie vzorků tkáně popsala obvyklou sliznici duodena v rozsahu odběru bez dysplazie. CT trupu s perorální i intravenózně podanou kontrastní látkou rovněž neprokázalo expanzi v oblasti podjaterní krajiny ani patologicky zvětšené lymfatické uzliny. Koloskopii jsme neindikovali vzhledem k jejímu provedení asi před 1 rokem, kdy byl odstraněn diminutivní přisedlý polyp 5 mm sigmoidea, jinak bez další popsané patologie vč. divertiklů až do terminálního ilea. Pacient byl po celou dobu hospitalizace oběhově stabilní, bez nutnosti hemosubstituce a bez známek pokračujícího krvácení či jiných potíží. Byl dimitován do domácí péče s vysazenou antiagregační medikací, zajišten IPP v dávce 40 mg 2× denně a s ambulantním termínem kontrolní duodenoskopie a EUS v rámci dovyšetření.
Při této kontrole byl použit lateroskop Olympus JF 100 a echoendoskop GF–UCT 180 linear. Subpapilárně byla v odstupu shledána miskovitá exulcerovaná léze velikosti cca 20 mm. EUS obraz nezískán z důvodu nestabilní polohy, kdy přístroj opakovaně vypadával do žaludku. Byly nabrány četné kontrolní bioptické vzorky, které konstatují hyperplastickou duodenální sliznici se smíšenou středně aktivní zánětlivou infiltrací bez atypií. Vzorky nezasahují podslizniční vazivo. Pacient byl prezentován na interoborovém semináři s chirurgem, kde byla dohodnuta ještě jedna časná endoskopická a histologická kontrola před zvažovaným resekčním výkonem. V odstupu 2 týdnů se však velikost léze nezmenšila, i když byl povrch částečně reepitelizován. Kontrolní histologické vyšetření bioptovaných vzorků popsalo duodenální sliznici tentokrát s ložiskem low grade dysplazie. Pacient byl objednán k chirurgickému zákroku. Provedena infrapapilární resekce duodena, choledochotomie se zavedením T drénu a suturou a duodenojejunoanastomóza end to side. Peroperační histologie resekované části duodena s miskovitou lézí a lymfatická uzlina byly bez jasných známek malignity. Pooperační průběh byl bez komplikací, pacient zhojen per primam. Definitivní histologie z resekátu nakonec překvapivě potvrzuje ložisko ektopické tkáně slinivky břišní 12 × 7 × 7 mm s dominujícími aciny a dukty uložené ve stěně duodena (obr. 4).
Obr. 4. Normální duodenální sliznice, acini, pankreatické vývody. Barvení hematoxylin-eozinem, zvětšení 5×.
Fig. 4. Normal duodenal mucosa, acini, pancreatic ducts. Haematoxylin and eosin staining, magnification 5×.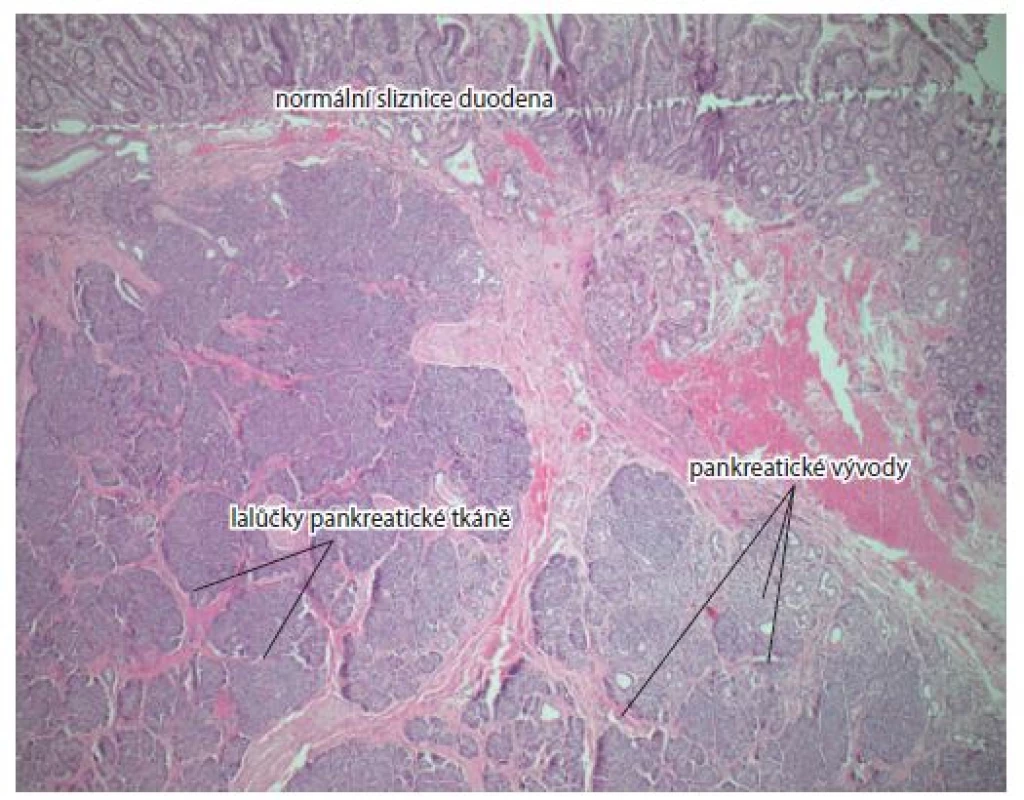
Diskuze
Ektopický pankreas (EP) představuje diferencovanou pankreatickou tkáň mimo běžnou lokalitu bez anatomické souvislosti s vlastním orgánem. Dle pramenů byl poprvé pozorován a popsán roku 1727 Jeanem Shultzem [1]. EP můžeme nalézt v celém průběhu trávicího traktu [2], nejčastěji pak, ve shodě s našimi případy, ve stěně žaludku (27,5 %) a duodena (25,5 %) [1]. Vývoj EP není plně objasněn. V současné době jsou uznávány dvě hlavní teorie jeho vzniku. První z nich uvádí jako možný způsob metaplazii multipotentních buněk entodermu během embryonálního vývoje organizmu, druhá pak předpokládá migraci buněk pankreatu během vývoje samotného orgánu [3]. Incidence EP se ve studiích na kadaverech pohybuje od 0,55 do 13,70 % [1,4] a vyskytuje se u dospělých, častěji u mužského pohlaví [5]. Histologickou třístupňovou klasifikaci EP dle zastoupení jednotlivých složek pankreatu zavedl v roce 1909 Heinrich (tab. 1) [6], kterou pak revidovali Gaspar Fuentes et al roku 1973 na čtyřstupňovou (tab. 2) [7]. V nálezech pak dominuje typ 1 dle obou klasifikací, tedy se zastoupením acinů, duktů i endokrinních Langerhansových ostrůvků. V obou našich případech však nebyla endokrinní složka pankreatu prokázána. V prvém případě dominovaly četné dilatované dukty s menším zastoupením acinů – tedy typ 3 dle Heinrichovy klasifikace. V druhém případě naopak dominují aciny s malým zastoupením nedilatovaných duktů – tedy typ 2 dle Heinrichovy klasifikace. Druhá rozšířená klasifikace dle Gaspara Fuentese et al dvousložkovou ektopii pouze s dukty a aciny nezmiňuje.
Tab. 1. Heinrichova klasifikace, 1909 [6].
Tab. 1. Heinrich‘s Classification, 1909 [6].![Heinrichova klasifikace,
1909 [6].<br>
Tab. 1. Heinrich‘s Classification,
1909 [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/07f3310c368e1934cfab81edf798e792.jpeg)
Tab. 2. Modifikovaná klasifikace dle Gaspara Fuentese et al, 1973 [6].
Tab. 2. Modified classification by Gaspar Fuentese et al., 1973 [6].![Modifikovaná klasifikace dle
Gaspara Fuentese et al, 1973 [6].<br>
Tab. 2. Modified classification by Gaspar Fuentese et al., 1973 [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5a5cfb25641d007563b12a5eabc3e640.jpeg)
Při endoskopickém vyšetření nejčastěji pozorujeme submukózní nodulární útvar krytý obvyklou sliznicí s centrální vkleslinou či umbilikací. EUS obraz EP je charakterizován smíšenou echogenitou pro acinární složku a anechogenními oblastmi odpovídající duktům [8]. EP může vycházet ze 2.–4. endosonografické vrstvy stěny orgánu [8].
Většina případů je asymptomatických [3,5] a k nálezu EP dojde náhodně během vyšetřování z jiných důvodů. Symptomy většinou pozorujeme u EP > 15 mm [1,5]. V prvním případě byla tato hranice překročena, v druhém našem sdělení byl největší rozměr EP 12 mm a krvácení bylo pravděpodobně potencováno medikací kyselinou acetylsalicylovou. Z popisovaných symptomů se pak nejčastěji jedná o bolest břicha, obstrukci horního gastrointestinálního traktu, ulceraci, krvácení akutní či chronické, která zmiňujeme v našich kazuistikách, obstrukční ikterus, je-li v blízkosti Vaterovy papily [1]. Dále může být přítomen akutní a chronický zánět ektopické pankreatické tkáně s možností vzniku pseudocyst [3]. Histologické známky chronického zánětu představované dilatací duktů a fibrózou bývají častým jevem [5], který popisujeme i v prvním našem sdělení, kde dilatované dukty dominují histologickému preparátu (obr. 3). Maligní transformace tkáně EP je raritní – dle provedených studií je toto riziko 0,7–2,9 % [2]. Krvácení popisované u našich pacientů nebývá jako příznak EP časté. Akutní krvácení u lézí lokalizovaných v duodenu uvedené ve druhé z kazuistik je pak popisováno v literatuře jen ve 3 % případů EP této oblasti [1].
Vzhledem k absenci typického vzhledu EP a negativním biopsiím jsme v diagnostické rozvaze v první kazuistice museli vyloučit jiné subepiteliální útvary, zejména GIST, lipom, leiomyom, neuroendokrinní tumor.
Lipom se nezdál pravděpodobný již při odběru biopsie. Centrum nodulu se jevilo tužší a na spodině po odběru biopsie kleštěmi chyběla u lipomů často pozorovaná žlutavá tkáň. V EUS obraze pak nebyla pro lipomy charakteristická hyperechogenita léze [8,9]. Leiomyomy bývají mimo jícen lokalizovány raritně a v EUS obraze jsou hypoechogenní a dobře ohraničené [8]. Ani leiomyom nebyl v tomto případě tedy příliš pravděpodobný. Neuroendokrinní tumory se prezentují jako polyploidní či subepiteliální léze, které mohou mít centrální depresi či erozi [8]. Vzhledem k faktu, že nejčastěji vycházejí ze slizniční vrstvy s možností penetrovat do submukózy, bývá diagnostická již klasická klešťová biopsie [8]. Získaný EUS obraz rovněž neodpovídal neuroendokrinním tumorům, které by měly být homogenně izoechoenní až středně hypoechogenní [8]. Nejpravděpodobnější lézí se tedy v našem prvém případě jevil GIST, který může vycházet rovněž ze submukózy, bývá hypoechogenní, event. i s heterogenní složkou a/nebo s anechogenními okrsky [8], a je znám možným krvácením do trávicího traktu.
Ve druhé z kazuistik jsme zvažovali přítomnost neoplazie pankreatu s infiltrací stěny duodena, dále lymfom, neuroendokrinní tumor či raritní primární duodenální adenokarcinom. U obou našich pacientů nás zobrazovací, laboratorní ani opakovaná histologická vyšetření k definitivní diagnóze neposunula. Vzhledem k projevům krvácení byla oběma indikována chirurgická resekce.
Podle doporučení Americké společnosti pro gastrointestinální endoskopii týkající se subepiteliálních lézí je endoskopický nález nodulu krytého obvyklou sliznicí s centrální umbilikací při velké křivině antra žaludku diagnostický pro EP a odběr biospie či dovyšetření pod EUS nejsou nutné [8]. Pokud však tento obraz chybí, může být diferenciální diagnóza obtížná.
Evropská společnost gastrointestinální endoskopie u subepiteliálních lézí žaludku doporučuje provedení klešťové biopsie, lépe „bite-on-bite“. Při jejím selhání pak EUS útvaru a odběr tkáně tenkou jehlou (s diagnostickým oknem kolem 60 % [3]) zejména tam, kde je podezření na maligní potenciál léze [9]. Doporučení pro podslizniční tumory v duodenu pro nedostatek údajů nejsou k dispozici [9].
Asymptomatický EP dle současných doporučení nevyžaduje sledování [8,10], i když se někteří autoři kloní k pravidelným EUS kontrolám pacienta [5] vzhledem k výše uvedeným možným kom-plikacím. Symptomatické případy ek-topického pankreatu, event. ty léze, u kterých nelze vyloučit maligní potenciál, indikujeme k resekčním výkonům na trávicím traktu [5]. Malé léze, vycházející z 2.–3. endosonografické vrstvy, mohou být odstraněny zkušeným endoskopistou [9,10]. Ačkoli EP bývá vzácným zdrojem krvácení, musíme na tuto možnost zejména u lézí pozorovaných v horní etáži trávicího traktu v diferenciální diagnostice pamatovat.
Doručeno: 28. 9. 2018
Přijato: 5. 11. 2018
MUDr. Michal Vacík
Gastroenterologické oddělení
Nemocnice České Budějovice, a. s.
Boženy Němcové 54
370 01 České Budějovice
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení.
Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Podpořeno MZ ČR – RVO VFN64165.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Zdroje
1. Wlaź J, Mądro A, Kaźmierak W et al. Pancreatic and gastric heterotopy in the gastrointestinal tract. [online]. Available from: http: //www.phmd.pl/api/files/view/29653.pdf4.
2. Betzler A, Mees ST, Pump J et al. Clinical impact of duodenal pancreatic heterotopia – Is there a need for surgical treatment? BCM Surg 2017; 17 : 53. doi. 10.1186/s12893-017-02 50-x.
3. Gottschalk U, Dietrich CF, Jenssen C. Ectopic pancreas in the upper gastrointestinal tract: is endosonographic diagnosis reliable? Data from the German Endoscopic Ultrasound Registry and review of the literature. Endosc Ultrasound 2018; 7 (4): 270–278.
4. Feldman M, Friedman L, Brandt L. Sleisenger and Fordtran‘s gastrointestinal and liver disease. Saunders: Elsevier 2010 : 918–919.
5. Bromberg SH, Neto CC, Borges AF et al. Pancreatic heterotopias: clinicopathological analysis of 18 patients. Rev Col Bras Cir 2010; 37 (6): 413–419.
6. Heinrich H. Ein Beitrag zur Histologie des sogen. akzessorischen Pankreas. Virchows Arch Pathol Anat Physiol Klin Med 1909; 198 (3): 392–401.
7. Gaspar Fuentes A, Campos Tarrech JM, Fernández Burgui JL et al. Pancreatic ectopias. Rev Esp Enferm Apar Dig 1973; 39 (3): 255–268.
8. Faulx AI, Kothari S, Acosta RD et al. The role of endoskopy in subepithelial lesions of the GI tract. Gastrointest Endosc 2017; 85 (6): 1117–1131. doi: 10.1016/j.gie.2017.02.022.
9. Dumonceau JM, Polkowski M, Larghi A et al. Indikace, výsledky a klinický dopad endosonograficky (EUS) – navigovaného odběru v gastroenterologii: klinická doporučení Evropské společnosti pro gastrointestinální endoskopie (ESGE). [online]. Dostupné z: http: //www.endoskopiste.cz/wp-content/uploads/2017/07/indikace-eus-fnab.pdf.
10. Kliment M. Diagnostika aberantního pankreatu pomocí EUS-FNA. Kolonoskopie 2010. [online]. Dostupné z: http: //www.kolonoskopie.cz/pripad-mesice/2010/kveten-1/diagnostika-aberantniho-pankreatu-pomoci-eus-fna.aspx.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Kvíz z klinické praxeČlánek Právoplatnosť slovenskej verzie dotazníka SIBDQ v kohorte pacientov s idiopatickými střevními zánětyČlánek EditorialČlánek Vzácní a výjimeční jubilantiČlánek Dieulafoy léze žaludkuČlánek XXIII. hradecké gastroenterologické a hepatologické dny a XIII. mezinárodní endoskopický workshopČlánek Správná odpověď na kvíz
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2019 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Kvíz z klinické praxe
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV)
- Laparoskopická resekce jater pro alveolární echinokokózu
- Idiopatické střevní záněty a fertilita mužů
- Ektopický pankreas jako zdroj krvácení do horní etáže trávicího traktu
- Právoplatnosť slovenskej verzie dotazníka SIBDQ v kohorte pacientov s idiopatickými střevními záněty
- Dieulafoy léze žaludku
- Postižení gastrointestinálního traktu amyloidózou – kdy na ni myslet a jak diagnostikovat
- Díl II. – Epidemiologie idiopatických střevních zánětů v české populaci: dostupné datové zdroje, prevalence léčených pacientů a celková mortalita
- Výběr z mezinárodních časopisů
- 23rd Days of Gastroenterology and Hepatology and 13th International Endoscopic Workshop in Hradec Kralove
- 5th IBD working days, Hořovice 2019
- Kreditovaný autodidaktický test
- Správná odpověď na kvíz
- Biosimilární adalimumab FKB327 (Hulio®)
- Editorial
- Vzácní a výjimeční jubilanti
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dieulafoy léze žaludku
- Postižení gastrointestinálního traktu amyloidózou – kdy na ni myslet a jak diagnostikovat
- Ektopický pankreas jako zdroj krvácení do horní etáže trávicího traktu
- Idiopatické střevní záněty a fertilita mužů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



