-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Odběr bioptického materiálu při endoskopickém vyšetření gastrointestinálního traktu pro vybraná zánětlivá onemocnění
Obtaining biopsies during endoscopic investigation of the gastrointestinal tract for selected inflammatory disorders
Obtaining mucosal biopsies has become a standard part of endoscopic investigations of the gastrointestinal tract. Although targeting biopsies of tumoriform (neoplastic) lesions does not usually constitute a difficult task, investigating inflammatory disorders may necessitate more extensive tissue harvesting due to the discontinuous or even patchy distribution of morphological changes, topical differences in the intensity of inflammatory changes and finally, in attempts to detect early phases of inflammation-associated tumour development. Furthermore, even if clinical guidelines exist (e.g. Barrett’s oesophagus or chronic gastritis), they are usually not followed in practice, especially regarding the amount of retrieved tissue or number of sites investigated by biopsy. However, an inappropriate number of tissue samples may paradoxically cause harm to the patient due to the necessity of repeating the biopsy.
Key words:
biopsy – Barrett’s oesophagus – celiac disease – endoscopy – eosinophilic esophagitis – gastritis – microscopic colitis – reflux esophagitis – inflammatory bowel disease
Autoři: O. Daum 1; Z. Beneš 2; M. Michal 1
Působiště autorů: Bioptická laboratoř s. r. o., Plzeň a Šiklův ústav patologie, LF Plzeň, UK Praha 1; II. interní klinika, Fakultní Thomayerova nemocnice, Praha 2
Vyšlo v časopise: Gastroent Hepatol 2011; 65(2): 84-89
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
Souhrn
Odběr slizničních vzorků pro bioptické vyšetření je standardní součástí endoskopického vyšetření gastrointestinálního traktu. Zatímco určení lokalizace biopsie při vyšetření nádorových (neoplastických) lézí nepředstavuje většinou příliš závažný problém, u zánětlivých onemocnění není optimální strategie pro odběr materiálu zdaleka tak jednoznačná. Příčinou těchto obtíží je diskontinuální až ložisková distribuce morfologických změn, topické rozdíly v intenzitě zánětlivých změn a konečně i snaha o zastižení časných vývojových fází nádorů, které vznikají na podkladě některých chronických zánětů. Navíc, přestože pro některá onemocnění (např. Barrettův jícen nebo chronická gastritida) jsou doporučené postupy pro odběr bioptických vzorků zpracovány, klinická praxe je často jiná, zejména pokud jde o množství odebraného materiálu, respektive počet míst, z nichž byly pořízeny biopsie. Nedostatečný odběr však může paradoxně vést ke zvýšené zátěži pacienta v důsledku nutnosti opakování endoskopických vyšetření.
Klíčová slova:
biopsie – Barrettův jícen – celiakie – endoskopie – eozinofilní ezofagitida – gastritida – mikroskopická kolitida – refluxní ezofagitida – idiopatické střevní zánětyEndoskopické vyšetření gastrointestinálního traktu se často neobejde bez odběru bioptických vzorků. U zánětlivých onemocnění může být biopsie nezbytná nejen k potvrzení přítomnosti zánětu, ale i k bližší kategorizaci zánětlivého onemocnění, stanovení stupně zánětlivých změn, průkazu etiologického agens, průkazu prekancerózních změn nebo v horším případě i maligního nádoru vznikajícího v terénu chronického zánětu. Endoskopický obraz, zejména při konvenčním endoskopickém vyšetření, často neumožňuje subtilní změny diferencovat, což spolu s nehomogenní distribucí, případně ložiskovým výskytem patologických změn, vede k nutnosti odběru mnoha vzorků z více míst vyšetřované oblasti. Kvantitativně nedostatečný odběr, ať již zdůvodněný faktory časovými, finančními nebo ohledy na pacienta (od krvácení po jeho pohodlí), může ve skutečnosti vést ke zvýšené zátěži časové i finanční a k další traumatizaci pacienta opakováním endoskopického vyšetření při nedostatečné konkluzivitě histologického vyšetření z důvodu nedostatečného samplingu. Kvantitativní dostatečnost odběru by měla být zajištěna jednak používáním bioptických kleští umožňujících odběr většího množství tkáně (např. jumbo), jednak odběrem z více lokalizací. Některé nové metody digestivní endoskopie sice umožňují pozorování větších detailů, až prakticky provádění mikroskopického vyšetření „in vivo“ při tzv. endoskopické mikroskopii [1,2], ale i přesto (zejména díky nízké dostupnosti technik endoskopické mikroskopie) stále zůstává hlavní úloha samplingu v diagnostice gastrointestinálních onemocnění, jako je alergická eozinofilní ezofagitida, refluxní ezofagitida a její komplikace, chronická gastritida, celiakie nebo idiopatické střevní záněty (IBD) včetně mikroskopické kolitidy [3].
Eozinofilní ezofagitida
Základem této diagnózy je histologický průkaz infiltrace sliznice jícnu eozinofilními granulocyty u pacientů s odpovídajícím klinickým a endoskopickým nálezem, jejichž obtíže neustupují při terapii inhibitory protonové pumpy (IPP) [4]. Mezi klinické příznaky patří dysfagie, odynofagie, regurgitace obsahu a zvracení, zejména u pacientů s jinými alergickými projevy. Při endoskopickém vyšetření může být patrno zúžení lumina, příčné prstence nebo podélné brázdy, „krepovitá“ sliznice, slizniční plaky i eroze, nález však může být makroskopicky i zcela normální.
Problémem histologické verifikace této diagnózy je jednak absence definice minimálního počtu eozinofilních granulocytů v zorném poli mikroskopu diagnostického pro eozinofilní ezofagitidu, jednak nepravidelně ložiskovitá distribuce zánětlivých změn ve sliznici [5]. V typickém případě jsou sice přítomny výrazné intraepiteliální infiltráty vytvářející až eozinofilní mikroabscesy, v lehkých případech či v okraji postiženého ložiska však může absence kritické hodnoty způsobovat diagnostické problémy. Fokální charakter slizničního postižení, zejména při makroskopicky normálním vzhledu sliznice, logicky vyžaduje odběr více vzorků z různých částí jícnu.
Přestože přesný počet a algoritmus odběru vzorků nebyl dosud stanoven, doporučuje se u pacientů s podezřením na alergickou eozinofilní ezofagitidu provést vícečetné biopsie z orální, střední i aborální části jícnu, případně doplněné o vzorky sliznice žaludeční a duodenální pro vyloučení eozinofilní gastroenteritidy [4].
Refluxní ezofagitida
V posledních 10 letech Parakrama Chandrasoma výrazně změnil pohled na definice gastroezofageální junkce (GEJ), kardiacké sliznice, refluxní ezofagitidy a adenokarcinomu „žaludeční kardie“. Přestože jeho závěry nejsou přijímány všemi gastroenterology a gastroentero-patology, mají jeho teorie natolik silný logický základ a metodika jeho publikací je natolik solidní, že je možné je zde prezentovat jako pravděpodobnější popis reality než tradiční pojetí oblasti „kardie“. Nově je tedy za jedinou spolehlivou hranici mezi jícnem a žaludkem považován horní okraj korporální žaludeční (oxyntické) sliznice, přičemž fyziologicky by nad touto hranicí měla být zastižena pouze sliznice krytá nerohovějícím dlaždicobuněčným epitelem. Kardiacká sliznice, dříve pokládaná za normální součást GEJ, je velmi pravděpodobně ve skutečnosti patologickou metaplazií sliznice distálního jícnu indukovanou gastroezofageálním refluxem. Přítomnost kardiacké sliznice je tedy známkou refluxní ezofagitidy, a to daleko senzitivnější než změny indukované refluxem v dlaždicovém epitelu. Z této nové definice hranice mezi jícnem a žaludkem také vyplývá, že adenokarcinomy „žaludeční kardie“ jsou ve skutečnosti adenokarcinomy distálního jícnu, které jsou kauzálně asociovány především s refluxní ezofagitidou [6–17].
Přestože průkaz samotné kardiacké sliznice, vzhledem ke své vysoké prevalenci, není příliš významným nálezem, zásadní význam má poznatek, že metaplastická sliznice (i intestinálního typu, tedy Barrettova sliznice hodnocená jako prekanceróza) může být přítomna i v lokalizaci makroskopicky chybně lokalizované jako žaludek. Navíc, slizniční změny (metaplastické i dysplastické) bývají nepravidelně distribuovány, což zvyšuje nároky na odběr vzorků. Ačkoli nejsou zpracovány detailní doporučené postupy pro odběr vzorků při endoskopickém vyšetření za účelem diagnózy refluxní ezofagitidy, případně primodiagnózy Barrettova jícnu (zejména v případech refluxní nemoci bez makroskopického obrazu Barrettova jícnu) je vhodný odběr více vzorků, zejména pod Z-linií, a to i z míst makroskopicky imponujících jako proximální okraj žaludku. Vzhledem k tomu, že pohárkové buňky, které jsou histologickým diagnostickým znakem Barrettova jícnu, jsou distribuovány především v metaplastické žlázové sliznici těsně pod dolní hranicí dlaždicového epitelu jícnu (v 94 % vzorků, zatímco při distálním konci jícnu pouze v 39 %), měla by biopsie postihnout zejména tuto oblast [8]. Takto cílená biopsie, navíc případně zpřesněná použitím vitálních barviv a/nebo zvětšovacích endoskopických metod, značně snižuje optimální počet odebraných vzorků až na čtyři [18–20].
Na druhou stranu, u pacientů s již prokázaným Barrettovým jícnem byla přijata doporučení pro surveillance s cílem časného záchytu případně vznikající neoplastické léze. Tento doporučený postup byl navržen pro konvenční endoskopické vyšetření a zahrnuje kvadrantový odběr slizničních vzorků každé 2 cm v úseku sahajícím od „gastroezofageální junkce“ po distální okraj dlaždicového epitelu jícnu, přičemž při nálezu dysplazie vysokého stupně by měl být při opakovaném vyšetření odběrový interval 1 cm [21]. Navíc by samozřejmě měly být cíleně bioptovány makroskopicky podezřelé oblasti jako ulcerace, polypy či indurace sliznice. Vzhledem k tomu, že nález dysplazie vysokého stupně je indikací k ablaci či ezofagektomii, je nutné druhé čtení biopsie specializovaným gastroenteropatologem. Potvrzení této diagnózy by mělo být následováno opakováním biopsie do 3 měsíců, pokud nejsou přítomny makroskopické změny sliznice indikující nutnost ablační terapie. Hlavní problém tohoto doporučení (kromě značné technické náročnosti a lokálního krvácení při biopsii, kdy i při oplachování vyšetřované slizniční oblasti je tato procedura mnohdy značně problematická) spočívá v definici „gastroezofageální junkce“. Jak již bylo uvedeno výše, tato junkce je jednoznačně definována histologicky, ale makroskopicky může být chybně lokalizována do orálnější etáže jícnu, což může vést k nedostatečnému vyšetření v distální části jícnu a nezastižení vývoje adenokarcinomu „žaludeční kardie“ [17]. Tyto doporučené postupy navíc nezohledňují možnosti endoskopické mikroskopie, která ve zkušených rukou umožňuje nejen in vivo detekovat pohárkové buňky, ale i dysplastické změny a invazivní růst [1,20,22]. Je však pravda, že účinnost těchto metodik není ještě dostatečně validována a navíc je jejich použití limitováno na specializovaná pracoviště.
Chronická gastritida
Bioptické vyšetření žaludeční sliznice při předpokládané či již potvrzené chronické gastritidě má několikerý význam: 1. potvrzení zánětlivých změn, či jejich vyloučení (a případná diagnóza nezánětlivé gastropatie, např. reaktivní nebo kongestivní); 2. určení typu chronické gastritidy (helikobakterová, autoimunní); 3. stanovení aktivity zánětu; 4. identifikace intestinální metaplazie a její typ; 5. identifikace časných neoplastických změn.
Vhodnými kandidáty na odběr slizničních vzorků při gastroskopii jsou zejména pacienti s klinickými projevy perniciózní anémie, pacienti s předpokládanou helikobakterovou gastritidou před započetím eradikační terapie a pacienti se slizničními změnami suspektními z preneoplastického nebo neoplastického charakteru.
Revidovaným „Sydney systémem“ je doporučen odběr vzorků z pěti lokalizací: 2 vzorky antrální sliznice 2–3 cm nad pylorem, z toho jeden z malé a druhý z velké kurvatury, 1 vzorek z angulární řasy a 2 vzorky korporální žaludeční sliznice, přibližně 8 cm pod „gastroezofageální junkcí“ (přičemž o problematice její endoskopické identifikace je pojednáno v části věnované refluxní ezofagitidě), z toho 1 z malé a 1 z velké kurvatury [23]. Tento protokol je dostatečně spolehlivý pro zastižení zánětlivých změn i helikobakterové infekce, přičemž zvláštní význam má vyšetření sliznice z angulární řasy, na niž mohou být zánětlivé změny omezeny až u 9 % pacientů a intestinální metaplazie u 6 % [24]. Záchytnost intestinální metaplazie a dysplastických změn je však samozřejmě nižší a podezření na možnost rozvoje neoplastických změn vyžaduje extenzivnější bioptické vyšetření, zejména z endoskopicky abnormálních oblastí (eroze, vředy, polypy, slizniční indurace).
Celiakie
I přes vysokou senzitivitu a specificitu sérologického vyšetření je dosud považováno za zlatý standard v diagnostice celiakie histologické vyšetření sliznice tenkého střeva. Pro histologický průkaz celiakie se preferuje vyšetření duodenální sliznice místo odběru sliznice jejuna enterobioptickou kapslí pro srovnatelnou senzitivitu a možnost cíleného odběru z makroskopicky suspektních ložisek [25], přičemž za optimální se považuje odběr 4–6 vzorků. Ačkoli může distribuce diagnostických histologických změn, tedy zvýšení počtu intraepiteliálních CD3+ lymfocytů, chronická zánětlivá celulizace proprie, hyperplazie krypt a atrofie klků [26,27] vykazovat značné topické rozdíly [28, 29], měla by být u všech pacientů s celiakií přítomna alespoň intraepiteliální lymfocytóza ve sliznici bulbu duodena [30].
Významnější problém tak je možnost falešně pozitivní diagnózy kvůli intraepiteliální lymfocytóze ve sliznici bulbu duodena způsobené mimo jiné hypersenzitivní reakcí na jiné složky potravy, bakteriální dysmikrobií, užíváním nesteroidních antirevmatik, dysregulací imunitního systému při autoimunních chorobách nebo imunodeficitech, idiopatickém střevním zánětu, nebo střevními infekcemi virovými, giardiózou nebo při helikobakterové gastritidě. Z toho důvodu je vhodné kromě vzorku duodenální sliznice odebrat též sliznici antra žaludku pro vyloučení této možnosti.
Management pacienta s podezřením na celiakii má být v rukou specializovaného klinického lékaře, jehož úzká spolupráce se specializovaným gastroentero-patologem by měla být samozřejmostí, protože bez znalosti klinického obrazu a výsledků sérologického vyšetření antiendomysiálních a anti-tTG protilátek je patolog často schopen podat pouze zevrubný morfologický popis a zbytečně širokou diferenciálně diagnostickou rozvahu v závěru.
Idiopatické střevní záněty (IBD)
Hlavním cílem endoskopického vyšetřování pacientů s IBD (kromě primárního stanovení této diagnózy a posouzení odpovědi na terapii) je časná detekce vývoje kolorektálního adenokarcinomu, jehož výskyt je výrazně zvýšen v závislosti na délce trvání chronického zánětu, rozsahu postižení, době vzniku nemoci, léčbě mesalazinem a případné asociaci s primární sklerozující cholangitidou [31,32].
Stanovení diagnózy IBD vyžaduje odběr více vzorků z pěti lokalizací v rozsahu od rekta po terminální ileum, samozřejmě se zaměřením na makroskopicky abnormální úseky.
Endoskopická surveillance je podle doporučení European Crohn´s and Colitis Organisation (ECCO) vhodná u pacientů s extenzivní ulcerózní kolitidou trvající 8 a více let, nebo levostrannou kolitidou trvající 15 a více let. U pacientů s UC-asociovanou primární sklerozující cholangitidou (PSC) by měla surveillence začít po diagnóze PSC a měla by být prováděna v jednoletých intervalech. Kolonoskopie je doporučena v klidovém stadiu každé 1–2 roky s odběrem etážových biopsií k vyloučení dysplazie [33]. Při rozsáhlejším postižení blížícím se pankolitidě takové vyšetření zahrnuje odběr minimálně 33 vzorků, a to po 5–6 z ascendentu, transverza, descendentu, sigmatu, horního rekta a dolního rekta, nebo kvadrantové biopsie odebírané v intervalech dlouhých 10 cm z oblasti postižené kolitidou, volitelně v rizikové rektosigmoideální oblasti dokonce po 5 cm. Pro časové a finanční limitace je však preferován odběr vzorků ze všech lézí vzbuzujících endoskopické podezření na přítomnost dysplazie (plaky, polypy, ulcerace). Právě v tomto zacílení endoskopické biopsie mohou být velmi nápomocny sofistikované modifikace endoskopie, chromoendoskopií počínaje a metodami endoskopické mikroskopie konče [34,35].
Mikroskopická kolitida
Mikroskopická kolitida je skupina nosologických jednotek charakterizovaných chronickými vodnatými průjmy, normálním endoskopickým nálezem a mikroskopickým průkazem kolitidy. Patří sem především histologicky dobře definovaná lymfocytární kolitida a kolagenní kolitida. V různých klasifikacích jsou pak do kategorie mikroskopické kolitidy řazeny i další hůře či lépe definované jednotky. Základem histologického obrazu lymfocytární i kolagenní kolitidy je chronická zánětlivá celulizace proprie a intraepiteliální lymfocytóza (více než 20 intraepiteliálních lymfocytů na 100 epitelových buněk), u kolagenní kolitidy navíc doplněna přítomností rozšíření subepiteliálního pruhu kolagenu na více než 10 µm [36,37].
Stejně jako u jiných zánětlivých onemocnění GIT, i diagnóza lymfocytární nebo kolagenní kolitidy může být komplikována ložiskovou distribucí zánětu, která může být příčinou nezastižení diagnostických znaků v odebraném slizničním vzorku [38]. Zejména v případě kolagenní kolitidy se projevuje tendence k převažujícímu postižení pravé části tračníku s možným ušetřením sliznice rektosigmatu až ve třetině případů [39], ušetřením rektální sliznice až u 73 % a s izolovaným postižením céka až u desetiny pacientů [40]. Z uvedeného vyplývá, že možnost mikroskopické kolitidy, zejména kolagenní kolitidy, by neměla být vyloučena pouze na základě absence zánětlivých změn v rektální sliznici a sliznici sigmatu a že by vyšetření mělo být doplněno biopsií sliznice příčného tračníku a céka či alespoň vzestupného tračníku.
Závěr
Diagnostika zánětlivých onemocnění GIT je často komplikována nesouvislým až ložiskovým postižením, které může vést k nezastižení diagnostických histologických změn v materiálu odebraném při endoskopii. Řešení tohoto problému se odehrává na dvou úrovních. Tradiční snahou o zvýšení záchytnosti patologických změn je stanovení kvantitativních minimálních kritérií pro odběr materiálu na histologické vyšetření odbornými společnostmi (tab. 1). Druhou cestou je technické zdokonalení endoskopických metod umožňující přesnější detekci suspektních slizničních změn, případně až endoskopické histologické vyšetření in vivo. Samozřejmostí by také mělo být sdílení klinických a laboratorních informací s gastroenteropatologem a zasílání vzorků z různých lokalizací v oddělených nádobách označených dle topiky odběru.
Tab. 1. Pokyny k odběru materiálu při endoskopickém vyšetření GIT . Tab. 1. Suggestion of obtaining biopsies during endoscopic investigation of GIT. 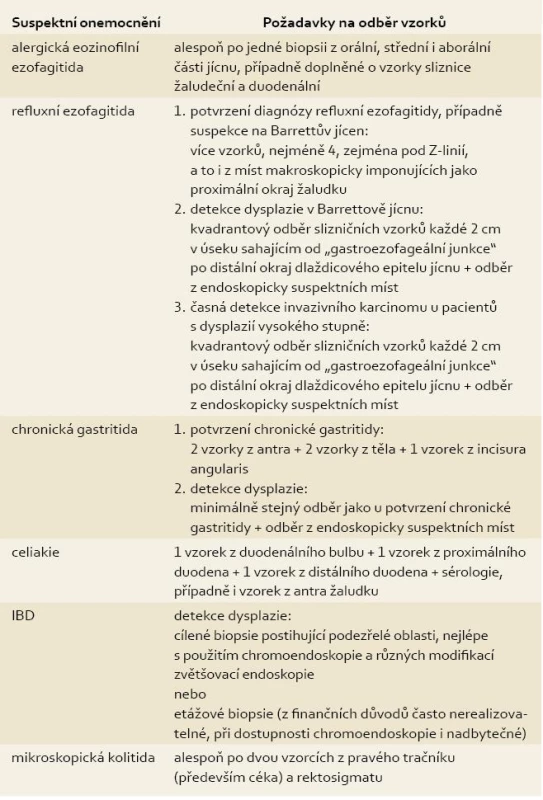
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.MUDr. Ondřej Daum, Ph.D.
ŠPAÚ FN a LF UK v Plzni
Edvarda Beneše 13, 305 99, Plzeň
DAUM@fnplzen.cz
Zdroje
1. Benes Z, Daum O, Puskarova G et al. Význam endoskopické cytoskopie u vyšetření trávicího traktu. Vnitř Lék 2007; 53(11): 1215–1219.
2. Inoue H, Kudo SE, Shiokawa A. Novel endoscopic imaging techniques toward in vivo observation of living cancer cells in the gastrointestinal tract. Dig Dis 2004; 22(4): 334–337.
3. Yantiss RK, Odze RD. Optimal approach to obtaining mucosal biopsies for assessment of inflammatory disorders of the gastrointestinal tract. Am J Gastroenterol 2009; 104(3): 774–783.
4. Furuta GT, Liacouras CA, Collins MH et al. Eosinophilic esophagitis in children and adults: a systematic review and consensus recommendations for diagnosis and treatment. Gastroenterology 2007; 133(4): 1342–1363.
5. Liacouras CA, Spergel JM, Ruchelli E et al. Eosinophilic esophagitis: a 10-year experience in 381 children. Clin Gastroenterol Hepatol 2005; 3(12): 1198–1206.
6. Chandrasoma PT, Der R, Ma Y et al. Histology of the gastroesophageal junction: an autopsy study. Am J Surg Pathol 2000; 24(3): 402–409.
7. Chandrasoma PT, Lokuhetty DM, Demeester TR et al. Definition of histopathologic changes in gastroesophageal reflux disease. Am J Surg Pathol 2000; 24(3): 344–351.
8. Chandrasoma PT, Der R, Dalton P et al. Distribution and significance of epithelial types in columnar-lined esophagus. Am J Surg Pathol 2001; 25(9): 1188–1193.
9. Chandrasoma P. Histopathology of the gastroesophageal junction: a study on 36 operation specimens. Am J Surg Pathol 2003; 27(2): 277–278.
10. Chandrasoma P. Cardiac mucosal changes in a pediatric population. Am J Surg Pathol 2003; 27(2): 274–275.
11. Chandrasoma PT, Der R, Ma Y et al. Histologic classification of patients based on mapping biopsies of the gastroesophageal junction. Am J Surg Pathol 2003; 27(7): 929–936.
12. Chandrasoma P. Controversies of the cardiac mucosa and Barrett‘s oesophagus. Histopathology 2005; 46(4): 361–373.
13. Chandrasoma P, Makarewicz K, Wickramasinghe K et al. A proposal for a new validated histological definition of the gastroesophageal junction. Hum Pathol 2006; 37(1): 40–47.
14. Chandrasoma P, Wickramasinghe K, Ma Y et al. Adenocarcinomas of the distal esophagus and „gastric cardia“ are predominantly esophageal carcinomas. Am J Surg Pathol 2007; 31(4): 569–575.
15. Lenglinger J, Ringhofer C, Eisler M et al. Histopathology of columnar-lined esophagus in patients with gastroesophageal reflux disease. Wien Klin Wochenschr 2007; 119(13–14): 405–411.
16. Chandrasoma P, Wijetunge S, Demeester SR et al. The histologic squamo-oxyntic gap: an accurate and reproducible diagnostic marker of gastroesophageal reflux disease. Am J Surg Pathol 2010; 34(11): 1574–1581.
17. Wijetunge S, Ma Y, DeMeester S et al. Association of adenocarcinomas of the distal esophagus, „gastroesophageal junction“ and „gastric cardia“ with gastric pathology. Am J Surg Pathol 2010; 34(10): 1521–1527.
18. Chandrasoma P. Four directed biopsies are better than eight random biopsies to find intestinal metaplasia in columnar lined esophagus. Am J Gastroenterol 2007; 102(10): 2352–2353.
19. Canto MI, Setrakian S, Willis J et al. Methylene blue-directed biopsies improve detection of intestinal metaplasia and dysplasia in Barrett‘s esophagus. Gastrointest Endosc 2000; 51(5): 560–568.
20. Kumagai Y, Monma K, Kawada K. Magnifying chromoendoscopy of the esophagus: in-vivo pathological diagnosis using an endocytoscopy system. Endoscopy 2004; 36(7): 590–594.
21. Kumagai Y, Kawada K, Yamazaki S et al. Endocytoscopic observation for esophageal squamous cell carcinoma: can biopsy histology be omitted? Dis Esophagus 2009; 22(6): 505–512.
22. Kumagai Y, Kawada K, Yamazaki S et al. Prospective replacement of magnifying endoscopy by a newly developed endocytoscope, the ‚GIF-Y0002‘. Dis Esophagus 2010; 23(8): 627–632.
23. Dixon MF, Genta RM, Yardley JH et al. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol 1996; 20(10): 1161–1181.
24. Eriksson NK, Farkkila MA, Voutilainen ME et al. The clinical value of taking routine biopsies from the incisura angularis during gastroscopy. Endoscopy 2005; 37(6): 532–536.
25. Meijer JW, Wahab PJ, Mulder CJ. Small intestinal biopsies in celiac disease: duodenal or jejunal? Virchows Arch 2003; 442(2): 124–128.
26. Lukáš Z. Histopatologie a diferenciální diagnostika celiakální sprue. Cesk Patol 2004; 40(1): 3–6.
27. Chlumská A, Beneš Z, Mukenšnabl P. Celiakie – histologické nálezy v duodenální sliznici a jejich diagnostický význam. Kongresové noviny (IV. Kongres České gastroenterologické společnosti ČLS JEP) 2009 : 8.
28. Ravelli A, Bolognini S, Gambarotti M et al. Variability of histologic lesions in relation to biopsy site in gluten-sensitive enteropathy. Am J Gastroenterol 2005; 100(1): 177–185.
29. Hopper AD, Cross SS, Sanders DS. Patchy villous atrophy in adult patients with suspected gluten-sensitive enteropathy: is a multiple duodenal biopsy strategy appropriate? Endoscopy 2008; 40(3): 219–224.
30. Bonamico M, Mariani P, Thanasi E et al. Patchy villous atrophy of the duodenum in childhood celiac disease. J Pediatr Gastroenterol Nutr 2004; 38(2): 204–207.
31. Pinczowski D, Ekbom A, Baron J et al. Risk factors for colorectal cancer in patients with ulcerative colitis: a case-control study. Gastroenterology 1994; 107(1): 117–120.
32. Jess T, Loftus EV Jr., Velayos FS et al. Risk of intestinal cancer in inflammatory bowel disease: a population-based study from Olmsted county, Minnesota. Gastroenterology 2006; 130(4): 1039–1046.
33. Biancone L, Michetti P, Travis S et al. European evidence-based consensus on the management of ulcerative colitis: special situations. J Crohns Colitis 2008; 2(1): 63–92.
34. Kiesslich R, Galle PR, Neurath MF. Endoscopic surveillance in ulcerative colitis: smart biopsies do it better. Gastroenterology 2007; 133(3): 742–745.
35. Kiesslich R, Goetz M, Lammersdorf K et al. Chromoscopy-guided endomicroscopy increases the diagnostic yield of intraepithelial neoplasia in ulcerative colitis. Gastroenterology 2007; 132(3): 874–882.
36. Lazenby AJ. Collagenous and lymphocytic colitis. Semin Diagn Pathol 2005; 22 : 295–300.
37. Lazenby AJ, Yardley JH, Giardiello FM et al. Lymphocytic („microscopic“) colitis: a comparative histopathologic study with particular reference to collagenous colitis. Hum Pathol 1989; 20(1): 18–28.
38. Thijs WJ, van Baarlen J, Kleibeuker JH et al. Microscopic colitis: prevalence and distribution throughout the colon in patients with chronic diarrhoea. Neth J Med 2005; 63(4): 137–140.
39. Surawicz CM. Collating collagenous colitis cases. Am J Gastroenterol 2000; 95(1): 307–308.
40. Tanaka M, Mazzoleni G, Riddell RH. Distribution of collagenous colitis: utility of flexible sigmoidoscopy. Gut 1992; 33(1): 65–70.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Jubilejní rok
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2011 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Rozhovor s prof. dr. Petrem Dítě, DrSc., prezidentem EAGE (European Association for Gastroenterology and Endoscopy) a ředitelem 7. kurzu EAGE pro mladé gastroenterology
- Ostrava live endoscopy 18. 3. 2011
- O čem také psal profesor Mařatka
- Jubilejní rok
- Etiologie a patogeneze ulcerózní kolitidy. Stále více otazníků než jasných odpovědí
- Doporučený postup pro vyšetření tenkého střeva u pacientů s Crohnovou chorobou
- Vliv albuminemie na farmakokinetiku infliximabu u nemocných s idiopatickými střevními záněty
- Biologická léčba nemocné s ulcerózní kolitidou v průběhu gravidity
- 10. výročí založení organizace ECCO a 6. ECCO kongres v Dublinu
- Endoskopická submukózní disekce v léčbě recidivující high-grade neoplazie v rektu
- Odběr bioptického materiálu při endoskopickém vyšetření gastrointestinálního traktu pro vybraná zánětlivá onemocnění
- Kvantitativní test ve screeningu kolorektálního karcinomu – pohled do blízké budoucnosti
- Gastrointestinální manifestace Henoch-Schönleinovy purpury napodobující akutní pankreatitidu
- Ohlédnutí za 15. hradeckými gastroenterologickými a hepatologickými dny
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Odběr bioptického materiálu při endoskopickém vyšetření gastrointestinálního traktu pro vybraná zánětlivá onemocnění
- Doporučený postup pro vyšetření tenkého střeva u pacientů s Crohnovou chorobou
- Kvantitativní test ve screeningu kolorektálního karcinomu – pohled do blízké budoucnosti
- Etiologie a patogeneze ulcerózní kolitidy. Stále více otazníků než jasných odpovědí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



